fl
GAMBARAN HISTOPATOLOGI JARINGAN ATEROMA AORTA POTONG BEKU DARI KELINCT NEW ZEALAND WHITE (Oyctolagus cuniculus) HIPERLIPEMIK
DENGAN DAN TANPA ANTIBIPERLIFIDEMIA
DEPARTEMEN KLINIK REPRODUKSI DAN PATOLOGI
FAKULTAS KEDOKTERAN HEWAN NSTITUT PERTANIAN BOGOR
ABSTRAK
ZULFIK.ML Gambaran histopatologi jaringan ateroma aorta potong beku dari kelinci New Zealand white (Otyctolagus nmiculus) hiperlipemik dengan clan tanpa pemberian antihiperlipidemia D i b i i i g oleh DEWI R A W AGUNGPRIYONO.
Penelitian ini bertujuan untuk mengetahui gambaran histopatologi perubahan jaringan buiuh darah pada kelinci hiperlipemik dengan dan tanpa pemberian obat antihiperlipidemia menggunakan tehnik potong beku (Ctyo-section). Penelitian dilakukan menggunakan 12 ekor keliici jantan jenis New Zealand white (Otyctolagus cuniculus) jrang dibagi dalam 3 keIompok perlakuan, yaitu kelompok perlakuan hiperlipemik (H), kelompok perlakuan hiperlipemik dengan pemberian anti-hiperlipidemia (HA) serta kelompok kontrol (KN).
Kondisi hiperlipemik diperoleh dennan uemberian kolesterol murni sebesar 0.2dekorhari -
-
- selama 3 bkan,-obat anti-hiperlipidemia yang digunakan adalah golongan statin dengan dosis 1,25g/ekor&& padahulm
ke 2 hinggaa i r
penelitiar?: Pengamatan jaingan aorta potong be& yang diwamai dengan Sudan Black menunjukkan bahwa kelinii jenis New %aland white (Oryctolagus cuniculus) peka terhadap proses aterogenesis. Proses aterogenesis yang terjadi adalah penumpukan lipid dipermukaan endotel, inisiasi lipid pada tunika intima hingga tunika media d m pembentukan plak ateroma. Kelompok perlakuan KN,H
dan HAmenunjukkan proses aterogenesis. Pemberian obat anti hiperlipidemia dapat menurunkan kadar kolesterol total darah dan merusak struktur plak yang terbentuk. Tehnik potong beku dengan pewamaan Sudan Black dapat menunjukkan distribusi lipid pada dinding aorta dan kerapuhan plak ateroma dengan jelas.
Kata kunci : Ateroma, Hiperlipidemik, Keliici (Oryctolagus cuniculus), Kolesterol
ABSTRACT
ZULFIKAR
Histopathology of Atheromatous Aorta Frozen Section from Hyperlipemic Rabbit New Zealand white (Oryctolagus cuniculus) With and Without Anti-hyperlipidemia Drug Treatment. Under guidance DEWI RATIH AGUNGPRIYONO.The aim of the research is to investigate the histopathology of atheroma lesion
within
aorta wall from hyperlipemic rabbit (Oryctolagus cuniculus) with and without anti- hyperlipidemia drug treatment using Cryo-section method. The research use 12 New Zealand white rabbit (Oryctolagus cuniculuc;) devided into 3 groups, hyperlipemic rabbit group (H), hyperlipemic rabbit group with anti-hyperlipidemia drug treatment (HA) and control group
(KN). The hyperlipemic condition of the animal was obtained by giving the rabbit 02g/day pure cholesterol for 3 months, and anti-hyperlipidemia drug of choice is statin dose 1.25glday for 2 month treatment. The examination of aorta wall revealed that the New Zealand white rabbit
is
responsivefor
the atherogenesis process, The atherogenesis observed inclllde lipid accumulation on the endothelial surface, lipid initiation in the intimal up to the medial layer of aorta wall and atheroma plaque formation. All the rabbits showed the athrogenesis process. The anti-hyperlipidemia drug could decrease the blood total cholesterol level and damaged the plaque structure. The cryo-section technique with Sudan Black staining could show lipid distribution on arterial wall and fragile atheroma lesion obviously.GAMBARAN HISTOPATOLOGI JARINGAN ATEROMA AORTA POTONG BEKU
DARI KELINCI NEW ZEALAND WHITE (Oiyctolagm ccu~tic~dus) HtPERLIPEMIK
DENGAN DAN TANPA ANTXHIPERLIPJDEMIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Kedokteran Hewan
Fakultas Kedokteran Hewan
DEPARTEMEN KLINIK REPRODUKSI DAN PATOLOGI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul : Ganibaran histopatologi jariGgaa ateroma aorta potong
bsku
dari keliici new zealand white (Oryetolagus Cuniculus) hiperlemik dengan dan tanpa antihiperlipidemia: zulfikar
drh. Dewi Ratih Ag5mriyono Ph.D. Dosen Pembimbing
Dietahui:
KATA PENGANTAR
Segala puji bagi ALLAH, zat yang Maha Melihat dan Maha Mengetahui segala amal perbuatan hamba-hambaNYA. Dialah yang menjad'ian siang dan malam silih berganti sebagai perenungan bagi orang-orang yang mau berfikir. Dialah yang menjadi ilham dalilro setiap kata, sehingga penulis dapat menyelesaikan skripsi yang berjudul Gambaran histopatologi jarhgan ateroma aorta potong beku dari hiperlemik kelinci new zealand white (oryctolagus cuniculus) dengan dan tanpa antihiperlipidemia. Shalawat serta salam semoga tetap tercurah kepada Rasulullah SAW, keluarga d m sahabatnya. Tulisan
i
n
i
merupakan hasil penelitian yang telah dilakuakan penulis di laboratorium Patologi, Departemen K l i Reproduksi dan Patologi, Fakultas Kedokteran Hewan-Institut Pertanian Bogor.
Ddam menyelesaikar studi dan penulisan, penulis banyak mendapatkan dukungan dan bantuan dari banyak pihak. Oleh karenanya, penulis sampaikan terima kasih kepada :
1. Keluargaku tercinta: Bapak (Alm), Mamah, A'Ari, A' Puad, Mas Wibi dan Teh Yayu serta keponakanku Zahra dan Nindy, I love you all.
2. Special untuk kakek ku tercinta, H. Thoin hanya ALLAH yang dapat membalas segala kebaikanmu, serta do'a kejayaan untuk seluruh Bani Thoin dan Bani Dudung.
3. Drh. Dewi Ratih Agungpriyono Ph.D atas filosofi hidup, bimbingan, arahan dan saran kepada penulis selama masa studi, penelitian clan penyusunan skripsi
ini.
Teriring do'auntuk
seluruh keluarga Dr. Srihadi A, jazakumullahu ahsanul jaza.4.
Ir.
Nurjanah M.Si atas dukungan moriil maupun materiil selama penelitian clan Lilian Devanita S . M selaku teman penelitian penulis.5. Teman-teman Asternidea 41, F5 (AIi, Fajrin, Dwisand, Agus P), BaIio 27 (Adriyan, bang Agung, all penghuni lama dan penghuni baru) terima kasih atas dukungan dan bantuannya.
6. Pak Kasnadi, Pak Sholeh, Pak Endang dan seluruh dosen dan pegawai Departemen Patologi, atas bantuan, saran dan support kepada penulis.
Serta semua pihak y'ang yang telah membantu penulis sejak kuliah sampai kelulusan tiba. Semoga tulisan ini bermanfaat d m menjadi teman kebaikan bagi penulis di akhirat kelak.
Bogor, Januari 2009
Penulis
Penulis dilahirkan di Bekasi, Jaxa Barat, pada tanggal 04 Maret 1987. Penu!is merupakan anak ke empat dari l i i a bersaudara, Buah hati dari Ayahanda Muhammad Hasan dan Ibunda Nurlaela.
Penulis menamatkan p e n d i d i i SD hingga SMU di Bekasi, Jawa Barat. Pendidikan formal penu!is diawali di SDN Karang Asih dan lulus pada tahun 1998. Sekolah Lanjutan Pertama tamatkan di MTsN Cikarang pada tahun 2001. Sekolah Menengah Umum ditamatkan di SMLJN 1 Cikarang Utara pada Tahun 2004. Pada Tahun yang sama (2004) penulis diterima sebagai mahasiswa Fakultzs Kedokteran Hewan di lnstitzlt Pertanian Bogor melalui jalur USMI.
Selama mengikuti pendidikan di IPB, penulis Artif di berbagai kegiatan intra kampus dan ekstra kampus. Tahun 2004-2005 Penulis aktif di Dewan Perwakilan Mahasiswa (DPM) FKH IPB sebagai ketua Komisi 1 dan Staf Majelis Permusyawaratan Mahasiswa
KM IPB. Tahun 2005-2006 penulis terpilii sebagai Ketua DPM KM FKH IPB dan Staf
Badan Pengawas JMAKAHI. Pada Tahun 2006-2007 penulis aktif sebagai staf Departemen Kebijakan Nasional BEM
KM
IPB, staf divisi Hubungan Luar (PR) Himpunan Profesi Ruminansia, staf DKM An Nahl, dan Badan Pengawas IMAKAHI (2005-2007). Pada tahun 2007 sebagai staff komisi 1 L)PM KM FKH IPB. Selain itu penulis menjadi asisten Mata Kuliah Pendidikan Agama Islam (PAI) dan asisten praktikum Patologi Sistemik 11 padatahun 2008. Penulis aktif sebagai pendamping POSDAYA (Pos Pemberdayaan Keluarga) Benteng Harapan, Pengajar pada bibingan belajar Prima Eksakta, Mentor PA1 SMP
DAFTAR
IS1
Halaman
KATA PENGANTAR
...
,...
i..
RIWAYAT HIDUP...
I1 DAFTAR IS1...
iiiDAFTAR TABEL
...
vDAFTAR GAMBAR
...
vi..
DAFTAR LAMPIRAN...
-....
V I I PENDAEfuLUAN Latar Betakang...
1Tujuan
...
2Hipotesis
...
2.
.
Manfaat Penel~tlan...
2TINJAUAN PUSTAKA Anatomi dan Histologi Pembuluh darah
...
.
...
3Kelinci
...
...
4Lipid
...
5Hiperlipidemia
...
12Aterosklerosis
...
14.
.
Obat Antihiperl~p~demia...
16Sediaan Potong Beku
...
--.-...
18METODOLOGI PENELITIAN Waktu dan Tempat
...
21Bahan dan Alat
...
21. .
Desain Penellban...
21Evaluasi Histopatologi
...
23Pengamatan Histopatologi
...
24Analisis Data
...
24HASIL DAN PEMBAHASAN Pengamatan Gejala Klinis
...
25Kadar Lipid dalam Darah Hewan dan Indeks Aterogenik
...
26Ketebalan Plak Ateroma dan Gambaran Histopatologis Ateroma
...
30KESIMPULAN DAN SARAN Kesimpulan
...
35Saran
...
35DAFTAR
PUSTAKA...
36Halaman
...
1 Pola konsumsi pakan dan berat badan kelinci selama percobaan 25...
2 Kadar kolesterol total. LDL. HDL. dan trigliserida 27 3 Tebal plak aterorna dan intensitas lipid...
30...
DAFTAR GAMBAR
Halaman
.
.
...
1 Penampang janngan arteri 3
...
2 Kelinci New Zealand white 4
3 Metabalisrne lipoprotein
...
6 4 Metabolisme VLDL dan LDL...
11 5 Skema tahapan proses aterosklerosis...
15...
6 Cryostat 19
7 Bagan perlakuan yang diberikan saat penelitian
...
22. .
8 Pertambahan berat badan kellncl
...
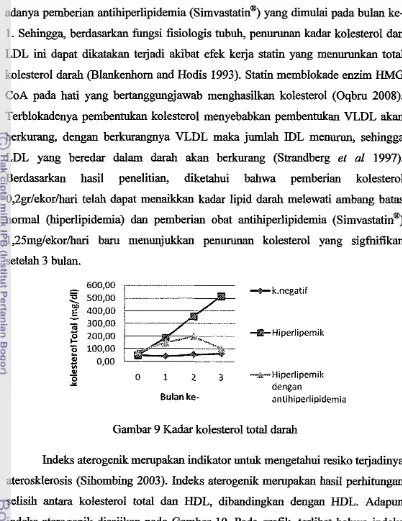
26 9 Kadar kolesterol total darah...
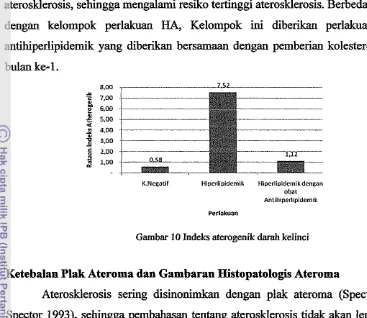
29 10 Indeks aterogenik darah kelinci...
30 11 Gambaran histopatologi jaringan potong beku aorta perlakuan hiperlipemik 31 12 Gambaran histopatologi jaringan potong beku aorta perlakuan kontrolnegatif
...
31 13 Gambaran histopatologi jaringan potong beku aorta perlakuanhiperlipernik dengan obat antihiperlipidemia
...
34 14 Gambaran histopatologi jaringan potong beku aorta perlakuanHalaman
. .
...
1 Analisa indeks aterogenik 41
...
2 Analisa kolesterol total 43
3 Analisa trigliserida
...
46 4 Analisa HDL...
48 5 Analisa LDL...
50...
6 Analisa rataan berat badan 53
...
7 Analisa konsumsi pakan 54
8 Analisa konversi pakan
...
56 9 Analisa tebal plak ateroma...
57...
Latar Belakang
Perkembangan teknologi dunia semakin pesat berkembang seiring bergantinya zaman. Pola hidup masyarakat modem yang mengejar percepatan tak dapat dipungkiri telah merubah pola hidup masyarakatnya. Pola hidup yang serba cepat ini jugalah yang menyebabkan pola konsurnsi makanan masyarakat berubah. Masyarakat dunia kini lebih menyukai segala ha1 yang berbau instan dan cepat
,
termasuk makanan. Padahal, pola makanan yang serba instan ini sebagian besar rentan akan tingginya kadar zat-zat yang sebenarnya diperlukan sedikit oleh tubuh menjadi berlebihan. Salah satu zat yang akrab ditelinga kita adalah kolesterol dan lemak. Kadar kolesterol yang tinggi pada makanan siap saji dan impor saat ini telah sangat mengkhawatirkan, ha1 ini terbukti dengan tingginya angka penyakit akibat hiperkolesterol didunia.Tak jauh berbeda dengan dunia intemasional yang menempatkan penyakit kardiovaskular sebagai penyakit berbahaya, dalam sebuah survey penyakit yang ditayangkan di salah satu layar televisi baru-baru ini (maret ZOOS), Indonesia yang masih terhitung sebagai negara berkembangpun temyata memiliki catatan bur& terhadap penyakit kardiovaskular. Penyakit kardiovaskular menenlpati m t a n pertama dalam penyakit yang paling banyak merenggut nyawa penduduk Indonesia. Penyakit kegagalan jantung/jantung koroner mempakan penyakit paling berbahaya di Indonesia dengan memegang catatan kematian lebih dari 300.000 orang pertahun. Sedangkan penyakit kedua paling berbahaya adalah penyakit penyumbatan pembuluh darah aorta yang sering disebut sebagai aterosklerosis. Ironisnya negara yang masih berkembang ini, yang masih belum secara sempurna mengadopsi ilmu pengetahuan dan teknologi dunia, mendapatkan catatan penyakit yang telah merepotkan negara-negara maju.
Menurut Hemlan (1991) faktor penyebab penyakit kardiovaskular dibagi menjadi dua kelompok. Kelompok pertama adalah faktor resiko primer seperti hipertensi, merokok, kadar kolesterol tinggi, dan tingginya LDL (Low Density Lipoprotein). Faktor kelompok kedua meliputi obesitas, stress, kurangnpa kegiatan fisik, genetik, jenis kelamin, trigliserida darah yang meninggi dan meningkatnya umur.
Pencegahan penyakit kardiovaskular yang dipublikasikan oleh lembaga kesehatan adalah dengan diet rendah kolesterol; diet makanan berserat tinggi dan olahraga teratur. Pola hidup teratur tersebut sangat sulit dilakukan sehingga masyarakat modem lebih banyak memilih cara pengobatan. Pengobatan penyakit kardiovaskular saat ini masih terus dikembangkan dan masih populer pada obat-obatan dari golongan stntin. Penelitian medis tentang aterogenesis juga sangat banyak digalakkan, namun sampai saat ini belum adanya penelitian aterogenesis dengan evaluasi lipid.
Tujuan Penelitian
Penelitian ini betujuan untuk mempelajari perubahan jaringan aorta potong beku pada kelinci New Zealand white (Oryctolagus cuniculus) hiperlipemik dengan dan tanpa pemberian antihiperlipidemia.
Hipotesis
Pemberian obat antihiperlipidemia mampu menurunkan kadar kolesterol dalam darah kelinci hiperlipemik dan pewamaan sudan black pada sediaan potong beku mampu memberikan gambaran yang jelas terhadap distribusi lipid pada plak ateroma.
Manfaat
TINJAUAN
PUSTAKA
Anatomi dan HistoIogi Buluh Darah
Sistem a l i i darah terdii atas jantung, arteri, kapiler, sinusoid dan vena. Arteri meNpt3kaII bulnh darah yang mengalirkan darah dari jantung menuju jaringan. Aorta meNptIkaIB arteri tipe penyalur yang memilii dindig tebal dan
bersifat etastis @elman dan Venable 1989).
Aorta berjalan meliitasi rongga toraks dan abdomen, dan segmen-segmen aorta diberi nama sesuai dengan l o k a s i i Beberapa nama aorta diantaranya adalah aorta thorasika, aorta abdominalis dan aorta terminalis (Price dan Wilson 2005).
Gambar 1 Penampang jaringan arteri (A. Tunika intima, B. Tunika Media dan C. Tunika Adventisia) (Sumber: http://imapes.rroogle.co.id 2008)
Lapisan Media terletak pada bagian tengah dinding arteri dan terdiri atas jalinan lapisan sel otot polos. Setiap otot polos dikeliligi oleh membran basalis yang tidak kontinu. Pada sel otot polos ini ditemukan sel-sel reseptor untuk lipoprotein berdensitas rendah (LDL),
insulin,
stimulator pertumbuhan dan inhibitor pertumbuhan (Pricedan
Wilson 2005).Lapisan adventitia terletak di bagian terluar dindiig arteri yang memberikan kekuatan utama pada pembuluh darah (Price dan Wilson 2005). Batas terdalam lapisan adventisia adalah lapisan media dan batas luarnya adalah depo lemak (Davies 1986). Lapisan adventisia terdiri atas jaringan fibril kolagen, serabut elastis, fibroblas, beberapa sel otot polos, serabut syaraf dan pembuluh darah (Price dan Wilson 2005).
Garnbar rib adi).
Asal mula keberadaan kelici New zealand adalah kelinci Eropa yang didistribusikan ke berbagai belahan dunia melalui pelayaran kapal jarak dekat oleh para nahkoda
dari
eropa untuk memenuhi ketersediaan jumlah daging. Kelinci eropa (Olyctolagus cuniculus) yang terdishibusikan bersama dengan pelayaran kapal laut Eropa menuju New Zealand dan Australiaini
selanjutnya lebii diienal sebagai kelinci New Zealand. Kelinci New Zealand terdiridari
Berdasarkan taksonomi, kelinci m e m i l i taksonomi sebagai berikut:
Kingdom : Animalia
Filum : Chordata
Kelas : Mamalia
Sub kelas : Theria
Infrakelas : Eufheria
Famili : Leporidae
Sub-famili : Leporinae
Genus : Oryetolagus
Spesies : Oryctolagus cuniculus
Nama umum : Kelinci New Zealand White (Fox 1974)
Keliici mempakan hewan model aterosklerosis yang digunakan pertama kali clan telah digunakan dalam eksperimen pada beberapa kajian selama 65 tahun terakhit (Clarkson et al. 1974). Penyelidikan awal pada penelitian induksi aterosklerosis keliici dilakukan oleh Ignatowski. Ignatowski menemukan bahwa lesio lipid lamina intima arteri yang te rjadi akibat diet susu, dagicg d m telur pada kelici m e m i l i kesamaan dengan pembentukan lapisan lemak pada manusia (Clarkson et al. 1974). Secara alamiah lesio arteri dapat terjadi pada kelinci. Peneliti yang menggunakan kelinci harus menyadari lesio ini, karena lesio arteri ini sangat bervariasi antar spesies kelici. Dengan berpedoman pada penelitian Zeek (1933) tentang seleksi jenis kelinci untuk menghadirkan ataupun meniadakan lesio arteri, para peneliti
kini
cenderung menjadikan kelinci New Zealand white atau Dutch belted sebagai sumberdaya yang paling tepat dalam penelitian aterosklerosis. Penelitian aterosklerosis pada kelinci juga ham memperhatikan fenomena lesi spontan clan respon hewan sehingga dapat dilakukan manipulasi eksperimen dengan tepat (Clarkson et al. 1974).C. Lipid
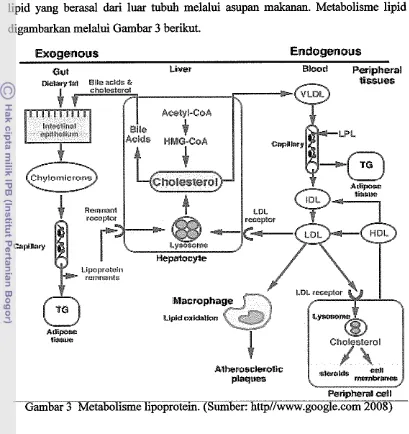
diperoleh melalui jalur eksogen dan endogen. Lipid endogen merupakan lipid yang berasal dari sintesis kolesterol oleh hati, sedangkan lipid eksogen adalah lipid yang berasal dari luar tubuh melalui asupan makanan. Metabolisme lipid digambarkan melalui Gambar 3 berikut.
b O ~ t t . n w 8
."
Ejndi~genms
Gut Liver
LWbdxitJnlian
Alhemscbtic
Perilpheri4 &I
Gambar 3 Metabolisme lipoprotein. (Sumber: http//www.google.wm 2008)
[image:17.541.72.481.115.549.2]yang didominasi dengan metabolisme lipoprotein dan dijelaskan kemudian pada sub bab metabolisme lipoprotein.
C.1. Kolesterol
Kolesterol me~pCikaLI kelompok steroid, suatu zat yang termasuk golongan lipid. Metabolisme kolesterol erat hubungannya dengan metabolisme lipid (Girindra 1988). Kolesterol mempunyai rumus molekul Cz7a50H dan dapat dinyatakan sebagai 3 hidroksi -5,6 kolesten karena mempunyai satu gugus hidroksil pada atom C3 dan ikatan rangkap pada C5 dan C6, serta percabangan pada Clo, C13, dan C17 (Mayes 1996). Kolesterol mempunyai rantai hidrokarbon dengan delapan atom karbon yang diberi nomor 20 s a p & 27 sebagai lanjutan nomor pada inti steroid (Ismadi 1993).
Kolesterol terdapat di dalam semua sel hewan dan tersebar luas di seluruh jaringan tubuh. Pada mamalia, jaringan-jaringan yang diketahui m m p u mensintesis kolesterol antara lain hati, korteks adrenal, Mit, usus, testis, lambung, otot, jaringan adiposa, dan otak. Sekitar 17 % berat kering otak terdiri dari kolesterol (Tillman et al. 1991). Di dalam tubuh tidak dapat dibedakan kolesterol yang b e d dari sintesis di dalam tubuh clan kolesterol yang berasal
dari makanan.kolestero1 (Muchtadi
et
al. 1993).Fungsi kolesterol di dalam tubuh adalah sebagai prekursor pembentuk asam empedu yang dibutuhkan untuk mengemulsikan lemak pada usus halus. Kolesterol juga diperlukan pada sintesis hormonal dan m e ~ p a k a n unsur penting pada dinding sel. Selain itu didalam tubuh, kolesterol m e ~ p a k a n substansi semua senyawa steroid, seperti kortikosteroid dan vitamin D (Mayes 1996). Peranan lain
kolesterol yaitu membantu sel syaraf dalam menjalankan fungsinya, dimana tanpa kolesterol k w r d i i i gerak tubuh dan kemampuan berbicara akan terganggu (Herman 1991).
C.1.1. Biosintesis Kolesterol
menghasilkan lebih kurang 10%
dari
seluruh sintesis dan 10% lagi diperoleh dari usus (Mayes 1996).Kolesterol terdapat dalam jaringan dan lipoprotein plasma, bisa sebagai kolesterol bebas atau sebagai estemya Via berikatan dengan asam lemak rantai panjang. Senyawa tersebut disintesis
dari
asetil-KoA dan akhirnya dikeluarkandari
tubuh sebagai konjugat garam-garam empedu atau kolesterol (Mayes 1996). Terdapat lima tahap biosintesis kolesterol, yaitu (1) sintesis mevalonat, suatu senyawa enam karbon dari asetil-KoA, terbentuk akibat reaksi kondensasi dan reduksi yang berlangsung di dalam mitokondria, (2) unit isoprenoid dibentukdari
mevalonat melalui pelepasan C 0 2 pada reaksi fosforilasi oleh ATP, (3) enam unit isoprenoid mengadakan kondensasi untuk membentuk senyawa antara skualen,
(4) skualen mengadakan siklisasi untuk menghasilkan senyawa steroid induk yaitu lanosterol yang berlangsung di dalam Retikulum Endoplasma, dan (5) kolesterol dibentuk di dalam membran reticulum endoplasma dari lanosterol setelah melewati beberapa tahap, termasuk pelepasan tiga gugus metal (Mayes 1996).
Banyak faktor yang mempengamhi keseimbangan kolesterol di dalam jaringan yang dapat mengakibatkan terjadinya peningkatan dan penurunan kolesterol. Peningkatan kolesterol tcrjadi karena (1) ambilan lipoprotein yang mengandung kolesterol oleh reseptor LDL, (2) ambilan lipoprotein yang mengandung kolesterol oleh jalur yang tidak diperantarai reseptor, (3) ambiian kolesterol bebas dari lipoprotein yang kaya kolesterol oleh sel membran, (4)
sintesis kolesterol, dan (5) hidrolisis ester kolesterol oleh enzim kolesterol ester hidrolase. Sedangkan penurunan kolesterol terjadi karena (1) keluarnya kolesterol dari membran sel ke lipoprotein yang mengandung sediit kolesterol khususnya HDL3 atau HDL m e n yang duancang oleh enzim LCAT (lecithin cholesterol acyltranferase), (2) esterifikasi kolesterol oleh enzim ACAT (acyl CoA :
cholesterol acyltranferase) dan (3) penggunaan kolesterol untuk sintesis senyawa- senyawa steroid lainnya seperti hormon atau asam empedu di hati (Mayes 1996).
C.2. Metabolisme Lipoprotein
kolesterol, triasilgliserol, dan fosfolipid. Triasilgliserol dan bentuk esterifikasi kolesterol adalah lemak non polar yang tidak larut air (hidrofobii) yang membentuk inti lipoprotein. Fosfolipid clan sejumlah kecil kolesterol bebas yang larut dalam lipid dan air, menutupi permukaan partikel dan bertindak sebagai pembatas antara komponen inti dan plasma Apolipoprotein menempati permukaan lipoprotein dan berfmgsi sebagai pemisah antara lipid dengan lingkungan berair, serta mempunyai peran sangat penting dalam pengaturan transport lipid dan metabolisme protein ( G i b e r g dan Goldberg 1998). Metabolisme lipoprotein dapat terlihat pada Gambar 3.
Berdasarkan berat jenisnya lipoprotein diielompokkan menjadi empat kelas utama berturut-huut dari terendah hingga tertinggi, yaitu kilomikron, VLDL (vey low density lipoprotein), LDL (low density lipoprotein), dan HDL (high density lipoprotein) (Gum 1992).
C.2.1. Kilomikron
Kilomikron adalah lipoprotein yang banyak mengandung triasilgliserol, disintesis di dalam mukosa usus halus dari lemak eksogen dan bernkuran paling besar dengan divneter lebii dari 100 nm (Marinetti 1990). Kilomilcron yang baru terbentuk atau disebut kilomikron nasen sebagian besar terdiri dari triasilgliserol. Bersama dengan ester kolesterol, triasilgliserol terdapat di dalam inti lipoprotein
ini. Penelitian baru menunjukkan bahwa protein tertentu yaitu microsomal Piglyceride fransfer protein (MI1P) bertanggung jawab atas pengangkutan dan masuknya triasilgliserol ke dalam inti kilomikron (Grundy 1996).
Kilomikron nasen akan disekresikan ke dalam kelenjar limfe intestinum
dan kemudian dibawa ke dalam sirkulasi melalui d u b torasikus (Dominiczak 1994). Di dalam pembuluh darah perifer, kilomilcron akan bereaksi dengan enzim lipoprotein lipase (LPL) yang terdapat pada permukaan endotel kapiler jaringan ekstra hepatic. Enzim
ini
akan menghidrolisis triasilgliserol dalam inti kilomikronPartikel kilomikron yang tersisa (kilomikron remnan) mengandung lebii sedikit triasilgliserol dan banyak mengandung kolesterol dan ester kolesterol, akan
diambil oleh hati melalui reseptor khusus apo E serk reseptor LDL (Mayes 1996). Lemak dari kitomikron remnan di dalam sel hati mengalami hidrolisis menjadi asam lemak bebas, monoasilgliserol, gliserol, dan kolesterol. Komponen tersebut akan diresintesis menjadi triasilgliserol dan turut membentuk VLDL atau HDL. Kolesterol dan ester kolesterol dari kilomikron remnan akan mengalami (1) perubahan menjadi asam empedy (2) disekresikan ke dalam empedu sebagai sterol netrai, atau (3) bergabung ke dalam VLDL atau HDL dan dilepaskan ke dalam plasma (Groff ef a1 1995).
C.2.2. High Density Lipoprotein
@DL)
HDL adalah partikel lipoprotein yang padat dan kecil, disintesis di hati maupun usus. Bila diisolasi dengan menggunakan ultrasentifbgal, HDL terpecah menjadi dua kelas utama yaitu HDL2 dan HDL3 (Kane dan Malloy 1997). HDL2 berukuran lebih besar dan kaya lipid bila dibandiigkan dengan HDL3 yang lebih kecil dan padat.
HDL3 terdii dari lapisan ganda fosfolipid, mengandung apolipcprotein dan kolesterol bebas, dan disebut sebagai HDL nasen (Mayes 1996 ; G i b e r g dan Goldberg 1998). Kolesterol bebas yang berasal dari membran sel ditransfer ke HDL3, dan diubah menjadi ester kolesterol oleh enzim LCAT. Ester kolesterol ini
akan bergerak masuk ke dalam inti HDL3 ( G i b e r g dan Goldberg 1998). Reaksi terus berlangsung, inti nonpolar mendesak lapisan ganda sehingga terpisah sampai bentuknya berubah menjadi sferis. Pembentukan ester kolesterol tersebut akan meningkatkan kapasitas HDL3 untuk menerima lebii banyak kolesterol bebas sehingga terbentuk HDL;! yang berukuran lebii besar dan kaya lipid @layes
C.2.3. Very Low Density Lipoprotein (VLDL)
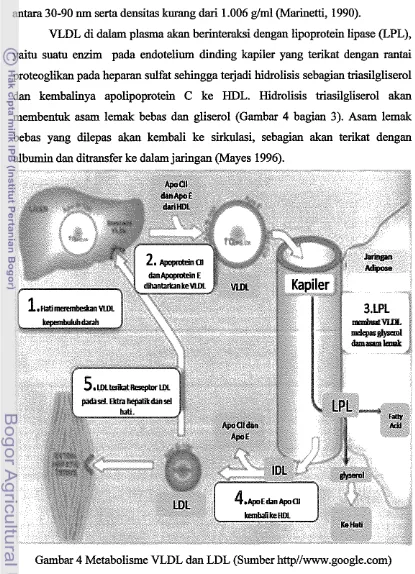
VLDL addah lipoprotein endogen yang disintesis
di
dalam hati, b e r h g s i membawa triasilgliserol, fosfolipid, dan kolesterol dari hati ke jaringan lain dalam tubuh. VLDL lebii kecil dibandingkan kilomikron, dan mempunyai diameter antara 30-90 nm serta densitas kurang dari 1.006 glml (Marinetti, 1990). [image:22.541.69.484.149.723.2]VLDL di dalam plasma akan berinteraksi dengan lipoprotein lipase (LPL), yaitu suatu enzim pada endotelium dinding kapiler yang terikat dengan rantai proteoglikan pada heparan sulfat sehingga terjadi hidrolisis sebagian triasilgliserol dan kembaliiya apolipoprotein C ke HDL. Hidrolisis triasilgliserol akan membentuk asam lemak bebas dan gliserol (Gambar 4 bagian 3). Asam lemak bebas yang dilepas akan kembali ke sirkulasi, sebagian akan terikat dengan albumin dan &transfer ke dalam jaringan (Mayes 1996).
Partikel VLDL yang tersisa setelah hidrolisis (remnan) mengandung sebagian kecil triasilgliserol, ester kolesterol, fosfolipid, apolipoprotein B-100 dan
E. VLDL remnant (IDL) akan mengalami dua kemungkinan yaitu : (1) diambil oleh hati melalui reseptor LDL atau (2) diubah menjadi LDL dengan melibatkan lipase hepatik yang akan menghidrolisis triasilgliserol dan fosfolipid serta melepaskau semua apolipoprotein E (Grundy 1996).
C.2.4. Low Density Lipoproteirr (LDL)
LDL sebagian besar terbentuk dari sisa hidrolisis VLDL remnan, namun terdapat bukti bahwa sebagian diproduksi langsung oleh hati (Mayes, 1996). LDL mempakan pembawa kolesterol terbanyak yaitu kurang lebii 60 % dari kolesterol total plasma, sedangkan triasilgliserol m e ~ p a k a n komponen paling sediit dalam LDL. Fungsi utama dari LDL adalah membawa sterol ke dalam jaringan perifer, digunakan untuk konstruksi membran atau untuk pembentukan hormon steroid (Groff ct al. 1995).
Metabolisme LDL diawali dengan terikatnya partikel LDL pada reseptor spesifik apo B-100E, yang terletak pada perrnukaan sel. Reseptor LDL bereaksi dengan ikatan pada LDL yaitu apo B-100 dan LDL diambil dalam keadaan utuh melalui endositosis. Setelah melepaskan LDL, reseptor kembali ke permukaan sel (Gambar 4 bagian 5). LDL yang terpisah masuk ke dalam lisosom, dimana komponen lipoprotein dan ester kolesterol mengalami hidrolisis menjadi asam amino dan kolesterol bebas (Kane dan Malloy 1997).
Kolesterol bebas yang diiasilkan mempunyai fungsi regulator (lipid) sebagai berikut : (1) menurunkan jumlah m-RNA sehingga menekan reseptor LDL dan mencegah masuknya LDL ke dalarn sel, (2) mengatur aktivitas kedua enzim mikrosomal yaitu HMG-KoA reduktase
dan
ACAT. Aktivitas enzim HMG-KoA reduktase dihambat sehingga laju sintesis kolesterol ditekan, sebaliiya aktivitas ACAT diiaikkan untuk memacu pembentukan ester kolesterol yang bisa disimpan di dalam sitoplasma sel (Groff ct al. 1995).D. Hiperlipidemia
darah (hiperkolesterolemia), trigliserida (hipertrigliseridemia) atau k o m b ' i i keduanya (Kamaludin 1995). Menurut Marinetti (1990), faktor yang mempengaruhi kejadian hiperlipidemia adalah nutrisi, faktor g e n e t s kelainan metabolisme, urnur, jenis kelamin, aktivitas fisik, dan ketidak seimbangan hormonal.
Berdasarkan mekanisme terjadinya, kejadian hiperlipidemia dapat terjadi dengan 3 mekanisme, yaitu kelainan pada enzirn lipoprotein lipase dan ApoC-11, kelainan dalarn eliminasi LDL, dan kelainan ApoE dan pembuangan sisa (Marinetti 1990). Menurut Price dan Wilson (2005), berdasarkan penyebabnya hiperlipidemia dikelompokkan menjadi dua jenis yaitu hiperlipidemia primer dan sekunder. Hiperlipidemia primer terjadi akibat kelainan gecetik yang mengkode enzim, apoprotein, atau reseptor yang terlibat ddam metabolisme lipid. Hiperlipidemia sekunder te rjadi akibat gangguan sistemik. Penyebab utama hiperlipidemia sekunder adalah obesitas, asupan alkohol berlebihan, diabetes melitus, hipotiroidisme dan sindrom nefrofik.
Berdasarkan tipenya, Fredrickson (1978) mengelompokkan hiperlipidemia menjadi tipe I - V yaitu,
1. Jenis I (Sindrom Buerger-Gruetz atau hiperkilomikroilemia keturunan). Keadaan ini ditandai dengan kadar kilomikron yang tinggi walau diet lemak normal. Hal ini disebabkan kurangnya en& lipoprotein lipase ataupun apoprotein C-II.
2. Jenis
IIA
(Folygenic hiperkolesterolemia atau hiperkolesterolemia ketunman). Kondisi ini dicirikan dengan kenaikan kadar LDL, kenaikan kadar kolesterol dan normalnya level trigliserida dan VLDL. Hal inidisebabkan karena terhalangnya penurunan/eliminasi LDL akibat kerusakan reseptor pada kromosom 19.
3. Jenis IlB (Hiperlipidemia kombinasi). Kondisi yang te rjadi sama dengan jenis IIA akan tetapi pada jenis ini VLDL mengalami peningkatan juga. Hal
ini
disebabkan karena kelebihan pembentukan VLDL oleh hati.5. Jenis
TV
(Hipertrigliseridemia atau endogenous hiperlipemia). Kenaikan kadar VLDL yang meningkat baik saat level LDL normal ataupun menurun, level kolesterol normal dan peningkatan trigliserida merupakan karakteristik jenisini.
Kondisi demikian tejadi disebabkan karena kelebihan d a d atau penurunan penguraian VLDL.6. Jenis V (Keturunan kombinasi hipertrigliseridemia). Kondisi jenis
ini
menyebabkan peningkatan kadar kolesterol, trigliserida, VLDL dan kilomikron walaupun kadar LDL normal ataupun menurur. Jenis V hiperlipidemia ini te rjadi karena peningkatan pembentukan atau penurunan eliminasi VLDL dan kilomikron.
E. Aterosklerosis
Aterosklerosis, berasal dari bahasa yunani "athero" (yang berarti lekat atau jenuh) dan "sclerosis" (yang berarti pengeman) khususnya menyangkut pembahan pada lamina intima arteri. Aterosklerosis adalah suatu penyakit dari arteri-arteri yang berukuran besar dan sedang dirnana lesi lemak yang disebutplak ateromatosa timbul pada permukaan dalam dinding arteri ( Guyton & Hall 1996). Secara morfologi, aterosklerosis terdii atas lesi-lesi fokal pada arteri-arteri otot dan jaringan elastis berukuran sedang dan besar seperti aorta, a. poplitea, afemoralis, a karotis dan a renalis (Price dan Wilson 2005).
Menurut Price dan Wilson (2005), faktor resiko aterosklerosis dibagi menjadi 3, yaitu faktor yang tak dapat diubah, faktor yang dapat diubah dan faktor resiko negatif. Faktor resiko yang tak dapat diubah adalah usia dan riwayat penyakit arteri koroner keluarga Adapun faktor resiko yang dapat diubah adalah hiperlipidemia, rendahnya kadar HDL-C (High Density Lipoprotein-Cholesterol/ kolesterol lipoprotein serum densitas tinggi), hipertensi, merokok sigaret, diabetes melitus, obesitas, ketidakaktifan fisik dan hiperhomosistein. Sedangkan faktor resiko negatihya adalah tingginya kadar HDL-C.
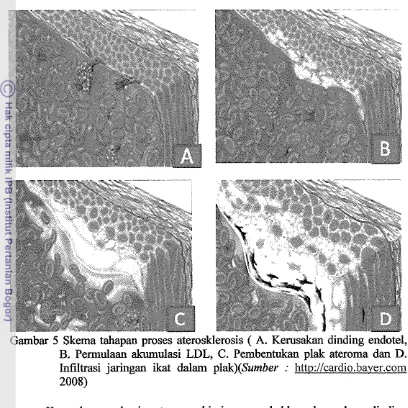
Patogenesa kejadian aterosklerosis secara sistematis dapat diuraikan pada gambar 5 sebagai berikut:
Gambar
5
Skema tahapan proses aterosklerosis ( A. Kerusakan dinding endotel,B. Permulaan akumulasi LDL, C. Pembentukan plak ateroma dan D. Infiltrasi jaringan ikat dalam plak)(Surnber : htto://cardio.bayer.com 2008)
medium dinding arteri. Sel ini berubah menjadi sel yang menyusun jaringan ikat penunjang dan mampu menyerap lipid lain di peredaran darah. Pada lesio ini, akan dimulai siklus peradangan proliferatif, yang memicu pembentukan trombus pada dindiig arteri (Gambar 5C). Di akhir waktu, akumulasi lapisan lipid menstimulasi masuknya lipid di sirkulasi secara kontiny deposit kolesterol, ekspansi sel otot polos dan pembentukan jaringan &at. Seluruh faktor tersebut menuntun untuk terjadinya plak fibrosa, yang melekat pada sisi arteri dan bertambah ukuran, sehingga ukuran lumen arteri menyempit (Gambar 5D). Plak fibrosa tersusun atas bentukan jaringan ikat padat dengan sel otot polos yang menempel
dan
biasanya ditutup dengan lapisan lipid dan runtuban sel nekrosa Seiring wakty plak akan berkalsifikasi yang menyebabkan penutupan sebagian saluran darah (Staros 2006).Aterosklerosis menyebabkan iskemia karena obstruksi aliran darab,
disfungsi kontraksi vaskular (Dupasquier 2006), idark miokard atau stroke, embolisasi dan aneurisme (akibat kerusakan bagian medial dinding arteri) (Marinetti 1990).
F. Oba: Anti Hiperlipidemia
Pada umumnya hiperkolesterolemia atau hipertrigliseridemia ringan masih dapat dikendalikan dengan hanya melakukan diet rendah lemak jenuh dan kalori. Namun pada kasus berat dan atau bersifat herediter yang sexing menyerag pada usia muda maka diet saja ti& mampu menanggulanginya. Sehingga digunakanlah obat-obat antihiperlipidemia yang mampu mengendalii kadar
Statin adalah golongan obat yang berfungsi menurunkan tingkat kolesterol dalam darah dengan cara mengurangi produksi kolesterol oleh organ hati. Statin memblokade enzym HMG CoA (hidroxy-methilglutaryl-coenzyme A reductuse) dalam hati yang bertugas membuat kolesterol (Oqbru 2008). Dengan terblokadenya enzim HMG CoA maka suMasi LDL (pembawa kolesterol) akan men- (Hitner clan Nagle 1999).
Statin digunakan untuk pengobatan hiperkolesterolemia, k o m p l i i i aterosklerosis pembuluh darah, serangan jantung, stroke, intermittent k l a u d i i i (kepincangan yang berselang) dan sangat baik dalam menurunkan LDL @hnaludii 1997; Oqbru 2008). Selain itu, Statin juga memperlihatkan efek sebagai anti oksidan (Staros 2006).
Contoh obat komersial golongan statin diantaranya adalah Simvastatin, Lovastatin, Pravastatin, Fluvastatin, Atorvastatin (Lipitor), dan Rosuvastatin.
Statin memiliki efek samping ringan seperti sakit kepala, mud, muntah, konstipasi, diare dan linglung. Sedmgkan efek samping yang serius adalah kerusakan hati, dan rhabdomyolysis (kerusakan parah pada sel otot) (Oqbru 2008). S e l m efek samping statin juga memiliki konfraindikasi terhadap wanita hamil (Hitner dan Nagler 1999).
2. Niacin
Niacin atau asam nikotinat berfimgsi menurunkan kolesterol dan trigliserida, dengan p e n m a n yang sangat nyata untuk trigliserida. Selain itu niasin juga menyebabkan kenaikan level HDL. Niasin bekerja menekan sintesa trigliserida sehingga sekresi VLDL
turun.
Secara tidak langsung LDLakan
turun
dan HDL akan meningkat dan kolesterol men- &amdudin1997).
peptikum dan diabetes mellitus. Obat ini mudah diserap di semua bagian saluran cema dan diekskresi melalui urin (Kamaludin 1997).
3. Fibrate
Fibrate bekeja merangsang enzim Lipoprotein lipase sehingga menurunkan serum trigliserida menghambat sintesa kolesterol dalam hati dan meningkatkan HDL sehingga menurunkan kadar kolesterol dan menarik cadangan kolesterol dalam jaringan. Contoh obat golongan fibrate adalah klofibrat dan gemfibrozil (Kamaludii 1997).
Efek samping obat ini adalah nyeri lambung, mual, muntab, diare clan
bertambahnya berat badan. Selain itu, fibrat juga dapat meningkatkan aktivitas koumarin saat dipakai bersarnaan dengan koumarin (Kamaludin
1997)
4. Cholestyramine
Kolestiramin mengikat asam empedu di dalam usus halus, mengkonversi kolesterol menjadi asam empedu, dan menurunkan kadar LDL. Karena fimgsi kejanya, obat ini dapat mengganggu penyerapan digitoksin, fenobarbitai, klorotiazid, warfarin, asam flufenamat, asam mefenamat dan tetrasikli (Kamaludim 1997).
Efek samping kolestiramin adalah .konstipasi, Flaws (kecacatan), hipokloremik metabolii asidosis, peningkatan ringan alkali fosfatase dan
transaminase, pembentukan batu empedu, sfeafosis, dan hilangnya penyerapan vitamin A dan D pada dosis tinggi (Kamaludin 1997).
G . Sediaan Potong Beku
Sediaan potong beku mempakan prosedur yang diynakan untuk meneguhkan dengan cepat diagnosa histopatologis dari proses patologis (Alonsozana 1992). Bagian terpenting dalan sediaan potong beku adalah cryosfat, yaitu alat bempa microtome khusus yang dilengkapi denganfieezer. Microtome yang digunakan sangatlab akurat dan mampu memotong dengan ketebalan 1
adalah kemudahan diagnosa dan kontras patologis yang jelas, sehingga proses patologis dapat terlihat (Gal clan Cagle 2005; Alonsozana 1992).
Gambar 6 Cryotome. (Sumber: koleksi pribadi)
Prosedur potong beku telah dikenal sejak 1905 oleh Dr. William Mayo. Temuan ini pertama kali dilaporkan oleh Dr. Thomas Cullen di Baltimore. Setelah cara fiksasi dengan formalii ditemukan, Wilson baru benar-benar sepenuhnya menemukan prosedur yang tepat (Gal dan Cagle 2005). Prosedur ke rja pembuatan sediaan potong beku dapat dilihat pada lampiran 10.
Metodologi Penelitian
WaMu dan Tempat
Penelitian ini dilaksanakan pada Januari 2007 sampai dengan Februari 2008. Penelitian
ini
dilakukan di Bagian Patologi, Departemen K l i , Reproduksi dan Patologi, Fakultas Kedoktemn Hewan, Institut Pertanian Bogor.Bahan dan Alat
Bahan Penelitian utama yang digunakan adalah kolesterol, untuk membuat hewan percobaan mengalami kondisi hiperlipidemia. Hewan percobaan yang dipergunakan adalah 12 ekor kelinci New Zealand white atau European rabbit (Oryctolagus cuniculus) jantan dengan bobot badan
12,s
Kg dan berumur'mta- rata 6 bulan. Bahan lain yang digunakan pada penelitian ini adalah ekstrak pellet kelinci komersial jenis Rb12 (pakan) kelinci, air minum, obat anti koksidia (Sulfamixe), anthelmentik (AlbendazoleQ), preparat sulfat (Zalf PagodaQ), ivermectin sebagai antiektoparasit dan preparat antihiperkolesterolemia (Simvastatin*). Adapun bahan pembuatan preparat potong beku adalah formalinlo%, aquades, sukrosa, N2 cair, albumin, Tissue ~ e k ' - OCT compound (optimum cutting tissue ), Propylen Glycol, Sudan Black, Nuclear Fast Redkernechtrot, silo1 dun Glycerin Jelly.
Alat yang digunakan a n t m lain adalah 12 buah kandang pemeliiharaan berbahan besi, tempat pakan dan rninum berbahan semen, timbangan elektrik, spoit 3m1, sendok, gelas, kertas label, alat-alat nekropsi dan alat-alat untuk
membuat sediaan preparat potong beku (Tissue cassette, Refrigerator, Cryosfat, gelas objek dan gelas penutup) mikroskop cahaya dan Digital Camera Microscope.
Desain Penelitian
Sebelum perlakuan utama, kelinci terlebii dahulu diadaptasikan dengan kondisi laboratorium. Pada masa adaptasi ini dilakukan pemberian antikoksidia (Sulfamix@) dengan dosis 3mlIlL atau 6,25d untuk masing-masing hewan. Pemberian antikoksi ini diseliigi dengan pemberian anthelmentik dengan pola
antikoksidia). Adapun pemberian anthelmentik (Albendazole@), masing-masing kelinci diberikan 1 mllekor. Diet makan dan minum yang diberikan berupa lOOgr pakan dan air ad libitum. Selanjutnya, 12 ekor kelinci dibagi menjadi 3 kelompok perlakuan yang terdii dari kontrol negatif (KN), kelompok hiperlipidemik tanpa obat antihiperlipidemia (H) dan perlakuan kelompok hiperlipidemik dengan obat antihiperlipidemia (HA). Kelompok kontrol negatif adalah kelompok kelinci tanpa perlakuan apapun kecuali pakan dan minum. Kelompok hiperlipidemik tanpa obat antihiperlipidemia diberikan pakan dan minum seperti kelompok kontrol negatif namun diikuti dengan pemberian kolesterol per oral. Perlakuan kelompok hiperlipidemik dengan obat antihiperlipidemia adalah kelompok perlakuan yang mendapatkan perlakuan kolesterol dan Smvastatin. Dosis Simvastatin diperoleh dengan mengkonversikan dosis melalui berat badan. Sedangkan dosis kolesterol diberikan berdasarkan penelitian-penelitian sebelumnya. Garis besar alur penelitian digambarkan pada Gambar 7.
Pengambilansampel darah
Minggu ke-
1
11
2Masa Adaptasi Pernberian obat antihiperlipidemia
Pemberian
kolesterol
[image:32.541.71.484.40.816.2]Pakan dan Minurn ad libitum
Gambar 7 Bagan perlakuan yang diberikan saat penelitian
Pemberian kolesterol dilakukan peroral sebanyak 0,2 gr/ekor/hari (berdasarkan penelitian Kolodgie et al. 1996). Sedangkan statin diberikan peroral sebanyak 1,25mg/ekor/hari. Perlakuan yang diberikan dilakukan dengan menggunakan alat bantu bexupa s p i t 3ml. Pengamatan gejala klinis dilakukan dengan kontrol jumlah pakan dan pertambahan berat badan. Kontrol terhadap jumlah pakan dilakukan setiap hari, sedangkan penghitungan berat badan
kolesterol total dalam darah dilakukan setiap empat minggu, dengan p e n g a m b i i darah via v. auricularis. Pa&
atchir
percobaan, hewan dinekropsi guna e v a l w i organ secara patologi anatomis dan histopatologi. Hewan dieutanasi dengan cara ex-sanguinasi v. jugularis. Setelah hewan mati dan darah keluar maka diambil aorta dan organ jantung dan arteri hewan. Setelah di dapat, organ tersebut difiksasi dalam f o r d i n 10%.Evaluasi Histopatologi
Sebelum dibuat sediaan histopatologi terlebii dahulu organ di potong setebal & 0,Scm dan di susun dalam tissue cassette. Setelah siap dalam cassette, organ yang telah ditempatkan di dalam cassette didehidrasikan dengan cara merendamnya dalam larutan sukrosa secara bertingkat (20%, SO%, 66%). Selanjutnya jaringan potong aorta ditempatkan cup pencetak (yang terbuat dari alumunium foil), dilanjutkan dengan pembekuan jaringan aorta dengan
Nz
cair. Setelah aorta membeku, dilakukan penanaman aorta dalam OCT Compound dengan cara memberikan cairan Tissue tek (OCT compound) sampai seluruh pennukaan preparat dalam cup alumunium foil terselubung. Selanjutnya cup berisi preparat dibekukan di dalam Cryo chamber. Apabila telah mengeras cup disimpan dalamfieezer.Sediaan potong beku ini mempakan sediaan yang tidak dapat bertahan Iama sehingga hams segera didokumentasikan.
Pengamatan Hktopatologi
Pengamatan histopatologi dilakukan dengan menggunakan mikroskop cahaya dengan pe:besaran lensa objektif 20x dan 40x. Sediaan mempakan organ aorta yang dipotong menjadi 5 irisan tranversaI. Kelima irisan tersebut diiris dengan ketebalan 5 pm dengan tiga kali ulangan, sehingga satu aorta akan diperoleh 15 lingkaran yang terbagi dalam tiga slide gelas objek. Setiap lingkaran selanjutnya di ukur ketebalan plak
,
intensitas lipid pada plak dan intensitas lipid pada tunika media masing-masing aorta. Ketebalan plak d i t u n g dengan menggunakan video mikrometer. Batasan pengukuran yang dilakukan di mulai dari batas plak ateroma terdekat dengan lumen, dan berakhir pada batas terjauh plak terdekat dengan tunika media. Ketebalan plak terhitung adalah ketebalan plak rata-rata yang diukur dari 3 lokasi berbeda dengan karakteristik plak terlebar, sedang dan terpendek. Intensitas lipid pada plak ateroma dan tunika media d i t u n g berdasarkan kepekatan lipid (endapan berwarna hitam) pada gambaran Xstopatologis. Plak ateroma ataupun tunika media dengan kepekatan lipid tinggi diberi skor (*), (*) pada kepekatan sedang dan (+) pada kepekatan rendah.Plak ateroma akan terlihat berwama hitam akibat pewamaan sudan black dan sel-sel ataupun lamina aorta akan terlihat berwama merah akibat terwamai oleh kernechhot.
Analisis Data
HASIL DAN PEMBAHASAN
Pengamatan Gejala &is
Pengamatan gejala Minis dilakukan dengan melakukan pengamatan aktifitas fisiologis hewan coba. Aktifitas fisiologis yang teramati adalah pola nafsu makan hewan yang diperoleh
dari
hasil penimbangan sisa pakan dan penghitungan jumlah pakan yang dikonsumsi. Jumlah pakan yang dikonsumsi erat kaitannya dengan pola pertumbuhan berat badan hewan coba. Angka konversi pakan (FCR) adalah besamya persentase kenaikan berat badan akibat konsumsi pakan. Besarnya FCR didapatkan dari hasil bagi antara total konsumsi pakan dengan tingkat kenaikan berat badan. Jumlah konsumsi perhari, konversi pakandan persentase kenaikan berat badan disajikan dalam Tabel 1 dan pertambahan berat badan dari awal hingga akhir penelitian digambarkan oleh Gambar 1.
Tabel 1 Konsumsi pakan dan berat badau kelinci selama percobaan
Rataan Kenaikan Konversi Rataan
Perlakuan Konsumsi Berat Pertambahan
Pakan (grlhari) Badan(Y0) Berat Badan
Kontrol negatif (KN) 83,03+7,96* 12,07 0,43i0,15' 246,12 Hiperlipemik (H) 82,85+10,57" 15,63 1,12M,70D 341,22 Hiperlipemik dengan
Obat anti 74,69i10,64' 15,52 0,54H,49
'
320,99Hipertipidemik (HA)
Keterangan : Nilai yang diikuti oleh humf superscript yang sama pnda kolom menunjukan nilai yang tidak
berbeda nyata (a= 0,05)
Pada Tabel 1 dapat terlihat bahwa kontrol negatif (KN) menunjukan konsumsi pakan terbanyak (83,03gr), kelompok perlakuan hiperlipemik (H) memiliki tingkat konsumsi 82,85 gr, sedangkan kelompok perlakuan hiperlipemik dengan obat antihiperlipemik (HA) menunjukkan nilai konsumsi terendah (74,69gr). Perbedaan konsumsi ini tidak berbeda nyata,
dan
menunjukkan bahwa pemberian obat anti hiperlipemik tidak menyebabkan gangguan atau berkumngnya nafsu makan. Tidak adanya gangguan makan dicirikan dengan tidak terjadinya muntah pada hewan selama perlakuan. Hal ini sesuai dengan hasil penelitian Hitnerdan
Nagle (1999) bahwa pemberian obat anti hiperlipidemia (sediaan statin) dalam dosis rendah tidak menyebabkan muntah.Pada Tabel 1 juga terlihat bahwa perbedaan nilai konsumsi pakan tidak berbeda nyata terhadap kenaikan berat badan antar perlakuan. Perbedaan
ini
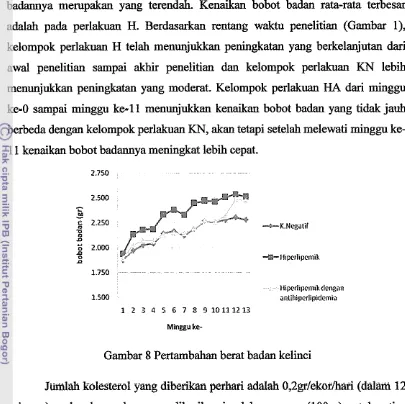
badannya me~pZIkaII yang terendah. Kenaikan bobot badan rata-rata terbesar adalah pada perlakuan H. Berdasarkan rentang waktu penelitian (Gambar I), kelompok perlakuan H telah menunjukkan peningkatan yang berkelanjutan dari awal penelitian sampai akhir penelitian dan kelompok perlakuan KN lebih menuqjukkan peningkatan yang moderat. Kelompok perlakuan HA dari minggu ke-0 sampai minggu ke-11 menunjukkan kenaikan bobot badan yang tidak jauh berbeda dengan kelompok perlakuan KN, akan tetapi setelah melewati minggu ke-
11 kenaikan bobot badannya meningkat lebii cepat.
2 750
[image:36.541.75.480.74.478.2]Minggu ke.
Gambar 8 Pertambahan berat badan kelinci
kales
.tefo
yymg dibe*@ru
2gii,ekofM 12 minggu), sedangkan pakan yang diberikan jumlahnya sama (100gr) untuk setiap hewan coba. Halini
mengindikasikan bahwa perbedaan berat badan yang terjadi lebih diakibatkan oleh variasi tingkat kecemaan antar individu kelompok perlakuan. Hasil percobaan ini sejalan dengan pendapat Metzger (2006) bahwa tingkat kecemaan hewan berbeda antar spesies bahkan antar individu keliici.Kadar Lipid dalam Darah Hewan Percobaan dan Indeks Aterogenik
Salah satu indikator terjadiiya aterosklerosis adalah meningkatnya kadar kolesterol dalam plasma darah dalam bentuk LDL dalam plasma darah. Kadar LDL darah sangat erat kaitannya dengan pembentukan aterosklerosis (Guyton dan Hall 1997; Spector dan Spector 1993). Kadar LDL didapat dari nunus; LDL =
Low Density Lipoprotein) (Friedwald et al. 1972). Kadar Lipid darah hewan percobaan digambackan oleh Tabel 2.
Tabel 2 Kadar kolesterol total, kadar lipoprotein densitas rendah (LDL), lipoprotein densitas tinggi (IIDL) dan trigliserida
I
Bulanke-OI
'
Bulanke-1I
Bulan ke-2I
Bulan ke-3Kontrol negatif
Hiperlipemik
I
Rataan kadar High Density Lipoprotein @DL) (mgldl)18,59&13,87' 16,27+10,19'
I
Hiperlipemik
1
22,O3*7,5la/
61,51;U2,81a1
77,19&31,8W1
113,17*70,33'I
63,85+25,23'
Hiperlipsmik denpn Obat anti Hiperlipidemik
Kontrol oegstif
14,8845,69' 92,93+66,15'
47,29331,03' 128,82+139,07"
Bulan k c 4 24,07+8,13'
55,5017534. 177,86t104,19'
8'2,37+8,3Ia
Hiperlipemik dengan Obat anti Hiperlipidemik
Kontrot n e s t i f
Hiperlipemik 33,61+20,09' 161,94+176,02' Bulan ke-1 60,75*13,97" 117,9%72,57% 39,63+20,49'
I I I I
bcrbeda nyata @>0,05)
Rataan kadar Trig'serida (mgldl)
Hiperlipemik denmn Obat anti ~ikrlipidcmik
I
Bulan ke-2 64,11+24,18' 136,6%98,28' Bulan ke-O 52,57+20,19' 56,67+16,35'
I
Bulan ke-3 53,40+22,34' 53,W16,22' 11237+103.09'Ketcmgan : Nilai yang diikuti oleh humf superscript yang samn padn kolom mcnunjukan nilni ymg tidak Bulan kc-1 69,23M3,34= 44,87+5,87' 91.021105.00a Bulan ke-2 28,2011 1,10* 21,7%t8,0On Bulan ke-3 53,76a22,65" 65,5P+38,4XL
[image:37.541.73.482.106.707.2]Pemberian kolesterol0,2g/ekor/hari diberikan diawal rninggu ke-3, setelah hewan mengalami masa karantina dan adaptasi kandang. Pada Tabel 2 terlihat tidak terjadi perbedaan yang nyata atau kadar lipid yang relatif homogen antar perlakuan pada bulan ke-0 karena efek dari perlakuan belurn terlihat. Efek pemberian kolesterol t e r l i i t pada bulan ke-1, diiana terjadi perbedaan kadar lipid darah yang nyata (P<0,05) pada perlakuan H dan HA. Pada tabel terlihat kelompok perlakuan H mengalami kenaikan LDL lebih dari 500% dan kolesterol total lebii dari 300% d i b a n d i i a n bulan ke-0. Peningkatan kadar lipid ini juga terjadi pada kelompok perlakuan HA yang mengalami kenaikan kadar LDL, kolesterol total dan HDL pada bulan ke-1. Dengan demikian, dapat diietahui bahwa telah terjadi peningkatan kadar kolesterol dan LDL melebii kadar normal pada hewan percobaan yang diberi perlakuan kolesterol. Kadar kolesterol normal darah kelinci berkisar antara 40-80 mddl untuk TPC (Total Plasma Colesterol/ kadar kolesterol total), 10-40 mg/dl untuk LDL, dan 60-110 mddl untuk trigliserida (Momuat 2001). Perlakuan H dan perlakuan HA mengalami peningkatan yang tinggi karena pemberian pemberian kolesterol dosis rendah pada jangka waktu yang lama (Kolodgie et a1 1996). Kejadian peningkatan kolesterol total mudah terjadi pada kelinci karena kelinci memang sangat sensitif terhadap diet kolesterol (Clarkson et a1 1974; Mahfoudz dan Kumerrow 2000). Peningkatan yang mudah te rjadi pada kelinci ini &karenakan kelinci tidak mampu meningkatkan ekskresi sterol sehingga menghasilkan peningkatan pengeluaran ester kolesterol hati yang kaya lipoprotein ke dalam sirMasi (Kolodgie et al
1996).
Pada Tabel 2 selanjutnya dapat terlihat peningkatan kadar lipid
darah
kelompok perlakuan HA yang tertahan pada bulan ke-2 dan menurun pada bulan ke-3. Pada kelompok perlakuan HA profil LDL meningkat mulai minggu ke-1 dan minggu ke-2, pada rninggu ke-3 terjadi penurunan secara tidak sign3kan p . 0 5 ) kadar LDL dari 128 mddl menjadi 82 mg/dl. Selain kadar LDL yang menurun, kadar kolesterol total juga mengalami penurunan tidak signifikan (B0.05) pada bulan ke-3 d i a n a kadar kolesterol total turun menjadi 127 mg/dl. Untuk lebih jelas, perubahan kadar kolesterol total terlihat pada Gambar 9.
adanya pemberian antihiperlipidemia (simvastatin@) yang dimulai pada bulan ke- 1. Sehingga, berdasarkan fungsi fisiologis tubuh, p e n m a n kadar kolesterol dan LDL ini dapat dikatakan terjadi akibat efek kerja statin yang m e n d a n total kolesterol darah (Blankenhorn and Hodis 1993). Statin memblokade enzim HMG CoA pa& hati yang bertanggungjawab menghasilkau kolesterol (Oqbru 2008). Terblokadenya pembentukan kolesterol menyebabkan pembentukan VLDL akan
berkurang, dengan berkurangnya VLDL maka jurnlah IDL menurun, sehingga LDL yang beredar dalam
darah
akan berkurang (Strandberg et a1 1997). Berdasarkan hasil penelitian, diketahui bahwa pemberian kolesterol 0,2gr/ekormari telah dapat menaikkan kadar lipid darah melewati ambang batas normal (hiperlipidemia) dan pemberian obat antihiperlipidemia (simvastatinm)1,25mg/ekorhari baru menunjukkan p e n m a n kolesterol yang sigfnitikan setelah 3 bulan.
".
w
-
o 0 1 2 3 h H i p e r l i p e m i kr dengan
[image:39.544.77.479.65.586.2]Bulan kt?- antihiperlipiderr~ia
Gambar 9 Kadar kolesterol total darah
aterosklerosis, sehingga mengalami resiko tertinggi aterosklerosis. Berbeda halnya dengan kelompok perlakuan HA, Kelompok
ini
diberikan perlakuan obat antihiperlipidemik yang diberikan bersarnaan dengan pemberian kolesterol pada bulan ke-1.
K.Nqatil Hi(~r1ipidcmik Hipcrlipidemikdengan
obat
Anrihiperiipidemik
[image:40.541.77.444.72.390.2]Perlaku~n
Gambar 10 Indeks atemgenik d a d kelinci
Ketebalan Plak Ateroma dan Gambaran Histopatologis Ateroma
Aterosklerosis sering disinonimkan dengan plak ateroma (Spector dan Spector 1993), sehingga pembahasan tentang aterosklerosis tidak akan lepas dari
plak ateroma Pada pengamatan histopatologi aorta potong beky diketahui tebal plak ateroma yang terjadi. Hasil perhitungan rata-rata tebal plak ateroma setiap kelompok perlakuan tersaji pada Tabel 3 dan gambaran histopatologinya pada Gambar 11,12,14 dan 15.
Tabel 3 Tebal plak ateroma dan intensitas lipid
Pcrlakuan
.
.- - -
.-
Kontml negatif
I
0,4M0,39'1
+
I
+
Dari hasil pengamatan diketahui bahwa pada setiap perlakuan didapati plak ateroma. Kelompok perlakuan KN meNpt3kan kelompok perlakuan dengan rata-rata tebal plak terendah dan kelompok perlakuan HA me~pakan kelompok perlakuan dengan rata-rata tebal plak tertinggi. Namun, berdasakan hasil analisa statistik perbedaan antar perlakuan ini tidak nyata e0.05). Apabila dibandingkan
Tebal Plak ( ~ m )
Hiperlipidcmik
Hipcrlipidemik dcngan Obat Anti Hiperlipidemik
Intensitas lipid Plak Atcroma
1,32&0,66'
Keterancan : Nilni , m e diikuti oleh huruf vane sama ~ n d n kolom menuniukan nilni vane. tidak berbeda nvata
2,8W2,53*
Intensitas lipid Tuniks
Media
C H
t+
t+e
[image:40.541.83.402.148.292.2]dengan indeks aterogeniknya, seharusnya kelompok H mengalami plak ateroma paling tebal, karena kelompok H memilii indeks aterogenik
>5.
Kenyataan lain adalah bahwa kelompok HA dan KN juga mengalami aterogenesis, walaupun dengan indeks aterogenesis yang rendah (55). Dengan demikian terlihat bahwa ada faktor lain selain pemberian yang mempengaruhi aterogenesis pada penelitian ini.Gambar Gambaran histopatologi jaringan potong beku aorta perlakuan hiperlipemik. ateroma (huruf A), B. Akumulasi lipid pada tunika media (humf B), C. Adventisia ( h m f C). Pewamaan: Sudan Black, Perbewan 400x, Bar =2pm
Plak unika
Gambar 12 Gambaran histopatologi jaringan potong beku aorta perlakuan kontrol negatif. A. Infiltrasi lipid p a d a e a intima (A), B. Tunika media (B), C. Tunika adventisia (C). Pewamaan: Sudan Black, Perbesaran 400x, Bar =2w.
merupakan bentuk plak ateroma pada tunika intima (penunjuk A). Selain itu, akurnulasi lipid juga terlihat pada tunika media sebagai butiian-butiran hitam (penunjuk B). Diet pakan yang mengandung kolesterol terus menerus memicu peningkatan kolesterol darah, kolesterol darah terbanyak dibawa oleh LDL-C (Low Density Lipoprotein -serum) dalam sirkulasi. LDL akan dioksidasi pada lokasi kerusakan endotel yang selanjutnya akan dimakan oleh makrofag dan membentuk ateroma. Karena kelompok perlakuan H diberi asupan kolesterol terus menerus tanpa diobati, maka kelompok perlakuan H mengalami ateroma.
Gambar 12 merupakan gambaran histopatologis sediaan potong beku dari aorta kelompok perlakuan
KN.
Pada gambar ini endapan lipid (benvarna hitam) hanya terlihat pada tunika intilna saja, sedangkan tunika media relatif bersih dari butiran lipid. Telnuan lesio ateroma padaKN
melnperkuat pernyataan Mahfoudz dan Kumerrow (2000) bahwa kelinci merupakan hewan yang sangat mudah membentuk endapan lipid. Menurut Kolodgie et al. (1996) kepekaan pembentukan lesio ateroma terjadi karena kelinci tidak marnpu meningkatkan ekskresi sterol sehingga terjadi peningkatan pengeluaran hasil metabolit hati yang kaya akan lipoprotein ke dalam sirkulasi, sehingga plak ateroma akan mudah terjadi. Pada penelitian ini, plak ateroma tetap terjadi sekalipun kelompok perlakuanKN
tidak menerima perlakuan kolesterol. Adapun kejadian ateroma yang terjadi, kemunglunan terjadi karena adanya kandungan lipid pada ransum pakan yang lebih dari kebutuhan kelinci. Menurut Clarkson et al. (1974), kebutuhan lemak kelinci adalah 3,5gr, sedangkan berdasarkan pakan komersial Rb12 (Tabel 4) jumlah lipid yang terkonsumsi adalah 4gr. Sehingga telah terjadi kelebihan asupan lipid yang terkonsumsi.Tabel 4 Kandungan zat makanan pada pellet kelinci RblZ
Protein I 16%
Kandungan zat makanan Persentase zat dalam pakan
Lipid
-
(sumber: http//www.cahaeral 18.indonetwork.co.id 2008)
Air
45'0
Kalsium
12%
1,3696
Serat kasar 14%
Pada Gambar 12 memang terlihat adanya inisiasi lipid pada tunika intima, namun pada tunika media infiltrasi lipid sangat sediit dibuktikan dengan sedikitnya bercak dan warna lapisan otot lebii jernih. Dari paparan tersebut, dapat dikatakan bahwa dalam keadaan normal, ateromatosis dapat te rjadi pada hewan kelinci dengan asupan pakan mengandung lipid.
Pemberian obat antihiperlipidemia (Simvastatin", diharapkan dapat m e n d a n ketebalan plak ateroma, karena sirkulasi LDL yang mentransport kolesterol telah dihambat dan pada saat yang sama level HDL meningkat. Secara teori, dengan mengurangi kadar LDL, kadar kolesterol dalarn plasma akan
terkurangi (Hitner d m Nagle 1999). Dengan berkurangnya level kolesterol dalam plasma, diiarapkan kemungkinan masuknya LDL teroksidasi
akan
berkurang sehingga ketebalan plak ateroma yang terjadi berkurang.Kelompok perlakuan HA (Hiperlipidemia dengan obat Antiluperlipidemia) diwakili oleh Gambar 14 dan Gambar 15. Hal yang perlu dicermati dari kelompok perlakuan HA adalah bahwa sediaan histopatologi HA menunjukkan ketebalan plak tertinggi, meskipun hasil analisa lipid darah menunjukkan penunman kadar LDL. Hasil pengukuran plak ateroma yang terjadi pada kelompok HA
menunjukkan plak ateroma tertinggi diantara perlakuan lainnya Alcan tetapi, apabila diliiat lebih teliti pada Gambar 15, maka plak ateroma yang terbentuk tidak sepadat plak pada kelompok H dan KN (Tabel 3). Hal ini menunjukkan bahwa pemberian simvastatin@ menyebabkan terkikisnya bentukan plak ateroma Gambaran pIak tersebut juga sesuai dengan hasil penelitian Son er al. (2003) tentang kemarnpuan statin yang dapat merusak stabilitas plak ateroma dan mengikis plak yang terbentuk.
kemampuan hati dalam menghasilkan HDL berkurang (Tabel 3). Kurangnya HDL menyebabkan pengangkutan kolesterol dari jaringan perifer dan sirkulasi akan berkurang, sehingga kemampuan
HDL
menghilangkan kolesterol dari sirkulasi berkurang. Hal inilah yang menyebabkan pembentukan plak pada kelompok H lebii progresif dibandingkan perlakuan lainnya. Pembentukkan plak ateroma yang progresif tersebut dapat terlihat pada Gambar 15.Gambar 14 Gambamn histopatologi jaringan potong beku aorta perlakuan biperlipemik dengan obat antihper1ipidemia plak ateroma (panah A), akumulasi lipid pada f m h media (panah B). pewhaan: sudan black, perbesaran 400x, bar =5pm
Gambar 15 Gambamn histopatologi jaringan potong beku aorta perlakuan hiperlipemik dengan obat antihiperlipidemia. tebal plak (A). pewamaan: sudan black perbesaran 200y bar
[image:44.547.72.446.53.755.2]KESLMPULAN DAN SARAN
Kesimpulan
1. Tehnik potong beku dan pewarnaan lemak dapat menunjukkan dengan jelas distribusi lipid pada plak ateroma.
2. Pemberian obat antihiperlipidemia menyebabkan kerapuhan plak ateroma.
Saran
DAFTAR PUSTAKA
Alonsozana GLG. 1992. Frozen section procedure (intraoperative consultation).
http:Nw.netautopsy.org/axsop [7 januari 20091
Bird RP dan Draper
HH.
1984. Conzparative Studies on D!fferent Methods of Malonadelzyde Deternzination. Di dalanz Abidin, Z . 1996. Kadar Malonaldelzida dan Zat Gizi Antioksidan pada Plasma Populasi Remaja Rentan Pencemaran Makanan. Skripsi. Bogor: Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian.Blankenhom DH and HN Hodis. 1993. Atherosclerosis--reversal with therapy. West J Med. 159(2): 172-179.
Bottorf MB. 2004. Safety and Statins: Pharmacologic an clinical perspectives. Preventive Medicine in Managed Care. Vol4, No.2 (30-37).
Clarkson BT, Lehner NDM and Bullock C. 1974. Arteriosclerosis Research Aplicafion. Di dalajn: Weisbroth S H , Flatt RE, Kraus AL, Editor. The Biology of The Laboratory Rabbit. New York: Academic Press. hlm 155-
177.
Conti MPC, Levillaind MP and Lemonnier A. 1991. Improve fluorometric determination of malonaldehyde. J Clin Chetn Soc. 103: 6472-6477. Cook RP. 1958. CHOLESTEROL: Clzemisrv Biochenzistiy and Pathology. New
York: Acadelnis Press Inc.
Davies MJ MD, 1986. Colour Atlas of Cardiovascular Pathology. Hprvey Miller Publisher. USA: Oxford University Press.
Dellman HD dan Venable. 1989. Buku Teks Histologi Veteriner 1. Ed ke-1. Jakarta:
UI
Press.Devanita L. 2008. Kajian patologi hati kelinci hiperlipidemia dengan dan tanpa pemberian antihiperlipidemia.
m.
Departemen Klinik Reproduksi Patologi. Fakultas Kedokteran Hewan. Bogor: IPB.Dominiczak MH. 1994. Apolipoprotein and Lipoprotein in Hunzan Plasma. N Rifai Dan GR Wamick (eds). Laboratory Measurenzent of Lipid, Lipoprotein, and Apolipoprotein. Washington DC: AACC Press. Dupasquier CMC, AM Weber, BP Ander, PP Rampersad, S Steigenvald, JT
Wigle, RW Mitchell, EA Kroeger, JSC Gilchnst, MM Moghadasian, A Lukas and GN Pierce.. 2006. Effect of dietary flaxseed on vascular contractil functionand atherosclerosis during prolonged hypercolesterolemia in rabbits. http://nww.ajpheart. Org. [17 Januari 20081
Frederickson D, et al. 1978. The Familial Hyperlipidemias. Di dalam Spector WG & Spector TD. 1993. Pengantar Patologi Umum. Edisi ke-3. Soetjipto, Harsoyo, Hana A, Astuti P, pene rjeinah. UK: Longman Group Limited. Tejemahan dari: An Introduction to General Pathology.
Friedwald WT, Levy RI and Fredriskson DS. 1972. Estimation of the concentration of low-density lipoprotein cholesterol in plasma without use of the preparative ultra-centrifuge.
J
Clin Chem 18:499-502.Gal AA and Cagle PT. 2005. The 100-year anniversary of the description of the frozen section procedure. J A M ; 294: 3 135-7.
Ginsberg HN and IJ Goldberg. 1998. Disorder of Intermediary Metabolisnz. Fauci AS, Braunwald E, Isselbacher KJ, Wilson JD, Martin JB, Kasper DL, Hauser SL dan Longo DL (eds). McGraw Hill Health Professions Division, New York
Girindra A. 1988. Biokimia I. Jakarta: PT Gramedia Pustaka Utama. Di dalam Sihombing ABH, Pemanfaatn Rumput Laut sebagai Sumber Serat Pangan dalam Ransum untuk Menurunkan Kadar Kolesterol Darah Tikus Percobaan.
Skripsi.
Bogor: Departemen Teknologi Pangan dan Gizi,. Fateta, LPB.Graves DT, Jiang Y and Anthony JV. 1999. The Expression of MCP-1 and other chemokines by osteoblast. Di dalam Groff JL, Gropper SS dan Hunt SM. 1995. Advanced Nutrition and Human Metabolism. USA: West Publishing Company.
Groff JL, SS Gropper dan SM Hunt. 1995. Advanced Nutrition and Human Metabolism. USA:West Publishing Company.
Grundy SM. 1996. Dietary Fat. Di dalam Ziegler EE dan LJ Filer. Present (eds) Knowledge in Nutrition. Edisi ke-7. washington DC: ILSI Press
Gun MI. 1992. Role of Fats in Food Nutrition 2nd Edition. London: Elsevier Applied Sci.
Guyton AC and Hall JE. 1997. Buku Ajar Fisiologi Kedokteran. Ed ke-9. Irawati Setiawan, editor. Jakarta: EGC.
Hagen KW. 1974. Colony Husbanda~y dalam The Biology of The Laboratory Rabbit. New York: Academic Press.
Herman S. 1991. Pe~zgarulz Gizi terlzadap Penyakit Kardiovaskuler. Cermin Dunia Kedokteran. 73 : 12-16
Hitner H and Nsgle B. 1999. Basic Pharmacology 4& Edition. USA: GlencoeMcGrawl-Hill.
Kamaludin MT. 1993. Farmakologi Obat Anti Hiperlipidemia. Cermin Dunia Kedokteran. 85:26-31.
Kane JP and MJ Malloy. 1997. Disorder of Lipoprotein Metabolism. Di dalam Greenspan FS dan GJ Strewler (eds). Basic and Clinical Endocrinology. London: Prentice Hall International Limited.
Kitaev MI, Aitbaev KA and Liamtsev VT. Effect of Hypoxia on Development of Atherosclerosis in Rabbits. http://www.ncbi.nlm.nilt.gov/enfre~/que~. [ 27 Januari 20071
Kolodgie FD, AS Katocs Jr, EE Largis, SM Wrenn, JF Cornhill, EE Herderick, SJ Lee and R Vinnani. 1996. Hypercolesterolemia in the rabbit induced var