ERVIAN HADI RAMDANI. Isolasi dan Pemurnian Protein Inhibitor RNA
Helikase Virus Hepatitis C dari Kapang Endofit
. Dibimbing oleh
EMAN KUSTAMAN dan A. ZAENAL MUSTOPA.
1
Hepatitis C merupakan penyakit yang disebabkan oleh virus hepatitis C ( (
) atau HCV). Virus hepatitis C memiliki satu untai positif RNA, berpelindung, dan berbentuk bola dengan diameter 50-60 nm (Borowski 2008). Virus ini memiliki tingkat virulensi yang tinggi. Sebanyak 180 juta jiwa penderita di seluruh dunia mengidap penyakit ini dan bertambah setiap tahunnya. Penularan penyakit ini umumnya terjadi melalui transfusi darah atau jarum suntik yang tercemar darah yang mengandung HCV (Kandil 2009).
Saat ini pengobatan yang diberikan kepada penderita penyakit hepatitis C yaitu terapi interferon-alfa, ribavirin, dan kombinasi keduanya. Namun, pengobatan ini memiliki beberapa kelemahan, yaitu mahal dan memiliki efek samping. Efek samping yang dapat terjadi akibat penggunaan ribavirin yaitu dapat menyebabkan anemia yang dapat terjadi secara tiba-tiba dan kecacatan pada janin. Terapi kombinasi interferon alfa dengan ribavirin belum dapat mengobati dengan efek yang luas, karena hanya dapat menghilangkan virus sampai 50% dari HCV genotipe 1 dan 80% dari genotipe 2 dan 3 (Yayasan Spiritia 2005 dalam Megawati 2008).
Terapi untuk hepatitis C diharapkan memiliki efektifitas yang tinggi, dapat digunakan secara oral, memiliki efek samping yang sedikit, murah, dan cocok untuk kebanyakan pasien (McHutchison & Patel 2002). Salah satu pendekatan pengobatan yang sedang berkembang adalah terapi target molekuler yang bertujuan menghambat siklus hidup HCV. Salah satunya yaitu dengan cara menghambat kerja RNA helikase .
Enzim RNA heilkase HCV memiliki peranan penting dalam tahapan replikasi virus ini yaitu membuka ikatan dupleks RNA virus agar dapat ditranslasikan (Borowski 2008). RNA helikase memiliki tiga macam aktivitas, yaitu aktivitas pengikatan RNA, pengikatan (" (" e (ATP), dan pembukaan rantai RNA ( * ). Apabila proses pembukaan ikatan dupleks RNA virus sebagai pustaka genetik tidak dapat dilakukan, maka proses translasi informasi genetik tidak dapat berjalan sehingga siklus hidup HCV terhenti. Oleh karena itu, enzim ini dapat dijadikan target obat yang potensial untuk pengembangan dan penemuan obat anti HCV yang baru (Utama
2000).
Kinerja dari RNA helikase dapat dihambat oleh suatu inhibitor. Inhibitor enzim dapat diperoleh dari hasil metabolit sekunder, misalnya metabolit dari kapang endofit. Kapang endofit adalah kapang yang hidup berkoloni di dalam jaringan tanaman dan tidak menyebabkan efek yang negatif bagi tanaman inang (Maksum 2005). Endofit ini merupakan sumber dari metabolit sekunder yang belum diketahui potensinya di bidang medis, pertanian, dan pemanfaatan industri. Oleh karena itu, pemanfaatan kapang endofit perlu untuk dilakukan.
Pemanfaatan kapang endofit sebagai sumber obat baru saat ini sedang banyak dilakukan. Hal ini dikarenakan mikroorganisme ini mampu menghasilkan senyawa bioaktif yang sama dengan tanaman inangnya. Satu tanaman dapat memiliki satu atau lebih mikroorganisme endofit yang hidup di dalamnya, sementara di dunia terdapat 30000 jenis tanaman, maka dapat dibayangkan kekayaan biodiversitas mikroorganisme ini sangatlah besar (Strobel & Daisy 2003). Biodiversitas yang besar inilah yang dapat digunakan pemanfaatannya dalam mencari inhibitor RNA helikase HCV.
Megawati (2008) menyebutkan bahwa protein metabolit sekunder dari isolat endofit yang diisolasi dari tanaman temu putih gombyok memiliki kemampuan menghambat RNA helikase HCV, sehingga dapat dimanfaatkan sebagai obat bagi pasien yang terkena penyakit hepatitis C. Namun, perlu dilakukan isolasi dan pemurnian terhadap protein inhibitor ini sehingga memiliki efektifitas yang maksimal dalam menghambat kinerja RNA helikase.
Penelitian ini bertujuan melakukan isolasi dan memurnikan protein inhibitor RNA helikase virus hepatitis C dari isolat
. Belum ditemukannya obat atau vaksin yang dapat mengobati infeksi virus hepatitis C secara efektif sampai saat ini memberikan inspirasi untuk mencoba mencari senyawa antivirus yang berasal dari bahan yang berasal dari alam bukan sintetik.
Hipotesis penelitian ini adalah protein metabolit sekunder yang dihasilkan oleh
kapang endofit dapat
menghambat aktivitas RNA helikase virus hepatitiis, sehingga dapat digunakan sebagai kandidat obat hepatitis C. Penelitian ini diharapkan dapat memberikan informasi mengenai protein metabolit sekunder yang dihasilkan oleh kapang endofit
2
! "#$%&
Endofit adalah mikroorganisme yang hidup di dalam tanaman tingkat tinggi. Bacon dan White (2000) menyebutkan bahwa endofit merupakan mikroorganisme yang hidup berkoloni di dalam jaringan tumbuhan tanpa menyebabkan efek negatif terhadap tumbuhan tersebut. Mikroorganisme yang hidup pada jaringan tumbuhan ini memilki hubungan simbiosis. Mikroorganisme yang banyak ditemukan hidup sebagai endofit adalah bakteri dan kapang.
Endofit diperkirakan menghasilkan metabolit yang karakteristiknya mirip dengan tumbuhan inangnya. Schuzt (2002) menjelaskan bahwa metabolit yang dihasilkan dipengaruhi oleh lingkungan dan tingkatan organisme tertentu. Pemilihan tumbuhan yang akan diisolasi endofitnya harus mempertimbangkan beberapa hal. Pertama, tumbuhan tersebut berasal dari lingkungan yang unik dan mempunyai kemampuan untuk bertahan hidup. Kedua, tumbuhan tersebut memiliki sejarah etnobiologi yang digunakan sebagai obat dari penyakit tertentu. Ketiga, ketersediaan tumbuhan bersifat endemik karena dikaitkan dengan lingkungan tempat tumbuhnya sehingga diduga menghasilkan metabolit aktif untuk mempertahankan kelangsungan hidup. Keempat, tumbuhan yang hidup di dalam lingkungan dengan keragaman tinggi sehingga kemungkinan memiliki endofit dengan keragaman yang tinggi pula (Strobel & Daisy 2003).
Mikroorganisme yang hidup sebagai endofit salah satunya adalah kapang. Isolat merupakan kapang endofit yang diisolasi dari tanaman temu putih. Endofit ini termasuk ke dalam kelompok kapang dengan morfologi bulat (Gambar 1). Temu putih ( + ) dapat dijadikan sebagai obat antivirus (Chungsamarnyart 2007).
Gambar 1 Kapang endofit
Suhu optimal yang dibutuhkan untuk pertumbuhan kapang berkiksar 25-30oC. Pada umumnya kapang dapat tumbuh pada kisaran pH 2-8.5, akan tetapi pertumbuhannya akan lebih baik pada kondisi pH rendah. Nilai pH optimum untuk pertumbuhan kapang berkisar antara 6-7 (Fardiaz 1992).
%'() * &%&%)
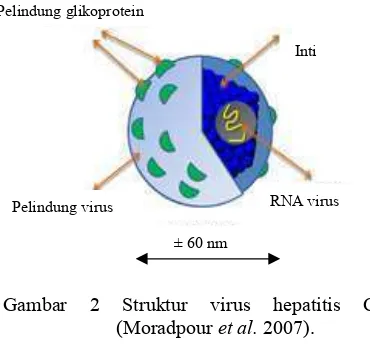
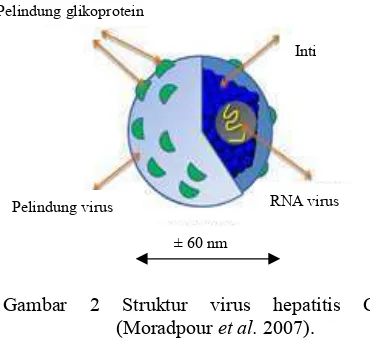
Virus hepatitis C (HCV) ditemukan pertama kali pada tahun 1989 dengan nama virus hepatitis non-A dan non-B. Virus ini termasuk kedalam genus ( dan famili . Genom HCV terdiri atas utas tunggal RNA positif yang berukuran sekitar 9.6 kilobasa (kb). Virus ini berbentuk bulat, berpelindung, dan berdiameter sekitar 50-60 nm (Gambar 2) (Tellinghuisen 2007).
Genom HCV terdiri dari (
(ORF) tunggal yang mengkodekan poliprotein tunggal. Poliprotein tersebut merupakan prekusor bagi 3000 jenis asam amino. Poliprotein ini akan diubah menjadi sekitar 10 jenis protein yang berbeda dan terbagi dalam dua kelompok besar protein virus, yaitu protein struktural (protein inti, E1, E2, dan p7) dan protein nonstruktural (NS) (NS2, NS3, NS4A, NS4B, NS5A, dan NS5B) (Lauer &Walker 2001).
Protein struktural dari HCV terletak pada daerah N terminal. Protein inti diperlukan untuk perakitan partikel virus baru (virion) dalam bentuk nukleokapsid. Protein inti berperan sebagai modulator metabolisme lipid dan hepatokarsinogenesis. Protein pelindung
( 1 (E1) mempunyai bobot molekul sekitar 30-35 kDa, sedangkan protein pelindung ( 2 (E2) sekitar 70-75 kDa. Pelindung tersebut banyak mengandung glikoprotein. Kedua pelindung ini mempunyai tingkat mutasi yang sangat tinggi dan bersifat sangat spesifik terhadap antibodi. Pada E2 terdapat region yang berfungsi unuk mengikat
pada 81 (CD81),
yaitu reseptor untuk HCV. Protein p7 berperan dalam pengaturan kanal ion (Tellinghuisen 2007).
Protein nonstruktural (NS) terdiri dari NS2, NS3, NS4A, NS4B, NS5A, dan NS5B. Protein nonstruktural berperan dalam replikasi virus. Protein NS2 mempunyai aktivitas protease. Protein NS3 mempunyai dua aktivitas utama, yaitu serin protease dan NTPase atau helikase. Protein NS4A berperan sebagai kofaktor serin protease NS3, sedangkan NS4B belum diketahui fungsinya secara jelas. NS5A merupakan fosfoprotein Kapang
3
yang fungsinya belum diketahui secara jelas. Protein ini bersifat hidrofilik dan sangat sensitif terhadap interferon. NS5B mempunyai peranan dalam aktivitas
RNA-( RNA polimerase (RdRp)
(Tellinghuisen 2007).
Virus hepatitis C menyerang sel hati atau limfosit B. Virus ini menyebabkan penyakit hepatitis C yang dalam jangka panjang mengakibatkan peradangan hati, sirosis, dan kanker hati. Penyakit ini sulit dideteksi karena gejala yang ditimbulkan mirip dengan penyakit yang lain, seperti mual, nafsu makan berkurang, mudah lelah, timbul kekuningan (mata, kulit), dan urin berwarna gelap. Umumnya penyakit ini terdeteksi apabila sudah mencapai tingkat akut, sekitar 30-80% infeksi (Sy & Jamal 2006).
Gambar 2 Struktur virus hepatitis C (Moradpour 2007).
* %+ )*
Helikase adalah enzim yang berperan dalam membuka untai ganda nukleotida (DNA atau RNA) menjadi untai tunggal. RNA helikase merupakan enzim yang membuka ikatan dupleks RNA positif dengan negatifnya menjadi untai tunggal. Enzim ini pertama kali ditemukan pada " " Enzim ini bekerja secara katalitik dengan memutus ikatan hidrogen yang terjadi antara kedua untai tersebut (Kadare & Haenni 1997).
RNA helikase yang terdapat pada virus hepatitis C (HCV) dikodekan oleh protein NS3 RNA helikase (Ceng 2007). Enzim ini juga memiliki aktivitas ATPase dan pengikatan terhadap untai RNA. Mekanisme kerja dari RNA helikase pertama-tama adalah mengikat untai RNA pada ujung 3’. ATP akan terikat pada sisi aktif enzim tersebut dan dihidrolisis oleh RNA helikase menjadi ADP dan fosfat anorganik. Energi yang dilepaskan digunakan oleh RNA helikase untuk
membuka ikatan hidrogen pada dupleks RNA. Enzim akan bergerak sepanjang arah 3’-5’ dalam memisahkan kedua untai RNA dan berperan dalam proses translasi, pembentukan poliprotein, dan memutus interaksi RNA dengan protein (Gambar 3) (Utama 2000).
RNA helikase berperan penting dalam replikasi virus dapat dijadikan target dalam pencarian obat HCV. Target pencarian obat dapat dilakukan dengan menghambat salah satu aktivitas dari RNA helikase tersebut. Penghambatan dilakukan dengan mencari inhibitor RNA helikase sehingga proses replikasi virus menjadi terhambat (Megawati 2008). Aktivitas ATPase dari RNA helikase lebih mudah digunakan sebagai target pencarian obat antivirus. Hal tersebut dikarenakan substrat yang digunakan, yaitu ATP, bersifat lebih stabil (Tellinghuisen 2007).
Gambar 3 Mekanisme RNA helikase (Utama 2000).
,
-Elekroforesis adalah teknik pemisahan yang memisahkan analit berdasarkan kemampuannya bergerak dalam medium konduksi yang biasanya berupa larutan bufer dan akan memberikan respons setelah ditambahkan medan listrik. Suatu zat yang bermuatan jika diberi potensial, maka zat tersebut akan berpindah sepanjang medium yang kontinu ke arah katode atau anode sesuai dengan muatan yang dibawanya (Harvey 2000).
Elektroforesis SDS-PAGE termasuk ke dalam kelompok elektroforesis zona/wilayah, yaitu kelompok elektroforesis yang dibedakan berdasarkan medium penyangganya. Elektroforesis SDS-PAGE menggunakan gel ± 60 nm
RNA virus Pelindung virus Inti Pelindung glikoprotein RNA helikase 3’ 5’ ADP Pi 5’ 3’ Pembukaan ikatan dupleks RNA Pengikatan RNA 5’ 3’ 3’
5’ RNA
4
buatan sebagai medium penyangga. Gel yang digunakan terbentuk dari polimerisasi akrilamida dengan ,- , .metilena bis akrilamida sehingga terbentuk ikatan silang karena polimerisasi akrilamida sendiri hanya menghasilkan ikatan linear yang tidak membentuk gel kaku (Girindra 1993). Polimerisasi dapat terjadi dengan cepat pada suhu kamar dengan adanya katalis dan inisiator. Katalis dan inisiator yang umum digunakan ialah ,- , - , - , -tetrametilenadiamina (TEMED) dan amonium persulfat (APS) sebagai sumber radikal bebas yang akan menginisiasi pembentukan polimer (Caprette 2005). Pada metode ini, digunakan natrium dodesil sulfat (SDS) dan β-merkaptoetanol. SDS merupakan detergen anionik yang bersama dengan β-merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein menjadi konfigurasi acak. Hal ini disebabkan oleh pecahnya ikatan disulfida yang selanjutnya tereduksi menjadi gugus-gugus sulfidril. Umumnya analisis dengan elektroforesis protein menggunakan gel poliakrilamida dengan konsentrasi yang sesuai dengan bobot proteinnya (Tabel 1).
Pergerakan partikel di dalam medium bergantung pada ukuran partikel dan ukuran medium penunjang. Ukuran pori dari gel akan ditentukan oleh konsentrasi gel poliakrilamida. Protein yang besar mempunyai mobilitas yang lebih lambat dibandingkan dengan kompleks protein yang lebih kecil. Bobot molekul protein dapat ditentukan dengan kalibrasi menggunakan standar protein yang sudah diketahui bobot molekulnya (Rybicki 1996). Teknik elektroforesis gel banyak digunakan baik di bidang kimia maupun biokimia, karena teknik ini memiliki banyak keuntungan, diantaranya memiliki daya resolusi tinggi, sederhana, dan mudah dibawa (Girindra 1993).
Tabel 1 Variasi konsentrasi gel berdasarkan bobot protein
% gel Bobot protein (kDa)
7 50 – 500
10 20 – 300
12 10 – 200
15 3 – 100
Sumber: Laemmli (1970)
'# &#!' $% * % &' )%
Kromatografi adalah metode pemisahan yang dapat digunakan untuk memisahkan suatu komponen dari komponen lainnya atau memisahkan komponen dari sekumpulan
komponen lainnya. Metode ini merupakan teknik yang efektif dan dapat digunakan untuk memisahkan komponen yang sulit dipisahkan dengan metode lain (Wilson & Walker 1994).
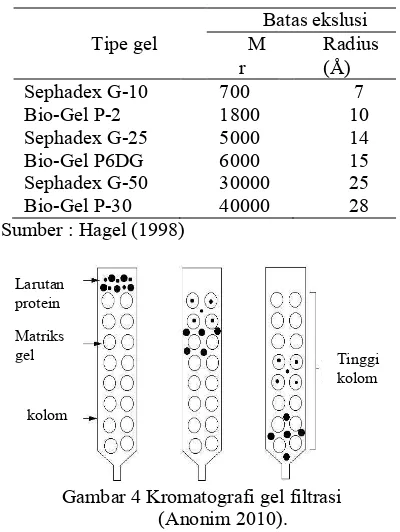
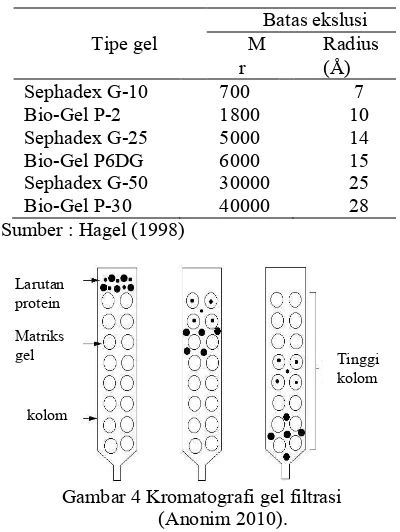
Kromatografi gel filtrasi merupakan teknik pemisahan yang berdasarkan pada ukuran dan atau bentuk dari partikel analit. Pemisahan tersebut dilakukan menggunakan matriks yang berpori. Masing-masing molekul memiliki tingkatan yang berbeda untuk melewati pori tersebut (molekul yang lebih kecil memilki kemampuan lebih tinggi untuk melewati pori tesebut dibandingkan dengan molekul yang lebih besar), sehingga menyebabkan pemisahan analit. Batasan pemisahan dari sebuah ukuran yang dipisahkan merupakan indikasi bobot molekul, umumnya untuk tipe polimer, dari analit tersebut (Hagel 1998). Ukuran protein yang dapat dipisahkan oleh beberapa matriks gel dapat dilihat pada Tabel 2.
Pemisahan molekul yang terjadi yaitu molekul yang memiliki ukuran besar akan terelusi oleh fase gerak dari kolom kromatografi dan akan keluar paling awal melalui ruang antar matriks dengan laju alir yang tinggi. Molekul yang berukuran kecil akan terelusi ke dalam fase diam oleh fase gerak dengan laju alir yang rendah, sehingga akan keluar dari kolom paling akhir (Wilson & Walker 1994). Ilustrasi pemisahan protein yang terjadi pada kromatografi kolom ditunjukkan pada Gambar 4.
Tabel 2 Ukuran protein minimum yang dapat dipisahkan oleh matrik gel
Sumber : Hagel (1998)
5
. " &
Bahan-bahan yang digunakan untuk isolasi enzim RNA Helikase meliputi bakteri pET BL21 (DE3) pLysS yang membawa gen NS3 RNA helikase virus hepatitis C dalam plasmid pET 21b (koleksi Andi Utama), media Luria Bertani " (LB), akuades, ampisilin, bufer B (10 mM Tris HCl pH 8.5, 0.3 M isopropil β-D-thiogalaktopiranosida (IPTG), resin Talon, dan bufer elusi (400 mM imidazola dalam bufer B).
Bahan-bahan yang digunakan untuk isolasi dan pemurnian kapang endofit
adalah isolat kapang endofit
(koleksi Titik K Prana, Laboratorium Biopolimer Puslit Bioteknologi LIPI), media
( / " (PDB), ( /
" (PDA), 0.1 mM ATP (Adenosin trifosfat), 1 mM MgCl2, larutan hijau malakit,
0.1 mM MOPS (4- (" ( (
(" ), 2.3% polivinil alkohol,
amonium molibdat, natrium sitrat, gel Sephadex G-50, metanol, akuabides, amonium sulfat, amonium persulfat, , , -, - -,-tetrametilenadiamina (TEMED), Tris HCl pH 7.4, Tris pH 6.8 mengandung 0.4% SDS, Tris pH 8.8, sukrosa, akuades, dan pewarnaan perak.
Alat-alat yang digunakan untuk isolasi RNA helikase adalah sonikator (Labsonic), ultrasentrifugasi Sorvall RC-26 plus, tabung sentrifus, Erlenmeyer 2000 mL, inkubator berpenggoyang, ( * - dan rotator (N-Biotec). Peralatan untuk pemurnian protein inhibitor kapang endofit meliputi
01.* ( (Nalge Nunc), pipet mikro, neraca analitik, peralatan gelas,
( (Multiscan EX Thermo),
" SDS PAGE, laminar, oven, kolom gel filtrasi, tabung falcon, dan vial.
*&#"*
)# )% " * (' % * %+ )*
, &
-)# )% .* %+ )* . Sebanyak 10
mL kultur pET BL21(DE3) pLysS yang membawa gen NS3 RNA helikase HCV diinokulasikan ke dalam 400 mL medium LB cair yang mengandung ampisilin. Selanjutnya, kultur tersebut diinkubasi di dalam inkubator berpenggoyang pada suhu 37oC dengan kecepatan 200 rpm selama 30 menit. Setelah 30 menit kultur tersebut dihitung OD600.
Apabila telah mencapai ± 0.3, maka
ditambahkan 0.3 M IPTG ke dalam kultur tersebut. Kultur selanjutnya diinkubasi di dalam inkubator berpenggoyang dengan suhu 37oC dengan kecepatan 200 rpm selama 3 jam atau nilai OD600 mencapai ± 1,
kemudian kultur tersebut disentrifugasi pada suhu 4oC dengan kecepatan 7000 g selama 10 menit. Pelet yang diperoleh kemudian diresuspensikan kembali menggunakan 5 mL medium LB cair. Selanjutnya, hasil resuspensi pelet tersebut disentrifugasi kembali pada suhu 4⁰C dengan kecepatan 7000 g selama 10 menit. Pelet yang dihasilkan pada proses sebelumnya diberi perlakuan pengering bekuan ( + 2 " * & sebanyak 3 kali. Hasil + " * tersebut kemudian disonikasi (amplitudo 40; siklus 0.5; waktu 3 x 15 detik; interval waktu 1 menit). Suspensi sel disentrifus dengan kecepatan 12000 g, selama 10 menit, pada suhu 4oC. Pelet kemudian dibuan sedangkan supernatan dikoleksi.
* (' % /% * %+ )* %'()
* &%&%) 0 Supernatan hasil sentrifugasi pada tahap isolasi kemudian dicampur dengan resin TALON yang telah diseimbangkan dengan buffer B. Resin TALON yang sudah diseimbangkan kemudian dicampur dengan supernatan menggunakan pemutar selama 3 jam dalam ruang pendingin (4oC). Setelah itu, disentrifus selama 10 menit dengan kecepaatan 5000 g pada suhu 4oC. Supernatan dibuang kemudian ditambahkan buffer B sebanyak 15 ml, dan disentrifus kembali pada kecepatan 5000 g selama 7 menit. Pelet kemudian ditambahkan bufer elusi dan diinkubasi semalam pada rotator yang ditempatkan pada suhu 4oC. Setelah itu, supernatan diambil dan dipisahkan dari pelet dengan sentrifugasi dengan kecepatan 5000 g selama 3 menit pada suhu 4oC. Supernatan merupakan enzim RNA helikase yang telah dipurifikasi.
1% +&%2%& ) )* * %+ )*
, &
-Pengujian aktivitas RNA helikase dilakukan dengan uji ATPase secara kolorimetri (Utama 2000). Pengujian ini dimaksudkan untuk mengukur jumlah fosfat yang dilepaskan dari hidrolisis senyawa ATP menjadi ADP. Sebanyak 50 µL campuran reaksi yang dimasukkan ke dalam satu sumur mengandung 5 µL 10 mM bufer MOPS (pH 6.5), 1 mM ATP, 0.5 µL 1 mM MgCl, 38.5 µL H2O, dan 5 µL RNA helikase HCV.
6
selama 45 menit. Setelah itu reaksi tersebut divisualisasikan menggunakan pewarnaan dengan cara penambahan 100 µL larutan pewarna pada masing-masing sumur. Larutan pewarna yang digunakan merupakan campuran 0.081% hijau malakit, H20, 5.7%
amonium molibdat dalam 6 M HCl, dan 2.3% polivinil alkohol dengan perbandingan 2:2:1:1. Pewarnaan tersebut diinkubasi selama 5 menit. Setelah masa inkubasi dilakukan penghentian reaksi pewarnaan dengan menambahkan 25 µL natrium sitrat. Hasil reaksi diukur pada panjang gelombang 620 nm dengan referensi 405 nm.
)# )% '#&*% .%3%&#' * %+ )*
, %' 4
&% )% ) % +(3 )% %)# &
0Isolat diinokulasikan sebanyak satu ose ke dalam Erlenmeyer yang berisi medium PDB 25 mL sebagai media prekultur. Selanjutnya, media tersebut diinkubasi pada suhu ruang selama 3 hari dengan bantuan alat berpenggoyang. Setelah 3 hari media tersebut dipindahkan ke dalam media PDB 250 mL sebanyak 2.5 mL. Media produksi tersebut diinkubasi pada suhu ruang selama 10 hari dengan bantuan alat berpenggoyang. Pada rentang masa inkubasi dilakukan pengambilan sampel setiap hari untuk dihitung aktivitas inhibisi terhadap RNA helikase HCV dan produksi protein inhibitor. Sebanyak 5 mL biakan diambil dalam setiap pengambilan sampel. Sampel tersebut selanjutnya disentrifugasi dengan kecepatan 12.000 g selama 10 menit. Filtrat yang diperoleh dipisahkan dari endapan dan digunakan sebagai ekstrak kasar protein inhibitor. Selanjutnya diuji aktivitas inhibitornya terhadap aktivitas ATPase dan kadar proteinnya.
&% )% * !* " '#&*% 0 Supernatan yang merupakan ekstrak kasar dioptimasi fraksinasi proteinnya menggunakan amonium sulfat berdasarkan metode Scope (1987) dengan berbagai tingkatan pengendapan. Supernatan tersebut diendapkan menggunakan amonium sulfat 60%, 70%, 80%, dan 90% (w/v). Pelarutan amonium sulfat dibantu dengan pengaduk dengan kecapatan 20 rpm pada suhu 4⁰C. Hasil pengendapan tersebut disimpan selama 12 jam pada suhu 4⁰C. Selanjutnya dilakukan sentrifugasi terhadap hasil pengendapan menggunakan amonium sulfat tersebut dengan kecepatan 12.000 g selama 30 menit pada 4⁰C. Pelet yang didapatkan kemudian diresuspensikan
kembali menggunakan bufer Tris-HCl pH 7.4. Selanjutnya diuji aktivitasnya menggunakan uji ATPase.
'#"(+)% '#&*% % .%3%&#' " '% %)# & Isolat diinokulasikan sebanyak satu ose ke dalam Erlenmeyer yang berisi media PDB 25 mL sebagai media pre-kultur. Selanjutnya, media tersebut diinkubasi pada suhu ruang selama 3 hari dengan bantuan alat berpenggoyang. Setelah 3 hari, media tersebut dipindahkan ke dalam media produksi PDB 250 mL sebanyak 2.5 mL. Media produksi tersebut diinkubasi pada suhu ruang sesuai dengan hasil optimasi dengan bantuan " $ .
Setelah mencapai masa inkubasi optimum, kultur kapang endofit
disentrifugasi dengan kecepatan 12.000 g selama 30 menit pada suhu 4⁰C. Supernatan dikoleksi, sedangkan peletnya dibuang. Supernatan yang merupakan ekstrak kasar, kemudian proteinnya diendapkan menggunakan amonium sulfat. Sebelum dilakukan pengendapan diuji aktivitas inhibisinya menggunakan uji ATPase.
* !* " '#&*% % .%3%&#'0Tahapan ini dilakukan sesuai dengan hasil optimasi pengendapan protein yang dilakukan sebelumnya Selanjutnya diuji aktivitas inhibisinya menggunakan uji ATPase.
* (' % '#&*% .%3%&#' * %+ )*
, %' 4
-Protein yang telah diendapkan mengunakan amonium sulfat selanjutnya dimurnikan menggunakan kromatografi gel filtrasi. Fase diam yang digunakan adalah Sephadex G-50.
Kolom kromatografi yang sudah dipadatkan dicuci menggunakan ddH2O
sebanyak 1.5 kali volume kolom dengan laju alir 0.5 mL/menit. Setelah itu, sebanyak 1 mL sampel protein inhibitor diinjeksikan ke dalam kolom. Eluen yang digunakan adalah larutan H2O:MeOH (6:4) dengan laju alir sebesar 1
mL/menit. Hasil elusi ditampung dalam tabung vial dengan volume masing-masing 1 mL. Keseluruhan tahapan ini dilakukan di suhu 4oC. masing-masing fraksi diuji aktivitas inhibisinya dengan uji ATPase dan dikarakterisasi proteinnya.
* !(+(' " ' '#&*% .%3%&#'
* %+ )* ,
5-Kadar protein diukur dengan "
' 3BCA) # ' ! $ . Sebanyak 0.1 mL sampel ditambahkan 2 mL * $
7
diinkubasi pada suhu 37ºC selama 30 menit. Absorbansi diukur menggunakan panjang gelombang 562 nm. Standar protein yang digunakan adalah albumin serum sapi (
' (BSA)) pada kisaran 0.05 – 0.5 mg/mL.
%)%) #3#& # *+( '#&*% .%3%&#'
* %+ )* , %' 4
&*' #"%$%+
)%-Analisis bobot molekul protein inhibitor dari berbagai tahap dilakukan dengan metode
( !
(" (SDS-PAGE). Komposisi
( yang digunakan sebesar 18% akrilamid. Gel kemudian dielektroforesis pada 30 mA selama 60 menit dalam bufer elektroforesis (24% gliserol, 8% SDS, 100 mM Tris). Setelah itu, gel tersebut diwarnai dengan pewarnaan perak.
)% )# )% * %+ )*
Bakteri BL21 pET 21b (D3E) pLysS yang telah disisipi oleh gen NS3 RNA helikase HCV dikulturkan pada media LB. Kultur tersebut diinkubasi pada suhu 37oC dan digojok dengan kecepatan 150 rpm. Kultur yang telah memasuki fase logaritmik yaitu setelah mencapai nilai ( ! (OD600)
sebesar 0.3 diinduksi menggunakan IPTG. Penambahan IPTG bertujuan menginduksi pengekspresian gen NS3 yang telah disisipkan, sehingga akan terjadi ekspresi berlebih pada gen tersebut. Tujuan dari penginduksian tersebut yaitu meningkatkan produksi RNA helikase yang ditranslasikan karena ekspresi berlebih terjadi pada gen NS3. Pemanenan kultur dilakukan ketika memasuki fase stasioner dengan nilai OD600
sebesar 1. RNA helikase terekspresi secara intraseluler, sehingga pengisolasiannya dilakukan pengkoleksian terlebih dulu menggunakan teknik sentrifugasi. Sentrifugasi akan memisahkan sel (pelet) dengan medianya (supernatan). Pelet yang telah dikoleksi selanjutnya akan memasuki tahap pemecahan sel untuk mengeluarkan enzim RNA helikase yang terdapat didalam sel.
Pemecahan sel dilakukan sebanyak dua kali, yang pertama menggunakan teknik pengeringbekuan ( + 2 " * ) dan sonikasi. Teknik pengeringbekuan pada sel menyebabkan pembekuan yang cepat pada cairan intraselular dan ekstraselular,
sehingga akan membentuk kristal es pada intraselular dan ekstraselular yang akan menyebabkan kerusakan terhadap sel (Scawen & Meling 1985). Setelah tahap pengeringbekuan, disonikasi terhadap sel tersebut dengan tujuan semua sel tersebut dapat dipecah dan dikoleksi enzimnya.
Pada waktu sonikasi, sel tersebut ditambahkan bufer B (Tween 20, Tris HCl, dan NaCl) yang berfungsi untuk mempertahankan aktivitas RNA helikase HCV. Tris HCl digunakan untuk menjaga keseimbangan pH larutan, agar RNA helikase HCV tidak mengalami denaturasi dan menurun aktivitasnya. Penambahan NaCl pada larutan bufer ini berfungsi menghilangkan asam nukleat dan kontaminan lainnya yang berikatan tidak spesifik dengan RNA helikase HCV dengan cara interaksi ionik (Vanz 2008). Tween 20 digunakan untuk menghancurkan lipid bipolar pada membran sel, sehingga bagian hidrofobik dari enzim RNA helikase yang terikat pada membran sel dapat terdisosiasi. Detergen ini juga dapat melarutkan enzim tersebut di dalam kondisi tidak terdenaturasi dan menjaga kelangsungan aktivitas biologis. Selanjutnya dilakukan sentrifugasi dengan tujuan memisahkan semua bagian sel yang terlarut pada air termasuk RNA helikase dengan pecahan-pecahan sel (Moradpur 2007).
)% * (' % * %+ )*
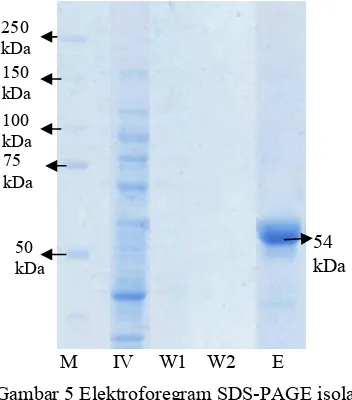
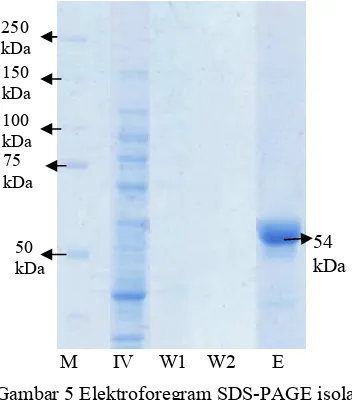
Semua tahapan isolasi dan pemurnian enzim RNA helikase di analisis menggunakan SDS-PAGE untuk menentukan kemurnian dari enzim tersebut. Gambar 5 memperlihatkan enzim RNA helikase yang telah termurnikan memiliki ukuran sebesar 54 kDA (E) (Lampiran 2). Ukuran RNA helikase ini sesuai dengan pemurnian yang telah dilakukan Utama (2000). Lajur
(IV) terdapat banyak pita protein, karena merupakan supernatan hasil sonikasi yang mengandung metabolit intraseluler yang belum dimurnikan. Lajur * " 1 (W1) dan
* " 2 (W2) merupakan bufer hasil pencucian enzim. Kedua lajur tidak terdapat pita protein.
7
diinkubasi pada suhu 37ºC selama 30 menit. Absorbansi diukur menggunakan panjang gelombang 562 nm. Standar protein yang digunakan adalah albumin serum sapi (
' (BSA)) pada kisaran 0.05 – 0.5 mg/mL.
%)%) #3#& # *+( '#&*% .%3%&#'
* %+ )* , %' 4
&*' #"%$%+
)%-Analisis bobot molekul protein inhibitor dari berbagai tahap dilakukan dengan metode
( !
(" (SDS-PAGE). Komposisi
( yang digunakan sebesar 18% akrilamid. Gel kemudian dielektroforesis pada 30 mA selama 60 menit dalam bufer elektroforesis (24% gliserol, 8% SDS, 100 mM Tris). Setelah itu, gel tersebut diwarnai dengan pewarnaan perak.
)% )# )% * %+ )*
Bakteri BL21 pET 21b (D3E) pLysS yang telah disisipi oleh gen NS3 RNA helikase HCV dikulturkan pada media LB. Kultur tersebut diinkubasi pada suhu 37oC dan digojok dengan kecepatan 150 rpm. Kultur yang telah memasuki fase logaritmik yaitu setelah mencapai nilai ( ! (OD600)
sebesar 0.3 diinduksi menggunakan IPTG. Penambahan IPTG bertujuan menginduksi pengekspresian gen NS3 yang telah disisipkan, sehingga akan terjadi ekspresi berlebih pada gen tersebut. Tujuan dari penginduksian tersebut yaitu meningkatkan produksi RNA helikase yang ditranslasikan karena ekspresi berlebih terjadi pada gen NS3. Pemanenan kultur dilakukan ketika memasuki fase stasioner dengan nilai OD600
sebesar 1. RNA helikase terekspresi secara intraseluler, sehingga pengisolasiannya dilakukan pengkoleksian terlebih dulu menggunakan teknik sentrifugasi. Sentrifugasi akan memisahkan sel (pelet) dengan medianya (supernatan). Pelet yang telah dikoleksi selanjutnya akan memasuki tahap pemecahan sel untuk mengeluarkan enzim RNA helikase yang terdapat didalam sel.
Pemecahan sel dilakukan sebanyak dua kali, yang pertama menggunakan teknik pengeringbekuan ( + 2 " * ) dan sonikasi. Teknik pengeringbekuan pada sel menyebabkan pembekuan yang cepat pada cairan intraselular dan ekstraselular,
sehingga akan membentuk kristal es pada intraselular dan ekstraselular yang akan menyebabkan kerusakan terhadap sel (Scawen & Meling 1985). Setelah tahap pengeringbekuan, disonikasi terhadap sel tersebut dengan tujuan semua sel tersebut dapat dipecah dan dikoleksi enzimnya.
Pada waktu sonikasi, sel tersebut ditambahkan bufer B (Tween 20, Tris HCl, dan NaCl) yang berfungsi untuk mempertahankan aktivitas RNA helikase HCV. Tris HCl digunakan untuk menjaga keseimbangan pH larutan, agar RNA helikase HCV tidak mengalami denaturasi dan menurun aktivitasnya. Penambahan NaCl pada larutan bufer ini berfungsi menghilangkan asam nukleat dan kontaminan lainnya yang berikatan tidak spesifik dengan RNA helikase HCV dengan cara interaksi ionik (Vanz 2008). Tween 20 digunakan untuk menghancurkan lipid bipolar pada membran sel, sehingga bagian hidrofobik dari enzim RNA helikase yang terikat pada membran sel dapat terdisosiasi. Detergen ini juga dapat melarutkan enzim tersebut di dalam kondisi tidak terdenaturasi dan menjaga kelangsungan aktivitas biologis. Selanjutnya dilakukan sentrifugasi dengan tujuan memisahkan semua bagian sel yang terlarut pada air termasuk RNA helikase dengan pecahan-pecahan sel (Moradpur 2007).
)% * (' % * %+ )*
Semua tahapan isolasi dan pemurnian enzim RNA helikase di analisis menggunakan SDS-PAGE untuk menentukan kemurnian dari enzim tersebut. Gambar 5 memperlihatkan enzim RNA helikase yang telah termurnikan memiliki ukuran sebesar 54 kDA (E) (Lampiran 2). Ukuran RNA helikase ini sesuai dengan pemurnian yang telah dilakukan Utama (2000). Lajur
(IV) terdapat banyak pita protein, karena merupakan supernatan hasil sonikasi yang mengandung metabolit intraseluler yang belum dimurnikan. Lajur * " 1 (W1) dan
* " 2 (W2) merupakan bufer hasil pencucian enzim. Kedua lajur tidak terdapat pita protein.
8
dilakukan oleh logam Co2+ yang terdapat dalam resin TALON. Penandaan yang terdapat pada enzim RNA helikase yaitu ujung His dilakukan pada saat konstruksi gen NS3 yang disisipkan pada . Setelah enzim tersebut terikat pada resin TALON, kemudian dipisahkan dengan protein lainnya dengan cara sentrifugasi. RNA helikase yang terikat pada resin akan terdapat pada bagian pelet, sedangkan protein lainnya terpisahkan pada bagian supernatan. Tahapan selanjutnya yaitu memutus ikatan antara resin TALON dan ujung His.
Pemutusan ini dilakukan dengan cara menambahkan bufer elusi pada resin yang telah mengikat enzim. Bufer elusi mengandung imidazol dan bufer B. Imidazol berfungsi sebagai analog pengganti residu His enzim yang diikat oleh logam Co2+, sehingga resin tersebut akan memutus ikatannya dengan enzim RNA helikse dan mengikat imidazol sebagai penggantinya. Teknik sentrifugasi digunakan untuk memisahkan resin yang mengikat imidazol dan enzim yang telah murni. Sentrifugasi pada kecepatan rendah bertujuan mengurangi kerusakan yang terjadi pada enzim.
Gambar 5 Elektroforegram SDS-PAGE isolasi dan pemurnian RNA helikase HCV; (M) $ ; (IV)
; (W1) Hasil * " 1; (W2) Hasil * " 4; (E) Enzim
+&( * * '#&*% .%3%&#' " '% ! "#$%&
solat kapang merupakan kapang endofit yang berasal dari gembyok (temu putih atau + ). Isolat ini ditumbuhkan pada media # /
" (PDB). Pertumbuhan kapang ini pada media PDB dapat terlihat pada kekeruhan
yang terjadi pada media tersebut yang tadinya berwarna kuning jernih menjadi kuning keruh. Media PDB merupakan media yang telah memenuhi syarat minimum pertumbuhan kapang, karena memiliki sumber karbon yang berasal dari dekstrosa dan pati kentang serta sumber nitrogen yang berasal dari asam amino yang terdapat pada kentang (Hadioetomo 1993).
Pertumbuhan dari kapang juga dipengaruhi oleh masa inkubasi dan agitasi. Masa inkubasi yang dibutuhkan oleh isolat ini untuk menghasilkan protein inhibitor RNA helikase HCV optimum pada 7 hari. Hal ini ditentukan berdasarkan perhitungan inhibisi protein tersebut terhadap RNA helikase HCV setiap hari selama masa inkubasi. Masa inkubasi 7 hari merupakan masa inkubasi yang paling optimum yang dibutuhkan oleh kapang isolat ini untuk memproduksi protein tersebut dengan nilai inhibisi sebesar 85.86% (Gambar 6). Agitasi bertujuan meningkatkan aerasi dan distribusi nutrisi sehingga sel kapang dapat mencapai kondisi yang optimum (Rahman 2009).
Pemanenan protein inhibitor RNA helikase HCV yang dihasilkan oleh kapang dengan teknik sentrifugasi untuk memisahkan protein tersebut dengan sel kapangnya. Supernatan selanjutnya digunakan untuk proses isolasi protein yang mempunyai aktivitas inhibisi terhadap RNA helikase HCV.
Gambar 6 Aktivitas inhibisi RNA helikase HCV pada berbagai waktu inkubasi kapang endofit
.
)# & '#&*% .%3%&#' * %+ )*
Tahap isolasi protein dari fraksi supernatan diendapkan menggunakan amonium sulfat. Pengendapan protein M IV W1 W2 E
250 kDa 150 kDa
75 kDa 100 kDa
50 kDa
9
menggunakan amonium sulfat merupakan teknik yang dapat memenuhi dua tujuan sekaligus yaitu pemurnian dan pengendapan protein yang spesifik. Penggunaan amonium sulfat umum digunakan dalam proses pengendapan ini karena memiliki beberapa kelebihan yaitu memiliki kelarutan yang tinggi, tingkat toksisitas yang rendah untuk sebagian besar protein, murah, dan pada beberapa kondisi memiliki efek penstabil pada protein. Protein akan terendapkan karena molekul air yang berikatan dengan ion-ion garam semakin banyak. Hal ini menyebabkan terjadinya penarikan selubung air yang mengelilingi permukaan protein sehingga mengakibatkan protein saling berinteraksi dan beragregasi (Scawen & Melling 1985).
Pengendapan protein target yang terdapat pada fraksi supernatan dilakukan pada konsentrasi amonium sulfat 90% (w/v). Hasil pengendapan pada konsentrasi ini memilki aktivitas inhibisi terhadap RNA helikase HCV paling tinggi dibandingkan dengan hasil pengendapan amonium sulfat dengan konsentrasi yang lainnya yaitu sebesar 89.24% (Gambar 7). Perbedaan aktivitas inhibisi yang diperlihatkan oleh beberapa hasil pengendapan protein dimungkinkan karena protein yang terendapkan pada berbagai konsentrasi pengendapan tersebut berbeda. Karena protein yang terendapkan akan mengalami fase pengendapan yang berbeda-beda sesuai dengan titik isolistriknya. Titik isolistrik ini tercapai karena kekuatan ionik yang terdapat pada garam dan garam dengan nilai valensi yang tinggi memiliki kemampuan yang lebih besar dalam mengendapkan dibandingkan dengan garam yang memiliki nilai valensi yang rendah (Scawen & Meling 1985).
Gambar 7 Aktivitas inhibisi RNA helikase HCV pada beberapa tingkatan pengendapan amonium sulfat.
Protein yang terendapkan menggunakan amonium sulfat dilarutkan kembali menggunakan larutan bufer Tris HCl pH 7.4 (Hairany 2010). Penggunaan bufer fosfat tidak dapat dilakukan karena dapat mempengaruhi hasil perhitungan aktivitas inhibisi RNA helikase HCV, karena menggunakan uji ATPase yang menghitung fosfat anorganik yang bebas.
)% * (' % '#&*% .%3%&#' " '% !
Pemurnian protein inhibitor RNA helikase HCV dari kapang endofit
dilakukan dengan kromatografi gel filtrasi. Kromatografi gel filtrasi merupakan teknik pemisahan campuran senyawa berdasarkan bobot molekulnya. Ukuran yang dapat dipisahkan fase diam tergantung pada poros matriksnya. Fase diam yang digunakan yaitu Sephadex G-50 dengan kemampuan memisahkan molekul protein sampai 30 kDa. Fase gerak yang digunakan yaitu metanol 40%. Hasil dari pemisahan protein menggunakan kolom kromatografi gel filtrasi didapatkan fraksi sebanyak 28 fraksi. Semua fraksi yang didapatkan selanjutnya diuji aktivitas inhibisinya dengan uji ATPase.
Uji ATPase merupakan metode yang digunakan untuk menghitung pelepasan fosfat anorganik yang berasal dari ATP dengan bantuan enzim ATPase. Penggunaan uji ATPase pada penentuan aktivitas dari enzim RNA helikase HCV karena enzim ini memiliki aktivitas yang distimulasi oleh ATP. Larutan campuran dan larutan pewarna digunakan dalam uji ATPase. Larutan campuran terdiri atas asam 4-morfolinopropanafosfat sulfonat (MOPS), ATP, dan MgCl2. MOPS berfungsi sebagai
bufer dalam larutan campuran. ATP berfungsi sebagai substrat yang akan dihidrolisis oleh enzim RNA helikase HCV menjadi ADP dan fosfat anorganik bebas (Pi). Selanjutnya yang terakhir yaitu Mg2+ berfungsi sebagai kofaktor dari RNA helikase HCV. Kuo (1997) menyebutkan bahwa RNA helikase dari golongan flavivirus memerlukan Mg2+ atau Mn2+ untuk mengoptimalkan aktivitasnya dan diinbihisi oleh keberadaan K+.
10
sebagai pencegah terbentuknya endapan akibat reaksi protein dengan kompleks fosfomolibdat (Chan 1986).
Penghentian reaksi warna dengan penambahan Na-sitrat terhadap campuran. Hal ini dilakukan karena sitrat dapat berikatan dengan molibdat yang bebas, sehingga mencegah proses pembentukan warna yang berlebihan. Molibdat bebas tersebut dapat berikatan dengan ATP labil yang dapat terhidrolisis selama proses uji berlangsung. Penambahan sitrat tersebut dapat mempertahankan warna secara stabil sampai enam jam (Gawronski dan Benson 2004).
Berdasarkan hasil uji ATPase didapatkan bahwa fraksi ke-8 mempunyai aktivitas inhibisi RNA helikase HCV tertinggi sebesar 64.11% (Gambar 8). Kenaikan aktivitas inhibisi terhadap RNA helikase HCV terjadi pada fraksi-fraksi awal. Hal ini menunjukkan bahwa protein yang memiliki bobot molekul tinggi yang memiliki aktivitas inhibisi terhadap RNA helikase HCV. Protein inhibitor tersebut diperkirakan menghambat RNA helikase secara alosterik. Inhibitor menempel pada enzim selain di situs katalitiknya sehingga merubah konfromasi enzim. Perubahan tersebut menyebabkan interaksi enzim-substrat berkurang sehingga tidak ada produk yang dihasilkan (Boroswki
2008).
Gambar 8 Aktivitas inhibisi RNA helikase HCV fraksi hasil kromatografi gel filtrasi.
#3#& # *+( '#&*% .%3%&#' * %+ )*
Penentuan bobot molekul protein penghambat RNA helikase HCV yang berasal dari kapang endofit dilakukan dengan metode SDS-PAGE. Konsentrasi media penyangga yang digunakan bergantung pada bobot molekul campuran protein yang akan dipisahkan. Penggunaan konsentrasi gel sebesar 20% pada penelitian ini dikarenakan
dugaan protein yang akan dipisahkan memiliki kisaran yang lebih rendah dari 3 kDa.
Fraksi terbaik hasil kolom kromatografi ini yaitu fraksi ke- 8 setelah dianalisis menggunakan teknik SDS-PAGE memilki empat pita protein (Gambar 9). Semua pita tersebut menunjukkan bahwa molekul protein yang terdapat pada fraksi ke-8 memiliki bobot diatas 17 kDa. Hal ini dimungkinkan karena pada fraksi-fraksi awal yang terpisahkan merupakan molekul yang memiliki bobot molekul besar. Bobot molekul relatif (Lampiran 3) dari keempat pita protein berturut turut yaitu 47.2 kDa, 31.9 kDa, 25.4 kDa, dan 20.2 kDa untuk pita protein 1, 2, 3, dan 4.
Hasil analisis pada fraksi ke- 8 memiliki kesamaan pita pada analisis hasil pengendapan amonium sulfat. Jumlah pita protein yang lebih sedikit dibandingkan dengan hasil pengendapan amonium sulfat. Hal ini menunjukkan bahwa kromatografi gel filtrasi memperkecil jumlah molekul protein dari hasil pengendapan amonium sulfat. Pewarna perak memiliki sensitivitas yang lebih baik dibandingkan dengan pewarna (Rozaida 2003). Konsentrasi protein yang kemungkinan rendah setelah proses pemurnian menggunakan kromatogarafi kolom, dengan metode pewarnaan ini masih bisa dilihat secara jelas.
Gambar 9 Elektroforegram protein
; (M) $ ; (Cr) pengendapan amonium sulfat; (F8) Fraksi ke-8 hasil pemurnian; (1, 2, 3, dan 4) pita-pita protein pada fraksi ke-8 kolom kromatografi.
1 42 kDa
26 kDa
17 kDa
10 kDa
4.6 kDa
2
3
11
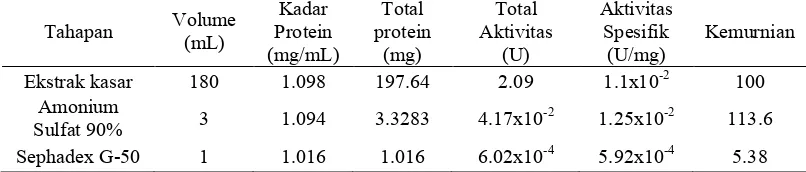
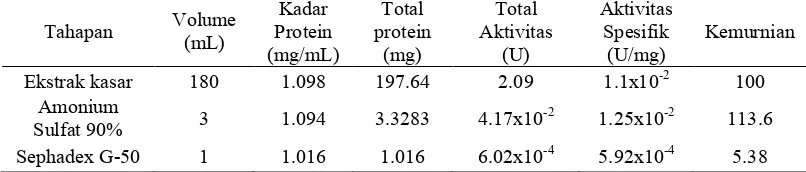
Tabel 3 Kadar dan aktivitas spesifik protein inhibitor RNA helikase HCV dari kapang endofit
Tahapan Volume (mL) Kadar Protein (mg/mL) Total protein (mg) Total Aktivitas (U) Aktivitas Spesifik (U/mg) Kemurnian
Ekstrak kasar 180 1.098 197.64 2.09 1.1x10-2 100
Amonium
Sulfat 90% 3 1.094 3.3283 4.17x10
-2
1.25x10-2 113.6 Sephadex G-50 1 1.016 1.016 6.02x10-4 5.92x10-4 5.38
# )* &' )% '#&*% .%3%&#'
* %+ )* 0
Konsentrasi protein tiap tahapan pada penelitian ini ditentukan dengan uji
" ' (BCA) ( $ !.
Prinsip uji ini yaitu pereduksian Cu2+menjadi Cu+ oleh protein pada media alkalin (reaksi biuret). Kation cupro yang terbentuk akan bereaksi dengan asam bicinchoninat membentuk warna ungu yang dapat dideteksi pada panjang gelombang 562 nm. Uji ini dapat mendeteksi konsentrasi protein antara 20-2000 µg/mL (PIERCE 2003).
Tabel 3 memperlihatkan aktivitas spesifik dari protein inhibitor pada beberapa tahapan isolasi dan pemurnian yang dilakukan. Unit pada aktivitas protein inhobitor didefinisikan sebagai jumlah aktivitas protein yang dibutuhkan untuk menghambat 1 mol substrat menjadi produk. Protein yang telah diendapkan dengan amonium sulfat 90% memiliki aktivitas yang tidak berbeda jauh dalam menghambat aktivitas RNA helikase HCV dibandingkan dengan ekstrak kasarnya yaitu sebesar 1.25x10-2 U/mg dengan tingkat kemurnian sebesar 113.6. Hal ini dikarenakan amonium sulfat tidak hanya mengendapkan protein yang memiliki aktivitas penghambatan RNA helikase HCV melainkan juga beberapa protein lainnya yang terdapat pada ekstrak kasar.
Aktivitas spesifik dari protein inhibitor hasil pemurnian menggunakan kromatografi gel filtrasi Sephadex G-50 lebih kecil dibandingkan dengan aktivitas ekstrak kasarnya sebesar 5.92x10-4 U/mg dan memilki kemurnian sebesar 5.38. Nilai aktivitas dan kemurnian yang kecil dari hasil kromatografi kolom dimungkinkan protein yang didapatkan dalam konsentrasi yang kecil, sebab sebelum dimasukkan pada kolom kromatografi proteinnya tidak dipekatkan terlebih dahulu (Udin 1996). Selain itu, diperkirakan terjadi autolisis pada protein saat proses pemurnian terjadi (Scopes 1987). Proses autolisis yang terjadi disebabkan oleh suhu saat pemurnian dilakukan tidak stabil.
% (
RNA helikase HCV yang telah dimurnikan memilki ukuran 54 kDa. Protein inhibitor yang telah dimurnikan menggunakna kromatografi gel filtrasi dari kapang
dapat menginhibisi RNA helikase dengan aktivitas inhibisi sebesar 64.11%. Protein tersebut dipanen setelah masa inkubasi 7 dan diisolasi dengan ammonium sulfat 90% w/v. Protein inhibitor tersebut mempunyai memiliki empat pita, dengan bobot 47.2 kDa, 31.9 kDa, 25.4 kDa, dan 20.2 kDa. Aktivitas protein sebagai inhibitor dari setiap tahapan yaitu ekstrak kasar, hasil pengendapan amonium sulfat, dan hasil pemurnian berturut-turut sebesar 1.1x10-2 U/mg, 1.25x10-2 U/mg, dan 5.92x10-4 U/mg. Kemurnian setiap tahapan berturut-turut sebesar 100, 113.6, dan 5.38.
'
Pemurnian lanjutan terhadap protein inhibitor RNA helikase yang dihasilkan oleh kapang
endofit perlu dilakukan.
Pemurnian lanjutan tersebut bisa dengan teknik KCKT preparatif dan kromatografi pertukaran ion. Karakterisasi dan optimasi terhadap protein inhibitor perlu juga dilakukan. Karakterisasi meliputi pengaruh pH, suhu, dan suhu penyimpanan protein terhadap aktivitas inhibisinya. Optimasi juga perlu dilakukan untuk meningkatkan aktivitas inhibisi dari protein inhibitor tersebut.
Anonim. 2010. Column Chromatography. [terhubung berkala]. Http://www. Newarkbioweb. Rutgers. Edu/bio301s/ Lab4-molwt-column chromatography.htm. [26 Desember 2010].
Bacon CW, White JW. 2000.
11
Tabel 3 Kadar dan aktivitas spesifik protein inhibitor RNA helikase HCV dari kapang endofit
Tahapan Volume (mL) Kadar Protein (mg/mL) Total protein (mg) Total Aktivitas (U) Aktivitas Spesifik (U/mg) Kemurnian
Ekstrak kasar 180 1.098 197.64 2.09 1.1x10-2 100
Amonium
Sulfat 90% 3 1.094 3.3283 4.17x10
-2
1.25x10-2 113.6 Sephadex G-50 1 1.016 1.016 6.02x10-4 5.92x10-4 5.38
# )* &' )% '#&*% .%3%&#'
* %+ )* 0
Konsentrasi protein tiap tahapan pada penelitian ini ditentukan dengan uji
" ' (BCA) ( $ !.
Prinsip uji ini yaitu pereduksian Cu2+menjadi Cu+ oleh protein pada media alkalin (reaksi biuret). Kation cupro yang terbentuk akan bereaksi dengan asam bicinchoninat membentuk warna ungu yang dapat dideteksi pada panjang gelombang 562 nm. Uji ini dapat mendeteksi konsentrasi protein antara 20-2000 µg/mL (PIERCE 2003).
Tabel 3 memperlihatkan aktivitas spesifik dari protein inhibitor pada beberapa tahapan isolasi dan pemurnian yang dilakukan. Unit pada aktivitas protein inhobitor didefinisikan sebagai jumlah aktivitas protein yang dibutuhkan untuk menghambat 1 mol substrat menjadi produk. Protein yang telah diendapkan dengan amonium sulfat 90% memiliki aktivitas yang tidak berbeda jauh dalam menghambat aktivitas RNA helikase HCV dibandingkan dengan ekstrak kasarnya yaitu sebesar 1.25x10-2 U/mg dengan tingkat kemurnian sebesar 113.6. Hal ini dikarenakan amonium sulfat tidak hanya mengendapkan protein yang memiliki aktivitas penghambatan RNA helikase HCV melainkan juga beberapa protein lainnya yang terdapat pada ekstrak kasar.
Aktivitas spesifik dari protein inhibitor hasil pemurnian menggunakan kromatografi gel filtrasi Sephadex G-50 lebih kecil dibandingkan dengan aktivitas ekstrak kasarnya sebesar 5.92x10-4 U/mg dan memilki kemurnian sebesar 5.38. Nilai aktivitas dan kemurnian yang kecil dari hasil kromatografi kolom dimungkinkan protein yang didapatkan dalam konsentrasi yang kecil, sebab sebelum dimasukkan pada kolom kromatografi proteinnya tidak dipekatkan terlebih dahulu (Udin 1996). Selain itu, diperkirakan terjadi autolisis pada protein saat proses pemurnian terjadi (Scopes 1987). Proses autolisis yang terjadi disebabkan oleh suhu saat pemurnian dilakukan tidak stabil.
% (
RNA helikase HCV yang telah dimurnikan memilki ukuran 54 kDa. Protein inhibitor yang telah dimurnikan menggunakna kromatografi gel filtrasi dari kapang
dapat menginhibisi RNA helikase dengan aktivitas inhibisi sebesar 64.11%. Protein tersebut dipanen setelah masa inkubasi 7 dan diisolasi dengan ammonium sulfat 90% w/v. Protein inhibitor tersebut mempunyai memiliki empat pita, dengan bobot 47.2 kDa, 31.9 kDa, 25.4 kDa, dan 20.2 kDa. Aktivitas protein sebagai inhibitor dari setiap tahapan yaitu ekstrak kasar, hasil pengendapan amonium sulfat, dan hasil pemurnian berturut-turut sebesar 1.1x10-2 U/mg, 1.25x10-2 U/mg, dan 5.92x10-4 U/mg. Kemurnian setiap tahapan berturut-turut sebesar 100, 113.6, dan 5.38.
'
Pemurnian lanjutan terhadap protein inhibitor RNA helikase yang dihasilkan oleh kapang
endofit perlu dilakukan.
Pemurnian lanjutan tersebut bisa dengan teknik KCKT preparatif dan kromatografi pertukaran ion. Karakterisasi dan optimasi terhadap protein inhibitor perlu juga dilakukan. Karakterisasi meliputi pengaruh pH, suhu, dan suhu penyimpanan protein terhadap aktivitas inhibisinya. Optimasi juga perlu dilakukan untuk meningkatkan aktivitas inhibisi dari protein inhibitor tersebut.
Anonim. 2010. Column Chromatography. [terhubung berkala]. Http://www. Newarkbioweb. Rutgers. Edu/bio301s/ Lab4-molwt-column chromatography.htm. [26 Desember 2010].
Bacon CW, White JW. 2000.
12
Borowski P 2008. Viral NS3 helicase activity is inhibited by peptides reproducing the Arg-rich conserved motif of the enzyme (motif VI). "
#" ! 76: 28–38.
Caprette DR. 2005. Preparing SDS-Gels. Experimental Biosciences. Introductory Laboratory-Bios 211. Texas: Rice University.
Chan Kwok Ming, Delfert D, Junger KD. 1986. A direct colorimetricc assay for Ca2+-stimulated ATPase activity. '
" 157: 375-380.
Cheng 2007. NS3 helicase actively separates RNA strands and senses sequence barriers ahead of the opening fork. #,' 104: 13954–13959.
Chungsamarnyart N, Sirinarumitr T, chumsing W, Wajjawalku W. 2007. in vitro study of antiviral activity of plant crude extract againts the foot and mouth
disesease virus. 5
3, & 41: 97-103.
Fardiaz S. 1992. $ ( 6.
Jakarta: Gramedia Pustaka Utama.
Gawronski JD, Benson DR. 2004. Microtiter assay for glutamin synthetase biosynthetic activity using inorganic phosphate detection. ' " 327: 114-118.
Girindra A. 1993. 6 $ . Bogor: PAU-IPB.
Hagel L. 1998. # #
New York: John Willey & Sons Inc.
Hadioetomo RS. 1993. $
# $ $. Jakarta: Gramedia Pustaka Utama.
Hairany A. 2010. Pemurnian dan karakterisasi protein inhibitor RNA helikase virus hepatitis C dari ( ! "
.70 [tesis]. Bogor: Pascasarjana IPB.
Harvey D. 2000. ' !
" !. Ed ke-1. New York: McGraw Hill.
Kadare G, Haenni A. 1997. Virus encoded RNA helicases. 5 ) ! 71: 2583-2590.
Kandil S 2009. Discovery of a novel HCV helicase inhibitor by a de novo drug design approach. 2
" ! 8 19: 2935–2937
Kuo . 1997. Characterization of the NTPase activity of japanese enchephalitis virus NS3 protein.5 % ) . 77: 2077-2084.
Laemmli UK. 1970. Cleavage of stuctural proteins during the assembly of the head of bacteriophage T4. , 227: 680-685.
Lauer GM, Walker BD. 2001. Review article: hepatitis c virus infection. , 5 1: 41-50.
Maksum R. 2005. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal 5 962: 113-126.
McHutchison JG, Patel K. 2002. Future therapy of hepatisis C. ( ! 36: 245-252.
Megawati. 2008. Penapisan senyawa inhibitor RNA helikase virus hepatitis C dari isolat kapang endofit spp. [skripsi]. Jakarta: Fakultas Framasi, Universitas Pancasila.
Moradpour D, Penin F, Rice CM. 2007. Replication of hepatitis C virus. ,
5:453–463.
PIERCE. 2003. 6 ' #
' ! . Rockford: Pierce Biotechnology Inc.
Promega. 2003. , ' # .
Wisconsin: VWR International Inc.
Qiagen. 2006. , ! # $.
Shanghai: F. Hoffman-La Roche Ltd.
Rahman MN. 2009. Aktivitas senyawa antibakteri hasil biotransformasi kurkumin oleh mikrob endofit asal kunyit [skripsi]. Bogor: FMIPA IPB.
Rozaida 2003. An attempt to produce Brugia Malayi L3 Antigen Fractions for studies on antibody responses in JIRD (Meriones unguiculatus). Di dalam :
( ! $ : $ ( $ 477;;
Kuala Lumpur , 12-13 Maret 2003. Kuala Lumpur: 1-5.
Rybicki EP . 1996. !
" < . Ed ke-3. Rondebosch:
University of Capetown.
Sambrook J, Russel DW. 2001.
= ! ) ; Ed
13
Scawen MD, Melling J. 1985. $
+! " !. Alan Wiseman,
editor. West Sussex: Ellis Horword Ltd.
Schutz . 2002. Endophytic fungi: a source of novel biologically active secondary metabolites. 5 ! 106: 996-1004.
Scopes RK. 1987. # (
-( ( - ( . Ed ke-2.. New York: Springer Verlag.
Strobel G, Daisy B. 2003. Bioprospecting for microbial endophytes and their natural
products. !
! * 67: 491-502.
Suzuki et al. 2007. Review: molecular biology of hepatitis C virus. 5 % 42: 411-423.
Sy T, Jamal MM. 2006. Reviews: Epidemiology of hepatitis C virus (HCV) Infection. 6 5 3:41-46.
Tellinghuisen TL 2001. Sudying hepatitis C virus: making the best of a bad virus. 5 ) ! 81: 8853-8867.
Udin . 1996. Isolasi dan karakterisasi glukosa isomerase ' ( !+ .
6# 4:36-40.
Utama A 2000. Identifcation and characterization of the RNA helicase activity of japanese enchepalitis virus NS3 protein. 8 456: 74-78.
Vanz . 2008. Human granulocyte colony stimulating factor (hG-CSF): Cloning, overexpression, purification, and
characterization. .
7:13.
Wilson K, Walker JM. 1994. # (
" < # " ! Ed
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Judul : Isolasi dan Pemurnian Protein Inhibitor RNA Helikase Virus Hepatitis C
dari Kapang Endofit
Nama : Ervian Hadi Ramdani
NIM : G84062350
Disetujui
Komisi Pembimbing
Ir.Eman Kustaman
A.Zaenal Mustopa, M.Si
Ketua
Anggota
Diketahui
Dr. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
ERVIAN HADI RAMDANI. Isolasi dan Pemurnian Protein Inhibitor RNA
Helikase Virus Hepatitis C dari Kapang Endofit
. Dibimbing oleh
EMAN KUSTAMAN dan A. ZAENAL MUSTOPA.
ERVIAN HADI RAMDANI. Isolation and Purification Protein Inhibitor of RNA
Helicase Hepatitis C Virus from Endophytic Fungi
. Under the
direction of EMAN KUSTAMAN and A. ZAENAL MUSTOPA.
Puji dan syukur penulis panjatkan kepada Allah SWT, yang telah melimpahkan
karunia-Nya sehingga usulan penelitian ini dapat terselesaikan dengan
sebaik-baiknya. Penelitian ini berjudul Isolasi dan Pemurnian Protein Inhibitor RNA
Helikase Virus Hepatitis C Dari Kapang Endofit
Penelitian ini
dilakukan di Laboratorium Bakteriologi dan Virologi molekuler, Puslit
Bioteknologi LIPI Cibinong.
Penulis menyampaikan terima kasih kepada Bapak Eman Kustaman selaku
ketua pembimbing, Bapak A. Zaenal Mustopa selaku anggota pembimbing, Ibu
Laksmi Ambarsari, Bapak I Made Artika, dan Ibu Titik K. Prana yang telah
memberi izin penggunaan isolat kapang endofit
. Ucapan terima kasih
juga penulis sampaikan kepada bapak, mamah, adikku Anis, Mbah, Umi, Pak
Idun, Mak Idun, Prabawati Hyunita Putri dan semua keluarga yang telah
memberikan bantuan dan doa selama ini. Tidak lupa penulis mengucapkan terima
kasih kepada staf laboratorium (Mas Ridwan, Mas Erik, dan Mas Kukun),
teman-teman di laboratorium (Mas Melki, Soleh, Skotia, Tya, Ika, dan Marcel),
Biokimia 43 (Adju, Tiwi, Nestri, Taufiq, Herdit, Mike, Danang, Umul, Haya, dan
Himajaman), dan D’Sabars (Diki, Dedi, Soleh, Imam, dan Rido) atas bantuannya
selama ini.
Akhir kata, penulis mengharapkan kritik dan saran yang membangun atas
ketidaksempurnaan dari skripsi ini sehingga tulisan ini dapat berguna bagi penulis
sendiri maupun semua pihak yang membutuhkan demi kemajuan ilmu
pengetahuan.
Ervian Hadi Ramdani dilahirkan di Sukabumi pada tanggal 11 April 1989 dari
ayah Karna Sukarna dan ibu E. Nurhasanah. Penulis merupakan anak pertama dari
dua bersaudara.
Penulis menyelesaikan sekolah menengah atas di SMA Negeri I Cibadak
Kabupaten Sukabumi pada tahun 2006. Pada tahun yang sama, penulis diterima di
Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Tahun 2007 penulis diterima sebagai mahasiswa Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum mata
kuliah Biokimia Umum dan mata kuliah Struktur dan Fungsi Biomolekul pada
tahun yang 2009/2010. Penulis melakukan praktek kerja lapang di Laboratorium
Biologi Sel dan Jaringan Hewan, Pusat Penelitian Bioteknologi LIPI dari bulan
Juli sampai Agustus 2009 dengan judul laporan praktek lapang, yaitu Pengaruh
Penambahan
(FBS) Pada Media
(DMEM) Terhadap Pertumbuhan Sel Cumulus Mencit (
musculus). Pada tahun 2008/2009 dan 2009/2010 penulis aktif di Himpunan
Profesi (Himpro) CREBs (
!
"
"
!
ii
DAFTAR GAMBAR ... ii
DAFTAR TABEL ... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Kapang Endofit ... 2
Virus Hepatitis C ... 2
RNA Helikase ... 3
SDS-PAGE (
#
$
%
$
&
... 3
Kromatografi Gel Filtrasi ... 4
BAHAN DAN METODE PERCOBAAN
Bahan dan Alat ... 4
Metode ... 5
HASIL DAN PEMBAHASAN
Hasil Isolasi RNA Helikase HCV ... 7
Hasil Pemurnian RNA Helikase ... 7
Waktu Pemanenan Protein Inhibitor dari
... 8
Isolat Protein Inhibitor dari Kapang Endofit
8
Hasil Pemurnian Protein Inhibitor dari Kapang Endofit
... 9
Bobot Molekul Protein Inhibitor RNA helikase HCV
10
Konsentrasi Protein Inhibitor RNA Helikase HCV
10
SIMPULAN DAN SARAN
iii
1 Kapang endofit
... 2
2 Struktur virus hepaitis C ... 3
3 Mekanisme RNA heilkase ... 3
4 Kromatografi gel filtrasi ... 4
5 Elektroforegram SDS-PAGE RNA helikase hepatitis C. ... 8
6 Aktivitas inhibisi RNA helikase HCV terhadap waktu inkubasi ... 8
7 Aktivitas inhibisi RNA helikase RNA helikase HCV pada beberapa
tingkatan pengendapan amonium sulfat ... 9
8 Aktivitas inhibisi RNA helikase HCV fraski hasil kromatografi gel filtasi .. 10
9 Elektroforegram SDS-PAGE protein
... 10
1 Variasi konsentrasi gel berdasarkan bobot protein ... 4
2 Ukuran protein minimum yang dapat dipisahkan oleh matriks gel ... 4
3 Kadar dan aktivitas spesifik protein inhibitor RNA helikase HCV dari
kapang
... 11
1 Diagram alir penelitian ... 15
2 . Bobot molekul relatif enzim RNA helikase HCV ... 17
3 Bobot molekul relatif protein kapang
18
4 Kurva standar
'
(BSA) ... 19
5 Kurva standard fosfat (Uji ATPase) ... 20
6 Nilai inihibisi RNA helikase HCV optimasi pemanenan kultur kapang
pengendapan amonium sulfat ... 21
7 Nilai inihibisi RNA helikase HCV dari optimasi pengendapan amonium
1
Hepatitis C merupakan penyakit yang disebabkan oleh virus hepatitis C ( (
) atau HCV). Virus hepatitis C memiliki satu untai positif RNA, berpelindung, dan berbentuk bola dengan diameter 50-60 nm (Borowski 2008). Virus ini memiliki tingkat virulensi yang tinggi. Sebanyak 180 juta jiwa penderita di seluruh dunia mengidap penyakit ini dan bertambah setiap tahunnya. Penularan penyakit ini umumnya terjadi melalui transfusi darah atau jarum suntik yang tercemar darah yang mengandung HCV (Kandil 2009).
Saat ini pengobatan yang diberikan kepada penderita penyakit hepatitis C yaitu terapi interferon-alfa, ribavirin, dan kombinasi keduanya. Namun, pengobatan ini memiliki beberapa kelemahan, yaitu mahal dan memiliki efek samping. Efek samping yang dapat terjadi akibat penggunaan ribavirin yaitu dapat menyebabkan anemia yang dapat terjadi secara tiba-tiba dan kecacatan pada janin. Terapi kombinasi interferon alfa dengan ribavirin belum dapat mengobati dengan efek yang luas, karena hanya dapat menghilangkan virus sampai 50% dari HCV genotipe 1 dan 80% dari genotipe 2 dan 3 (Yayasan Spiritia 2005 dalam Megawati 2008).
Terapi untuk hepatitis C diharapkan memiliki efektifitas yang tinggi, dapat digunakan secara oral, memiliki efek samping yang sedikit, murah, dan cocok untuk kebanyakan pasien (McHutchison & Patel 2002). Salah satu pendekatan pengobatan yang sedang berkembang adalah terapi target molekuler yang bertujuan menghambat siklus hidup HCV. Salah satunya yaitu dengan cara menghambat kerja RNA helikase .
Enzim RNA heilkase HCV memiliki peranan penting dalam tahapan replikasi virus ini yaitu membuka ikatan dupleks RNA virus agar dapat ditranslasikan (Borowski 2008). RNA helikase memiliki tiga macam aktivitas, yaitu aktivitas pengikatan RNA, pengikatan (" (" e (ATP), dan pembukaan rantai RNA ( * ). Apabila proses pembukaan ikatan dupleks RNA virus sebagai pustaka genetik tidak dapat dilakukan, maka proses translasi informasi genetik tidak dapat berjalan sehingga siklus hidup HCV terhenti. Oleh karena itu, enzim ini dapat dijadikan target obat yang potensial untuk pengembangan dan penemuan obat anti HCV yang baru (Utama
2000).
Kinerja dari RNA helikase dapat dihambat oleh suatu inhibitor. Inhibitor enzim dapat diperoleh dari hasil metabolit sekunder, misalnya metabolit dari kapang endofit. Kapang endofit adalah kapang yang hidup berkoloni di dalam jaringan tanaman dan tidak menyebabkan efek yang negatif bagi tanaman inang (Maksum 2005). Endofit ini merupakan sumber dari metabolit sekunder yang belum diketahui potensinya di bidang medis, pertanian, dan pemanfaatan industri. Oleh karena itu, pemanfaatan kapang endofit perlu untuk dilakukan.
Pemanfaatan kapang endofit sebagai sumber obat baru saat ini sedang banyak dilakukan. Hal ini dikarenakan mikroorganisme ini mampu menghasilkan senyawa bioaktif yang sama dengan tanaman inangnya. Satu tanaman dapat memiliki satu atau lebih mikroorganisme endofit yang hidup di dalamnya, sementara di dunia terdapat 30000 jenis tanaman, maka dapat dibayangkan kekayaan biodiversitas mikroorganisme ini sangatlah besar (Strobel & Daisy 2003). Biodiversitas yang besar inilah yang dapat digunakan pemanfaatannya dalam mencari inhibitor RNA helikase HCV.
Megawati (2008) menyebutkan bahwa protein metabolit sekunder dari isolat endofit yang diisolasi dari tanaman temu putih gombyok memiliki kemampuan menghambat RNA helikase HCV, sehingga dapat dimanfaatkan sebagai obat bagi pasien yang terkena penyakit hepatitis C. Namun, perlu dilakukan isolasi dan pemurnian terhadap protein inhibitor ini sehingga memiliki efektifitas yang maksimal dalam menghambat kinerja RNA helikase.
Penelitian ini bertujuan melakukan isolasi dan memurnikan protein inhibitor RNA helikase virus hepatitis C dari isolat
. Belum ditemukannya obat atau vaksin yang dapat mengobati infeksi virus hepatitis C secara efektif sampai saat ini memberikan inspirasi untuk mencoba mencari senyawa antivirus yang berasal dari bahan yang berasal dari alam bukan sintetik.
Hipotesis penelitian ini adalah protein metabolit sekunder yang dihasilkan oleh
kapang endofit dapat
menghambat aktivitas RNA helikase virus hepatitiis, sehingga dapat digunakan sebagai kandidat obat hepatitis C. Penelitian ini diharapkan dapat memberikan informasi mengenai protein metabolit sekunder yang dihasilkan oleh kapang endofit
2
! "#$%&
Endofit adalah mikroorganisme yang hidup di dalam tanaman tingkat tinggi. Bacon dan White (2000) menyebutkan bahwa endofit merupakan mikroorganisme yang hidup berkoloni di dalam jaringan tumbuhan tanpa menyebabkan efek negatif terhadap tumbuhan tersebut. Mikroorganisme yang hidup pada jaringan tumbuhan ini memilki hubungan simbiosis. Mikroorganisme yang banyak ditemukan hidup sebagai endofit adalah bakteri dan kapang.
Endofit diperkirakan menghasilkan metabolit yang karakteristiknya mirip dengan tumbuhan inangnya. Schuzt (2002) menjelaskan bahwa metabolit yang dihasilkan dipengaruhi oleh lingkungan dan tingkatan organisme tertentu. Pemilihan tumbuhan yang akan diisolasi endofitnya harus mempertimbangkan beberapa hal. Pertama, tumbuhan tersebut berasal dari lingkungan yang unik dan mempunyai kemampuan untuk bertahan hidup. Kedua, tumbuhan tersebut memiliki sejarah etnobiologi yang digunakan sebagai obat dari penyakit tertentu. Ketiga, ketersediaan tumbuhan bersifat endemik karena dikaitkan dengan lingkungan tempat tumbuhnya sehingga diduga menghasilkan metabolit aktif untuk mempertahankan kelangsungan hidup. Keempat, tumbuhan yang hidup di dalam lingkungan dengan keragaman tinggi sehingga kemungkinan memiliki endofit dengan keragaman yang tinggi pula (Strobel & Daisy 2003).
Mikroorganisme yang hidup sebagai endofit salah satunya adalah kapang. Isolat merupakan kapang endofit yang diisolasi dari tanaman temu putih. Endofit ini termasuk ke dalam kelompok kapang dengan morfologi bulat (Gambar 1). Temu putih ( + ) dapat dijadikan sebagai obat antivirus (Chungsamarnyart 2007).
Gambar 1 Kapang endofit
Suhu optimal yang dibutuhkan untuk pertumbuhan kapang berkiksar 25-30oC. Pada umumnya kapang dapat tumbuh pada kisaran pH 2-8.5, akan tetapi pertumbuhannya akan lebih baik pada kondisi pH rendah. Nilai pH optimum untuk pertumbuhan kapang berkisar antara 6-7 (Fardiaz 1992).
%'() * &%&%)
Virus hepatitis C (HCV) ditemukan pertama kali pada tahun 1989 dengan nama virus hepatitis non-A dan non-B. Virus ini termasuk kedalam genus ( dan famili . Genom HCV terdiri atas utas tunggal RNA positif yang berukuran sekitar 9.6 kilobasa (kb). Virus ini berbentuk bulat, berpelindung, dan berdiameter sekitar 50-60 nm (Gambar 2) (Tellinghuisen 2007).
Genom HCV terdiri dari (
(ORF) tunggal yang mengkodekan poliprotein tunggal. Poliprotein tersebut merupakan prekusor bagi 3000 jenis asam amino. Poliprotein ini akan diubah menjadi sekitar 10 jenis protein yang berbeda dan terbagi dalam dua kelompok besar protein virus, yaitu protein struktural (protein inti, E1, E2, dan p7) dan protein nonstruktural (NS) (NS2, NS3, NS4A, NS4B, NS5A, dan NS5B) (Lauer &Walker 2001).
Protein struktural dari HCV terletak pada daerah N terminal. Protein inti diperlukan untuk perakitan partikel virus baru (virion) dalam bentuk nukleokapsid. Protein inti berperan sebagai modulator metabolisme lipid dan hepatokarsinogenesis. Protein pelindung
( 1 (E1) mempunyai bobot molekul sekitar 30-35 kDa, sedangkan protein pelindung ( 2 (E2) sekitar 70-75 kDa. Pelindung tersebut banyak mengandung gliko