PENAMBATAN MOLEKUL SENYAWA KATEKIN SERTA
TURUNANNYA PADA TEH HIJAU TERHADAP PROTEIN
FAT MASS AND OBESITY
(FTO)
RENTI EFRAIM M SIMAMORA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Penambatan Molekul Senyawa Katekin serta Turunannya pada Teh Hijau terhadap Protein Fat Mass and Obesity (FTO) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
RENTI EFRAIM M SIMAMORA. Penambatan Molekul Senyawa Katekin serta Turunannya pada Teh Hijau terhadap Protein Fat Mass and Obesity (FTO). Dibimbing oleh LAKSMI AMBARSARI dan TONY IBNU SUMARYADA.
Teh hijau adalah tanaman herbal yang biasa dikonsumsi masyarakat sebagai minuman terapi untuk obesitas. Kandungan metabolit sekunder teh hijau yang mempunyai aktivitas tersebut adalah katekin. Salah satu protein dalam tubuh manusia yang memiliki peran regulasi terhadap proses terjadinya obesitas adalah protein FTO. Interaksi katekin dan turunannya terhadap protein FTO dapat dipelajari dengan teknik penambatan molekul secara in silico. Penelitian ini bertujuan mempelajari interaksi molekuler senyawa katekin dan turunannya terhadap protein FTO menggunakan parameter nilai energi bebas Gibbs (ΔG) dan ikatan kimia yang terbentuk. Proses penambatan molekul menggunakan perangkat lunak utama yaitu AutoDock Vina 1.5.6. Ligan yang digunakan adalah katekin, gallokatekin, epikatekin, epigallokatekin dan orlistat. Hasil yang diperoleh adalah gallokatekin memiliki kestabilan interaksi yang paling baik dengan protein FTO. Nilai energi bebas Gibbs dari interaksi tersebut adalah -7.7 kkal/mol. Gugus fungsi yang berperan dalam interaksi ligan dengan protein adalah gugus fungsi OH2, OH4 dan OH7 pada struktur aromatik. Berdasarkan penambatan molekul, dapat diketahui bahwa senyawa katekin dan turunannya pada teh hijau dapat digunakan sebagai terapi herbal untuk obesitas.
Kata kunci : Penambatan molekul, Katekin, Obesitas, Protein FTO, Energi bebas Gibbs
Based on analysis of molecular docking, catechin and its dervatives can be used as a herbal therapy for obesity.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PENAMBATAN
MOLEKUL SENYAWA KATEKIN SERTA
TURUNANNYA PADA TEH HIJAU TERHADAP PROTEIN
FAT MASS AND OBESITY
(FTO)
RENTI EFRAIM M SIMAMORA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penambatan Molekul Senyawa Katekin serta Turunannya pada Teh Hijau terhadap Protein Fat Mass and Obesity (FTO)
Nama : Renti Efraim M Simamora NIM : G84110027
Disetujui oleh
Dr Laksmi Ambarsari, MS
Pembimbing I Dr Tony Ibnu Sumaryada, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus yang telah mengaruniakan berkat dan anugerahNya sehingga karya ilmiah ini dapat diselesaikan dengan baik. Karya ilmiah yang berjudul Penambatan Molekul Senyawa Katekin dan Turunannya serta Teh Hijau terhadap Protein Fat Mass and Obesity (FTO) ini dilaksanakan sejak bulan Maret 2015 hingga April 2015 di Laboratorium Biokimia Institut Pertanian Bogor dan Departemen Fisika Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Ibu Dr Laksmi Ambarsari MS dan Bapak Dr Tony Ibnu Sumaryada MSi selaku pembimbing yang telah memberikan arahan dan saran untuk penulisan karya ilimiah ini.Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Di samping itu, ucapan terima kasih juga penulis sampaikan kepada kak Ridho, kak Ori, Nia, Nina, Hijriana, keluarga besar UKM PMK IPB yang telah membantu penyelesaian karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 3 Alat dan Bahan 3 Metode Penelitian 3 HASIL 3 PEMBAHASAN 8 SIMPULAN DAN SARAN 13 Simpulan 14 Saran 14 DAFTAR PUSTAKA 14 LAMPIRAN 17
DAFTAR TABEL
1 Sifat ligan berdasarkan Aturan Lipinski 4
2 Interaksi di sekitar ligan dengan radius <5Å 6
DAFTAR GAMBAR
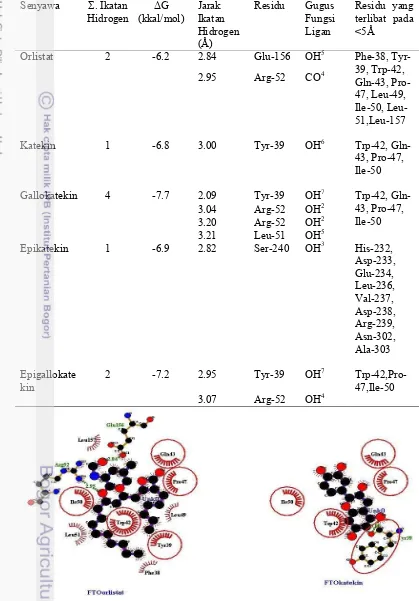
1 Nilai energi bebas Gibbs (ΔG) ligan pembanding dan ligan uji 4 2 Visualisasi penambatan molekul dari interaksi orlistat dan katekin terhadap
protein FTO dengan LigPlot+ 1.4.5 6
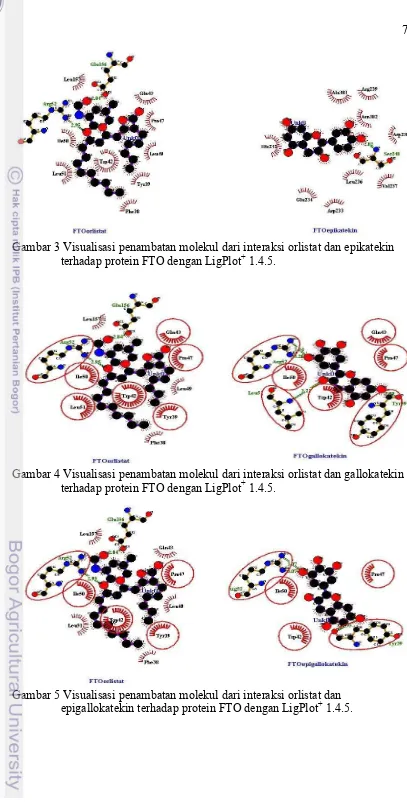
3 Visualisasi penambatan molekul dari interaksi orlistat dan epikatekin terhadap
protein FTO dengan LigPlot+ 1.4.5 7
4 Visualisasi penambatan molekul dari interaksi orlistat dan gallokatekin terhadap
protein FTO dengan LigPlot+ 1.4.5 7
5 Visualisasi penambatan molekul dari interaksi orlistat dan epigallokatekin
terhadap protein FTO dengan LigPlot+ 1.4.5 7
DAFTAR LAMPIRAN
1 Diagram alir penelitian 17
2 Struktur 2D Protein FTO 18
3 Posisi residu Arg-52 pada daerah motif Protein FTO 19 4 Posisi residu Tyr-39 pada daerah motif Protein FTO 19
5 Nilai ΔGligan dengan reseptor 20
PENDAHULUAN
Obesitas merupakan keabnormalan atau kelebihan akumulasi lemak pada tubuh manusia yang dapat berisiko terhadap kesehatan. Obesitas didefinisikan berdasarkan nilai Body Mass Index (BMI) yang lebih besar dari 30 kg/m2. Obesitas menyebabkan beberapa faktor risiko dari penyakit kronis seperti diabetes, penyakit kardiovaskular, kanker dan osteoartritis (Archana et al. 2010). Prevalensi terjadinya obesitas telah meningkat dalam beberapa tahun terakhir dan telah menjadi salah satu masalah kesehatan global yang paling serius. Menurut data statistik World Health Organization (WHO) tahun 2011, lebih dari 1.5 miliar orang dewasa yang berusia di atas 20 tahun mengalami kelebihan berat badan, 200 juta pria dan hampir 300 juta wanita mengalami obesitas. Selain itu, hampir 43 juta anak di bawah usia lima tahun yang mengalami kelebihan berat badan (WHO 2011).
Terjadinya obesitas sering dikaitkan dengan faktor lingkungan dan gen obesitas yang terkait. Bukti bahwa setiap individu memiliki respon yang berbeda terhadap perubahan lingkungan dan berat badan menunjukkan bahwa faktor genetik yang menyebabkan variasi dalam respon tersebut dan sekitar 40%-70% respon ini diwariskan (Herrera et al. 2011). Studi genom terkait dan studi fenotip model tikus transgenik memberikan wawasan eksplorasi gen obesitas terbaru. Gen yang pertama dan terkuat berkontribusi terhadap obesitas pada beberapa populasi berbagai negara adalah gen yang mengkodekan Fat mass and Obesity protein (protein FTO) (Zhao et al. 2014).
Salah satu upaya terapi obesitas adalah dengan menghambat aktivitas protein FTO. Protein FTO merupakan jenis enzim oksidoreduktase yang ada pada manusia yang dikodekan oleh gen FTO (Chang et al 2011). Gen FTO merupakan faktor genetik obesitas yang baru teridentifikasi. Namun, mekanisme molekuler pasti yang membuktikan efek FTO terhadap obesitas masih banyak yang belum diketahui. Data terbaru secara in vivo menunjukan bahwa gangguan pada aktivitas enzimatik protein FTO akan menyebabkan disregulasi gen-gen yang terlibat dalam metabolisme energi, kesalahan fungsi homeostasis energi dan jaringan adiposa pada tikus (Zhao et al. 2014). Enzim ini diekspresikan di semua jaringan dengan tingkat kelimpahan paling tinggi terdapat pada hipotalamus dan hati (Gerken et al 2007). Menurut Sudeep and Shyam (2014), protein FTO memiliki merupakan salah satu enzim yang berkorelasi dengan terjadinya obesitas pada manusia. Ekspresi yang berlebihan terhadap enzim ini akan berdampak pada peningkatan akumulasi lemak dan dapat menyebabkan obesitas. Efek enzim ini akan terminimalisir apabila terdapat suatu senyawa yang dapat menghambat aktivitasnya.
2
sekunder golongan fenol (Cabrera 2006). Hal ini sesuai dengan penyataan Williams et al (2013), bahwa senyawa fitokimia pada tanaman yang memiliki potensi sebagai antiobesitas adalah senyawa polifenol. Senyawa katekin dan turunannya pada teh hijau telah diketahui memiliki manfaat terhadap obesitas, namun interaksi secara molekuler yang terjadi belum diketahui secara pasti. Berdasarkan hal ini, senyawa katekin dan turunannya diduga dapat menghambat aktivitas protein FTO dalam kaitannya terhadap terapi obesitas.
Aktivitas katekin dan turunannya terhadap antiobesitas dapat dipelajari interaksinya dengan protein FTO menggunakan teknik penambatan molekul. Teknik ini digunakan untuk menggambarkan orientasi pengikatan molekul katekin dan turunannya dengan protein FTO untuk memprediksi afinitas dan aktivitas penghambatannya secara molekuler. Konformasi yang tepat dan konfigurasi ligan dapat diperhitungkan untuk menemukan molekul terbaik dengan energi pengikatan yang rendah (Singh et al 2012). Kelebihan metode penambatan molekul dapat membuat fokus riset dipersempit, menghemat biaya penelitian dan waktu yang digunakan lebih efektif (Sharma et al. 2010). Penelitian ini bertujuan mempelajari interaksi molekuler antara senyawa katekin dan turunannya terhadap protein FTO dengan teknik penambatan molekuler serta diharapkan dapat memberikan informasi ilmiah mengenai penggunaan metode penambatan molekul untuk mengetahui interaksi yang terjadi antara katekin pada teh hijau terhadap penghambatan penyakit obesitas.
METODE
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah seperangkat komputer dengan spesifikasi RAM (Random Access Memory) 1 GB, Intel (R) Atom (TM) CPU N550 Processor, sistem operasi Microsoft Windows 7 ultimate, perangkat lunak Discovery studio 3.5 Client, AutoDock Vina Tools 1.5.6 (The Scripps Research Institute, Amerika), MarvinView 6.0, LigPlot+ 1.4.5, webserver POLYVIEW 2-D dan Visual Molecular Dynamic 1.9.2.
Bahan yang digunakan dalam penelitian ini berupa data struktur protein FTO yang diperoleh dari Protein Data Bank (PDB), struktur senyawa orlistat yang diperoleh dari Drug Bank serta struktur senyawa katekin dan turunannya yang diperoleh dari subdatabase PubChem Compound.
Metode Penelitian
Preparasi Struktur Reseptor dan Ligan (Lipinski 2000)
3 www.drugbank.ca. Struktur senyawa ligan perlu dilakukan analisis sifat bioavabilitas ligan dengan menggunakan aturan Lipinski. Struktur ligan uji dan pembanding yang telah diunduh, ditransformasikan ke dalam bentuk file.pdb menggunakan program Marvin View.
Reseptor yang digunakan adalah protein FTO yang diunduh melalui Protein Data Bank (PDB) pada situs www.rcsb.org/pdb dengan kode 3LFM. Data ini merupakan hasil teknik biofisika seperti kristalografi X-ray maupun spektroskopi NMR dari FTO yang meliputi struktur, sisi aktif dan sekuens. Langkah selanjutnya adalah visualisasi struktur sekunder dua dimensi protein FTO dengan menggunakan server web POLYVIEW 2-D dan visualisasi struktur tiga dimensi dengan menggunakan Visual Molecular Dynamic 1.9.2.
Proses Penambatan molekul (Yanuar 2012)
Setelah protein dan ligan diperoleh maka langkah selanjutnya adalah proses penambatan molekul. Proses ini dilakukan dengan menggunakan perangkat lunak AutoDock Vina 1.5.6. Protein target dan ligan yang akan disimulasi diubah formatnya dari *.pdb menjadi format *.pdbqt yang merupakan format untuk molekul yang telah ditambahkan muatan atom (Shingh et al 2012). Metode penambatan molekul dilakukan dengan menambatkan ligan pada reseptor protein FTO dan mengisi koordinat penambatan yaitu Grid center dan Grid box sesuai yang diperlukan. Masing-masing ligan berada pada kondisi fleksibel yang akan berinteraksi dengan biomakromolekul pada kondisi rigid. Ligan dan protein di penambatan molekul sebanyak 20 kali untuk mendapatkan energi bebas Gibbs yang terbaik. Hasil penambatan molekul yang diperoleh dilakukan scoring dan diperoleh nilai terbaik yaitu yang memiliki energi bebas (ΔG) paling negatif. Daerah penambatan ligan terhadap reseptor protein FTO dalam format *.pdbqt diubah menjadi format *.pdb menggunakan perangkat lunak Discovery Studio 3.5 Client. Analisis ikatan hidrogen dan residu kontak antara ligan dan reseptor dapat divisualisasikan dengan perangkat lunak Ligplot+ 1.4.5 dengan format *.pdb. Analisis Hasil Penambatan molekul (Yanuar 2012)
Tahap terakhir dari penelitian ini adalah analisis hasil penambatan molekul. Analisis hasil penambatan molekul dapat dilakukan dengan menggunakan perangkat lunak Ligplot+1.4.5. Hasil yang dianalisis adalah interaksi antara ligan dan protein. Interaksi tersebut antara lain ikatan hidrogen, interaksi hidrofobik dan jarak ikatan yang terjadi. Semua interaksi tersebut akan divisualisasikan dalam perangkat lunak Ligplot+1.4.5.
HASIL
Sifat Ligan berdasarkan Aturan Lipinski
4
dalam Lipinski et al (2012) antara lain (1) berat molekul senyawa kurang dari 500 g/mol, (2) koefisien partisi (logP) kurang dari 5, (3) jumlah donor ikatan H ≤ 5, dan (4) jumlah akseptor ikatan H kurang dari 10. Berdasarkan hasil analisis, semua ligan uji memiliki nilai berat molekul di bawah 500 g/mol begitu pula dengan ligan pembanding. Selain itu, nilai logP ligan uji semuanya kurang dari 5 kecuali nilai logP ligan pembanding yaitu sebesar 8.11. Analisis selanjutnya adalah jumlah donor dan akseptor ikatan hidrogen. Ligan yang memiliki jumlah donor ikatan hidrogen yang memenuhi aturan Lipinski adalah katekin, epikatekin dan orlistat, sedangkan gallokatekin dan epigallokatekin memiliki jumlah donor ikatan hidrogen sebanyak 6. Jumlah akseptor ikatan hidrogen dari semua ligan uji dan pembanding sesuai dengan aturan Lipinski yaitu kurang dari 10. Hasil analisis ligan berdasarkan aturan Lipinski dapat dilihat pada Tabel 1.
Tabel 1 Sifat ligan berdasarkan Aturan Lipinski
Nama Struktur Struktur Rumus Molekul Berat
(g/mol) Log P
Energi Bebas Gibbs (ΔG) Penambatan molekul Ligan dan Protein FTO
Data hasil energi bebas Gibbs (ΔG) dari penambatan molekul senyawa ligan uji dan pembanding terhadap protein FTO ditunjukkan pada Gambar 1. Orlistat digunakan sebagai ligan pembanding dalam teknik penambatan molekul ini. Energi bebas Gibbs (ΔG) yang paling baik adalah energi yang nilainya semakin negatif, karena semakin negatif nilai energi bebas Gibbs yang terbentuk maka interaksi ligan dan reseptor akan semakin kuat dan stabil. Berdasarkan hasil penelitian, nilai energi bebas Gibbs (ΔG) ligan uji yaitu katekin, gallokatekin, epikatekin dan epigallokatekin berturut-turut adalah -6.8 kkal/mol, -7.7 kkal/mol, -6.9 kkal/mol dan -7.2 kkal/mol, sedangkan nilai energi bebas Gibbs (ΔG) ligan pembanding yaitu orlistat adalah -6.2 kkal/mol. Hasil penambatan molekul menunjukkan bahwa ligan uji gallokatekin memiliki interaksi yang paling kuat dan stabil terhadap protein FTO dengan nilai energi bebas Gibbs (ΔG) yang paling negatif yaitu -7.7 kkal/mol.
5 Interaksi kimia residu protein FTO dengan ligan
Data hasil penambatan molekul yang diperoleh berupa interaksi kimia antara ligan terhadap residu asam amino protein FTO ditunjukkan pada Tabel 2. Interaksi kimia yang terdapat dalam hasil penambatan molekul ini adalah ikatan hidrogen (beserta jarak ikatan) dan interaksi hidrofobik yang terletak kurang dari 5Å. Semakin banyak ikatan hidrogen yang terbentuk maka nilai energi bebas Gibbs (ΔG) akan semakin negatif. Berdasarkan data hasil penambatan molekul, ikatan hidrogen yang paling banyak terdapat pada senyawa ligan uji gallokatekin dan epigallokatekin berturut-turut sebanyak 4 ikatan hidrogen dan 2 ikatan hidrogen. Hasil tersebut berkorelasi positif dengan data nilai energi bebas Gibbs (ΔG) yang dihasilkan oleh gallokatekin dan epigallokatekin. Gallokatekin memiliki jumlah ikatan hidrogen terbanyak dan memiliki nilai energi bebas Gibbs yang paling baik. Gugus fungsi ligan yang terlibat dalam ikatan hidrogen yang terbentuk juga memiliki peran terhadap kekuatan ikatan yang terjadi. Secara umum, gugus fungsi keempat ligan uji yang terlibat dalam ikatan hidrogen dengan protein FTO adalah gugus hidroksil (OH). Interaksi hidrofobik yang terbentuk selama proses penambatan molekul ditunjukkan melalui residu asam amino yang terlibat. Ligan uji yang memiliki residu asam amino yang paling banyak terlibat dalam interaksi hidrofobik adalah epikatekin yaitu sebanyak sembilan residu asam amino.
6
Tabel 2 Interaksi di sekitar ligan dengan radius <5Å
Senyawa Σ. Ikatan
7
Gambar 3 Visualisasi penambatan molekul dari interaksi orlistat dan epikatekin terhadap protein FTO dengan LigPlot+ 1.4.5.
Gambar 4 Visualisasi penambatan molekul dari interaksi orlistat dan gallokatekin terhadap protein FTO dengan LigPlot+ 1.4.5.
8
PEMBAHASAN
Sifat Ligan berdasarkan Aturan Lipinski
Analisis permeabilitas dan solubilitas dari ligan yang akan digunakan merupakan tahap skrining awal ligan. Permeabilitas dan solubilitas ligan dianalisis menggunakan aturan Lipinski yang dapat menentukan kemampuan ligan apabila dikonsumsi secara oral untuk diserap dalam tubuh. Ligan uji yang digunakan dalam docking adalah katekin, epikatekin, gallokatekin dan epigallokatekin sedangkan ligan pembandingnya adalah orlistat. Menurut Towaha (2013), struktur molekul katekin dan turunannya terdiri atas dua gugus fenol yaitu cincin A dan cincin B serta satu gugus dihidropiran (cincin C), karena katekin dan turunannya memiliki lebih dari satu gugus fenol, maka senyawa ini sering disebut senyawa polifenol. Terdapat empat parameter yang digunakan dalam menganalisis permeabilitas dan solubilitas ligan antara lain berat molekul ligan, nilai koefisien partisi (logP), jumlah akseptor ikatan hidrogen dan jumlah donor ikatan hidrogen pada ligan. Berat molekul ligan menentukan kemampuan ligan berdifusi secara pasif untuk menembus membran sel sehingga dapat mencapai area target. Berat molekul ideal yang dinyatakan dalam Aturan Lipinski adalah kurang dari 500 gram/mol supaya ligan uji yang digunakan dapat diserap oleh tubuh. Berdasarkan data Tabel 1, semua ligan uji dan pembanding memiliki berat molekul kurang dari 500 gram/mol dan dapat dikatakan memiliki permeabilitas yang baik.
Hal lain yang perlu dianalisis adalah koefisien partisi ligan yaitu koefisien yang menunjukkan rasio pendistribusian ligan apabila beredar dalam dua fase yang berbeda yaitu fase organik dan air. Nilai koefisien partisi (logP) yang disarankan berada pada rentang -0.4-5. Empat dari lima senyawa ligan yang digunakan memiliki nilai logP yang kurang dari 5. Nilai logP ligan yang melebihi dari rentang ideal yang disarankan adalah nilai logP dari orlistat yaitu 8.11 (Tabel 1). Apabila nilai logP lebih dari 5 maka senyawa ligan memiliki sifat yang sangat hidrofobik. Semakin hidrofobik ligan tersebut, maka sifatnya akan semakin toksik dalam tubuh karena akan bertahan lama pada lipid bilayer dan terdistribusi lebih luas dalam tubuh. Nilai logP yang kurang dari -0.4 juga tidak baik karena ligan tersebut tidak akan dapat melewati lipid bilayer karena bersifat terlalu hidrofilik (Lipinski et al. 2012).
9 Energi Bebas Gibbs (ΔG) Hasil Penambatan Molekul
Penambatan molekul adalah istilah yang digunakan dalam model komputasional untuk memprediksi interaksi intermolekuler dari kompleks struktur yang dibentuk antara dua atau lebih molekul yaitu antara reseptor dan ligan. Teknik penambatan molekul digunakan untuk mengetahui mekanisme senyawa kimia atau makromolekul seperti protein dalam skala molekuler sehingga dapat didesain menjadi obat berbasis struktur (Ali 2007). Prinsip dari metode ini adalah menambatkan ligan ke reseptor yang diuji dan dilanjutkan dengan evaluasi molekul berdasarkan konformasi struktur dan sifat elektrostatiknya (Kroemer 2003). Reseptor merupakan sebuah protein target sedangkan ligan dapat berupa protein lain, asam nukleat atau molekul kecil seperti obat potensial, substrat, dan inhibitor (Sousa et al. 2006).
Teknik penambatan molekul terdiri atas dua jenis, yaitu blind docking dan targeted docking. Blind docking merupakan metode penambatan molekul dengan melibatkan seluruh bagian ligan dan reseptor karena tidak mengetahui letak sisi aktif reseptor dengan tepat, sedangkan targeted docking merupakan metode penambatan molekul yang dilakukan dengan telah mengetahui sisi aktif reseptor dengan tepat. Penelitian ini dilakukan dengan metode blind docking karena belum mengetahui parameter grid dari enzim/protein FTO. Proses penambatan molekul dilakukan dengan kondisi reseptor yang rigid sedangkan kondisi ligan fleksibel (Reddy et al. 2007). Fleksibilitas suatu ligan dinyatakan dengan jumlah rotatable bond dari suatu ligan. Semakin banyak jumlah rotatable bond ligan, maka semakin flesksibel ligan yang digunakan. Sampai saat ini setidaknya terdapat 60 program penambatan molekul dan yang paling sering digunakan adalah AutoDock Vina. Kelebihan dari program ini adalah keakuratan dan kecepatan yang dimilikki sangat baik, dapat digunakan secara gratis, serta banyak digunakan untuk menghitung afinitas ikatan molekul kecil dengan protein (INBIO 2014).
Proses penambatan molekul yang dilakukan antara protein FTO dengan ligan uji dan pembanding akan menghasilkan nilai energi bebas Gibbs (ΔG) yang merupakan parameter kestabilan konformasi yang terjadi antara ligan dengan protein FTO. Secara Termodinamika, interaksi antara protein dan ligan akan terbentuk apabila kompleks yang dihasilkan memiliki nilai ΔG negatif. Semakin negatif nilai ΔG yang dihasilkan maka interaksi yang terjadi antara reseptor dengan ligan akan semakin kuat dan stabil. Penelitian ini melakukan sebanyak 20 kali penambatan setiap senyawa ligan sehingga menghasilkan 20 model hasil penambatan molekul yang memiliki energi bebas Gibbs masing-masing, namun yang dipilih adalah konformasi ligan dan protein dengan nilai ΔG yang paling negatif. Nilai energi bebas Gibbs setiap ligan uji dan ligan pembanding yang terbaik dapat dilihat pada Gambar 1.
10
rendah dan baik dimilikki oleh senyawa gallokatekin yaitu sebesar -7.7 kkal/mol, sedangkan nilai energi bebas Gibbs yang tertingggi dimiliki oleh senyawa orlistat yaitu sebesar -6.2 kkal/mol (Gambar 1). Nilai energi bebas Gibbs senyawa ligan uji lebih baik dbandingkan dengan senyawa orlistat, hal ini menunjukkan bahwa interaksi yang terjadi antara senyawa katekin dan turunannya lebih kuat dan stabil terhadap protein FTO apabila dibandingkan senyawa orlistat. Senyawa katekin dan turunannya dapat berikatan lebih kuat dan spontan daripada senyawa orlistat. Berdasarkan perbandingan hasil energi bebas Gibbs ini, ligan uji yaitu katekin dan turunannya memiliki potensi aktivitas yang lebih baik daripada orlistat dalam menghambat terjadinya obesitas secara herbal.
Interaksi Gallokatekin dan Orlistat terhadap Residu Protein FTO
Hasil proses penambatan molekul antara senyawa katekin dan turunannya divisualisasi menggunakan perangkat lunak LigPlot+ 1.4.5 sehingga dapat diketahui interaksi intermolekuler yang terjadi antara ligan dengan protein FTO yang kurang dari radius 5Å (Tabel 2). Interaksi molekuler merupakan interaksi yang terjadi antara dua molekul atau lebih yang berupa ikatan hidrogen, interaksi hidrofobik dan interaksi elektrostatik. LigPlot merupakan perangkat lunak yang digunakan untuk mempresentasikan kompleks ligan-protein secara 2D (diagram skematik) (INBIO 2014). Perangkat lunak LigPlot+ 1.4.5 memvisualisasikan hasil penambatan molekul berupa interaksi struktur ligan terhadap residu asam amino protein yang digunakan dengan simbol interaksi hidrogen berupa garis putus-putus dan interaksi hidrofobik berupa gambar busur merah. Gallokatekin merupakan ligan yang memiliki nilai ΔG yang paling rendah dibandingkan dengan ligan yang lain, sehingga gallokatekin adalah ligan yang memiliki kestabilan interaksi yang paling baik ketika berikatan dengan protein FTO. Kestabilan yang baik antara gallokatekin dengan protein FTO dipengaruhi oleh beberapa faktor antara lain ikatan hidrogen (jumlah dan jarak ikatan), interaksi hidrofobik, dan peran gugus fungsi (Reddy et al. 2007).
Jumlah ikatan hidrogen antara gallokatekin terhadap protein FTO yaitu empat buah yang melibatkan tiga residu asam amino antara lain Tyr-39, Arg-52, dan Leu-51. Setiap ikatan hidrogen yang terjadi memiliki jarak ikatan masing masing yaitu 2.09Å (Tyr-39), 3.04Å (Arg-52), 3.20Å (Arg-52) dan 3.21Å (Leu-51). Ikatan hidrogen paling kuat adalah ikatan hidrogen yang memiliki jarak ikatan yang paling pendek yaitu 2.09Å pada Tyr-39. Ikatan hidrogen tersebut terjadi antara gugus OH7 gallokatekin dengan gugus fungsi CO residu Tyr-39 (Gambar 4). Interaksi hidrofobik juga berperan penting dalam kestabilan ligan-reseptor. Residu yang memiliki interaksi hidrofobik dengan gallokatekin adalah Trp-42, Gln-43, Pro-47, Ile-50. Interaksi hidrofobik merupakan interaksi lemah antara gugus nonpolar ligan dengan residu nonpolar reseptor yang bersifat menghindari lingkungan cair dan berperan penting dalam stabilisasi konformasi protein (Nelson dan Cox 2008). Interaksi hidrofobik juga mampu menurunkan nilai ΔG dengan menstabilkan interaksi yang terjadi antara ligan-reseptor.
11 terhadap protein FTO terjadi pada residu Glu-156 (2.84Å) dan Arg-52(2.95Å). Apabila dibandingkan dengan gallokatekin, jumlah ikatan hidrogen pada orlistat lebih sedikit dibandingkan dengan gallokatekin yaitu hanya dua buah, hal ini merupakan salah satu penyebab kestabilan orlistat terhadap protein FTO lebih rendah pula dibandingkan dengan gallokatekin, karena semakin banyak ikatan hidrogen yang terbentuk maka kestabilan kompleks reseptor-ligan akan semakin kuat. Ikatan hidrogen orlistat terjadi antara gugus COO pada Glu-156 dengan gugus OH5 orlistat dan antara gugus NH2 Arg-52 dengan gugus CO4 orlistat. Residu yang terlibat dalam interaksi hidrofobik orlistat-FTO antara lain Phe-38, Tyr-39, Trp-42, Gln-43, Pro-47, Leu-49, Ile-50, Leu-51, Leu-157. Residu-residu yang terlibat dalam interaksi hidrofobik adalah residu yang memiliki sifat nonpolar. Jumlah interaksi hidrofobik orlistat-FTO lebih banyak dibandingkan dengan gallokatekin, namun tidak membuat nilai ΔG nya lebih negatif. Hal ini dapat dimungkinkan karena gallokatekin memiliki jumlah ikatan hidrogen dua kali lipat dibandingkan dengan orlistat, sehingga kestabilan yang dipengaruhi oleh jumlah interaksi hidrofobik orlistat yang banyak tidak cukup untuk membuat interaki orlistat-FTO lebih stabil dan kuat. Terdapat beberapa residu yang sama dalam interaksi hidrofobik antara orlistat-FTO dengan gallokatekin-FTO yaitu Ile-50, Trp-42, Pro-47, dan Gln-43. Berbeda halnya dengan residu Leu-51 dan Tyr-39 yang pada interaksi orlistat-FTO hanya terlibat dalam interaksi hidrofobik namun pada interaksi gallokatekin-FTO terlibat dalam ikatan hidrogen (Gambar 4). Hal ini dapat menjadi faktor nilai ΔG orlistat-FTO lebih positif dibandingkan gallokatekin-FTO.
Residu yang berperan dalam ikatan hidrogen terhadap protein FTO antara orlistat dan gallokatekin memiliki kesamaan yaitu pada residu Arg-52 namun kekuatan ikatannya berbeda. Oleh karena itu, dapat diasumsikan bahwa residu Arg-52 memiliki peran penting dalam proses inhibisi protein FTO. Hal ini juga dapat menunjukkan bahwa konformasi paling stabil orlistat dan gallokatekin berada pada daerah yang hampir sama. Apabila dilihat pada Tabel 2, terdapat perbedaan gugus fungsi ligan yang terlibat dalam ikatan hidrogen. Ikatan hidrogen yang terjadi antara gallokatekin dengan protein FTO secara keseluruhan melibatkan gugus hidroksil (OH) dari gallokatekin. Hal ini sesuai dengan penelitian Yang et al. (2007) yang menyatakan bahwa gugus polifenol dari teh memiliki aktivitas farmakologi. Sedangkan gugus fungsi orlistat yang berperan dalam ikatan hidrogen dengan protein FTO ada dua jenis yaitu gugus hidroksil (OH) dan gugus keton (CO). Perbedaan gugus fungsi ligan ini terdapat pada ikatan hidrogen dengan residu Arg-52. Gugus fungsi orlistat yang berikatan dengan residu ini adalah gugus ketonnya, sedangkan pada gallokatekin adalah gugus hidroksil.
12
merupakan gabungan struktur sekunder protein yaitu alfa helix dan beta sheet yang dihubungkan melalui suatu loop. Motif memiliki nama lain yaitu struktur supersekunder protein. Struktur motif dapat berupa struktur yang sederhana dan merupakan bagian kecil dari protein, antara lain alfa-alfa, beta-beta, dan beta-alfa-beta ataupun berupa struktur yang rumit dan kompleks seperti beta-alfa-beta barrel (Nelson dan Cox 2008). Keberadaan motif dari protein sering dikaitkan terhadap fungsi protein tersebut (Attwood et al. 2002). Residu Arg-52 dari protein FTO merupakan motif protein yang membentuk unit beta-alfa-beta yaitu terdiri atas dua beta-strand paralel yang dihubungkan oleh dua loop pada suatu alfa helix di antara keduanya. Visualisasi menggunakan VMD menunjukkan Arg-52 berada pada struktur beta sheet protein FTO (Lampiran 3). Penambatan molekul gallokatekin dan orlistat pada residu motif protein FTO akan berpengaruh pada aktivitas dan fungsi protein FTO.
Interaksi Kimia Katekin, Epikatekin, dan Epigallokatekin terhadap Residu Protein FTO
Epigallokatekin merupakan ligan uji yang memiliki nilai energi bebas Gibbs terbaik kedua setelah gallokatekin yaitu sebesar -7.2 kkal/mol. Nilai ini masih lebih baik dari energi bebas Gibbs orlistat. Terdapat tiga buah ikatan hidrogen yang dihasilkan dari interaksi epigallokatekin terhadap protein FTO. Ikatan hidrogen tersebut terjadi pada residu Tyr-39 dengan jarak ikatan 2.95Å, dua buah ikatan pada residu Arg-52 dengan jarak ikatan masing-masing sama yaitu 3.07Å (Tabel 2). Jenis ikatan hidrogen ini serupa dengan ikatan hidrogen yang dimilikki oleh gallokatekin hanya jarak ikatannya saja yang berbeda. Gugus fungsi yang terlibat dengan interaksi hidrogen ini adalah gugus hidroksil (OH) yang terdapat pada epigallokatekin. Ikatan hidrogen pada Tyr-39 terjadi antara gugus fungsi OH7 epigallokatekin dengan gugus keton pada Tyr-39, ikatan hidrogen pada Arg-52 terjadi antara gugus fungsi OH4 epigallokatekin dengan gugus NH2 residu tersebut (Gambar 5). Gugus fungsi epigallokatekin dengan gallokatekin memiliki kesamaan pada ikatan hidrogen dengan residu Tyr-39.Gugus fungsi tersebut adalah gugus fungsi OH7. Hal ini dapat menunjukkan bahwa gugus fungsi OH7 memiliki peran yang penting dalam interaksinya dengan protein FTO. Selain daripada ikatan hidrogen, terdapat pula interaksi hidrofobik antara senyawa epigallokatekin terhadap protein FTO. Jumlah interaksi hidrofobik epigallokatekin-FTO hanya tiga buah, lebih sedikit daripada interaksi hidrofobik yang terjadi pada gallokatekin-FTO dan orlistat-FTO. Residu yang terlibat dalam interaksi hidrofobik ini antara lain Trp-42, Pro-47, dan Ile-50. Residu tersebut juga merupakan residu yang terlibat pada interaksi hidrofobik gallokatekin-FTO. Jumlah ikatan hidrogen dan interaksi hidrofobik yang terlibat dalam interaksi epigallokatekin terhadap protein FTO lebih sedikit dibandingkan dengan gallokatekin, oleh karena itulah nilai energi bebas Gibbs (ΔG) epigallokatekin-FTO lebih positif dibandingkan dengan gallokatekin-epigallokatekin-FTO.
13 epigallokatekin. Gugus fungsi katekin yang terlibat dalam ikatan hidrogen ini adalah gugus hidroksil (OH6) katekin dengan gugus keton residu Tyr-39. Residu Tyr-39 diduga memiliki peran penting pula dalam interaksi antara ligan uji dengan protein FTO dikarenakan residu ini selalu terlibat dalam ikatan hidrogen pada gallokatekin, epigallokatekin dan katekin terhadap protein FTO. Residu Tyr-39 juga merupakan residu asam amino pada motif protein FTO sama seperti residu Arg-52. Visualisasi menggunakan VMD menunjukkan Tyr-39 berada pada struktur alfa helix protein FTO (Lampiran 3). Residu Tyr-39 juga terdapat pada interaksi orlistat-FTO namun hanya berupa interaksi hidrofobik yang kekuatan ikatannya lebih lemah. Nilai ΔG katekin terhadap protein FTO sebesar -6.8 kkal/mol lebih positif dibandingkan dengan ligan uji yang lain. Hal ini disebabkan karena interaksi katekin-FTO hanya memiliki satu ikatan hidrogen dan empat residu dalam interaksi hidrofobik. Residu yang terlibat dalam interaksi hidrofobik katekin-FTO antara lain Trp-42, Pro-47, Ile-50, dan Gln-43 yang juga merupakan residu pada interaksi hidrofobik pada orlistat-FTO (Gambar 2). Residu Trp-42, Pro-47, dan Ile-50 diprediksikan merupakan residu yang memilikki peran penting dikarenakan ketiga residu tersebut selalu terlibat di setiap interaksi hidrofobik ligan uji terhadap protein FTO.
14
SIMPULAN DAN SARAN
Simpulan
Katekin dan senyawa turunannya memiliki interaksi intermolekuler dengan kestabilan yang baik terhadap protein FTO. Interaksi yang terjadi adalah ikatan hidrogen dan interaksi hidrofobik. Residu yang berperan dalam interaksi ligan dengan protein FTO adalah Arg-52 dan Tyr-39 (ikatan hidrogen) yang merupakan residu asam amino motif protein ini serta Trp-42, Pro-47, dan Ile-50 (interaksi hidrofobik). Gugus fungsi ligan yang berperan penting dalam berinteraksi dengan protein FTO adalah OH2, OH4 dan OH7. Ligan uji yang memiliki kestabilan interaksi penghambatan protein FTO paling baik adalah gallokatekin yaitu sebesar -7.7 kkal/mol.
Saran
Saran untuk penelitian ini adalah perlu pengujian residu yang paling berperan dalam inhibisi protein FTO dengan melakukan penambatan molekul ligan dengan protein FTO yang telah mengalami mutasi pada daerah residu asam amino Arg-52 atau Tyr-39.. Selain itu, disarankan membuat modifikasi ligan yang dapat digunakan sebagai inhibitor protein FTO.
DAFTAR PUSTAKA
Ali HI. 2007. Antitumor studies. Part 3: Design, synthesis, antitumor activity,and molecular docking study of novel 2-methylthio-, 2-amino and 2-(Nsubstituted amino)-10-alkyl-2-deoxo-5-deazaflavins. Bioorganic & Medicinal Chemistry Annual Reports in Medicinal Chemistry.1-10. doi: 10.1016/j.bmc.2007.06.058. Archana P, Sathishkumar N, Bharathi N. 2010. In silico docking analysis of
curcumin-an inhibitor for obesity. International Journal of Pharma and Bio Sciences. 1(4): 224-235.
Attwood T.K, M. Blythe, D.R. Flower, A. Gaulton, J.E. Mabey, N. Maudling, L. McGregor, A. Mitchell, G. Mouton, K. Paine, and P. Scordus. 2002. PRINTS and PRONTS-S shed light on protein ancestry. Nucleid Acid Research. 30(1) :239-241.
Cabrera C, Artacho R, Gime´nez R. 2006. Beneficial effects of green tea–areview. J Am Coll Nutr.25: 79–99.
Chang P, Wang J, Lee M, Chang S, Tsai T, Chang K, Tsai F, and Chen C. 2011. Lose weight with traditional chinese medicine? Potential supression of fat mass and obesity-associated protein. Journal of Biomoleculer Structure & Dynamics. 29(3): 471-483.
Dewi K. 2008. Pengaruh ekstrak teh hijau (Camellia sinensis var. Assamica) terhadap penurunan berat badan, kadar trigliserida dan kolesterol total pada tikus jantan galur wistar. Jurnal Kesehatan Masyarakat. 7(2):1-10.
15 Gerken T .2007. The obesity-associated FTO gene encodes a
2-oxoglutarate-dependent nucleic acid demethylase. Science. 318:1469-1472.
Han Z, Niu T, Chang J, Lei X, Zhao M, Wang Q, Cheng W, Wang J, Feng Y, Chai J. 2010. Crystal structure of the FTO protein reveals basis for its substrate specifity. Nature. 464 : 1205-1208.doi : 10.1038/nature08921.
Hermawan GA. 1991. Komplikasi obesitas dan usaha penanggulanganya. Cermin Dunia Kedokteran. 68: 39-41.
Herrera BM, Keildson S, Lindgren CM. 2011. Genetics and epigenetics of obesity. Maturitas. 69 :41-49.
[INBIO] Indonesian Institute of Bioinformatics. 2014. Molecular Docking. Malang (ID) : INBIO Pr.
Kroemer RT. 2003. Molecular modelling probes: docking and scoring. Biochemical Society Transactions. 31(5): 980-984.
Lins L, Brasseur R. 1995. The hydrophobic effect in protein folding. Faseb J. 9: 535-540.
Lipinski CA, Lombardo F, Dominy BW, Feeney PJ. 2012. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Advanced Drug Delivery Reviews. 64 : 4-17. doi : 10.1016/j.addr.2012.09.019.
Lipinski CA. 2000. Drug-like properties and the causes of poor solubility and poor permeability. Journal of Pharmacological and Toxicological Methods. 44:235-249. doi: 10.1016/S1056-8719(00)00107-6.
Nelson DL, Cox MM. 2008. Lehninger : Principles of Biochemistry 5th Edition. New York (US) : W.H Freeman and Company.
Reddy A, Pati S, Kumar P, Pradeep H, Sastry G. 2007. Virtual screening in drug
discovery: a computational perspective. Curr Prot & Peptide Sci. 8(4):329-351.
doi : 10.2174/138920307781369427.
Sharma NK, Jha KK, Priyanka. 2010. Molecular docking : an overview. J. Adv Sci. Res. 1:67-72.
Silitonga R.F. 2008. Daya inhibisi ekstrak daun jati belanda dan bangle terhadap aktivitas lipase pankreas sebagai antiobesitas [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Singh R, Chaturvedi N, Singh VK. 2012. In silico study of herbal compounds as novel MAO inhibitors for parkinsons disease treatment. Life Scie Phar Res. 2: 81-98.
Sousa SF, Fernandes PA, Ramos MJ. 2006. Protein-ligand docking: current status and future challenges. Proteins .65: 15–26. doi : 10.1002/prot.21082.
Sudeep HV, Shyam PK. 2014. Computational studies on the antiobesity effect of polyphenols from pomegranate leaf. Journal of Chemical and Pharmaceutical Research. 6(9):278-281.
Towaha J. 2013. Kandungan senyawa kimia pada daun teh (Camellia sinensis). Warta Penelitian dan Pengembangan Tanaman Industri. 19(3) :12.
16
Yang CS, Lambert JD, Ju J, Lu G, Sang S. 2007. Tea and cancer prevention: Molecular mechanisms and human relevance. Toxicology and Applied Pharmacology. 224: 265-273.doi :1 0.1016/j.taap.2006.11.024.
Yanuar A. 2012. Penambatan molekul : Praktek dan Aplikasi pada Virtual Screening. Depok (ID) : UI Pr.
17 Lampiran 1 Diagram alir penelitian
Pengambilan data struktur FTO dan ligan
Analisis permeabilitas & solubilitas ligan
Preparasi FTO dan ligan
Proses penambatan molekul dengan AutoDock Vina 1.5.6
Analisis hasil penambatan molekul (LigPlot 1.4.5)
Energi Bebas
18
Lampiran 2 Struktur 2D Protein FTO
Keterangan :
: Alfa heliks : loop
19 Lampiran 3 Posisi residu Arg-52 pada daerah motif Alfa Ketoglutarat
Dioksigenase FTO
20
21 Lampiran 5 Nilai ΔGligan dengan reseptor
22
Lampiran 5 Nilai ΔGligan dengan reseptor e. Epigallokatekin
Mode Affinity
(kcal/mol) Dist from rmsd l.b Best mode rmsd u.b.
1 -7.2 0.000 0.000
2 -7.2 21.306 23.227
3 -7.1 21.482 23.371
4 -7.1 1.203 3.203
5 -7.1 31.557 32.462
6 -6.9 21.559 23.941
7 -6.8 51.035 51.750
8 -6.6 42.069 43.395
9 -6.5 34.052 35.819
10 -6.4 65.167 67.280
11 -6.4 40.616 42.328
12 -6.3 48.797 49.752
13 -6.3 53.240 54.147
14 -6.3 52.869 53.660
15 -6.3 21.878 24.049
16 -6.3 39.663 40.818
17 -6.2 22.056 22.945
18 -6.2 35.955 37.487
19 -6.2 18.503 20.606
20 -6.1 41.512 43.394
Lampiran 6 Struktur 2D ligan uji dan ligan pembanding
Nama ligan Struktur
Orlistat
23
Epikatekin
Gallokatekin
24
RIWAYAT HIDUP
Penulis dilahirkan di Rantau Prapat, Sumatera Utara pada tanggal 1 Desember 1993 dari ayah Prasma Simamora dan ibu Riana Turnip. Penulis merupakan anak kedua dari 4 bersaudara. Pendidikan penulis dimulai dari SMAN 3 Slawi. Penulis lulus SMA tahun 2011 dan pada tahun yang sama lulus seleksi Peserta Beasiswa Bidik Misi Jalur SNMPTN Undangan IPB dengan memilih mayor Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis pernah melakukan Praktek Lapangan (PL) di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Jawa Barat selama periode Juli 2014 hingga Agustus 2014.