PENGEMBANGAN METODE ISOLASI TOTAL RNA, mRNA
DAN SINTESIS cDNA SENGON (
Falcataria moluccana
L.
Nielsen) YANG SEHAT DAN TERSERANG HAMA BOKTOR
(
Xystrocera festiva
)
ADE AYU DEWAYANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengembangan Metode Isolasi Total RNA, mRNA dan Sintesis cDNA Sengon (Falcataria moluccana L. Nielsen) yang Sehat dan Terserang Hama Boktor (Xystrocera Festiva) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ADE AYU DEWAYANI. Pengembangan Metode Isolasi Total RNA, mRNA dan Sintesis cDNA Sengon (Falcataria moluccana L. Nielsen) yang Sehat dan Terserang Hama Boktor (Xystrocera Festiva). Dibimbing oleh ULFAH JUNIARTI SIREGAR dan N. SRI HARTATI.
Sengon (Falcataria moluccana L. Nielsen) memiliki kemampuan alami untuk melindungi diri dari serangan hama dengan mensintesis makromolekul tertentu seperti tripsin inhibitor dan alfa amilase inhibitor. Karakterisasi gen-gen penyandi tripsin inhibitor tersebut perlu dilakukan antara pohon yang resisten dengan yang rentan untuk mengetahui perbedaannya guna menunjang pemuliaan pohon yang tahan hama. Penelitian ini bertujuan untuk mengembangkan metode isolasi RNA, mRNA dan sintesis cDNA yang tepat untuk jenis sengon yang memiliki kandungan enzim inhibitor. Bahan tanaman yang digunakan adalah jaringan kambium dan kayu dari pohon yang resisten dan rentan hama. Isolasi RNA total dilakukan dengan Total RNA Mini Kit dari Geneaid, isolasi mRNA dilakukan dengan PolyATract mRNA Isolation System III with Magnetic Stand
dari Promega, dan sintesis cDNA dilakukan menggunakan cDNA Substraction Kit dari
Clontech dan RevertAid RT Transcription Kit dari Thermo. Hasil RNA total yang terbaik yaitu sebesar 65,60ng/µl dihasilkan oleh metode modifikasi, selanjutnya hasil isolasi mRNA yang paling baik dihasilkan oleh metode modifikasi. Hasil sintesis cDNA yang terbaik yaitu sebesar 2296,17ng/µl dengan menggunakan metode modifikasi.
Kata kunci: sengon, isolasi RNA, sintesis cDNA
ABSTRACT
ADE AYU DEWAYANI. Developing Isolation Methods for Total RNA, mRNA and cDNA of Sengon (Falcataria moluccana L. Nielsen) which Resistent and Vulnerable to Stem Borer (Xystrocera Festiva). Supervised by ULFAH JUNIARTI SIREGAR and N. SRI HARTATI.
Sengon (Falcataria moluccana L. Nielsen) has a natural self-defense mechanism towards pest infection by synthesizing certain macromolecul such as tripsin inhibitor and alfa-amilase inhibitor. Characterization of those genes which produce the inhibitor need to be done on resistant trees and the vulnerable ones, to define the differences so that can be used for tree improvement. This research aim to develop an appropriate isolation methods of total RNA, mRNA and cDNA of plants that have a inhibitor enzymes such as sengon. The materials used in this research were cambium and timber tissue from resistant and vulnerable tree. Total RNA was isolated using Total RNA Mini Kit by Geneaid, mRNA was isolated using PolyATract mRNA Isolation System III with Magnetic Stand by Promega and cDNA synthesize was conducted using cDNA Substraction Kit by Clontech and RevertAid RT Transcription Kit by Thermo. The highest concentration of total RNA isolation were 65,60ng/µl from modification methods, and the best mRNA yields was resulted by modification methods. The highest concentration for cDNA synthesize were 2296,17ng/µl from modification methods.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
PENGEMBANGAN METODE ISOLASI TOTAL RNA, mRNA
DAN SINTESIS cDNA SENGON (
Falcataria moluccana
L.
Nielsen) YANG SEHAT DAN TERSERANG HAMA BOKTOR
(
Xystrocera festiva
)
ADE AYU DEWAYANI
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2014 ini ialah pengembangan metode isolasi total RNA, mRNA dan sintesis cDNA, dengan judul Pengembangan Metode Isolasi Total RNA, mRNA dan Sintesis cDNA Sengon (Falcataria moluccana L. Nielsen) yang Sehat dan Terserang Hama Boktor (Xystrocera Festiva).
Terima kasih penulis ucapkan kepada Dr Ir Ulfah Juniarti Siregar, M.Agr dan Dr. N Sri Hartati selaku dosen pembimbing. Di samping itu, penghargaan penulis sampaikan kepada keluarga besar Laboratorium Genetika Molekuler dan Modifikasi Jalur Biosintesis Tanaman – Pusat Penelitian Bioteknologi. Ungkapan terima kasih juga disampaikan kepada Mama serta kakak-kakak tercinta Sari, Wulan, dan Astri atas cinta, semangat, dukungan dan kepercayaannya kepada penulis. Selain itu penulis juga mengucapkan terima kasih kepada Lody, Arry, Dewi, Dhita, Arni, Nitha, Artha, Gusti, Dery dan segenap keluarga besar Silvikultur 46 untuk kesabaran dan dukungannya, juga kepada Pipit, Memet dan (almh) Rai rekan satu bimbingan atas semangatnya untuk menyelesaikan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
METODE PENELITIAN 4
Bahan dan Alat 4
HASIL DAN PEMBAHASAN 9
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 21
DAFTAR TABEL
1 Matriks variasi komposisi total RNA yang digunakan pada metode
modifikasi sintesis cDNA. 8
2 Perbadingan metode kontrol dan metode modifikasi dari tiap prosedur 8 3 Hasil pengukuran pada Genequant Pro sampel RNA dengan metode
kontrol. 13
4 Hasil pengukuran pada Genequant Pro sampel RNA dengan metode
modifikasi. 13
5 Hasil pengukuran pada Spectrophotometer sampel cDNA dengan
metode kontrol. 17
6 Hasil pengukuran pada Spectrophotometer sampel cDNA dengan
metode modifikasi. 18
DAFTAR GAMBAR
1 Proses reverse transcription yang dapat menghasilkan sekuens DNA
dari templat mRNA. 2
2 Bagan alur tahapan kerja dalam proses kloning sekuens cDNA. 4 3 Hasil elektroforesis RNA dengan Metode Kontrol. (SK= kayu dari
pohon sehat, SC= kambium dari pohon sehat, BK= kayu dari pohon
sakit, BC= kambium dari pohon sakit). 10
4 Hasil elektroforesis RNA dengan Metode Kontrol dari bagian kambium pohon sehat (SC) dan bagian kambium pohon sakit (BC). 11 5 Hasil elektroforesis RNA dengan Metode Modifikasi pada bagian
kambium dari pohon sehat (SC) dengan nomor tube 25-35. 12 6 Hasil elektroforesis RNA dengan Metode Modifikasi pada bagian
kambium dari pohon sakit (BC) dengan nomor tube 10-15. 12 7 Hasil elektroforesis mRNA dengan Metode Kontrol dan Metode
Modifikasi. 15
8 Ilustrasi sintesis cDNA. 16
9 Hasil elektroforesis cDNA dengan menggunakan kit RevertAid RT
Transcription Kit (Thermo). 17
DAFTAR LAMPIRAN
1 Protokol Isolasi Total RNA Mini Kit (Geneaid) 21 2 Protokol PolyATract mRNA Isolation System III with Magnetic Stand
(Promega) 22
PENDAHULUAN
Latar Belakang
Sengon (Falcataria moluccana L. Nielsen) adalah salah satu jenis pohon yang paling banyak dikembangkan dalam program pembangunan hutan tanaman dan hutan rakyat, khususnya di Pulau Jawa. Sengon adalah jenis cepat tumbuh (fast growing species), kayunya juga memiliki beragam manfaat antara lain dapat digunakan sebagai bahan dasar industri pulp dan kertas, konstruksi bangunan, papan serat, papan partikel, korek api dan kayu bakar. Masalah yang biasa dihadapi dalam pembangunan hutan sengon adalah serangan hama boktor, yang dapat menyebabkan kematian pada individu pohon (Atmosuseno 1998). Pengendalian hama boktor dapat dilakukan secara fisik/mekanik, silvikultur, hayati, kimiawi dan pengendalian terpadu.
Sengon memiliki kemampuan alami untuk melindungi diri dari serangan hama dengan mensintesis makromolekul tertentu seperti tripsin inhibitor dan alfa amilase inhibitor. Tripisin inhibitor adalah senyawa yang mempunyai kemampuan untuk menghambat aktivitas proteolitik enzim tripsin sehingga mengganggu proses pencernaan protein pada larva hama. Senyawa alfa amilase inhibitor menghambat kerja enzim yang mengubah karbohidrat rantai panjang menjadi molekul yang lebih sederhana untuk dapat diolah menjadi pasokan energi (Siregar 2011). Gen-gen yang berperan menghasilkan senyawa-senyawa inhibitor tersebut adalah gen TI dan AAI. Kedua gen tersebut telah banyak dipelajari dalam bidang peningkatan resistensi tanaman lain terhadap hama. Gen-gen tersebut dapat dipakai sebagai sarana untuk memindahkan sifat resistensi hama tertentu dari suatu tanaman ke tanaman lain melalui rekayasa genetik (Tampang 2012).
Melalui pendekatan biologi molekuler dapat diterapkan proses pemuliaan pohon dengan cara melakukan seleksi menggunakan penanda molekuler. Penanda yang paling tepat digunakan untuk menguji sifat genetik yang dapat diwariskan ke generasi berikutnya adalah penanda molekuler. Penanda molekuler dengan menggunakan DNA genom sengon diperoleh dengan menandai utas DNA yang berkaitan dengan ketahanan terhadap boktor, kemudian utas DNA tersebut diisolasi serta diklon untuk keperluan lebih lanjut. Namun, tidak semua penanda molekuler berbasis DNA genom terkait langsung dengan gen yang bertanggung jawab terhadap ketahanan terhadap boktor. Untuk itu diperlukan pendekatan lain guna menemukan gen yang bertanggung jawab untuk ketahanan terhadap boktor yaitu dengan menggunakan RNA (Hilis 1987).
2
molekul akan memiliki grup fosfat yang bebas sedangkan ujung 3’ memiliki gugus hidroksil yang bebas.
Gambar 1. Proses reverse transcription yang dapat menghasilkan sekuens DNA dari templat mRNA. (diambil dari Module 2 Genetic Engineering mrothery.co.uk)
Pada molekul dengan untai ganda seperti DNA, ikatan gula-fosfat yang ditemukan berbentuk anti-paralel, dengan dua untai nukleotida yang terikat pada arah berlawanan. Basa nitrogen adalah komponen yang sangat penting pada fungsi penyandian di asam nukleat. Basa nitrogen yang terdapat pada DNA adalah adenin (A), guanin (G), sitosin (C), dan timin (T). Pada RNA, basa timin digantikan keberadaannya oleh basa urasil (U) dengan fungsi yang setara. Senyawa adenin dan guanin tergolong sebagai purin yaitu senyawa yang memiliki struktur cincin ganda, sedangkan sitosin dan timin/urasil tergolong sebagai pirimidin yaitu senyawa dengan struktur cincin tunggal (Nicholl 1994).
Penentuan bahan dasar yang tepat dalam pekerjaan yang berkaitan dengan molekuler sangatlah penting. Sebagai contoh, penggunaan DNA genom dalam ukuran yang besar untuk mengisolasi suatu gen yang spesifik adalah langkah yang kurang tepat. Oleh karena itu, penggunaan mRNA lebih disarankan untuk mengisolasi suatu gen yang spesifik. RNA berada dalam bentuk yang sangat mudah terdegradasi, maka perlu teknik penanganan khusus supaya RNA yang dihasilkan memiliki kualitas tinggi, sehingga mRNA yang digunakan sebagai bahan dasar suatu klon dari gen spesifik juga berkualitas.
Karakterisasi gen-gen penyandi TI atau AAI dapat dilakukan dengan membandingkan mRNA dari tanaman yang resisten dengan tanaman yang rentan terhadap hama, untuk selanjutnya dibuat DNA komplementer yang tahan terhadap serangan hama boktor (Hartati 2002). DNA komplementer (cDNA) merupakan DNA yang disintesis dari templat mRNA dalam reaksi yang dikatalis oleh enzim reverse transcriptase seperti ilustrasi yang digambarkan pada Gambar 1. Ekspresi sebuah gen dilakukan melalui produksi mRNA gen tersebut yang kemudian diterjemahkan menjadi protein tertentu, dengan demikian maka cDNA merupakan salinan ekspresi dari sebuah gen.
3 untai ganda RNA dapat ditemukan pada daerah komplementer. RNA terdiri dari dua jenis yaitu RNA yang berhubungan dengan ekspresi gen dan RNA yang tidak berhubungan dengan ekspresi gen (Hartati 2002). Pada RNA yang berhubungan dengan ekspresi gen terdapat tiga tipe yaitu messenger RNA (mRNA), ribosomal RNA (rRNA), dan transfer RNA (tRNA). Tipe yang paling melimpah pada total sel RNA adalah rRNA yaitu sebanyak 85%, hal tersebut terkait dengan fungsi ribosom yang berperan penting pada proses translasi. Kelimpahan tRNA pada total RNA yaitu sebanyak 10% dan berfungsi sebagai penyeleksi asam amino yang tepat untuk disisipkan ke dalam protein yang sedang disintesis. mRNA diberikan nama sesuai dengan tugasnya yaitu untuk membawa informasi genetik dari DNA ke mesin translasi (rRNA) dan biasanya hanya terdapat sekitar 5% dari jumlah keseluruhan total RNA (Nicholl 1994). Pada umumnya mRNA sangat tidak stabil terutama pada suhu tinggi dan senyawa alkali, mRNA prokariot memiliki masa hidup hanya sekitar 3 menit, sebaliknya mRNA eukariot cenderung lebih stabil dengan masa hidup >10 jam namun ada pula yang hanya memiliki masa hidup sekitar 30 menit atau selama protein yang disandikan masih diproduksi (Albert et al 1989).
RNA juga mudah terdegradasi oleh RNase yang adalah sebuah enzim yang dapat memutus ikatan 3’-O-P pada RNA. Oleh karena itu pada saat mengisolasi RNA, aktivitas RNase harus dihambat dengan senyawa 8-hydroxyquinolin atau dengan cara memanaskan peralatan yang digunakan selama proses isolasi di autoklaf suhu C (Hartati 2002). Ketidakstabilan molekul RNA mengharuskan adanya strategi lain dalam penelitian molekuler yaitu pembuatan cDNA dari RNA agar lebih mudah ditangani dalam proses selanjutnya seperti reverse transcription polymerase chain reaction (RT-PCR), pustaka cDNA, dan ekspresi gen microarray (Tattersal 2005).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengembangkan metode isolasi total RNA, mRNA, serta sintesis cDNA sengon dari pohon yang sehat maupun yang terserang hama boktor yang dapat digunakan untuk penelitian identifikasi gen penyandi ketahanan terhadap hama boktor.
Manfaat Penelitian
4
METODE PENELITIAN
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Genetika Molekuler dan Modifikasi Jalur Biosintesis Tanaman – Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Kabupaten Bogor. Penelitian dilakukan mulai bulan Maret-September 2014 dan November 2014-Januari 2015.
Bahan dan Alat
Bahan yang digunakan untuk percobaan adalah jaringan kayu dan kambium dari pohon sengon yang sehat dan terserang hama boktor. Pohon sengon yang digunakan berasal dari kebun Kebun Plasma Nutfah – Pusat Bioteknologi LIPI dengan tegakan yang sama untuk setiap percobaan. Selain itu digunakan juga bahan-bahan untuk isolasi RNA (Total RNA Mini Kit dari Geneaid®), isolasi mRNA (PolyATract mRNA Isolation System III with Magnetic Stand dari Promega®), elektroforesis, pengecekan konsentrasi, dan sintesis 1st cDNA (cDNA Substraction Kit dari Clontech® dan RevertAid RT Transcription Kit dari Thermo®). Alat yang digunakan antara lain microtube, alu, mortar, mikro pipet Eppendorf Research Plus, centrifudge Eppendorf 5430R, timbangan analitik, vorteks, thermal cycler Techne TC-5000, Wise Clean Waterbath, perangkat elektroforesis, UV transilluminator.
Prosedur Pelaksanaan
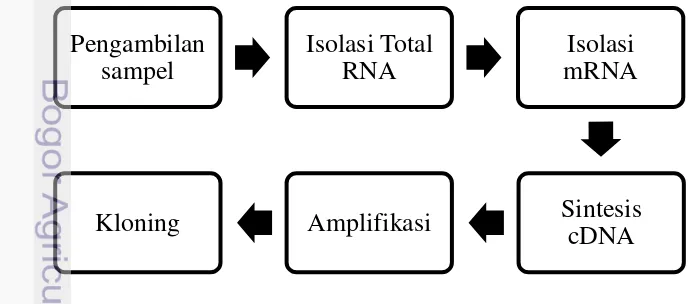
Penelitian terdiri dari isolasi total RNA dari jaringan kambium pohon sengon yang sehat dan yang terinfeksi penyakit boktor, isolasi mRNA dan sintesis cDNA. Gambar 2 menunjukkan bagan alur tahapan-tahapan percobaan untuk pembuatan sekuens cDNA.
Gambar 2. Bagan alur tahapan kerja dalam proses kloning sekuens cDNA.
5 Pengambilan Sampel
Sampel yang diambil berupa jaringan kambium segar yang segera diambil atau dipisahkan dari potongan kayu sengon dari pohon yang sehat dan pohon yang terserang hama boktor. Cara penanganan sampel kayu sebelum pemisahan kambium adalah dengan cara dimasukkan ke dalam plastik dan disimpan di coolbox berisi es. Sebelum sampel jaringan diambil, dilakukan dahulu pengamatan mengenai pohon yang benar-benar sehat dan pohon yang benar-benar mengalami serangan hama. Setelah diambil dari pohon, dalam jangka waktu antara 30-60 menit jaringan yang diambil harus segera digunakan dan diproses untuk menghindari degradasi RNA dalam sel sehingga diperoleh total RNA dengan kualitas yang tinggi.
Isolasi Total RNA
Metode Kontrol (Sesuai Protokol Total RNA Mini Kit dari Geneaid)
Isolasi total RNA dilakukan dengan menggunakan Total RNA Mini Kit dari Geneaid. Persiapan yang dilakukan adalah membersihkan area meja yang akan digunakan dengan menggunakan semprotan alkohol 70%. Alat penggerus (mortar dan alu) yang akan digunakan harus sudah disterilisasi. Alat penggerus disemprotkan dengan RNase Inhibitor kemudian diamkan sampai benar-benar kering dengan cara dianginkan, hindari melakukan pengusapan dengan tisu. Tujuannya adalah untuk menghilangkan kontaminasi RNA yang kemungkinan menempel pada alat yang digunakan.
Lisis
Microtube berukuran 2ml diisi dengan 500µl RB Buffer ditambah 5µl ß-merkaptoetanol. Bahan sampel kambium sebanyak 50-100mg digerus dengan menggunakan nitrogen cair. Penggerusan dilakukan hingga sampel berbentuk bubuk dengan berupa butiran halus. Selanjutnya bubuk sampel dimasukkan ke dalam tube yang sudah berisi campuran RB buffer dan ß-merkaptoetanol. Tube tersebut kemudian diinkubasi selama 10 menit di dalam es. Setelah inkubasi selesai, larutan sampel divorteks dengan tujuan untuk menghomogenkan larutan, kemudian larutan dipindahkan ke tube baru yang telah dipasangi Filter Column. Larutan disentrifuse selama 10 menit dengan kecepatan 5000 rpm pada suhu 4°C.
Pengikatan RNA
Setelah sentrifugasi selesai, Filter Column dibuang dan ditambahkan 250 µl ethanol absolut ke dalam larutan yang telah disentrifuse, kemudian seluruhnya dipindahkan ke dalam RB Column. Larutan disentrifuse kembali selama 2 menit dengan kecepatan 12000 rpm pada suhu 4°C. Larutan sisa yang berada di bawah microtube dibuang.
Pencucian
400 µl W1 Buffer ditambahkan tepat ke tengah RB column. Larutan kemudian disentrifuse lagi selama 2 menit dengan kecepatan 12000 rpm pada suhu 4°C. Larutan yang berada di bawah microtube dibuang, kemudian ditambahkan 500 µl Wash Buffer tepat ke tengah RB column. Larutan disentrifuse selama 3 menit dengan kecepatan 12000 rpm pada suhu 4°C.
Elusi
6
kecepatan 12000 rpm pada suhu 4°C. Pindahkan larutan total RNA ke tube yang baru untuk disimpan maupun dilakukan pengecekan elektroforesis.
Metode Modifikasi
Isolasi total RNA dilakukan dengan menggunakan Total RNA Mini Kit dari Geneaid, secara umum langkah yang dilakukan sama dengan metode kontrol. Beberapa perubahan yang dilakukan adalah waktu inkubasi bubuk sampel di dalam campuran 500 µl RB Buffer ditambah 5 µl ß-merkaptoetanol dilakukan lebih lama yaitu 30 menit di dalam es. Hal tersebut dilakukan dengan tujuan supaya proses lisis dapat berlangsung dengan lebih sempurna sehingga hasil akhir total RNA yang diperoleh akan lebih banyak. Modifikasi yang berikutnya adalah jangka waktu inkubasi RB collumn dengan RNase Free Water dilakukan selama 10-15 menit di dalam es. Hal tersebut dilakukan dengan tujuan supaya RNA yang tertinggal di RB collumn dapat seluruhnya larut dalam RNase Free Water. Perbandingan antara metode kontrol dan metode modifikasi pada isolasi total RNA dapat dilihat di Tabel 1.
Isolasi mRNA
Setelah RNA total diperoleh, selanjutnya dilakukan isolasi mRNA atau poly A+ RNA dengan menggunakan kit PolyATract mRNA Isolation System III with Magnetic Stand dari Promega.
Metode Kontrol (Sesuai dengan Protokol PolyATract mRNA Isolation System III with Magnetic Stand dari Promega)
Annealing
Isolasi diawali dengan proses anealing, campuran kurang lebih 200µl total RNA dengan RNase freewater dengan total volume 500µl dipanaskan menggunakan water bath dengan suhu 65ºC selama 10 menit. Sebanyak 3µl Biotinylated-oligo (dT) Probe dan 13µl 20X Saline Sodium Citrate (SSC) ditambahkan ke dalam larutan total RNA. Larutan diinkubasi pada suhu ruang sampai dingin.
Pencucian Partikel Streptavidin Paramagnetic Particles (SA-PMP)
SA-PMP partikel yang terdapat dalam kit disuspesikan sampai tercampur rata, kemudian tangkap partikel dengan Magnetic Stand dan buang supernatannya. SA-PMP partikel dicuci dengan 300µl 0,5X SSC sebanyak 3 kali, pada setiap pencucian buang supernatan secara hati-hati. Setelah pencucian terakhir, SA-PMP partikel disuspensikan dalam 100µl 0,5X SSC.
Pengikatan mRNA
7 Elusi
SA-PMP partikel yang sudah mengandung mRNA dicampurkan dengan 100µl RNase free water, kemudian SA-PMP partikel ditangkap dengan Magnetic Stand, RNase free water yang sudah mengandung partikel mRNA diambil dan pindahkan ke microtube baru. SA-PMP partikel dapat dielusi ulang dengan menggunakan 150µl RNase free water kemudian ulangi tahap pengambilan RNase free water yang sudah mengandung mRNA dari partikel SA-PMP.
Metode Modifikasi
Isolasi dilakukan dengan menggunakan kit PolyATract mRNA Isolation System III with Magnetic Stand dari Promega. Secara umum metode yang dilakukan menyerupai metode kontrol, hanya dilakukan beberapa perubahan di bagian tertentu. Perubahan pertama dilakukan terhadap proses anealing, campuran total RNA dengan RNase Free Water dengan total volume 500µl tidak dipanaskan, namun langsung ditambahkan 3 µl Biotinylated-oligo(dT) probe dan 13 µl 20X SSC dan diinkubasi di dalam es. Langkah berikutnya sama dengan langkah pencucian pada Metode Kontrol. Perubahan berikutnya dilakukan terhadap proses elusi, partikel SA-PMP yang sudah mengandung mRNA diinkubasi selama 2-3 menit dengan 50 µl RNase Free Water baru setelah itu ditangkap menggunakan magnetic stand dan supernatannya dimasukkan ke dalam microtube baru yang steril. Proses elusi ulang dilakukan dengan 100 µl RNase Free Water diinkubasi selama 2-3 menit di dalam es, kemudian partikel SA-PMP ditangkap menggunakan magnetic stand dan supernatannya dimasukkan ke dalam microtube baru yang steril. Perbandingan antara metode kontrol dan metode modifikasi isolasi mRNA dapat dilihat di Tabel 2.
Sintesis cDNA dari mRNA
Setelah mRNA diperoleh dari proses isolasi, dalam waktu kurang dari 60menit untuk segera diakukan proses selanjutnya dari tahapan kloning yaitu sintesis cDNA utas pertama. Sintesis cDNA akan dibedakan menjadi dua metode yaitu metode kontrol dengan menggunakan pereaksi SSH (Suppression Subtractive Hybridization) Kit dan metode modifikasi dengan menggunakan pereaksi RevertAid RT Reverse Transcription Kit dari Thermo.
Metode Kontrol (Sesuai dengan cDNA Substraction Kit dari Clontech)
Sintesis diawali dengan inkubasi campuran 2-3 µl mRNA dan 1 µl cDNA sintesis primer pada thermal cycler selama 2 menit dengan suhu 700C. Setelah itu campuran didinginkan dan ditambahkan reagen 5X First-Strand Buffer (2 µl); Deuxynucleotide (dNTP) mix 10 mM (1 µl); H20 steril (1 µl); DTT 20 mM (1 µl); Reverse Transcriptase (1 µl). Campuran mRNA dan reagen dihomogenkan dengan menggunakan vorteks kemudian diinkubasi kembali pada suhu 420C selama 90 menit pada thermal cycler. Setelah proses inkubasi selesai, larutan disimpan di es dengan tujuan untuk menghentikan sintesis cDNA utas pertama. Metode Modifikasi (RevertAid RT Reverse Transcription Kit dari Thermo)
8
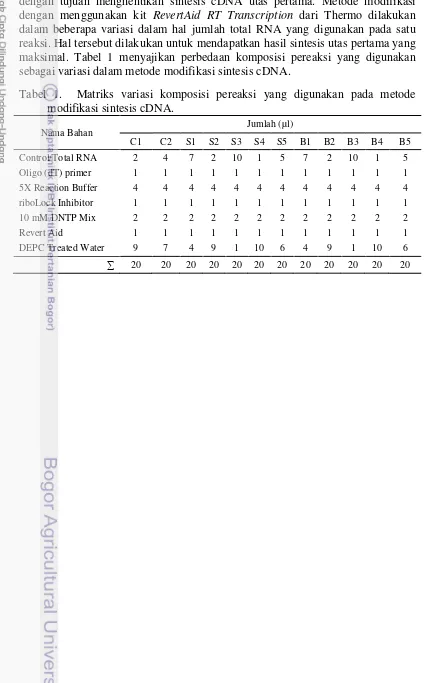
berurutan. Larutan tersebut diinkubasikan pada thermal cycler dengan suhu 420C selama 60 menit dan suhu 700C selama 5 menit. Kemudian larutan disimpan di es dengan tujuan menghentikan sintesis cDNA utas pertama. Metode modifikasi dengan menggunakan kit RevertAid RT Transcription dari Thermo dilakukan dalam beberapa variasi dalam hal jumlah total RNA yang digunakan pada satu reaksi. Hal tersebut dilakukan untuk mendapatkan hasil sintesis utas pertama yang maksimal. Tabel 1 menyajikan perbedaan komposisi pereaksi yang digunakan sebagai variasi dalam metode modifikasi sintesis cDNA.
Tabel 1. Matriks variasi komposisi pereaksi yang digunakan pada metode modifikasi sintesis cDNA.
Nama Bahan Jumlah (µl)
C1 C2 S1 S2 S3 S4 S5 B1 B2 B3 B4 B5 Control/Total RNA 2 4 7 2 10 1 5 7 2 10 1 5 Oligo (dT) primer 1 1 1 1 1 1 1 1 1 1 1 1 5X Reaction Buffer 4 4 4 4 4 4 4 4 4 4 4 4 riboLock Inhibitor 1 1 1 1 1 1 1 1 1 1 1 1 10 mM DNTP Mix 2 2 2 2 2 2 2 2 2 2 2 2 Revert Aid 1 1 1 1 1 1 1 1 1 1 1 1 DEPC Treated Water 9 7 4 9 1 10 6 4 9 1 10 6
9 Tabel 2. Perbandingan metode kontrol dan metode modifikasi dari tiap prosedur
Isolasi Total RNA Isolasi mRNA Sintesis cDNA
10
HASIL DAN PEMBAHASAN
Isolasi RNA
Pengukuran kuantitas dan kualitas RNA dapat dilakukan melalui beberapa metode seperti: penampakan pita RNA pada gel agarose, penyerapan cahaya pada 260/280 nm, penyerapan cahaya pada 260/230 nm, kemampuan untuk menghasilkan produk RT-PCR, dan menggunakan bioanalyzer. Penelitian ini menggunakan dua metode untuk mengukur kuantitas dan kualitas RNA yang dihasilkan yaitu metode visual dan metode spektofotometri. RNA dengan kualitas tinggi akan menghasilkan dua atau lebih pita RNA yang jelas terlihat, tergantung berapa lama waktu yang digunakan pada proses elektroforesis sehingga dapat memisahkan rRNA 16S dari 23S dan18S dari 28S (Tattersal 2005).
M SK SC BK 1 BK 2 BC
Gambar 3. Hasil elektroforesis RNA dengan Metode Kontrol. (SK= kayu dari pohon sehat, SC= kambium dari pohon sehat, BK= kayu dari pohon sakit, BC= kambium dari pohon sakit).
Sampel yang digunakan pada isolasi total RNA sengon adalah jaringan kambium pohon sengon yang sehat dan yang terkena serangan hama boktor. Hal tersebut dilakukan untuk memperoleh untai RNA yang secara spesifik menunjukkan ekspresi gen terhadap serangan hama yang terjadi di bagian batang pohon. Pada awalnya isolasi dilakukan dengan menggunakan sampel jaringan kayu dan kambium namun hasil elektroforesis menunjukkan bahwa pita RNA yang berasal dari jaringan kambium lebih jelas dibandingkan pita RNA dari jaringan kayu. Hal tersebut disebabkan karena jaringan kayu memiliki struktur yang cenderung lebih sulit untuk dihancurkan dan pada umumnya sel-sel pada jaringan kayu sudah mati sehingga kandungan RNA dan DNA hanya terdapat dalam jumlah yang sangat sedikit. Hasil penyaringan melalui filter kolom pada jaringan kayu juga menghasilkan lebih banyak ampas yang berlendir, hal tersebut mengindikasikan bahwa pada jaringan kayu lebih banyak mengandung polisakarida dan zat metabolit sekunder.
12
polimerase; menghambat seleksi poly(A)+-RNA (mRNA); dan juga mengganggu migrasi RNA saat dilakukan running elektroforesis. Selain polisakarida, senyawa bawaan dari tanaman berkayu yang dihasilkan selama proses isolasi RNA adalah senyawa fenolik dan metabolit sekunder yang dapat mempengaruhi proses isolasi RNA dan percobaan lanjutan yang menggunakan total RNA. Terdapat beberapa cara untuk mengatasi hal tersebut, salah satunya adalah menggunakan senyawa pereduksi seperti ß-merkaptoetanol dan dithithreitol (DTT) yang dapat mencegah oksidasi senyawa fenolik sehingga menghambat aktifitas radikal bebas yang dihasilkan oleh oksidasi senyawa fenol terhadap asam nukleat (Wilkins dan Smart, 1996).
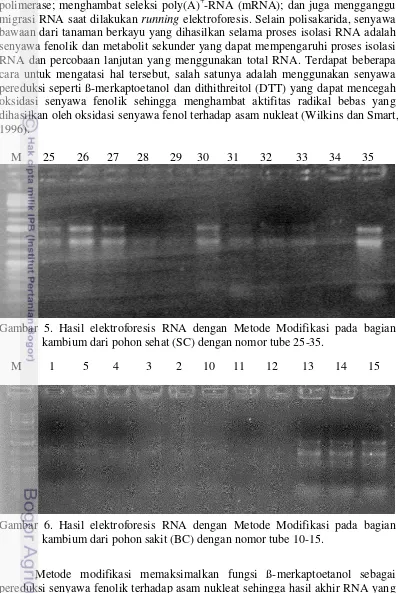
M 25 26 27 28 29 30 31 32 33 34 35
Gambar 5. Hasil elektroforesis RNA dengan Metode Modifikasi pada bagian kambium dari pohon sehat (SC) dengan nomor tube 25-35.
M 1 5 4 3 2 10 11 12 13 14 15
Gambar 6. Hasil elektroforesis RNA dengan Metode Modifikasi pada bagian kambium dari pohon sakit (BC) dengan nomor tube 10-15.
13 saat proses isolasi berlangsung, namun jaringan yang digunakan berasal dari pohon yang sama. Berdasarkan pengendapan RNA pada agarose, sampel yang menghasilkan pita RNA paling bagus adalah sampel jaringan kambium dari pohon sengon sehat yang menggunakan metode modifikasi. Walaupun diisolasi secara bersamaan, namun hasil pita di agarose tidak secara keseluruhan sama.
Kualitas RNA juga dapat diukur menggunakan penyerapan cahaya dengan menggunakan alat spektrofotometer, data yang dihasilkan adalah penyerapan cahaya pada panjang gelombang 230, 260, 280, 320 dan konsentrasi RNA. Rasio A260/280 mengindikasikan tingkat kontaminasi protein berdasarkan teori yang menyatakan bahwa asam nukleat menunjukkan penyerapan optimum pada 260 nm, sedangkan protein menunjukkan penyerapan maksismum pada 280 nm (Winfrey et al. 1997). Oleh karena itu semakin besar nilai rasio A260/280 maka kemurnian RNA yang dihasilkan semakin tinggi. Rasio A260/230 menunjukkan tingkat kontaminasi dari polisakarida dan polifenol. Nilai rasio 2.5 adalah nilai yang menunjukkan tidak adanya kontaminasi (Loulakakis et al. 1996, Schultz et al. 1994). Pengukuran kualitas RNA dengan parameter rasio A260/280, A260/230 serta konsentrasi RNA dilakukan dengan menggunakan Genequant Pro dengan pelarut berupa RNase free water, hasil dari pengukuran tersebut dapat ditemukan pada Tabel 3 dan 4.
14 memiliki rata-rata konsentrasi sebesar 30,60 ng/µl pada metode kontrol dan 65,60 ng/µl pada metode modifikasi. Rata-rata tingkat kemurnian (A260/280) yang paling tinggi terdapat pada sampel jaringan kambium pohon sakit dengan metode modifikasi yaitu sebesar 2,36. Sedangkan untuk tingkat kontaminasi (A260/230) yang paling bebas dari kontaminasi polisakarida adalah sampel jaringan kambium pohon sehat dengan metode kontrol yaitu senilai 0,92.
Isolasi mRNA
15 M 14-1 14-2 M 35-1 35-2 35-A
Gambar 7. Hasil elektroforesis mRNA dengan Metode Kontrol (a) dan Metode Modifikasi (b).
Gambar 7a menunjukkan hasil isolasi mRNA dengan kit PolyATract mRNA Isolation System III with Magnetic Stand dari Promega dengan metode kontrol. Terdapat 3 sumur yang digunakan, terdiri dari (secara berurutan) Gene Ruler 1kb (M), elusi 100 µl RNase free water (14-1), dan elusi 150 µl RNase free water (14-2). Pada foto hasil elektroforesis tidak nampak pita yang merepresentasikan keberadaan mRNA. Selanjutnya pada gambar 7b menunjukkan hasil isolasi mRNA dengan metode modifikasi. Terdapat 4 sumur yang digunakan, terdiri dari (secara berurutan) Gene Ruler 1kb (M), elusi 50 µl RNase free water (35-1), elusi 100 µl RNase free water (35-2), dan supernatan dari proses annealing (35-A). Terlihat bahwa mRNA dari elusi pertama maupun elusi kedua terlihat sangat kabur (smear), namun larutan annealing menunjukkan seutas pita yang terlihat menyerupai pita RNA total yang mengindikasikan bahwa masih terdapat RNA total yang berkualitas pada larutan annealing.
Salah satu hal kesulitan utama dalam proses isolasi mRNA adalah kelimpahan mRNA yang hanya berkisar 5% dari total RNA sehingga membutuhkan teknik dan tingkat akurasi yang sangat tinggi selama penanganan bahan mentah maupun alat-alat pendukung proses isolasi. Selama proses isolasi mRNA seluruh alat yang digunakan harus dipastikan steril dan terbebas dari kontaminasi RNase yang dapat mendegradasi mRNA secara cepat. Terdapat perbedaan yang sangat nyata dari kenampakan pita mRNA dengan metode kontrol dan modifikasi pada agarose, hal tersebut terjadi karena pada metode kontrol proses annealing dilakukan pada suhu 65°C sedangkan pada metode modifikasi proses annealing dilakukan pada suhu ruang. Hasil isolasi mRNA yang kurang begitu nampak pada agarose juga menunjukkan bahwa konsentrasi dari RNA total harus ditingkatkan supaya mendapatkan hasil pita mRNA yang jelas. Pada hasil isolasi mRNA tidak dilakukan pengecekan dengan spektofotometer dikarenakan selama proses penelitian hasil mRNA langsung digunakan untuk tahapan sintesis cDNA yang harus dilakukan secepatnya mengingat masa hidup mRNA yang sangat singkat.
16
Sintesis cDNA
Gambar 8. Ilustrasi sintesis cDNA. (Sumber: monografias.com)
Pada proses kloning gen dengan menggunakan DNA komplementer, mRNA harus dikonversi terlebih dahulu sebelum dimasukkan ke dalam vektor (Gambar 8). Hal tersebut dapat terjadi oleh keberadaan enzim reverse transkriptase yang dapat menghasilkan cDNA (DNA komplementer). Walaupun rantai poly(A) dari mRNA sering digunakan sebagai dasar dalam sintesis cDNA, terkadang ada beberapa kasus yang membuat hal tersebut tidak dapat terjadi. Hal-hal tersebut adalah ketika mRNA tidak dalam bentuk polyadenylated maka primer oligonukleotid random dapat digunakan sebagai dasar pembuatan cDNA, atau ketika seluruh/sebagian sekuen asam amino dari protein yang dibutuhkan telah diketahui maka primer oligonukleotid yang spesifik dapat digunakan sebagai dasar pembuatan cDNA (Nicholl 1994).
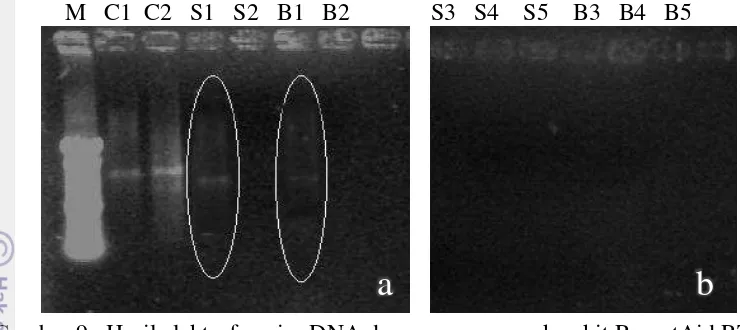
17 M C1 C2 S1 S2 B1 B2 S3 S4 S5 B3 B4 B5
Gambar 9. Hasil elektroforesis cDNA dengan menggunakan kit RevertAid RT Transcription Kit dari Thermo.
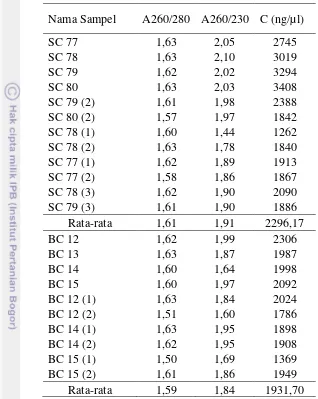
Pada metode modifikasi, telah dilakukan beberapa variasi dengan tujuan untuk mendapatkan hasil sintesis cDNA yang maksimal. Variasi yang dilakukan adalah merubah kuantitas total RNA yang digunakan pada setiap sintesis, seperti yang telah dicantumkan pada tabel 1. Berdasarkan kenampakan pita cDNA pada agarose, diketahui bahwa sampel yang menggunakan total RNA sebanyak 7µl menghasilkan gambaran fisik pita cDNA yang lebih jelas dibandingkan yang lainnya. Pada Gambar 9a terlihat bahwa reaksi dengan kontrol RNA (C1 dan C2) menghasilkan pita yang sangat jelas, hal tersebut mengindikasikan bahwa reaksi berlangsung dengan baik di mana semua pereaksinya masih bekerja. Sedangkan untuk reaksi yang menggunakan total RNA hasil isolasi hanya terlihat pita cukup jelas pada reaksi S1 (7µl total RNA dari kambium pohon sehat) dan B1 (7µl total RNA dari kambium pohon sakit). Kualitas cDNA yang tergambar melalui pengendapan pada agarose tidak terlihat sejelas pita RNA pada agarose, hal tersebut dapat disebabkan karena materi genetik yang terkandung dalam cDNA semakin spesifik dan jumlahnya pun semakin sedikit. Tabel 5 dan 6 menyajikan konsentrasi cDNA yang diukur dengan spectrophotometer.
Tabel 5. Hasil pengukuran pada Spectrophotometer sampel cDNA dengan metode kontrol.
Nama Sampel A260/280 A260/230 C (ng/µl)
SC 4 1,54 1,88 1852
SC 5 1,54 1,91 1822
BC 4 1,59 1,77 1932
SC 5 1,61 1,93 2002
Rata-rata 1,57 1,87 1902
18
19
SIMPULAN DAN SARAN
Simpulan
Jaringan yang terbaik untuk isolasi RNA total sengon resisten dan rentan boktor adalah jaringan kambium. Modifikasi prosedur dari protokol asli pada kit komersial yang digunakan untuk isolasi RNA total, mRNA dan sintesis cDNA dapat memberikan hasil yang lebih baik. Kualitas RNA yang tergambar pada hasil elektroforesis metode modifikasi lebih jelas, begitupun konsentrasi RNA yang dihasilkan oleh metode modifikasi rata-rata lebih tinggi yaitu sebesar 65,60 ng/µl dibandingkan metode kontrol sebesar 30,60 ng/µ l. Hal yang serupa juga terlihat dari hasil elektroforesis isolasi mRNA metode modifikasi menunjukkan pita mRNA yang lebih jelas dibanding metode kontrol. Begitu juga hasil sintesis cDNA yang menggunakan metode modifikasi terlihat lebih jelas pada hasil gel elektroforesis dibandingkan pada metode kontrol dan memiliki rata-rata nilai konsentrasi tertinggi yaitu 2296,17ng/µl.
Saran
Saran untuk perbaikan hasil penelitian lebih lanjut adalah penanganan sampel harus sangat diperhatikan kesterilannya dan waktu isolasi dari mRNA menjadi utas pertama cDNA harus kurang dari 24jam untuk mendapatkan hasil yang lebih sempurna. Begitu juga hasil isolasi dari setiap tahap harus segera dilanjutkan dalam waktu kurang dari 24jam untuk pengerjaan tahap berikutnya untuk menghindari adanya degradasi yang dapat mengurangi kualitas hasil isolasi.
DAFTAR PUSTAKA
Atmosuseno BS. 1998. Budi Daya, Kegunaan dan Prospek Sengon. Jakarta. Penebar Swadaya.
Albert B, Bray D, Lewis J, Raff M, Roberts M, Watson JD. 1989. Molecular Biology of The Cell, 2nd Edition. New York. Garland Publishing.
Hartati NS. 2002. Konstruksi Pustaka cDNA Sengon yang Terinduksi oleh Serangan Hama Boktor [tesis]. Bogor (ID): Institut Pertanian Bogor.
Hillis DM. 1987. Molecular versus morphological approaches to systematics. Annual Review of Ecology and Systematics 18(1): 23-42.
Loukakis KA, Roubelakis-Angelakis KA, Kanellis AK. 1996. Isolation of functional RNA from grapevines tissues poor in nucleic acid content. Am. J. Enol. Vitic. 47:181-185.
Nicholl DST. 1994. An Introduction to Genetic Engineering (Studies in Biology). Great Britain, University Press, Cambridge.
Schultz DJ, Craig R, Cox-Foster DL, Mumma RO, dan Medford JI. 1994. RNA isolation from recalcitrant plant tissue. Plant Mol. Biol. Rep. 12:310-316. Siregar UJ, Haheda NF, dan Flowrensia L. 2011. Hubungan antara trypsin
20
larva boktor dalam artificial diet. Jurnal Silvikultur Tropika. Vol 3(01): 101-108.
Tampang A. 2012. Pengembangan Metode Kloning Gen Ketahanan Terhadap Hama Pada Sengon (Paraseriathes falcataria) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Tattersal EAR, DeLuc L, Cushman JC, Cramer GR, Ergul A, AlKayal F. 2005. Technical brief: comparison of methods for isolating high-quality RNA from leaves of grapevine. Am. J. Enol. Vitic 56:400-406.
Wilkins TA, Smart LB. 1996. Isolation of RNA from Plant Tissue. New York. Wiley – Liss.
22
24
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi pada tanggal 24 Juli 1991 dari ayah (alm) Petrus Djoko Sardjono dan ibu Veronica Widarsih. Penulis adalah putri keempat dari 4 bersaudara. Pada tahun 2009 penulis lulus dari SMA Negeri 5 Bekasi dan kemudian diterima di Institut Pertanian Bogor melalui jalur Ujian Talenta Mandiri IPB (UTM-IPB) dan diterima di Departemen Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor.
Pada tahun 2011, penulis mengikuti Praktek Pengenalan Ekosistem Hutan PPEH) di lokasi Sancang Timur – Papandayan pada bulan Juli. Tahun 2012 penulis mengikuti Praktek Pengelolaan Hutan (PPH) di lokasi Hutan Pendidikan Gunung Walat (HPGW) Sukabumi, Bandung dan Cianjur pada bulan Juni-Juli. Tahun 2013 penulis mengikuti Praktik Kerja Profesi (PKP) di lokasi Persemaian Permanen Cimanggis, Balai Perbenihan Tanaman Hutan (BPTH) Jawa Barat pada bulan Maret sampai dengan April. Selama menjalani perkuliahan, penulis aktif dalam organisasi International Forestry Student Association Local Commitee IPB (IFSA LC IPB) sebagai Head of Human Resources Division pada tahun 2011/2012, serta aktif dalam organisasi Himpunan Profesi Mahasiswa Silvikultur yaitu Tree Grower Community (TGC) sebagai staff Divisi Informasi dan Komunikasi pada tahun 2011/2012. Kepanitiaan yang pernah diikuti penulis antara lain, Seminar Nasional dan Pelatihan Budidaya Jabon tahun 2012 sebagai sekretaris, TGC in Action tahun 2013 sebagai Publikasi dan Dokumentasi, dan Perayaan Natal Civitas Akademik IPB tahun 2013 sebagai Sekretaris. Pada bulan Desember tahun 2011 penulis menjadi delegasi IFSA LC IPB pada South East Asia Forestry Youth Meeting (SEAFYM) di Bogor, Indonesia. Pada bulan Mei 2012 penulis menjadi delegasi IFSA LC IPB pada Asia Regional Meeting (ARM) IFSA World, di Yogyakarta dan Kamojang, Indonesia. Pada bulan Oktober 2012 penulis menjadi delegasi Fakultas Kehutanan dalam 19th Tri-U International Joint Seminar and Symposium di Bogor, Indonesia. Pada bulan Oktober 2014 penulis menjadi peserta 24th International Union Forest Research Organization (IUFRO) World Congress di Salt Lake City, Utah, Amerika Serikat. Penulis menerima penghargaan sebagai Mahasiswa Berprestasi dalam Bidang Ekstra Kurikuler periode Agustus 2012 – Mei 2013 (SK Rektor IPB No: 68/IT3/KM/2013) dari Direktorat Kemahasiswaan Institut Pertanian Bogor. Penulis pernah mengikuti pelatihan Pengenalan Software untuk Genetika Molekuler dan Association Mapping dan Pelatihan Mini Workshop DNA Barcoding pada bulan November 2013 di Fakultas Kehutanan, Institut Pertanian Bogor. Pada tahun 2012-2014 penulis menjadi asisten praktikum mata kuliah Dendrologi dan Ekologi Hutan di Departemen Silvikultur, Fakultas Kehutanan, IPB.