"
INDUKSI PEMBUNGAAN PADA GLOXINIA
(Siningia speciosa)
DENGAN GA3, SUKROSA, NITROGEN DAN FOSFOR PADA
MEDIUM IN VITRO
IMELDA JEANETTE LAWALATA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis "Induksi Pembungaan pada Gloxinia
(Siningia speciosa) dengan GA3, Sukrosa, Nitrogen dan Fosfor pada Medium In Vitro"
adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguman tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhii tesis ini.
Bogor, Mei 2009
Imelda Jeanette Lawalata
ABSTRACT
IMELDA JEANETTE LAWALATA. In Vitro Flowering Induction of Gloxinia
(Siningia speciosa) by GA3, Sucrose, Nitrogen and Phosphor. Under direction of
NURHAYATI A. MATTJIK and NI MADE ARMINI WIENDI
In vitro flowering is a method of flower organ induction under controlled and aseptic condition. This method can be used in all plant including gloxinia. Gloxinia is an ornamental plant having beautiful leaf, color, form, and size of flower. This research consisted of three separate experiments by using Factorial Design compiled in Completely Randomized Block Design. Experiment-I consisted of concentration of GA3 (4, 6 , 8, 10 mgtl), and sucrose (30, 40, 50 dl). Experiment-I1 consisted of concentration of nitrogen (lx, 1/5x, 1/10x, 1/20x), and phosphor (lx, 5x). Experiment- I11 consisted of concentration of nitrogen (lx, 1/5x, 1/10x, 1/20x), and phosphor (lx, 5x) at appropriate temperature and photoperiodicity. Results showed that gloxinia has not produce any flower in at the all experiments after 14, 10 and 8 weeks of treatment, but its vegetative growth was growing until the end of experiment period. Treatment of GA3 and interaction of GA3 and sucrose significantly influenced a number of gloxinia leaves. Also, nitrogen gave a significant effect on a number of leaves. Nitrogen and phosphor at appropriate temperature aqd photoperiodicity significantly affected growth rate of buds, a number of buds and leaves.
RINGKASAN
IMELDA JEANETTE LAWALATA. Induksi Pembungaan Pada Gloxinia (Siningia speciosa) Dengan GA3, Sucrose, Nitrogen Dan Fosfor Pads Medium In Vitro. Dibimbing oleh NURHAYATI A. MATTJIK dan NI MADE ARMINI WIENDI.
Pembungaan secara in viho merupakan suatu metode menginduksi keluarnya organ dalam kondisi terkendali secara aseptik. Induksi pembungaan secara in vitro dapat dilakukan pada semua tanaman termasuk tanaman hias gloxinia. Gloxinia mempakan tanaman hias yang memiliki keindahan pada daun, warna, bentuk dan ukuran bunganya. Tujuan penelitian ini adalah untuk mempelajari dan menganalisa pengaruh konsentrasi zat pengatur tumbuh GA3 dan sukrosa dalam menginduksi pembungaan tanaman gloxinia secara in vitro, mempelajari dan menganalisa pengaruh konsentrasi nitrogen dan fosfor dalam menginduksi pembungaan tanaman gloxinia secara in vitro dan mempelajari dan menganalisa pengaruh nitrogen dan fosfor pada suhu dan fotoperiodisitas yang sesuai dalam menginduksi pembungaan tanaman gloxinia secara in vitro.
Penelitian terdiri dari 3 percobaan terpisah dengan menggunakan rancangan perlakuan faktorial dua faktor yang disusun dalam Rancangan Acak Kelompok. Percobaan 1 terdiri dari konsentrasi GA3 (4,6,8, 10 mdl) dan sukrosa (30,40,50 g/l). Percobaan 2 terdiri dari konsentrasi nitrogen (lx, 1/5x, 1/10x, 1120~) dan fosfor (lx, 5x). Percobaan 3 terdiri dari konsentrasi nitrogen (lx, 1/5x, 1/10x, 1120~) dan fosfor (lx, 5,) pada suhu dan fotoperiodisitas yang sesuai.
Hasil penelitix menunjukkan bahwa gloxinia tidak menghasilkan bunga pada semua percobaan tetapi pertumbuhan vegetatifnya tetap berlangsung hingga akhir peneiitian. Percobaan GA3 serta interaksi antara GA3 dan sukrosa berpengamh secara nyata terhadap jumlah daun total. Pemberian nitrogen juga berpengaruh secara nyata terhadap jumlah daun total. Percobaan nitrogen dan fosfor pada suhu dan fotoperiodisitas yang sesuai berpengaruh secara nyata dan sangat nyata terhadap kecepatan turnbuh daun baru, iumlah tunas dan iumlah d a m total gloxinia.
Hasil pengamatan menunjukkan bah& pada 6 MST pe&aan GA3 4 mgll menunjukkan nilai yang lebih besar dari perlakuan lainnya sedangkan perlakuan GA3
10 mgll menunjukkan nilai yang lebih kecil. Pada 10 MST perlakuan GA3 6 mgll menunjukkan nilai yang lebih besar dari perlakuan lainnya. Pemberian GA3 4 mg/l sampai dengan 10 mgll dapat meningkatkan jumlah d a m total gloxinia pada 2 MST, sebaliknya pada 6 MST hingga 14 MST peningkatan konsentrasi GA3 menyebabkan p e n m a n jumlah daun total. Jurnlah daun total tertinggi hingga 14 MST diperoleh
Jumlah daun total terbanyak hingga 14 MST diperoleh dari perlakuan GA3 8 mgll dengan sukrosa 50 gll (12.2 helai).
Pemberian nitrogen juga berpengaruh nyata terhadap jumlah daun total gloxinia pada 7 MST. Penurunan konsentrasi nitrogen hingga 1/20x menyebabkan jumlah daun total gloxinia juga menurun. Jumlah daun total tertinggi hingga 10 MST
diperoleh dari perlakuan nitrogen l x (1 1.9 helai).
Kecepatan tumbuh daun baru gloxinia menurun seiring dengan rendahnya konsentrasi nitrogen pada suhu dan fotoperiodisitas yang sesuai. Eksplan yang tercepat menghasilkan daun baru diperoleh dari perlakuan nitrogen l x (1.5) dan yang terlama menghasilkan daun baru adalah perlakuan nitrogen 1/5x (2.5). Jumlah tunas gloxinia menunjukkan nilai yang lebih besar diperoleh dari perlakuan nitrogen l x pada 4 MST sampai dengan 8 MST. Peningkatan jumlah tunas juga diperoleh dari peningkatan konsentrasi fosfor pada suhu dan fotoperiodisitas yang sesuai. Jumlah tunas tertinggi diperoleh dari perlakuan fosfor 5x. Nitrogen pada suhu d m fotoperiodisitas yang sesuai juga mempengamhi jumlah daun total gloxinia. Pada 2 MST sampai dengan 8 MST pemberian nitrogen l x menunjukkan nilai yang lebih besar dari perlakuan lainnya. Jumlah daun total tertinggi hingga 8 MST diperoleh dari perlakuan nitrogen
1x (12.8 helai).
Pemberian GA3 dan sukrosa, nitrogen dan fosfor serta nitrogen dan fosfor pada suhu dan fotoperiodisitas yang sesuai belum dapat menginduksi munculnya bunga gloxinia hingga 14,lO dan 8 minggu setelah perlakuan. Belum terinduksinya bunga gloxinia karena pertumbuhan vegetztif masih berlangsung. Selain itu, beberapa faktor seperti komposisi media, eksplan atau genetik tanaman dan faktor liigkungan turut mempengamhi sehingga belum terinduksinya pembungaan gloxinia, walaupun diperlakukan dengan kondisi-kondisi yang mendukung untuk pembungaan.
O Hak Cipta rnilik IPB, tahun 2009 Hak Cipta dilindungi Undang-Undang
I. Dilarang mengutip sebagian atau selurih karya tulis ini tanpa
mencantumkan atau menvebutkan strmbernva. ,
.
a. Pengutipan hanya untuk kepentinganpendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan bitik, atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumurnkan dun memperbanyak sebagian atau seluruh
INDUKSI PEMBUNGAAN PADA GLOXINIA (Siningia speciosa)
DENGAN GA.3, SUKROSA, NITROGEN DAN FOSFOR PADA
MEDIUM IN VITRO
IMELDA JEANETTE LAWALATA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Agronomi dan HortiMtura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Induksi Pembungaan pada Gloxinia (Siningia speciosa) dengan GA3, Sukrosa, Nitrogen dan Fosfor pada Medium In Vitro
Nama : Imelda Jeanette Lawalata NRP :A151060011
Disetujui Komisi Pembimbing
A I
-
/
Prof. Dr. Ir. Nuhavati A. Mattiik, M.S Dr. Ir. Ni Made Armini Wiendi.M.S.
Ketua Anggota
Diketahui
Ketua Program Studi Agronomi dan Hortikultura
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas anugerahNya sehingga penulisan tesis dengan judul "Induksi Pembungaan pada Gloxinia (Siningia speciosa) dengan GA3, Sukrosa, Nitrogen dan Fosfor pada Medium In Viiro " dapat terselesaikan.
Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Nurhayati A. Mattjik, M.S
dan
Dr. Ir. Ni Made Armini Wiendi, M.S selaku Komisi Pembimbing atas segalakebijaksanaan dan kesabaran dalam pembimbingan, memberikan dorongan, motivasi dan masukan mulai dari rencana penelitian hingga penulisan tesis ini.
Penyusunan tesis ini talc lepas dari bantuan berbagai pihak. Oleh karena itu penulis mengucapkan terima kasih kepada :
1. Rektor Universitas Pattimura yang telah memberikan ijin kepada penulis untuk melanjutkan studi pada Sekolah Pascasajana IPB.
2. Institut Pertanian Bogor khususnya program sekolah pascasarjana dimana penulis menuntut ilmu dan memberikan dorongan untuk penulis dapat menyelesaikan studi.
3. Yayasan Satyabhakti Widya, Yayasan Dana Beasiswa Maluku atas b a n w dana yang sangat membantu penulis dalam proses penelitian.
4. Dr. Ir. Winarso D. Widodo, MS selaku Penguji Luar Komisi pada ujian tesis yang telah memberikan banyak masukan dalam penyempurnaan tesis ini. 5. Keluarga tercinta, Papa (alm), Mama, Deny, Elmy, Meilo, Ruth dan Vico serta
semua saudara yang setia berdoa dan mendorong penulis selama studi di IPB.
7. Teman-teman dari Ambon (Bu Mon, Bu Nus, Yan, Degen, Max, Edi, Tya, Oca, Semby, Marko) untuk bantuan, dukungan dan doa selama proses perkuliahan sampai penulisan tesis ini serta teman-teman penghuni Kost Penvira No. 12 yang penuh suasana kekeluargaan walaupun berasal dari daerah yang berbeda namun tetap kompak.
Semoga tulisan ini dapat bermanfaat dan menjadi sumber informasi bagi pengembangan ilmu dan pengetahuan khususnya di bidang Bioteknologi Tanaman.
Bogor, Mei 2009
RIWAYAT
HIDUP
Penulis dilahirkan di Negeri Rumah Tiga - Ambon pada 21 Januari 1972 dari ayah Jan Ch Lawalata (alm) dan ibu Charlotte LawalataIAdoe. Penulis merupakan anak ke-4 dari 5 bersaudara.
DAFTAR IS1
Halaman
...
DAFTAR TABEL...
DAFTAR GAMBAR...
DAFTAR LAMPIRAN...
PENDAHULUANLatar Belakang
. .
...
...
Tujuan Penelltlan
Hipotesis
...
...
TINJAUAN PUSTAKA.
.
...
Tanaman Gloxlnra
Induksi Pembungaan S e c m In Vitro
...
Giberelin dan Sukrosa
...
:
...
Nitrogen dan Phospor. . .
...
Suhu d m Fotopenod~s~tas
...
...
BAHAh! DAN METODE...
Tempat dan Waktu Penelitian...
Bahan dan AlatMetode Penelitian
...
...
Pelaksanaan Penelitian...
HASIL DAN PEMBAHASAN
DAFTAR TABEL
Halaman
Konsentrasi Nitrogen, Fosfor dan Kalium dalam Media Perlakuan Induksi Pembungaan Gloxinia (Siningia speciosa) secara In Vitro
pada Percobaan 2 yang Diambil dari Media Murashige dan Skoog
(MS)
...
22 Konsentrasi Nitrogen, Fosfor dan Kalium dalam Media PerlakuanInduksi Pembungaan Gloxinia (Siningia speciosa) secara In Vitro
pada Percobaan 3 yang Diambil dari Media Murashige dan Skoog
(MS)
...
24 Rekapitulasi Hasil Uji F Pengaruh Konsentrasi GA3 dan Sukrosaterhadap Pertumbuhan Vegetatif Gloxinia secara In vitro
...
28 Persentase Kultur Berkalus dan Eksplan Terkontaminasi padaGloxinia secara In Vitro pada Percobaan 1
...
3 1 Pengamh GA3 dan Sukrosa terhadap Persentase Tumbuh,Kecepatan Tumbuh Tunas Baru dan Kecepatan Turnbuh Daun
Baru Gloxinia secara In Vitro pada Percobaan 1
...
32 Pengaruh Kombinasi GA3 dan Sukrosa terhadap PersentaseTumbuh, Kecepatan Tumbuh Tunas Baru dan Kecepatan Tumbuh
Daun Baru Gloxinia secara In Vitro pada Percobaan 1
...
33 Pengaruh GA3 dan Sukrosa terhadap Jumlah Tunas Gloxinia secaraIn Vitro pada Percobaan 1
...
36 Pengaruh Kombinasi GA3 dan Sukrosa terhadap Jumlah TunasGloxinia secara In V i m pada Percobaan 1
...
37 Pengaruh GA3 dan Sukrosa terhadap Jumlah Daun Total Gloxiniasecara i n Vitro pada Percobaan 1
...
38 Pengamh Kombinasi GA3 dan Sukrosa terhadap Jumlah Daun11. Rekapitulasi Hasil Uji F Pengaruh Nitrogen dan Fosfor terhadap Pertumbuhan Vegetatif Gloxinia secara In Vitro
...
12. Persentase Tumbuh, Eksplan Terkontaminasi d m Kultur Berkatus pada Gloxinia secara In Vitro pada Percobaan 2
...
13. Pengamh Nitrogen dan Fosfor terhadap Kecepatan TumbuhTunas Baru d m Kecepatan Tumbuh Daun Baru Gloxinia secara In
...
Viho pada Percobaan 2
14. Pengaruh Kombinasi Nitrogen dan Fosfor terhadap Kecepatan Tumbuh Tunas Baru dan Kecepatan Tumbuh Daun Baru Gloxinia secara In Vitro pada Percobaan 2
...
15. Pengaruh Nitrogen dan Fosfor terhadap Jumlah Tunas Gloxiniasecara In Vitro pada Percobaan 2
...
16. Pengaruh Kombinasi Nitrogen dan Fosfor terhadap Jumlah TunasGloxinia secara In Vitro pada Percobaan 2
...
17. Pengaruh Nitrogen dan Fosfor terhadap Jumlah Daun TotalGloxinia secara In Vitro pada Percobaan 2
...
18. Pengaruh Kombiiasi Nitrogen dan Fosfor terhadap Jumlah Daun Total Gloxinia secara In Vitro pada Percobaan 2
...
19. Rekapitulasi Hasil Uji F Pengaruh Nitrogen dan Fosfor pada Suhudan Fotoperiodisitas yang Sesuai terhadap Pertumbuhan Vegetatif
...
Gloxinia secara In Vitro20. Persentase Ekspla Terkontaminasi dan Kultur Berkalus pada Gloxinia secara In Vitro pada Percobaan 3
...
21. Pengaruh Nitrogen dan Fosfor pada Suhu dan Fotoperiodisitas yang Sesuai terhadap Persentase Tumbuh, Kecepatan Tumbuh Tunas
Baru
dan Kecepatan Tumbuh Daun Baru Gloxinia secara InVitro pada Percobaan 3
...
23. Pengaruh Nitrogen dan Fosfor pada Suhu dan Fotoperiodisitas yang Sesuai terhadap Jumlah Tunas Gloxinia secara In Vitro pada
Percobaan 3
...
55 24. Pengaruh Kombinasi Nitrogen dan Fosfor pada Suhu danFotoperiodisitas yang Sesuai terhadap Jumlah Tunas Gloxinia
secara In Vitro pada Percobaan 3
...
56 25. Pengaruh Nitrogen dan Fosfor pada Suhu dan Fotoperiodisitasyang Sesuai terhadap Jumlah Daun Total Gloxinia secara In Vitro
pad* Percobaan 3
...
57 25. Pengaruh Kombinasi Nitrogen dan Fosfor pada Suhu danFotoperiodisitas yang Sesuai terhadap Jumlah Daun Total Gloxinia
DAFTAR
GAMBAR
Halaman
1. Bagan Alur Penelitian Induksi Pembungaan Gloxinia secara In
vitro
...
62. Eksplan Berupa Tunas In Vitro yang Digunakan untuk Induksi
Pembungaan pada Percobaan 1
...
20 3 . Eksplan Bempa Tunas In Vitro yang Digunakan untuk InduksiPembungaan pada Percobaan 2
...
21 4. Eksplan Bempa Tunas In Vitro yang Digunakan untuk InduksiPembungaan pada Percobaan 3
...
235.
Pertumbuhan Planlet Gloxinia 14 MST dengan Perlakuan GA3dan Sukrosa
...
30 6. Kontaminasi pada Kultur Gloxinia...
3 1 7. Pertumbuhan Planlet Gloxinia 10 MST dengan PerlakuanNitrogen dan Fosfor
...
41 8. Perubahan Warna pada Daun Gloxinia...
42 9. Pertumbuhan Planlet Gloxinia 10 MST dengan PerlakuanNitrogen dan Fosfor pada Suhu dan Fotoperiodisitas yang
Sesuai
...
50. .
DAFTAR
LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara dengan potensi tanaman hias yang tinggi karena keadaan lingkungan yang cocok sebagai lingkungan tumbuhnya, serta kaya akan sumber daya plasma nutfah. Pemanfaatan tanaman hias di Indonesia ternyata amat beragam dan makin meluas bahkan cenderung mempengaruhi tatanan kehidupan masyarakat. Tanaman hias dapat dimanfaatkan sebagai komponen dalam taman di samping potensial untuk dijadikan komoditas perdagangan antar negara di dunia. Walaupun demikian, tanaman hias introduksi juga banyak dikembangkan di indonesia. Gloxinia (Siningia speciosa) merupakan salah satu tanaman hias introduksi yang memiliki potensi untuk dikembangkan di Indonesia. Tanaman ini merupakan tanaman semusim yang tumbuh baik di negara yang memiliki empat musim maupun di daerah tropis seperti Indonesia. Keindahan tanaman ini terletak pada daun, wama, bentuk dan ukuran bunganya. Gloxinia populer sebagai tanaman nunah termasuk bunga pot dan dapat dipakai untuk mengtuasi jendela rumah, taman-taman batu atau rumah-rumah kaca. Tenampilan g!oxinia akan lebih menarik jika menghasilkan bunga dengan bentuk, wama dan ukuran yang beragam dan unik (Syafni, 2006).
Pembungaan secara in vitro pada tanaman gloxinia belum pemah diteliti. Tanaman ini mudah berbunga secara in vivo, namun sulit menghasilkan biji, sehingga sulit melakukan persilangan di dalam program pemuliaan gloxinia guna meningkatkan keragaman genetiknya. Perlu ada teknologi altematif untuk mengatasi kendala ini. Pembungaan in vitro diharapkan dapat membantu mengatasi kendala ini. Selain itu tanaman gloxinia memerlukan waktu 3-4 bulan untuk menghasilkan bunga. Induksi pembungaan secara in vitro diharapkan dapat mempercepat pembungaan. Proses seleksi terhadap tanaman hasil persilangan juga langsung dapat dilakukan secara in
vitro tanpa hams melakukan penanaman di lapangan
untuk varietas-varietas unggul yang baru dihasilkan (Gunawan, 1992). Selain itu teknik ini memiliki kelebihan yaitu tanaman dapat diperbanyak setiap saat tanpa tergantung musim, daya multiplikasinya tinggi dari bahan tanaman yang kecil, tanaman yang dihasilkan seragam dan bebas penyakit terutama bakteri dan cendawan (Wiendi el al, 1992). Menurut Rahmi (2007) teknik in vitro juga mempakan salah satu altematif untuk memperbanyak bibit dengan kualitas terjamin seperti induknya. Jenis tanaman yang diperbanyak secara in vitro ini ditujukan temtama untuk mengatasi masalah seperti daya perkecambahan yang rendah, tanaman-tanaman hibrida yang tetua jantannya stedi, fanaman langka, pohon-pohon elit atau pohon untuk batang bawah dan tanaman yang selalu diperbanyak dengan cara vegetatif.
Pembungaan merupakan peristiwa terjadinya pembahan pola pertumbuhan dan perkembangan dari proses vegetatif menjadi generatif, yang dipengaruhi dan dikendalikan oleh interaksi genetik dengan lingkungan. Pembentukan bunga diinduksi oleh senyawa penginduksi pembungasn (suatu pembahan kimia pada jaringan meristematik) sebagai respons terhadap temperatur dingiri dan hari pendek (Gardner et al, 1991). Perubahan ini mempengaruhi metabolisme tanaman, seperti aktivitas respirasi meningkat, asimilasi meningkat d m dengan dernikian kecepatan pengangkutan air, makanan dan hara ke arah bunga juga me~ngkat.
Pembungaan secara in vitro me~pEkkan suatu metode menginduksi keluarnya organ dalam kondisi terkendali secara aseptik. Menurut Wang et a1 (2002), ada tiga alasan utama untuk mempelajari pembungaan secara in vitro yaitu menyediakan suatu sistem model untuk mempelajari inisiasi bunga dan perkembangannya, melaksanakan
microbreeding yang bermanfaat temtama bagi tanaman yang membutuhkan waktu
yang lama untuk pertumbuhan vegetatifhya, serta sebagai miniatur pembungaan secara
in viho yang berpotensi komersial baik sebagai tanaman hias.
menghasilkan bunga. Menurut Bemier et a1 (1985), pengaturan pembungaan mungkin dilakukan apabila mengacu pada dua teori universal tentang pembungaan yaitu (1) inisiasi bunga pada tanaman tidak akan terjadi kecuali bila diinduksi, dan (2) tanaman yang berada pada kondisi yang kurang sesuai untuk pembungaan menghasilkan satu atau beberapa zat penghambat pembungaan d m inisiasi bunga akan terjadi bila produksi zat tersebut dicegah.
Induksi pembungaan pada tanaman secara in vitro masih jarang dilakukan dan hanya terjadi pada kondisi-kondisi tertentu. Menurut Chaari-Rkhis et a1 (2006), induksi pembungaan bergantung pada beberapa faktor seperti genetik, hormon d m faktor iklim dimana hasilnya dapat menekan gen-gen pertumbuhan vegetatif dan mengaktifkan pembungaan. Selain itu, pembungaan secara in viho dapat terjadi karena adanya perbedaan jenis eksplan, perangsang pertumbuhan, komposisi media (auksin, sitokinin dan giberelin) dan lingkungan kultur seperti suhu dan fotoperiodisitas cahaya. Teknik dalam induksi pembungaan secara in viho diawali dengan penanaman eksplan dari jaringan yang bebas hama dan penyakit serta membungakan pada media pertumbuhan dalam lingkungan yang aseptik (Hew dan Yong, 1996).
Modifikasi zat pengatur tumbuh dan komposisi hara pada media kultur dapat dilakukan untuk menginduksi pembungaan. Menurut Weaver (1972) zat pengatur tumbuh sangat penting untuk menginduksi pembungaan, karena penggunaannya dapat mengatur pembungaan sesuai dengan waktu yang diinginkan. Zat pengatur tumbuh yang sering digunakan untuk pembungaan antara lain TDZ (thidiazuron), ZT (zeatin),
BA (benzyl adenine) dan giberelin (Hew dan Yong, 1996; Wang et al, 2002; Taylor et
al, 2007; Chaari-Rkhis et al, 2006).
perkecambahan biji, mendorong terjadinya pembungaan, pembentukan buah partenokarpi dan mengganti pengaruh suhu dingin pada tanaman (Wattimena, 1988).
Karbohidrat merupakan salah satu unsur yang besperan penting dalam keberhasilan kultu jaringan suatu tanaman. Gula nerupakan sumber karbohidrat utama dalarn kultur jaringan. Menurut Taylor et a1 (2007), umurnnya jenis gula yang digunakan dalam medium in vitro adalah sukrosa. Sukrosa juga merupakan salah satu produk akhir dari proses fotosintesis yang banyak digunakan tanaman. Secara umum pembungaan akan berkuang pada konsentrasi gula yang rendah dan pada konsentrasi gula yang tinggi akan menghalangi pembentukan kuncup bunga (Taylor et al, 2007).
Nitrogen berperan dalam mempengaruhi kecepatan pertumbuhan tanaman (Wattimena et al, 1992). Selain itu nitrogen dapat membentuk protein, lemak dan berbagai persenyawaan organik yang lain (Hendaryono dan Wijayani, 1994). Protein banyak terdapat pada sel-sel yang masih hidup yaitu pada bagian yang sedang aktif tumbuh sehingga nitrogen dapat dipergunakan terutama untuk perhmbuhan vegetatif tanaman. Nitrogen juga berperan dalam pembentukan klorofil yang berguna di dalam proses fotosintesis yang nantinya menghasilkan karbohidrat. Fosfor diberikan pada tanaman terutama untuk pembentukan karbohidrat sehingga unsur P dibutuhkan pada waktu pembungaan, pembuahan, pemasakan buah dan biji. Pemberian nitrogen yang rendah dan fosfor yang tinggi diiarapkan dapat mempengaruhi perhmbuhan tanaman khususnya untuk merangsang pembungaan.
Penelitian tentang induksi pembungaan secara in vitro pemah dilakukan baik pada tanaman hias maupun tanaman buah. Chaari-Rkhis et a1 (2006) melaporkan bahwa tanaman zaitun (Olive) varietas Marsaline mampu memberi variasi di dalam mengubah struktur bunga dan bentuk dengan pemberian GA3 (gibberellic acid)
marginatum secara in vitro sebanyak 97% setelah 3 buian (Kostenyuk, 1999). Selain itu, Dewir et a1 (2007) juga melaporkan bahwa pemberian GA310 mg/l dan sukrosa 3 atau 6% dapat menginduksi 83-85% bunga Spathiphyllum.
Faktor lingkungan juga dapat mempengaruhi keberhasilan induksi pembungaan suatu tanaman. Suhu dan fotopriode merupakan faktor lingkungan yang berperan aktif dalam proses pembungaan. Pengaturan suhu siang dan malam serta fotoperiode yang tepat sangat membantu tananan untuk menginduksi fase generatifnya. Menurut Gardner et a1 (1991), suhu dan fotoperiode yang dominan memegang peranan penting dalam proses pembungaan, pembuahan dan produksi biji suatu tanaman.
Tujuan Penelitian
Penelitian ini bertujuan untuk 1) memperoleh informasi tentang pengaruh konsentrasi zat pengatur tumbuh GA3 dan sukrosa dalam menginduksi pembungaan tanarnan gloxinia secara in vitro, 2) memperoleh informasi tentang pengaruh konsentrasi nitrogen dan fosfor dalam menginduksi pembungaan tanaman gloxinia secara in vitro dan 3) memperoleh informasi tentang pengaruh nitrogen dan fosfor pada suhu dan fotoperiodisitas yang sesuai dalam menginduksi pembungaan tanaman gloxinia secara in vitro.
Hipotesis
Hipotesis penelitian ini adalah
1. Terdapat konsentrasi GA3, sukrosa, nitrogen dan fosfor yang optimum dalarn menginduksi pembungaan gloxinia secara in vifro.
2. Terdapat interaksi antara GA3 dan sukrosa dalam menginduksi percepatan pembungaan gloxinia secara in vitro.
4. Terdapat interaksi antara nitrogen dan fosfor pada suhu dan fotoperiodisitas yang sesuai dalam menginduksi percepatan pembungaan gloxinia secara in viho.
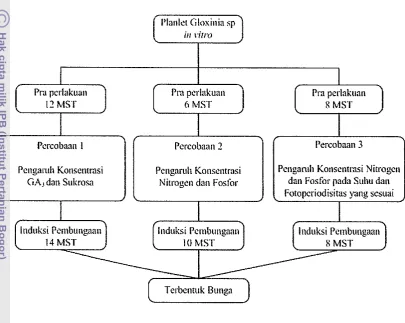
Bagan alur penelitian disajikan pada Gambar 1.
Pcrcobaan I
rn
IPcrcobaan 2 I'ercobaan 3
Pcognml~ Konseotrasi P e ~ ~ g a n ~ l i K o ~ l s c ~ i t m i Nirrogcl! h'itroge~~ dan Foslbr d a ~ i Posfor pada Sdlu d a ~ i
I I I
lodt~ksi Pcmbuagaa~t Induksi Pcmbut~gaan Induksi Pembungaa~~
I1 MST 10 MS'I' 8 MST
Tel.bentuk Bu~lga
Gambar 1 Bagan Alur Penelitian Induksi Pembungaan Gloxinia secara
[image:23.595.92.498.194.517.2]TINJAUAN PUSTAKA
Tanaman Gloxinia
Gloxinia (Siningia speciosa) merupakan tanaman yang berasal dari Brazil, termasuk dalam famili Gesneriaceae bersama dengan Saintpaulia ionantha (African violet). Tanaman Siningia speciosa pertama kali bernama Gloxinia speciosa, yang diberikan oleh Conrad L~ddiges seorang petani bunga berkebangsaan Inggris, dan sampai sekarang nama gloxinia lebih dikenal dari nama bofaninya (Syafni, 2006).
Tanaman ini merupakan tanaman herba yang memiliki daun dan bunga yang indah, helai daunnya lebar, berwama hijau tua dan berbulu. Gloxinia ~ e m p u n y a i satu atau lebih batang daun yang berpasangan clan berbatang pendek dengan beberapa jenis ada yang mencapai tinggi 30 cm. Daunnya oval, agak persegi, tepi daun bergerigi dengan tangkai daun pendek. Panjang daun untuk jenis-jenis budidaya mencapai ukuran 12.5 - 35 cm dengan warna perak atau hijau gelap dan lebar daunnya 7.5 - 15 cm (Larouse, 1995). Untuk jenis-jenis liar panjang daun dapat mencapai 8 inci dan lebamya 6 inci. Kedua sisi permukaan daun berbulu halus dengan permukaan daun atas berwarna hijau dan urat d a m berwarna agak putih.
Gloxinia ada yang tumbuh tegak dan ada yang mendatar, memiliki umbi dengan akar muncul disekelilingnya. Bunga gloxinia tumbuh di tengah lingkaran daun, berbentuk lonceng, berbulu halus dengan diameter 7.5
-
15 cm dan bermahkota tunggal (Crockett, 1974). Bunganya berwarna ungu, putih, rose, merah, kekuningan dengan motif polos atau berbintik (Larouse, 1995). Menurut McHoy (1995) ada beberapa bunga yang berwarna kontras clan sangat menarik.perlahan-lahan mengalami pengguguran sampai berhenti. Untuk pertumbuhan tanaman yang baik dipertukan unsur hara yang seimbang. Pemupukan dapat dilakukan setiap 2-3 kalilminggu sampai tanaman berbunga (Larouse, 1995). Menurut McHoy (1995) bahwa ketika pembungaan telah sempuma, pemupukan dapat dihentikan.
Cahaya juga mempakan salah satu faktor iklim yang sangat mempengaruhi pertumbuhan suatu tanaman. Gloxinia memerlukan cahaya selarna pertumbuhan dan perkembangmnya. Intensitas cahaya dapat mempengaruhi ukuran daun tanaman gloxinia. Dam akan memucat jika cahaya tidak mencukupi (De Vertuil, 1984). Selain cahaya yang tidak mencukupi, suhu air yang rendah dapat menimbulkan tintik pada daun dan menghambat pembentukan tunas baru. Gloxinia dapat tumbuh dengan suhu minimum ~O'C dan 16' - 3 0 ' ~ pada musim kemarau, dan memerlukan kelembaban tinggi (Bonar, 1992). Wood (1982) melaporkan bahwa kelembaban yang kurang, terutama pada musim kemarau, dapat menyebabkan kuncup bunga gloxinia dan african violet tidak membuka dan perlahan-lahan gugur.
Seperti tanaman berumbi lainnya, gloxinia mengalami masa pertumbuhan dan dormansi. Pertumbuhan dari umbi akan memerlukan satu periode dengan dormansi penuh. Apabila bunga telah mulai layu satu per satu, akan diikuti dengan matinya daun sampai hanya tersisa umbi (Crockett, 1974). Masa dormansi berlangsung antara 2-4 bulan.
Perbanyakan gloxinia dapat dilakukan dengan biji, umbi ataupun dam. Perbanyakan dengan biji memang sulit dilakukan karena gloxinia sulit menghasilkan biji. Selain itu, biji yang dihasilkan mempunyai kualitas yang menurun dari generasi ke generasi berikutnya sehingga bibit yang dikembangkan selalu tergantung dari biji impor yang kualitasnya terjarnin (Rahmi, 2007).
Induksi Pembungaan Secara In Viiro
protoplasma, sel, sekelompok sel, jaringan atau organ serta menumbuhkannya dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembaii.
Pembungaan merupakan peristiwa terjadinya pembahan pola pertumb.uhan dan perkembangan dari proses vegetatif menjadi generatif, yang dipengaruhi dan dikendalikan oleh interaksi genetik dengan lingkungan. Proses pembungaan mengandung sejumlah tahap penting yaitu : (1) induksi bunga, inisiasi bunga, (2) diferensiasi, (3) pendewasaan bagian-bagian bunga, serta (4) antesis (Lang, 1952). Pada tahap induksi akan terjadi pembahan respon biokimia pada pelapisan struktur apeks, yang menjadi sinyal pertama perubahan dari fase vegetatif menjadi generatif dan dapat dideteksi secara kimiawi dari peningkatan sintesis asam nukleat dan protein, yang dibutuhkan dalam pembelahan dan diferensiasi sel. Inisiasi bunga merupakan tahap yang sangat penting pada pembungaan tanaman dimana pada tahap ini terjadi perubahan morfologis menjadi bentuk kuncup generatif mulai dapat terdeteksi secara makroskopis untuk pertama kalinya dan transisi dari tunas vegetatif menjadi kuncup generatif ini dapat dideteksi dari perubahan bentuk maupun ukuran kuncup, serta proses-proses selanjutnya yang mulai membentuk organ-organ generatif. Perubahan tunas apikal dan aksilar menjadi tunas bunga merupakan h a i l dari aktivitas hormonal pada tanaman yang diinduksi oleh kondisi lingkungan tertentu seperti pembahan panjang hari (lama penyinaran) dan suhu.
Pada tahap diferensiasi, struktur primordia bunga terlihat jelas dan terdiri dari sepal, petal, stamen, pistil maupun karpelnya. Selama tahap pendewasaan akan terjadi proses megasporogenesis dan mikrosporogenesis untuk penyempumaan dan pematangan organ-organ reproduksi jantan dan betina. Antesis merupakan tahap
akhir
Induksi pernbungaan rnempakan produksi senyawa penginduksi pernbungaan (suatu pembahan kimia pada ujung pucuk) sebagai respons terhadap temperatur dingin dan hari pendek (Gardner et al, 1991). Pembahan ini rnempengaruhi kehidupan tanaman, seperti aktivitas respirasi meningkat, asimilasi meningkat dan dengan dernikian kecepatan pengangkutan air, makanan dan hara ke arah bunga juga meningkat. Pengaruh induksi pembungaan tidak terjadi langsung pada satu waktu tetapi pada selang waktu tertentu, tergantung jenis tanamannya. Pembungaan dapat terjadi setelah melewati petiode malam kritis yang ditentukan oleh panjang pendeknya periode gelap.
Ada beberapa pendapat yang mendasari pembungaan pada tanaman bahwa pembungaan dikontrol oleh keseimbangan karbohidrat dan nitrogen atau nisbah CM. Jika C/N rasio tinggi maka tanaman dapat menginduksi bunga dan bila CM rasio rendah tanaman dipacu ke arah perturnbuhan vegetatif. Menurut Ryugo (1990), proses pembungaan pada tanaman tertentu diatur oleh zat pendorong pembungaan (florigen) yang diproduksi oleh daun dan ditranslokasikan ke kuncup untuk rnemproduksi organ generatif. Pada prinsipnya terdapat tiga proses dalam induksi pembungaan, yaitu adanya produksi hormon pembungaan yang diinduksi oleh kondisi lingkungan, tersedianya kandungan nutrisi yang cukup untuk rnendukung perubahan dalam apeks dan perubahan respon biokirnia pada apeks yang memicu dihasilkannya unsur-unsur tertentu untuk menginduksi pembungaan (Ryugo, 1990).
Pembungaan tanaman dapat dipacu oleh berbagai kondisi, seperti hari panjang, vemalisasi, hari pendek pada suhu tinggi ataupun pemberian hormon turnbuh. Berdasarkan beberapa penelitian yang sudah dilakukan, induksi pembungaan dapat tejadi pada tanarnan seperti Roses sp, Cymbidium niveo-marginatum Mak, Olive dan
Petunia sp.
Pembungaan secara in vitro merupakan suatu metode rnenginduksi keluarnya organ dalam kondisi terkendali secara aseptik. Tujuan pembungaan secara in vitro
karena genetik atau lingkungan yang kurang mendukung, melakukan in vitro fertilisasi yang sulit dilakukan secara in viiro dan mencegah aborsi buah, mempersingkat waktu dalam proses pemuliaan, melakukan pelestarian plasma nutfah dan untuk tujuan estetika sebagai tanaman hias dalam botol. Menurut Wang er a1 (2002) bahwa ada tiga alasan utama untuk mempelajari pembungaan secara in vitro yaitu menyediakan suatu sistem model untuk mempelajari inisiasi bunga dan pengembangannya; melaksanakan
microbrecding yang bermanfaat terutaina bagi tanaman yang membutuhkan waktu
yang lama un:uk pertumbuhan vegetatifnya serta sebagai miniatur pembungaan secara
in vitro yang berpotensi komersial baik sebagai tanaman hias.
Keberhasilan pembungaan secara in vitro bergantung pada beberapa faktor dan salah satunya adalah eksplan (Taylor et al, 2007). Eksplan m e ~ p a k a n potongan jaringan atau organ yang diisolasi dari tanaman untuk inisiasi suatu kultur. Untuk menentukan eksplan yang tepat maka perlu memperhatikan pemilihan bagian tanaman sebagai sumber eksplan, umur eksplan clan perlakuan eksplan sebelum diilturkan (Gunawan, 1992).
Komposisi media yang digunakan terdiri dari nutrisi, karbohidrat, zat pengatur tumbuh dan pH (Taylor et al, 2007). Komposisi media di dalam induksi pembungaan secara in vitro berbeda untuk setiap tanaman. Perbedaan tersebut terletak pada konsentrasi bahan-bahan kimia penyusunnya. Media yang sering digunakan untuk banyak jenis tanaman adalah media Murashige dan Skoog 1962 yang komposisi medianya mengandung unsur hara esensial yang lengkap dibandingkan komposisi media lainnya.
untuk menginduksi pembungaan, karena penggunaannya dapat mengatur pembungaan sesuai dengan waktu yang diinginkan. Zat pengatur tumbuh ini tidak bekerja sendiri dalam mempengamhi setiap proses pembungaan. Pembungaan dapat dihasilkan dari interaksi zat pengatur tumbuh seperti sitokinin, auksin, giberelin, etilen, a s m absisat atau zat-zat lain Wew dan Yong, 1996).
Giberelin dan Sukrosa
Giberelin merupakan zat pengatur tumbuh endogen, terdapat pada berbagai organ dan jaringan tumbuhan seperti akar, tunas, mata tunas, daun, bunga, bintil akar, buah dan jaringan halus (Wahyurini, 2002). Giberelin berperan dalam menginduksi pertumbuhan tanaman dengan cara merangsang pembesaran sel, dormansi dan perkecambahan biji, mendorong terjadinya pembungaan, pembentukan buah partenokarpi dan mengganti pengaruh suhu dingin pada tanaman (Wattimena, 1988). Giberelin dapat memacu pertumbuhan dan pembesaran sel karena hormon ini
meningkatkan hidrolisis pati, fruktan dan fruktosa menjadi glukosa dan fruktosa (Davies, 1995). Pembesaran sel yang disebabkan oleh GA3 (gibberellic acid) dapat mencapai 15 kali lebih tinggi dari sel yang tidak diberi GA3. Giberelin dapat menggantikan kondisi lingkw~gan yang spesifik guna mengendaliian pembentukan bunga. Induksi pembungaan yang disebabkan oleh GA merupakan pengganti peran hari panjang dan menginduksi pembungaan pada tanaman hari pendek.
Chaari-Rkhis et a1 (2006) melaporkan bahwa giberelin merupakan fitohormon yang terlibat di dalam proses fisiologi termasuk induksi pembungaan
dan
pertumbuhan tunas. Menurut Brooking dan Cohen (2002); Zhang dan Leung (2002) bahwa giberelin mempunyai peran di dalam proses pembungaan. Menurut Chaari- Rkhis et al. (2006) pemberian GA 10 mgll dapat menginduksi pembungaan tanaman
zaitun (Olive). Ben-Nissan ef a1 (2004) membuktikan bahwa ekspresi GIPl (suatu
(Chen et al, 2003). Yursak (2003) dalam penelitiannya menyatakan ha1 yang sama bahwa pemberian GA3 selain meningkatkan pertumbuhan tinggi dan jumlah ruas batang juga merangsang pembungaan tanaman lily. Selain itu, Wuryaningsih dan Sutater (1993) melaporkan bahwa pemberian tiga kali 23 mgll GA3 pada tanaman krisan meningkatkan tinggi tanaman sampai dengan minggu ke-12 dan produksi bunga dengan panjang tangkai lebih 60 cm serta kesegaran bunga 5 hari.
Dalam menginduksi pembungaan suatu tanaman pemberian giberelin dapat dilakukan bersamaan dengan unsur lain. Karbohidrat merupakan salah satu unsur yang berperan penting dalam keberhasilan kultur jaringan suatu tanaman. Karbohidrat dibutuhkan dalam sel hidup sebagai sumber energi dan kerangka karbon untuk proses biosintesis. Dalam kultur jaringan tanaman, penyediaan karbohidrat dari media sangat diperlukan karena aktivitas fotosintesis dalam jaringan in viiro berlangsung sangat rendah akibat rendahnya intensitas cahaya, pertukaran gas terbatas dan kelembaban relatif rendah. Guia merupakan sumber karbohidrat utama dalam kultur jaringan. Menurut Gunawan (1992), gula putih yang digunakan untuk keperluan sehari-hari cukup memenuhi syarat untuk mendukung pertumbuhan Mtur. Keberadaan gula berfungsi sebagai sumber energi pengganti karbon yang biasa didapat tanaman dari atmosfer melalui fotosintesis (George dan Shenington, 1984). Beberapa penelitian tentang induksi pembungaan secara in viiro pada tanaman-tanaman seperti Kalanchoe
blossfeldiana pickens dan Van Staden, 1988), Lolizm temulentum (McDaniel et al,
Jenis gula yang ditambahkan pada medium juga berpengamh pada pembungaan suatu tanaman. Umumnya jenis gula yang digunakan dalam medium in
vitro adalah sukrosa (Taylor et al, 2007). Gamborg dan Shyluk (1981) juga menyatakan bahwa sumber karbon standar adalah sukrosa atau glukosa. Sukrosa juga merupakan salah satu produk akhir dari proses fotosintesis dan mempakan bentuk utama dari gula yang ditranslokasikan pada kebanyakan tanaman. Konsentrasi sukrosa yang diberikan pada tanaman sangat dipengaruhi oleh tipe dan umur eksplan. Konsentrasi sukrosa yang sering digunakan berkisar antara 1-5 % (Pierik, 1987). Tanimoto d m Harada (1981) melaporkan bahwa sukrosa dan glukosa mempengaruhi bunga di dalam induksi pembungaan Torenia fournieri sedangkan fruktosa dapat mencegah pembungaan pada konsentrasi-konsentrasi rendah dan hanya sedikit bunga yang terbentuk. Respon pembungaan akan meningkat dengan meningkatkannya konsentmi-konsentrasi sukrosa dan glukosa sampai dengan 50 g/l. Menurut Tiburcio et al (1988) bahwa sukrosa lebih baik dari pada glukosa di dalam m e m p e n g d pembungaan Nicotiana tabacum kultur-kultur TCL. Franklin et a1 (2000) melaporkan bahwa frekuensi dan efisiensi pembungaan secara in viiro pada tanaman Pisum sativum lebih tinggi dengan penambahan sukrosa 30 g/l pada media dibandingkan dengan sukrosa 15 g/l dan 50 g/l.
Nitrogen dan Fosfor
Nitrogen merupakan unsur penting yang sangat berperan dalam mempengaruhi kecepatan pertumbuhan suatu tanaman (Wattimena et al, 1992). Nitrogen juga dapat membentuk protein, lemak dan berbagai persenyawaan organik yang lain (Hendaryono dan Wijayani, 1994). Protein banyak terdapat pada sel-sel yang masih hidup yaitu pada bagian yang sedang aktif tumbuh sehingga nitrogen dapat dipergunakan terutama untuk pertumbuhan vegetatif tanaman. Selain itu, nitrogen juga berperan dalam pembentukan Morofil yang berguna di dalam proses fotosintesis dan menghasilkan karbohidrat. Secara in vitro nitragen diberikan dalam bentuk N&N03 dan KNO3 (Wattimena et al, 1992). Dickens
dan
Staden (1988) melaporkan bahwa nitrogen yang terdapat didalam N&N03 dan KN03 dapat merangsang pembungaan secara in vibo pada Kalachoe. NH4N03 berperan positif dalam mempengaruhi pembungaan secara in vitro pada konsentrasi rendah dan menghalangi pembungaan pada konsentrasi yang lebih tinggi (Franklin et al, 2000). Menurut Ignacimuthu et a1(1997) bahwa pengurangan sebagian NH4N03 dari medium MS dapat menimbulkan jumlah bunga yang maksimum seperti pada tanaman Vigna mungo.
Fosfor diberikan pada suatu tanaman terutama untuk pembentukan asam amino. Selain itu, fosfor dibutuhkan bagian organ aktif tanaman seperti akar c!an buah (Adam dan Early, 2004). Fosfor juga berperan dalam pembentukan gula atau karbohidrat di dalam tanaman yang sangat dibutuhkan untuk proses pembungaan. Pemberian fosfor pada media biasanya bekerjasama dengan ion kalium dan diduga juga dengan sukrosa dan ion femun. Fosfor yang diberikan pada media biasanya
dalam bentuk (Wattimena et al, 1992).
Selain giberelin dan sukrosa, nitrogen dan fosfor sebagai hara dalam media in
vitro dapat digunakan untuk merangsang pembungaan. Pemberian nitrogen yang
fosfor yang tinggi (5x konsentrasi fosfor dari komposisi MS) dapat menginduksi pembungaan Cymbidium niveo-marginatum Mak sebanyak 97% setelah 3 bulan.
Suhu dan Fotoperiodisitas
Selain eksplan, pengaturan zat pengatur tumbuh dan hara dalam media maupun jenis dan konsentrasi karbohidrat, faktor lingkungan juga berperan penting dalam pertumbuhan dan pembungaan suatu tanaman. Proses pembungaan suatu tanaman secara in vitro dapat dikendalikan oleh suhu dan lama penyinaran atau fotoperiodisitas. Menurut Vaz et a1 (2004), faktor lingkungan, khususnya suhu dan fotoperiodisitas mempengaruhi inisiasi dan perkembangan bunga pada banyak jenis tanaman. Ratcliffe dan Riechmann (2002) melaporkan bahwa transisi pembungaan mempakan proses yang plastis, yang selain dipengaruhi oleh faktor endogen juga faktor lingkungan, seperti panjang hari, kualitas cahaya dan suhu. Pengaruh suhu terhadap pembungaan tanaman sudah banyak dipelajari. Secara umum suhu tinggi merangsang pertumbuhan vegetatif sedangkan suhu rendah pada malam hari mempengaruhi pembungaan. Suhu rendah bervariasi sesuai perbedaan ketinggian tempat atau adanya curah hujan yang menyebabkan pendinginan (Goh dan Arditti, 1982). Jenis anggrek seperti Cymbidium merupakan tanaman yang proses pembungaannya dipengaruhi oleh suhu, terutama suhu rendah. Untuk terjadiiya induksi, tanaman chicory harus ditumbuhkan dengan perlakuan suhu rendah (4°C selama 3 minggu) pada benih-benih yang berkecambah atau pada seluruh tanaman (Rappaport dan Wittwer 1956).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Bioteknologi Tanaman, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Januari 2008 sampai Desember 2008.
Bahan dan Alat
Bahan tanaman yang digunakan adalah planlet gloxinia yang berurnur 8 minggu dalam kondisi in vitro. Media yang digunakan yaitu media Murashige dan Skoog (MS). Planlet gloxinia tersebut terlebih dahulu ditanam pada media pra perlakuan sebelum dipindahkan ke media perlakuan.
Percobaan
1
Bahan untuk media pra perlakuan Percobaan 1 terdiri dari komposisi media MS, 0.1 mgll IAA (indole acetic acid), 1.5 mg/l 2 iP (isopentenyladenine), 4 mg/l CAP (calsium pantotenat), 30 g/l gula dan diukur pada pH 5.8. Media perlakuan Percobaan 1 terdii dari komposisis media MS, 2 mg/l BAP (6-benzylarninopurine), 0.5 mg/l IAA, GA3 (4 mgil, 6 mgll, 8 mgll, 10 m d ) , sukrosa (30, 40, 50 gll) dan diukur pada pH 5.8. Planlet gloxinia ditanam selama 12 rninggu pada media pra perlakuan sebelurn dipindahkan ke media perlakuan Percobaan 1.
Percobaan 2
Percobaan 3
Media pra perlakuan Percobaan 3 meliputi komposisi media MS, 0.1 mg/l IAA, 1.5 mg/l2 iP, 4 mgll CAP, 30 g/l gula dan diukur pada pH 5.9. Media perlakuan Percoban 3 terdiri dari komposisi media MS, 5 mg/l BAP, nitrogen (lx, 1/5x, 1110x, 1120~) dari konsentrasi NH4N03 dan KN03 di dalam komposisi media MS, fosfor ( l x dan 5x) dari konsentrasi KH2P04 di dalam komposisi media MS dan diukur pada pH 5.8. Planlet gloxinia ditanam selama 8 minggu pada media pra perlakuan sebelum dipindakkan ke media perlakuan Percobaan 3.
Bahan lain yang digunakan adalah agar-agar sebagai bahan pemadat, gula, aquades, air sterii dan spiritus. Bahan sterilisasi yang digunakan adalah alkohol 70% dan 96 %, clorox dan bethadin. Bahan untuk pembuatan media adalah plastik dan karet.
Alat yang digunakan dalam pembuatan media meliputi botol kultur, erlenmeyer, labu takar, gelas ukur, pH meter, timbangan analitik, pipet, pengaduk, peralatan masak, tissu, magnetic stirrer dan autoclave. Pada saat penanaman digunakan alat-alat yaitu Laminar air flow cabinet, bunsen, gunting, scalpel, pinset, cawan petri, sprayer dan korek api.
Metode Penelitian
Penelitian ini terdiri dari tiga percobaan terpisah yaitu Percobaan 1 : Pengamh konsentrasi GA3 dan Sukrosa dalam menginduksi pembungaan gloxinia, Percobaan 2 :
Pengamh konsentrasi Nitrogen dan Fosfor dalam menginduksi pembungaan gloxinia clan Percobaan 3 : Pengamh Nitrogen dan Fosfor pada suhu dan fotoperiodisitas yang sesuai dalam menginduksi pembungaan gloxinia.
Percobaan 1 : Pengamh Konsentrasi Giberelin (GA3) dan Sukrosa dalam Menginduksi Pembungaan Gloxinia
GA3 (G), terdiri dari 4 taraf konsentrasi yaitu 4 mg/l (GI), 6 mg/l (G2), 8 mg/l (G3) dan 10 mgll (G4). Faktor kedua adalah Sukrosa (S), terdiui dari 3 taraf yaitu 30 g/l (Sl), 40 gll (S2) dan 50 gn (S3). Percobaan ini terdiri dari 12 kombinasi perlakuan dan pada masing-masing perlakuan diulang 3 kali sehingga terdapat 36 satuan percobaan. Setiap ulangan terdiri dari 3 tanaman sebagai satuan amatan sehingga terdapat 108 tanaman dalam percobaan ini. Setiap botol ditanami 1 planlet gloxinia. Planlet diletakkan pada mang kultur dengan suhu 20°C dan fotoperioda 16 jamhari
Gambar 2 Eksplan bempa tunas in vitru yang digunakan untuk induksi pembungaan pada Percobaan 1. (a) eksplan dari kultur in vihu beriunur 8 minggu, (b) eksplan yang ditatlam pada media psa perlakuan b e r m 12 minggu dan (c) eksplan yang ditanam pada media perlakuan
Model statistik linier yang digunakan dalam rancangan menurut Mattjik dan Sumertajaya (2002) yaitu :
Yijk =
p
+
a i+
pj+
(ap)ij+
pk+
Eijk, denganYijk = hasil pengamatan yang diperoleh dari pengaruh konsentrasi GA3 ke-i, Sukrosa ke-j dan kelompok ke-k
I.1
= nilai rata-rata hasil pengamatan untuk setiap satuan percobaan a i = pengaruh konsentrasi GA3 pada taraf ke-iPj = pengaruh Sukrosa pada taraf ke-j
(ap)ij = pengaruh interaksi perlakuan konsentrasi GA3 pada taraf ke-i dan Sukrosa pada taraf ke-j
Eijk = pengaruh galat untuk pengamatan konsentrasi GA3 ke-i, Sukrosa ke-j dan kelompok ke-k
1 = 1 , 2 , 3 , 4 untuk perlakuan GA3 j = 1,2,3 untuk perlakuan Sukrosa k = 1 , 2 , 3 untuk kelompok ke-k
Percobaan 2 : Pengaruh Konsentrasi Nitrogen dan Fosfor dalam Menginduksi Pembungaan Gloxinia
[image:38.595.36.495.56.768.2]Pada Percobaan 2, rancangan yang digunakan adalah rancangan perlakuan faktorial dengan dua faktor yang disusun dalam Rancangan Lingkungan Acak Kelompok. Faktor pertama adalah Nitrogen (N), terdiri dari 4 taraf konsentrasi dari konsentrasi NH4N03 dan KN03 di dalam komposisi media MS yaitu l x (Nl), 1/5x (N2), 1/10x (N3) dan 1/20x (N4). Faktor kedua adalah Fosfor (F), terdiri dari 2 taraf konsentrasi dari konsentrasi KH2P04 di dalam komposisi media MS yaitu l x (Fl) dan 5x (F2). Percobaan 2 terdiri dari 8 kombinasi perlakuan dan masing-masing perlakuan diulang 3 kali sehingga terdapat 24 satuan percobaan. Setiap ulangan terdiri dari 5 tanaman sebagai satuan amatan sehingga terdapat 120 tanaman dalam percobaan ini. Setiap botol ditanami 1 planlet. Planlet diletakan pada ruang kultur dengan suhu 20°C dan fotoperioda 16 jam/hari.
Gambar 3 Eksplan berupa tunas in vitro yang digunakan untuk induksi pembungaan pada Percobaan 2. (a) eksplan dari kultur in vitro berumur 8 minggu,
Tabel 1 Konsentrasi Nitrogen, Fosfor dan Kalium dalam Media Perlakuan Induksi Pembungaan Gloxinia (Siningia speciosa) secara In Vitro pada Percobaan 2 yang diambil dari Media Murashige dan Skoog (MS)
Perlakuan Total N (mg/l) Total P (mgtl) Total K (mg/l) MS konsentrasi normal 551.86 37.84 784.19
NI FI 551.86 37.84 784.19
NI F2 551.86 189.21 980.85
N2 FI 110.37 37.84 196.33
N2 F2 110.37 189.21 392.99
N3 Fi 55.19 37.84 122.85
N3 Fz 55.19 189.21 319.51
N4 FI 27.59 37.84 86.11
N4 F2 27.59 189.21 282.77
Keterangan : N =Nitrogen, P = Fosfor, K = Kaliun~
Model statistik linier yang digunakan dalam rancangan menurut Mattjik dan Sumertajaya (2002) yaitu :
Yijk =
p
+
a i+
pj+
(aP)ij+
pk+
Eijk, denganYijk = hasil pengamatan yang diperoleh dari pengaruh konseneasi Nitrogen ke-i, Fosfor ke-j dan kelompok ke-k
P = nilai rata-rata hasil pengamatan untuk setiap satuan percobaan a i = pengaruh konsentrasi Nitrogen pada taraf ke-i
Pj = pengaruh konsentrasi Fosfor pada taraf ke-j
(ap)ij = pengaruh interaksi perlakuan konsentrasi Nitrogen pa& taraf ke-i dan Fosfor pa& taraf ke-j
Pk = pengamh kelompok ke-k
Eijk = pengaruh galat untuk pengamatan konsentrasi Nitrogen ke-i, Fosfor ke-j dan kelompok ke-k
i = 1 , 2 , 3 , 4 untuk perlakuan Nitrogen
[image:39.595.63.488.2.810.2]Percobaan 3 : Pengaruh Konsentrasi Nitrogen Dan Fosfor Pada Suhu Dan Fotoperiodisitas Yang Sesuai Dalarn Menginduksi Pembungaan Gloxinia
Rancangan yang digunakan pada Percobaan 3 yaitu rancangan perlakuan faktoiial dengan dua faktor yang disusun dalam Rancangan Lingkungan Acak Kelompok. Faktor pertama adalah Nitrogen (N), terdiri dari 4 taraf konsentrasi dari konsentrasi NH4N03 dan KNO3 di dalam kornposisi media MS yaitu l x (Nl), 1/5x (N2). 1110~ (N3) dan 1120x (34). Faktor kedua adalah Fosfor (F), terdiri dari 2 taraf konsentrasi dari konsentrasi K h P 0 4 di dalam komposisi media MS yaitu l x (Fl) dan 5x (F2). Percobaan 3 terdiri dari 8 kombinasi perlakuan dan tiap perlakuan diulang 3 kali sehingga terdapat 24 satuan percobaan. Setiap ulangan terdiri dari 4 tanaman sebagai satuan arnatan sehingga terdapat 96 tanaman dalam percobaan ini. Setiap botol ditanami 1 planlet. Planlet diletakkan di ruang kultur pada suhu 28°C dengan penyinaran 8 jam cahaya dan suhu 22°C dengan penyinaran 16 jam gelap selama 24 hari. Setelah 24 hari kultur dibiarkan tumbuh pada suhu i 25°C dengan penyinaran 16
Gambar 4 Eksplan berupa tunas in vitro yang digunakan untuk induksi pernbungaan pada Percobaan 3. (a) eksplan dari kultur in vitro berumur 8 minggu,
[image:40.599.49.497.42.787.2]Tabel 2 Konsentrasi Nitrogen, Fosfor dan Kalium dalam Media Perlakuan Induksi Pembungaan Gloxinia (Siningia speciosa) secara In Yitro pada Percobaan 3 yang - Diambil dari Media Murashige dan Skoog (MS)
.
Perlakuan Total N (rngll) Total P (mg/l) Total K (mg/l) MS konsentrasi normal 551.86 37.84 784.19
Nl FI 551.86 37.84 784.19
NI F2 551.86 189.21 980.85
N2 FI 110.37 37.84 196.33
N2 F2 110.37 189.21 392.99
N3 FI 55.19 37.84 122.85
N3 Fz 55.19 189.21 319.51
N4 FI 27.59 37.84 86.11
N4 F2 27.59 189.2 1 282.77
Keterangan : N =Nitrogen, P = Fosfor, K = Kalium
Model statistik linier yang digunakan dalam rancangan menurut Mattijk dan Sumertajaya (2002) yaitu :
Yijk = p
+
a i+
pj+
(ap)ij+
pk+
Eijk, denganYijk = hasil pengamatan yang diperoleh dari pengaruh konsentrasi Nitrogen ke-i, Fosfor ke-j dan kelompok ke-k
P
= nilai rata-rata hasii pengamatan untuk setiap sat- percobaan a i = pengaruh konsentrasi Nitrogen pada taraf ke-ipj = pengaruh konsentrasi Fosfor pada taraf ke-j
(ap)ij = pengaruh interaksi perlakuan konsentrasi Nitrogen pada taraf ke-i
dan Fosfor pada taraf ke-j FJk = pengaruh kelornpok ke-k
Eijk = pengaruh galat untuk pengamatan konsentrasi Nitrogen ke-i, Fosfor ke-j
dan
kelompok ke-k1 = 1 , 2 , 3 , 4 untuk perlakuan Nitrogen j = 1,2 untuk perlakuan Fosfor
[image:41.605.78.504.59.814.2]Untuk mengetahui pengaruh pelakuan dalam penelitian ini dilakukan analisis ragam. Apabila hasil analisis ragam menunjukkan pengaruh yang nyata terhadap peubah yang diamati maka dilakukan uji lanjut DMRT pada taraf 5%.
Palaksanaan Penelitian
Penelitian ini dilaksanakan dengan beberapa tahap antara lain persiapan alat, botol, lingkungan kerja dan bahan tanaman, pembuatan media perlakuan, penanaman eksplan dalam media perlakuan dan pengamatan.
Persiapan Alat, Botol, Lingkungan Kerja dan Bahan Tanaman
Semua peralatan tanam dan cawan petri dicuci dan dikeringkan, kemudian dibungkus dengan kertas. Alat tanarn, cawan petri dan botol kultur disteriliszsi dalam autoklaf selama 1 jam pada suhu 1 2 1 ' ~ dan tekanan 17,5 psi (0.1 bar). Pada saat tanam, semua alat tanam disterilkan dengan perendaman dalam alkohol96% dan nyala api lampu bunsen. Permukaan tempat kerja (Laminar air flow cabinet) sebelum digunakan disterilkan dengan menyemprot alkohol 70% dan dilap dengan kertas tissu. Gloxinia sebelurnnya ditanam pada media pra perlakuan secara in viho selama 12 minggu (Percobaan l), 6 minggu (Percobaan 2) dan 8 minggu (Percobaan 3), kemudian planlet ditanam pada media perlakuan untuk menginduksi pembungaan. Untuk mencegah terjadinya kontaminasi, sebelum ditanam planlet disterilisasi dengan merendam di dalam larutan clorox 10% yang dicampur dengan 15 - 20 tetes bethadin selama 10 menit.
Pembuatan Media Perlakuan
Pembuatan media perlakuan dilakukan dengan cara memipet larutan stok media dasar sebanyak volume yang dibutuhkan, ditambah zat pengatur tumbuh, GA3 dan sukrosa sesuai perlakuan pada Percobaan 1 serta nitrogen dan fosfor sesuai perlakuan pada Percobaan 2 dan 3. Campuran larutan tersebut ditera dengan menambahkan aquades menjadi 1 liter ke dalam labu takar dan kemudian diaduk dengan menggunakan magnetic stirrer. Selanjutnya diukur pH media dengan menggunakan pH meter menjadi 5.8. Untuk menaikkan ataupun menurunkan pH ditambahkan KOH atau HCI 0.1 N sampai mencapai pH yang diinginkan. Media tersebut dimasak bersama agar-agar sampai mendidih, kemudian dimasukkan ke dalam botol kultur steril bervolume 200 ml sebanyak 25 ml/botol, ditutup dengan plastik dan diikat dengan karet gelang. Setelah itu botol kultur yang berisi media disterilkan dengan autoclave selama 20 menit pada suhu 1 2 1 ' ~ dan tekanan 17.5 psi (0.1 bar). Media yang sudah disterilisasi kemudian disimpan selama 3-7 hari untuk melihat ada tidaknya kontaminasi.
Penauaman Eksplan dalam Media Perlakuan
Penanaman dilakukan di dalam laminar a i r j o w cabinet yang telah disemprot alkohol 70% untuk mencegah kontaminasi. Planlet yang ditanam pada media perlakuan berasal dari hasil penanaman pada media pra perlakuan secara in vifro
selama 12 minggu (Percobaan I), 6 minggu (Percobaan 2) dan 8 minggu (Percobaan 3). Pada setiap botol ditanami 1 planlet. Setelah penanaman, kultur pada Percobaan 1 dan 2 disimpan dalam ruang kultur pada suhu 20°C dengan penyinaran 16 jam/hari. Pada Percobaan 3, setelah penanaman kultur faktor lingkungan ruang inkubasi diatur yaitu 8 jam cahaya dengan suhu 28°C dan 16 jam gelap dengan suhu 22°C selama 24 hari. Setelah 24 hari, kultur dibiarkan tumbuh dengan cahaya 16 jam/hari pada suhu rt 25°C.
Pengamatan
1. Persentase tumbuh (%) : C tunas yang tumbuh X 100% C tunas yang digunakan
Kriteri tunas tumbuh adalah tunas yang bertumbuh dan mengalami multiplikasi.
2. Kecepatan tumbuh tunas baru, rentang waktu tumbuhnya tunas dihitung mulai saat ditanam sampai munculnya tunas baru.
3. Kecepatan tumbuh daun baru, rentang waktu tumbuhnya daun dihitung mulai saat ditanam sampai munculnya daun baru.
4. Jumlah tunas, dihitung berdasarkan banyaknya tunas baru yang muncul pada planlet.
5. Jumlah daun total, yang dihitung berdasarkan jumlah daun per botol yang telah membuka sempuma.
Peubah generatif yang diamati adalah :
1. Saat terbentuknya bunga, diamati pada saat perkma inunculnya tunas bunga pada planlet.
2. Jumlah kunturn bunga, dihitung berdasarkan banyaknya kunturn bunga yang ada pada setiap plantlet.
3. Jumlah bunga per tanaman, dihitung berdasarkan banyaknya bunga pada setiap tanaman dalam botol.
4. Jumlah bunga per perlakuan, dihitung berdasarkan banyaknya bunga pada setiap perlakuan
HASIL DAN PEMBAHASAN
HASIL
Percobaan 1 : Pengaruh Konsentrasi Giberelin (GA3) dan Sukrosa dalam Menginduksi Pembungaan Gloxinia
Kondisi Umum
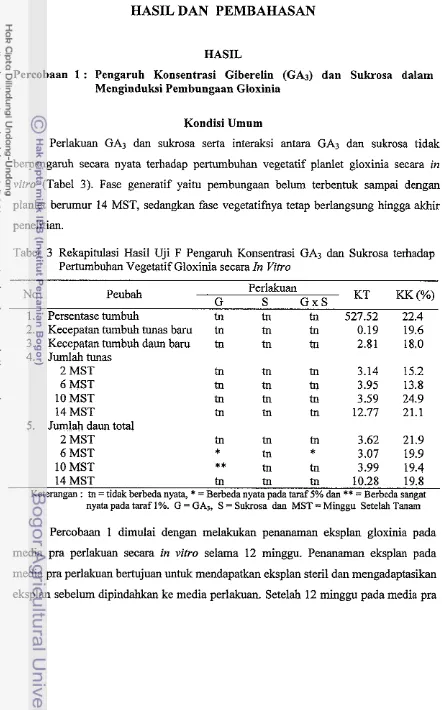
Perlakuan GA3 dan sukrosa serta interaksi antara GA3 dan sukrosa tidak berpengaruh secara nyata terhadap pertumbuhan vegetatif planlet gloxinia secara in
vitro (Tahel 3). Fase generatif yaitu pembungaan belum terbentuk sarnpai dengan planlet berumur 14 MST, sedangkan fase vegetatifnya tetap berlangsung hingga akhir penelitian.
Tabel 3 Rekapitulasi Hasil Uji F Pengaruh Konsentrasi GA3 dan Sukrosa terhadap Pertumbuhan Vegetatif Gloxinia secara In Vifro
No Peubah Perlakuan
G S G x S KT KK(%)
1. Persentase tumbuh tn tn tn 527.52 22.4 2. Kecepatan tumbuh tunas baru
3. Kecepatan tumbuh d a m
baru
4. Jumlahtunas 2 MST 6 MST 10 MST 14 MST
5. Jumlah daun total 2 MST
6 MST 10 MST
14 MST tn tn tn 10.28 19.8
Keterangan : tn = tidak berbeda nyata,
*
= Berbeda nyata pada taraf5% dan**
= Berbeda sangat nyata pada taraf 1%. G = GA3, S = ~ukrosa- clan MST = Minggu Setelahs an&
[image:45.595.55.497.88.798.2]perlakuan, eksplan ditanam pada media perlakuan tanpa mengalami pencucian dengan air steril. Eksplan yang ditanam pada media perlakuan berupa anakan (planlet) gloxinia
Proses pertumbuhan planlet pada media induksi pembungaan mulai terlihat pada satu minggu setelah tanam dan menunjukkan peningkatan yang baik sampai dengan 10 MST, namun diakhir penelitian (14 MST) terjadi penurunan pertumbuhan. Tumbuhnya tunas barn mulai terlihat pada 2 MST sedangkan daun bam mulai telihat pada 4 MST. Pertumbuhan planlet pada media induksi pembungaan yang diberi perlakuan GA3 dan sukrosa dapat dilihat pada Gambar 5.
Planlet yang ditanam umumnya membentuk kalus pada pangkal batang dan daun. Terbentuknya kalus pada planlet mulai terlihat pada 6 MST. Persentase kalus setelah penanaman pada media induksi pembungaan cukup tinggi pada beberapa perlakuan seperti tercantum pada Tabel 4. Persentase kultur yang berkalus pada media induksi ini sebesar 66.7%. Tumbuhnya kalus disebabkan adanya bagian tanaman yang terpotong sehingga bagian potongan itu membentuk kalus. Kalus tersebut pada umumnya benvama hijau kekuningan dan coklat.
Keterangan : A l = GA3 4 mg/l+ Sukrosa 30 g/l, A2 = GA3 4 mg/l+ Sukrosa 40 g/l,
A3 = GAj 4 mg/l+ Sukrosa 50 fl. A4 = GAj 6 mg/l+ Sukrosa 30 g/l,
A5 = GA3 6 mg/l
+
Sukrosa 40 g/l, A6 = GA3 6 mg/l + S u h s a 50 dl, A7 = GA3 8 mg/l+ Sukrosa 30 dl, A8 = GA3 8 mg/l+
Sukrosa 40 dl,A9 = GA3 8 mg/l + Sukrosa 50 g/l, A10 = GA3 10 mg/l
+
Sukrosa 30 gll, [image:47.595.91.468.108.530.2]A l l = GA3 10 mg/l+ Sukrosa 40 g/l, A12 = GA; 10 mg/l
+
Sukrosa 50 g/lGambar 5 Pertumbuhan Planlet Gloxinia 14 MST dengan Perlakuan GA3 dan Sukrosa.
Gambar 6 Kontaminasi pada Kultur Gloxinia : (A) Kontaminasi oleh cendawan (panah biru) dan (B) Kontaminasi oleh bakteri(panah biru).
Terjadinya kontaminasi dapat disebabkan oleh faktor eksternal maupun dari eksplan itu sendii. Kontaminasi ini dapat diatasi dengan melakukan subkultur dengan tujuan penyelamatan planlet namun dalarn kenyataannya dengan subkulturpun masih terjadi kontaminasi.
Tabel 4 Persentase Kultur Berkalus dan Eksplan Terkontaminasi pada Gloxinia secara In Vitro pada Percobaan 1
Perlakuan Persentase Kultur Persentase Eksplan GA3 ( d l ) Sukrosa (dl) Berkalus (%) Terkontaminasi (%)
Persentase Tumbuh
dan mulai menurun pada perlakuan GA3 8 mg/l sampai dengan 10 mg/l. Persentase tumbuh tertinggi dihasilkan oleh perlakuan GA3 6 mg/l pada 14 MST.
Pemberian sukrosa juga tidak memberi pengaruh yang nyata terhadap persentase turnbuh gloxinia secara in vitro (Tabel 5). Peningkatan konsentrasi sukrosa 30 g/l sampai dengan 40 g/l menyebabkan persentase tumbuh gloxinia cenderung stabil dan mulai menurun pada perlakuan 50 g/l sukrosa. Persentase tumbuh tertinggi dihasilkan juga dari perlakuan sukrosa 30 dan 40 g/l.
Tabel 5 Pengaruh GA3 dan Sukrosa terhadap Persentase Tumbuh, Kecepatan ~ u m b u h Tunas Baru dan Kecepatan Tumbuh Daun Baru Gloxinia secara In
T/i'tro pada Percobaan 1
Perlakuan Persentase Tumbuh Kecepatan Tumbuh Kecepatan Turnbuh (??) Tunas Baru (MST) Daun Baru (MST) GA3 (mg/l)
4 70.4 2.2 4.7
6 81.5 2.3 6.1
8 74.1 2.15 5.7
10 66.7 2.15 5.3
Sukrosa (gh)
30 77.8 2.3 5.2
40 77.8 2.3 5.2
50 63.9 2.0 5.9
Keterangan : MST = Minggu Setelah Tanam. Angka yang ditampilkan rnerupakan data asli dan pengolahan data dengan transformasi (x + 0.5)'~
[image:49.595.53.494.2.807.2]Tabel 6 Pengaruh Kombinasi GA3 dan Sukrosa terhadap Persentase Tumbuh, Kecepatan Tumbuh Tunas Baru dan Kecepatan Tumbuh Daun Baru Gloxinia secara In Vitro pada Percobaan 1
Perlakuan Persentase Tt
' ' Keceoatan Keceoatan
GA3 (mgll) Sukrosa (gll)
(%I
Baru (MST) Baru (MST)4 30 66.7 2.0 4.2
4 40 88.9 2.0 4.4
4 50 55.5 2.7 5.3
6 30 100 2.9 5.6
6 40 77.8 2.0 6.9
6 50 66.7 2.0 5.8
8 30 55.5 2.0 6.4
8 40 88.9 2.0 4.4
8 50 77.8 2.4 6.2
10 30 88.9 2.4 4.6
10 40 55.5 2.0 5.1
10 50 55.6 2.0 6.3
Keterangan : MST = Minggu Setelah Tanam. Angka yan ditampilkan merupakan data asli dan pengolahan data dengan lransfomasi (x + 0.5) $2
Kecepatan Tumbuh Tunas Baru
Perlakuan GA3 tidak berpengamh secara nyata terhadap kecepatan tumbuh tunas baru gloxinia secara in viiro (Tabel 5). Tunas baru yang muncul semakin lambat dengan bertambahnya konsentrasi GA3 dari 4 mg/l sampai dengan 6 mg/l dan cenderung mulai meningkat pada perlakuan GA3 8 mg/l. Pada perlakuan 8 mg/l GA3 sampai dengan 10 g/l tunas baru yang muncul cenderung stabil. Eksplan tercepat menghasilkan tunas baru diperoleh dari perlakuan GA3 8 dan 10 mg/l, sedangkan eksplan yang terlama mengahasilkan tunas baru diperoleh dari perlakuan GA3 6 mg/l.
[image:50.595.50.497.93.806.2]Interaksi antara GA3 dan sukrosa tidak berpengaruh secara nyata terhadap kecepatan tumbuh tunas baru gloxinia secara in vitro (Tabel 6). Berdasarkan hasil analisis ragam, eksplan yang tercepat menghasilkan tunas baru diperoleh dari perlakuan GA3 4 mgll dengan sukrosa 30 g/l, GA3 4 mg/l dengan sukrosa 40 g/l, GA3 6 mg/l dengan sukrosa 40 g/l, GA3 6 mg/l dengan sukrosa 50 g/l, GA3 8 m d l dengan sukrosa 30 g/l, GA3 8 mgA dengan sukrosa 40 g/l, GA3 10 mg/l dengan sukrosa 40 g/l dan GA3 10 mg/l dengan sukrosa 50 g/l. Eksplan yang terlama menghasilkan tunas baru diperoleh dari perlakuan GA; 6 mg/l dengan sukrosa 30 g/l.
Kecepatan Tumbuh Daun Baru
Hasil analisis ragam menunjukkan bahwa perlakuan GA3 tidak berpengaruh secara nyata terhadap kecepatan tumbuh d a m baru gloxinia secara in vitro (Tabel 5). Munculnya daun baru gloxinia semakin lambat dengan bertambahnya konsentrasi perlakuan GA3 sampai dengan 6 mg/l dan pada perlakuan GA3 8 mg/l sampai dengan 10 mg/l munculnya daun baru cenderung semakin cepat. Eksplan tercepat menghasilkan daun baru diperoleh dari perlakuan GA3 4 mg/l dan yang terlama mengahasilkan dam baru diperoleh dari perlakuan GA3 6 mg/l.
Perlakuan sukrosa juga tidak memberikan pengaruh yang nyata terhadap kecepatan tumbuh d a m baru gloxinia secara in vitro (Tabel 5). Pada perlakuan sukrosa 30 g/l sampai dengan 40 g/l, daun baru gloxinia yang muncul semakin stabil dan cenderung mengalami penurunan pada perlakuan sukrosa 50 g/l. Perlakuan sukrosa 30 dan 40 g/l merupakan perlakuan yang paling cepat menghasilkan daun baru, sedangkan perlakuan sukrosa 50 g/l yang paling lama menghasilkan daun baru
.
Interaksi antara GA3 dan sukrosa tidak berpengaruh secara nyata terhadap kecepatan turnbuh daun baru gloxinia secara in vitro (Tabel 6). Kecepatan tumbuh d a m baru cendemg menurun pada perlakuan GA3 4 mg/l dengan sukrosa 30 g/l
sampai dengan 50 gll. Demikian juga pada perlakuan GA3 10 mgll dengan sukrosa 30
perlakuan GA3 6 mg/l dengan sukrosa 50 gA dan perlakuan GA3 8 mg/l dengan sukrosa 40 g/l, namun pada perlakuan GA3 8 mg/l dengan sukrosa 50 g/l tejadi penurunan kecepatan tumbuh daun baru. Eksplan yang tercepat menghasilkan daun baru diperoleh dari perlakuan GA3 4 mgll dengan sukrosa 30 g/l.
Jumlah Tunas
Pada semua perlakuan, eksplan mengalami proliferasi tunas. Proliferasi tunas mulai terjadi pada minggu ke-2 setelah dikulturkan. Tunas yang terbentuk umumnya berasal dari kultur yang berkalus baik pada akar maupun daun.
Hasil analisis ragam menunjukkan bahwa respons tanaman yang diberi perlakuan GA3 terhadap jumlah tunas gloxinia secara in vitro, tidak berpengaruh secara nyata (Tabel 7). Pemberian GA3 4 mgA s m p a i dengan 10 mg/l menyebabkan proliferasi tunas gloxinia terhambat. Pada 2 MST sampai dengan 14 MST jumlah tunas cenderung terus meningkat, namun pada 10 MST sampai dengan 14 MST pemberian GA3 4 mg/l menurunkan jumlah tunas gloxinia. Jumlah tunas cenderung meningkat pada 2 MST dan 10 MST dengan bertambahnya konsentrasi perlakuan GA3 hingga 6 mg/l dan mulai menurun pada perlakuan 8 mgA hingga 10 mgA. Sebaliknya, semakin meningkatnya konsentrasi GA3 pada 6 MST menyebabkan jumlah tunas yang dihasilkan semakin menurun. Demikian juga cenderung terjadi peningkatan jumlah tunas yang diperoleh dari perlakuan GA3 4 mgA sampai dengan 8 mgA pada 14 MST dan mengalami penurunan pada perlakuan GA3 10 mg/l. Jumlah tunas tertinggi d i i i l k a n dari perlakuan GA3 8 mg/l.
Tabel 7 Pengamh GA3 dan Sukrosa terhadap