KERAGAMAN AKTINOMISET
CULTURABLE
DAN
UNCULTURABLE
YANG BERASOSIASI DENGAN SPONS
Neofibularia
sp. ASAL PULAU BIRA, INDONESIA
CICO JHON KARUNIA SIMAMORA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Aktinomiset Culturable dan Unculturable yang Berasosiasi dengan Spons Neofibularia sp. Asal Pulau Bira Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
RINGKASAN
CICO JHON KARUNIA SIMAMORA. Keragaman Aktinomiset Culturable dan Unculturable yang Berasosiasi dengan Spons Neofibularia sp. Asal Pulau Bira, Indonesia. Dibimbing oleh YULIN LESTARI dan DEDY DURYADI SOLIHIN. Neofibularia sp. merupakan salah satu spons laut yang berpotensi menghasilkan senyawa toksik yang tinggi. Senyawa toksik spons laut diproduksi oleh komunitas mikrob yang berasosiasi, diantaranya aktinomiset. Aktinomiset yang berasosiasi dengan Neofibularia sp. memiliki keragaman yang tinggi, sehingga berpotensi mendapatkan spesies indigenous novel. Aktinomiset laut diketahui merupakan penghasil senyawa bioaktif yang berpotensi sebagai antibakteri, antifungi, antitumor, antikanker, inhibitor enzim dan beragam manfaat lain. Selama ini komunitas aktinomiset yang dikaji terbatas pada aktinomiset yang dapat dikulturkan (culturable), sedangkan aktinomiset unculturable yang berasosiasi dengan spons laut belum diketahui. Oleh karena itu penelitian ini bertujuan untuk mengidentifikasi keragaman aktinomiset culturable dan unculturable yang berasosiasi dengan spons Neofibularia sp. asal Pulau Bira, Indonesia.
Aktinomiset culturable diisolasi menggunakan media Humic Acid Vitamin Agar (HVA) dan dipurifikasi menggunakan media Yeast Starch Agar (YSA). Isolat yang diperoleh diidentifikasi secara morfologi berdasarkan warna hifa aerial, bentuk koloni, tipe spora, dan pigmentasi pada media padat. Identifikasi molekuler dilakukan dengan mengekstrak DNA genom 5 isolat terpilih menggunakan GeneaidGenomic DNA Mini Kit, dan diamplifikasi gen 16S rRNA. Aktinomiset unculturable dianalisis dengan mengekstrak total DNA genom spons menggunakan MoBioPower Soil DNA Isolation Kit. Gen 16S rRNA diamplifikasi dengan nested PCR menggunakan primer spesifik aktinomiset dan menghasilkan produk berukuran 1087 pb dan 180 pb. Analisis komunitas aktinomiset unculturable dilakukan menggunakan denaturing gradient gel electrophoresis (DGGE). Gen 16S rRNA aktinomiset culturable dan unculturable yang diperoleh, diurutkan basa nukleotidanya dan dianalisis kekerabatannya menggunakan software bioinformatika MEGA 6.
Profil DGGE gen 16S rRNA menunjukkan keragaman komunitas aktinomiset unculturable yang diwakili oleh 13 pita DGGE. Hasil separasi pita gen 16S rRNA dipotong dan di re-PCR menggunakan primer non GC clamps untuk sequencing. Hasil pensejajaran basa nukleotida pita DGGE terhadap galur pembanding dari database GenBank menunjukkan hubungan kekerabatan 13 pita dengan identitas maksimum berkisar 87-100% terhadap 5 genus rare-aktinomiset yaitu Ferrithrix, Thermobispora, Aciditerrimonas, Lamia, Propionibacterium, dan unculture bacterium clone. Delapan pita DGGE memiliki kekerabatan tertinggi sebesar 94% dengan Ferrithrix thermotolerans. Nilai identitas maksimum <97.5% merupakan indikator suatu isolat berbeda dengan galur pembandingnya dan terindikasi spesies novel.
Konstruksi pohon filogenetik antara aktinomiset culturable dan unculturable menunjukkan hasil yang berbeda. Komunitas aktinomiset culturable didominasi oleh Streptomyces spp. sedangkan komunitas aktinomiset culturable dan unculturable didominasi oleh kelompok non-Streptomyces spp. Hal ini dipengaruhi oleh rendahnya kelimpahan Streptomyces spp. pada spons Neofibularia sp., sehingga tidak teramplifikasi dan tidak ditemukan pada konstruksi filogenetik aktinomiset culturable dan unculturable. Komunitas aktinomiset unculturable tidak ditemukan pada konstruksi filogenetik aktinomiset culturable dipengaruhi oleh media isolasi dan kondisi inkubasi yang belum sesuai untuk aktinomiset tersebut tumbuh.
SUMMARY
CICO JHON KARUNIA SIMAMORA. Biodiversity of Culturable and Unculturable Actinomycetes Associated with Sponge Neofibularia sp. Origin of Bira Island, Indonesia. Supervised by YULIN LESTARI and DEDY DURYADI SOLIHIN.
Neofibularia sp. is a sea sponge which potentially produce high toxic compounds. Toxic compounds produced by marine sponges associated microbial communities, including actinomycetes. Actinomycetes associated with Neofibularia sp. have a high diversity, thus potentially gaining novel indigenous species. Marine actinomycete are known to be producing bioactive compounds that have the potential as an antibacterial, antifungal, antitumor, anticancer, enzyme inhibitors and varieties of other benefits. During this limited community of actinomycetes studied in actinomycetes that can be cultivated (culturable), while actinomycetes unculturable associated with marine sponges unknown. Therefore, the aims of study were to identify the diversity of culturable actinomycetes and unculturable associated with sponge Neofibularia sp. origin Bira Island, Indonesia.
Culturable actinomycete was isolated using Humic Acid Vitamin (HV) agar medium and purified in Yeast Starch Agar (YSA) medium. The isolates were identified based on morphology of acquired color of aerial hypha, type of spores, colony form, and pigmentation on solid medium. Molecular identification was conducted by extracting the genomic DNA from 5 selected isolates using the Geneaid Genomic DNA Mini Kit, and 16S rRNA gene amplification. Unculturable actinomycetes were analyzed by extracting total DNA from sponge was amplified genome using MoBio Power Soil DNA Isolation Kits. Then, 16S rRNA gene was amplified using specific primer of actinomycetes through nested PCR technique. 16S rRNA gene amplification produced two kinds of amplicons 1087 bp and 180 bp in size. Unculturable actinomycete community analysis was performed by denaturing gradient gel electrophoresis (DGGE). 16S rRNA gene sequence of culturable and unculturable actinomycetes were analyzed phylogenetically using bioinformatics software MEGA 6.
Analysis of 16S rRNA gene sequence showed five isolates (NOAq 1.1, NRSw 4.1, NOAq 1.3 NOAq, 1.3, and 1.4 NOAq) are closely related to S. sampsonii, S. albus, S. resistomicificus, S. erringtonii, and S. gougeroti with maximum identity up to 97-99%. Five isolates have a high similarity of 16S rRNA with their comparison isolates, but they were distinct in morphology. Base on morphological identification, colonies of S. sampsonii was yellowish white with smooth colony surface and rectiflexibiles spore, whereas the color of three isolate colonies were reddish-white, white, brown, grey, brownish white, and unsmooth surface. Those results indicated that culturable actinomycete isolates was different and suspicious as novel strains
GenBank. The thirteen bands showed the similarity ranged around 87 up to 100% with five genus of rare-actinomycete such as Ferrithrix, Aciditerrimonas, Lamia, Thermobispora, Propionibacterium, and Unculture bacterium clone. Eight of DGGE bands were around 94% similar to Ferrithrix thermotolerans. Maximum identity have under 97.5% was an indicator which was a species distinct with the comparison species and suspicious as a novel species.
Construction of phylogenetic tree between culturable and unculturable actinomycetes were different. Culturable actinomycete community was dominated by Streptomyces, while unculturable actinomycetes community was dominated by non-Streptomyces groups. The differences among phylogenetic trees were influenced by the low abundance of Streptomyces sp. in the sponge Neofibularia sp., so they were not amplificate and were not find in the construction of unculturable actinomycetes phylogenetic tree. Unculturable actinomycetes community was not find on the construction of culturable actinomycetes phylogenetic tree because the isolation medium and incubation condition were not appropriate yet.
©
Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KERAGAMAN AKTINOMISET
CULTURABLE
DAN
UNCULTURABLE
YANG BERASOSIASI DENGAN SPONS
Neofibularia
sp. ASAL PULAU BIRA, INDONESIA
CICO JHON KARUNIA SIMAMORA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga penyusunan karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan dari bulan Juni 2014 sampai dengan Mei 2015 ini ialah keragaman aktinomiset spons laut asal Pulau Bira Kepulauan Seribu di Indonesia, dengan judul Keragaman Aktinomiset Culturable dan Unculturable yang Berasosiasi dengan Spons Neofibularia sp. Asal Pulau Bira, Indonesia.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Yulin Lestari sebagai ketua komisi pembimbing dan Bapak Dr Ir Dedy Duryadi Solihin, DEA sebagai anggota komisi pembimbing, yang telah banyak memberikan nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Ibu Dr Suryani, MSc dan Ibu Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Kepada BPPDN DIKTI 2013/2014 terima kasih atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB, sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga mengucapkan terima kasih tak terhingga kepada Bapak Anggiat Simamora (Alm), Ibu Tiomas Damanik S.Pd, adikku tercinta dr. Cika Tio Anggela Simamora S.Ked dan Chinda Setia Lestari Simamora atas doa, dukungan, kasih sayang, dan semangat yang diberikan. Ucapan terima kasih juga penulis ucapkan kepada kepada Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, kepada Ibu Retnowati selaku staf Laboratorium Terpadu Biologi IPB, Mba Sari, Kak Sipri, Kak Aar, Kak Mona, Mbak Mei, serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Penulis juga mengucapkan terimakasih kepada sahabat-sahabatku tersayang, atas kebersamaan yang singkat, penuh makna, dan sangat indah bagi teman-teman seperjuangan Noor, Naswandi, Bang Riskyhadi, grup Satu Tesis Satu Pikiran, Grup Semangat Pintar Cerdik, Grup Mikrotropisian 2013, dan Pascasarjana Mikrobiologi IPB angkatan 2013. Kepada teman di Pascasarjana Mikrobiologi IPB 2012, 2013 dan 2014, teman-teman di Biologi IPB, serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2015
DAFTAR ISI
Aktinomiset Asal Spons Laut 5
Metagenomik 6
METODE 9
Kerangka Penelitian 9
Waktu dan Tempat Penelitian 9
Pengambilan Sampel dan Identifikasi Spons Laut 10 Isolasi dan Karakterisasi Aktinomiset Culturable dari Spons Laut 10 Isolasi Genom Aktinomiset Culturable Spons Laut 10 Isolasi Genom Total Aktinomiset Unculturable 11 Amplifikasi Gen 16S rRNA Aktinomiset Culturable dan Unculturable
Asal Neofibularia sp. 12
Analisis DGGE (Denaturing Gradient Gel Electrophoresis)
Aktinomiset Unculturable 13
Sekuensing Gen 16S rRNA Aktinomiset Culturable dan Unculturable 13 Analisis Bioinformatik dan Konstruksi Pohon Filogenetik 13
HASIL DAN PEMBAHASAN 14
Hasil 14
Karakteristik Morfologi Sampel Spons Neofibularia sp. Asal Pulau
Bira 14
Efektivitas Preparasi Penyimpanan Sampel Spons 14 Isolasi Aktinomiset Culturable yang Berasosiasi pada Neofibularia
sp. 14
Keragaman Aktinomiset Culturable yang Berasosiasi pada
Neofibularia sp. 15
Identifikasi Gen 16S rRNA Aktinomiset Culturable yang
Berasosiasi pada Neofibularia sp. 16
Total DNA Genom Spons Neofibularia sp. 19
Analisis DGGE Total Komunitas Aktinomiset Unculturable yang
Keragaman Struktur Komunitas Aktinomiset yang Berasosiasi pada
Spons Neofibularia sp. 22
Urutan Basa Region V3 Gen 16S rRNA dan Analisis Single Nucleotide Polymorphism (SNP) Sekuen Basa Struktur Komunitas
Aktinomiset 26
Pembahasan 29
Karakteristik Morfologi Spons Neofibularia sp. 29 Keragaman Aktinomiset Culturable dengan Teknik Kultivasi 29 Keragaman Struktur Komunitas Aktinomiset dengan Pendekatan
Metagenomik DGGE 31
Analisis Single Nucleotide Polymorphism (SNP) pada Region V3
Sekuen Pita DGGE 32
Perbandingan Keragaman Aktinomiset Culturable dan Unculturable 33
SIMPULAN DAN SARAN 35
Simpulan 35
Saran 35
DAFTAR PUSTAKA 36
LAMPIRAN 44
DAFTAR TABEL
1 Karakteristik morfologi aktinomiset asosiatif spons Neofibularia sp. 15 2 Konsentrasi dan kemurnian DNA genom hasil ekstraksi dari sampel
spons asal Pulau Bira 16
3 Hasil BLAST sekuen gen 16S rRNA aktinomiset culturable yang
berasosiasi pada spons Neofibularia sp. 18
4 Konsentrasi dan kemurnian DNA genom hasil ekstraksi dari sampel
spons asal Pulau Bira 20
5 Hasil BLAST sekuen gen 16S rRNA aktinomiset unculturable yang
berasosiasi pada spons Neofibularia sp. 24
6 Konsentrasi DNA pita DGGE aktinomiset unculturable yang
berasosiasi pada Neofibularia sp. 26
7 Analisis SNP pada 4 pita DGGE yang mirip dengan Propionibacterium
acnes galur KPA171202 27
8 Analisis SNP pada 8 pita DGGE yang mirip dengan Ferrithrix
thermotolerans galur Y005 28
9 Analisis SNP pada 13 pita DGGE yang mengelompokkan keseluruhan
sekuen kedalam 2 genus 28
DAFTAR GAMBAR
1 Analisis metagenomik komunitas mikrob di lingkungan berdasarkan
DNA genom 7
2 Diagram alir tahapan penelitian 9
3 Isolat aktinomiset culturable yang berasosiasi pada Neofibularia sp. secara makroskopis dan mikroskopis dengan mikroskop cahaya
perbesaran 400x 15
4 Hasil amplifikasi PCR gen 16S rRNA (1087 pb) dengan primer 27F
dan 16sact1114R. 17
5 Pohon filogenetik gen 16S rRNA aktinomiset culturable yang
berasosiasi pada Neofibularia sp. dengan piranti lunbak MEGA 6 19 6 Hasil PCR gen 16S rRNA sampel spons laut asal Pulau Bira
Kepulauan Seribu. 20
7 Hasil DGGE pada Gel Poliakrilamida 21
8 Hasil amplifikasi ulang pita hasil DGGE dengan primer 338F non GC
clamp dan 518R. 22
9 Profil filogenetik gen 16S rRNA aktinomiset unculturable spons
Neofibularia sp. hasil isolasi dari gel DGGE 23
10 Ordinal sekuen basa 4 pita DGGE yang mirip dengan
Propionibacterium acnes galur KPA171202 27
11 Ordinal sekuen basa 8 pita DGGE yang mirip dengan Ferrithrix
DAFTAR LAMPIRAN
1 Spons Neofibularia sp. asal Pulau Bira Kepulauan Seribu 44 2 Isolat aktinomiset culturable yang berasosiasi pada Neofibularia sp. 45 3 Analisis SNP sekuen gen 16S rRNA 4 pita DGGE yang mirip dengan
Propionibacterium acnes 46
4 Analisis SNP sekuen gen 16S rRNA 8 pita DGGE yang mirip dengan
Ferrithrix thermotolerans 47
5 Analisis SNP sekuen gen 16S rRNA 13 pita DGGE terhadap
pengelompokkan genus aktinomiset 48
6 Hasil sekuensing gen 16S rRNA lima isolat aktinomiset culturable yang
berasosiasi pada Neofibularia sp. 49
7 Hasil sekuensing gen 16SrRNA tiga belas isolat aktinomiset
PENDAHULUAN
Latar Belakang
Spons laut merupakan organisme sesil kuno yang telah ada sejak 600 juta tahun yang lalu dan berperan penting membangun ekosistem terumbu karang. Spons memperoleh nutrisi melalui proses penyaringan partikel makanan dengan memompa air laut masuk ke tubuhnya (Hentschel et al. 2012). Keragaman spons di Indonesia tinggi dipengaruhi letak geografis di antara Samudera Hindia dan Pasifik. Spons yang ditemukan di perairan Indonesia terdiri dari banyak famili dan mencapai 830 spesies (Hutomo dan Moosa 2005). Pulau Bira merupakan salah satu bagian dari Taman Nasional Bahari Kepulauan Seribu yang memiliki keragaman spons laut yang tinggi, salah satunya adalah Neofibularia sp.
Neofibularia sp. merupakan spons yang dilaporkan menghasilkan senyawa toksik yang berpotensi sebagai antileishmanial, antimalaria, dan antibakteri (Thompson dan Gallimore 2013), dan berpotensi menghasilkan protein phosphatase inhibition (PPI) dengan aktivitas moderat melawan Bacillus subtilis (Fagerholm 2010). Neofibularia sp. memiliki jaringan penghubung, dinding silinder tebal bertumpuk, dengan saluran keluar yang terbuka (Sheppard 2010). Genus ini termasuk famili Desmacellidae yang secara luas terdistribusi di perairan dunia, dari perairan dangkal sampai kedalaman 2165 m (Young dan Chung 2008). Senyawa bioaktif yang dihasilkan spons diduga dihasilkan oleh asosiasi mikrobnya (Peraud 2006). Spons memiliki organ sederhana hasil evolusi yang menjadi mikrohabitat penting komunitas bakteri simbiotik, arkea, dan eukariot uniseluler pada jaringan spons (Taylor et al. 2007). Mikrob yang berasosiasi pada spons dapat mencapai kepadatan 109 sel per cm3 yang mencakup 35% dari total biomassa jaringan spons (Hentschel et al. 2012). Mikrob yang berasosiasi sebagian besar mendiami mesohil yang menyusun jaringan ekstraseluler spons, akan tetapi beberapa simbion juga ditemukan di ruang intraseluler berdasarkan visualisasi mikroskop elektron (Vacelet et al. 1977). Spons merupakan organisme yang memiliki asosiasi erat dengan beragam mikrob high microbial abundance (HMA) (Hentschel et al. 2003). Hal inilah yang menyebabkan keragaman bakteri yang berasosiasi dengan spons tinggi termasuk di antaranya aktinomiset (Sun et al. 2010).
2
perkembangan spons seperti penyediaan nutrisi, penstabilan skeleton, dekomposisi sisa metabolit, perlindungan dari UV, dan pertahanan dari senyawa racun (Shick dan Dunlap 2002). Senyawa bioaktif yang dihasilkan aktinomiset spons memiliki perbedaan struktur metabolit dengan aktinomiset lingkungan terrestrial (Drummond 2006). Struktur senyawa yang berbeda menimbulkan dugaan dihasilkan oleh aktinomiset yang berbeda pula (Pathirana et al. 1992). Hal inilah yang mendasari pentingnya mengetahui keragaman komunitas aktinomiset dari habitat yang belum tereksplor dan berperan sebagai sumber komponen bioaktif baru (Mincer et al. 2002).
Komunitas aktinomiset yang berasosiasi dengan spons beragam, teknik kultivasi yang tepat dapat meningkatkan peluang tumbuh aktinomiset culturable yang kelimpahannya rendah pada jaringan spons. Mikrob yang dapat dikultivasi kurang dari 1% sedangkan 99% merupakan mikrob unculturable. Aktinomiset unculturable sulit diidentifikasi morfologi sehingga dikembangkan pendekatan metagenomik untuk mengetahui keragaman aktinomiset culturable dan unculturable melalui amplifikasi gen 16S rRNA. Pendekatan metagenomik dengan amplifikasi gen 16S rRNA dapat menunjukkan kekerabatan beberapa spesies mikrob menggunakan denaturing gradien gel electrophoresis (DGGE) untuk memisahkan gen berukuran sama namun memiliki urutan nukleotida berbeda (Fischer dan Lerman 1983). Urutan basa nukleotida DNA dipisahkan secara parsial berdasarkan pengurangan mobilitas elektroforesis pasangan basa yang terdenaturasi pada gel poliakrilamida dengan gradien denaturan yang bertambah secara teratur (Mahyarudin 2015).
Aplikasi DGGE dapat menganalisis profil keragaman komunitas aktinomiset culturable dan unculturable berdasarkan identifikasi gen 16S rRNA. Sejauh ini di Indonesia penelitian mengenai analisis komunitas aktinomiset yang berasosiasi dengan spons Neofibularia sp. menggunakan pendekatan dengan teknik kultivasi dan metagenomik DGGE belum banyak dilakukan sehingga sangat menarik untuk dikaji. Deskripsi hasil penelitian yang disampaikan dalam makalah ini merupakan informasi baru tentang keragaman aktinomiset yang berasosiasi dengan spons Neofibularia sp. asal Pulau Bira, Kepulauan Seribu, Indonesia.
Perumusan Masalah
Spons laut termasuk dalam filum Porifera, berperan penting sebagai indikator ekologi, sumber antiviral, antikanker, antibakteri dan bahan kosmetik. Senyawa bioaktif spons ternyata dihasilkan pula oleh mikrob yang berasosiasi salah satunya aktinomiset. Aktinomiset merupakan kelompok bakteri penghasil senyawa bioaktif tertinggi dibandingkan kelompok bakteri lainnya. Aktinomiset mampu beradaptasi pada berbagai lingkungan, termasuk diantaranya adalah lingkungan laut yang masih belum banyak dieksplorasi keragamannya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji keragaman aktinomiset menggunakan dua pendekatan yaitu dengan cara isolasi koloni (culturable) dan metagenomik DGGE (total komunitas culturable dan unculturable) yang berasosiasi dengan spons Neofibularia sp. asal Pulau Bira, Kepulauan Seribu, Indonesia.
Manfaat Penelitian
Kajian mengenai keragaman aktinomiset dengan cara isolasi konvensional dan pendekatan metagenomik DGGE diharapkan dapat memberikan informasi mengenai keseluruhan aktinomiset yang berasosiasi dengan spons laut Neofibularia sp. asal Pulau Bira Kepulauan Seribu Indonesia. Selain itu dapat diperoleh kelompok aktinomiset culturable dari total komunitas aktinomiset spons yang selanjutnya akan dikembangkan sebagai sumber penghasil senyawa bioaktif baru.
Ruang Lingkup Penelitian
4
TINJAUAN PUSTAKA
Spons Laut
Spons merupakan organisme laut Porifera yang hidup menetap pada suatu permukaan, memiliki sistem pori, ostia, kanal dan ruang saluran air yang melewati tubuh spons. Air masuk ke dalam spons melewati saluran pernapasan dan keluar melewati oscules (Peraud 2006). Spons bersifat non selective filter feeder, dan umum dijumpai di perairan tropik hingga subtropik dengan penyebaran dari zona intertidal hingga zona subtidal dalam suatu perairan. Klasifikasi spons terbagi menjadi 4 kelas yaitu Calcarea, Hexactinellida, Archaeocyatha, dan Demospongiae. Demospongiae mempunyai anggota terbesar sekitar 90% dari keseluruhan spons laut yaitu 4500-5000 spesies (Subagio dan Aunurohim 2013)
Komunitas spons laut pada suatu perairan dapat menjadi bioindikator kualitas air laut dan dimanfaatkan sebagai sumber senyawa bioaktif (Subagio dan Aunurohim 2013). Senyawa bioaktif yang dihasilkan memiliki perbedaan struktur dan aktivitas, meliputi poliketida, alkaloid, sterol, peptida siklik, dan terpenoid (Proksch et al. 2002; Peraud 2006). Senyawa bioaktif yang dihasilkan spons berperan sebagai antikanker, antiparasitik, antiviral, antiinflamasi, antibiotik, antipencemaran dan herbisida (Osinga et al. 1998).
Komponen bioaktif pertama yang diisolasi dari spons dan dikembangkan secara luas adalah nukleosida spongouridin dan spongotimidin dari spons Cryptotethya crypta (Bergmann dan Feeney 1951). Komponen ini dikembangkan sebagai obat antivirus, vidarabin, dan sitarabin. Selain itu dilaporkan pula Haliclona simulans menggunakan teknik metagenom berpotensi menghasilkan lipase halo-tolerant (Selvin et al. 2009). Spons Ircinia fusca diketahui menghasilkan kolagen yang telah dikarakterisasi secara biokimia (Pallela et al. 2011). Spons Geodia barretti telah dikarakterisasi senyawa bioaktif antifouling yang diperoleh dari laut Swedia (Sjogren 2006). Spons Discodermia dissoluta merupakan spons yang diketahui berpotensi senyawa antikanker berupa discodermolide, yang termasuk poliketida sebagai obat Pacitaxel (taxol) (Haygood et al. 1999). Spons merah tropis Oceanapia sp. menghasilkan metabolit sekunder piridoakrin alkaloid kuanoniamin C dan D yang berwarna merah dan berfungsi untuk pertahanan alami spons terhadap serangan predator laut (Schupp et al. 1999).
Komunitas Mikrob Spons
beberapa kemungkinan salah satunya dari aliran air yang melewati spons dan bertahan terhadap respon imunitas alami spons. Beberapa mikrob yang berasosiasi pada spons mempunyai struktur kapsul yang menyelubungi tubuhnya berfungsi untuk melindungi sel mikrob dari arkeosit spons (Friedrich et al. 1999). Komunitas mikrob spons laut memiliki hubungan asosiasi yang unik, yang dipengaruhi oleh kondisi inang, lingkungan serta kemampuan adaptasi. Koanosit spons laut berperan dalam proses penyaringan air laut sehingga dapat mengakumulasi mikrob pada jaringan interior (mesohil) spons (Sharp et al. 2007). Komunitas mikrob spons sebagian besar didominasi oleh sel tunggal bakteri atau kelompok arkea, asosiasi yang terjadi berperan penting dalam produksi komponen bioaktif, fiksasi karbon autotropik, serta translokasi nutrisi dan antioksidan bagi spons (Hentschel et al. 2003). Komunitas mikrob pada beberapa generasi spons memiliki perbedaan kelimpahan dan keragaman mikrob yang dipengaruhi oleh mekanisme transmisi vertikal mikrob simbion, yang dibuktikan dengan kajian ultrastruktural mikrob pada spons (Usher et al. 2004).
Mikrob yang berasosiasi dengan spons berperan terhadap produksi senyawa metabolit sekunder spons. Spons Aplysina aerophoba memiliki komunitas mikrob yang beragam diantaranya filum Chloroflexy, Proteobacteria, Cyanobacteria, Actinobacteria, Acidobacteria, dan Bacteroidetes yang diketahui menghasilkan senyawa brominated alkaloid (BAs) (Soriano et al. 2010). Keragaman mikrob yang dapat dikultivasi kurang dari 1% total komunitas mikrob spons (Buck 1974). Keterbatasan ini menjadi peluang yang besar untuk menemukan spesies mikrob baru yang berasosiasi dengan spons.
Aktinomiset Spons Laut
Aktinomiset merupakan kelompok terbesar penghasil antibiotik dibandingkan dengan kelompok bakteri lainnya yaitu sekitar 2/3 antibiotik di dunia (Berdy 1989). Aktinomiset banyak dikenal sebagai bakteri tanah berfilamen, dengan kandungan guanin dan sitosin (G+C) yang tinggi (> 55%) di dalam keseluruhan genomnya (Miyadoh 1977).
Menurut Stackebrandt et al. (1997) secara taksonomi aktinomiset dapat diklasifikasikan sebagai berikut :
Domain : Bakteri Filum : Actinobacteria Kelas : Actinobacteria Subkelas : Actinobacteridae Ordo : Actinomycetales
Komunitas aktinomiset tidak hanya terdapat di lingkungan tanah akan tetapi juga di lingkungan sedimen (Moran et al. 1995). Maldonado et al. (2005) menemukan genus aktinomiset pertama yang terdapat di lingkungan sedimen yaitu Salinispora. Keragaman aktinomiset di lingkungan laut tidak terlalu tinggi, akan tetapi memiliki potensi yang besar sebagai sumber senyawa bioaktif baru (Peraud 2006).
6
Streptomyces sp. galur KM86-9B berhasil diisolasi dari spons Korea yang berpotensi menghasilkan senyawa inhibitor topoisomerase I, yang berperan menghambat supercoiling DNA menjadi utas tunggal DNA (Lee et al. 1998). Streptomyces sp. galur NI80 berhasil diisolasi dari spons Jepang yang belum teridentifikasi dan berpotensi menghasilkan urausimisin A yang memiliki setengah rantai cabang antimisin dan uraumisin B untuk menghambat Candida albicans (Imamura et al. 1993).
Saccharopolyspora spp. merupakan genus aktinomiset baru yang berhasil diisolasi dari spons Mycale plumose dari pantai Qingdao China (Liu et al. 2005). Aktinomiset ini menghasilkan senyawa bioaktif metasikloprodigiosin dan undesiprodigiosin yang mempunyai aktivitas antikanker terhadap 5 jenis sel kanker. Prodigiosin sebelumnya telah ditemukan, akan tetapi berasal dari sumber yang berbeda dari Saccharopolyspora spp. dimana senyawa ini merupakan kelompok pigmen polypyrrole yang memiliki aktivitas spektrum luas sebagai immunosuppresive, inhibitor proton, dan antikanker (Matsuya et al. 2000; Montaner et al. 2000; Furstner et al. 2001). Micromonospora sp. galur L31-CLCO-002 berhasil diisolasi dari homogenat spons Clathrina coriacea asal laut Pulau Fuerteventure, yang berpotensi menghasilkan senyawa indolokarbazol alkaloids, 4‟-N-methil-5‟-hidroksistaurosporin dan 5‟hidroksistaurosporin yang mirip dengan senyawa staurosporin Hernandez et al. (2000).
Metagenom
Metagenom merupakan analisis komunitas organisme culture-independent untuk mengetahui keseluruhan genom dari suatu sampel (Cardoso dan Coutinho 2012). Metagenom mencakup berbagai teknik yang terdiri atas total DNA hasil ekstraksi dari sampel yang diamplifikasi gen spesifik, konstruksi pustaka gen dan sekuensing dari keseluruhan material genetik. Pendekatan metagenomik digunakan untuk mempelajari komposisi, dinamika, dan fungsi dari suatu komunitas mikrob pada lingkungan yang berbeda (Gilbert dan Dupont 2011). Konstruksi pustaka metagenom didasarkan pada hasil isolasi genom dengan kualitas DNA yang baik sehingga layak untuk dikloning dan mencakup seluruh keragaman mikrob dari sampel asli (Simon dan Daniel 2011).
DNA genom yang dianalisis dengan pendekatan metagenom, akan dilanjutkan dengan proses shotgun sekuensing, yaitu sekuensing fragmen DNA dari keseluruhan populasi mikrob (Droge dan Hardy 2012). Hasil analisis yang diperoleh dari pendekatan metagenom dapat memberikan informasi akurat tentang kesimpulan filogenetik, yang menunjukkan hubungan kemiripan suatu mikrob berdasarkan homologinya (Gonzales dan Knight 2012).
Gambar 1 Analisis metagenomik komunitas mikrob di lingkungan berdasarkan DNA genom (Simon dan Daniel 2011).
Pendekatan metagenom dengan teknik PCR dapat mendeskripsikan keragaman taksonomi mikrob: (a) metode finger-printing, yang dapat memisahkan fragmen rDNA berdasarkan panjang atau komposisi nukleotida yaitu denaturing/temperature gradient gel electrophoresis (DGEE/TGGE) (Muyzer 1999), restriction fragment length polymorphisms (RFLP) (Laguerre et al. 1994), terminal restriction fragment length polymorphism (T-RFLP) (Dunbar et al. 2000), single-strand conformation polymorphisms (SSCP) (Lee et al. 1996), dan automated rRNA intergenic spacer analysis (ARISA); (b) dengan menggunakan mikroskop FISH (fluorescence in situ hybridization) dan metode turunannya (CARD-FISH, MAR-FISH); dan (c) melalui kloning fragmen gen 16S rRNA yang disekuensing dengan metode sekuensing Sanger.
Salah satu pendekatan metagenomik yang efisien digunakan untuk analisis komunitas mikrob dari DNA genom lingkungan adalah denaturing gradien gel electrophoresis (DGGE) (Muyzer 1999). PCR-DGGE merupakan metode dengan target gen 16S rRNA (16S rDNA) yang telah digunakan secara luas untuk mempelajari struktur komunitas mikrob di lingkungan (Muyzer 1993). Selain itu PCR-DGGE juga digunakan untuk mengetahui struktur komunitas cendawan dan nematoda (Hoshino dan Matsumoto 2004; Okada dan Oba 2008). Pendekatan metagenomik dengan PCR-DGGE mempunyai kelebihan antara lain biaya murah, proses cepat, dan hasil yang baik untuk membandingkan struktur keragaman total komunitas mikrob pada sampel tanah yang berbeda tekstur (Fuji et al. 2006).
8
sekuens dengan domain yang sama mempunyai titik lebur yang berbeda, sehingga molekul dengan sekuens yang berbeda akan berhenti pada posisi yang berbeda pula di gel poliakrilamid (Muyzer 1997).
METODE
Kerangka Penelitian
Penelitian ini terdiri atas beberapa tahapan kerja yang tergambar pada diagam alir di bawah ini (Gambar 2).
Gambar 2 Diagam alir tahapan penelitian
Waktu dan Tempat Penelitian
10
Pengambilan Sampel dan Identifikasi Spons Laut
Spons laut dikumpulkan oleh SCUBA diving dari dasar laut dangkal asal perairan Pulau Bira Taman Nasional Kepulauan Seribu dan diidentifikasi genus sponsnya. Spons laut yang diperoleh dimasukkan dalam plastik polietilen steril dan disimpan di freezer dengan suhu penyimpanan 4 ºC hingga siap digunakan.
Isolasi dan Karakterisasi Aktinomiset Culturable dari Spons Laut
Media isolasi aktinomiset yang digunakan adalah Humic Acid Vitamin Agar (HV Agar) (Hayakawa dan Nonomura 1987). Media HV Agar terdiri atas asam humat 1 g, CaCO3 0.02 g, FeSO4.7 H2O 0.01 g, KCl 1.71 g,MgSO4.7H2O 0.5 g, Na2HPO4 0.5 g, vitamin B 5 mL, sikloheksamida0.05 g, agar-agar 18 g, asam nalidiksat 20 mg, akuades 1 L yang disterilisasi di dalam autoklaf pada suhu 121°C dan tekanan 15 lbi selama 15 menit. Media dituang dengan volume 10 mL per cawan Petri. Sampel spons yang diperoleh selanjutnya ditimbang sebanyak 1 g dan dilakukan penggerusan dengan mortar steril.
Hasil gerusan spons dilakukan pengenceran bertingkat (serial dilution) hingga pengenceran 10-2. Hasil pengenceran 10-1 dan 10-2 diambil masing-masing 1 mL suspensi kemudian dimasukkan ke dalam media agar-agar HV. Hasil isolasi kemudian diinkubasi pada suhu 28 ºC selama 4 sampai 8 minggu. Koloni aktinomiset yang tumbuh dipurifikasi pada media Yeast Starch Agar modifikasi yang terdiri atas agar-agar15 g, pati larut air 15 g, Ekstrak Khamir 4 g, K2HPO4 0.5 g, MgSO4.7H2O 0.5 g,asam nalidiksat 100 mg, sikloheksamida 0.05 g, dan air laut 1000 mL. Koloni aktinomiset murni dikarakterisasi morfologi dengan identifikasi koloni meliputi pengamatan makroskopis dan mikroskopis. Secara makroskopis isolat yang diperoleh diamati bentuk koloni tunggal, bentuk permukaan koloni, warna permukaan koloni, warna hifa aerial, warna dasar koloni, dan terbentuknya pigmentasi pada media pertumbuhan. Pengamatan mikroskopis meliputi bentuk sel tunggal, pewarnaan gram, dan tipe hifa aerial.
Isolasi Genom Aktinomiset Culturable Spons Laut
Tahapan lisis dilakukan dengan menambahkan 200 L buffer GB kemudian dikocok selama 5 detik, dan diinkubasi pada suhu 60 oC selama 10 menit sambil dibolak-balik setiap 3 menit. Selanjutnya isolasi DNA masuk tahapan pengikatan DNA yaitu 200 L etanol absolut dimasukkan pada tabung Eppendorf kemudian diresuspensi hingga homogen. Campuran tersebut dipindahkan ke dalam kolom GD yang telah dipasangkan pada tabung mikro, kemudian disentrifugasi 2 menit dengan kecepatan 10 000 rpm. Hasil sentrifugasi dibuang supernatannya dan masuk tahapan pencucian yaitu sebanyak 400 L larutan W1 ditambahkan ke dalam kolom GD dan disentrifugasi selama 30 detik dengan kecepatan 10 000 rpm. Supernatan dibuang dari tabung koleksi dan dilakukan penambahan 600 L buffer pencuci(telah ditambahkan etanol absolut) pada kolom GD. Tabung Eppendorf kemudian disentrifugasi selama 30 detik pada kecepatan 10 000 rpm dan dibuang supernatannya. Tabung Eppendorf kembali disentrifugasi selama 3 menit pada kecepatan 10 000 rpm hingga sampel DNA benar-benar kering.
Tahapan akhir dari isolasi DNA adalah kolom GD dipindahkan ke tabung Eppendorf baru dengan menambahkan 50 L buffer elusi ke bagian tengah dari matriks kolom GD dan diinkubasi selama 15 menit sampai buffer elusi menyerap ke dalam DNA. Tabung Eppendorf kembali disentrifugasi selama 1 menit pada kecepatan 10 000 rpm. Hasil isolasi DNA diukur kemurnian dan konsentrasinya dengan menggunakan jasa Nanodrop 2000 (Thermo Scientific, Wilmington, DE, USA) di Laboratorium Institut Pertanian Bogor Culture Collection (IPBCC). Sampel DNA yang baik untuk digunakan dalam tahapan PCR apabila kemurnian DNA berkisar antara 1.8-2.
Isolasi Genom Total Aktinomiset Unculturable
Isolasi genom dari spons dilakukan dengan menimbang sebanyak 0.5 g sampel spons segar yang digerus dengan menggunakan nitrogen cair hingga halus membentuk serbuk putih. Proses ini dilakukan sesuai dengan protokol kit ekstraksi genom Power Soil DNA Isolation Kit (Mobio Laboratories, Carlsbad, CA, USA) (Hardoim et al. 2009). Sampel spons yang telah halus dimasukkan ke dalam tabung dengan larutan bead 2 mL kemudian divorteks selama 15 menit. Sampel ditambahkan dengan 60 L larutan C1 dan divorteks selama 10 menit. Tabung sampel divorteks dengan posisi horizontal selama 20 menit kemudian disentrifugasi selama 45 detik dengan kecepatan 10 000 rpm (Sentrifuge Eppendorf Mini Spin dengan rotor F-45-12-11). Supernatan sebanyak 400-500 L yang terdapat pada dasar tabung dipindahkan ke dalam tabung koleksi2 mL.
Campuran ini kemudian ditambahkan dengan 250 L larutan C2 lalu divorteks selama 5 detik dan diinkubasi selama 10 menit pada suhu 4 ºC. Sampel disentrifugasi pada temperatur suhu ruang dengan kecepatan 10 000 rpm selama 1 menit. Sebanyak 600 L supernatan dipindahkan dalam tabung Eppendorf baru dan ditambahkan larutan C3 sebanyak 200 L kemudian divorteks selama 20 detik dan diinkubasi selama 7 menit pada suhu 4 °C. Tabung Eppendorf kembali disentrifugasi pada kecepatan 10 000 rpm dalam temperatur ruang. Supernatan sebanyak 750 L dipindahkan ke dalam tabung Eppendorf baru.
12
dalam spin filter dan disentrifugasi selama 1 menit pada kecepatan 10 000 rpm dalam temperatur ruang. Langkah ini dilakukan berulang hingga keseluruhan sampel habis. Supernatan di dasar tabung dibuang dan ditambahkan dengan 500 L larutan C5, kemudian disentrifugasi kembali pada suhu ruang selama 30 detik. Supernatan dibuang dan disentrifugasi ulang pada kecepatan 10 000 rpm selama 1 menit pada suhu ruang hingga spin filter benar-benar kering. Spin filter dipindahkan ke dalam tabung Eppendorf baru dan ditambahkan 100 L larutan C6 ke bagian tengah dari matriks membran filter dan disentrifugasi selama 1 menit pada kecepatan 10 000 rpm. Sampel yang tertinggal di dasar tabung disimpan pada suhu 4 °C hingga siap digunakan sebagai cetakan DNA dalam proses PCR. Hasil DNA yang telah diperoleh selanjutnya dielektroforesis pada gel agarosa 1% untuk kemudian divisualisasi (Rondon et al. 2000).
Amplifikasi Gen 16S rRNA Aktinomiset Culturable dan Unculturable Asal
Neofibularia sp.
Amplifikasi DNA aktinomiset dilakukan dengan menggunakan metode polymerase chain reaction (PCR) dengan T1-thermocycler (Biometra, Goettingen, Germany). Amplifikasi dilakukan pada total genom aktinomiset hasil ekstraksi genom spons dan DNA aktinomiset culturable hasil isolasi genom aktinomiset yang berhasil dikultivasi. Genom unculturable dan culturable diamplifikasi dengan menggunakan primer gen 16S rRNA yang sama, yaitu primer spesifik aktinomiset 27F (5‟-AGAGTTTGATCCTGGCTCAG-3‟) dan 16Sact1114R (5‟ -GAGTTGACCCCGGCRGT-3‟) (Martina et al. 2008).
Proses PCR berlangsung dengan volume 25 µL yang mengandung 12.5 µL GoTaq Geen Master Mix 2X, 0.25 µL masing-masing primer (10 pmol), 5 µL cetakan DNA (~100 ng µL-1) dan 7 µL air bebas nuklease. Gradien suhu yang digunakan selama PCR antara lain tahapan pra-denaturasi selama 5 menit pada suhu 94 °C, denaturasi selama 1 menit pada suhu 94 °C, penempelan primer selama 45 detik pada suhu 65 °C (menurun 0.5 oC setiap siklus hingga siklus ke 20, 55 oC untuk 10 siklus berikutnya) ekstensi selama 2 menit pada suhu 72 °C, pasca ekstensiselama 7 menit pada suhu 72 °C dan pendinginan 4 °C selama 15 menit (touch down amplification).
Proses PCR berlangsung sebanyak 30 siklus (Zhang et al. 2013). Produk PCR dielektroforesis pada gel agarosa 1% dan diamati pita tunggal DNA pada gel untuk dokumentasi di dalam G:BOX (Syngene, Frederick, MD, USA) untuk melihat pita DNA yang dihasilkan sesuai dengan target gen sebesar ~1087 pasang basa. Gen 16S rRNA aktinomiset dari total genom asal spons yang berhasil diamplifikasi akan dilanjutkan dengan PCR tahap kedua dengan menggunakan hasil sampel PCR tahap 1 sebagai cetakan DNA.
menit), penempelan primer (suhu 55 oC, 45 detik), ekstensi (suhu 72 oC, 1 menit), dan pasca ekstensi (suhu 72 oC, 5 menit). Proses PCR dilakukan hingga 30 siklus. Produk PCR dielektrophoresis pada gel agarose 1 % dengan volume 5 µL per sumurnya selama 45 menit dengan daya 80 V. Hasil elektroforesis divisualisasi dengan cara direndam Ethidium Bromida (EtBr) (Sigma, USA), kemudian diamati pita tunggal yang berukuran 180 pb pada gel untuk dokumentasi di dalam G:BOX (Syngene, Frederick, MD, USA).
Analisis DGGE (Denaturing Gradient Gel Electrophoresis) Aktinomiset
Unculturable
Hasil PCR gen 16S rRNA dimasukkan ke dalam gel vertikal 0.75 mm yang mengandung 8% (w/v) gel poliakrilamida (akrilamida-bisakrilamida (37.5:1)) dalam 1x Tris-asetat-EDTA (TAE). Gradien linier antara 30-70% denaturan (100% denaturan sesuai dengan 7M urea dan 40% formamida deionisasi). Elektroforesis dilakukan selama 7 jam pada suhu 60 0C dengan daya 150 V dengan menggunakan D Code Universal Mutation Detection System (Bio-Rad, Hercules, CA, USA). Gel yang telah dielektroforesis direndam selama 30 menit dengan EtBr pada kondisi gelap selama 30 menit. Pembilasan dilakukan dengan menggunakan 500 mL larutan TAE kemudian pita diamati dan didokumentasi di bawah sinar UV pada G:BOX (Syngene, Frederick, MD, USA).
Hasil visualisasi berupa separasi pita dipotong dengan menggunakan pisau scalpel steril dan dimasukkan ke dalam tabung Eppendorf yang berisi 100 µL ddH2O. Produk DGGE diinkubasi pada suhu 4 oC selama satu malam dan diinkubasi pada suhu 60 0C selama 2 jam (Coelho et al. 2009; Perez et al. 2014). Produk DGGE selanjutnya dapat diamplifikasi dengan menggunakan primer gen 16S rRNA tahap 2 yang sama tanpa menggunakan GC-clamp dengan kondisi PCR yang sama dengan sebelumnya (Learn-Han et al. 2012).
Sekuensing Gen 16S rRNA Aktinomiset Culturable dan Unculturable
Produk PCR gen 16S rRNA dari aktinomiset culturable dan unculturable yang berasosiasi dengan spons Neofibularia sp. disekuensing sesuai dengan standar protokol DNA sekuenser (ABI PRISM 3100) menggunakan Perusahaan Jasa Sekuensing (First Base Malaysia). Sekuens basa yang diperoleh dikoreksi menggunakan BioEdit Sequence Aligment Editor. Semua sekuen gen 16S rRNA dibandingkan dengan database GenBank, NCBI BLAST (http://www.ncbi.nlm.nih.gov/). Analisis filogenetik menggunakan program MEGA 6 (Molecular Evolutionary Genetics Analysis, Version 6).
Analisis Bioinformatik dan Konstruksi Pohon Filogenetik
14
HASIL DAN PEMBAHASAN
Hasil
Karakteristik Morfologi Sampel Spons Neofibularia sp. Asal Pulau Bira
Pulau Bira merupakan bagian dari Kepulauan Seribu yang terletak 5°23’ -5°40’LS,106°25’-106°37’BT sebelah Utara Jakarta. Kepulauan Seribu merupakan kawasan pelestarian alam bahari yang lebih dikenal sebagai Taman Nasional Kepulauan Seribu dan mencakup luas 107.489 ha. Ekosistem laut Pulau Bira terdiri atas beragam komunitas spons, karang, ikan, rumput laut dan berbagai jenis biota laut. Pulau Bira memiliki keragaman spons yang tinggi salah satunya adalah Neofibularia sp.
Sampel spons diperoleh pada kedalaman 4 meter dan diidentifikasi secara morfologi. Hasil identifikasi morfologi menunjukkan spons merupakan Neofibularia sp. Spons memiliki lebar 1 m dan tinggi 50 cm, berwarna coklat-merah dengan bentuk batang-cangkir. Identifikasi mikroskopis menunjukkan spons memiliki megaskleres stiles dengan spikula menutup di dalam plumos, berbentuk retikulat (Lampiran 1).
Klasifikasi sampel spons berdasarkan Fonbressin dan Michelotti (1864) secara taksonomi sebagai berikut :
C. Spons segar menghasilkan cairan berwarna yang disekresikan secara terus menerus. Cairan yang keluar segera dibuang agar tidak mempengaruhi konsistensi dan kesegaran sampel. Perlakuan ini diulang hingga spons stabil tidak terendam cairan. Efektivitas penyimpanan dan preparasi terlihat dari kondisi fisik spons yang tidak mengalami perubahan konsistensi dinding dan aroma dari sampel. Selain itu tidak terbentuk lendir yang menyelubungi sampel dan tidak terjadi degradasi oleh mikrob pengurai. Hal ini bertujuan menekan perubahan fisiologis dan lingkungan normal sampel sehingga mikrob yang berasosiasi dapat tetap hidup hingga diisolasi.
Isolasi Aktinomiset Culturable yang Berasosiasi pada Neofibularia sp.
bubuk. Satu isolat tidak memiliki hifa aerial dan tidak membentuk spora. Kelimpahan aktinomiset culturable yang berasosiasi dengan spons tidak sama jumlahnya.
Keragaman Aktinomiset Culturable yang Berasosiasi pada Neofibularia sp.
Aktinomiset culturable diisolasi menggunakan media Humic Acid Vitamin Agar (HV Agar) yang ditambahkan air laut. Total 20 isolat aktinomiset tumbuh pada media HV Agar dan berhasil dipurifikasi pada media Yeast Starch Agar (YSA) (Lampiran 2). Isolat aktinomiset diseleksi berdasarkan keragaman morfologi koloni yaitu warna hifa aerial, tipe spora, dan pigmentasi media. Pigmentasi media yang dihasilkan antara lain kuning, coklat, merah bata, dan terdapat isolat non pigmentasi.
Gambar 3. Isolat aktinomiset culturable yang berasosiasi dengan Neofibularia sp. secara makroskopis (atas) dan mikroskopis (bawah) pada YSA dengan umur inkubasi 10 hari menggunakan mikroskop cahaya perbesaran 400x (Olympus).
Isolat NOAq 1.1, NRSw 4.1, NOAq 1.3, NOAq 2.1, dan NOAq 1.4 berdasarkan karakteristik morfologi memiliki perbedaan koloni dan tipe spora (Gambar 3). Kelima isolat merupakan kelompok Streptomyces dengan ciri umum membentuk hifa aerial dengan rantai spora, memiliki miselia substrat, serta termasuk Gram positif (Tabel 1) (Shirling dan Gottlieb 1966).
Tabel 1. Karakteristik morfologi aktinomiset yang berasosiasi pada spons Neofibularia sp.
Kode isolat Warna Bentuk
koloni Pigmentasi
kemerahan basil gram positif rf Keterangan : * b = bulat; tb = tidak beraturan; lk = berlekuk; lc = licin; ld =
16
Identifikasi Gen 16S rRNA Aktinomiset Culturable yang Berasosiasi pada
Neofibularia sp.
Identifikasi molekuler aktinomiset culturable dilakukan menggunakan DNA genom yang diperoleh dari tahapan ekstraksi. Hasil isolasi DNA genom memiliki nilai konsentrasi dan kemurnian yang berbeda pada setiap isolatnya. Konsentrasi DNA genom dari lima isolat aktinomiset diukur menggunakan Nanodrop 2000 Spechtrophotometer pada 260 nm dengan konsentrasi tertinggi pada isolat NRSw 4.1 sebesar 472.45 ng/µ L dan konsentrasi terendah pada NOAq 1.1 sebesar 40.25 ng/µL. Kemurnian DNA genom aktinomiset culturable ditentukan berdasarkan rasio 260/280 dengan kisaran kemurnian terbaik antara 1.7-2. Kemurnian DNA genom kelima isolat aktinomiset culturable berkisar antara 1.06 hingga 4.44 (Tabel 2).
Tabel 2 Konsentrasi dan kemurnian DNA genom hasil ekstraksi dari sampel spons asal Pulau Bira
Kode sampel Konsentrasi DNA (ng L-1)
260 260/280
Blanko -1.3 1.34
NOAq 1.1 40.25 1.27
NRSw 4.1 472.45 4.44
NOAq 1.3 107.2 4.08
NOAq 2.1 301.05 3.87
NOAq 1.4 134.35 1.06
17
Gambar 4 Hasil amplifikasi PCR gen 16S rRNA (1087 pb) dengan primer 27F dan 16Sact1114R. Marker 1 Kb, sumur ke 1-5 yaitu NOAq 1.1, NRSw 4.1, NOAq 1.3, NOAq 2.1, dan NOAq 1.4.
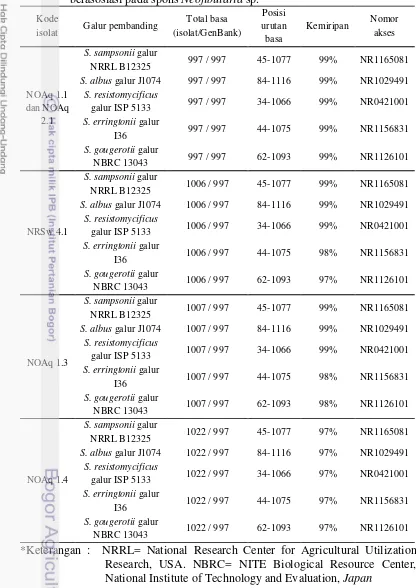
Hasil pensejajaran sekuen lima isolat aktinomiset culturable dengan galur pembanding menunjukkan bahwa isolat NOAq1.1, NRSw 4.1, NOAq 1.3, NOAq 2.1 memiliki kemiripan 99% dengan Streptomyces sampsonii galur NRRL B12325, S. albus galur J1074, dan S. resistomycificus galur ISP 5133. Isolat NRSw 4.1 dan NOAq 1.3 memiliki kemiripan 98% dengan Streptomyces gougerotii galur NBRC 13043 dan Streptomyces erringtonii galur I36. Isolat NOAq 1.4 memiliki kemiripan 97% dengan kelima galur pembanding tersebut (Tabel 3).
Hasil konstruksi pohon filogenetik menunjukkan bahwa isolat NOAq 1.1, NRSw 4.1, NOAq 1.3, NOAq 2.1, dan NOAq 1.4 berada dalam satu kluster. Kelima isolat berada pada kluster I yang sama dengan Streptomyces sampsonii galur NRRL B12325, S. albus galur J1074, S. resistomycificus galur ISP 5133, Streptomyces gougerotii galur NBRC 13043 dan Streptomyces erringtonii galur I36. Terlihat pada pohon filogenetik bahwa kluster tersebut terpisah dari kluster outgroup Micromonospora sediminicola (aktinomiset non-Streptomyces spp.), Bacillus halodurans (bakteri Gram positif), dan Pseudomonas aeruginosa (bakteri Gram negatif) (Gambar 5).
„
18
Tabel 3 Hasil BLAST sekuen gen 16S rRNA aktinomiset culturable yang berasosiasi pada spons Neofibularia sp.
Kode
Gambar 5 Pohon filogenetik gen 16S rRNA aktinomiset culturable yang berasosiasi pada Neofibularia sp. dengan piranti lunak MEGA 6 (analisis bootstrap 1000 kali).
Kelima isolat aktinomiset memiliki kemiripan tertinggi dengan Streptomyces sampsonii galur NRRL B12325 sebesar 99%. Streptomyces sampsonii galur B12325 awalnya diisolasi dari tanah dengan tipe rantai spora rectiflexibiles, permukaan koloni halus, berwarna putih tipis kekuningan pada media ISP 2. Streptomyces sampsonii berpotensi menghasilkan senyawa antifungi heptaene yang termasuk antibiotik poliene, dengan aktivitas penghambatan cendawan Candida albicans, Aspergillus niger, Microsporum gypseum, dan Trichophyton (Jain dan Jain 2006). Streptomyces resistomycificus galur ISP 5133 berpotensi menghasilkan resistomisin yaitu poliketida pentasiklik yang berperan dalam proses apoptosis sel megakaryoblastik leukemia CMK-7 manusia (Shiono et al. 2002).
Streptomyces albus J1074 awalnya diisolasi dari tanah akan tetapi ditemukan pula berasosiasi dengan spons laut dengan warna spora abu-abu muda, coklat, dan coklat abu-abu (Ian et al. 2014). Streptomyces albus berpotensi menghambat pertumbuhan patogen tanaman Fusarium solani dan Helminthosporium oryzae serta menghasilkan xilanase yang berperan penting dalam fermentasi rice straw pulp (Rifaat et al. 2005). Streptomyces gougerotii memiliki tipe rantai spora rectiflexibiles, dengan permukaan spora halus berwarna putih kekuningan pada media ISP 2 dan berpotensi menghasilkan antibiotik nukleosida gougerotin sebagai antibakteri dan antivirus untuk menghambat pembentukan ikatan peptida (Murao dan Hayashi 1983). Streptomyces erringtonii awalnya diisolasi dari serasah jerami padang rumput, bersifat aerobik, tidak tahan asam, dan memiliki miselia substrat yang bercabang dengan hifa aerial berwarna putih abu-abu (0.5-0.6x0.8 µm) (Santhanam et al. 2013).
Total DNA Genom Spons Neofibularia sp.
20
Neofibularia sp. sebesar 10.5-10.7 ng/ L dengan kemurnian sebesar 0.64-0.65 (Tabel 4). Tingginya kadar air dan kandungan senyawa yang dihasilkan spons menurunkan sensitivitas dan efektivitas reagen yang digunakan pada saat proses ekstraksi. Hal ini menyebabkan rendahnya DNA genom yang berhasil dielusi. Tabel 4 Konsentrasi dan kemurnian DNA genom hasil ekstraksi dari sampel
spons asal Pulau Bira
Sampel Konsentrasi DNA (ng L-1)
260 260/280
Blanko -0.8 0.62
Spons 3 10.5 0.64
Spons 3 10.7 0.65
Analisis DGGE Total Komunitas Aktinomiset yang Berasosiasi pada Spons
Neofibularia sp.
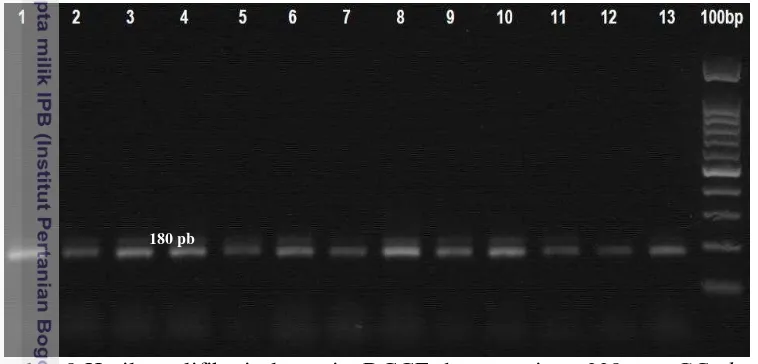
Produk PCR gen 16S rRNA aktinomiset unculturable spons laut diamplifikasi menggunakan teknik nested PCR dan dianalisis dengan denaturing gradient gel electrophoresis (DGGE). Teknik ini menggunakan dua tahap PCR, tahap pertama adalah PCR produk gen 16S rRNA berukuran 1087 pb (Gambar 6A), sedangkan tahap kedua menghasilkan produk gen berukuran 180 pb (Gambar 6B).
Gambar 6 Hasil PCR gen 16S rRNA sampel spons laut asal Pulau Bira. A) Produk PCR tahap pertama berukuran 1087 pb menggunakan primer 27F dan 16Sact 1114R, B) Produk PCR tahap kedua 180 pb menggunakan primer p338F GC clamp dan p518R. Marker 1 kb; Sumur 1 (Neofibularia sp.)
Pita DNA gen 16S rRNA yang berhasil diamplifikasi memiliki ukuran 1087 pb (Gambar 6A). Hal ini mengindikasikan keberadaan aktinomiset pada
± 1087 pb
± 180 pb
spons Neofibularia sp. yang diamplifikasi mengggunakan primer spesifik aktinomiset culturable dan unculturable. Produk PCR tahap pertama merupakan template DNA pada PCR tahap kedua, yaitu sebanyak 0.2 L per 100 L total reaksi PCR. Hasil PCR tahap dua merupakan amplikon dari region V3 sekuen gen 16S rRNA berukuran 180 pb (Overeas et al. 1997) (Gambar 6B).
Hasil amplifikasi berukuran 180 pb diseparasi menggunakan teknik DGGE. Hasil DGGE merupakan fragmen gen 16S rRNA berukuran sama yang terpisah dan terdistribusi pada posisi berbeda di gel poliakrilamida. Pemisahan mengindikasikan bahwa terdapat perbedaan aktinomiset dalam suatu komunitas yang berasosiasi pada Neofibularia sp. Semakin banyak pita DNA yang terseparasi maka semakin tinggi pula keragaman aktinomiset pada sampel spons tersebut. Analisis foretik menggunakan 1D Phoretix Software mendeteksi 25 pita DGGE pada gel poliakrilamida (Gambar 7B). Hasil visualisasi pita DNA pada G:BOX gel documentation tidak dapat menangkap semua pita yang terdistribusi karena keterbatasan alat pengamatan yang dilakukan. Berdasarkan pengamatan langsung terdapat 13 pita DNA dominan yang terpisah dan berhasil diisolasi menggunakan scalpel (Gambar 7A).
Gambar 7. (A) Profil DGGE pita gen 16S rRNA asal Neofibularia sp. (B) Ilustrasi pita DGGE menggunakan piranti lunak Phoretix ID
Analisis pola kemiripan pita DGGE yang terdistribusi pada gel poliakrilamida (Gambar 7B), menunjukkan komunitas aktinomiset yang berbeda. Sebaran pita DGGE pada gel poliakrilamida memiliki perbedaan jarak antar pita yang kecil, yang dipengaruhi oleh komponen urutan nukleotida yang tidak
22
berbeda jauh. Hal ini menggambarkan kekerabatan antar isolat aktinomiset yang berasosiasi dengan Neofibularia sp. mirip satu sama lain.
Hasil pemotongan pita DGGE yang tervisualisasi pada gel poliakrilamida adalah 13 pita dominan. Pita tersebut kemudian dipurifikasi dengan penambahan akuabides steril dan diinkubasi selama 24 jam pada suhu 4 °C. Pita tersebut diinkubasi kembali pada suhu 60 °C selama 1 jam dan suhu 4 °C 24 jam. Perlakuan ini bertujuan untuk melepaskan DNA genom yang terjerap pada gel poliakrilamida agar terdifusi pada akuabides dalam tabung mikro. Pita DNA genom hasil purifikasi digunakan sebagai template PCR dengan primer tanpa GC clamp. Amplifikasi PCR menggunakan primer tanpa GC clamp bertujuan melepaskan GC pada fragmen gen 16S rRNA berukuran 180 pb agar tidak mengganggu pembacaan dalam proses sekuensing (Gambar 8).
Gambar 8 Hasil amplifikasi ulang pita DGGE dengan primer 338 non GC clamp dan 518R. Marker 1 kb; well 1-13, pita 1-13
Keragaman Struktur Komunitas Aktinomiset yang Berasosiasi dengan Spons
Neofibularia sp.
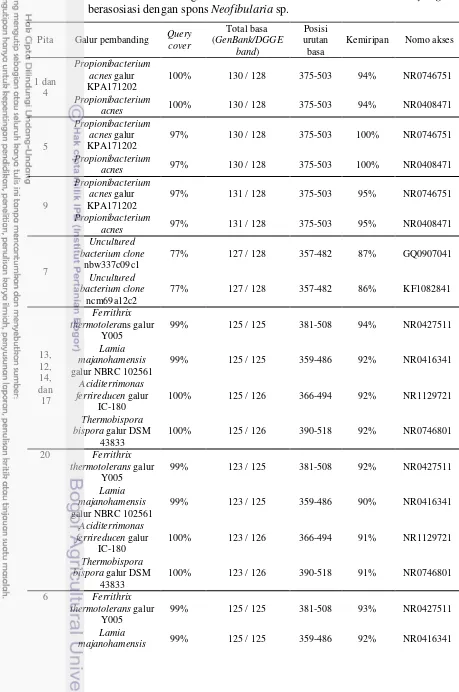
Pensejajaran sekuen 13 pita DNA dengan sekuen pembanding database GenBank meunjukkan kekerabatan dengan 5 genus aktinomiset yaitu Ferrithrix, Aciditerrimonas, Thermobispora, Lamia, dan Propionibacterium (Gambar 9). Hasil BLAST.N secara berurutan menunjukkan pita 13, 14, 17, dan 12 memiliki kemiripan sebesar 94% dengan Ferrithrix thermotolerans galur Y005 sedangkan pita 20 (92%), pita 6 dan 3 (93%), dan pita 11 (88%).
Gambar 9 Profil filogenetik gen 16S rRNA struktur komunitas aktinomiset spons Neofibularia sp. hasil isolasi dari gel DGGE (analisis bootstrap 1000 kali)
24
Tabel 5 Hasil BLAST sekuen gen 16S rRNA struktur komunitas aktinomiset yang berasosiasi dengan spons Neofibularia sp.
Pita Galur pembanding Query
cover
galur NBRC 102561
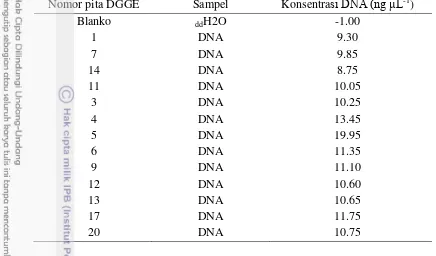
Separasi pita DGGE mempunyai ketebalan yang berbeda yang mengindikasikan kelimpahan isolat yang berbeda pula. Pita 5, 4, dan 17 lebih tebal dibandingkan pita DNA yang lain (Tabel 6). Hal ini menunjukkan bahwa pita yang mirip dengan P. acnes galur KPA171202 memiliki kelimpahan tertinggi dengan konsentrasi sebesar 19.95 ng dan pita 17 yang mirip dengan F. thermotolerans galur Y005 sebesar 11.75 ng. Pita 4 (uncultured bacterium clone) memiliki kelimpahan yang tinggi sebesar 13.45 ng akan tetapi belum teridentifikasi menggunakan analisis filogenetik yang diduga merupakan komunitas aktinomiset baru yang belum diketahui dari spons Neofibularia sp.
26
Tabel 6 Konsentrasi DNA pita DGGE struktur komunitas aktinomiset spons Neofibularia sp.
Nomor pita DGGE Sampel Konsentrasi DNA (ng L-1)
Blanko ddH2O -1.00
1 DNA 9.30
7 DNA 9.85
14 DNA 8.75
11 DNA 10.05
3 DNA 10.25
4 DNA 13.45
5 DNA 19.95
6 DNA 11.35
9 DNA 11.10
12 DNA 10.60
13 DNA 10.65
17 DNA 11.75
20 DNA 10.75
Lamia majanohamensis pertama kali diisolasi dari timun laut Holothuria edulis yang dikoleksi dari perairan dangkal Jepang (Midori et al. 2009). Aciditerrimonas ferrireducens galur IC-180 awalnya diisolasi dari zona solfatarik Hakone, Jepang, dengan kemampuan reduksi besi, oksidasi H2, fiksasi CO2 pada kondisi anaerob, tidak membentuk filamen dan bersifat termoasidofilik. Aciditerrimonas ferrireducens memiliki keunikan dibandingkan anggota Acidimicrobiae yang lain yaitu mampu mereduksi Fe3+, akan tetapi tidak mampu mengoksidasi Fe2+ (Itoh et al. 2011).
Thermobispora bispora DSM 43833 merupakan sinonim dari Microbispora bispora yang awalnya diisolasi dari pupuk kompos. Thermobispora bispora diketahui mempunyai dua tipe traksripsional aktif gen 16S rRNA yang berbeda, yang tidak dimiliki oleh semua mikrob. Thermobispora bispora memiliki miselium dengan percabangan monopodial berdiameter 0.5-0.8 µm, spora berbentuk oval hingga bulat, dan non-motil (Wang et al. 1996).
Urutan Basa Region V3 Gen 16S rRNA dan Analisis Single Nucleotide Polymorphism (SNP) Sekuen Basa Struktur Komunitas Aktinomiset
Gambar 10 Ordinal sekuen basa 4 pita DGGE yang mirip dengan Propionibacterium acnes galur KPA171202
Delapan pita DGGE memiliki kemiripan tertinggi dengan Sekuen Ferrithrix thermotolerans galur Y005 yang berada pada urutan basa 381-508 dari total 1331 pasang basa (Gambar 11).
Gambar 11 Ordinal sekuen basa 8 pita DGGE yang mirip dengan Ferrithrix thermotolerans galur Y005
Hasil analisis SNP pada 4 pita DGGE terhadap galur pembanding Propionibacterium mendeteksi perbedaan beberapa basa yang mempengaruhi nilai persentase kemiripan (Lampiran 5). Semakin tinggi jumlah basa yang sama maka semakin tinggi pula persentase kemiripannya. Pita DGGE 1, 4, 5, dan 9 memiliki basa G dan C pada urutan basa 24, sedangkan pada sekuen Propionibacterium diganti dengan basa C. Keempat sekuen pita DGGE tersebut memiliki basa C,G, dan A pada urutan basa 52 sedangkan pada sekuen Propionibacterium hanya memiliki basa G. Selain itu padaurutan basa 118, keempat pita DGGE memiliki basa A dan C, sedangkan pada sekuen Propionibacterium diganti dengan basa A (Tabel 7).
Tabel 7 Analisis SNP pada 4 pita DGGE yang mirip dengan Propionibacterium acnes galur KPA171202
Keterangan sekuen Urutan basa yang berbeda Basa 24 Basa 52 Basa 118
Propionibacterium acnes galur KPA171202 C G A
Pita 1 G C A
Pita 4 C C C
Pita 5 C G A
Pita 9 C A C
28
8 pita DGGE urutan basa 60 diganti dengan basa G pada sekuen Ferrithrix (Tabel 8).
Tabel 8 Analisis SNP pada 8 pita DGGE yang mirip dengan Ferrithrix thermotolerans galur Y005
Keterangan Urutan basa yang berbeda Basa 29 Basa 52 Basa 60
Ferrithrix thermotolerans galur Y005 C T G
Pita 6 T C T
Sekuen basa yang berbeda dapat menentukan perbedaan genus dan spesies suatu mikrob. Kedua genus aktinomiset ini diperoleh berdasarkan hasil pensejajaran pita-pita DGGE dengan galur pembanding terdekat. Hasil analisis SNP menunjukkan bahwa kedua kelompok genus memiliki sekuen basa tunggal yang berbeda diantara daerah konservatifnya (Lampiran 7). Empat pita DGGE yang memiliki kemiripan tertinggi dengan Propionibacterium memiliki sekuen basa T pada urutan basa 7 yang diganti dengan basa C pada 8 pita DGGE yang mirip dengan Ferrithrix. Basa C pada 4 pita DGGE yang mirip dengan Propionibacterium pada urutan basa 33 diganti dengan basa A pada 8 isolat yang mirip dengan Ferrithrix (Tabel 9).
Tabel 9 Analisis SNP pada 13 pita DGGE yang mengelompokkan keselurhan sekuen kedalam 2 genus
Keterangan Urutan basa yang berbeda
Pembahasan
Karakteristik Morfologi Spons Neofibularia sp.
Neofibularia sp. merupakan spons laut yang termasuk dalam famili Desmacellidae (Demospongiae, Poecilosclerida). Secara morfologi spons ini memiliki megaskleres diaktinal, dan skeleton koanosomal retikulat; mikroskleres meliputi bagian sigmas, raphides, mikroseas, dan komata, dengan poecilosclerids yang kehilangan chelae dan microsleres yang menyerupai diancistra. Famili Desmacellidae memiliki kemampuan menghasilkan toksik dan komponen dermatitis dalam jumlah besar. Desmacellidae terdiri dari enam genus yaitu Biemna, Desmacella, Dragmatella, Microtylostylifer, Neofibularia, dan Simaxinella. Fibularia merupakan sinomin terdahulu dari Neofibularia dan dianggap pula sebagai sinonim dari Sigmaxinella (Hadju dan Van Soest 2002).
Sampel spons yang ditemukan pada Pulau Bira Kepulauan Seribu, Indonesia secara morfologi memiliki kemiripan dengan Neofibularia nolitangere. Neofibularia nolitangere merupakan spons yang memiliki kandungan toksik yang tinggi berwarna coklat kemerahan. Spons ini secara morfologi memiliki saluran penghubung dalam tubuhnya, berbentuk kanal silinder dengan dinding yang tebal bertumpuk, dan saluran terbuka yang besar pada bagian ujung (Sheppard 2010). Neofibularia nolitangere dikenal pula dengan nama „touch-me-not’, istilah tersebut diperoleh berdasarkan fenomena unik yang terjadi jika terjadi kontak langsung dengan permukaan spons berupa efek dermatitis. Sentuhan pada permukaan kulit menyebabkan efek terbakar dan panas (Voss 1976). Neofibularia nolitangere memiliki penyebaran yang luas di seluruh dunia, dengan kedalaman laut yang beragam (Yong dan Chung 2008). Empat spesies telah ditemukan sebelumnya dari Samudera Tropis Atlantik dan Pasifik Barat.
Keragaman Aktinomiset Culturable dengan Teknik Kultivasi
Aktinomiset culturable berhasil diisolasi dari spons Neofibularia sp. asal Pulau Bira, Kepulauan Seribu dan sebagian besar merupakan Streptomyces. Karakterisasi spesies Streptomyces sp. dilakukan berdasarkan warna miselium substrat, hifa aerial, pigmentasi media, dan tipe spora (Shirling dan Gottlieb 1996). Dominansi Streptomyces sebagai isolat terbanyak yang dapat dikultivasi sangat dipengaruhi oleh media isolasi dan temperatur inkubasi yang digunakan (Vieira dan Nahas 2005). Hal ini sejalan dengan penelitian yang dilakukan pada dua spons berbeda Hymeniciadon perleve dan Haliclona sp. dari Laut Cina Selatan yang menemukan Streptomyces sebagai isolat dominan yang tumbuh pada media kultivasi (Jiang et al. 2007; Sun et al. 2010).