ABSTRACT
SYNTHESIS AND CHARACTERIZATION ZrO2-CuO AS A FUNCTION OF COMPARISON MOL
BY
WINDHINI ANGGRAENI
The synthesis of ZrO2-CuO has been carried out by sol gel method. The starting material used is zirconium chloride and copper nitrate. Preparation begins with the mixing of raw materials under stirring for 10 hours to produce the gel. Powder molded into pellets and then calcined at 700 °C for 10 hours. The samples were characterized by X-Ray Diffraction (XRD) and Scanning Electron Microscopy (SEM) to determine the crystal structure and microstructural. XRD characterization results on samples with composition ZrO2-CuO 1 : 8 shows that the peak of CuO (tenorite) is higher than the other comparison and addition of CuO as lower dopant ZrO2 crystal size. In the XRD results of the grain size on the composition of 1: 1 is 313 nm and composition 1 : 8 is 77 nm. SEM microstructural characterization results indicate that the ZrO2-CuO ratio 1: 8 is smaller and than the ratio of 1: 1.
i ABSTRAK
SINTESIS DAN KARAKTERISASI ZrO2-CuO SEBAGAI FUNGSI PERBANDINGAN MOL
Oleh
WINDHINI ANGGRAENI
Telah dilakukan preparasi ZrO2-CuO dengan metode sol-gel. Bahan awal yang digunakan adalah zirkonium klorida dan tembaga nitrat. Komposisi ZrO2-CuO dilakukan dengan variasi perbandingan antara ZrO2-CuO. Preparasi dimulai dengan mencampur bahan baku dibawah pengadukan selama 10 jam untuk menghasilkan gel, diikuti dengan pengeringan gel pada suhu 150 ºC selama 7 jam. Serbuk dicetak menjadi pelet lalu dikalsinasi pada suhu 700 ºC selama 10 jam. Sampel dikarakterisasi dengan X-Ray Diffraction (XRD) dan Scanning Electron Microscopy (SEM) untuk mengetahui karakteristik struktur kristal dan mikrostruktur. Hasil karakterisasi XRD pada sampel dengan komposisi ZrO2 -CuO 1 : 8 menunjukkan bahwa puncak -CuO (tenorite) lebih tinggi daripada perbandingan yang lain dan penambahan CuO sebagai dopan menurunkan ukuran kristal ZrO2. Pada hasil XRD ukuran butir pada komposisi 1 : 1 adalah 313 nm dan komposisi 1 : 8 adalah 77 nm. Hasil karakterisasi SEM menunjukkan mikrostruktur pada perbandingan ZrO2-CuO 1 : 8 semakin kecil dan merata dibandingkan dengan sampel perbandingan 1 : 1.
ii
Judul Skripsi : SINTESIS DAN KARAKTERISASI ZrO2-CuO SEBAGAI FUNGSI PERBANDINGAN MOL
Nama Mahasiswa : Windhini Anggraeni
Nomor Pokok Mahasiswa : 0717041071
Jurusan : Fisika
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI,
1. Komisi Pembimbing
Posman Manurung, Ph.D. NIP. 195903081991 03 1 001
Wasinton Simanjuntak, Ph.D. NIP. 195907061988 11 1 001
2. Ketua Jurusan Fisika
Halaman
ABSTRAK ... i
LEMBAR PENGESAHAN ... ii
HALAMAN JUDUL ... iii
PERNYATAAN ... iv
RIWAYAT HIDUP ... v
MOTTO ... vi
PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
SANWACANA ... ix
DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Rumusan Masalah ... 5
C. Tujuan Penelitian ... 6
D. Batasan Masalah ... 6
E. Manfaat Penelitian ... 6
II. TINJAUAN PUSTAKA ... 8
A. Zirkonium Dioksida ... 8
1. Struktur ZrO2 ... 11
2. Aplikasi ZrO2 ... 13
B. Tembaga Dioksida dan Aplikasinya ... 15
C. Sistem Pembuatan ZrO2-CuO ... 19
D. Sintesis Partikel dengan Metode Sol-Gel ... 22
E. Difraksi sinar-X ... 24
F. Analisis Mikrostruktur dengan SEM ... 29
III. METODELOGI PENELITIAN ... 32
A. Waktu Tempat Penelitian ... 32
1. Sintesis ZrO2-CuO ... 33
2. Karakterisasi Sampel ... 34
D. Diagram Alir ... 34
IV. HASIL DAN PEMBAHASAN ... 36
A. Hasil Sintesis ZrO2-CuO dari Zirkonium Klorida dan Tembaga Nitrat... 36
B. Hasil Analisis Karakterisasi Struktur ZrO2-CuO dengan XRD ... 38
C. Hasil Analisis Penghalusan Struktur Rietveld dengan Rietica ... 42
D. Hasil Analisis Karakteristik Mikrostruktur ZrO2-CuO dengan SEM-EDS ... 44
V. KESIMPULAN DAN SARAN ... 51
A. Kesimpulan ... 51
B. Saran ... 52
DAFTAR PUSTAKA ... 53
I. PENDAHULUAN
A. Latar Belakang
Dalam sintesis material, beberapa hal yang sangat berpengaruh dalam menentukan kinerjanya adalah pemrosesan, modifikasi struktur dan sifat-sifat material. Perbaikan kinerja material terkait dengan sifat-sifatnya dapat dilakukan melalui beberapa cara, di antaranya memvariasi komposisi dengan mengubah konsentrasi atau menambahkan elemen pemadu (Fleming and Chan, 2000). Salah satu bahan yang dikembangkan dalam penelitian ini adalah ZrO2-CuO. ZrO2-CuO banyak menarik perhatian karena dapat diaplikasikan sebagai katalis (Vahidshad et al, 2008), selain itu dapat juga digunakan sebagai bahan elektrolit oksida dalam sel bahan bakar oksida padat sebab bahan ini merupakan bahan penghantar ionik yang baik (Usada dkk., 2001). Hasil penelitian sebelumnya (Vahidshad et al, 2008) menunjukkan bahwa ZrO2-CuO menjanjikan untuk digunakan sebagai katalis pada sintesis hidrogen guna menghasilkan metanol.
hijau bubuk atau kristal biru yang dapat larut dalam air, biasanya digunakan dalam elektroplating tembaga pada besi. Alasan digunakannya bahan-bahan itu karena bahan baku relative dapat terjangkau, mudah didapat dan dapat langsung digunakan dalam metode sol-gel.
ZrO2 (baddeleyite) adalah logam berwarna putih keabu-abuan, berbentuk kristal (amorf/struktur kristal yang tidak teratur), lunak, dapat ditempa dan diulur bila
murni, juga tahan terhadap udara bahkan api (Fleming and Chan, 2000). ZrO2 mempunyai 3 polimorfis yaitu monoklinik dengan suhu di bawah 1170 °C, tetragonal dikisaran suhu 1170 °C - 2370 °C dan kubik pada suhu 2370 °C. Hal yang menarik dan menjadi unggulan zirkonium adalah kekuatan dan ketangguhannya, dimana kekuatan yang tinggi tersebut tidak dapat dijumpai bila zirkonium ada pada fase monoklinik. Justru pada fase kubik zirkonium mempunyai ikatan ionik yang sangat kuat. ZrO2 dengan fase kubik biasanya diaplikasikan pada komposit keramik tetapi perlu distabilkan dan dimurnikan terlebih dahulu (Febrianto, 1996). Sifat-sifat bentuk simetri ZrO2 yang lebih tinggi dan lebih baik terjadi pada fase monoklinik. Pada bentuk tetragonal menunjukkan tekstur dan sifat asam basa yang baik dan sebagian besar digunakan dalam katalisis sebagai bahan pendukung yang penting karena memiliki sifat mekanis dan stabilitas termal, luas daerah permukaan yang besar dan bersifat asam basa (Vahidshad et al, 2012).
monoklinik sederhana (Ohya, 2000). Sebagai oksida logam transisi, CuO juga banyak digunakan sebagai baterai, elektroda, pigmen dan terutama digunakan sebagai katalis. Katalis logam transisi CuO biasanya didukung oleh logam oksida seperti ZnO, Al2O3, SiO2, ZrO2, Ce2O3. Menurut penelitian Vahidshad et al (2008) ada beberapa perbedaan yang mendukung logam transisi untuk aktif membentuk uap pada metanol.
Stabilisator doping zirkonia dengan logam pada fase tetragonal dan fase kubik telah dilaporkan sebelumnya. Stabilisator seperti Y2O3, MgO, CaO, Cr2O3, Fe2O3, NiO, CuO biasanya ditambahkan ke zirkonia untuk mempromosikan penahanan dari suhu tinggi polimorf. Tujuan utama menggunakan oksida logam seperti dopan adalah untuk mendapatkan zirkonia pada fase kubik dan fase tetragonal dengan permukaaan Brunaur Emmett Teller (BET) tinggi. CuO adalah katalis logam oksida kompleks yang dipakai pada reaksi hidrogenasi CO2 menjadi metanol. Bahan ZrO2 banyak digunakan dalam proses katalitik pada katalis, sebagai pendukung dan juga sebagai promotor karena logam ZrO2 termasuk logam transisi yang tidak bersifat asam lemah dan basa lemah tetapi sebagai redoks (Tanabe et al, 1997). Kinerja katalis sintesa berbasis Cu dapat ditingkatkan dengan penambahan zat aditif seperti ZrO2 (Syamsuddin dan Husin, 2008).
degradasi, biasanya bahan padatan yang memiliki sifat semikonduktor (Illisz et al., 2002). Fotokatalis yang sudah banyak dikenal adalah logam transisi yang memiliki struktur semikonduktor (Ekimav et al., 1985) seperti bahan ZrO2-CuO. Saat zirkonium didopan dengan logam transisi bisa menjadi bahan elektronik yang dapat dimodifikasi. Bahan zirkonium efektif sebagai fotokatalis, sifat fotokatalis ini dapat ditingkatkan dengan didopan logam seperti mangan. Zirkonium memiliki sifat yang menarik untuk beragam aplikasi seperti katalis. Penelitian sebelumnya, Cu/ZrO2 dan ZrO2 dikarakterisasi dengan spektroskopi UV-Vis dapat dilaporkan bahwa nilai energi gap (Eg) berkurang saat ditambahkan dopan logam (Lopez et al, 2006). Hal ini juga diketahui bahwa aktifitas optimal fotokatalitik evolusi H2 dapat diperoleh ketika fotokatalis komposit Cu/ZrO2 disintesis dengan teknik sol-gel dengan perbandingan mol CuO ke ZrO2 itu 40% (Yang et al, 2012).
Menurut penelitian Vahidshad et al (2008), pembuatan ZrO2-CuO dengan metode sol-gel diperoleh ZrO2 dengan fase tetragonal dan CuO 30 wt % yang menjanjikan menjadi katalis. ZrO2-CuO dapat juga menjadi fotokatalis karena zirkonium memiliki sifat yang membuatnya menarik untuk berbagai aplikasi. Jadi zirkonium dapat diperhitungkan dalam aplikasi fotokimia, terutama bila didoping dengan ion logam transisi yang cocok untuk memperpanjang penyerapan cahaya untuk daerah tampak (Lopez et al, 2006).
bergantung pada kesempurnaan reaksi hidrolisis dan polikondensasi. Pembuatan material komposit melalui proses sol-gel banyak keuntungannya antara lain tingkat stabilitas termal yang baik, stabilitas mekanik yang tinggi, daya tahan pelarut baik, modifikasi permukaan yang dapat dilakukan dengan berbagai kemungkinan (Fernandez, 2011). ZrO2-CuO dapat disintesis dengan beberapa metode seperti sol-gel, presipitasi, mikroemulsi, metode template, solid state. Metode sol-gel adalah metode yang menjanjikan untuk sintesis partikel berukuran nanometer. Metode sol-gel telah berhasil digunakan untuk menghasilkan nanopartikel (Vahidshad et al, 2011). Dari uraian ini diharapkan ZrO2-CuO yang akan diperoleh dapat berukuran nano.
Penelitian ini bertujuan untuk mempelajari pembuatan ZrO2-CuO dan menganalisis struktur dan mikrostruktur yang dimiliki sampel. Struktur ZrO2 -CuO dianalisis menggunakan X-Ray Diffraction (XRD) untuk melihat struktur kristal yang terdapat dalam sampel dan mikrostruktur sampel dianalisis menggunakan Scanning Electrone Microscopy (SEM) yang dilengkapi dengan Energy Dispersive Spectroscopy (EDS) untuk melihat topografi dan jenis atom pada permukaan sampel.
B. Rumusan Masalah
1. Bagaimana pengaruh variasi komposisi dengan perbandingan antara ZrO2-CuO adalah 1 : 1, 1 : 4, 1 : 5, 1 : 6, 1 : 7, dan 1 : 8 terhadap karakterisasi struktur ZrO2-CuO?
2. Bagaimana pengaruh variasi komposisi dengan perbandingan antara ZrO2-CuO adalah 1 : 1, 1 : 4, 1 : 5, 1 : 6, 1 : 7, dan 1 : 8 terhadap karakterisasi mikrostruktur ZrO2-CuO?
C. Tujuan Penelitian
Adapun tujuan penelitian ini adalah:
1. Mengetahui pengaruh variasi komposisi antara ZrO2-CuO terhadap karakteristik strukturnya.
2. Mengetahui pengaruh variasi komposisi antara ZrO2-CuO terhadap karakteristik mikrostrukturnya.
D. Batasan Masalah
Pada penelitian ini, pembahasan dibatasi pada sintesis dan karakterisasi ZrO2-CuO dengan pengaruhnya dari variasi komposisi antara ZrO2-CuO.
E. Manfaat Penelitian
Manfaat dari penelitian ini adalah:
2. Sebagai alternatif dalam pemilihan bahan baku dan metode pembuatan ZrO2 -CuO.
II. TINJAUAN PUSTAKA
A. Zirkonium Dioksida (ZrO2)
Bahan ZrO2 ditemukan oleh M.H. Kalaproth pada tahun 1788 dalam bentuk
mineral zirkon yang tidak ditemukan di alam dalam bentuk bebas tetapi sebagai
oksida atau silikat dalam kerak bumi dan bebatuan dalam kadar kecil. Zirkonium
dioksida adalah logam berwarna putih keabu-abuan, berbentuk kristal
(amorf/struktur kristal yang tidak teratur), lunak, dapat ditempa dan diulur bila
murni, juga tahan terhadap udara bahkan api. Bahan ini termasuk keramik teknik
yang mempunyai sifat kegetasan (brittle) yang tinggi dan resistansi tinggi
terhadap berbagai jenis asam dan alkali, air laut dan agen lain-lain, memiliki titik
lebur yang sangat tinggi (>2000 °C) dan sensitif terhadap gas oksigen (Fleming
and Cahn, 2000).
Umumnya mineral zirkonium mengandung unsur besi, kalsium sodium, mangan
putih, bening hingga kuning kehijauan, coklat kemerahan, kuning kecoklatan dan
gelap (Sajima dkk., 2007). Unsur zirkonium termasuk dalam golongan IV B pada
sistem periodik yang mempunyai struktur kristal berbentuk heksagonal pejal
(HCP) dan mempunyai penampang makroskopis yang kecil dengan keuletan yang
tinggi. Bahan ini dapat mengalami transformasi fasa dari heksagonal tumpukan
1992). Garam-garam Zr (II) dan (III) akan segera berubah menjadi Zr (IV) dalam
media berair. Hidrat zirkonium oksida hanya larut dalam asam (Haissinky and
Adloff, 1965) yang memiliki daya tangkap yang rendah untuk neutron termal
sehingga cenderung sulit diaktifkan melalui iradiasi. Karakteristik zirkonium
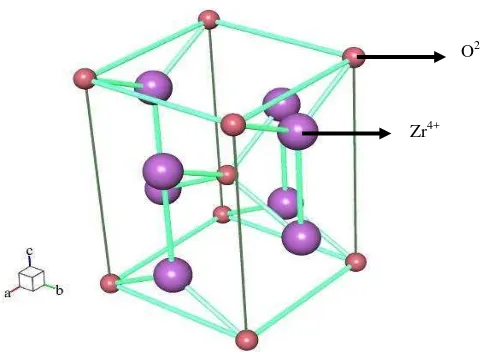
dioksida dapat dilihat pada Tabel 2.1 di bawah ini.
Tabel 2.1 Karakteristik zirkonium dioksida
Karakteristik Nilai Rumus molekul ZrO2
Warna Putih keabu-abuan
Struktur kristal kubik, monoklinik, dan tetragonal Parameter sel (Å) monoklinik :
a = 5,1450
b = 5,2070 c = 5,3110
tetragonal :
a = 3,640 b = 3,640
c = 5,270
Nomor atom 40
Indeks refleksi 1,92 – 2,19 Kekerasan (MPa) 903
Kepadatan (g.cm-3) 6,49 pada suhu 20°C Titik lebur (°C) 1852
Titik didih (°C) 4400
Zirkonium melimpah keberadaanya di alam seperti zirkon (hyacianth) dan
zirkonium (baddeleyite). Baddeleyite merupakan oksida zirkonium yang tahan
terhadap suhu yang sangat tinggi sehingga dapat digunakan untuk pelapis tanur
tinggi. Zirkonium terjadi secara alami, terdapat 4 isotop yang stabil dan dari 1
radioisotop yang mempunyai waktu hidup yang sangat panjang. Radioisotop
kedua yang paling stabil adalah 93Zr yang mempunyai waktu paruh 1,53 juta
tak murnian di dalam zirkonium oksida, didapatkan hasil bahwa zirkonium oksida
mengandung unsur kadmium (Cd) dengan konsentrasi 3,8-7,44 ppm, unsur silikat
(Si) antara 74,38-150,33 ppm dan krom (Cr) antara 19,00-45,76 ppm (Sholikhati
dan Prayitno, 2009). Pada keadaan di bawah normal zirkonium tidak dapat
bereaksi dengan air. Namun dengan udara zirkonium dapat bereaksi sehingga
dapat menghasilkan ZrO2, seperti reaksi berikut:
Reaksi dengan udara:
Zr (s) + O2 (g) ZrO2 (g) (2.1)
Reaksi dengan halogen
Zirkonium bereaksi dengan halogen membentuk zirkonium (IV) halida:
Zr (s) + 2F2 (g) ZrF4 (s) (2.2)
Zr (s) + 2Cl2 (g) ZrCl4 (s) (2.3)
ZrCl4 adalah kristal tak bewarna (tersublimasi di atas 331 °C). Zirkonium
berkoordinasi oktahedral dan membentuk jembatan rantai zig zag melalui
jembatan khlorin. Senyawa ini bersifat higroskopik dan larut dalam air,
etanol, dan sebagainya. ZrCl4 digunakan sebagai katalis Friedel-Crafts dan
sebagai komponen katalis polimerisasi olefin.
Zr (s) + 2Br2 (g) ZrBr2 (s) (2.4)
Zr (s) + 2I2 (g) ZrI2 (s) (2.5)
Reaksi dengan asam
Hanya terdapat sedikit kemungkinan logam zirkonium bereaksi dengan
asam. Zirkonium tidak dapat bercampur dengan asam hidrofluorik, HF,
Zirkonium dioksida sering didoping dengan Ca demi terjadinya kekosongan
oksigen. Karena difusi oksigen ke dalam ZrO2 dapat terjadi manakala ada
kekosongan oksigen pada ZrO2, maka semakin mudah pula oksigen terdifusi ke
dalam ZrO2 (Alvina blog, 2008). Beberapa metode yang tersedia untuk
memproduksi nanopartikel zirkonia adalah metode sol-gel, metode pirolisis,
penyemprotan, hidrolisis dan microwave plasma (Vahidshad et al, 2012).
1. Struktur Kristal ZrO2
Zirkonium tergolong material yang bersifat polimorfi yang memiliki tiga macam
struktur kristal yaitu monoklinik (<1170 °C), tetragonal (1170 - 2370 °C), kubus
(>2370 °C). Zirkonium murni pada suhu kamar memiliki struktur kristal
monoklinik (m-ZrO2) dan bila terkena pemanasan sampai 1000 - 1100 °C akan
berubah struktur kristalnya menjadi tetragonal (t-ZrO2). Karena pada kisaran suhu
1000 - 1100 °C masih tergolong fase yang tidak stabil dan bila didinginkan
kembali pada suhu ruang akan berubah kembali menjadi monoklinik (m-ZrO2).
Oleh karena itu, m-ZrO2 atau t-ZrO2 hanya sesuai untuk aplikasi pada suhu rendah
atau suhu ruang, akan tetapi m-ZrO2 atau t-ZrO2 memiliki kekuatan mekanik lebih
tinggi dibanding dengan c-ZrO2. Sedangkan c-ZrO2 tergolong fasa yang paling
stabil terhadap perubahan suhu. Untuk menstabilkannya perlu struktur kristalnya
sebagian atau seluruh diubah ke fasa c-ZrO2. Proses penstabilan ini ada
bermacam-macam yaitu Fully Stabilized Zirconia (FSZ), Partially Stabilized
Zirconia (PSZ), dan Tetragonal Zirconia Polycrystal (TZP) dimana dalam proses
CaO, MgO, atau Y2O3 (Maghfirah, 2008). Gambar 2.1 dan 2.2 menunjukkan
struktur kristal zirkonium menggunakan perangkat lunak Balls and Sticks (Ozawa
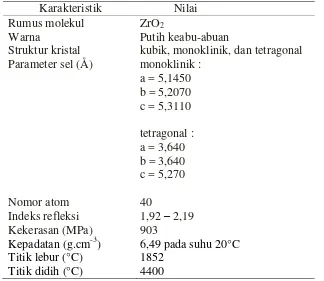
and Kang, 2004). Pada Gambar 2.1 model yang digambar adalah sistem monoklinik dengan nomor grup ruang 14, parameter sel: a = 5,1450 Å, b = 5,2070 Å, c = 5,3110 Å dan sudut α = λ0°, = λλ,2°, = 90° (model yang dipakai adalah Smith dan Newkirk, 1965).
Gambar 2.1 Kristal ZrO2 monoklinik dengan ion Zr4+ ditunjukkan dengan bulatan kecil berwarna kuning dan ion O2- bulatan besar berwarna biru di mana atom Zr dikelilingi oleh lima atom oksigen. Perangkat lunak yang digunakan untuk menggambar adalah program Ball and Sticks.
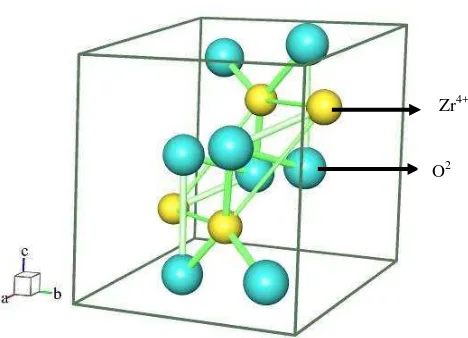
Sedangkan pada Gambar 2.2 model yang digambar adalah tetragonal dengan
nomor grup ruang 14, parameter sel: a = 3.640 Å, b = 3.640 Å, c = 5.270 Å dan
sudut α = λ0°, = 90°, = 90° (model yang dipakai adalah Smith and Newkirk,
1965).
Zr4+
Gambar 2.2 Kristal ZrO2 tetragonal dengan ion Zr4+ ditunjukkan dengan bulatan
kecil berwarna ungu dan ion O2- bulatan besar berwarna merah
dimana atom Zr dikelilingi oleh lima atom oksigen. Perangkat lunak yang digunakan untuk menggambar adalah program Balls and Sticks.
2. Aplikasi ZrO2
Zirkonium merupakan bahan yang mempunyai peran yang sangat strategis dalam
berbagai industri (Sajima dkk., 2007) dan pemakaian zirkonium saat ini masih
relatif sedikit (Roziqin dan Wahyuni, 2007). Salah satu aplikasinya digunakan
sebagai penghias batu permata alami yang digunakan pada intan kemudian
diproses untuk menghasilkan kubik zirkonia. Kubik zirkonia ini berwujud kristal
yang bisa digunakan sebagai pengganti intan dengan harga yang lebih terjangkau.
Dalam matriks, zirkonium berperan meningkatkan densitas matriks yang
memberikan kekuatan pada matriks agar lebih tahan terhadap kompresi dan
perlakuan mekanis (Hidayat dkk., 2009). Sedangkan pada bidang
mekanik/otomotif, elektrik, refraktori bahan ini termasuk salah satu jenis dari
keramik teknik yang aplikasinya sangat luas (Maghfirah, 2008).
O2
Material berbasis ZrO2 dengan struktur nanokristal mempunyai ketahanan
oksidasi lebih tinggi dibandingkan dengan fasa amorf maupun kuasikristalnya.
Kristalisasi bahan amorf berbasis ZrO2 dengan penambahan unsur pemadu Cu
untuk 2 komponen (ZrCu) dan 3 komponen (ZrCuAl) dapat menambah nilai
kekerasannya (Triwikantoro dan Sukendar, 2007). ZrO2 termasuk keramik teknik
yaitu keramik yang dibuat dengan oksida-oksida logam atau logam, selain ZrO2
ada oksida logam seperti Al2O3, MgO, SiO2 dan lain-lain. Keramik oksida ini
tahan sampai dengan suhu 2000 °C. Pada tipe sel pembakaran solid oxide fuell
cell (SOFC) yang bekerja pada suhu 1000 °C menggunakan keramik padat yaitu
ZrO2 sebagai elektrolit (Yandi-sage, 2009). ZrO2 dengan tambahan CaO dan
Y2O3 digunakan sebagai bahan elektrolit oksida dalam sel bahan bakar oksida.
Ketetapan struktur kristal yang dimiliki zirkonia dapat memiliki sifat konduktor
yang baik sehingga dikatakan sebagai elektokramik. Dalam elektrokeramik,
zirkonia dapat digunakan sebagai fotoanoda untuk reaksi redoks (Veda et al,
2004) apabila didoping dengan oksida metal, seperti tembaga, platina, rodium,
paladium, dan nikel dalam fotoelektrokimia (sel elektrolisis) dan sensor oksigen
karena dengan kemampuannya, ion-ion oksigen dapat memungkinkan berpindah
secara bebas melalui struktur kristalnya pada temperatur yang sangat tinggi.
Dalam bidang industri non nuklir, zirkonium berperan dalam industri keramik, cat
(pigmen), semikonduktor dan pelapisan pengikat keras seperti turbin. Oksida
zirkonium apabila dipadukan dengan oksida logam lainnya dapat digunakan
sebagai bahan elektrolit oksida dalam sel bahan bakar oksida padat (Usada dkk.,
katalisis karena bersifat mekanis dan stabilitas termal, daerah permukaan yang
besar dan sifat asam basa. Zirkonium selain diterapkan sebagai penyangga katalis
yang menjanjikan, dapat digunakan diberbagai reaksi penting dalam industri
seperti pengolahan air, oksidasi alkohol dan sintesis metanol dan alkohol tinggi
(Vahidshad et al, 2011;2012). Dalam bidang industri nuklir, bahan zirkonium dapat diolah menjadi logam yang berguna sebagai struktur reaktor atau
kelongsong bahan bakar nuklir, karena mempunyai sifat yang unggul seperti tahan
korosi mempunyai serapan neutron yang kecil (0,18-0,2 barn) yang membuatnya
menjadi bahan yang ideal dan menaikkan sifat fisik terhadap logam paduannya
(Lutsman and Kerze, 1995).
B. Tembaga Dioksida (CuO) dan Aplikasinya
Tembaga (Cu) merupakan unsur yang jarang ditemukan di alam (precious metal).
Tembaga umumnya ditemukan dalam bentuk senyawa yaitu bijih mineral,
chalcopyrite (CuFeS2), copper glance atau chalcolite (Cu2S), cuprite (Cu2O),
malachite (Cu2(OH)2CO3) dan malaconite/tenorite (CuO). Logam tembaga
bereaksi hanya dengan campuran asam sulfat dan asam nitrat pekat panas (aqua
regia). Bilangan oksidasi tembaga adalah +1 dan +2. Ion Cu+ kurang stabil dan
cenderung mengalami disproposionasi yaitu reaksi redoks yang reduktor dan
oksidatornya merupakan zat yang sama. Reaksi yang terjadi adalah sebagai
berikut:
Tembaga tidak berekasi dengan asam klorida dan asam sulfat encer dan beberapa
asam organik, tetapi larut dalam asam nitrat encer dan asam oksidator lain.
Reaksi yang terjadi adalah sebagai berikut:
Cu + 2NO3 + 8H 3Cu2+ + 2NO + 4H2O (2.7)
Tembaga (II) bersifat paramagnetik dan berwarna sedangkan untuk senyawa
hidrat yang mengandung ion Cu2+ berwarna biru. Beberapa contoh senyawa yang
mengandung tembaga (II) adalah CuSO4.5H2O (biru), CuS (hitam), CuO (hitam).
Tembaga dioksida merupakan senyawa yang terdiri dari Cu dan O dalam senyawa
mineral CuO atau tenorite, salah satu dari senyawa oksida tembaga disamping
Cu2O (cupric). Tembaga dioksida ini termasuk tembaga yang bereaksi dengan
oksigen membentuk oksidanya, berwarna kristal hitam yang diperoleh melalui
pirolisis dari garam okso yang lain, dan memiliki struktur kristal monoklinik
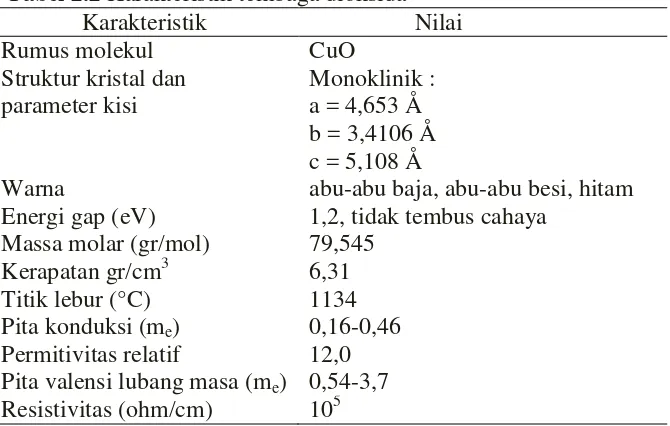
(Ohya et al, 2000). Karakteristik tembaga dioksida dapat dilihat dari Tabel 2.2.
Tabel 2.2 Karakteristik tembaga dioksida
Karakteristik Nilai
Rumus molekul CuO
Struktur kristal dan parameter kisi
Monoklinik : a = 4,653 Å b = 3,4106 Å c = 5,108 Å
Warna abu-abu baja, abu-abu besi, hitam Energi gap (eV) 1,2, tidak tembus cahaya
Massa molar (gr/mol) 79,545 Kerapatan gr/cm3 6,31 Titik lebur (°C) 1134 Pita konduksi (me) 0,16-0,46
Permitivitas relatif 12,0 Pita valensi lubang masa (me) 0,54-3,7
Berikut ini adalah gambar struktur kristal CuO menggunakan perangkat lunak
Balls and Sticks (Ozawa and Kang, 2004) (Gambar 2.3). Model pada Gambar 2.3
adalah monoklinik dengan nomor grup ruang 15, parameter sel: a = 4,653 Å,
b = 3,4106 Å, c = 5,108 Å dan sudut α = λ0°, = λλ,48°, = 90° (model yang
dipakai adalah Tunell et al, 1935).
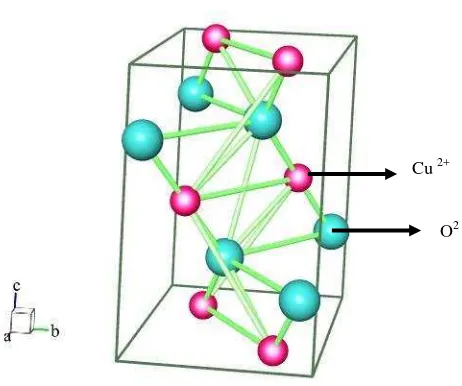
Gambar.2.3 Kristal CuO dengan ion Cu2+ ditunjukkan dengan bulatan kecil
berwarna merah muda dan ion O2- bulatan besar berwarna biru di mana atom Cu dikelilingi oleh empat atom oksigen. Perangkat lunak yang digunakan untuk menggambar adalah program Balls and Sticks.
CuO terdekomposisi pada suhu di atas 800 °C menjadi CuO2 halida
(Annisanfushie’s weblog, 2012). Dalam senyawa mineral, CuO atau tenorite
merupakan senyawa keramik yang paling sederhana yang terdiri dari atom logam
dan non logam dalam jumlah yang sama. Seperti halnya keramik pada umumnya
ikatan CuO terbentuk oleh ikatan ion dan kovalen. Ikatan ion yang terbentuk
melalui serah terima elektron, jadi ikatan ion pada CuO dapat terjadi dimana dua
Cu 2+
elektron dipindahkan dari atom Cu ke atom O sehingga menghasikan kation
(Cu2+) dan anion (O2-). Ikatan kovalen CuO pada hal ini elektron valensi dipakai
bersama dan terjadinya pembagian elektron valensi. Sebagaimana definisi dari
ikatan kovalen yaitu terbentuk karena penggunaan bersama pasangan elektron.
Senyawa CuO diperoleh dari hasil pemanasan senyawa copper (II) nitrate
(Cu(NO3)2), copper (II) hydroxide (Cu(OH)2) atau copper (II) carbonate (CuCO3)
seperti yang ditunjukkan pada persamaan reaksi di bawah ini:
2Cu(NO3)2 2CuO + 4NO2 + O2 (2.8)
Cu(OH)2 (s) CuO(s) + H2O(l) (2.9)
CuCO3 CuO + CO2 (2.10)
Pada ekstraksi logam zaman dahulu, prosesnya dimulai dengan bara arang sebagai
reduktornya. Karbon dan karbon monoksida (CO) mempunyai kemampuan
mereduksi beberapa oksida logam menjadi logam, misalnya:
2CuO (s) + C (s) 2Cu (l) + CO2 (g) (2.11)
CuO (s) + CO (g) 2 Cu (l) + CO2 (g) (2.12)
Gas netral seperti metana (CH4) dapat juga digunakan untuk mereduksi tembaga
(II) oksida panas menjadi logam tembaga. Namun perlu diingat tidak semua
senyawa logam dapat direduksi oleh C atau CH4
4CuO (s) + CH4 4Cu (l) + 2H2O (g) + CO2 (g) (2.13)
Senyawa CuO memiliki sifat optik dan listrik yang cocok untuk piranti-piranti
optoelektronik seperti piranti sel surya dan baterai lithium sebagai elektroda aktif
(Wismadi, 2001). Bahan CuO memiliki sifat serapan (absorption) gas yang baik
diaplikasikan sebagai sensor gas, di antaranya gas oksigen, karbon monoksida,
asam sulfida dan sebagainya. CuO murni memiliki koefisien absorpsi yang tinggi
sehingga sebagian besar cahaya dapat diabsorpsi pada CuO dalam bentuk lapisan
tipis (Ohya, 2000). CuO banyak digunakan sebagai katalis yang digunakan pada
hidrogenasi CO2 dalam berbagai riset karena cukup aktif dalam sintesis metanol
dengan metode kopresipitasi (Nasikin dkk., 2004).
C. Sistem Pembuatan ZrO2-CuO
Ada beberapa penelitian yang dilakukan untuk mendapatkan bahan ZrO2-CuO
dengan teknik yang berbeda-beda. Dalam penelitian Esposito et al (2011), katalis
Cu-ZrO2 dibuat dengan metode sol-gel dan dikarakterisasi dengan XRD, adsorpsi
N2, DTA/TGA, TPR dan pengukuran dispersi N2O sebagai katalis untuk oxidatif
steam reforming methanol (OSRM). Prosedur sintesis untuk masing-masing
prekursor Cu-ZrO2 yaitu prekursor Cu untuk sampel A-ZrCu pada bahan
Cu(CH3COO)2.H2O dibandingkan dengan prekursor Cu untuk sampel N-ZrCu
dari Cu(NO3)2.5H2O untuk menyelidiki akibat dari sintesis parameter pada sifat
fisik dan kimia dari bahan. Prosedur yang diterapkan menghasilkan perbedaan
yang luar biasa dalam perilaku termal, seperti kristalisasi ZrO2 tetragonal
dialihkan ke suhu yang lebih tinggi pada sampel N-ZrCu, efek ini tidak teramati
pada sampel A-ZrCu. Sistem Cu-ZrO2 menunjukkan aktifitas katalitik yang baik
untuk OSRM bahkan tanpa perlakuan pra-reduksi. Sampel N-ZrCu ternyata
menghasilkan metanol yang lebih tinggi dan juga menghasilkan H2. N-ZrCu
Pada penelitian Wang and Caruso (2002), partikel nanosized tembaga
oksida-zirkonia mengandung 10-30% mol yang dibuat dengan teknik presipitasi dalam
larutan hidroksida tetra metil amonium cair. Dua metode yang digunakan yaitu
metode yang berbeda yaitu in situ dan metode tahap demi tahap dimana tembaga
diperkenalkan dengan prosedur sintesisnya dan memungkinkan perbandingan sifat
serbuk akhir yang dihasilkan dalam dua metode itu. Setelah dikalsinasi pada suhu
500 °C, area permukaan dan tahap komposisi yang didapat berbeda dari dua
metode itu. ZrO2 tetragonal diamati dari pola XRD pada metode tahap demi
tahap, ini menunjukkan bahwa semua tembaga yang halus terdistribusi.
Sedangkan metode in situ, ZrO2 tetragonal diperoleh kadar tembaga rendah dan
puncak yang terindeks untuk ZrO2 tetragonal bergeser ke sudut yang yang lebih
tinggi dengan meningkatnya kadar tembaga. Senyawa amorf diperoleh pada kadar
tembaga yang tinggi (30% mol). Penelitian menunjukkan bahwa ZrO2 tetragonal
dan tembaga oksida hadir setelah dikalsinasi pada 400 °C, dalam jumlah kecil
terdapat ZrO2 monoklinik dan hadirnya tembaga oksida setelah dikalsinasi 700 °C.
Jadi, setelah pemanasan 500 °C senyawa amorf diperoleh dan suhu ini
menunjukkan titik tahap transisi. Penggabungan tembaga dalam kisi ZrO2
mengakibatkan hilangnya urutan dalam struktur ZrO2 ketika dikalsinasi pada suhu
500 °C, dengan peningkatan suhu kalsinasi yang dapat mengarah ke perubahan
fasa.
Struktural dan morfologi sampel tembaga-zirkonia pada penelitian Vahidshad
(2009) dibuat dengan metode teknik sol-gel dengan suhu kalsinasi dan waktu
yang berbeda. Suhu kalsinasi dan waktu sangat mempengaruhi morfologi serta
menunjukkan ZrO2 kubik dan tembaga oksida hadir dalam struktur bila suhu di
bawah 400 °C. Terdapat ZrO2 kubik, ZrO2 tetragonal dan ZrO2 monoklinik hadir
meski dalam jumlah kecil serta CuO terbentuk setelah kalsinasi 500 °C.
Pemanasan di bawah 500 °C akan menghasilkan senyawa amorf yang terbentuk
dan suhu ini menyatakan titik transisi fase. Pengaruh waktu kalsinasi ini diamati
dalam morfologi dan perubahan struktural CuO-ZrO2 pada suhu 600 °C selama 2,
3.5, 5.5, 7.5, dan 10 jam. Penggabungan tembaga dalam ZrO2 menghasilkan kisi
dan hilangnya urutan dalam struktur ZrO2 saat dikalsinasi. Peningkatan suhu
kalsinasi menyebabkan perubahan fasa dalam struktur ZrO2.
Steam reforming methanol yang digunakan untuk memproduksi hidrogen dapat
dilakukan pada katalis yang berbasis tembaga seperti penelitian Purnama dkk
(2004). Menurut penelitian mereka, sifat katalitik dari katalis CuO-ZrO2 (8.5 %
wt) disintesis dengan teknik templating yang diselidiki berhubungan dengan
aktifitas, stabilitas jangka panjang, pembentukan CuO. Setelah aktifasi, katalis
CuO-ZrO2 ini ditemukan menjadi lebih aktif dari sistem CuO/ZnO/Al2O3, lebih
stabil selama beroperasi dan dapat menghasilkan sedikti CO. Karakterisasi
struktural dengan XRD dan XAS menunjukkan bahwa katalis terdiri dari kristal,
zirkonia tetragonal juga hadir dalam ukuran domain kecil dan struktur CuO yang
teratur atau kecil.
Zirkonia sebagai pendukung komposit fotokatalis CuO-ZrO2 berhasil disintesis
oleh Wang and Caruso (2012) melalui teknik sol-gel yang dibantu dengan asam
sitrat. Sebagai perbandingan, bahan CuO-ZrO2 juga dibuat dengan reaksi
dikarakterisasi dengan XRD, TEM, TGA-DTA. Aktifitas fotokatalitik katalis
CuO-ZrO2 diselidiki berdasarkan evoluisi H2 dari larutan asam oksalat di bawah
simulasi iradiasi sinar matahari. Hal ini ditemukan bahwa aktifitas optimal
fotokatalitik evolusi H2 dapat diperoleh ketika fotokatalis komposit CuO-ZrO2
disintesis dengan teknik sol-gel dan perbandingan mol CuO ke ZrO2 ini 40%.
Aktifitas oksida tembaga didukung oleh ZrO2 monoklinik yang dikalsinasi pada
suhu yang lebih tinggi ini ternyata hasilnya jauh lebih tinggi dibandingkan pada
ZrO2 tetragonal yang dikalsinasi pada suhu yang lebih rendah dan suhu kalsinasi
terbaik adalah 900 °C.
D. Sintesis Partikel dengan MetodeSol-Gel
Metode sol-gel dikenal sebagai salah satu metode sintesis nanopartikel yang
cukup sederhana dan mudah. Salah satu metode basah karena prosesnya
melibatkan larutan sebagai medianya. Pada metode sol-gel, sesuai dengan
namanya larutan mengalami perubahan fasa menjadi sol (koloid yang mempunyai
padatan tersuspensi dalam larutannya) dan kemudian menjadi gel (koloid tetapi
mempunyai fraksi solid yang lebih besar daripada sol). Adapun parameter dari
Tabel 2.3 Parameter prosessol-gel
Tahapan Proses Tujuan Proses Parameter Proses Larutan Kimia membentuk gel tipe prekursor, tipe pelarut,
kadar air, konsentrasi prekursor, temperatur, pH
Aging mendiamkan gel
untuk mengubah sifat waktu temperatur, komposisi cairan, lingkungan aging Penyaringan
(drying)
menghilangkan air dari gel
metode pengeringan
(evaporative, supercritical dan
freeze drynig), temperatur,
tekanan waktu
Kalsinasi mengubah sifat-sifat fisik/kimia padatan, sering menghasilkan kristalisasi dan densifikasi
temperatur waktu, gas (inert atau reaktif)
(Widodo, 2010).
Beberapa keuntungan menggunakan metode sol-gel adalah homogenitasnya lebih
baik, temperatur proses rendah, kemurnian lebih baik, hemat energi, pencemaran
rendah, tidak terjadi reaksi dengan senyawa sisa, kehilangan bahan akibat
penguapan dapat diperkecil. Sedangkan beberapa kerugian menggunakan metode
sol-gel adalah material proses cukup mahal, penyusutan yang besar selama proses
pengeringan, sisa hidroksil dan karbon, menggunakan pelarut organik yang
berbahaya bagi kesehatan, waktu proses cukup lama (Mackenzie, 1982).
Metode sol-gel digunakan dalam pembuatan teknologi nanokristalin metal oksida
karena prosesnya lebih singkat, temperatur yang digunakan lebih rendah,
menghasilkan serbuk metal oksida dengan ukuran nanopartikel dan dapat
menghasilkan karakteristik yang lebih baik dari pada proses metalurgi serbuk
(Widodo, 2010). Metode sol-gel terutama untuk pembuatan bahan (biasanya
sebagai prekursor untuk jaringan terpadu (gel) baik dari diskrit partikel atau
polimer jaringan. Proses yang terjadi selama perubahan fase dari sol menjadi gel
ada dua tahap yaitu reaksi hidrolisis komponen logam alkoksida dan reaksi tahap
kedua adalah reaksi polimerasi logam hidroksida menjadi jaringan polimer
anorganik yang menyebabkan viskositas maikn tinggi dan akhirnya membentuk
gel (Mahreni, 2010).
Penghapusan sisa cairan (pelarut) fase memerlukan proses pengeringan yang
biasanya disertai dengan sejumlah besar penyusutan dan densifikasi. Tingkat di
mana pelarut dapat dihapus pada akhirnya ditentukan oleh distribusi porositas
dalam gel. Metode sol-gel juga berperan dalam pembentukan teknologi katalis
heterogen karena proses sol-gel dapat dikontrol untuk mendapatkan kemurnian
dan homogenitas komposisi yang tinggi, sehingga katalis yang diperoleh memiliki
unjuk kerja yang konsisten (Brinker and Scherer, 1990). Beberapa metode telah
dikembangkan untuk mempersiapkan nanopartikel ZrO2-CuO, seperti metode
sol-gel (Dongare et al., 2001), presipitasi (Ritzkopf et al., 2006), mikroemulsi
(Ramaswamy et al., 2004), metode template dan sebagainya (Ritzkopf et al.,
2006). Metode sol-gel adalah metode yang menjanjikan untuk sintesis partikel
berukuran nanometer (Vahidshad et al., 2011).
E. Difraksi Sinar-X
Spektroskopi XRD merupakan salah satu metode karakterisasi material yang
untuk mengidentifikasi fasa kristalin dalam material dengan cara menentukan
parameter struktur kisi serta untuk mendapatkan ukuran partikel.
Difraksi sinar-X mulai dikenal pada tahun 1912 sebagai awal dari studi intensif
mengenai difraksi sinar-X. Dimulai dari pertanyaan Max Von Lau kepada salah
seorang kandidat doktor P.P. Ewald yang dibimbing A. Sommerfeld, W. Friedrich
(asisten riset Sommerfeld) menawari dilakukannya eksperimen mengenai difraksi
sinar-X (Beiser, 1982). Max Von Lau mengawali pekerjaannya dengan
menuliskan hasil pemikiran teoritiknya dengan mengacu pada hasil eksperimen
Barkla. Max Von Lau berargumentasi, ketika sinar-X melewati sebuah kristal,
atom-atom pada kristal bertindak sebagai sumber-sumber gelombang sekunder,
layaknya garis-garis pada kisi optik (optical grating). Efek-efek difraksi bisa jadi
menjadi lebih rumit karena atom-atom tersebut membentuk pola tiga dimensi.
Untuk analisis struktur kristal dari suatu material dapat dilakukan dengan difraksi
sinar-X. Sinar-X adalah suatu radiasi elektromagnetik yang memiliki panjang
gelombang mendekati jarak antar atom pada kristal. Karena kristal terdiri atas
susunan atom-atom yang teratur, maka kristal akan mampu mendifraksikan
sinar-X yang melaluinya. Berkas sinar-sinar-X monokromatis yang jatuh pada suatu
permukaan kristal akan didifraksi ke segala arah, tetapi karena keteraturan letak
atom-atom kristal pada arah tertentu gelombang hambur itu akan berinterferensi
konstruktif dan berinterferensi destruktif. Skema difraksi sinar-X pada kisi kristal
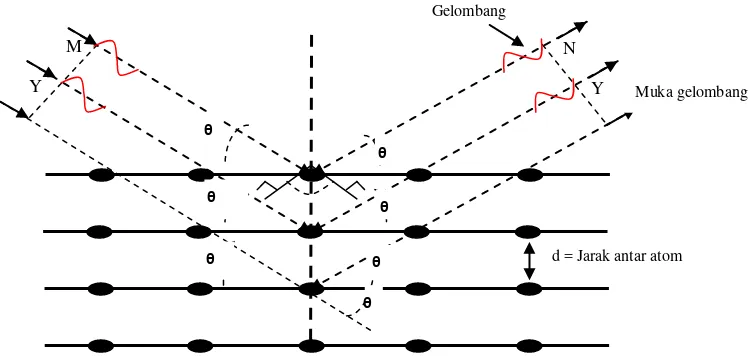
Gambar 2.4 Difraksi sinar-X pada kisi kristal (Vlack, 1989).
Agar berkas sinar yang dihamburkan atom-atom kristal secara konstruktif maka
beda lintasan antara kedua berkas sinar harus sama dengan kelipatan bilangan
bulat dari panjang gelombangnya, yaitu , 2 , γ dan seterusnya. Selisih jarak
antara dua berkas sinar adalah 2 d sin θ, maka persamaan matematis untuk
terjadinya interferensi konstruktif adalah sebagai berikut:
(2.14)
dengan d = jarak antar bidang, θ = sudut difraksi , = panjang gelombang sinar
-X, rumus di atas dikenal dengan Hukum Bragg (Beiser, 1982). Keuntungan
utama penggunaan sinar-X dalam karakterisasi material adalah kemampuan
penetrasinya, sebab sinar-X memiliki energi yang sangat tinggi akibat panjang
gelombangnya pendek. Sinar-X adalah gelombang elekromagnetik dengan
panjang gelombang 0,5-0,2 mikron. Sinar ini dihasilkan dari penembakan logam
dengan elektron berenergi tinggi. Elektron itu mengalami perlambatan saat
menumbuk logam dan meyebabkan elektron pada kulit atau logam tersebut
θ θ Y N M Y θ θ θ θ θ θ θ Muka gelombang
d = Jarak antar atom
terpental membentuk kekosongan. Elektron dengan energi yang lebih tinggi
masuk ke tempat kosong dengan memancarkan kelebihan energinya sebagai foton
sinar-X.
Sinar-X dihasilkan di suatu tabung sinar katode dengan pemanasan kawat pijar
untuk menghasilkan elektron-elektron, kemudian elektron-elektron tersebut
dipercepat terhadap suatu target dengan memberikan beda tegangan yang besar,
dan menembak target dengan elektron. Ketika elektron-elektron mempunyai
energi yang cukup untuk mengeluarkan elektron-elektron dalam target,
karakteristik spektrum sinar-X akan dihasilkan. Spektrum ini terdiri atas beberapa
komponen-komponen, yang paling umum adalah Kα dan K . Kα berisi pada
sebagian dari Kα1 dan Kα2. Kα1 mempunyai panjang gelombang sedikit lebih
pendek dan dua kali lebih intensitas dari Kα2. Panjang gelombang yang spesifik
merupakan karakteristik dari bahan target (Cu, Fe, Mo, Cr).
Lalu kertas perak atau kristal monokrometer sebagai penyaring untuk
menghasilkan sinar-X monokromatik yang diperlukan untuk difraksi. Tembaga
adalah bahan sasaran yang paling umum untuk difraksi kristal tunggal, dengan
radiasi Cu Kα = 0,5418 Å. Berkas sinar-X ini melewati kolimator dan diarahkan
ke sampel. Saat sampel dan detektor diputar, intensitas sinar-X pantul itu
direkam. Ketika geometri dari peristiwa sinar-X tersebut memenuhi persamaan
Bragg, interferensi konstruktif terjadi dan suatu puncak di dalam intensitas terjadi.
Detektor akan merekam dan memproses isyarat penyinaran ini dan mengkonversi
isyarat itu menjadi suatu arus yang akan dikeluarkan pada printer atau layar
Dalam penelitian okasida logam yang berbentuk serbuk, sering digunakan metode
difraksi sinar-X serbuk. Pada difraksi sinar-X serbuk ini, terkadang terjadi
overlap dari puncak difraksi, terutama pada nilai 2θ yang tinggi. Hal tersebut
disebabkan semua pemantulan sinar-X terjadi pada sumbu 2θ. Terjadinya overlap
ini menyebabkan pemisahan intensitas dari tiap-tiap pemantulan sinar sangat sulit
dilakukan, padahal intensitas pemantulan sinar ini sangat penting dalam
penentuan struktur senyawa yang dianalisis.
Seperti serbuk di atas, analisis kualitatif data difraksi sinar-X serbuk dapat
dilakukan dengan database PCPDWIN (PDF, Powder Diffraction File) yang
dikeluarkan oleh JCPDS (Joint Committee on Powder Diffraction Standard).
Sementara itu, untuk dapat memastikan struktur senyawa yang dianalisis dapat
digunakan metode Rietveld.
Dalam metode Rietveld, intensitas dari berbagai macam pemantulan dihitung
dengan suatu model struktur. Pembentukan pola difraksi serbuk dilakukan
dengan melakukan penggabungan antara intensitas yang dihasilkan dengan
faktor-faktor pengontrol, seperti panjang gelombang radiasi dan parameter kisi. Hal ini
dimaksudkan agar pola difraksi serbuk dapat dihitung berdasarkan model struktur.
Prinsip dari metode Rietveld ini adalah penyesuian antara pola difraksi serbuk
hasil eksperimen dengan pola difraksi model struktur. Dalam metode Rietveld ini
dilakukan pergeseran nilai-nilai parameter struktur model sehingga dihasilkan
kemiripan yang maksimal dengan pola difraksi serbuk hasil eksperimen dan
model. Nilai-nilai parameter struktur hasil pergeseran akan menjadi nilai
F. Analisis Mikrostruktur dengan SEM
Analisis mikrostruktur untuk mengetahui bentuk dan ukuran dari butir-butir serta
mengetahui interaksi satu butir dengan butir lainnya. Melalui observasi dengan
SEM dapat diamati dengan seberapa jauh ikatan butiran yang satu dengan yang
lainnya dan apakah terbentuk lapisan di antara butiran atau disebut grain
boundary. SEM adalah mikroskop elektron yang memiliki pembesaran yang
lebih tinggi dibandingkan dengan mikroskop optik. Namun untuk pembesaran di
bawah 500 kali, gambar yang dihasilkan oleh SEM memiliki kualitas yang kurang
baik dibandingkan dengan mikroskop optik, sehingga keduanya dapat saling
melengkapi. Teknik SEM merupakan suatu teknik yang umumnya dipakai untuk
menganalisis morfologi permukaan lapisan tipis.
Analisis mikrostruktur dengan SEM bertujuan untuk mengetahui susunan
partikel-partikel setelah proses sintering dan juga dapat diketahui perubahannya akibat
variasi suhu sintering (William, 1991). Keunggulan SEM terutama pada beragam
sinyal yang dihasilkan oleh interaksi antara berkas elektron dengan sampel. Hasil
dari pola refleksi dalam proses SEM ini memberikan informasi kepada kita berupa
topologi, morfologi, komposisi, informasi mengenai kekristalan bahan.
Gambaran permukaan yang diperoleh merupakan gambaran topologi dengan
semua tonjolan dan lekukan permukaan. Gambaran topologi ini diperoleh dari
penangkapan eklektron sekunder yang dipancarkan oleh sampel yang dilapisi
konduktor sehingga berinteraksi dengan berkas elektron yang dapat memberi
ditangkap oleh detektor kemudian direkam melalui monitor sehingga diperoleh
gambaran topologi permukaan sampel.
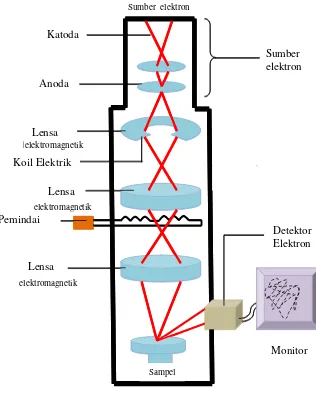
Elektron yang dihasilkan dari proses SEM ini dihasilkan dari senjata elektron
(electron gun), elektron yang dipancarkan dari senjata elektron ini bersifat
monokromatik. Pancaran elektron tersebut kemudian diteruskan pada anoda, pada
proses ini elektron mengalami penyearahan menuju titik fokus, selain itu anoda
pun berfungsi untuk membatasi (meng-eliminasi) pancaran elektron yang
memiliki sudut hambur yang terlalu besar. Kemudian berkas elektron yang telah
melewati anoda diteruskan menuju lensa magnetik, scanning coils, dan akhirnya
elektron tersebut menembak spesimen. Skema SEM ditunjukkan pada Gambar
Gambar 2.5 Skema kerja alat SEM (Goldstein et al, 1981). Sumber elektron Detektor Elektron Monitor Katoda Anoda Lensa Lensa Lensa Pemindai
LL Koil Elektrik
Sampel
El elektomagnetik
Eelelektromagnetik
El elektomagnetik
El elektromagnetik
Sumber elektron Detektor Elektron Monitor Katoda Anoda Lensa Lensa Lensa Pemindai
LL Koil Elektrik
Sumber elektron
Sampel Eelelektromagnetik
III. METODELOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2012 sampai dengan Februari
2013 di Labotarium Fisika Material Jurusan Fisika. Proses pencetakan dilakukan
di Laboratorium Kimia Instrumentasi, sementara kalsinasi dilakukan di
Laboratorium Ilmu Tanah Fakultas Pertanian Universitas Lampung. Karakterisasi
sampel untuk XRD dilakukan di laborarium Pusat Survey Geologi Bandung
sedangkan SEM dilakukan di Laboratorium Biomass FMIPA Universitas
Lampung.
B. Bahan dan Alat Penelitian
1. Bahan
Bahan yang digunakan dalam penelitian ini adalah serbuk zirkonium (IV) klorida
(ZrCl4) (98%) dari Merck dan serbuk tembaga nitrat (Cu(NO3)2) (99,5%) dari
Merck, etilen glikol (HOCH2CH2OH), asam sitrat (C6H8O7), KOH dan air.
2. Alat
Peralatan yang digunakan adalah neraca, timbangan digital, oven, furnace,
beaker, spatula, cawan tahan panas, mortal dan alu, alumunium foil, plastik
pressing, kertas label, pipet tetes. Kemudian menggunakan seperangkat
komputer, perangkat lunak Balls and Sticks, perangkat lunak Rietica, serta
karakterisasi sampel menggunakan XRD dan SEM yang dilengkapi dengan EDS.
C. Prosedur Kerja
Adapun langkah-langkah yang dilakukan adalah preparasi ZrO2-CuO dengan
metode sol-gel, pressing, kalsinasi, karakterisasi sampel dengan XRD untuk
mengetahui struktur kristal dan karakterisasi SEM untuk mengetahui
mikrostruktur sampel.
1.Sintesis ZrO2-CuO
Preparasi sampel diawali dengan penimbangan serbuk zirkonium (IV) klorida
(ZrCl4) dan tembaga nitrat (Cu(NO3)2) dengan komposisi masing-masing bahan
yang telah disiapkan. Sintesis ZrO2-CuO dilakukan dengan metode sol-gel
dimana serbuk ZrCl4 dan serbuk Cu(NO3)2 dicampur dengan perbandingan molar
1 : 1, 1 : 4, 1 : 5, 1 : 6, 1 : 7, 1 : 8. Setelah penimbangan bahan ZrCl4 dilarutkan
dengan50 ml air dalam gelas beaker kemudian barulah dimasukkan bahan
Cu(NO3)2. Selanjutnya semua bahan yang telah dicampur diaduk dengan
pengaduk magnetik selama 10 jam pada temperatur ruangan dan seraya diaduk
dengan menambahkan bahan etilen glikol 1 ml dan asam sitrat 1 gr. Dalam hal ini
etilen glikol bias berfungsi sebagai kompensasi panas yang timbul pada saat
artinya untuk merangsang campuran reaksi. Setelah diaduk selama 10 jam
kemudian ditambahkan KOH sebanyak 4 gr untuk mendapatkan gelnya dan
dipanaskan sampai kering pada suhu 150 °C selama 7 jam. Setelah dikeringkan
material ditumbuk sampai halus dan dilanjutkan dengan proses pencetakan dan
kalsinasi. Tahap pencetakan menggunakan die pressing, serbuk ditekan dengan
cetakan (die) berbentuk silinder dengan tekanan 100 MPa. Proses kalsinasi
berfungsi untuk menghilangkan zat-zat lain yang terdapat pada serbuk ZrO2-CuO
seperti asam sitrat, glikol etilen dan kadar uap air (H2O). Kalsinasi dilakukan
menggunakan tungku pembakaran selama10 jam pada suhu 700 °C.
2. Karakterisasi Sampel
Untuk keperluan karakterisasi ZrO2-CuO dilakukan menggunakan XRD untuk
mengetahui struktur kristal, SEM untuk mengetahui struktur mikronya. Alat XRD
yang digunakan adalah merk PANalytical dengan V sebesar 40 Kv, I sebesar 30
mA, untuk 2θ sebesar 20° - 120°, dan step size yang digunakan yaitu 0,02°. Pada
SEM, alat yang digunakan merk Zeiss dengan perbesaran 500 kali. Kombinasi
kedua uji ini akan dapat mengkonfirmasi dengan jelas apakah sampel yang dibuat
sudah menunjukkan ukuran butir dalam skala nano atau belum.
D. Diagram Alir Penelitian
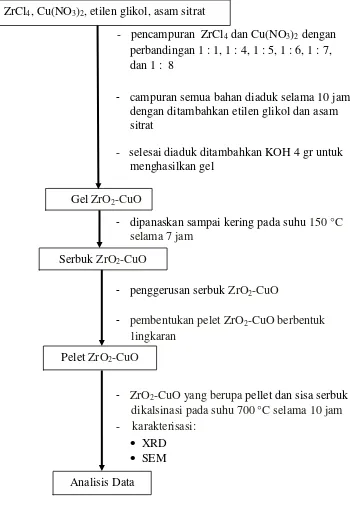
Adapun garis besar proses penelitian yang dilakukan dapat dibentuk ke dalam
- pencampuran ZrCl4 dan Cu(NO3)2 dengan perbandingan 1 : 1, 1 : 4, 1 : 5, 1 : 6, 1 : 7, dan 1 : 8
- campuran semua bahan diaduk selama 10 jam dengan ditambahkan etilen glikol dan asam sitrat
- selesai diaduk ditambahkan KOH 4 gr untuk menghasilkan gel
-- dipanaskan sampai kering pada suhu 150 °C selama 7 jam
- penggerusan serbuk ZrO2-CuO
- pembentukan pelet ZrO2-CuO berbentuk
lingkaran
- ZrO2-CuO yang berupa pellet dan sisa serbuk
dikalsinasi pada suhu 700°C selama 10 jam - karakterisasi:
[image:44.595.159.509.85.592.2] XRD SEM
Gambar 3.1 Diagram alir proses penelitian.
ZrCl4, Cu(NO3)2, etilen glikol, asam sitrat
GelZrO2-CuO
Serbuk ZrO2-CuO
Pelet ZrO2-CuO
V. KESIMPULAN
Sintesis dan karakterisasi ZrO2-CuO mempengaruhi hasil analisis struktur dan mikrostrukturnya, maka disimpulkan sebagai berikut:
1. Fasa yang muncul setelah kalsinasi pada suhu 700 °C adalah fasa baddeleyite dengan nomor PDF#37-1484, tenorite dengan nomor PDF#02-1041, zirconium yttrium oxide dengan nomor PDF#01-089-9068, dan sylvite dengan nomor PDF#00-004-0587 .
2. Hasil analisis dengan SEM menunjukkan mikrostruktur yang dihasilkan semakin kecil dan homogen seiring dengan penambahan perbandingan komposisi CuO dan ukuran butiran partikel relatif berukuran mikro. Ukuran butiran partikel berkisar 9 µm – 19 µm.
3. Pada hasil XRD untuk ukuran butir pada sampel ZrO2-CuO 1 : 1 lebih besar yaitu 313 nm dibandingkan dengan hasil SEM pada sampel yang sama yaitu 19,3 m. Sedangakan pada hasil XRD untuk ukuran butir pada sampel ZrO2 -CuO 1 : 8 ternyata lebih kecil yaitu 77 nm jika dibandingkan dengan hasil
SEM pada sampel yang sama yaitu λ,8 m.
hadirnya fasa amorf dari CuO dan mikrostruktur ZrO2-CuO yang dihasilkan lebih kecil dari ukuran butiran pada komposisi mol antara ZrO2-CuO 1 : 1.
B. Saran
DAFTAR PUSTAKA
Annisanfushie’sweblog.htm. 2012. Kimia Tembaga. Diakses pada tanggal 11
Februari 2012. Pada pukul 10.34 WIB.
Alvina.blog.uns.ac.id/page/38.html. 2008. Unsur Golongan IV B. Diakses pada tanggal 11 Februari 2012. Pada pukul 10.23 WIB.
Atwirman, S. 2000. Penelitian Potensi Oksida Logam Fe2O3 dan CuO Untuk Peningkatan Kecepatan Pembakaran Propelan Komposit. Jurnal Penelitian di Bidang Propelan. Jakarta. LAPAN. Page. 45-51.
Beiser, A. 1982. Konsep Fisika Modern Edisi 3. Jakarta. Erlangga. Hal. 39-71. Brinker, C. J. and Scherer, G.W. 1990. Sol Gel Science: The Physics and
Chemistry of Sol Gel Processing. Academic Press. Inc. San Diego. CA. Page. 108, 339-380.
Connoly, J.R. 2007. Introduction to X-Ray Diffraction, for EPS400-001. Spring Company. Inc. p:3-86.
Cullity, B.D. 1978. Elements of X-Ray Diffraction. Addison-Wesley Publishing Company, Inc. New Jersey, USA. Page. 84, 102.
Dongare, M.K., Ramaswamy, V., Gopinath, C.S., Ramaswamy, A.V. and Schevrell, S. 2001. Oxidation Activity and 18O-isotop Exchange Behavior of Cu-Stabilized Cubic Zirconia. Journal of Catalysis. Vol. 199. Page. 209-216.
Ekimav, A.I., Effros, A.I.L. and Anuchenko, A.A. 1985. Quantum Size Effect in Semiconductor Microcrystal. Solid State Communication. Vol. 5611. Page. 921-1524.
Esposito, S., Turco, M., Bagnasco, G., Cammarano, C. and Pernice, P. 2011. New Insight Into The Preparation of Copper/Zirconia Catalysts By Sol-Gel Method. Science Direct. Vol. 403. Page. 128-135.
Fernandes, B.R. 2011. Makalah Sintesis Nanopartikel. Padang. Program Studi Kimia Pascasarjana Univ. Andalas.
Ferragina, C., Di Rocco, R., Petrilli, L. 2004. Zinc Ions and Zinc Sulfide Particles in Sol–Gel Zirconium Phosphate Synthesis, Thermal Behavior and X-ray Characterization. Thermochimica Acta. Vol. 49. Page. 177.
Flemings, M.C. and Chan, R.W. 2000. Organization and Trends in Mater. Acta Mater 48 Scie and Eng. Education in USA and Europe. Page. 371-383. German, R.M. 1985. Liquid Phase Sintering. New York. Plenum.
Goldstein, J., Newbury, D.E., Joy, D.C., Lyman, C.E., Echlin, P., Lifhshin, E., Sawyer, L. and Michael, J.R. 1981. Scanning Electron Microscopy and X-Ray Microanalysis, A textbook for Biologist. New York. Material Scientist and Biologist.
Haissinky, M. and Adloff, J.P. 1965. Radiochemical Survey of the Elements. Apllied Catalysis B:Environmental. Vol. 12. Page. 3017-315.
Hidayat, C., Supriyadi dan Prabondari. 2009. Pengembangan Zirkonia Agarosa Sebagai Matrik untuk Biokatalis pada Amobilisasi Lipase Candida Rugosa. Agritech Vol. 29 No. 3. Page. 159-166.
Hunter, B.A. 1997. Rietica for 85/98/Nt Vresion 1. 62. Australia.
Illisz, I., Dombi, A., Mogyorosi, K., Farkas, A. and Pekwny, I. 2002. Removal of 2-chlorophenol from Waterby Adsorption Combines with Photocatalysis. Applied Catalysis B. Vol. 39. Page. 247-256.
Kisi, E.H. 1994. Rietveld Analysis of Powder Diffraction Pattern. Material Forum. 18:135-153.
Lubis, N.Y. 2013. Skripsi Sintesis dan Karakterisasi Komposit ZrO2-CuO Dengan Metode Sol Gel Sebagai Fungsi Waktu. Bandar Lampung. Fisika FMIPA Universitas Lampung. Page 1-55.
Lutsman, B. and Kerze, F. Jr. 1995. The Metalurgy Zirconium. New York. Mc Graw Hill Book Company, Inc. Page. 1-216.
Lopez, T., Alvarez, M., Tzompantzi, F. and Picquart, M. 2006. Photocatalytic Degradation of 2,4-dichlorophenoxiacetic acid and 2,4,6-trichlorophenol with ZrO2 and Mn/ ZrO2 Sol-Gel Materials. J Sol Gel Sci Techn. Vol. 37. Page. 207-211.
Mahreni. 2010. Sintesis Membran Nanokomposit Nafion-SiO2 Menggunakan Metode Sol-Gel. Jurnal Sains Materi Indonesia. Vol. II. No. 2 Page. 129-133.
Masduki, B., Legowo, S., Suardi, N., Kardana., Al’Amin., Linda, S., Edy dan Asep. 1994. Pemurnian dan Pembuatan Logam Zirkonium. Pusat Dokumentasi dan Informasi Ilmiah. Lembaga Ilmu Pengetahuan Indonesia.
Mc. Murdie, H.F., Morris, M.C., Evans, E.H., Paretzkin, B., Wong-NG, W. and Hubbard, C.R. 1986. Methods of Producing Standards X-Ray Diffraction Powder Patterns. Powder Diffraction. Vol 1. Page. 265-275. Ohya, Y., Syuoka, I., Takayuki, B and Yasutaka, T. 2000. Preparation of CuO
Thin Film and Their Electrical Conductivity. CSJ Series Publication of The Ceramic Society of Japan. Page.113-116.
Ozawa, T.C and Kang, S.J. 2004. Balls and Sticks : Easy-to-Use Structure Visualisasi and Animation Creating Program. J Appl. Cryst. Vol. 37. Page. 679.
Purnama, H., Girgsdies, F., Ressler, T., Schattka, J.H., Carusso, R.A., Schomacker, R. and Schlogl, R. 2004. Activity and Selectivity of a Nanostructured CuO-ZrO2 Catalyst in The Steam Reforming of Methanol. Catalyst Letters. Vol. 94. Page. 61-68.
Ramaswamy, V., Bhagwat, M., Srinivas, D and Ramaswamy, A.V. 2004. Structural and Spectral Features of Nano-Crystalline Copper-Stabilized Zirconia. Catalysis Today. Vol. 97. Page. 63-70.
Ritzkopf, I., Vukojevic, S., Weidenthaler, C., Grunwaldt, J.D. and Schuth, F. 2006. Decreased CO Production in Methanol Steam Reforming Over Cu/ZrO2 Catalysts Prepared by The Microemulsion Technique. Apllied Catalysis A : General. Vol. 302. Page. 215-223.
Roziqin, M.M dan Tri Wahyuni, I. Perilaku Material Amorf Gelas Metalik Biner dan Tersier Berbasis Zirkonium terhadap Laju Korosi. Journal PKM. Surabaya. Fisika MIPA Universitas Airlangga. Page. 1-9.
Sajima., Nuraini, E. dan Handayani, A. 2006. Pembuatan ZrO2 dengan Pengendapan Larutan Stripping Secara Catu dari Berbagai Keasaman dan Volume. Seminar Nasional II SDM Teknologi Nuklir Sekolah Tinggi Teknologi Nuklir. BATAN. Yogyakarta. Page. 69-75.
Schumck, J. 1992. The Properties of Zirconium and Its Alloys for Chemichal Engineering Apllications. Ugine, France. Cezus. Centre de Recherches. Sholikhati dan Prayitno. 2009. Penentuan Kecepatan Adsorpsi Boron Dalam
Larutan Zirkonium dengan Zeolit. Seminar Nasional V SDM Teknologi Nuklir Yogyakarta. STTN. BATAN. Page. 639-646.
Simatupang, R.A. 2005. Pengaruh Aditif CaO dan Suhu Sintering Terhadap Mikrostruktur Keramik PSZ (Partially Stabillized Zirconia). Jurnal Sistem Teknik Industri Vol. 6. Fisika FMIPA USU. Page. 19-24.
Simbolon, S., Masduki., Busron dan Aryadi. 2000. Penentuan Unsur-Unsur Tak Murnian di dalam Zirkonium Oksida dengan Metode Spektrografi Emisi. Prosiding Presentasi Ilmiah Daur Bahan Bakar Nuklir V P2TBDU dan P2BGDN-BATAN. Jakarta. Page. 639-646.
Smith, D. K and Newkirk, H.K. 1965. Crystal Structure of Baddeleyite (Monoclinic ZrO2) and it’s Relation to The Polymorphism of ZrO2. Acta Crystallography. Vol. 18. Page. 982.
Swanson, H.E., and Tatge, E. 1953. Standard X-Ray Diffraction Powder Pattern. Washington D.C. United States Department of Commerce. National Bureau of Standards Circular. Vol. 539. Page. 1-10.
Syamsuddin, Y. dan Husin, H. 2008. Hidrogenasi CO2 Menjadi Metanol dengan Menggunakan Katalis Zeolit Alam, Zeolit Sintesa ZSM-5 dan Katalis Sintesa Cu/ZnO/Al2O3. Jurnal Purifikasi. Vol. 9. No. 1. Teknik Kimia, Fakultas Teknik, Universitas Syiah Kuala. Banda Aceh.
Tanabe, M., Hokim, J. and Nivea. 1997. Characterization and Catalytic Activity of The Al-MCM-41 Prepare by Methode of Gel Equalibrium Adjustment. Microporous Material Vol. 10. Page. 85-93.
Triwikantoro dan Sukendar, S. 2007. Nanokristalisasi Material Amorf Zr69,5 Cu12 Ni11Al7,5 antara Temperatur Transisi Gelas (Tg) dan Temperatur Kristalisasi (Tx). Jurnal Fisika dan Aplikasinya. Vol. 3. No. 1. Jurusan Fisika FMIPA ITS. Page.1-4.
Tunell, E.G., Posnjak, C.J. and Ksanda, Z. 1935. Kristallography. Vol. 90. Page. 120.
Tunell, E.G., Ponsjak, C.J. and Ksanda, Z. 1935. Identification of The Copper Ore Minerals by Means of X-Rays Powder Diffraction Pattern. Zeit Krist. Vol.90. Page.138-139.
Vahidshad, Y., Abdizadeh, H., Baharvandi, H.R. and Baseri, M.A. 2008. Effects of Calcinations Temperature on The Structure of CuO-ZrO2 Nanoparticles. International Journal of Modern Physics B. World Scientific Publishing Company. Vol. 22. Page. 3201-3209.
Vahidshad, Y., Abdizadeh, H., Baharvandi, H.R. and Baseri, M. Akbari. 2009. Structural and Morphology of Nanopowders Copper-Stabilized Zirconia. Surface Review and Letters. Vol. 16. Page. 569-577.
Vahidshad, Y and Abdizadeh, H. 2011. Influence of Taguchi Selected Parameters on Properties of CuO-ZrO2 Nanoparticles Produced via Sol-Gel Method. World Academy of Science, Engineering and Technology. Vol. 50. Page. 305-313.
Vahidshad, Y., Abdizadeh, H. and Asadi, S. 2012. Effect of Crystalline Size on The Structure of Copper Doped Zirconia Nanoparticles Synthesized via Sol-Gel. Journal of Nanostructures. Vol. 2. Page. 205-212.
Veda, R., Mahesh, B., Srinivas, D., and Ramaswamy, A.V. 2004. Structural and Spectral Features of Nano-Crystalline Copper-Stabilized Zirconia. Catalysis Today. Vol. 97. Page. 63-70.
Vlack, V.L.H. 1989. Ilmu dan Teknologi Bahan (Ilmu Logam dan Bukan Logam). Edisi kelima. Jakarta. Erlangga. Hal.101-104.
Wang, D.-N., Guo, Y.-Q., Liang, K.-M., and Tao, K. 1999. A: Math. Phys., Astron. Sci. China, Ser. Vol. 42 Page. 80.
Wang, Y. and Caruso, R.A. 2002. Preparation And Characterization Of Cuo-ZrO2 Nanopowders. J. Mater. Chem. Vol. 12. Page. 1442-1445.
Widodo, S. 2010. Teknologi Sol-Gel Pada Pembuatan Nano Kristalin Metal Oksida Untuk Aplikasi Sensor Gas. Seminar Rekayasa Kimia dan Proses. Semarang. Jurusan Teknik Kimia. Universitas Diponegoro. Page. 1-8.
Wismadi, T. 2001. Pembuatan dan Karakterisasi Lapisan Tipis Copper Oxide (CuO) Sebagai Sensor Gas. Bogor. Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor. Page. 1-22.
William, C. 1991. Firing of Sintering (Densification) of Ceramics, Engineered Material Handbook. Vol. 4. New York. ASM International Publisher. Yandi-sage-blogspot.com/2009/07/html. 2009. Keramik Teknik. Diakses pada
tanggal 11 Februari. Pada tanggal 11.00 WIB.
Under Simulated Sunlight Irradiation. Journal of Central South University of Technology. Vol. 18. Page. 56-62.