Prosiding Kimia FMIPA
SK-091304 Pengaruh Suhu pada Lipase dari Bakteri Bacillus subtilis
Rena Yuneta*, Prof. Dr. Surya Rosa Putra, M.S1
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Abstrak
Bacillus subtilis telah lama dikenal sebagai bakteri penghasil enzim. Berdasarkan pengaruh suhu habitatnya, bakteri ini
bersifat fakultatif termofilik. Sifat ini mempengaruhi juga terhadap enzim yang dihasilkan dimana salah satunya adalah enzim lipase. Penelitian ini memfokuskan pada pengaruh suhu terhadap lipase yang dihasilkan Bacillus subtilis dengan menggunakan substrat minyak zaitun. Aktivitas lipase diuji dengan metode dari Kwon menggunakan spektrofotometer dan metode Bradford digunakan untuk menguji kandungan proteinnya. Kandungan protein yang diperoleh sebesar 4,002 mg protein tiap 1 mg sel kering. Aktivitas spesifik lipase tertinggi adalah 0,120 U/mg pada suhu 45oC.
Kata kunci : fakultatif termofilik, metode Bradford, lipase
Abstract
Bacillus subtilis have been known as enzyme producing bacteria. Based on temperature effect of its habitat, Bacillus subtilis
cathegorized as facultative thermophilic bacteria. This characteristic influenced for its enzyme which lipase is one of them. This research was focused on temperature effect of lipase from Bacillus subtilis with olive oil as a substrate. Lipase activity was evaluated by Kwon method with spectrophotometer and Bradford method used for evaluating protein content. Protein content was 4,002 mg each mg of dry cell weight. The highest lipase specific activity was 0,120 U/mg at 45oC.
Keywords: facultative thermophilic, Bradford method, lipase
1. Pendahuluan
Dewasa ini industri enzim telah berkembang pesat dan menempati posisi penting dalam bidang industri. Kesadaran masyarakat terhadap masalah lingkungan yang semakin tinggi serta adanya tekanan dari para ahli dan pecinta lingkungan menjadikan teknologi enzim sebagai salah satu alternatif untuk menggantikan berbagai proses kimiawi dalam bidang industri (Falch, 1991). Enzim merupakan katalisator pilihan yang diharapkan dapat mengurangi dampak pencemaran dan pemborosan energi karena reaksinya tidak membutuhkan energi tinggi, bersifat spesifik, dan tidak beracun (Aunstrup, 1979).
Produksi enzim untuk jumlah besar dan mempunyai aktivitas yang tinggi perlu diperhatikan faktor-faktor penting seperti kondisi pertumbuhan, cara isolasi, serta jenis substrat yang digunakan. Kondisi pertumbuhan yang menunjang produksi enzim secara maksimal adalah pH, suhu inkubasi, waktu inkubasi, dan komposisi media pertumbuhan harus mengandung sumber energi, sumber karbon, sumber nitrogen dan mineral (Wang, 1979).
Penggunaan enzim dalam bioteknologi modern semakin berkembang secara cepat. Banyak industri-industri yang telah memanfaatkan kerja enzim, meliputi industri pangan dan non pangan. Salah satu jenis enzim yang mempunyai peran penting dan tidak ada bandingan dalam pertumbuhan bioteknologi adalah enzim lipase (Sumarsih, 2004). Enzim lipase sangat
berperan dalam pemisahan asam lemak dan pelarutan noda minyak pada alat industri agar minyak dapat dilarutkan dalam air (Dosanjh, 2002).
Lipase yang berasal dari mikroorganisme termofilik (dapat tumbuh pada suhu 45oC-70oC) memainkan peran yang penting dalam proses industri karena sifatnya yang stabil, sangat cocok dengan kondisi proses di industri yang membutuhkan kondisi khusus, seperti suhu tinggi, tahan terhadap denaturasi dan proteolisis. Bacillus substilis menunjukkan sifat ini, karena memiliki T maks 45-55°C (Friedman, 1992). Penggunaan suhu tinggi dalam proses industri akan meningkatkan kecepatan reaksi sehingga mengurangi jumlah enzim yang dibutuhkan. Kemungkinan adanya kontaminasi mikrobial oleh mikroba mesofilik yang mengganggu dapat dikurangi, kelarutan substrat dan senyawa-senyawa kimia lainnya meningkat (Haki, 2003).
Pada penelitian ini dilakukan isolasi lipase yang berasal dari salah satu bakteri termofilik yaitu Bacillus
subtilis. Produksi lipase menggunakan minyak zaitun
sebagai substrat. Lipase yang diperoleh diuji kandungan protein dan aktivitasnya, dimana sebelumnya dilakukan liofilisasi terhadap ekstrak kasarnya. Optimasi lipase dilakukan terhadap faktor suhu inkubasi dimana dilakukan uji aktivitas lipase pada variasi suhu tertentu.
2. Metode Penelitian 2.1 Alat dan Bahan 2.1.1 Alat
Alat - alat yang digunakan dalam penelitian ini adalah erlenmeyer, tabung reaksi, gelas kimia, gelas ukur, corong, pipet tetes, mikropipet, kuvet, botol semprot, jarum ose, labu ukur, pengaduk, inkubator, Prosiding Skripsi Semester Genap 2009/2010
* Corresponding author Phone : +6285649421521, e-mail: rheyna@chem.its.ac.id
Alamat sekarang : Jurusan Kimia, Fakultas MIPA, Institut Teknologi Sepuluh Nopember, Surabaya.
Prosiding Kimia FMIPA
laminary flow Hotpack 524042, inkubator bergoyang Gerhardt Thermoshake, Sentrifuga Beckman TJ-6, spektrofotometer spektronik Genesys 20, neraca analitik Mettler AE 200, autoclave Tomy ES-315, freeze dryer Sneijders 2040, dan pH meter 510.
2.1.2 Bahan
Bahan – bahan yang digunakan dalam penelitian ini adalah bakteri Bacillus subtilis, agar nutrisi, cairan nutrisi, KH2PO4, MgSO4.7H2O, minyak zaitun,
aquades, gum arab, NaOH, buffer fosfat, HCl, heksana, asam oleat, reagen tembaga (II) asetat, reagen Bradford, Bovine Serum Albumine (BSA), aluminium foil, kasa, kapas steril dan isolasi.
2.2 Prosedur Kerja 2.2.1 Pembuatan Media
Media padat yang digunakan adalah agar nutrisi dengan takaran 40 g/L. Larutan dimasukkan dalam gelas kimia dan dipanaskan hingga larut. Larutan ditutup dengan aluminium foil lalu disterilisasi selama 15 menit pada 121oC. Larutan steril dituangkan ke dalam tabung reaksi yang telah disterilkan terlebih dahulu dan ditutup dengan kapas berlemak. Media dalam tabung reaksi kemudian dimiringkan untuk mendapatkan agar miring dalam inkubator selama 24 jam.
Media cair dibuat dengan komposisi sebagai berikut: cairan nutrisi 15 g/L, KH2PO4 1 g/L,
MgSO4.7H2O 0,5 g/L dilarutkan dengan aquades dalam
volume 10 mL dan 100 mL serta media produksi dibuat dari media cair yang sama namun dengan penambahan minyak zaitun 10% dan gum arab 5% kemudian dilarutkan dengan aquades dalam volume 20 mL dan 1L. pH diatur hingga 7 dengan penambahan NaOH dan diukur menggunakan pH-meter. Semua bahan disterilisasi pada suhu 121oC selama 15 menit. Media yang telah dibuat disimpan dalam erlenmeyer yang ditutup kapas berlemak yang sudah steril kemudian disimpan dalam refrigerator.
2.2.2 Uji Sterilisasi Bacillus subtilis
Bacillus subtilis diperoleh dari Laboratorium
Mikrobiologi Unair Surabaya. Uji sterilisasi dilakukan dengan menambahkan 1 ose Bacillus subtilis dari media padat ke dalam 10 mL media cair. Biakan diinkubasi pada suhu 45oC selama 3 jam. Sebanyak 100 μL bakteri dari media cair ini diteteskan pada kaca preparat dan dilihat di bawah mikroskop dengan perbesaran 100x. Selanjutnya biakan yang tumbuh diamati morfologinya.
2.2.3 Regenerasi Bacillus subtilis
Biakan murni Bacillus subtilis diremajakan pada agar miring yang telah disterilisasi pada suhu 121oC
dan tekanan 1 atm selama 15 menit, selanjutnya biakan diinkubasi pada suhu 30oC selama 24 jam. Bacillus
subtilis pada agar miring ini menjadi stok kultur yang
diregenerasi pada media agar miring yang baru sebelum digunakan.
2.2.4 Penentuan Kurva Pertumbuhan Bacillus subtilis
Bacillus subtilis dari media agar miring diambil
sebanyak 2 ose dan dimasukkan dalam 20 mL media cair. Selanjutnya campuran diinkubasi selama 3 jam dengan inkubator bergoyang pada 120 rpm dan suhu
45oC. Biakan ini selanjutnya dipindahkan ke dalam 80 mL media cair lain dan diinkubasi dengan inkubator bergoyang pada 120 rpm dan 45oC. Kekeruhan biomassa diukur menggunakan metoda turbidimetri dengan Spektrofotometer pada panjang gelombang 600 nm setiap 1 jam sekali selama 20 jam.
2.2.5 Produksi dan Isolasi Lipase
Produksi enzim lipase dilakukan dengan cara yaitu 2 ose biakan media padat dimasukkan ke dalam 20 mL media produksi. Selanjutnya campuran diinkubasi pada inkubator bergoyang selama 8 jam pada suhu 45oC. Biakan ini selanjutnya diinokulasi kembali pada 1L media produksi dan diinkubasi pada inkubator bergoyang selama 8 jam pada 120rpm, 45oC. Setelah itu campuran disentrifugasi dan diambil supernatan sebagai ekstrak kasar lipase. Ekstrak kasar yang didapat diukur volumenya kemudian diliofilisasi hingga mengalami pemekatan ± 10 kali.
2.2.6 Penentuan Kandungan Protein Lipase 2.2.6.1Penentuan Panjang Gelombang Maksimum
Bradford
Penentuan panjang gelombang maksimum (λmaks)
dilakukan dengan menggunakan larutan standar Bovine Serum Albumine (BSA) dan ditambah dengan reagen Bradford kemudian ditentukan absorbansinya menggunakan spektrofotometer. Dalam penelitian ini digunakan larutan stok BSA 2 mg/mL. Larutan stok BSA kemudian diambil sebanyak 7 mL dan ditambahkan reagen Bradford sebanyak 3 mL. Larutan diaduk dan diinkubasi selama 5 menit pada suhu 30°C. Larutan standar BSA diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 560-620 nm dengan interval 5 nm sebanyak tiga kali untuk masing-masing panjang gelombang, sehingga diperoleh λmaks yang digunakan untuk
pengukuran selanjutnya. Kurva dibuat antara panjang gelombang (λ) sebagai sumbu x terhadap absorbansi (A) sebagai sumbu y.
2.2.6.2 Pembuatan Kurva Standar BSA
Kurva standar BSA dibuat dengan menggunakan larutan BSA. Konsentrasi yang dibutuhkan adalah antara 0,1 mg/mL, 0,3 mg/mL, 0,5 mg/mL, 0,7 mg/mL, 0,9 mg/mL, 1,1 mg/mL, 1,3 mg/mL, dan 1,5 mg/mL. Variasi konsentrasi larutan tersebut dibuat dengan menggunakan larutan standar BSA 2 mg/mL, larutan tersebut diambil sebanyak 0,5; 1,5; 2,5; 3,5; 4,5; 5,5; 6,5; 7,5 mL lalu diencerkan dengan aquades sampai 10 mL. Selanjutnya, larutan yang telah diencerkan diambil sebanyak 7 mL dan ditambahkan reagen Bradford sebanyak 3 mL. Sebelum dilakukan pengukuran absorbansi, larutan BSA yang telah ditambah dengan reagen Bradford tersebut terlebih dahulu diinkubasi selama 5 menit pada suhu ruang. Pengukuran absorbansi dilakukan dengan menggunakan spektrofotometer pada panjang gelombang maksimum yang telah ditentukan sebelumnya. Blanko yang digunakan adalah aquades sebanyak 7 mL yang ditambah dengan reagen Bradford sebanyak 3 mL.
2.2.6.3 Penentuan Kandungan Protein
Penentuan kandungan protein pada enzim lipase dilakukan dengan metode Bradford (1976). Sampel diambil 7 mL dan ditambahkan reagen Bradford sebanyak 3 mL, lalu campuran diinkubasi selama 5
Prosiding Kimia FMIPA
menit. Campuran tersebut diukur absorbansinya pada panjang gelombang maksimum sebanyak dua kali. Hasil absorbansi yang diperoleh dikonversikan pada persamaan garis dari kurva standar BSA yang telah dibuat sehingga diperoleh konsentrasi enzim lipase.
2.2.7 Uji Aktivitas Lipase
2.2.7.1 Pembuatan Kurva Standar Asam Oleat
Kurva standar asam oleat dibuat dengan beberapa variasi konsentrasi asam oleat. Konsentrasi yang dibutuhkan adalah antara 3,5; 7; 10,5; 14 dan 17,5 (x 10-4 M). Variasi konsentrasi larutan tersebut dibuat dengan menggunakan larutan standar asam oleat 0,007 M, larutan tersebut diambil sebanyak 0,5; 1; 1,5; 2; 2,5 mL lalu diencerkan dengan heksana sampai 10 mL. Selanjutnya campuran diambil 4 mL dan ditambahkan reagen tembaga (II) asetat sebanyak 1 mL lalu diaduk 1 menit Pengukuran absorbansi dilakukan dengan menggunakan spektrofotometer pada panjang gelombang 715 nm.
2.2.7.2 Penentuan Aktivitas Lipase
Penentuan aktivitas lipase dilakukan dengan menggunakan metode Kwon dan Rhee (Kwon, 1986). Substrat yang digunakan dalam metode ini adalah minyak zaitun. Minyak zaitun sebanyak 1,5 mL, ditambahkan dengan 1 mL buffer fosfat pH 7 dan 1 mL larutan enzim. Campuran ini selanjutnya diinkubasi pada inkubator bergoyang 120 rpm selama 30 menit. Selanjutnya campuran ditambahkan larutan 1 mL HCl 6N dan 5 mL heksana. Campuran selanjutnya dikocok kuat dan lapisan atas diambil sebanyak 4 mL, kemudian ditambahkan 1 mL reagen tembaga (II) asetat dan diaduk 1 menit. Campuran diukur dengan spektrofotometer pada panjang gelombang 715 nm.
Aktivitas lipase diukur pada suhu inkubasi yang bervariasi yaitu 30o, 35o, 40o, 45o, dan 50oC. Masing-masing variasi diperlakukan sama seperti penentuan aktivitas yang sebelumnya.
3. Hasil dan Diskusi
3.1 Uji Sterilisasi Bacillus subtilis
Uji sterilisasi dilakukan dengan tujuan untuk mengetahui apakah bakteri tersebut hanya terdiri dari spesies Bacillus subtilis atau tidak. Uji ini hanya dilakukan dengan mengamati bentuk morfologi bakteri, dimana Bacillus subtilis berbentuk basil atau batang (Noirot, 2007).
Gambar 4.1 Morfologi Bacillus subtilis perbesaran 100x
Morfologi yang diperoleh dari biakan yang difoto mikroskopik dengan perbesaran 100x seperti yang terlihat pada gambar 4.1 hanya menunjukkan morfologi suatu bakteri yang berbentuk batang. Dengan demikian maka biakan yang ada bersifat steril dan hanya terdiri atas bakteri Bacillus subtilis.
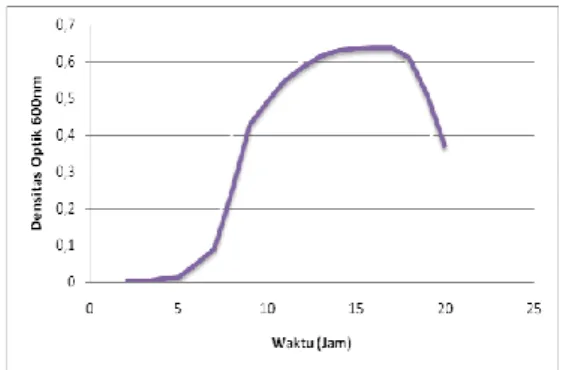
3.2 Kurva Pertumbuhan Bacillus subtilis
Saat Bacillus subtilis dipindahkan dalam media cair, mula – mula akan mengalami fasa adaptasi atau fasa lag untuk menyesuaikan dengan substrat dan lingkungannya. Jumlah sel pada fasa ini relatif tetap. Lamanya fasa ini tergantung pada kecepatan penyesuaian dengan lingkungan (Hendrianie,2001). Berdasarkan kurva pertumbuhan Bacillus subtilis mengalami fasa adaptasi selama ±4 jam (Gambar 4.2). Waktu tersebut tergolong singkat dikarenakan Bacillus
subtilis telah diinkubasi dalam media yang sama
sebelumnya untuk menghomologkan umur, sehingga tidak perlu waktu yang lama untuk beradaptasi lagi.
Gambar 4.2 Kurva pertumbuhan Bacillus subtilis Fasa selanjutnya adalah fasa log. Karena pembelahan sel merupakan persamaan eksponensial maka fasa ini disebut juga fasa eksponensial. Pada fasa ini perbanyakan jumlah sel meningkat sampai pada batas tertentu. Pada fasa ini terjadi sel membutuhkan energi lebih banyak dibandingkan fasa lainnya, selain itu sel menjadi sangat sensitif terhadap lingkungannya. Kurva pertumbuhan menunjukkan bahwa fase log bakteri terjadi pada jam ke-5 hingga jam ke-13. Oleh karena itu, isolasi lipase dilakukan pada pertengahan fase log yaitu pada saat jam ke-8.
Pertumbuhan kemudian menjadi diperlambat, hal ini dikarenakan zat nutrisi dalam media sudah sangat berkurang. Pertumbuhan terus diperlambat sampai pada batas tertentu. Selanjutnya Bacillus subtilis mengalami fasa stasioner, yaitu keadaan sel yang membelah sama dengan sel yang mati. Pada fasa ini sel menjadi tahan pada kondisi ekstrim seperti panas, dingin, radiasi dan bahan kimia (Hendrianie,2001).
Setelah fasa stasioner berakhir profil pertumbuhan bakteri memasuki fasa kematian (death). Pada fasa ini jumlah sel yang mati lebih banyak sehingga mengalami penurunan jumlah sel secara eksponensial, hal ini dikarenakan telah habisnya nutrisi. Pada metoda turbidimetri ini yang terukur hanya kekeruhannya, sedangkan jumlah bakteri sebenarnya tidak dapat ditentukan.
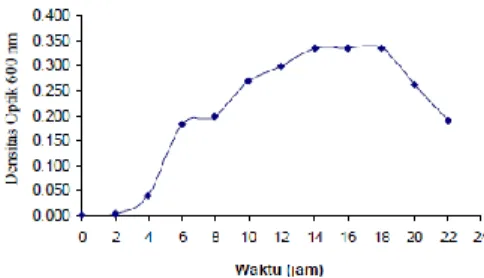
Penelitian terhadap bakteri yang sama yang telah dilakukan oleh Ardiansyah dkk (Ardiansyah, 2009) menunjukkan Bacillus subtilis dengan fase lognya dimulai pada jam keempat hingga jam keempat belas, seperti yang terlihat pada gambar 4.3.
Prosiding Kimia FMIPA
Gambar 4.3 Kurva Pertumbuhan Bacillus subtilis (Ardiansyah, 2009).
Data densitas optik dari kedua kurva menunjukkan perbedaan dimana pada penelitian Ardiansyah densitas optiknya berada pada rentang 0-0,4 sedangkan pada penelitian ini memiliki rentang densitas optik yang lebih tinggi yaitu 0-0,7. Perbedaan ini dikarenakan pada penelitian Ardiansyah suhu inkubasi pengukuran kurva pertumbuhan Bacillus
subtilis hanya 40oC, dimana suhunya lebih rendah dari penelitian ini, yaitu 45oC. Hal ini sesuai dengan
penelitian Friedman (1992) bahwa suhu optimum pertumbuhan Bacillus subtilis berada pada rentang 45-55oC.
3.3 Produksi dan Karakterisasi Lipase
Media produksi yang telah diinkubasi selama 8 jam selanjutnya disentrifugasi pada 8000 rpm. Supernatan yang diperoleh selanjutnya dipisahkan sebagai ekstrak kasar lipase. Ekstrak kasar yang diperoleh selanjutnya diliofilisasi hingga larutan enzim mengalami pemekatan ± 10 kali..
Karakterisasi lipase yang telah diproduksi dilakukan dengan metode Bradford untuk penentuan kandungan proteinnya, dan aktivitas lipase dilakukan secara spektrofotometri dengan metode Kwon dan Rhee. Larutan enzim pekat (yang telah diliofilisasi) dianalisa kandungan protein dan aktivitasnya seperti yang ditampilkan pada tabel 4.1.
Tabel 4.1 Karakterisasi Lipase
Setelah waktu inkubasi, absorbansi larutan enzim lipase bebas ditentukan pada panjang gelombang maksimum (λ maks = 595 nm). Pengukuran untuk larutan
enzim yang telah diliofilisasi dilakukan sebanyak dua kali dan didapatkan nilai absorbansi yaitu 0,419 dan 0,421 dengan nilai rata-rata 0,420.
Hasil absorbansi yang diperoleh dikonversikan pada persamaan garis dari kurva standar BSA yang telah dibuat sehingga diperoleh konsentrasi enzim lipase yang terukur sebesar 1,135 mg/mL. Untuk mengetahui konsentrasi sebenarnya maka konsentrasi terukur dikalikan dengan faktor kali 10/7 akibat penambahan reagen Bradford sehingga didapatkan konsentrasi enzim lipase sebenarnya adalah 1,621 mg/mL. Merujuk pada penelitian yang dilakukan oleh Mardhiah (2009), diperoleh sel kering sebesar
0,405 mg/mL setelah inkubasi selama 8 jam. Bila dibandingkan dengan kandungan protein maka dihasilkan 4,002 mg protein tiap 1 mg sel kering.
Kandungan protein yang diperoleh sebesar 1,621 mg/mL lebih kecil bila dibandingkan dengan kandungan protein yang diperoleh dari penelitian Nurhasanah (2008) sebesar 3,55 mg/mL. Perbedaan ini disebabkan karena mikroorganisme yang digunakan berbeda, selain itu waktu produksi yang berbeda juga menyebabkan terjadinya perbedaan jumlah enzim yang dihasilkan. Protein yang tinggi diduga menunjukkan enzim yang tinggi pula, namun enzim yang terbentuk belum dapat dipastikan merupakan lipase. Untuk mengetahui protein tersebut adalah lipase maka perlu diketahui aktivitasnya. Hubungan antara aktivitas lipase dan protein yang dihasilkan dinyatakan dengan aktivitas spesifik, semakin tinggi aktivitas spesifik suatu enzim maka semakin tinggi kemurnian enzim tersebut. Hal ini menunjukkan terjadinya pemisahan protein lain yang bukan enzim.
Penentuan aktivitas enzim lipase dilakukan dengan menggunakan metode Kwon dan Rhee (Kwon, 1986). Metode ini menggunakan minyak zaitun sebagai substrat. Blanko yang digunakan adalah larutan yang sama namun berbeda dalam urutan penambahannya. Hasil pengukuran aktivitas lipase ini selanjutnya dikalibrasikan dengan kurva standar asam oleat. Penggunaan asam oleat sebagai standar didasarkan pada komposisi asam lemak tertinggi dari minyak zaitun adalah asam oleat. Aktivitas enzim lipase dinyatakan dalam unit. Satu unit didefinisikan sebagai banyaknya mL enzim yang dibutuhkan untuk menghasilkan 1 μmol asam oleat tiap menit dengan minyak zaitun sebagai substrat.
Penentuan aktivitas lipase juga dilakukan dengan variasi suhu pada ekstrak pekat lipase untuk memperoleh suhu optimum. Variasi suhu dilakukan saat inkubasi enzim lipase. Suhu inkubasinya adalah 30oC, 35oC, 40oC, 45oC, dan 50oC.
Tabel 4.2 Aktivitas Lipase Pada Variasi Suhu
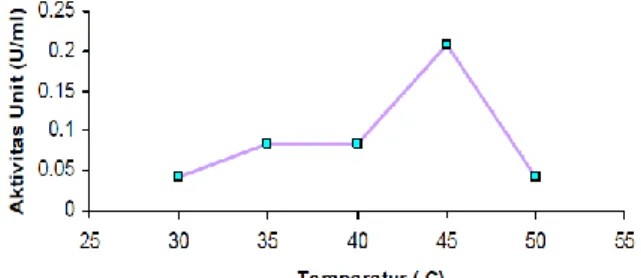
Hasil perhitungan yang ditampilkan pada tabel 4.2 menunjukkan bahwa aktivitas optimum enzim lipase yang dihasilkan dari Bacillus subtilis tercapai saat suhu inkubasi 45oC. Suhu optimum ini juga sesuai dengan penelitian yang dilakukan oleh Nurhasanah (Nurhasanah, 2008), dimana penelitian yang dilakukan adalah enzim lipase dari bakteri lokal yang diisolasi dari air laut Pelabuhan Panjang seperti yang ada pada gambar 4.4. Meskipun aktivitas optimum dicapai pada suhu yang sama, namun besarnya aktivitas optimum mengalami sedikit perberbedaan. Hal ini dikarenakan lipase pada penelitian Nurhasanah telah mengalami
Sel Kering (mg/mL) Kandungan Protein (mg/mL) Aktivitas Lipase Aktivitas (U/mL) Aktivitas Spesifik (U/mg) 0,405 1,621 0,195 0,120 Suhu Inkubasi Aktivitas Lipase Aktivitas (U/mL enzim) Aktivitas Spesifik (U/mg protein) 30oC 0,054 0,033 35oC 0,103 0,063 40oC 0,145 0,089 45oC 0,195 0,120 50oC 0,078 0,048
Prosiding Kimia FMIPA
pengendapan dengan amonium sulfat sehingga aktivitasnya lebih besar. Perbedaan lain dikarenakan sumber mikroorganisme penghasil lipase yang berbeda pula.
Gambar 4.4 Variasi suhu pada aktivitas lipase (Nurhasanah, 2008)
Pada penentuan suhu optimum, suhu yang digunakan adalah 30°C, 35°C, 40°C, 45°C, dan 50°C. Dari hasil pengujian yang dilakukan suhu optimum lipase adalah 45°C seperti yang tertera pada Gambar 2. Pada suhu kurang dari 45°C enzim cukup stabil, tetapi hidrolisis substrat minyak zaitun oleh enzim tidak berjalan secara maksimal.
Dengan meningkatnya suhu, energi kinetik molekul-molekul yang bereaksi bertambah sehingga molekul yang bereaksi semakin banyak dan produk yang dihasilkan semakin besar. Diatas suhu optimum, aktivitas enzim menurun tajam hal ini terjadi karena enzim mengalami denaturasi protein yang dapat merubah konformasi struktur molekul sehingga enzim kehilangan sifat alamiahnya.
Gambar 4.7 Aktivitas lipase pada variasi suhu
4. Kesimpulan
Kesimpulan yang diperoleh berdasarkan hasil penelitian ini adalah bakteri Bacillus subtilis dapat menghasilkan lipase. Pada penentuan kurva pertumbuhan Bacillus subtilis diperoleh fase log dari jam ke-5 sampai jam ke-13. Oleh karena itu, isolasi lipase dilakukan pada pertengahan fase log, yaitu jam ke-8. Lipase yang diperoleh dipekatkan dengan liofilisasi dan diperoleh kandungan protein sebesar 4,002 mg protein tiap 1 mg sel kering. Penentuan aktivitas lipase dilakukan dengan melihat pengaruh suhu inkubasi, dimana suhu yang digunakan 30oC,
35oC, 40oC, 45oC, dan 50oC. Aktivitas spesifik tertinggi diperoleh sebesar 0,120 U/mg dan dicapai pada suhu inkubasi 45oC.
Ucapan terimakasih
1. Prof. Dr. Surya Rosa Putra, M.S atas dukungan, bimbingan dan motivasi yang diberikan
2. Ibu dan Ayahanda atas dukungannnya dan doanya
3. Semua pihak yang mendukung yang tidak dapat saya sebutkan satu persatu hingga terselesainya penelitian ini
Daftar Pustaka
Ardiansyah, Y.T., 2009, Isolasi dan Karakterisasi
Enzim Xilanase dari Bacillus subtilis pada Media Nutrien Broth dengan Penambahan Xilan Hasil Isolasi Jerami Padi, Jurusan
Kimia, Fakultas MIPA, Universitas Diponegoro Semarang
Aunstrup, K.O., Andressen, Falch, and Nielsen, (1979),
Production of Microbial Enzymes, Microbial Technology, Vol. 1, Academic Press Inc., New
York
Dosanjh,N.S., dan Kaur, (2002), Immobilization,
Stability and Esterification Studies of A Lipase From Bacillus sp., Journal Biotechnology and Applied Biochemistr, Vol.
36. Hlm 7-12. Punjab University. Chandigarh Falch, E.A., (1991), Industrial Enzymes
Developments in Production and Application, Biotech Adv, 9:643-658
Friedman, S. M., (1992), Thermophilic
Microorganism, Encyclo Microbiol, 4,
217-229
Haki, G.D., Rakshit, S.K., (2003), Developments in
Industrially Important Thermostable Enzymes, Bioresource Tech., 89, 17–34
Hendrianie, N., (2001), Mikrobiologi Industri, Teknik Kimia, FTI ITS, Surabaya
Kwon Y.D, Rhee J.S., (1986), A Simple and Rapid
Colorimetric Method for Determination of Free Fatty Acids for Lipase Assay, JAOCS,
63: 89-92
Noirot, P., (2007), Replication of the Bacillus subtilis
Chromosome, Bacillus: Cellular and Molecular Biology, Graumann P, ed., Caister Academic Press
Nurhasanah, (2008), Pemurnian Enzim Lipase dari
Bakteri Lokal dan Aplikasinya dalam Reaksi Esterifikasi, Prosiding Seminar Nasional Sains dan Teknologi-II, Universitas Lampung
Sumarsih, S., (2004), Uji Aktivitas Lipolitik
Beberapa Bakteri Hasil Isolasi dari Pelabuhan Tanjung Perak dan Produksi Lipase dari Strain Terpilih, JIPTUNAIR,
Surabaya
Wang, I.C., (1979), Fermentation and Enzymes