LAPORAN PRAKTIKUM BIOTEKNOLOGI PERIKANAN
Oleh Kelompok 1
Samaidi B0A012001
Fandhy Okka P. B0A012002 Dina Septalia L. B0A012003 Soefina Napitupulu B0A012004
Dena Voninda B0A012006
Christon Maruli B0A012035
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS BIOLOGI
PROGRAM STUDI D-III PENGELOLAAN SUMBERDAYA PERIKANAN DAN KELAUTAN
I. PENDAHULUAN 1.1 Latar Belakang
Poliploidisasi adalah suatu metode manipulasi kromosom untuk menghasilkan ikan dengan jumlah kromosom yang lebih banyak dari jumlah kromosom normal atau diploid (2n), yaitu triploid (3n), tetraploid (4n), pentaploid (5n) dan seterusnya (Purdom, 1983 dalam Kadi, 2007dalam Fitria,et al , 2013). Poliploidisasi secara alami umumnya banyak terjadi pada tumbuhan, sedangkan pada hewan poliploidi sangat jarang terjadi kecuali pada ikan dan katak (Kadi, 2007 dalam Fitria,et al , 2013).
Rottman et al. (1991) dalam Fitria,et al ,(2013) menyatakan bahwa poliploidisasi secara alami terjadi akibat pencemaran perairan, radisasi sinar ultraviolet ataupun akibat pengaruh hormon berlebihan, sehingga menyebabkan kasus nondisjungsi pada kromosom. Nondisjungsi adalah kondisi dimana pasangan kromosom yang homolog tidak bergerak memisahkan diri sebagaimana mestinya pada waktu fase pembelahan meiosis I atau dimana sister chromatid gagal berpisah selama fase meiosis II (Campbell et al., 2000 dalam Fitria,et al , 2013).
Thorgaard (1983) dalam Fitria,et al , (2013), menyatakan poliploidisasi secara buatan dapat dilakukan dengan memberi perlakuan kejut temperatur, pemberian bahan kimiamaupun pemberian tekanan hidrostatik sesaat setelah fertilisasi telur guna mencegah peloncatan polar body II saat meiosis II (triploidisasi) ataupun pembelahan sel pertama (mitosis I) pada telur terfertilisasi (tetraploidisasi). Keunggulan poliploidisasi adalah dapat digunakan sebagai salah satu cara untuk memperbaiki dan meningkatkan kualitas genetik ikan guna menghasilkan benih-benih ikan yang mempunyai kemampuan pertumbuhan cepat, toleransi tinggi terhadap lingkungan dan resisten terhadap penyakit (Purdom, 1983 dalam Mukti et al., 2001 dalam Fitria,et al , 2013).
sistematik) makhluk, makin dekat persamaan jumlah kromosomnya. Namun tidak ada hubungan linear antara hubungan sistematik dengan banyaknya kromosom. Meski jumlah kromosom mungkin sama pada dua organisme yang berbeda spesies, tapi tentunya tidak mungkin sama bentuk kromosomnya (Yatim, 1972).
Perubahan jumlah kromosom menyediakan sumber tambahan keragaman genetik. Perubahan jumlah ini terjadi dengan penambahan atau pengurangan kromosom-kromosomnya, baik utuh atau satu set kromosom lengkap (genom). Perbedaan-perbedaan ini bisa dilihat dalam ragam fenotipnya (Crowder, 1993).
Poliploidisasi secara alami dapat disebabkan oleh faktor lingkungan seperti suhu, tekanan, ketinggian tempat dan sebagainya. Menurut Ayala, dkk (1984 dalam Corebima 2000) menyatakan bahwa poliploidisasi secara alami di alam ditemukan pada tumbuhan dan jarang ditemukan pada hewan. Hewan bertulang belakang (vertebrata) bereaksi negatif terhadap poliploidi. Poliploidi pada mamalia biasanya yang terjadi adalah berakhir dengan kematian pralahir. Organisme poliploid terbentuk melalui proses yang disebut induksi poliploidisasi. Pada umummnya hampir semua spesies pada setiap individunya mempunyai dua perangkat kromosom (diploid) dan sebagian ada yang mengalami perubahan jumlah perangkat kromosomnya.
1.2 Tujuan
Tujuan dari praktikum ini adalah
1. Melakukan poliploidisasi pada Ikan Nilem
2. Melakukan pengamatan keberhasilan fertilisasi Ikan Nilem
3. Melakukan pengamatan perkembangan embrionya telur Ikan Nilem 4. Melakukan pengamatan pertumbuhan Ikan Nilem
5. Membuat preparat apus darah dan mengukur ertitrosit pada Ikan Nilem
II. TINJAUAN PUSTAKA
proses atau kejadian yang menyebabkan individu berkromosom lebih dari satu set (Rieger et al., 1976). Poliploidisasi merupakan salah satu metode manipulasi kromosom untuk perbaikan dan peningkatan kualitas genetik ikan guna menghasilkan benih-benih ikan yang mempunyai keunggulan, antara lain: pertumbuhan cepat, toleransi terhadap lingkungan dan resisten terhadap penyakit.
Poliploidi adalah organisme yang mengalami perubahan jumlah perangkat kromosom menjadi lebih dari dua perangkat kromosom, sedangkan organisme yang mengalami perubahan perangkat kromosom menjadi satu perangkat kromosom saja disebut dengan monoploid atau haploid (Firdaus, 2002). Menurut Ayala dkk., (1984) dalam Firdaus (2002) organisme poliploidi adalah suatu organisme yang memiliki tiga atau lebih perangkat kromosom.
Polyploidi adalah organisme yang mempunyai lebih dari dua set kromosom atau genom dalam sel stomatisnya. Untuk organisme yang mempunyai jumlah kromosom dari kelipatan jumlah kromosom dasar (n) disebut haploid. Bila jumlah kromosom individu bukan merupakan kelipatan n disebut aneuploid, misalnya 2n+1 atau 2n-1. Jumlah yang lebih kecil daripada kelipatan n disebut hyperploid, sedang yang lebih besar disebut hypoploid ( Poespodarsono, 1998 ).
Allopoliploid terjadi karena persilangan antarspesies dengan genom yang berbeda tanpa diikuti reduksi jumlah sel dalam meiosis. Amfidiploid adalah allotetraploid yang perilaku pembelahan selnya serupa dengan diploid. Allopoliploidi segmental terjadi apabila sebagian kromosom berasal dari genom yang berbeda (tidak semuanya berasal dari set kromosom yang lengkap). Suatu spesies dapat bersifat diploid, meskipun dalam sejarah perkembangan evolusinya berasal dari poliploid. Spesies demikian dikenal sebagai paleopoliploid.
Manipulasi poliploidi dilakukan untuk mendapatkan jenis yang mempunyai lebihdari 2 set kromosom (2n), berdasarkan pertimbangan pemuliaan terhadap floradan fauna untuk memperbaiki mutu yang lebih baik dari jenis atau organismesebelumnya. Individu normal di alam pada umumnya memiliki 2 set kromosomyang biasa disebut diploid (2n). Individu diploid yang menghasilkan mutan gamethaploid (n), biasanya berumur pendek. Apabila telur dari organisme diploiddirangsang untuk menjalani embriogenesis tanpa fertilisasi oleh sperma, lebihdahulu akan menghasilkan individu haploid yang menyimpang (Adisoemarto, 1988).
Manipulasi poliploidi menghasilkan individu triploid,tetraploid dan ploid yanglebih tinggi. Poliploid ini dapat tumbuh lebih pesatdibandingkan individu diploid dan haploid. Individu triploid memiliki sifat sterildan individu tetraploid bersifat fertil (Sistina, 2000).
Poliploidi terbentuk dalam dua kelompok, yaitu : Kelompok pertama autopoliploidi yaitu penggandaan ploidi melalui penggabungan genom-genom yang sama. Ploid yang dihasilkan dari proses ini adalah aneuploid (kromosom abnormal) yakni dalam bentuk triploid, tetraploid dan pentaploid. Kelompok kedua alopoliploidi adalah penggandaan kromosom yang terjadi melalui pengga-bungan genom-genom yang berbeda. Manipulasi ini banyak dilakukan pada tanaman, dari dua jenis tanaman berbeda digabungkan, keduanya menghasilkan organisme alopoliploid dengan jumlah kromosom 2 x + 2 y (Jusup, 1988).
dewasa pada tahap organogenesis. Pertumbuhan menjadi sistem organ yang kompleks dan saling tergantung merupakan suatu hal yang terinci dalam sistem biologis yang semuanya akan termodifikasi secara sempurna (Harvey, 1979).
Perkembangan embrio pada Ikan Nilem (Osteochillus hassselti) betina dimulai setelah telur dibuahi oleh inti spermatozoon yang semua haploid, menjadi inti zigot yang diploid. Zigot inilah yang mempunyai kemampuan untuk melakukan pembelahan segmentasi melalui proses mitosis yang cepat. Zigot yang tersegmen-segmen menjadi bagian yang kecil (cleavage), bermula dari satu sel kemudian membelah menjadi 2 sel, 4 sel, 8 sel, 16 sel, hingga 32 sel yang disebut fase morula (Djuhanda,1981).
Apusan darah merupakan salah satu cara mengamati materi-materi yang ada dalam darah baik materi padat materi cairnya. Materi padat terdiri dari sel darah merah sel darah putih, keeping-keping darah. Setelah diamati menggunakan mikroskop tampak butiran-butiran dari eritrosit seperti gambar pada hasil pengamatan.
Pemeriksaan mikroskopik terhadap apusan darah yang diwarnai oleh giemsa merupakan metode pilihan untuk mengidentifikasi pasien dengan infeksi parasite darah, termasuk malaria, babesiosis, tripanosomiasis, dan filariasis. Pada keadaan- keadaan tertentu, pemeriksaan apusan yang diwarnai oleh giemsa dapat substitunsi. Harus disiapkan apusan tipis maupun tebal dari darah segar atau telah mendapatkan antikoagulan EDTA. Sebelum diwarnai, apusan tebal tidak difiksasi dan apusaan tipis difiksasi dengan metanol. Apusan tebal harus diwarnai dengan reagen giemsa, karena reagen pewarnaan wright mengandung suatu fiksatif alkohol yang mencegah lisis eritrosit (Sacher, 2002).
Alat yang digunakan dalam praktikum ini adalah objek glass, gunting, tisu, spuit, mikroskop, slide mikroskop berlekuk (cavity slide), saringan , mangkok inkubasi, stopwatch, piring kecil, water bath dan pipet.
Bahan yang digunakan dalam praktikum ini adalah Ikan Nilem (Osteochillus hassselti) matang gonad, ovaprim, larutan NaCl fisiologis, cairan metanol, pewarna gymza, alkohol 70 %.
3.2 Metode
A. Metode Kejut Panas
1. Induk Ikan Nilem yang matang gonad di induksi dengan menggunakan ovaprim 0,5 ml/ kg berat badan.
2. Ikan distripping untuk mendapatkan oosit dan milt.
3. Oosit dan spermatozoa di fertilisasi, bila ada kelebian milt dibilas dengan penyaringan.
4. Untuk kelompok kejut panas pada menit ke 1 , ke-3 atau ke-5 oosit diberi kejut panas40oC selama 90 detik dalam water bath dan diinkubasi, Pada kontrol setelah disaring oosit dimasukan kedalam mangkok inkubasi.
5. Pada menit ke-20 ambil sebagian oosit (10 butir) untuk mengamati keberhasilan fertilisasi.
Hitung FR = Σ Oosit terfertilisasi x 100% Σ Seluruh oosit
6. Pada menit ke-40 dan menit ke-60 diambil sebagian oosit untuk diamati perkembangan embrionya.
7. Keesokan pagi harinya diamati perkembangan embrionya ,dan pada sore hari di amati dan dihitung Σ embrio yang hidup.
Hitung HR = Σ Embrio menetas x 100% Σ oosit terfertilisasi
8. Morfologi ikan diamati dan dihitung proporsi larva yang abnormal. B. Metode Apus Darah
1. Ikan dipotong pada bagian pangkal ekor dengan gunting.
2. Gelas objek yang akan digunakan dibersihkan dengan alkohol 70% (untuk membuang lemak yang menempel) selanjutnya dikeringkan dalam suhu kamar.
4. Preparat darah didiamkan sampai kering pada suhu kamar, difiksasi dengan metanol absolut 5 menit dengan cara memasukan gelas objek ke dalam beker gelas yang telah diisi dengan metanol absolut sampai semua apusan darah terendam dalam metanol.
5. Preparat dikeringkan dalam suhu kamar. Setelah kering preparat diwarnai dengan larutan gimza selama 5 menit.
6. Preparat dicuci dengan air mengalir dan diibilas dengan air secara pelan – pelan dan dikeringkan dalam suhu kamar.
7. Amati dibawah mikroskop dan ukur diameternya dengan perbesaran 400 x.
IV. HASIL DAN PEMBAHASAN 4.1 Hasil
Volume milt = 0,5 ml dan 0,38 ml
Pengenceran I = 0,1 ml milt + 0,9 ml NaCl Fisiologis = 10 ml
Pengenceran II = 0,1 ml milt hasil pengenceran I + 0,9 ml NaCl Fisiologis = 10 ml
Tabel 4.1 Perkembangan Embrio pada perlakuan menit ke-1 Waktu Hasil pengamatan menggunakan mikroskop
ukuran 400 x Menit ke-20
- Pembelahan 2 sel ada 4 butir - Pembelahan 4 sel ada 2 butir - Yang belum membelah 4 butir
Menit ke-40
- Pembelahan 2 sel ada 2 butir - Pembelahan 4 sel ada 5 butir - Pembelahan 8 sel ada 1 butir - Pembelahan 16 sel ada 2 butir
Menit ke-60
- Pembelahan tidak sempurna ada 1 butir - Pembelahan 16 sel ada 1 butir
- Pembelahan 32 sel da 6 butir
Tabel 4.2 Perkembangan Embrio pada control perlakuan I
Waktu Hasil pengamatan menggunakan mikroskop ukuran400 x
Menit ke-20
- Pembelahan 2 sel ada 3 butir - Pembelahan 4 sel ada 6 butir
- Pembelahan 1 sel ada 1 butir - Rusak 1 butir
Menit ke-40
- Pembelahan 32 sel ada 1 butir
- Pembelahan tidak sempurna ada 2 butir - Pembelahan 8 sel ada 1 butir
- Pembelahan 16 sel ada 6 butir
Menit ke-60
- Pembelahan tidak sempurna ada 1 butir - Pembelahan 16 sel ada 1 butir
- Pembelahan 32 sel da 6 butir - Pembelahn 64 sel ada 2 butir Tabel 4.3 Perkembangan Embrio pada control perlakuan II
Waktu Hasil pengamatan menggunakan mikroskop ukuran400 x
Menit ke-20
- Pembelahan 2 sel ada 2butir - Pembelahan 1 sel ada 3 butir - Belum berkembang 5 butir
Menit ke-40
- Pembelahan 2 sel ada 1 butir
- Pembelahan tidak sempurna/ tidak normal ada 1 butir
- Pembelahan 8 sel ada 3 butir - Pembelahan 16 sel ada 5 butir
Menit ke-60
- Pembelahn 2 sel ada 1 butir - Pembelahan 1 sel ada 2 butir - Pembelahan 32 sel da 7 butir
Tabel 4.4 Hasil pengamatan larva ikan nilem perlakuan 1 menit No Hari Hasil Pengamatan
1 Hari ke-1 Telur belum menetas 2 Hari ke-2 4 ekor yang sudah menetas yang
lain belum menetas
3 Hari ke-3 30 ekor yang sudah menetas yang lain tidak menetas
6 Hari ke- 6 8 ekor yang hidup yang lain mati 7 Hari ke- 7 8 ekor yang hidup yang lain mati 8 Hari ke- 8 8 ekor yang hidup yang lain mati 9 Hari ke- 9 8 ekor yang hidup yang lain mati 10 Hari ke- 10 8 ekor yang hidup yang lain mati 11 Hari ke- 11 7 ekor yang hidup yang lain mati 12 Hari ke- 12 7 ekor yang hidup yang lain mati 13 Hari ke- 13 7 ekor yang hidup yang lain mati 14 Hari ke- 14 7 ekor yang hidup yang lain mati 15 Hari ke- 15 7 ekor yang hidup yang lain mati 16 Hari ke- 16 7 ekor yang hidup yang lain mati 17 Hari ke- 17 7 ekor yang hidup yang lain mati 18 Hari ke- 18 7 ekor yang hidup yang lain mati 19 Hari ke- 19 7 ekor yang hidup yang lain mati 20 Hari ke- 20 7 ekor yang hidup yang lain mati 21 Hari ke- 21 7 ekor yang hidup yang lain mati 22 Hari ke- 22 7 ekor yang hidup yang lain mati
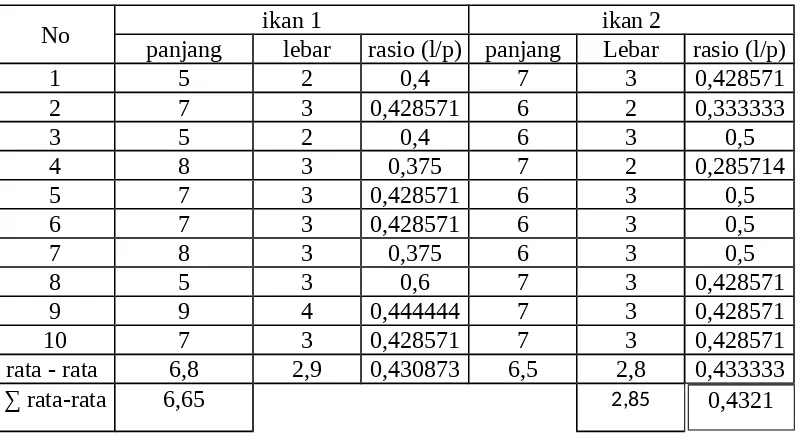
Tabel 4.5 Hasil kelompok 1 dengan kejut panas selama 1 menit
No ikan 1 ikan 2
panjang lebar rasio (l/p) panjang Lebar rasio (l/p)
1 5 2 0,4 7 3 0,428571
rata - rata 6,8 2,9 0,430873 6,5 2,8 0,433333
∑ rata-rata 6,65 2,85 0,4321
Tabel 4.6 Hasil pengamatan eritrosit dengan kejut panas semua kelompok
No Perlakuan Ulangan Ǿ L Ǿ P Rasio Ǿ L/P
SD
1 Kejut menit ke 1 1 2,85 6,65 0,432103 2 Kejut menit ke 3 1 5,95 3,3 0,478095 3 Kejut menit ke 3 2
Rata- rata
4.2 Pembahasan
Poliploidisasi adalah suatu metode manipulasi kromosom untuk menghasilkan ikan dengan jumlah kromosom yang lebih banyak dari jumlah kromosom normal atau diploid (2n), yaitu triploid (3n), tetraploid (4n), pentaploid (5n) dan seterusnya (Purdom, 1983 dalam Kadi, 2007 dalam Fitria,et al , 2013). Poliploidisasi secara alami umumnya banyak terjadi pada tumbuhan, sedangkan pada hewan poliploidi sangat jarang terjadi kecuali pada ikan dan katak (Kadi, 2007 dalam Fitria,et al , 2013).
Rottman et al. (1991) dalam Fitria,et al ,(2013) menyatakan bahwa poliploidisasi secara alami terjadi akibat pencemaran perairan, radisasi sinar ultraviolet ataupun akibat pengaruh hormon berlebihan, sehingga menyebabkan kasus nondisjungsi pada kromosom. Nondisjungsi adalah kondisi dimana pasangan kromosom yang homolog tidak bergerak memisahkan diri sebagaimana mestinya pada waktu fase pembelahan meiosis I atau dimana sister chromatid gagal berpisah selama fase meiosis II (Campbell et al., 2000dalamFitria,et al , 2013).
fertilisasi telur guna mencegah peloncatan polar body II saat meiosis II (triploidisasi) ataupun pembelahan sel pertama (mitosis I) pada telur terfertilisasi (tetraploidisasi).
Keunggulan poliploidisasi adalah dapat digunakan sebagai salah satu cara untuk memperbaiki dan meningkatkan kualitas genetik ikan guna menghasilkan benih-benih ikan yang mempunyai kemampuan pertumbuhan cepat, toleransi tinggi terhadap lingkungan dan resisten terhadap penyakit (Purdom, 1983 dalam Mukti et al., 2001 dalam Fitria,et al , 2013).
Perkembangan embrio merupakan suatu kelanjutan hasil fertilisasi dari hasil sel telur dan sel sperma yang kemudian setelah dibuahi akan mengalami proses pembentukan pola-pola pembelahan telur yang disebut cleavage. Sel telur membelah secara berturut-turut hingga mencapai fase diferensiasi menjadi bentuk dewasa pada tahap organogenesis. Pertumbuhan menjadi sistem organ yang kompleks dan saling tergantung merupakan suatu hal yang terinci dalam sistem biologis yang semuanya akan termodifikasi secara sempurna (Harvey, 1979).
Perkembangan embrio pada Ikan Nilem (Osteochillus hassselti) betina dimulai setelah telur dibuahi oleh inti spermatozoon yang semua haploid, menjadi inti zigot yang diploid. Zigot inilah yang mempunyai kemampuan untuk melakukan pembelahan segmentasi melalui proses mitosis yang cepat. Zigot yang tersegmen-segmen menjadi bagian yang kecil (cleavage), bermula dari satu sel kemudian membelah menjadi 2 sel, 4 sel, 8 sel, 16 sel, hingga 32 sel yang disebut fase morula (Djuhanda,1981).
Pembuatan sediaan apus darah biasanya digunakan dua buah kaca sediaan yang sangat bersih terutama harus bebas lemak. Satu buah kaca sediaan bertindak sebagai tempat tetes darah yang hendak diperiksa dan ynag lain bertindak sebagai alat untuk meratakan tetes darah agar didapatkan lapisan tipis darah (kaca perata). Darah dapat diperoleh dari tusukan jarum pada ujung jari. Sebaiknya tetesan darah pertama dibersihkan agar diperoleh hasil yang memuaskan. Tetesan yang kedua diletakan pada daerah ujung kaca sediaan yang bersih. Salah satu ujung sisi pendek kaca perata diletakan miring dengan sudut kira- kira 45o tepat didepan tetes darah menyebar sepanjang sisi pendek kaca perata, maka dengan mempertahankan sudutnya, kaca perata digerakan secara cepat sehingga terbentuklah selapis tipis darah diatas kaca sediaan. Setelah sediaan darah dikeringkan pada suhu kamar barulah dilakukan pewarnaan sesudah difiksasi menurut metode yang dipilih, yaitu metode Giemsa dan Wright yang merupakan modifikasi metode Romanosky (Maskoeri, 2008). Pembuatan sediaan apus darah ini digunakan untuk mengukur eritrosit ikan yang telah dilakukan kejut panas.
Zat warna yang digunakan dalam metode Romanovsky adalah Giemsa yang sebelumnya telah diencerkan dengan aquades. Sediaan apus yang telah dikeringkan diudara, difixir dulu dengan methyl alkohol selama 3-5 menit. Semakin lama pewarnaan yang dilakukan maka intensitasnya menjadi semakin tua. Preparat apus yang yang telah selesai dibuat kemudian diamati dibawah mikroskop dengan perbesaran 100x. Gambar yang didapat dalam hasil menunjukan sel-sel butir darah baik eritrosit, leukosit, trombosit, atau yang lain (Maskoeri, 2008).
laboratorium-laboratorium banyak dipakai larutan Giemsa 3% yang dibuat dari larutan baku Giemsa yang berupa cairan (larutan) (Sundoro, 1983).
Eritrosit yang diamati berbentuk butiran-butiran kecil berwarna sedikit transparan dengan jumlah yang banyak dan pada bagian tengahnya seperti terdapat lekukan. Selain itu, terdapat pula sel darah puti yang memiliki inti sel berwarna keunguan dengan bentuk yang beragam dan ukurannya lebih besar dari sel darah merah, namun jumlahnya sedikit.
Eritrosit normal berbentuk bulat atau agak oval dengan diameter 7 – 8 mikron (normosit). Dilihat dari samping, eritrositnampak seperti cakram atau bikonkaf dengan sentral akromia kira-kira ⅓ - ½ diameter sel. Dalam mengevaluasi morfologi sel darah merah pada sediaan apus, ada 4 hal yang harus diperlihatkan bentuknya (shape), 2. ukurannya (size), warnanya (staining), dan struktur intraselluler (structure). (Patologi klinik, 2006 dalam Warni, 2009).
V. KESIMPULAN Kesimpulan dari praktikum ini adalah :
1. Pengamatan perkembangan embrio telur Ikan Nilem, fase-fase perkembangan embrio bermula dari satu sel kemudian membelah menjadi 2 sel, 4 sel, 8 sel, 16 sel, hingga 32 sel yang disebut fase morula, selanjutnya blastula, gastrula, dan embryogenesis.
2. Pengamatan keberhasilan fertilisasi Ikan Nilem sangat sedikit pada kejut menit ke-1.
3. Pengamatan pertumbuhan Ikan Nilem sangat lambat dan banyak larva yang mati di akibat kan ikan tidak mampu bertahan pada kondisi tersebut. 4. Preparat apus darah dan mengukur ertitrosit pada Ikan Nilem memiliki
ukuran eritosit yang bervariasi baik dari panjang dan lebarnya.
DAFTAR REFERENSI
Adisoemarto, S. 1988. Genetika. Jilid 1. Penerbit Erlangga, Jakarta: 186 hal. Arsianingtyas. H. 2009. Pengaruh Suhu Panas dan Lama Waktu Setelah
Pembuahan Terhadap Daya Tetas dan Abnormlitas Larva Ikan Nila (Oreochromis niloticus). Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya
Djuhanda, T. 1981. Embriologi Perbandingan. Armico, Bandung.
Fitria, S , Yulia Sistina, Isdy Sulistyo .2013. Poliploidisasi Ikan Nilem(Osteochilus Hasselti Valenciennes, 1842) Dengan Kejut Dingin40C polyploidization On Shark Minnow.Seminar Nasional XPendidikan Biologi FKIP UNS.
Gratiana, E.W., P. Susatyo dan Sugiharto.1998. Perkembangan Awal Ikan Nilem Sampai Larva. Fakultas Biologi Unsoed, Purwokerto.
Harvey, B. J. 1979. The Theory and Passino. Ichtiology. John Willy and Sons. New York
Jasin, Maskoeri. 2008. Ilmu Alamiah Dasar. Jakarta: Rajawali Pers.
Jusup, M. 1988. Genetika I; Struktur dan ekspresi gen. Institut Pertanian Bogor: 205 hal.
Kadi, A. 2007. Manipulasi Poliploidi Untuk Memperoleh Jenis Baru Yang Unggul.Oseana, Volume XXXII, Nomor 4, Tahun 2007 : 1 – 11 hal
Mukti. A. T. dkk. 2001. Poliploidisasi Ikan Mas (Cyprinus carpio L.). BIOSAIN, Vol. 1 No. 1. Universitas Brawijaya. Malang.
Sacher, R.A., dan Mcpherson R.A., 2002. Tinjauan Klinis Hasil Pemeriksaan Laboratorium, Buku Kedokteran, EGC, Jakarta.
Sistina, Y. 2000. Biologi reproduksi, Fak. Biologi Unsoed, Pasca - Sarjana, Purwokerto : 66 hal.
LAMPIRAN
Gambar 1 metode apus darah Gambar 2 eritrosit larva ikan nilem