Prosiding Seminar Nasional Fundamental dan Aplikasi
Teknik Kimia 2011
Makalah No. XXX-XXX
Biosensor Glukosa Amperometrik dengan Prussian Blue /
Glucose oxidase yang Diimmobilisasi dengan Metode
Sol-gel Berbasis Senyawa Alkoksida
Adrian Nur, Debora Puspitasari, Dian Ningsih, Arief Widjaja, Minta Yuwana, Heru Setyawan*
Jurusan Teknik Kimia, Institut Teknologi Sepuluh Nopember, Surabaya, Indonesia *E-mail: sheru@chem-eng.its.ac.id
A B S T R A K
Penelitian ini bertujuan untuk mengembangkan biosensor glukosa berbasis sol-gel silika dengan pengukuran amperometri. Enzim glucose oxidase (GOD) diperangkap dalam lapisan sol-gel silika yang dilapiskan pada elektroda Pt berlapis prussian blue (PB). Disini PB berfungsi sebagai pengganti enzim horse radish peroxidase (HRP) untuk mereduksi H2O2 hasil reaksi enzimatik yang bertindak sebagai mediator tranfer elektron.
Percobaan elektrokimia dilakukan dalam sistem 3 elektroda konvensional dengan elektroda Pt/PB/SiO2/GOD sebagai elektroda kerja, elektroda platina sebagai elektroda
lawan dan elektroda Ag/AgCl (KCl jenuh) sebagai elektroda acuan. Kinerja biosensor ini dipengaruhi oleh beberapa faktor, terutama potensial yang digunakan, konsentrasi silika dalam sol dan jumlah enzim. Respon arus cenderung meningkat dengan meningkatnya potensial. Akan tetapi, dengan semakin besarnya potensial, kecederungan terjadinya reaksi samping semakin besar. Oleh karena itu, untuk mencegah terjadinya gangguan, pengukuran dilakukan pada potensial 0,4 V. Respon arus dengan potensial tersebut tertinggi diperoleh pada konsentrasi SiO2 untuk
immobilisasi GOD 1,1% dan jumlah enzim 7 U.
Kata kunci: Biosensor glukosa; glucose oxidase; immobilisasi; prussian blue; sol-gel.
1. Pendahuluan
Biosensor enzim amperometri adalah suatu alat yang merubah informasi konsentrasi senyawa kimia menjadi sinyal elektronika yang dapat dikuantifikasi. Enzim mengenali molekul target dengan transfer langsung kecepatan reaksi menjadi arus listrik. Salah satu biosensor yang paling populer adalah biosensor untuk mendeteksi gula darah yang diperlukan untuk memantau kadar gula darah penderita diabetes mellitus yang harus selalu menjaga kadar gula darah mendekati normal untuk mengurangi resiko komplikasi lanjutan.
Saat ini, sensor untuk keperluan mengukur kadar glukosa sangat mahal. Hal ini dikarenakan pada umumnya bioensor glukosa melibatkan dua enzim secara serentak. Satu enzim berfungsi
mengurai glukosa menjadi asam glukonat dan hidrogen peroksida dan enzim satunya berfungsi sebagai mediator untuk transfer elektron yang merupakan sinyal yang dapat dikuantifikasi. Enzim yang paling umum digunakan adalah glucose
oxidase (GOD) sebagai pengurai glukosa dan horseradish peroxsidase (HRP) sebagai mediator
transfer elektron.
Faktor keberhasilan suatu biosensor salah satunya tergantung pada sebaik apa suatu enzim terikat pada permukaan biosensor dan tetap aktif selama aplikasi yang diinginkan [1]. Untuk biostabilitas dan efisiensi reaksi yang optimal, matrik penyangga harus mampu mengisolasi biomolekul dan melindunginya dari agregasi antar molekul serta dari serangan mikroba. Immobilisasi yang bagus dicirikan oleh aktivitas enzimatik yang
tinggi dengan perembesan keluar yang dapat diabaikan dan difusi molekul analit serta produk reaksi hampir tidak terhambat.
Berbagai macam teknik immobilisasi telah digunakan, meliputi adsorpsi pada penyangga padat [2,3] pengikatan kovalen [4,5] dan pemerangkapan dalam polimer [6,7]. Pada umumnya, teknik adsorpsi mudah dilakukan, tetapi ikatan enzim seringkali lemah yang menyebabkan perembesan keluar sehingga derajat kestabilannya kurang. Sebaliknya, teknik kovalen membutuhkan persiapan yang kompleks dan seringkali memerlukan beberapa tahapan reaksi kimia. Immobilisasi, meskipun mencegah perembesan keluar tetapi seringkali mengarah kepada kehilangan aktivitas dan stabilitas enzim seiring dengan berjalannya waktu [8].
Sol-gel menawarkan cara yang lebih baik untuk mengimmobilisasi biomolekul dengan matriksnya yang berpori dan menunjukkan aktivitas fungsional biomolekul yang terselubungi [1,8,9]. Hal ini disebabkan kondisi proses sol-gel yang sederhana dan kemungkinan untuk merancang sesuai kebutuhan. Fleksibilitas sol-gel mengijinkan membentuk sensor sebagai monolith dan lapisan tipis yang dapat dipasangkan dengan serat optik atau dideposisikan pada elektroda, maupun sebagai nanopartikel.
Akan tetapi, pada proses sol-gel ketika terjadi reaksi hidrolisis senyawa alkoksida menjadi silica, dihasilkan alkohol. Selain itu, reaksi tersebut biasanya dikatalisis dengan asam atau basa yang menyebabkan pH larutan menjadi ekstrim. Adanya alkohol dan pH ekstrim dapat menyebabkan denaturasi dan penurunan aktivitas enzim. Oleh sebab itu, perlu dicari suatu metoda immobilisasi untuk menekan agar kedua faktor diatas tidak berpengaruh pada enzim yang diimobilisasi.
Sebagaimana disebutkan diatas alah satu penyebab mahalnya biosensor adalah digunakannya dua enzim secara serempak yang diperangkap dalam silika gel [10]. Untuk mengurangi biaya produksi telah ada upaya untuk mangganti HRP dengan (PB) [11]. PB memiliki karakteristik yang baik karena memiliki aktivitas elektrokatalik dan stabilitas yang tinggi, serta mudah dibuat. Kemampuan PB untuk mendeteksi hidrogen peroksida menyebabkan PB dapat digunakan untuk menggantikan enzim HRP.
Oleh karena itu, penelitian ini bertujuan untuk mengembangkan metoda immobilisasi enzim GOD dalam lapisan sol-gel silica dari enyawa alkosida sehingga faktor yang dapat mendenaturasi enzim dapat diabaikan. Selain itu, juga dipelajari penggunaan PB sebagai pengganti HRP dalam untuk biosensor amperometri untuk analisa glukosa.
2. Bahan dan Metode 2.1. Bahan
Glucose oxidase (GOD, dari Aspergillus niger, 5800
U/g) diperoleh dari Sigma-Aldrich. Bahan lain yang digunakan adalah reagen-reagen untuk membuat larutan sol-gel (tetraethoxysilane, TEOS, 99%, Merck; air demineralisasi; etanol, 97%, Merck;, HCl, p.a. 37%, Merck), reagen-reagen untuk membuat lapisan film prussian blue (FeCl3.6H2O, K3Fe(CN)6,
HCl, and KCl, Merck) dan reagen untuk analisa aktivitas enzim (β–D–glucose, anhydrous, 96%, Aldrich; K2PO4 monobasic, anhidrat, Sigma Aldrich;
KOH, Merck). Larutan glukosa dibiarkan 24 jam pada suhu kamar untuk mutorasi sebelum digunakan. Larutan penyangga fosfat pH 7 dibuat dengan pencampuran 0.1 M KH2PO4 and 0.1 M
KOH.
2.2. Peralatan
Pengukuran dan pengumpulan data percobaan elektrokimia dilakukan dengan Autolab PGSTAT302N (Eco Chemie) dan software NOVA 1.6. Percobaan elektrokimia dilakukan dalam sistem 3 elektroda konvensional dengan elektroda enzim sebagai elektroda kerja, elektroda platina sebagai elektroda counter, dan elektroda Ag/AgCl (KCl jenuh) sebagai elektroda referensi. Percobaan cyclic
voltammetric (CV) dilakukan pada sel elektrokimia
statis pada suhu ruangan. Sedangkan percobaan amperometrik dilakukan pada sel elektrokimia berpengaduk pada potensial konstan. Seluruh potensial dinyatakan sebagai versus Ag/AgCl (KCl jenuh).
2.3. Pembuatan larutan sol gel
Larutan sol gel yang digunakan pada penelitian ini berbasis TEOS sebagai prekursor silika dengan katalis asam. Larutan terdiri dari TEOS 1,95 mL, etanol sebagai pelarut 9,5 mL, air demineralisasi 3,1 mL, dan HCl 0,005 M 0,5 mL [9]. Larutan ini diaduk dengan magnetik stirer selama 15 jam. Setelah reaksi hidrolisa selesai, etanol diuapkan pada suhu ruang dengan hembusan udara sehingga dihasilkan sol silika yang bebas etanol.
2.4. Pembuatan lapisan film prussian blue
Elektrodeposisi lapisan film PB dilakukan secara elektrokimia. Kawat platina (diameter 1 mm dan panjang efektif 20 mm) dicuci dengan air, HCl, dan etanol. Selanjutnya kawat dikeringkan dalam oven 100 oC sampai kering. Kawat ditempatkan pada sel elektrokimia yang terdiri dari 2,5 × 10-3 M
FeCl3, 2,5 × 10 −3
M K3[Fe(CN)6], 0,1 M HCl, dan 0,1 M
KCl dengan potensial konstan 0,4 V selama 20 detik. Kawat tersebut kemudian dipindahkan pada sel elektrokimia yang terdiri 0,1 M HCl dan 0,1 M KCl dengan potensial disiklik sebanyak 25 kali antara 0,35 sampai -0,05 V dengan laju 0,05 V/detik. Kawat kemudian dikeringkan pada 100 oC selama 1 jam [12].
2.5. Pembuatan elektroda enzim
GOD yang telah dilarutkan pada penyangga fosfat dicampurkan ke dalam larutan sol-gel silika bebas alkohol. Larutan GOD/sol-gel kemudian ditempelkan pada kawat platina yang telah dilapisi PB. Elektroda Pt/PB/GOD/sol-gel silika dikeringkan pada suhu ruangan selama 24 jam dan disimpan pada suhu 10 oC sampai digunakan.
3. Hasil dan Diskusi
3.1. Sifat Elektrokatalitik elektroda Pt/PB/GOD/ sol-gel silika terhadap H2O2
Elektroda Pt/PB/GOD/sol-gel silika diuji dengan larutan H2O2 untuk mengetahui kemampuan PB
dalam memberikan respon terhadap H2O2. H2O2
merupakan hasil reaksi antara glukosa dengan GOD. Pengujian dilakukan dengan menempatkan elektroda Pt/PB/GOD/sol-gel pada sel elektrokimia tanpa H2O2 dan ada H2O2 dengan potensial siklik.
Gambar 1 menunjukkan voltammogram siklik elektroda Pt/PB/GOD/sol gel tanpa (a) dan dengan adanya (b) 5 mM H2O2 dalam larutan penyangga
fosfat. Tanpa adanya H2O2, elektroda enzim tidak
memberikan respon dan hanya memberikan sifat elektrokimia hasil reaksi reduksi oksidasi PB dalam larutan penyangga. Setelah penambahan H2O2
puncak katodik pada CV meningkat, sedangkan puncak anodik menurun. Perubahan pada CV disebabkan kenaikan reduksi elektrokatalitik H2O2
oleh Prussian white (PW) yaitu bentuk PB tereduksi. Reaksi katalitik tersebut dapat dinyatakan sebagai [11] : GODሺFADሻ + β˗D˗glucose → GODሺFADH2ሻ + δ˗gluconolactone (1) GODሺFADH2ሻ + O2 → GODሺFADሻ + H2O2 (2) Fe4ሾFeሺCNሻ6ሿ3 + 4 e- + 4K+ → Fe4K4ሾFeሺCNሻ6ሿ3 (3) Fe4K4ሾFeሺCNሻ6ሿ3 + 2H2O2 → Fe4ሾFeሺCNሻ6ሿ3 + 4OH- + 4K+ (4)
Glukosa mendifusi dari larutan ke lapisan film enzim yang selanjutnya secara enzimatik dioksidasi menjadi glukonat dan H2O2 (pers. 1 dan 2). H2O2
yang terbentuk kemudian direduksi secara katalitis
oleh PW (pers. 3) dan pada saat yang bersamaan PW kemudian teroksidasi menjadi PB (pers. 4). PB kemudian tereduksi menjadi PW secara elektrokimia pada potensial yang diberikan (pers. 3).
3.2. Respon Amperometrik Elektroda Enzim
Beberapa parameter yang mempengaruhi respon amperometrik elektroda enzim diteliti, yaitu potensial yang digunakan, konsentrasi SiO2, dan
jumlah enzim.
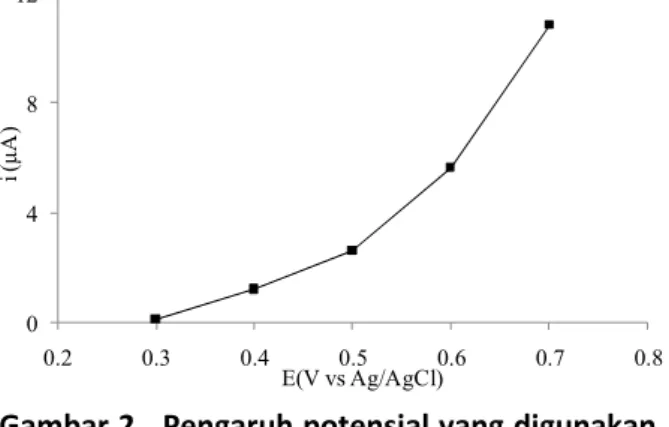
Gambar 2 menunjukkan pengaruh potensial yang diberikan pada respon arus biosensor. Pengukuran dilakukan pada 1,086 % konsentrasi SiO2 dan jumlah enzim 7 U. Semakin tinggi potensial
yang digunakan semakin besar arus respon yang dihasilkan. Potensial yang digunakan diusahakan pada rentang potensial serendah mungkin namun memiliki respon arus yang besar. Hal ini bertujuan untuk menghindari terjadinya interferensi yang timbul akibat reaksi samping. Namun, dalam pemilihan ini perlu juga diperhatikan bahwa pada potensial yang terlalu rendah akan dapat mengakibatkan enzim tidak dapat mengoksidasi
-600 -400 -200 0 200 -0.1 0 0.1 0.2 0.3 0.4 i ( µ A ) E / V vs Ag/AgCl a b 0 4 8 12 0.2 0.3 0.4 0.5 0.6 0.7 0.8 i ( µ A ) E(V vs Ag/AgCl)
Gambar 2. Pengaruh potensial yang digunakan terhadap respon arus pada larutan glukosa 5 mM dengan laju scan 0.05 V/detik dalam penyangga fosfat (pH 7).
Gambar 1. CV elektroda enzim dengan laju scan 0.05 V/detik dalam penyangga fosfat (pH 7).
glukosa dengan baik. Berdasarkan hasil analisa amperometrik untuk uji potensial, didapatkan potensial sebesar 0,4 V. Potensial ini telah mampu menghasilkan arus yang relatif besar. Oleh karena itu, pengukuran amperometrik selanjutnya untuk mengetahui pengaruh konsentrasi SiO2 dan jumlah
enzim digunakan potensial sebesar 0,4 V.
Konsentrasi silika berhubungan dengan porositas/ukuran pori. Dalam immobilisasi diinginkan porositas yang optimal yaitu tidak terlalu kecil yang dapat menghalangi tranfer massa glukosa dan elektron, namun tidak terlalu besar yang dapat menyebabkan berkurangnya aktivitas dan stabilitas enzim. Semakin besar porositas, maka enzim akan semakin mudah merembes keluar.
Gambar 3 menunjukkan pengaruh konsentrasi silika pada respon arus. Pengukuran dilakukan pada potensial sebesar 0,4 V dan enzim sebesar 7 U. Respon arus meningkat dengan naiknya konsentrasi SiO2, mencapai maksimum
pada konsentrasi SiO2 1,086 %, dan kemudian turun
dengan naiknya SiO2.
Konsentrasi SiO2 mempengaruhi porositas
jaringan sol-gel. Pada konsentrasi SiO2 yang rendah,
enzim tidak dapat terikat secara sempurna dalam jaringan sol-gel sehingga enzim cenderung dapat keluar dan menjadi tidak stabil yang menyebabkan respon arus rendah. Sebaliknya, konsentrasi SiO2
yang tinggi membuat ketebalan lapisan film sol-gel/GOD menjadi meningkat yang menyebabkan difusi glukosa melalui jaringan berpori menjadi semakin sulit dan lambat. Hal ini yang menyebabkan respon arus menjadi lebih kecil.
Performa biosensor glukosa bergantung pada aktivitas enzimatis dalam mengoksidasi glukosa, yang dipengaruhi oleh jumlah enzim (enzyme
loading). Pada umumnya enzim memberikan respon
karena adanya kontak dengan substrat β-D glukosa. Penelitian ini menggunakan enzim GOD yang merupakan katalis untuk mengubah glukosa menjadi asam glukonat. Pada umumnya respon arus semakin meningkat dengan meningkatnya enzim yang digunakan.
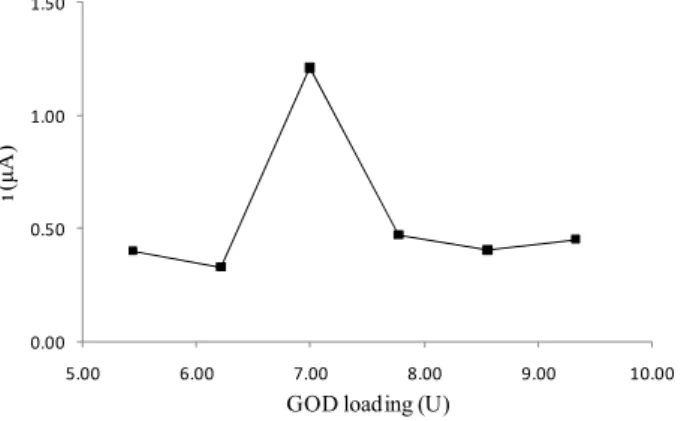
Gambar 4 menunjukkan pengaruh jumlah enzim terhadap aktivitas biosensor pada konsentrasi SiO2 sebesar 1,086 % pada larutan β-D
glukosa 5 mM dengan potensial sebesar 0,4 V. Dari gambar tersebut terlihat bahwa semakin besar jumlah enzim maka arus yang dihasilkan akan semakin besar pula. Hal ini terjadi karena dengan bertambahnya jumlah enzim, maka enzim yang bereaksi dengan glukosa juga semakin banyak sehingga H2O2 yang terdeteksi oleh PB juga semakin
banyak. Akibatnya elektron yang terlepas dan terbaca sebagai arus juga semakin tinggi. Setelah mencapai maksimum pada jumlah enzim 7 U, arus respon menjadi turun secara tajam dan cenderung konstan. Sensor berbasis enzim oksidase membutuhkan oksigen sebagai ko-substrat untuk terjadinya oksidasi sehingga konsentrasi oksigen dapat mempengaruhi respon arus. Pada nilai optimumnya, kecepatan reaksi meningkat pada elektroda enzim. Konsentrasi substrat menjadi jenuh setelah mencapai kecepatan maksimum dan menurun karena kekurangan oksigen [13].
4. Kesimpulan
Biosensor glukosa amperometrik dapat diperoleh dengan immobilisasi enzim GOD metoda sol-gel dan prussian blue. Beberapa parameter yang mempengaruhi respon arus biosensor telah diteliti yaitu potensial yang digunakan, konsentrasi silika, dan jumlah enzim. Arus respon cenderung meningkat dengan meningkatnya potensial. Tetapi potensial yang dipilih adalah 0,4 V untuk mencegah terjadinya interferensi. Respon arus maksimal diperoleh pada konsentrasi SiO2 untuk immobilisasi
GOD 1,086 % dengan jumlah enzim GOD 7 U.
Daftar Pustaka
[1] Coradin, T., Boissere, M., dan Livage, J., 2006. Sol – gel Chemistry in Medicinal Science, Current Medicinal Chemistry, 13, 99-108. 0.00 0.50 1.00 1.50 0 1 2 3 i ( µ A ) SiO2concentration (%, w/w) 0.00 0.50 1.00 1.50 5.00 6.00 7.00 8.00 9.00 10.00 i ( µ A )
GOD loading (U)
Gambar 4. Pengaruh jumlah enzim terhadap respon arus pada larutan glukosa 5 mM. Gambar 3. Pengaruh konsentrasi SiO2 terhadap
[2] Qian, J.M., Suo, A.L., Yao, Y., dan Jin, Z.H., 2004. Polyelectrolyte – stabilized Glucose Biosensor Based on Woodceramics as Electrode, Clinical Biochemistry, 37, 155-161. [3] Tsai, M.C., dan Tsai, Y.C., 2009. Adsorption of
Glucose Oxidase at Platinum Multiwalled Carbon Nanotube Alumina Coated Silica Nanocomposite for Amperometric Glucose Biosensor, Sensors and Actuators B, 141, 592-598.
[4] Subramanian, A., Kennel, S.J., Oden, P.I., Jacobson, K.B., Woodward, J., dan Doktycz, M.J., 1999. Comparison of Techniques for Enzyme Immobilization on Silicon Supports, Enzyme Microb. Technol., 24, 26-34.
[5] Yang, X., Hua, L., Gong, H., dan Tan, S.N., 2003. Covalent Immobilization of An Enzyme (Glucose Oxidase) onto Carbon Sol-Gel Silicate Composite Surface as A Biosensing Platform, Analytica Chimica Acta, 478, 67-75.
[6] Zhu, J., Zhu, Z., Lai, Z., Wang, R., Guo, X., Wu, X., Zhang, G., Zhang, Z., Wang, Y., dan Chen, Z., 2002. Planar Amperometric Glucose Sensor Based on Glucose Oxidase Immobilized by Chitosan Film on Prussian Blue Layer, Sensors, 2, 127-136
[7] Rauf, S., Ihsan, A., Akhtar, K., Ghauri, M.A., Rahman, M., Anwar, M.A., dan Khalid, A.M., 2006. Glucose Oxidase Immobilization on A
Novel Cellulose Acetate –
Polymethylmethacrylate Membrane, Journal of Biotechnology, 121, 351-360.
[8] Gupta, R. dan Chaudhury, N.K., 2007. Entrapment of Biomolecules in Sol – gel Matrix for Applications in Biosensors : Problems and Future Prospects, Biosensors and Bioelectronics, 22, 2387-2399.
[9] Kunzelmann, U. dan Bottcher, H., 1997. Biosensor Properties of Glucose Oxidase Immobilized within SiO2, Sensors and Actuators
B, 38-39, 222-228
[10] Singh, S., Singhal, R., dan Malhotra, B.D., 2007. Immobilization of Cholesterol Esterase and Cholesterol Oxidase onto Sol – Gel Films for Application to Cholesterol Biosensor, Analytica Chimica Acta, 582, 335-343.
[11] Liang, R., Jiang, J., dan Qiu, J., 2008. An Amperometric Glucose Biosensor Based on Titania Sol – gel/Prussian Blue Composite Film, Analytical Sciences, 24, 1425-1430
[12] de Mattos, I.L., Gorton, L., Laurell, T., Malinauskas, A., dan Karyakin, A.A., 2000. Development of biosensors based on hexacyanoferrates, Talanta, 52, 791-799. [13] Li, T., Yao, Z., dan Ding, L., 2004. Development
of an amperometric biosensor based on
glucose oxidase immobilized through silica sol– gel film onto Prussian Blue modified electrode, Sensors and Actuators B, 101, 155-160.