TLNJAUAN
PUSTAKA
Organ Reproduksi Udang Betina
Penaeus vanname1 L~iopenaeus vanname1 atau disebut juga udang putih merupakan spesies endemik amerika latin, tersebar di pantai Peru bagian utara hingga Mesiko bagian utara. Dlbandingkan dengan Penaeus monodon, ukuran I'. vannamei lebih kecil, berat maksimum individu betina adalah 120 gram sedangkan P. monodon dapat mencapai 600 gram. Spesies ini berwarna putth keabu-abuan. Udang putih merupakan hewan heteroseksual (diocious) sehingga antara individu jantan dan betina dapat dibedakan secara morfologi. Pada umur yang sama, ukuran individu betina lebih besar daripada individu jantan (Bailey- Brock dan Moss 1992).
Organ ekstemal sistem reproduksi udang betina adalah telikum. Telikum berguna untuk menampung spenna yang akan dilepaskan pada saat pemijahan. Telikum terletak antara pangkal kaki jalan ke-4 dan ke-5. Pada P. vannamei, telikumnya tidak tertutup oleh lempeng karapas yang keras atau disebut dengan telikum terbuka, sedangkan pada P. monodon, telikumnya tertutup oleh lempeng karapas yang keras. Struktur telikum ini erat kaitannya dengan tingkah laku reproduksi spesies tersebut. Pada spesies dengan telikum terbuka, proses perkawinannya tidak didahului molting sedangkan pada udang yang telikumnya
.a
tertutup, proses perkawinan didahului dengan molting. Tujuannya agar karapas menjadi lunak sehingga sperma dapat dimasukkan ke dalam telikum (Bailey- Brock dan Moss 1992). Perbedaan struktur telikum terbuka dan tertutup terdapat pada Gambar 1.
Organ reproduksi internal udang putih betina terdin dan sepasang ovan, berbentuk tubular, simetrik bilateral, terletak di bagian ventral hingga rongga dada dan berkembang ke arah posterior hingga hepatopankreas. Cuping abdominal berdampingan dengan usus dan cuping anterior terdapat di cepalothorax. Cuping lateral berkembang menyamping seperti jari dan terletak antara cuping anterior dan posterior. Oviduk berada diantara kedua sisi ovari dan mernanjang hingga organ genital eksternal yaitu pada koksapodit pasangan kaki jalan ke-3 (Bailey-
Brock dan Moss 1992). Pada saat matang, ovari akan tampak berkembang dan memanjang hinga beberapa segmen abdominal.
Telikum
Pereiopod
Pleopod
/
Telikurn terbuka
Teli kum tertutup
Gambar 1 Morfologi organ reproduksi betina. (a) Letak organ eksternal betina (telikum), (b) Telikum terbuka dan tertutup (c) Organ reproduksi internal betina (ovari) tampak dorsal (Bailey-Brock dan Moss 1992)
Perkembangan Gonad Udang
Perkembangan ovari dimulai dengan proses oogenesis. Proses oogenesis dimulai dengan proliferasi dan masuknya oogonia ke proses meiosis. Pembentukkan oogonia terjadi di zona germinal. Proses ini berlangsung kontinyu dan terjadi selama hidup udang (Quackenbush 2001). Proses meiosis dimulai dengan tahap profase dan diakhiri dengan lepasnya oogonia dari zona germinal dan terbentuk oosit primer.
Tahap beri kutnya adalah tahap pravitelogenesis yang dicirikan dengan proliferasi ribosom dan berkembangnya rztikulum endoplasma. Selama proses ini ukuran oosit akan berkembang sebagai hasil dari sintesis protein secara endogenous dan rongga vesikel terisi oleh materi granular yang disebut
glikoprotein. Akhir dari pravitelogenesis adalah sel folikel mengalami hiperplasia dan proses ini akan berlanjut ke tahap vitelogenesis.
Vitelogenesis merupakan merupakan proses biosintesis protein kuning telur oleh organ atau jaringan tertentu yang kemudian ditansportasikan ke dalam ovari melalui hemolim (Quackenbush 2001). Pada tahap ini terjadi akumulasi kuning telur (yolk) yang dicirikan dengan perkembangan oosit yang cepat. Oosit akan mengalami perubahan ukuran dari sekitar 50 pm menjadi
*
300 p dan ovari dapat tumbuh dari 2% bobot tubuh menjadi lebih dari 10% bobot tubuh dalam waktu 48 - 72 jam (Browdy 1992). Selama proses vitelogenesis, muncul butiran-butiran kuning telur yang mengandung vitelin. Vitelin (Vn) mengandung 30% lipid yang berasosiasi dengan karotenoid sehingga selama proses vitelogenesis akan tampak perubahan intensitas warna pada ovari.Vn adalah senyawa yang berfingsi sebagai sumber nutrien b a g perkembangan embrio. Vn pada P. vannamei merupakan polipeptida dengan berat molekul 300-500 kDa yang di dalamnya terdapat karotenoid, gula dan lipid (Quackenbush 2001). Bahan utama pembentuk Vn adalah Vitelogenin (Vg). Vitelin terdiri dari beberapa sub unit protein. Menurut Quackenbush (1989) vitelin P. vannamei terdiri dari 4 sub unit yaitu 103, 97, 95 dan 76 kDa, tetapi kemudian ditemukan sub unit dengan bobot molekul 158 kDa (Quackenbush, 2001). Garcia-orozco et a/. (2002) mengemukakan bahwa vitelin P. vannamer terdiri dari 3 sub unit utama yaitu 87, 78 da 46 kDa. Berdasarkan isolasi yang dilakukan Vasquez-Boucard et a/. (2003), diperoleh 6 sub unit yaitu 60, 90, 95, 100, 140 dan 160 kDa. Pada P. vannamer, sintesis Vg terjadi di dalam ovari dan hepatopankreas (Quackenbush 200 1 ), tetapi Fainzilber el al. ( 1992) menyatakan bahwa vitelin juga ditemukan dalam jaringan lemak.
Kandungan Vg dalam hemolim akan meningkat seiring dengan meningkatnya gonado somatrc rndex (GSI) dan menurun saat terjadi ovi posisi (Tsukimura 2001; Okumura 2004). Pada P. monodon, Vg dalam hemolim meningkat seiririg dengan meningkatnya GSI hingga TKG 111, tetapi menurun
pada TKG IV (Longyant et a/. 2003). Lebih lanjut dinyatakan bahwa 3-4 hari setelah ablasi, Vg dalam hemolim meningkat pesat dan pada hari ke-5 menurun dengan cepat. Pada hari ke-8/9 kandungan Vg dalam hemolim meningkat
kembali. Menurut Quackenbush (2001), seminggu setelah ablasi kandungan Vg dalam hemolim P. va~~na~ttei adalah 0,l mdmL dan setelah dua minggu kandungannya meningkat menjadi 1 mg/mL.
Munculnya protein kuning telur rnerupakan tallap akhir dari perkembangan oosit. Pada tahap pasca-vitelogenesis terjadi germinal vesicle breakdowr~ (GVBD) dan ovulasi. GVBD ditunjukkan dengan meleburnya inti dalam sitoplasma atau hilangnya sel folikel yang mengelilingi oosit. GVBD pada udang peneid umumnya tejadi pada dini hari (02.00-03.00) atau sesaat setelah terjadi pemijahan. Oosit yang telah matang akan diserap kembali oleh induk apabila tidak tejadi pemijahan. Faktor lain yang dapat memicu tejadinya reabsorbri oosit adalah stress. Absorbsi juga terjadi pada omit matang yang tersisa setelah pernijahan.
Peranan Hormon dalam Perkembangan Gonad Udang
Reproduksi pada udang dikendalikan ole11 berbagai hormon yang dihasilkan oleh tangkai mata, otak, ganglion toraks, ovari dan diduga juga dipengaruhi oleh ekdisteroid (Charmantier et al. 1997). Aktifitas kerja hormon tersebut akan berpengaruh baik langsung maupun tidak langsung terhadap kecepatan perkembangan dan pematangan ovari. Hormon-honnon yang berperan dalam perkembangan ovari udang adalah :
Go~~adZnhibiting H o r n ~ o ~ ~ e (GIH)/ Vitellogenin Znhibitii~g Hormone (VIH)
Gonad inhibiting hormone (GIH) atau disebut juga vitelfogenin-inhibiting honnorte (VIH) merupakan hormon yang hanya ada pada krustase. Neuropeptida ini satu golongan dengan crustacean hyperRlycemic hormone (CHH) dan molt inhibiting hormone (MIH) yang dicirikan dengan adanya residu cysfeine (Chen et a / . 2003). Prekursor GIH merupakan rantai peptida dengan panjang 112 asarn amino. Berat molekul GIH adalah 9135 Da (Edomi et a / . 2002). Pada lobster Amerika, Homarus americanus, GIH disintesis dalam sel neuroendokrin organ-)<, tepatnya di dalam medula terminal yang berada di tangkai mata. Neuropeptida hasil sintesis ditransportasikan meIalui axon ke kelenjar sinus untuk ditampung dan disekresikan (De Kleijn et ai. 1998).
GIH ditemukan pada individu jantan clan betina. Pada Hontarus atnerrcanns, jwnlah sel neurosekretori organ-x pada kedua jenis kelamin relatif sama (Edomi et al. 20021, ha1 ini menunjukkan bahwa GIH mempunyai peranan dalain peinatangan gonad baik jantan inaupun betina. GIH atau VIH inerupakan hormon yang bekerja menghambat perkembangan gonad. Hal ini telah dibuktikan dengan percobaan pada berbagai spesies krustase bahwa ablasi dapat mempercepat perkembangan gonad. Sekresi GIH dikendalikan oleh methionin enkephalrn (Met-Enk) and dopamin (DA).
Mandibular Organ Inhibiting Hormone (MOIH)
Mandibular organ inhibiting hormone (MOIH) merupakan hormon yang disintesis dan disekresi oleh komplek kelenjar sinus-organ-X pada tangkai mata. MOIH berfungsi untuk menghambat proses sintesis methyl farnesoate oleh organ mandibular (Huberman 2000). Neuropeptida ini mempunyai 78 residu asam amino dengan berat molekul9235,6 Da dan struktumya sangat mirip dengan molt- inhibiting hormone (MIH) (Wainwright et al. 1996).
GonadStimulating Homtone (GSH)
Gonad stimulating hormone (GSH) ditemukan pada otak dan thoracic ganglion. Implantasi thoracic ganglion pada Procambarus clarki~ dapat menstimulasi perkembangan gonad (Sarojini et al. 1 997). Sekresi GSH dikendalikan oleh neuroregulator seperti 5-Hydroxytryptamine (5-HT)/serotonin,
methionin enkephalin (Met-Enk), dopamin (DA), and naloxene.
Methyl Famesoate (MF)
Struktur MF mirip dengan juvenile hormone 111 (JH 111) pada serangga yang disintesis oleh mandibular o q a n (MO) (Chang 1997). Menurut Laufer et a/.
(1997), MF berperan dalam reproduksi krustase seperti gonadotropin dan juga berperan dalam morfogenesis. Berdasarkan uji secara in vitro pada betina Libina enzarginata, tingkat produksi MF oleh mandibular organ tinggi saat perkembangan oosit dan oogenesis. Sekresi MF oleh MO mencapai puncaknya pada h s e vitelogenesis (sekitar 3,30 ng/il). Pada masa intermolt hanya sekitar 0,5
ngh. Implantasi MO pada juvenil betina berpengaruh terhadap perkembangan gonad. Berdasarkan analisis iit vilro pada 1,. vannamei menunjukkan ballwa MF menyebabkan peningkatan ukuran oosit secara signifikan. Menurut Laufer el al.
( 1997), MF berpengaruh terhadap peningkatan fekunditas P. vannamei, selain itu MF juga berperan merangsang organ-Y untuk mensintesis ecdysteroid.
Dopamin (D A)
Dopamin (DA) merupakan neurotransmiter yang berperan dalam mengharnbat pematangan gonad udang (Chen el a / . 2003). DA menghambat pematangan gonad dengan menstimulasi sekresi hormon pengambat perkembangan gonad (GIH) (Fingerman 1997) dan dengan cara menghambat kerja
5-HT
dalarn stimulasi sekresi GSH. Menurut Chen et al. (2003), padaMacrobrachiurn rosenbergii, DA terdapat pada otak dan torasik ganglia. Saat vitelogenesis, reseptor DA akm diblok oleh anti dopamin sehingga terjadi proses pematangan gonad (Sarojini et al. 1995).
Hormon Steroid (vertebmte-type steroid hormone)
Sintesis hormon steroid pada krustase belum banyak diketahui. Berdasarkan studi oleh Junera el al. (1977) dalam Yano (1987) diketahui bahwa pada ovari terdapat vitellogenesis stimulating ovarian hormone (VSOH) yang diduga mempunyai peranan sama dengan estradiol-17P pada vertebrata. Menurut Summavielle et a / . (2003), ovari Marsupenaeus japon~cus mampu mensintesis estradiol-17P dari progesteron, ha1 ini ditunjukkan dengan adanya aktivitas enzim 17a-hidroksilase, C17-C20 liase, 17$-hidroksisteroid dehidrogenase (17$-HSD)
dan aromatase. Aktivitas enzim tersebut juga terdapat pada hepatopankreas
kecuali C I T C ~ O liase. Berdasarkan ha1 tersebut diduga kuat bahwa VSOH merupakan senyawa yang identik dengan estradiol- 17P. Biosintesis estradiol- 17P juga terdapat pada ovari Macrobrachiurn rosenbergii (Ghosh d m Ray 1993) dan
I'enaeus nlonodon (Fairs et al. 1990). Quinitio et al. (1991) mengemukakan keberadaan progesteron d m estradiol-17$ pada berbagai jaringan d m hemolim
Pandalus kessleri. Walaupun mekanisme biosintesis progesteron d m estradiol- 17f3 pada udang belum diketahui dengan jelas, tetapi keberadaanya dalam tubuh
udang dan krustase lainnya diduga mempunyai peranan yang cukup penting dalam siklus reproduksi.
Uji pengaruh honnon steroid terhadap proses reproduksi telah dilakukan pada beberapa spesies krustase. Pernberian 1 7a-Hidroksiprogesteron pada
Penueus japonicus mampu meningkatkan konsentrasi vitelogenin dalam hemolim (Yano 1987). Pemberian progesteron juga mampu merangsang perkembangan gonad Chasmagnathus grariulu~u (Zapata er ul. 2003). Procrambarus clarkii
(Rodriguez et al. 2002), dan I). mon(don (Ismail 1 99 1 ). Berdasarkan uji in vitro,
pemberian progesteron mampu meningkatkan kandungan hormon estradiol-l7fl pada ovari Mafiapernus jup)nrcrus dan rnempercepat perkembangannya
. .*
(Summavielle et al. 2003). Selain progesteron, percobaan penggunaan estradiol- 178 untuk merangsang perkembangan gonad krustase khususnya udang dan kepiting juga telah dilakukan. Pemberian estradiol-17$ pada udang windu
(Penaats monodon) mampu merangsang dan mempercepat perkembangan gonad (Quinitio e t a1 1993; Riani 200 1 ). Kecepatan perkembangan gonad Procambaius clarckii yang diberi methyl famesoate (MF) d m estradiol-17fl lebih tinggi dibandingkan dengan individu yang hanya diberi MF saja. Hal ini menunjukkan bahwa estradiol-17$ berpengaruh positif terhadap perkembangan gonad (Rodriguez et al. 2002). Pada Metapenaeus ensis, penyuntikan Pestradiol dapat meningkatkan ekspresi gen pengendali sintesis vitelogenin (MeVgl) dan *
meningkatkan gonado sornatlc index (GSI) (Tiu dan Chan 2005). Estradiol-17P juga berperan dalam reproduksi Macmbmchium msenbergii. Berdasarkan pengamatan yang dilakukan oleh Ghosh dan Ray (1993), organ
M.
msenbergiiresponsif terhadap hormon estrogen yang ditunjukkan dengan peningkatan akumulasi protein dalam hepatopankreas, otot dan hemolim. Pemberian estradiol- 178 pada spesies ini marnpu meningkatkan aktivitas beberapa enzim (N$-K+- ATPase, rnalate dehydrogenase dan glucose-6-phospate dehydrogenase) yang terdapat pada hepatopankreas. M. msenbergii yang telah disuntik dengan estradiol-17fl mengalami peningkatan jumlah protein dan RNA pada hepatopankreas (Ghosh dan Ray 1992). Selain itu aktivitas biosintesis 17P-HSD pada hepatopankreas dan ovari juga meningkat saat vitelogenesis.
Hal yang berbeda diungkapkan oleh Okumura (2004) bahwa hormon steroid tidak berperan penting dalam proses reproduksi udang. Berdasarkan uji ;PI
vivo pada induk M. Japonicus tanpa ablasi, pemberian est~adiol-17p tidak berpengaruh nyata terlladap perkembangan gonad. Tidak berpengarulmya l~onnon diduga akibat aktivitas hormon penghambat seperti GIH dan MOIH yang dihasilkan organ-X pada tangkai mata (Tsukimura 200 1 ).
Mekanisme Kerja Hormon dalam Perkembangan Ovari
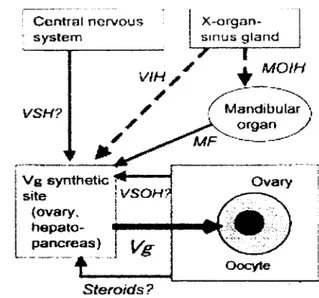
Reproduksi udang sangat berkaitan dengan siklus hormonal. Pada saat gonad belum matang, organ-)< yang terdapat pada tangkai mata akan bekerja menghasilkan GIH dan MOIH. Pengaruh GIWVIH dan MOIH dominan sehingga terjadi pertumbuhan somatik. Proses ini akan berjalan terus sampai suatu saat uhman kulit udang tidak sesuai dengan ukuran tubuh sehingga tejadi desakan. Kondisi ini akan merangsang syaraf pusat dan organ mandibular menjadi aktif
Syaraf pusat akan merangsang sekesi GSH dan organ mandibular akan mensintesis dan mensekresi MF. Hormon ini akan bekerja sinergi merangsang sintesis vitelogenin sehingga sehingga terjadi kernatangan gonad (Chang 1997). Sintesis vitelogenin terjadi di dalam hepatopankreas d m ovari. Secara alami, aktivitas honnon perangsang perkembangan gonad juga dipicu oleh adanya sinyal-sinyal lingkungan tertentu.
Perkembangan tingkat kematangan gonad udang merupakan proses yang berkesinambungan antara proses pravitelogenesis dan vitelogenesis. Kedua proses ini dirangsang oleh hormon VSHIGSH dan MF. Selain itu, proses pematangan gonad pada udang diduga juga dipen- oleh aktivitas VSOH dan honnon steroid yang dihasilkan ovari (Okumura 2004). Yano (1998) menyatakan bahwa VSOH juga merupakan hormon steroid. Disamping ketersediaan hormon, kedua proses tersebut juga memerlukan ketersediaan materi pakan yang baik sebagai bahan pembentuk vitelogenin serta kualitas air media yang layak. Jika materi dalam tubuh telah memadai dan ketersediaan hormon perangsang perkembangan gonad cukup maka pematangan gonad akan cepat dan kualitas sel telur yang dihasilkan baik (Benzie 1997). Diagram mekanisme sistem kerja hormon pada perkembangan ovari terdapat pada Gambar 2.
system
I
s ~ n u s glandI
VSH? 0 /' Mand~bular)
, -"- ----, .
Ovary I
Steroids ?
Gambar 2 Sistem ke j a hormon dalam pengendalian perkembangan gonad udang (Okumura 2004)
Peranan Pakan dalam Reproduksi Udang
Nutrisi induk merupakan salah satu faktor yang penting dalam proses pematangan gonad. Berbagai studi menunjukkan bahwa pakan segar seperti cumi-cumi, gastropoda jenis trochus, cacing laut, moluska dan artemia penting dalam diet pematangan gonad (Browdy 1992). Pemberian artemia mampu meningkatkan frekuensi pemijahan dan jurnlah telur yang dihasilkan. Menurut Benzie (1 997), induk udang yang diberi pakan campuran antara pakan buatan dan pakan alami menghasil hasil produksi larva yang lebih baik dibandingkan dengan induk yang hanya diberi pakan buatan.
Salah satu kandungan nutrisi yang sangat diperlukan dalam perkembangan gonad adalah asam lemak terutama asam lemak tak jenuh seperti PUFA. Asam lemak penting dalam perkembangan neuronal, sintesis biomembran dan sebagai prekursor hormon dan kuning telur (Hanison 1990). Udang tidak dapat mernperpanjang asam linolenat menjadi PUFA atau mensintesis kolesterol sehingga keduanya harus disuplai dari luar untuk mendukung pembentukkan biomembran dan pembentukan hormon (Cuzon et a / . 1994). Penaeus vanriartzei
yang dipelihara dalam wadah pemeliharaan dapat matang gonad jika komposisi asain leillak dalam pakan yang diberikan tinggi (Benzie 1997). Koinposisi asam lemak dalam pakan sangat bexpengaruh terhadap komposisi asam lemak dalam
tubuh induk udang. Komposisi asam lemak induk akan berkorelasi positif dengan komposisi asam lemak telur.
Seiain asam lemak, vitamin juga mempunyai fungsi yang penting dalam perkembangan gonad udang peneid (Wouters et a f . 2001). Pemberian vitamin A,
E dan C mampu meningkatkan perkembangan gonad P. japonicus Alava et a/. (1993). Menurut Wouters et af. (2001), agar pematangan gonad udang lebih optimal, diperlukan zat anti oksidan seperti vitamin E dan C.
Peranan Lingkungan dalam Reproduksi Udang
Lingkungan merupakan salah satu hktor eksternal yang mempunyai peranan penting dalam perkembangan reproduksi terutama saat perkembangan gonad. Kondisi linglcungan akan berpengaruh terhadap metabolisme tubuh. Kondisi lingkungan yang baik akan menunjang kecepatan perkembangan gonad. Selain itu sekresi hormon pada udang juga sangat dipen- oleh rangsangan eksternal temtama kondisi lingkungan. Sinyal dari luar akan diterima oleh susunan syaraf pusat dan komplek kelenjar sinus organ-X yang ada pada tangkai mata. Sistem syaraf pusat kernudian
akan
mensekresi honnon-hormon yang berperan dalam reproduksiTemperatur, panjang hari, kualitas dan kuantitas cahaya serta beberapa aspek kualitas air seperti salinitas, pH, konsentrasi oksigen dan kandungan amonia berpengaruh terhadap proses.-pematangan gonad, kualitas telur dan larva yang dihasilkan (Lotz dan ogle 1994 dalam Benzie 1997). Ukuran wadah, tipe substrat dan kepadatan populasi juga akan mempengaruhi pematangan gonad dan pemijahan udang peneid (Browdy 1992). Menurut Treece (2000), kualitas air yang baik untuk pematangan gonad dan pemijahan udang P. vannamel adalah : Salinitas 27 - 36 ppt
*
0,5, Tempemtur 28 "C*
2, pH 7,8*
0 2 , Fotoperiodisitas 14 terang, 10 gelap, Oksigen terlarut * 5 mgIL, Amonia total 0,004 mg/L, Sedangkan menurut Arcos et a/. (2003) salinitas 37 ppt dan ternperatur 28 "Cmemberikan pengaruh yang paling baik pada perkembangan gonad udang putih. Taylor et al. (2004) menambahkan bahwa laju perkembangan gonad berkembang maksimum pada fotoperiodisitas 12,5 jam terang dan 11,5 jam gelap.
METODOLOGI
Waktu dan Ternpat
Penelitian dilaksanakan pada bulan Maret hingga bulan Juni 2006 di Balai Budidaya Air Payau (BBAP) Situbondo, Jawa Timur. Analisis histologi gonad dilakukan di Laboratorium Penyakit Ikan, Jurusan Budidaya Perairan, FPIK-IPB dan analisis protein vitelogenin dan protein kuning telur (vitelin) dilakukan di iaboratorium Bioteknologi Hewan dan Biomedis PAU-IPB. Analisis kandungan estradiol-l7fl dalam hemolim dilakukan di Laboratorium Balitnak Ciawi.
Metode dan Desain Penelitian
Metode yang digunakan dalam percobaan ini adalah metode eksperimental. Hewan uji yang digunakan adalah udang putih berukuran 38+2 g yang merupakan hasil domestikasi oleh BBAP Situbondo. Percobaan dilakukan
dua tahap yaitu percobaan 1 dan percobaan 2.
A. Percobaan 1
Sebelum dilakukan percobaan 1, dilakukan studi pendahuluan. Studi pendahuluan ini dilakukan untuk mengetahui kisaran dosis hormon estradiol-17$ yang dapat ditolerir ole11 induk betina udang put& (Litopenaeus vannamei). Percobaan dilakukan pada induk yang telah diablasi dengan 4 perlakuan tingkat dosis yaitu 0,10 pg/g, 0,25 pg/g, 0,50 pglg dan 1,00 pg/g bobot tubuh. Kisaran dosis yang digunakan didasarkan hasil penelitian sebelurnnya pada Macrobrachiurn rosenbergii (Ghosh dart Ray 1993) dan Penaezls ntonodon (Riani 2001). Jumlah induk pada masing-masing perlakuan adalah 7 ekor. Induk yang telah diberi perlakuan dipelihara dalarn bak beton berukuran 2 ~ 2 x 1 m selama 5 hari. Parameter yang dipantau adalah tingkat kelangsungan hidup induk udang dan perkembangan gonad.
Hasil studi pendahuluan menunjukkan bahwa dosis yang dapat ditolerir oleh udang putih adalah < 0,50 pg/g bobot tubuh (Tabel 1). Pada dosis 0,10 dan 0,25 pg/g menunjukkan tingkat kelangsungan hidup dan perkembangan gonad
yang relatif baik. Berdasarkan hasil tersebut dibuat tingkat dosis estradiol-17B untuk percobaan 1 yaitu 0,05,0,10 dan 0,25 pglg.
Percobaan 1 dilakukan untuk mengetahui pengaruh pemberian hormon estradiol-l7$ terhadap peinatangan gonad induk udang putih dengan ablasi. Selain itu untuk mengetahui dosis optimal dilakukan uji dengan 3 tingkat dosis hormon estradiol-17P yang telah diperoleh pada studi pendahuluan (0,05,0,10 dan 0,25 pglg). Percobaan ini menggunakan rancangan acak lengkap (RAL). Masing- masing perlakuan terdiri dari 15 ekor induk betina berukuran 38
*
2 g, sebagai pembanding dilakukan uji tanpa perlakuan (kontrol). Induk yang telah diberi perlakuan dan kontrol dipelihara dalam bak beton berwarna hitam berukuran 2 ~ 2 x 1 m selama 12 hari. Parameter yang dipantau pada percobaan 1 adalab konsentrasi hormon estradiol-17$ dalam hemolim, perkembangan gonad (morfologi dan histologi), diameter telur dan karakteristik protein vitelogenin (Vg) dan vitelin (Vt). Konsentrasi estradiol-17p dalam hemolim ditentukan pada hari ke-0, 3 , 6 , 9 dan 12. Analisis kematangan gonad secara morfblogi dilakukan setiap hari, sedangkan secara histologi pada setiap tahap perkembaugan gonad. Diameter telur juga ditentukan pada setiap tahap perkembangan gonad. Karakteristik Vg dalam hemolim ditentukan pada beberapa tahap perkembangan gonad, sedangkan karakteristik Vg pada hepatopankreas dan Vt pada ovari ditentukan pada TKG 111.B. Percobaan 2
Percobaan 2 dilakukan untuk mengetahui pengaruh pemberian hormon estradiol-17P terhadap kecepatan perkembangan gonad pada induk udang tanpa ablasi. Percobaan ini menggunakan RAL dengan 2 perlakuan frekuensi penyuntikan hormon. Dosis yang digunakan adalah dosis optimal yang diperoleh dari percobaan 1 (0,lO pg/g bobot tubuh) dengan penyuntikan satu kali dan dua kali. Penyuntikan kedua dilakukan pada hari ke-6 setelah penyuntikan pertama. Penyuntikan dua kali dilakukan agar pemaparan honnon kontinyu dan lebih lama. Sebagai pembanding dilakukan uji tanpa perlakuan honnon (kontrol). Kontrol dan setiap perlakuan terdiri dari 15 ekor induk udang putih betina berukuran 38
+
2 g. Induk dipelihara dalam beton berwarna hitam berukuran 2 ~ 2 x 1 m selama 12hari. Parameter yang dipantau pada percobaan 2 adalah konsentrasi hormon estradiol-17p dalam hemolim, perkembangan gonad (morfolog dan histologi), tingkat kelangsungan hidup dan pertumbuhan induk, gonado somatic index (GSI) atau ovarian index (OI), hepato somatic index (HSI) dan diameter oosit. Konsentrasi estradiol-17P dalam hemolim ditentukan pada hari ke-0, 3, 6, 9 dan 12. Kelangsungan hidup dan pertumbuhan induk ditentukan pada
akhir
percobaan. Perkembangan gonad, GSI dan HSI ditentukan pada awal percobaan berdasarkan sampling dan setiap individu pada akhir percobaan. Diameter oosit ditentukan pada setiap individu yang disampling dan mengalami perkembangan gonad.Metode Pengukuran
a. Peneraan hormon estradiol-17$ pada hemotim
Hemolirn diambil sebanyak 150
pL
melalui pangkal kaki jalan kelima rnenggunakan syringe tuberculline (1 ml) yang telah dibilas dengan larutan antikoagulan (3,8% natrium sitrat dalam larutan isotonik). Hemolirn disenhikse pada 3000 rpm, suhu 4' C selama 20 menit kemudian disimpan pada suhu -20" C hingga saat analisis.Analisis kandungan hormon dalam hemolim dilakukan sesuai prosedur Coat-A-Count Estradiol-178. Prosedur Coat-A -Count Estradiol-178 berdasarkan pengkatan antibodi. Estradiol-17P yang telah diberi label akan bersaing dengan estradiol-17$ dalarn sampel untuk berikatan dengan antibodi. Setelah diinkubasi selama 3 jam pada suhu ruang, sampel didekantasi. Estradiol-17B yang telah berlabel diukur dengan gamma counter. Jumlah estradiol-17P di dalam sampel ditentukan dengan cara membandingkan jumlah count yang diperoleh dengan kurva kalibrasi.
b. Peneraan indeks maturasi (maturation Wex/MI)
Indek maturasi ditentukan berdasarkan persamaan berikut (Alfaro ef a/.
Induk TKG 111 & IV
2004): MI (?/+ x 100
Total induk
c. Peneraan gonado somatic index (GSI) atau ovarian index (01) dan hepato somatic index (HSI).
Pada waktu pantau (awal dan akhir percobaan), sampel induk yang telah ditimbang dibedah untuk dikeluarkan gonad dan hepatopankreasnya. Gonad dan hepatopankreas diletakkan pada kertas tisue selanjutnya ditirnbang dengan timbangan digital. Indeks Ovari / ovarlan ~ n d u (01) ditentukan dengan rumus (Longyant et al. 2003):
bobor gonad
(;.TI 1 0 1 (Yo) = x l 0 0 hohor rlrbrrh
H e p t ~ .vornut~c index ( H S I ) ditentukan dengan rumus
hohor hepuropankrra.~
H S I ( %) = xl00 hobor ruhuh
Gonad yang telah ditimbang difiksasi dalam larutan Davidson selama 24 jam selanjutnya dimasukkan ke dalam botol sampel yang berisi alkohol70%. d. Peneraan tingkat kematangan gonad
Tingkat kematangan gonad ditentukan secara morfologi yang didasarkan pada perubahan bentuk dan warna ovari, adapun tahapan tingkat kematangan gonad (ovari) L. vannamei adalah sebagai berikut (Yano 1988 yang diacu dalam Vaca dan Alfaro 2000):
Tahap I. Gonad transparan dan belum dapat dibedakan
Tahap 11. Gonad mnulai tampak menyerupai garis tipis sepanjang dorsal Tahap Ill. Gonad tampak lebih tebal dan berwama kuning
Tahap IV. Gonad tampak besar , melebar dan berwania orange tua.
Selain berdasarkan morfologi, tingkat kematangan gonad P. vunrzamei juga ditentukan berdasarkan analisis histologi gonad. Gonad yang telah difiksasi didehidmsi dengan etanol dan dijemihkan dengan kloroform. Contoh gonad kemudian diembeding dalam campuran parafin- paraplas selanjutnya dipotong menggunakan mikrotorn dengan ketebalan 5 pm dan diberi warna dengan pewarna hematoxylin-eosin. Preparat histologi diamati dengan mikropkop cahaya untuk ditentukan sebaran oosit pada berbagai tingkat perkembangan gonad. Adapun kriteria tahap perkembangan gonad udang P. vannamei adalah s e b a e berikut (Medina et al. 19%):
1 . Tahap 1 (previtellogenic)
2. Tahap 2 (awal vifellogenic)
Pada ovari tampak oosit pada tahap awal vitelogenesis dan sitoplasma mengalami peningkatan ukuran secara signifikan.
3. Tahap 3 ( Akhir vitellogenic)
Ovari mengandung oosit yang ukurannya besar dengan sitoplasma yang telah terisi oleh butiran kuning telur.
4. Tahap 4 ( matang)
Pada ovari banyak terdapat oosit yang telah matang sempurna yang dicirikan dengan terbentuknya struktur protein cortical rods. Selain terdapat batasan yang jelas antara sitoplasma dengan sel bagian tepi. 5. Tahap 5 ( Spent1 degenerasi)
Pada ovari sebagian besar oositnya mengalami atresia (degenerasi). e. Peneraan kelangsungan hidup induk
Tingkat kelangsungan hidup induk ditentukan berdasarkan persamaan SR (%) = (Nt/No) x 100
SR = Survival rote (tingkat kelangsungan hidup) No = Jurnlah individu pada waktu
t-O
Nt = Jumlah individu pada waktu t f. Peneraan pertumbuhan
Parameter pertumbuhan diukur berdasarkan laju pertumbuhan spesifik
(specific growth rate - SGR) yang tentukan dengan persamaan : SGR = 100(ln W 2 -
In
W 1 ) / TSGR = Laju pertumbuhan spesifrk (glhr)
W 1 = Bobot induk pada pengamatan pertama (g) W2 = Bobot induk pada pengamatan kedua (g)
T = Periode waktu pengukuran
Bobot induk ditentukan dengan menimbang masing-masing induk dengan timbangan digital. Penimbangan dilakukan pada kondisi basah.
g. Peneraan diameter oosit
Gonad yang mengandung oosit dimasukkan ke dalam lamtan formaldehide 5% selama dua hari untuk memperkuat dan menstabilkan oosit serta memisahkan oosit satu sama lainnya. Pengukuran oosit untuk setiap
perkembangan gonad dilakukan pada bagian depan, tengah dan belakang. Penentuan diameter oosit dilakulian dengan mengukur diameter 100 butir telur kemudian dibuat sebaran fiekuensi dan dismbusi normalnya. Pemeriksaan oosit dilakukan di bawah mikroskop binokuler yang dilengkapi dengan mikrometer dengan ketelitian 0,8 mikron. Pada percobaan 2, penentuan diameter oosit dilakdan secara histologis.
h. Peneraan karakteristik protein Vg dan protein kuning telur (Vt)
Karakteristik protein Vg dan protein kuning telur (Vt) ditentukan pada beberapa induk dengan TKG berbeda. Karakteristik Vg ditentukan berdasarkan sampel dari hepatopankreas dan, hemolim sedangkan Vt ditentukan berdasarkan sampel ovari.
-
Ekstrak hemolimHemolim diambil pada pangkal kaki jalan ke-5 menggunakan spuit berukuran 1 ml yang telah dibilas dengan natrium sitrat 3,8%. Sampel hemolim disentrifbse (10.000 g, 4 "C) selama 10 menit. Supernatan kemudian disimpan pada suhu -20 O C untuk selanjutnya dianalisis pola proteinnya.
-
Ekstrak ovari dan hepatopankreasOosit yang berasal dari ovari dan hepatopankreas ditambah larutan buffer (0,05
M
Tris, ), 5 M NaCl dan 5 mh4 E T A (pH 7) dengan perbandingan 0,l d l gram. Campuran selanjutnya dihomogenkan dengan homogenizer..
.
Sampel dipurifikasi dengan amonium sulfat. Hasil endapan diencerkan lagi dengan buffer (100 p1) dan disentrifuse (10.000 g, 4 OC) selama 15 menit. Supernatan kemudian di simpan pada suhu -20 untuk dianalisis pola proteinnya.
-
ElektroforesisUntuk identifikasi protein dilakukan separasi dengan non-denaturasi (Native- PAGE) pada 5 % gel poliakrilamid dalam buffer Tris-glisin (pH 8.3). Identifikasi sub unit vitelin dilakukan dengan sodium dodecyl sulfate polyaciyfamide gel electrophoresis (SDS-PAGE: 7 3 % gel poliakrilamida)
(Laernmli 1970). Untuk N-PAGE, gel diwarnai dengan arnidoblack, sedangkan untuk SDS-PAGE, gel diwarnai dengan 1% coomasie brilliant blue R250. Bobot protein ditentukan dengan meinbandingan jarak pergerakan
Volume penyuntikan adalah adalah 100 pL/induk dengan konsentrasi sesuai desain perlakuan. Pada kelompok induk yang diablasi, pemberian dilakukan 3 hari setelah ablasi.
4. Pemeliharaan induk
Setelah disuntik dengan estradiol-17P, udang uji ditempatkan kembali dalam wadah percobaan. Air pemeliharaan berasal dari laut yang telah di saring dengan salinitas 32-33 ppt dan temperatur 27-28 OC (Arcos el al. 2003). Selama pemelihman induk diberi pakan 5 kali perhari sebesar 15-20% biomas dengan komposisi 40 % cumi, 40% kerang, 15% polychaeta dan 5% pelet (Taylor et a/. 2004). Agar kondisi kualitas air tetap baik, pemeliharan dilakukan dengan sistim flow through. Debit air yang digunakan adalah 5-7 liter per menit. Selain itu dilakukan aerasi dan kotoran yang ada di dasar bak dibersihkan setiap hari dengan c m disifon. Untuk mengurangi pencahayaan, di atas bak diberi shelter daun kelapa.
Analisis Data
1. Uji tingkat perbedaan kecepatan matang gonad, GS1, HSI, diameter telur, dan kandungan hormon dilakukan dengan analisis satu arah antar perlakuan. Apabila signifikan dilakukan uji Tukey dengan, tingkat kepercayaan 95%.
2. Parameter utama sebagai penguji hipotesis adalah kecepatan matang gonad, HSI, GSI, diameter sel telur dan kandungan hormon. Analisis ditujukan pada pengujian untuk melihat hubungan a n t m dosis pemberian hormon (estradiol-17J3) dengan perkembangan gonad.
3. Profil hormon estradiol-179 dianalisis secara deskriptif berdasarkan tren pada grafik.
4. Karakteristik vitelogenin dianalisis secara deskriptif berdasarkan pola pita protein dan berat molekulnya.