P
P
a
a
n
n
d
d
u
u
a
a
n
n
P
P
r
r
a
a
k
k
t
t
i
i
k
k
u
u
m
m
P
P
E
E
N
N
G
G
A
A
W
W
A
A
S
S
A
A
N
N
M
M
U
U
T
T
U
U
H
H
A
A
S
S
I
I
L
L
T
T
E
E
R
R
N
N
A
A
K
K
Tim Pengampu Mata Kuliah:
Prof. Dr. Ir. Harapin hafid, M.Si. Fitrianingsih, S.Pt, M.Sc.
Drh. Yamin Yaddi
Drh. Purnaning Dhian Isnaeni
FAKULTAS PETERNAKAN
UNIVERSITAS HALU OLEO
P
P
a
a
n
n
d
d
u
u
a
a
n
n
P
P
r
r
a
a
k
k
t
t
i
i
k
k
u
u
m
m
P
P
E
E
N
N
G
G
A
A
W
W
A
A
S
S
A
A
N
N
M
M
U
U
T
T
U
U
H
H
A
A
S
S
I
I
L
L
T
T
E
E
R
R
N
N
A
A
K
K
Tim Pengampu Mata Kuliah:
Prof. Dr. Ir. Harapin hafid, M.Si. Fitrianingsih, S.Pt, M.Sc.
Drh. Yamin Yaddi
Drh. Purnaning Dhian Isnaeni
FAKULTAS PETERNAKAN
UNIVERSITAS HALU OLEO
P
P
a
a
n
n
d
d
u
u
a
a
n
n
P
P
r
r
a
a
k
k
t
t
i
i
k
k
u
u
m
m
P
P
E
E
N
N
G
G
A
A
W
W
A
A
S
S
A
A
N
N
M
M
U
U
T
T
U
U
H
H
A
A
S
S
I
I
L
L
T
T
E
E
R
R
N
N
A
A
K
K
Tim Pengampu Mata Kuliah:
Prof. Dr. Ir. Harapin hafid, M.Si. Fitrianingsih, S.Pt, M.Sc.
Drh. Yamin Yaddi
Drh. Purnaning Dhian Isnaeni
FAKULTAS PETERNAKAN
PANDUAN PRAKTIKUM
PENGAWASAN MUTU HASIL TERNAK
TIM PENGASUH PRAKTIKUM
JURUSAN PETERNAKAN
FAKULTAS PETERNAKAN
UNIVERSITAS HALU OLEO
TIM PENGAJAR MATA KULIAH:
Prof. Dr. Ir. H. Harapin Hafid, M.Si PenanggungJawab
Fitrianingsih, S.Pt, M.Sc Anggota Tim
drh. Yamin Yaddi Anggota Tim
HALAMAN PEGESAHAN
Mata Kuliah : Pengawasan Mutu Hasil Ternak
Penanggung Jawab :
Nama : Prof. Dr. Ir. Harapin Hafid, M.Si NIP : 19670511 199303 1 005
Anggota Tim :
1. Nama : Fitrianingsih, S.Pt, M.Sc NIP : 19890625 201504 2 002 2. Nama : Drh. Yamin Yaddi
NIP : 19850710 201504 1 002 3. Nama : Drh. Purnaning Dhian Isnaeni
NIP :
Tempat Praktikum : Laboratorium Ilmu Teknologi dan Produksi Ternak
Lama Praktikum : 3 kali praktikum
Kendari, 2 Maret 2017
Mengetahui, Penanggung Jawab Mata Kuliah, Ketua Jurusan Peternakan,
KATA PENGANTAR
Syukur Alhamdulillah Penulis panjatkan kehadirat Allah SWT karena berkat kehendak dan Rahmat- Nya sehingga Panduan Praktikum Pengawasan Mutu Hasil Ternak dapat tersusun.
Panduan ini disusun dari berbagai literatur yang berkaitan dengan Ilmu Pengawasan Mutu Hasil Ternak. Kehadiran buku panduan ini diharapkan menjadi petunjuk bagi mahasiswa Program Studi Peternakan dalam melaksanakan praktikum. Dengan demikian pelaksanaan praktikum dapat berjalan dengan lancar dan terarah.
Kepada Anggota Tim Penyusun, ibu Fitrianingsih, S.Pt, M.Sc, drh. Yamin Yaddi, dan drh. Purnaning Dhian Isnaeni yang sudah berkerja dengan baik membantu dengan penuh kreativitas dan kesungguhan dalam penyusunan panduan praktikum ini, diucapkan terimakasih. Semoga buku panduan ini bisa bermanfaat bagi mahasiswa yang menggunakannya, dan segala saran kontruktif untuk penerbitannya kedepan akan penulis terima dengan senang hati. Semoga capaian ini mendapat berkah dan bernilai pahala disisi Allah Subhanahu Wata’ala. Amiin.
Kendari, Maret 2017
Ketua Tim Penyusun/Penanggung Jawab MK.
DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
I. PRAKTIKUM PEMERIKSAAN KUALITAS DAGING A. Latar Belakang ... 1
B. Tujuan ... 1
C. Luaran. ... 1
D. Materi Praktikum ... 1
E. Langkah Kerja dan Jadwal Praktikum ... 2
II. PRAKTIKUM PEMERIKSAAN KUALITAS TELUR A. Latar Belakang ... 11
B. Tujuan ... 11
C. Luaran. ... 11
D. Materi Praktikum ... 11
E. Langkah Kerja dan Jadwal Praktikum ... 11
III. PRAKTIKUM PEMERIKSAAN KUALITAS SUSU Pemeriksaan Keadaan Susu A. Latar Belakang ... 16
B. Tujuan ... 16
C. Luaran. ... 16
D. Materi Praktikum ... 17
E. Langkah Kerja dan Jadwal Praktikum ... 17
Pemeriksaan Komposisi Susu A. Latar Belakang ... 22
B. Tujuan ... 23
C. Luaran. ... 23
D. Materi Praktikum ... 23
E. Langkah Kerja dan Jadwal Praktikum ... 23
FORMAT LAPORAN ... 27
I. PRAKTIKUM PEMERIKSAAN DAGING
A. Latar Belakang
Daging merupakan salah satu sumber protein hewani yang penting. Menurut SNI 3932:2008, pengertian daging adalah bagian otot skeletal dari karkas sapi yang aman, layak, dan lazim dikonsumsi oleh manusia, dapat berupa daging segar, daging segar dingin, atau daging beku. Selain itu daging juga berpotensi menularkan penyakit karena daging mengandung zat-zat yang berguna bagi perkembangan mikroorganisme penyakit, sehingga pemeriksaan kualitas daging mempunyai kedudukaan yang penting bagi kesehatan.
B. Tujuan
Mahasiswa dapat mengetahui cara melakukan pemeriksaan kualitas daging.
C. Luaran
Mahasiswa memiliki kemampuan pemeriksaan kualitas daging dengan metode yang telah dipraktikkan.
D. Materi Praktikum
Alat
- Cawan porselen - Penangas air
- Tabung erlenmeyer dengan sumbat karet yang diberi pengait/kawat - Cawan petri dengan diameter 100 mm
- Alat bor daging
- Warner – Bratzler Shear - kertas saring
- 2 plat kaca
- alat pemberat 35 kg.
- waterbath suhu 95oC dan 20oC - kaleng dan pembuka kaleng - saringan
- mangkok
- tabung reaksi 10 ml - pipet drop
- timbangan digital - mortar
- gelas objek - mikroskop - pipet berskala - balb pipet
Bahan
- sampel daging sapi/daging ayam - Larutan HCl
- Alcohol 96% - Ether - Asam laktat - Kertas lakmus - Kertas saring - adonan sosis - bakso - KMnO4 1 N
- Aquadest
- KIT test Boraks (easy test boraks) - Kunyit
- Tusuk gigi - Methilen blue - Asam sulfat pekat - Methanol/Ethanol
E. Langkah Kerja dan Jadwal Praktikum
1. Pemeriksaan Organoleptis
Uji dilaksanakan dengan cara membau contoh daging (sekurang-kurangnya dilakukan 24 jam setelah hewan dipotong)
Pemeriksaan bau dan rasa dapat dibuktikan dengan cara pemanasan contoh daging pada suhu ±160oC.
Penciuman dilakukan dengan mulut tertutup. Pemeriksaan sebaiknya tidak dilakukan pada tempat pemeriksaan bakteriologis.
Pemeriksaan dilakukan dengan 3 cara, yaitu :
2. Uji cair : lemak dipotong kecil-kecil sebanyak 20 gram dan dicairkan dalam cawan porselin di atas penangas air. Kemudian dicium baunya dan biarkan beku kembali.
3. Uji didih : didihkan air dalam bejana tertutup kemudian masukkan daging setebal 2 cm. Tutup diangkat dan dicium baunya. Kemudian daging dikeluarkan disayat dan dicium baunya.
2. Pemeriksaan awal pembusukan
Pada pembusukan daging terjadi perubahan kimiawi sehingga terbentuk gas NH3 dan H2S. hal ini dapat dibuktikan dengan beberapa pemeriksaan, salah
satunya yaitu uji Eber. Gas NH3 yang keluar dari potongan daging akan
berikatan dengan HCl dari reagen Eber dan akan membentuk embun NH4Cl.
-Uji Eber (pemeriksaan NH3)
Cara membuat reagen Eber: mencampurkan larutan HCl, alcohol 96%, dan eter dengan perbandingan 1 : 3 : 1.
Cara uji Eber :
• Sebanyak 5 ml reagen Eber dituangkan ke dalam tabung
• Tusukkan sepotong kecil contoh daging pada ujung kawat atau lidi pada sumbat tabung
• Tutupkan sumbat yang telah ditusukkan daging tersebut ke tabung yang berisi reagen sedemikian rupa sehingga daging tersebut tergantung di atas permukaan reagen
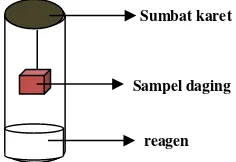
Gambar 1 Posisi sampel daging pada uji Eber
Penilaian : Hasil positif dinyatakan dengan terbentuknya kabut NH4Cl yang
berarti terjadi awal pembusukan. Hasil negatif dinyatakan dengan tidak terbentuknya kabut NH4Cl tetapi tidak berarti bahwa contoh daging dalam
keadaan tidak busuk.
Sampel daging Sumbat karet
reagen
Gambar 2 Hasil uji Eber negatif (A) dan Hasil Uji Eber positif (B) (Dengen 2015)
3. Pemeriksaan keempukan
Metode Warner – Bratzler : metode ini sangat sering digunakan untuk mengukur keempukan daging. Sampel yang diperiksa biasanya dimasak terlebih dahulu. Beberapa cara memasak yang biasa digunakan adalah:
-Digoreng
• Jika sampel dalam keadaan beku, maka defrost sampel sampai 38oF
• Sampel daging digoreng dalam minyak dengan suhu 300oF
• Tunggu sampai suhu internal sampel mencapai :
Suhu 170oF pada daging sapi dengan ketebalan 0,75 inchi Suhu 155oF pada daging sapi/babi dengan ketebalan 0,5 inchi
• Masukkan ke dalam oven yang telah dipanaskan pada suhu 200oF selama 5 menit
-Dipanggang atau di ‘grill’
• Jika sampel dalam keadaan beku, maka defrost sampel sampai 38oF
• Sampel daging dengan ketebalan 0,75 inchi dipanggang/grill pada suhu 100oF selama 30 menit
-Direbus dengan sedikit air
• Jika sampel dalam keadaan beku, maka defrost sampel sampai 38oF
• Sampel daging dengan ketebalan 0,75 inchi direbus selama 45 menit atau tunggu hingga suhu internal mencapai 100oF (biasanya selama 20 menit, tergantung ketebalan sampel)
Perlakuan sampel
• Sampel dibor dengan alat yang sudah tersedia sejajar dengan serat sampel. Sampel daging sapi/babi dibor 1 inchi di 3 lokasi (medial, sentral, dan lateral). Masing-masing lokasi sebanyak 3 sampel.
• Sampel daging yang sudah berupa silinder kemudian diukur daya putusnya menggunakan Warner – Bratzler Shear.
Gambar 3 Alat bor daging dan mata bor (Wheeler et al, 2015)
Gambar 4 Cara mengukur daya putus daging menggunakan Warner – Bratzler Shear (Wheeler et al, 2015)
Penilaian
Keempukan yang diterima adalah 7,5 – 10 kg per inchi sampel
4. Pemeriksaan pH
- Metode kertas lakmus
Gambar 5 Kertas lakmus sumber : https://www.google.co.id
- Metode elektrometris (dengan pH meter)
Timbang sampel daging sebanyak 5 – 10 gram kemudian masukkan ke dalam mortal yang telah diberi aquades sebanyak 5 – 10 ml. gerus sampai halus lalu ukur pHnya. Bersihkan tabung pada pH meter dan ditera pada pH 4 atau 7. Masukkan larutan daging ke dalam tabung elektroda kemudian lihat pHnya.
Gambar 6 pH meter. Sumber : https://www.google.co.id
Hasil pemeriksaan ekstrak daging :
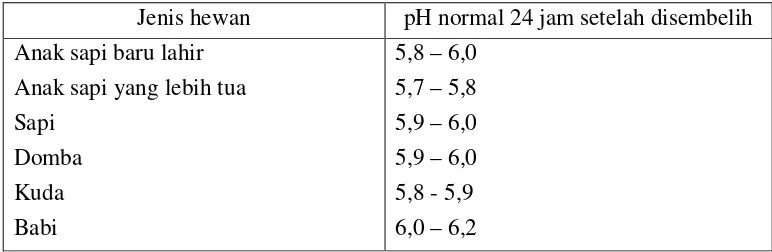
• Pada hewan sehat umumnya pHnya adalah
pH normal ekstrak daging saat disembelih adalah 6 -7. Dalam 24 jam setelah disembelih pH akan menurun dan akan berlangsung selama beberapa hari. Penurunan pH tidak sama semua jenis daging atau hewan.
Keterangan :
1-6 : asam
7 : netral
Tabel 1 pH normal daging setelah disembelih berdasarkan jenis hewan
Jenis hewan pH normal 24 jam setelah disembelih Anak sapi baru lahir
Anak sapi yang lebih tua Sapi
Domba Kuda Babi
5,8 – 6,0 5,7 – 5,8 5,9 – 6,0 5,9 – 6,0 5,8 - 5,9 6,0 – 6,2
Sumber : Sumber : Prawesthirini et al. 2009)
• Pada hewan sakit tidak terlihat penurunan pH dalam 48 – 72 jam sesudah penyembelihan.
5. Pengukuran daya ikat air oleh protein daging dan pengukuran susut masak a.Pengukuran daya ikat air oleh protein daging
Daya ikat air oleh protein adalah kemampuan daging untuk mengikat airnya atau air yang ditambahkan selama ada pengaruh dari luar misalnya pemotongan daging, pemanasan, penggilingan, dan tekanan.
Cara pengukuran daya ikat air oleh protein daging antara lain :
• Metode Graw dan Hamm (1972)
Prinsipnya : dengan melakukan pengepresan pada tekanan tertentu maka air akan dilepaskan ke kertas saring yang digunakan untuk pengepresan. Cairan pada kertas saring membentuk lingkaran yang jumlahnya sama dengan air yang tidak terikat pada bahan.
Alat : kertas saring, 2 plat kaca, alat pemberat 35 kg. Cara kerja :
- Ambil sampel daging sebanyak 0,3 gram
- Tekan sampel daging dengan alat pemberat pada kertas saring diantara 2 plat kaca selama 5 menit
- Area basah diukur dalam cm2 (area basah diukur dengan mengurangi area total dengan area yang tertutup sampel daging).
- Kandungan air sampel daging dihitung menggunakan rumus sebagai berikut:
Mg H2O =
( )
• Metode Gheong dan Fischer (1970) dengan cara sentrifuse
Pada prinsipnya air yang tidak terikat dalam daging akan dilepaskan pada saat pemanasan dan sentrifugasi. Jumlah air yang terpisah dari daging sama dengan jumlah air yang hilang waktu masak (daya ikat air oleh protein daging).
Cara kerja :
- Timbang 20 gram sampel daging dan masukkan dalam tabung sentrifuse khusus untuk pengukuran daya ikat air oleh protein kemudian ditutup. - Panaskan pada suhu 70oC selama 30 menit kemudian dinginkan selama 5
menit.
- Sentrifuse dengan kecepatan 1000 rpm.
- Air yang terpisah kemudian dibaca menggunakan skala yang terdapat dalam dinding tabung sentrifuse.
- Cara menghitung daya ikat air total :
Daya ikat air total = (1 – jumlah air yang memisah ) x 100%
b. Pengukuran susut masak
Prinsipnya lemak dan air yang tidak terikat dengan baik pada daging akan dilepaskan dalam proses pemanasan.
Alat : 2 waterbath suhu 95oC dan 20oC, kaleng dan pembuka kaleng, saringan dan beberapa mangkok.
Cara kerja :
- Timbang kaleng kosong lalu isi dengan adonan sosis sebanyak 250 gram - Kaleng ditutup kemudian dimasak atau disterilisasi
- Dinginkan
- Kaleng dan isinya ditimbang dan dimasukkan ke dalam waterbath 95oC selama 45 menit
- Kaleng diangkat dan dipindahkan ke waterbath 20oC selama 2 menit - Siapkan mangkok dan timbang. Letakkan saringan diatas mangkok - Buka kaleng dengan hati-hati (usahakan air tidak tumpah), kemudian isi
kaleng dituang pelan-pelan ke penyaring dan tiriskan selama 20 menit - Timbang cairan yang ada di dalam mangkok
% susut masak = ! " (# () ) x 100%
6. Pemeriksaan penambahan zat pengawet pada daging a.Uji kualitatif penambahan formalin (Saputro 2014) :
Prinsipnya formalin/formaldehid dapat mereduksi KMnO4 yang awalnya
warna merah muda menjadi pudar. Cara kerja :
- Isi tabung reaksi A dengan aquadest sebanyak 2 ml
- Tambahkan 1 tetes KMnO4 1 N lalu aduk sampai homogen
- Isi tabung reaksi B dengan aquadest 10 ml
- Masukkan sampel yang telah dilumatkan sebanyak 5 gram lalu aduk sampai homogen
- Saring larutan B dengan kertas saring
- Masukkan filtrat larutan B ke dalam tabung A
- Tunggu 30 menit. Jika warna merah jambu pudar, maka sampel tersebut positif mengandung formalin.
b.Penambahan boraks
• Cara kerja dengan KIT test boraks:
Gambar 7 Reagen Easy Test (Widayat 2011).
- Ambil 5 gram sampel kemudian haluskan menggunakan mortar - Letakkan pada gelas beker
- Tambahkan 5 ml air mendidih lalu aduk sampai homogen. Biarkan dingin. - Tambahkan 5 ml HCl
- Tambahkan 4 tetes reagen boraks (KIT test boraks) lalu diaduk sampai homogen.
- Kertas uji diangin-anginkan kemudian diamati bagian yang tercelup
- Sampel positif mengandung boraks apabila warna kertas uji berubah dari kuning menjadi merah bata.
Gambar 8 Warna kertas uji positif (A) dan warna kertas uji negatif (B) (Widayat 2011).
• Uji nyala api
- Pada cawan porselen masukkan bahan yang akan diuji - Tambahkan 1 ml asam sulfat (H2SO4) pekat
- Tambahkan 5 ml methanol atau ethanol - Bakar dengan api
- Hasil positif ditunjukkan dengan nyala api dengan pinggiran berwarna hijau.
7. Pemeriksaan mikrobiologi umum
Prinsip: Hewan yang disembelih secara higienis, pada dagingnya tidak akan mengandung mikroba. Pemeriksaan ini bertujuan untuk mengetahui ada atau tidaknya bakteri pada daging, sehingga akan mempengaruhi penilaian akhir. Terdapat dua metode yang dapat dilakukan, yaitu metode sentuhan dan metode media pertumbuhan bakteri.
Cara kerja metode sentuhan:
- Kupas permukaan daging kemudian potong daging berbentuk kubus - Bakar/panasskan permukaan daging di atas api Bunsen
- Belah daging menjadi dua bagian dengan menggunakan pisau steril
- Tekan kedua permukaan dalam daging ke gelas objek steril dan bebas lemak - Keringkan gelas objek dengan cara diangin-anginkan
- Warnai gelas objek dengan methilen blue
- Lihat di bawah mikroskop dengan pembesaran 1000X dengan menggunakan minyak emersi
- Lakukan penilaian sebagai berikut:
• Pada daging segar biasanya tidak didapakan bakteri
• Pada permulaan pembusukan tidak selalu terlihat bakteri dalam jumlah besar
II. PRAKTIKUM PEMERIKSAAN TELUR
A. Latar Belakang
Telur merupakan salah satu sumber protein yang penting bagi manusia dan harganya relative murah. Berdasarkan SNI 3926:2008 telur ayam konsumsi merupakan telur ayam yang belum mengalami proses fortifikasi, pendinginan, pengawetan, dan proses pengeraman. Karena kandungan telur yang baik untuk manusia, perlu dilakukan pengawasan terhadap mutu telur.
B. Tujuan
Mahasiswa dapat mengetahui cara pemeriksaan keadaan fisik telur dan kualitas isi telur.
C. Luaran
Mahasiswa memiliki keterampilan untuk memeriksa keadaan fisik telur dan kualitas telur dengan menggunakan metode yang telah dipraktikkan.
D. Materi Praktikum Alat
- Lempeng kaca - Jangka sorong - Spherometer - Timbangan telur - Yolk colour fan
Bahan
- Telur ayam kampung, - Telur ayam ras - Telur itik
E. Langkah Kerja dan Jadwal Praktikum
1. Pemeriksaan keadaan fisik telur Keadaan fisik telur mencakup :
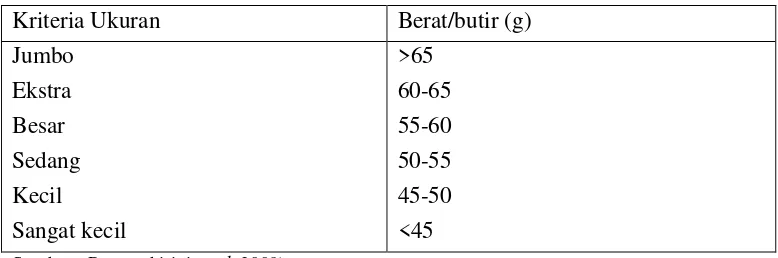
a. Ukuran : berat, panjang, dan lebar b. Warna : putih, agak kecoklatan, coklat c. Kulit : tipis dan tebal
Gambar 9 Bentuk ideal telur (A) dan bentuk abnormal telur (B)
e. Kebersihan kulit : bersih dan kotor
Table 2 Standar mutu telur ayam berdasarkan berat/butir Kriteria Ukuran Berat/butir (g) Jumbo
Ekstra Besar Sedang Kecil Sangat kecil
>65 60-65 55-60 50-55 45-50 <45
Sumber : Prawesthirini et al. 2009)
2. Pemeriksaan kualitas isi telur
Pemeriksaan kesegaran isi telur dapat dilakukan dengan candling (meletakkan telur dalam sorotan sinar yang kuat sehingga memungkinkan pemeriksaan kulit dan bagian dalam telur tanpa memecah telur. Dalam menentukan kualitas telur lama atau baru dapat dilakukan dengan melihat ukuran kantong udara (semakin lebar kantong udara menandakan bahwa telur sudah lama dan telah berkurang mutu isinya), ada tidaknya embrio dalam telur (terlihat adanya pembuluh darah dan bentukan padat hitam.
Candling dapat menentukan :
Keretakan kulit telur, ukuran dan gerakan kuning telur, ukuran kantong udara,
blood spot/meat spot, kerusakan mikroorganisme, dan pertumbuhan benih. Kelemahan cara candkling adalah hanya dapat mengetahui kerusakan yang menonjol saja
A
Kesegaran isi telur juga dapat dinilai dengan melihat kondisi kuning telur dan putih telur yang kental berada dalam keadaan membukit apabila telur dipecah dan isinya diletakkan pada permukaan datar dan halus (misanya kaca). Mengukur tinggi kuning dan ketebalan putih telur dapat menggunakan mikrometer.
Gambar 10 Cara mengukur menggunakan micrometer (USDA)
Cara ini dapat untuk mengukur : c.Indeks kuning telur (yolk index)
d.Warna kuning telur (dapat menggunakan “yolk colour fan”) e.Indeks putih telur (albumin index)
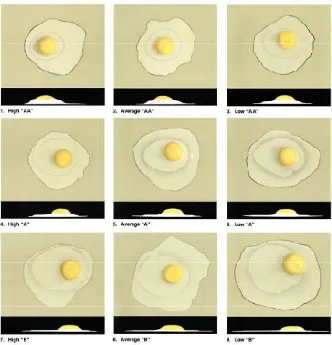
Gambar 11 Perbandingan kualitas isi telur (indeks kuning telur, indeks putih telur, dan haughunit
(http://www.ams.usda.gov/AMSv1.0/getfile?dDocName=STELDE V3004502)
- Telur dengan kualitas paling baik (1-3) : (1) telur kualias ‘AA’ tinggi; (2) telur kualias ‘AA’ sedang; (3) telur kualias ‘AA’ rendah.
- Telur dengan kualitas baik (4-6) : (4) telur kualias ‘A’ tinggi; (5) telur kualias ‘A’ sedang; (6) telur kualias ‘A’ rendah.
- Telur dengan kualitas kurang baik (7-9) : (7) telur kualias ‘B’ tinggi; (8) telur kualias ‘B’ sedang; (9) telur kualias ‘B’ rendah.
ukuran kuning telur akibat perpindahan air (dari putih ke kuning telur). Standar IKT adalah : 0,22 = jelek; 0,39 = rata-rata; 0,45 = tinggi.
Indeks Putih Telur adalah perbandingan – perbandingan putih telur (albumin) kental dengan rata-rata garis tengahnya. Pengukuran dilakukan setelah kuning telur dipisahkan dengan hati-hati. Telur yang baru mempunyai indeks putih telur antara 0,0050 – 0,174 tetapi biasanya berkisar antara 0,090 dan 0,120. Indeks putih telur menurun selama penyimpanan karena pemecahan ovomucin yang dipercepat oleh naiknya pH.
Haugh Unit dinyatakan dengan rumus :
HU = 100 log H – $%(30 ( ,)*− 100 + 1,9 100
atau : HU = 100 log (H + 7,57 – 1,7 W 0,37)
Keterangan :
H : tingi putih telur W : berat telur G : 32
III. PRAKTIKUM PEMERIKSAAN KUALITAS SUSU
Pemeriksaan Keadaan Susu
A. Latar Belakang
Susu merupakan salah satu komoditas peternakan yang penting. Susu merupakan sumber protein hewani yang dibutuhkan dalam pertumbuhan dan perkembangan tubuh serta dalam menjaga kesehatan. (BSN, 2011). Keadaan susu dapat dilihat secara fisik yang meliputi kondisi organoleptik, kebersihan, titik beku, berat jenis dan mikrobiologis susu.
Susu segar dapat diolah menjadi beberapa produk susu yang dapat disimpan lebih lama sehingga nilai ekonominya dapat dipertahankan, antara lain susu pasteurisasi dan susu UHT (Ultra High Temperature). Menurut SNI 01-3951-1995, susu pasteurisasi adalah susu segar, susu rekonstitusi, susu rekombinasi yang telah mengalami proses pemanasan pada 22 omogeny 22 22 22 63oC – 66oC selama minimum 30 menit atau pada pemanasan 72oC selama minimum 15 detik, kemudian segera didinginkan sampai 10oC, selanjutnya diperlakukan secara aseptis dan disimpan pada suhu maksimum 4,4oC. Sedangkan menurut SNI 01-3950-1998 susu UHT (Ultra High Temperature) adalah produk susu yang diperoleh dengan cara mensterilkan susu minimal pada suhu 135oC selama 2 detik, dengan atau tanpa penambahan bahan makanan dan bahan tambahan makanan yang diijinkan, serta dikemas secara aseptik.
Sebagai bahan pangan asal hewan, susu termasuk dalam bahan pangan yang mudah rusak (perishable food), sehingga diperlukan pengawasan terhadap mutu susu.Untuk menjaga susunan dan keadaan susu, diperlukan adanya kewaspadaan dan peraturan-peraturan untuk menjaga mutu, kemurnian dan kesehatan susu tersebut dalam mata rantai produksi dan peredarannya di pasaran (Arka,1988).
B. Tujuan
Mahasiswa dapat mengetahui cara memeriksa keadaan fisik susu dan kualitas susu secara cepat
C. Luaran
D. Materi Praktikum Alat
- Tabung reaksi
- Tabung reaksi 25 ml dengan penyumbat - Kertas putih
- Tabung Erlenmeyer 250ml, 500ml - Corong dan botol
- Kertas saring - Standar besi - Penjepit kayu - Penangas air - Api Bunsen
- Tabung ukur 250 ml - Laktodensimeter - Gelas ukur 250 ml - Thermometer
- Pipet steril 0,5 ml, 1 ml, dan 20 ml
- Tabung reduktase steril dengan penyumbat. - Tabung katalase steril
- Kapas untuk penyumbat - Inkubator
- Lavibond tintometer
Bahan
- Alcohol 70%
- Larutan methylen blue
larutkan 5 ml larutan pekat methylen biru dengan akuades sampai homogen hingga mencapai 200 ml.
- Susu segar/Susu pasteurisasi - Larutan H2O2 0,5%
- Folin ciocaltean phenol
E. Langkah Kerja dan Jadwal Praktikum
1. Pemeriksaan organoleptis
- Uji warna
Perubahan warna susu menjadi kebiruan terjadi bila ditambahkan air, dan menjadi kemerahan bila terdapat darah di dalam susu yang berasal dari ambing yang radang.
Pengujian dilakukan dengan memasukkan 5 ml susu ke dalam tabung reaksi, kemudian membandingkan warnanya dengan latar belakang kertas putih. Amati warna susu dengan kertas sebagai pembanding warna.
- Uji bau
Susu yang baik memiliki bau yang khas. Perubahan bau susu dapat terjadi karena lemak susu mudah menyerap bau di sekitarnya.
Pengujian dilakukan dengan cara mencium bau susu dan perhatikan bau khasnya.
- Uji kekentalan
Perubahan kekentalan susu akan terjadi apabila susu tercemar kuman dari air, sisa makanan, atau alat-alat pemerah susu sehingga menimbulkan lender pada susu.
Pengujian dilakukan dengan memasukkan 5 ml susu ke dalam tabung reaksi kemudian tabung digoyang perlahan-lahan. Perhatikan sisa goyangan pada dinding tabung, apabila cepat hilang berarti susu tersebut encer.
- Uji rasa
Perubahan rasa susu dapat terjadi akibat adanya perkembangan kuman dalam susu. Rasa pahit terasa bila terdapat kuman pembentuk pepton, rasa tengik akibar kuman asam mentega, dan rasa lobak oleh kuman coli.
Pengujian dilakukan dengan cara mencicipi susu yang sudah dididihkan. Perhatikan perubahan rasa susu.
2. Pemeriksaan derajat keasaman susu secara cepat
Kestabilan koloid protein susu terutama kasein tergantung pada selubung air yang menyelimutinya. Semakin asam susu, maka kestabilan kaseinnya kan berkurang sehingga menyebabkan susu mudah terkoagulasi. Susu yang derajat keasamannya tinggi akan mudah menggumpal bila dididihkan atau ditambah 24omogen.
- Uji didih
- Uji 25omogen
Pemeriksaan dilakukan dengan cara memasukkan 3 ml susu ke dalam tabung reaksi, kemudian ditambahkan alcohol 70% sebanyak 3 ml dan dikocok sampai rata. Percobaan akan menunjukkan nilai positif apabila terdapat gumpalan atau butiran pada dinding tabung.
3. Penetapan berat jenis susu
Di dalam susu terkandung beberapa protein dan karbohidrat susu yang mempengaruhi berat jenis susu. Pemeriksaan berat jenis susu dilakukan menggunakan alat laktodensimeter yang telah ditera pada suhu tertentu. Pemeriksaan berat jenis susu dilakukan dengan langkah-langkah sebagai berikut:
a. Susu diaduk sampai tercampur sempurna, kemudian dimasukkan ke dalam tabung ukur dengan hari-hati agar tidak menimbulkan buih.
b. Masukkan thermometer ke dalam susu untuk mengetahui suhunya. Catat suhu susu.
c. Masukkan laktodensimeter ke dalam susu. Laktodensimeter akan bergerak naik turun, tunggu hingga berhenti dan catat angka yang tertera pada batas permukaan susu. Dua angka yang tertera adalah angka kedua dan ketiga di belakang koma. Contohnya, apabila terbaca 31, maka angka yang didapat adalah 1,031.
d. Percobaan diulang sebanyak tiga kali dengan cara mencelupkan kembali laktodensimeter ke dalam susu dan dibaca ulang angkanya, kemudian dibuat rata-ratanya.
e. Contoh cara penghitungan berat jenis susu adalah sebagai berikut:
Bila suhu yang diperoleh adalah 28oC, skala laktodensimeter rata-rata adalah 31, koefisien pemuaian susu per derajat celcius adalah 0,0002, serta laktodensimeter yang digunakan ditera pada suhu 27oC, maka berat jenis susu adalah
BJ = 28 76 cm Hg = 1 27
4. Pemeriksaan enzimatis a. Uji Reduktase
berwarna. Uji ini dilakukan untuk menentukan adanya kuman di dalam susu secara kualitatif dalam waktu cepat.
Uji reduktase dilakukan dengan cara :
- Sebanyak 0,5 ml larutan methylen biru dimasukkan ke dalam masing-masing tabung reaksi steril
- Contoh susu diaduk sampai rata lalu diambil 20 ml dan dimasukkan ke dalam tabung reaksi
- Tabung disumbat
- Tabung dimasukkan ke dalam 26omogeny26 pada suhu 37 o C - Diperiksa setiap jam sampai warna biru hilang
Penilaian : Waktu reduktase adalah waktu (dalam jam) antara waktu memasukkan tabung ke 26omogeny26 sampai warna biru hilang.
Gambar 12 Hasil uji reduktase
(
http://eprints.upnjatim.ac.id/1360/1/Rudi_Nurismanto_dan_Moch._Dhofir_15-22.pdf)
Tabel 3 Kualitas susu berdasarkan waktu reduksi Waktu Reduksi Kualitas Susu 0 – 20 menit
20 menit – 2 jam 2 – 5 jam
>5 jam
Jelek, diperkirakan mengandung bakteri >20 juta/ml Sedang, diperkirakan mengandung bakteri 4 – 20 juta/ml Baik, diperkirakan mengandung bakteri 0,5 – 4 juta/ml Sangat baik, diperkirakan mengandung bakteri <0,5 juta/ml
b. Uji Katalase
Di dalam susu terdapat enzim katalase yang dibentuk oleh sel leukosit, kuman, reruntuhan se lambing dan zat organis yang membebaskan oksigen dari larutan peroksida. Uji ini dilakukan untuk menentukan adanya kuman di dalam susu secara kualitatif dalam waktu cepat.
Uji ini dilakukan dengan cara :
- Tabung katalase steril diisi dengan susu sebanyak 10 ml - Tambahkan 5 ml larutan H2O2 0,5%
- Diaduk dengan membolak-balik (seperti angka 8) sehingga tidak ada gelembung udara
- Tabung disumbat (pastikan susu ada pada ujung tabung) - Inkubasi pada suhu 37 o C
- Tetapkan volume gas oksigen pada ujung tabung yang terkumpul setelah 3 jam.
Penilaian : angka katalase = jumlah ml gas oksigen yang terkumpul di dalam puncak tabung. Angka maksimal = 3,0
c. Uji Fosfatase
Didalam susu terdapat enzim fosfatase yang akan rusak dengan proses pasteurisasi. Uji ini dilakukan untuk mengetahui apakah proses pasteurisasi susu telah baik dan benar.
- Larutan Penyangga dibuat dengan cara :
Larutkan 1,09 gram disodium phenil fosfat dan 11, 54 gram sodium veronal ke dalam 1 liter aquadest dan ditambahkan 10 ml 27 omogeny 27 27 murni sehingga menjadi 1 liter larutan penyangga. Simpan di lemari pendingin.
Uji fosfatase dilakukan dengan cara :
- Masukkan 10 ml larutan penyangga ke dalam tabung reaksi - Tambahkan 0,5 ml susu yang akan diperiksa, kocok
- Tambahkan 3 tetes chloroform, tutup tabung reaksi, dan letakkan dalam incubator selama 24 jam
- Setelah 24 jam, keluarkan dari 27 omogeny 27 , dinginkan sebentar, kemudian tambahkan 4,5 ml pereaksi Folin ciocaltean phenol, lalu kocok - Biarkan selama 3 menit, kemudian saring menggunakan kertas saring - Ambil 10 ml cairan hasil saringan, tambahkan larutan sodium karbonat,
- Warna yang timbul pada cairan dibandingkan dengan warna pada tintometer
- Setiap pengujian harus dilakukan secara duplo dengan satu tabung control tanpa susu.
Bila warna biru yang muncul melebihi 2,3 unit dari tintometer Lovibond, maka pasteurisasi yang dilakukan pada susu tidak sempurna. Batas maksimumnya adalah 6,0 unit.
Gambar 13 Tintometer Lovibond. Sumber :
Pemeriksaan Komposisi Susu
A. Latar Belakang
Susu merupakan sumber protein dengan mutu yang sangat tinggi, dengan kadar protein dalam susu segar 3.5 %, dan mengandung lemak yang kira-kira sama banyaknya dengan protein. Karena itu, kadar lemak sering dijadikan sebagai tolak ukur mutu susu, karena secara tidak langsung menggambarkan juga kadar proteinnya.
Susunan susu merupakan bahan-bahan yang merupakan bagian dari susu yang meliputi air, lemak, laktosa, bahan kering dan bahan kering tanpa lemak. Pemeriksaan kadar lemak susu terdiri dari beberapa metode tergantung dari bahan susu yang akan diperiksa. Metode Gerber digunakan untuk memeriksa susu penuh (whole milk), metode Siegfield digunakan untuk susu skim, metode Koehler untuk susu krim, metode Babcock untuk susu, mentega atau susu krim.
Pada prinsipnya penambahan H2SO4 pekat pada susu akan melarutkan kasein dan
protein susu yang lain sehingga bentuk 29omogeny lemak susu akan hilang. Amil 29 omogen dan panas akan mencairkan lemak sehingga butir-butir lemak akan menjadi cairan jernih di atas campuran H2SO4 dan susu (Prawesthirini et al. 2009).
B. Tujuan
Mahasiswa dapat mengetahui cara memeriksa komposisi susu menggunakan beberapa metode.
C. Luaran
Mahasiswa memiliki kemampuan untuk memeriksa kandungan susu di lapangan dengan metode yang telah dipraktikkan.
D. Materi Praktikum Alat
- Butyrometer Gerber - Pipet
- Alat sentrifus - Penangas air
Bahan
- Susu penuh (whole milk) - Susu skim
- Susu krim - Mentega
- Larutan isoamilalkohol
E. Langkah Kerja dan Jadwal Praktikum
1. Metode Gerber Cara kerja :
- Butyrometer Gerber berskala 0,0 – 7,0 % ditegakkan pad rak dan diisi H2SO4 91
sampai 92 % sebanyak 10 ml dengan pipet
- Aduk susu penuh (whole milk) sampai 30 omogeny kemudian masukkan sebanyak 11 ml pada butyrometer Gerber secara hati-hati melalui dinding tabung agar cairan tetap terpisah
- Masukkan 1 ml isoamilalkohol
- Sumbat/tutup tabung butyrometer Gerber dengan penutup karet sampai batas permukaan cairan, bungkus dengan lap dan kocok dengan hati-hati membentuk angka 8. Kesemprnaan pengocokan dapat dilihat dengan terbentuknya warna coklat ungu dan hilangnya bentukan-bentukan padat
- Rendam butyrometer Gerber dalam penangas air pada suhu 65oC selama 5 menit. Bagian yang berskala harus selalu berada di atas
- Lakukan sentifugasi dengan bagian berskala di poros sentrifuse lalu putar dengan kecepatan 1200 rpm selama 3 menit
- Rendam lagi butyrometer Gerber dalam penangas air pada suhu 65oC selama 5 menit
- Baca kadar lemak (cairan bening pada bagian atas tabung) pada bagian berskala dengan ketelitian 0,05%
Kadar lemak dinyatakan dalam persen yamg berarti jumlah gram lemak dalam setiap 100 gram susu.
Gambar 14 Tabung Butyrometer Gerber Sumber :
2. Metode Siegfield Cara kerja :
- Butyrometer Siegfield berskala 0,0 – 0,5 % ditegakkan pad rak dan diisi H2SO4
91 sampai 92 % sebanyak 20 ml dengan pipet
- Aduk susu skim sampai 31omogeny kemudian masukkan sebanyak 22 ml pada butyrometer Siegfield secara hati-hati melalui dinding tabung agar cairan tetap terpisah
- Masukkan 2 ml isoamilalkohol
- Sumbat/tutup tabung butyrometer Siegfield dengan penutup karet sampai batas permukaan cairan, bungkus dengan lap dan kocok dengan hati-hati membentuk angka 8. Kesemprnaan pengocokan dapat dilihat dengan terbentuknya warna coklat ungu dan hilangnya bentukan-bentukan padat
- Rendam butyrometer Siegfield dalam penangas air pada suhu 65oC selama 5 menit. Bagian yang berskala harus selalu berada di atas
- Lakukan sentifugasi dengan bagian berskala di poros sentrifuse lalu putar dengan kecepatan 1200 rpm selama 3 menit
- Rendam lagi butyrometer Siegfield dalam penangas air pada suhu 65oC selama 5 menit
- Baca kadar lemak (cairan bening pada bagian atas tabung) pada bagian berskala dengan ketelitian 0,05%
Kadar lemak dinyatakan dalam persen yamg berarti jumlah gram lemak dalam setiap 100 gram susu.
3. Metode Koehler Cara kerja :
- Butyrometer Koehler berskala 6 – 60 % ditegakkan pad rak dan diisi H2SO4 91
sampai 92 % sebanyak 10 ml dengan pipet
- Aduk susu krim sampai 31omogeny kemudian masukkan sebanyak 5 ml pada butyrometer Koehler secara hati-hati melalui dinding tabung agar cairan tetap terpisah
- Masukkan air hangat bersuhu 40oC sebanyak 5 ml - Masukkan 1 ml isoamilalkohol
angka 8. Kesemprnaan pengocokan dapat dilihat dengan terbentuknya warna coklat ungu dan hilangnya bentukan-bentukan padat
- Rendam butyrometer Koehler dalam penangas air pada suhu 65oC selama 5 menit. Bagian yang berskala harus selalu berada di atas
- Lakukan sentifugasi dengan bagian berskala di poros sentrifuse lalu putar dengan kecepatan 1200 rpm selama 3 menit
- Rendam lagi butyrometer Koehler dalam penangas air pada suhu 65oC selama 5 menit
- Baca kadar lemak (cairan bening pada bagian atas tabung) pada bagian berskala dengan ketelitian 0,05%
Jadwal Praktikum Pengawasan Mutu Hasil Ternak
Kegiatan Minggu
ke-1
Minggu ke-2
Minggu ke-3
Minggu ke-4
Minggu ke-5
Pendahuluan: menjelaskan materi praktikum Paktikum I: Pemeriksaan kualitas daging
Praktikum II: Pemeriksaan kualitas telur Praktikum III: Pemeriksaan kualitas susu Ujian
Membuat Laporan Sementara dan Laporan Akhir
FORMAT LAPORAN
Format laporan sementara :
LAPORAN PRAKTIKUM PEMERIKSAAN KUALITAS DAGING
No. Pemeriksaan Daging Sapi Daging Ayam
1. Pemeriksaan organoleptis Uji usap Uji cair Uji didih ……… ……… ……… ……… ……… ………
2. Pemeriksaan awal pembusukan
Uji eber ……… ………..
3. Pemeriksaan keempukan Metode Warner – Bratzler Digoreng
Dipanggang atau di grill Direbus dengan sedikit air
……… kg/inc ……… kg/inc ……… kg/inc ……… kg/inc ………kg/inc ……… kg/inc
4. Pemeriksaan pH Metode kertas lakmus Metode elektrometris
………
………
………
………
5. Pengukuran daya ikat air oleh protein daging dan pengukuran susut masak a. Pengukuran daya ikat
air oleh protein daging Metode Graw dan Hamm
Metode Gheong dan Fischer
b. Pengukuran susut masak
………
.………. %
……….
.……….. %
6. m
umum metode sentuhan
Kendari, ………...
Asisten Praktikan
LAPORAN PRAKTIKUM PEMERIKSAAN KUALITAS TELUR
No. Pemeriksaan Telur segar Telur setelah
penyimpanan
1. Organoleptik Ukuran Warna Kulit Bentuk Kebersihan kulit ……….. ……….. ……….. ……….. ……….. ……… ……….. ……….. ……….. ………..
2. Pemeriksaan kualitas isi telur
Indeks kuning telur Warna kuning telur Indeks putih telur Haugh unit ……….. ……….. ……….. ……….. ……….. ……….. ……….. ……….. Kendari, ………...
Asisten Praktikan
LAPORAN PRAKTIKUM PEMERIKSAAN KUALITAS SUSU
Pemeriksaan Keadaan Susu
Jenis Susu :
Tanggal Pemeriksaan : Pemeriksaan yang dilakukan : Kebersihan susu : 1. Uji Organoleptik
Warna : ………...
Bau : ………...
Kekentalan : ………...
Rasa : ………...
2. Pemeriksaan Derajat Keasaman Susu secara Cepat
Uji didih : ………...… Uji alkohol : ………... 3. Penetapan Berat Jenis Susu : ………... 4. Pemeriksaan Enzymatis
Uji reduktase : ……….. (waktu reduktase) Kualitas susu ………... Uji katalase (angka katalase) :………. ml (gas oksigen) Uji fosfatase : ………..……. Unit
Indikasi : ………...………...
Pemeriksaan Komposisi Susu
Metode Gerber (Kadar lemak) : ………... % Metode Siegfield (Kadar lemak) : ………... % Metode Koehler (Kadar lemak) : ………... %
Kendari, ………...
Asisten Praktikan
Format Laporan Akhir
SAMPUL LAPORAN DAFTAR ISI
BAB 1 PENDAHULUAN Latar belakang
Tujuan
BAB 2 MATERI DAN METODE BAB 3 HASIL DAN PEMBAHASAN KESIMPULAN
DAFTAR PUSTAKA
Arka, I. B. 1988. Peranan Ilmu Kesehatan Masyarakat Veteriner dalam Meningkatkan Kualitas Hidup Manusia. Pidato Guru Besar. PSKH UNUD.
Badan Standarisasi Nasional. 2008. SNI 3926:2008 Telur Ayam Konsumsi. Badan Standarisasi Nasional: Jakarta.
Badan Standarisasi Nasional. 2008. SNI 3932:2008 Mutu Karkas dan Daging Sapi. Badan Standarisasi Nasional: Jakarta.
Badan Standarisasi Nasional. 2011. SNI 3141.1:2011 Susu Segar-Bagian 1: Sapi. Badan Standarisasi Nasional: Jakarta.
Dengen PR. 2015. Perbandingan uji pembusukan dengan menggunakan metode uji postma, uji eber, uji H2s dan pengujian mikroorganisme pada daging babi di Pasar tradisional sentral Makassar. [Skripsi] PS. Kedokteran Hewan, FK,UH : Makassar.
Easy Test KIT Info. 2012. Test KIT uji cepat boraks. diunduh pada tanggal 18 Maret 2016. [terhubung berkala] www.easytestinfo.com/p/test-kit-borakx-boraks.html?m=1.
Laboratorium Kesmavet. 2012. Manual prosedur pelaksanaan praktikum hygiene makanan. Program Kedokteran Hewan, Universitas Brawijaya.
Prawesthirini S, Siswanto HP, Estoepangestie ATS, Efendi MH, Harijani N, Cores de Vries G, Budiarto, Sabdoningrum EK. 2009. Analisa Kualitas Susu, Daging, dan Telur. Fakultas Kedokteran Hewan, Universitas Airlangga : Surabaya.
Saputro T. 2014. Uji formalin dalam bahan pangan. diunduh pada tanggal 21 Oktober 2014. [terhubung berkala] ilmuternak.com.
Van den Berg, JTC. 1988. Dairy Technology on the Tropics and Subtropics. PUDOC. Wageningen.
USDA. 2003. Standard, Grades, and Weight Classes for Shell Eggs. Diunduh pada 18 Maret 2016. [terhubung berkala]
http://www.ams.usda.gov/AMSv1.0/getfile?dDocName=STELDEV3004502. Wheeler TL, Shackelford SD, Koohmaraie M. 2015. Warner – Bratzler Shear Force
Protocol. USDA-ARS Meat Animal Research Center: USA.