Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Pengendalian Mutu PT Haldin
Pacific Semesta.
Penelitian
dilakukan
mulai bulan Maret 2008 sampai dengan bulan Juni 2008.
Bahan dan Alat
Bahan
Bahan yang digunakan adalah ekstrak kering teh hijau (powder extract)
standar senyawa EGCG, asetonitril, asam asetat, etil asetat, etanol, Folin Ciocalteau
reagent 10 %, Larutan natrium karbonat 7,5 %, larutan standar asam galat, larutan
H
2SO
4, media PCA (Plate Count Agar), Larutan buffer fosfat pH 7,2, akuades, serta
bahan pengemas.
Alat
Alat yang digunakan adalah Kromatogafi Cair Kinerja Tinggi (KCKT),
Inkubator (memmert), sonikator, biosafety cabinet, autoclave, neraca analitis, serta
alat-alat gelas.
Metode Penelitian
Desain percobaan
Pada percobaan kali ini dilakukan penentuan kinetika reaksi degradasi
senyawa aktif ekstrak teh hijau (kandungan total polifenol dan EGCG) dan perubahan
sifat sensorinya (rasa, warna ekstrak kering, dan warna air seduhan ekstrak teh hijau).
Persamaan kinetika reaksi yang telah diperoleh kemudian digunakan untuk
22
menentukan umur simpan ekstrak teh hijau berdasarkan parameter mutu kritisnya
(kandungan total polifenol, kandungan EGCG, perubahan rasa, dan perubahan
warna).
Kinetika reaksi degradasi senyawa aktif maupun perubahan sifat sensori
ekstrak teh hijau dilakukan dengan metode akselerasi. Ekstrak kering teh hijau yang
digunakan sebanyak 2100 gram yang dibagi ke dalam 3 kelompok. Dari setiap
kelompok tersebut kemudian dibagi lagi menjadi empat kelompok kecil dan diberi
label sesuai dengan hari pengamatan (0, 7, 14, 28, dan 35). Ketiga kelompok tersebut
kemudian dikemas ke dalam kemasan LDPE (Low Density Poly Etilene) kemudian di
kemas kembali dengan kemasan karton. Dari setiap kemasan tersebut selanjutnya
disimpan dalam inkubator yang terkontrol secara termostatis pada suhu 35ºC, 45ºC,
dan 55ºC selama 35 hari. Kelembaban udara selama percobaan dijaga tetap yaitu
menggunakan kelembaban ruangan ( ± 70%).
Pada pengamatan hari ke-0, 7, 14, 28, dan 35, dilakukan sampling terhadap
sampel hasil akselerasi, kemudian dilakukan uji kandungan mikrobiologi, total
polifenol, EGCG, serta sifat sensori rasa dan warna.
Batas kritis yang digunakan pada masing-masing parameter mutu kritisnya
adalah 35% kandungan total polifenol, 5% kandungan EGCG, serta 5 untuk skor
sensori rasa dan warna.
Analisis Mikrobiologi
Analisis
kandungan
mikrobiologi
dilakukan sebagai analisis pendahuluan
untuk memastikan bahwa selama percobaan berlangsung (Hari ke-0, 7, 14, 28, dan
35) tidak terdapat aktivitas mikroorganisme yang dapat mempengatuhi komposisi
kimiawi maupun perubahan sensori pada ekstrak teh hijau.
Kandungan
mikroorganisme
ekstrak teh hijau akan diamati selama uji
stabilitas meliputi uji TPC ( total plate count). Metode analisis merujuk kepada
Bacteriological Analytical Manual (BAM), Chapter 3, Januari 2001.
Secara
aseptis
dilakukan pengenceran sampel ekstrak teh hijau dengan faktor
pengenceran sebesar 10
-1, 10
-2, 10
-3, dan 10
-4. Homogenkan sampel tersebut selama
kurang lebih 1 menit dengan alat vortex, hindari pengambilan sampel yang masih
berbusa. Tempatkan masing-masing 1 mL sampel homogen dengan pipettor dan tip
steril 1000 μL dan pada bagian tengah cawan petri steril. Lakukan pengaduka ulang
bila sample telah didiamkan selama 3 menit. Secepatnya ditambahkan PCA steril
yang telah didinginkan sampai suhu 45°C ± 1
0C, sebanyak 12 - 15 mL, waktu yang
diperlukan sejak pengenceran sampel sampai penuangan media sebaiknya tidak lebih
dari 15 menit. Inkubasi pada suhu 35°C selama 48 ±2 jam. Hitung cawan petri
(duplo) yang menunjukkan jumlah koloni antara 25 – 250. Pilih cawan petri (simplo
atau duplo) dari satu pengenceran yang menunjukkan jumlah koloni antara 25– 250
setiap cawan. Hitung semua koloni dalam cawan petri dengan colony counter
kalikan dengan faktor pengenceran. Nyatakan hasilnya sebagai jumlah bakteri per
mililiter atau gram dengan menggunakan persamaan :
N = Σ C / [(1 * n
1) + (0.1 * n
2)]*(d)
Dimana N = Jumlah koloni dalanm Cfu/ml atau Cfu/g
Σ C = Jumlah semua koloni pada semua petri
n
1= Jumlah cawan petri yang dilitung pada pengenceran pertama
n
2= Jumlah cawan petri yang dilitung pada pengenceran kedua
d = Faktor pengenceran terendah
Jika semua cawan petri jumlah koloninya kurang dari 25, maka catat jumlah
aktual dan nyatakan hasilnya kurang dari 25 x 1/d, dimana d adalah faktor
pengenceran terkecil. Jika semua cawan petri jumlah koloninya lebih besar dari 250
cfu (kurang dari 100 cfu/cm
2), perkirakan jumlah koloni yang mendekati 250 dan
kalikan dengan factor pengenceran. Jika tidak ada koloni yang tumbuh pada cawan
petri, nyatakan jumlah bakteri perkiraan lebih kecil dari satu, dikalikan dengan
pengenceran terendah (<10 x faktor pengenceran). Jika terdapat koloni yang
merambat seperti rantai yang tidak terpisah-pisah, maka koloni dianggap satu. Tetapi
bila 1 atau lebih rantai terbentuk dan berasal dari sumber yang berpisah-pisah maka
tiap sumber dihitung sebagai satu koloni. Jika terdapat koloni yang merambat
24
diantara dasar cawan dan agar, dan merambat pada pinggir atau permukaan agar,
sebaiknya pemeriksaan diulangi karena sukar dihitung.
Dalam melaporkan jumlah koloni atau jumlah koloni perkiraan hanya
menggunakan 2 angka penting. Jika angka ketiga lebih besar dari 5, maka dilakukan
pembulatan ke atas, yaitu angka penting kedua ditambahkan 1 satuan, kemudian
angka ketiga menjadi 0 (nol). Jika angka ketiga lebih kecil dari 5, maka dilakukan
pembulatan ke bawah, yaitu angka penting kedua tidak ditambahkan 1 satuan,
kemudian angka ketiga menjadi 0 (nol). Jika angka ketiga sama dengan 5 dan angka
kedua adalah ganjil, maka dilakukan pembulatan ke atas, yaitu angka penting kedua
ditambahkan 1 satuan, kemudian angka ketiga menjadi 0. Jika angka ketiga sama
dengan 5 dan angka kedua adalah genap, maka dilakukan pembulatan ke bawah,
yaitu angka penting kedua tidak ditambahkan 1 satuan, kemudian angka ketiga
menjadi 0.
Analisis total polifenol ekstrak teh hijau
Selama uji stabilitas kandungan total senyawa polifenol ekstrak teh hijau
ditentukan dengan metode Folin-Ciocalteu assay. Sampel ekstrak teh hijau
diencerkan sebesar lima kali, kemudian kandungan total senyawa polifenol
ditentukan berdasarkan kurva standar asam galat.
Pembuatan Folin Ciocalteau reagent 10% dan Larutan natrium karbonat
Dipipet sebanyak10 mL larutan Folin Ciocalteau pekat, kemudian tambahkan
90 ml akuades, larutkan dan homogenkan. Larutan tersebut kemudian disimpan
dalam botol coklat agar terlindung dari sinar matahari untuk digunakan pada analisis
selanjutnya. Larutan natrium karbonat 7,5% dibuat dengan cara melarutkan 7,5 gram
natrium dengan akuades 100 ml, kemudian homogenkan larutan tersebut dengan
magnetic stirrer.
Pembuatan larutan standar asam galat
Larutan deret standard dibuat dengan cara terlebih dahulu membuat larutan
induk asam galat 250 ppm, agar terbentuk larutan yang homogen dapat dilakukan
proses sonikasi selama kuranglebih 10 menit, amati hingga terbentuk larutan yang
benar-benar homogen. Dari larutan induk asam galat tersebut kemudian dibuat larutan
standar asam galat dengan konsentrasi masing –masing sebesar10, 25, 50, 75, dan
100 ppm. Diambil sebanyak 1 ml dari masing-masing larutan standar tersebut
kemudian ditempatkan ke dalam tabung reaksi kapasitas 15 ml, lindungi tabung
tersebut dari pengaruh cahaya. Tambahkan 5 ml larutan Folin Ciocalteau 10%,
diamkan selama 3-8 menit kemudian tambahkan 4 ml larutan sodium karbonat 7,5 %,
aduk menggunakan vortex mixer hingga homogen. Diamkan selama 2 jam dan
lindungi dari pengaruh cahaya. Ukur absorbansi masing – masing standar pada
panjang gelombang 740 nm.
Buatlah grafik lineritas standar, konsentrasi (ppm)
sebagai sumbu X dan absorbansi sebagai sumbu Y.
Penentuan Kadar Polifenol Sample Ekstrak Teh Hijau
Ditimbang sebanyak 0.150 gram sampel ekstrak the hijau kemudian dimasukan
ke dalam labu takar 100 ml, ditambahkan kurang lebih 25 ml akuades, sonikasi
larutan tersebut selama kurang lebih 10 menit hingga benar-benar larut. Tambahkan
akuades hingga tanda tera. Diambil sebanyak 5 ml dari larutan tersebut kemudian
ditempatkan ke dalam labu ukur 50 ml, tambahkan akuades hingga tanda tera
kemudian dihomogenkan. Diambil sebanyak 1 ml dari larutan tersebut kemudian
ditempatka ke dalam tabung reaksi 15 ml, lindungi dari pengaruh cahaya. Tambahkan
5 ml larutan Folin Ciocalteau 10%, diamkan selama 3-8 menit kemudian tambahkan
4 ml larutan sodium karbonat 7,5 %, aduk menggunakan vortex mixer hingga
homogen. Diamkan selama 2 jam dan lindungi dari pengaruh cahaya. Ukur
absorbansi masing – masing standar pada panjang gelombang 740 nm. Hitung kadar
polifenol dengan menggunakan persamaan :
26
Polifenol % =
[
−
]
/
×
100
/
5
×
50
/
1000
×
100
%
Wsample
b
a
Absorbansi
Analisis Senyawa Katekin dengan Metode KCKT
Senyawa EGCG pada ekstrak teh hijau dianalisis dengan metode KCKT
model Shimadzu LC-10AD, senyawa katekin ekstrak teh hijau diinjeksikan pada
kolom (Waters μ-Bondapak C-18, 3,9 X 300 mm). Fase gerak menggunakan metode
isokratik yang terdiri dari campuran asetonitril, etil asetat, dan asam fosfat 0,05%
dengan perbandingan 120: 20 : 860 berdasarkan volume. Detektor yang digunakan
adalah jenis detektor UV pada panjang gelombang 280 nm, identifikasi senyawa
golongan katekin dengan membandingkan waktu retensi senyawa tersebut dengan
standar (EGCG).
Evaluasi Sensori dari Ekstrak Teh Hijau
Sifat sensori dari ekstrak teh hijau akan diamati selama uji stabilitas dengan
melibatkan 10 panel terlatih, uji yang dilakukan adalah memberikan penilaian
organoleptik yang meliputi, rasa, dan warna ekstrak kering dan air seduhan dengan
menggunakan skala 1 sampai dengan 10. Batas kritis ditentukan pada skala 5. Skala
1-2 menunjukan peringkat penilaian yang sangat berbeda, 3-4 sangat berbeda, 5-6
cukup berbeda, 7-8 sedikit berbeda, dan 9-10 tidak berbeda.
Uji
sensori
dilakukan
pada hari ke-7,14,21,28,dan 35. Cara penyajian untuk
uji sensori dlakukan dengan cara melarutkan 0,2 gram ekstrak teh hijau ke dalam 100
ml aquademineralisasi yang mempunyai suhu ± 100 °C, kemudian dilarutkan hingga
larutan menjadi homogen. Biarkan sesaat hingga larutan tersebut sesuai untuk
dilakukan uji sensori. Pada pengujian sensori antar sampel dilakukan penetral air
putih untuk mengurangi efek bias akibat pengaruh sampel sebelumnya. Uji sensori
dalakukan pada ruangan tertutup, tidak bising, terbebas dari kontaminasi bau yang
dapat mempengaruhi hasil dari uji sensori.
Analisis Kinetika Reaksi
Kinetika reaksi dari masing-masing parameter mutu kritis ditentukan dengan
cara menggambarkan hasil pengamatan penurunan mutu paramenter kritis selama
percobaan terhadap waktu penyimpanan menggunakan kurva persamaan reaksi ordo
nol dan ordo satu. Dari hasil pengamatan tersebut kemudian ditentukan tingkat
korelasinya menggunakan persamaan regresi linear yang teredia pada program
Microsoft Excel. Nilai kemiringan kurva (slope) pada masing-masing suhu percobaan
menunjukan nilai konstanta reaksi (K). Nilai K yang telah diperoleh selanjutnya
digunakan untuk menggambarkan kurva persamaan Arrhenius pada ordo nol maupun
ordo satu dengan menghubungkan nilai ln K dengan 1/T (1/°K). Jenis kinetika reaksi
dari masing-masing parameter mutu kritis ditentukan berdasarkan tingkat korelasi
yang diperoleh dari kurva penurunan mutu ekstrak teh hijau pada persamaan orde
rekasi nol dan satu. Nilai korelasi yang lebih besar menunjukan kesesuaian jenis
reaksi yang lebih baik.
Penentuan Umur Simpan
Umur simpan ekstrak teh hijau ditentukan berdasarkan jenis kinetika reaksi
yang diperoleh dari parameter mutu kritis yang diamati. Umur simpan pada suhu
penyimpanan diperoleh dengan terlebih dahulu menentukan konstanta reaksi pada
suhu penyimpanan. Konstanta reaksi ditentukan dengan memasukan nilai suhu
penyimpanan pada persamaan garis yang diperoleh dari kurva persamaan Arrhenius.
Selanjutnya nilai konstanta reaksi yang diperoleh digunakan untuk menentukan umur
simpan ekstrak teh hijau dengan cara memasukan nilai konstanta reaksi pada
persamaan kinetika reaksi (ordo nol dan satu). Dengan menyelesaikan persamaan
matematika maka diperoleh waktu umur simpan, yaitu waktu yang diperlukan hingga
produk mencapai nilai mutu kritisnya.
HASIL DAN PEMBAHASAN
Kandungan Miikroba Ekstak Teh Hijau
Analisis kandungan mikroba ekstrak teh hijau dilakukan untuk mengetahui pengaruh suhu akselerasi terhadap kandungan mikroba ekstrak teh hijau. Selain itu, untuk memastikan bahwa tidak ada pengaruh aktivitas mikroba terhadap sifat sensori maupun kandungan kimiawi ekstrak teh hijau. Dari hasil pengematan TPC ( total plate count) pada ektrak teh hijau menunjukan tidak ada perubahan yang cukup signifikan baik pada kontrol maupun sampel hasil akselerasi. Jumlah koloni seluruh sampel pada pengenceran terkecil tidak lebih dari 25 cfu (coloni forming unit) per cawan petri, sehingga berdasarkan cara perhitungan yang diajukan oleh Bacteriological Analytical Manual (BAM) jumlah koloni pada setiap sampel tidak lebih dari 10 atau 250. Berdasarkan data tersebut dapat disimpulkan bahwa ekstrak teh hijau dapat menghambat pertumbuhan mikroba.
Tabel 5. Nilai TPC ekstrak teh hijau pada berbagai suhu perlakuan terhadap waktu penyimpanan
Waktu Penyimpanan (hari) Suhu
Penyimpanan 0 7 14 28 35
35 <10 cfu/g <10 cfu/g <250 cfu/g <10 cfu/g <10 cfu/g 45 <10 cfu/g <10 cfu/g <10 cfu/g <10 cfu/g <10 cfu/g 55 <10 cfu/g <10 cfu/g <10 cfu/g <250 cfu/g <10 cfu/g Hasil analisis kandungan TPC pada ekstrak teh hijau dapat disajikan pada Tabel 5. Berdasarkan hasil percobaan dapat ditunjukan bahwa secara umum kandungan total mikroba ekstrak teh hijau tetap hinggga waktu penyimpanan selama 35 hari, pada semua suhu penyimpanan. Dari hasil jumlah kandungan total mikroba yang disajikan menunjukan semua hasil pengukuran tidak menghasilkan angka pasti, hal tersebut disebabkan karena berdasarkan perhitungan jumlah kandungan total mikroba yang mengacu pada prosedur perhitungan yang diajukan oleh BAM (Bacteriological Analytical Manual), jumlah mikroba hanya akan memiliki nilai yang pasti jika berada pada selang 25 sampai dengan 250 koloni terhitung pada setiap cawan petri, sehingga jika jumlah koloni berada dibawah selang tersebut tidak akan dihitung sebagai angka pasti melainkan sebagai selang nilai angka ( contoh: <10 atau <250). Dengan kata lain, jumlah kandungan mikroba pada ekstrak teh hijau berada dibawah limit deteksi prosedur pengujian, namun dapat dipastikan bahwa jumlah
kandungan mikroba pada ekstrak teh hijau tidak lebih dari 10 cfu/g ataupun 250 cfu/g, sehingga dapat dipastikan bahwa tidak terdapat pertumbuhan muikroorganisme pada seluruh sampel percobaan.
Ada bebrapa faktor yang menyebabkan ekstrak teh hijau dapat menghambat pertumbuhan bakteri. Pertama, kadar air sampel ekstrak teh hijau cukup rendah (ekstrak kering) sehingga dapat menghambat pertumbuhan mikroorganisme. Kedua, adalah karena ekstrak teh hijau dapat berperan sebagai zat anti mikroba. Menurut Wang dan Zhou (2004), teh dapat pula dimanfaaatkan sebagai zat antimikroba sehingga dapat dimanfaatkan sebagai food additive pada bahan pangan untuk memperpanjang umur simpan tanpa mengakibatkan kerusakan bahan pangan maupun kandungan nutrisinya, bahkan menurut penelitian yang dilakukan oleh Friedman et al. (2006) senyawa aktif pada teh (epigalokatekin-3-galat, galokatekin-3-galat, theaflavin-3’-galat, dan theaflavin-3,3’-digalat) memiliki aktivitas antimikroba yang lebih tinggi tehadap Bacillus cereus daripada senyawa antibiotik yang telah biasa digunakan secara medis seperti tertrasiklin dan vankomisin. Senyawa katekin pada teh yang memiliki aktivitas antimikroba paling tinggi hingga paling rendah terhadap Bacillus cereus secara berturut-turut adalah galokatekin galat, epigalokatekin galat, katekin galat, epikatekin galat, epigalokatekin dan galokatekin. Aktivitas antimikroba senyawa katekin yang merupakan epimernya relatif tidak jauh berbeda, galokatekin-3-galat memiliki aktivitas antimikroba yang hampir sama dengan epigalokatekin-3-galat, hal yang sama juga terjdai pada senyawa galokatein dan epigalokatekin sedangkan senyawa katekin-3-galat memiliki aktivitas antimikroba empat kali lebih tinggi dibandingkan dengan epikatekin-3-galat.
Kinetika Penurunan Kadar Polifenol Ekstrak Teh Hijau
Pengukuran kadar polifenol ekstrak teh hijau pada suhu 35, 45, dan 55°C diamati pada selang waktu 7, 14, 28, dan 35 hari. Dari hasil pengukuran tersebut selanjutnya dilakukan perhitungan kinetika reaksi degradasinya dengan menggunakan persaaan reaksi orde 0 dan orde 1.
Kurva kinetika reaksi degradasi senyawa polifenol menggunakan persamaan reaski ordo nol disajikan pada Gambar 10. Dari hasil perhitungan menunjukan bahwa semua plot persamaan garis pada suhu pengamatan 35°C, 45°C, dan 55°C
31 menghasilkan kurva yang linear. Tingkat linearitas reaksi orde nol disajikan pada Tabel 6.
Perhitungan laju reaksi juga dilakukan dengan menggunakan persamaan reaksi orde satu. Seperti halnya pada reaksi orde nol, pada reaski orde satu seluruh plot persamaan garis pada suhu pengamatan 35°C, 45°C, dan 55°C menghasilkan kurva yang linear (Gambar 11). Tingkat linearitas reaksi orde nol disajikan pada Tabel 4.
Hasil perhitungan nilai konstanta reaksi degradasi senyawa polifenol baik pada ordo reaksi nol maupun ordo reaksi satu menunjukkan bahwa dengan semakin tingginya nilai suhu maka akan diperoleh nilai konstanta reaksi yang lebih besar (Tabel 5), hal ini menunjukan bahwa degradasi senyawa polifenol pada ekstrak teh hijau merupakan reaksi yang tergantung oleh suhu. Hasil dari penelitian ini sesuai dengan percobaan yang dilakukan oleh Kyi et al. (2005) yang mengamati pengaruh proses pengeringan terhadap laju degradasi senyawa polifenol pada biji coklat. Nilai konstanta reaksi pada ordo reaksi nol maupun satu yang diamati pada suhu 35°C, 45°C, dan 55°C disajikan pada Tabel 6.
Hasil perhitungan nilai korelasi pada ordo nol dan ordo satu yang diamati pada suhu 35°C, 45°C, dan 55°C disajikan pada Tabel 6. Dari hasil tersebut menunjukan kinetika reaksi pada ordo satu memiliki nilai korelasi yang lebih baik jika dibandingkan dengan ordo nol, dengan tingkat korelasi, r2 ≥ 95%. Hasil penelitian ini sesuai dengan penelitian yang diperoleh oleh Kyi et al. (2005) yang menyebutkan bahwa kinetika degradasi senyawa polifenol pada biji coklat terhadap proses pengeringan mengikuti jenis kinetika reaksi ordo satu dengan tingkat korelasi, r2 > 95%. Namun, nilai korelasi orde reaksi nol dan satu memiliki nilai yang tidak jauh berbeda. Dari data tersebut dapat disimpulkan bahwa sebenarnya tingkat kelajuan degradasi senyawa polifenol pada orde reaksi nol maupun satu sampai pada akhir pengamatan belum dapat dibedakan secara signifikan.
Pengukuran kadar polifenol pada penelitian ini dilakukan dengan menggunakan metode Folin-Ciocalteu. Reaksi Folin-Ciocalteu adalah metode pengujian yang umum digunakan untuk menentukan kadar total polifenol pada suatu bahan. Pengujian didasarkan kepada prinsip oksidasi reduksi suatu bahan. Pada umumnya, reaksi oksidasi senyawa polifenol sangat dipengaruhi oleh adanya perbedaan proses hidroksilasi dan tingkat polimerisasinya. Adanya penurunan kadar total polifenol menunjukan bahwa senyawa fenolik pada teh telah teroksidasi atau terpolimerisasi selama penyimpanan ( Wang et al. 2000).
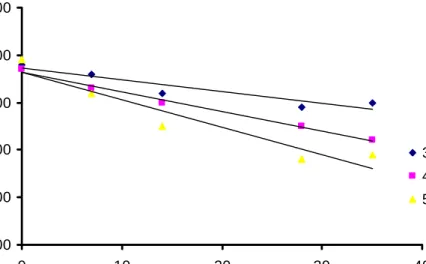
y = -0.1365x + 44.841 y = -0.1652x + 45.258 y = -0.2019x + 43.919
35.00
40.00
45.00
50.00
0
10
20
30
40
Waktu penyimpanan (hari)
K
a
d
a
P
o
lif
e
n
o
l
35oC 45oC 55oCGambar 10. Kurva perubahan kadar polifenol ekstrak teh hijau pada ordo reaksi nol
y = -0.0032x + 3.804 y = -0.0039x + 3.8135 y = -0.005x + 3.7832 3.500 3.600 3.700 3.800 3.900 4.000 0 10 20 30 40
Waktu penyimpanan (hari)
Ln K a da r P o lif e nol 35oC 45oC 55oC
33
Kinetika Penurunan Kandungan EGCG Dalam Ekstrak Teh Hijau
Kurva kinetika reaksi degradasi senyawa EGCG menggunakan persamaan reaski ordo nol yang diamati pada tiga suhu yang berbeda disajikan pada Gambar 12. Dari hasil perhitungan menunjukan bahwa semua plot persamaan garis pada suhu pengamatan 35°C, 45°C, dan 55°C menghasilkan kurva yang linear. Tingkat linearitas reaksi orde nol disajikan pada Tabel 6.
Perhitungan laju reaksi juga dilakukan dengan menggunakan persamaan reaksi orde satu. Seperti halnya pada reaski orde nol, pada reaski orde satu seluruh plot persamaan garis pada suhu pengamatan 35°C, 45°C, dan 55°C menghasilkan kurva yang linear (Gambar 13).
Hasil pengamatan kandungan EGCG pada ekstrak teh hijau terhadap waktu menunjukan adanya penurunan kandungan senyawa EGCG yang lebih cepat dengan meningkatnya suhu percobaan baik pada ordo reaksi nol maupun satu. Hal tersebut mengindikasikan bahwa nilai tetapan reaksi degradasi senyawa EGCG akan meningkat seiring dengan meningkatnya suhu percobaan. Peningkatan nilai tetapan reaski terhadap suhu percobaan menunjukan bahwa reaksi degradasi senyawa EGCG merupakan jenis reaksi yang tergantung dengan suhu (temperature dependent).
EGCG merupakan senyawa golongan polifenol utama yang terkandung pada ekstrak teh hijau. Telah disebutkan pada percobaan sebelumnya bahwa senyawa polifenol merupakan senyawa yang tergantung terhadap suhu (temperature dependent), sehingga terdapat korelasi yang positif antara penurunan kadungan polifenol dengan penurunan kandungan EGCG pada teh hijau. Hal tersebut mengindikasikan bahwa penurunan kandungan senyawa polifenol pada ekstrak hijau salah satunya disebabkan karena penurunan senyawa EGCG. Ditinjau dari nilai potensial reduksi standarnya senyawa EGCG memiliki nilai yang paling rendah dibandingkan dengan senyawa katekin lainnya, sehingga lebih mudah untuk mengalami proses oksidasi.
Hasil penentuan nilai korelasi reaksi degradasi senyawa EGCG pada orde reaski nol dan satu disajikan pada Tabel 6, dari tabel tersebut diperoleh nilai korelasi degradasi senyawa EGCG yang diamati pada suhu 35°C, 45°C, dan 55°C pada orde reaksi nol adalah 95, 96, dan 93% sedangkan nilai korelasi pada orde reaksi satu adalah 95, 96, dan 92%. Nilai korelasi dari nol dan satu tidak semuanya memiliki korelasi > 95% selain itu, korelasi pada dua orde reaksi tersebut memiliki nilai yang
hampir sama, sehingga reaksi degradasi senyawa EGCG belum dapat ditentukan jenis kinetika reaksinya. Alasan yang menyebabkan nilai korelasi yang hampir sama pada ordo reaksi nol dan satu adalah karena jumlah senyawa EGCG yang terdegradasi masih sedikit sehingga belum dapat dibedakan perbedaan kelajuan reaksi antara orde reaksi nol dengan satu.
Berdasarkan penelitian yang dilakukan oleh Zimeri dan Tong (1999), kinetika degradasi senyawa EGCG sebagai fungsi dari pH dan oksigen terlarut pada sistem model larutan mengikuti model pseudo-first order. Reaksi degradasi EGCG pada waktu tertentu akan berjalan sangat lambat, sehingga digolongkan sebagai reaksi non-zero equilibrium, artinya penurunan kosentrasi EGCG sebagai fungsi dari pH dan oksigen tidak akan mencapai nilai nol. Istilah pseudo digunakan untuk proses mekanisme dan kinetika reaksi yang kompleks dan tidak menggambarkan reaksi aktual yang terjadi sehingga hanya merupakan pendekatan semiempirik pada proses yang sebenarnya terjadi di alam.
Penurunan senyawa EGCG pada ekstrak teh hijau disebabkan oleh proses epimerisasi. Proses epimerisai senyawa EGCG terjadi akibat adanya pengaruh suhu yang menyebabkan perubahan konfigurasi stereokimia senyawa EGCG menjadi GCG. Senyawa EGCG memiliki konfigurasi struktur 2,3-cis sedangkan GCG memiliki konfigurasi struktur 2,3-trans. Secara termodinamika senyawa 2,3-trans memiliki tingkat stabilitas yang lebih tinggi jika dibandingkan senyawa 2,3-cis sehingga pada kondisi suhu tertentu senyawa GCG akan ditemui dalam jumlah yang lebih banyak daripada senyawa EGCG. Proses epimerisasi EGCG menjadi GCG digambarkan oleh sebuah reaski kesetimbangan (Gambar 14). Pada gambar 14 dapat dijelaskan bahwa kelajuan perubahan senyawa epigalokatekin galat menjadi galokatekin galat lebih besar daripada kelajuan perubahan senyawa galokatekin galat menjadi epigalokatekin galat sehingga pada suhu tertentu jumlah galokatekin galat akan ditemui lebih banyak daripada epigalokatekin galat.
Selain proses epimerisasi, penurunan jumlah EGCG pada ekstrak teh hijau juga dapat terjadi melalui proses oksidasi. Selama proses oksidasi EGCG akan melepaskan satu atom hidrogen radikal membentuk senyawa semikuinon radikal. Senyawa semikuinon radikal terjadi karena adanya pemutusan ikatan hidroksi menghasilhan satu atom hidrogen radikan dan oksigen radikal. Menurut Wang et al. (2000), hidrogen radikal akan lebih mudah terbentuk pada cincin yang mengikat tiga gugus hidroksi dibandingkan pada cincin yang hanya mengikat dua gugus hidroksi,
35 hal tersebut merupakan alasan mengapa senyawa galo-flavanol memiliki potensial reduksi yang lebih rendah dibandingkan dengan senyawa katekol-flavanol.
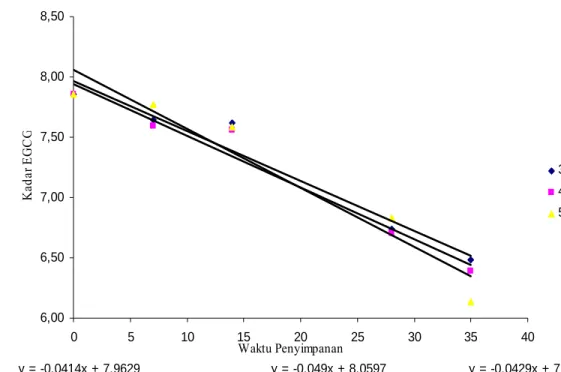
y = -0.049x + 8.0597 y = -0.0429x + 7.9436 y = -0.0414x + 7.9629 6,00 6,50 7,00 7,50 8,00 8,50 0 5 10 15 20 25 30 35 40 Waktu Penyimpanan Ka da r E GC G 35oC 45oC 55oC
Gambar 12. Kurva penurunan EGCG selama penyimpanan pada ordo reaksi nol
y = -0,0058x + 2,0777 y = -0,006x + 2,0755 y = -0,007x + 2,0918 1,750 1,850 1,950 2,050 2,150 0 5 10 15 20 25 30 35 40 Waktu Penyimpanan Ln K ad ar EG C G 35oC 45oC 55oC
Senyawa EGCG merupakan senyawa yang termasuk pada golongan galo-flavanol. Dibandingkan dengan senyawa polifenol lainnya EGCG mempunyai potensial reduksi yang paling rendah, sehingga paling mudah berperan sebagai penangkap radikal bebas, dalam perspektif farmakokimia EGCG merupakan senyawa yang sangat potensial untuk dimanfaatkan sebagai antioksidan.
O O OH OH OH O H O O H OH OH OH O O OH OH OH O H O O H OH OH OH
epigalokatekin galat galokatekin galat
Gambar14. Epimerisasi EGCG menjadi GCG (Wang et al. 2000)
Kinetika perubahan sensori ekstrak teh hijau
Kinetika perubahan rasa ekstrak teh hijau
Parameter mutu rasa pada teh ditentukan oleh sifat kesepatan (astingenccy), kepahitan ( bitterness) dan sweet after taste. Pada uji sensori rasa kali ini hanya akan menitikberatkan pada uji kepahitan dan kesepatan, karena parameter sweet after taste bukan merupakan parameter mutu yang utama sehingga faktor keberadaan mutunya dapat diabaikan. Sifat kesepatan dan kepahitan pada teh mempunyai korelasi yang hampir sama yaitu merupakan fungsi dari waktu, dengan semakin bertambahnya waktu maka akan terjadi penurunan kepahitan dan kesepatan pada teh, sehingga pada uji sensori rasa, panelist sekaligus membedakan sifat kepahitan dan kesepatan sampel teh hasil akselerasi dengan kontrol.
Perubahan sensori rasa ekstrak teh hijau hasil akselerasi yang dibandingkan terhadap kontrol berdasarkan ordo nol dan ordo satu disajikan pada Gambar 15 dan
37 Gambar 16. Pada gambar tersebut terlihat bahwa skor sensori rasa ekstrak teh hijau mempunyai nilai yang semakin menurun dengan bertambahnya suhu, dengan tingkat linearitas yang cukup baik. Dari hasil penentuan nilai konstanta reaksi baik pada ordo nol maupun ordo satu menunjukan bahwa semakin meningkatnya suhu akan menghasilkan nilai kemiringan kurva yang semakin besar yang berarti akan menghasilkan nilai K yang semakin besar. Hal tersebut mengindikasikan bahwa sifat sensori ekstrak teh hijau dapat dipengaruhi oleh suhu.
Nilai korelasi kinetika reaksi perubahan rasa ekstrak teh hijau disajikan pada Tabel 6. Nilai korelasi perubahan rasa ekstrak teh hijau pada suhu 35°C, 45°C, dan 55°C menggunakan persamaan orde reaksi nol adalah 93%, 98%, 94% sedangkan nilai korelasi pada orde reaksi satu adalah 92%, 97%, dan 96%. Ditinjau dari nilai korelasinya, kinetika reaksi pada orde nol maupun orde satu memilki nilai yang hampir sama, hal tersebut menunjukan bahwa pada perubahan sensori rasa ekstrak teh hijau belum dapat ditentukan jenis kinetika reaksinya.
Dari hasil penelitian yang dilakukan oleh Wang et al. (2000), sifat sensori ekstrak teh mempunyai korelasi dengan kandungan senyawa polifenolnya, semakin tinggi kandungan polifenol akan memberikan rasa sepat dan pahit yang semakin kaut. Penurunan tingkat kepahitan dan kesepatan yang terjadi pada ekstrak teh hijau mengindikasikan telah terjadi perubahan kandungan senyawa polifenol pada teh, hal tersebut sejalan dengan penelitian sebelumnya yang menunjukan adanya penurunan kandungan senyawa polifenol pada ekstrak teh hijau, sehingga indikasi penurunan kualitas ekstrak teh hijau selain dapat dideteksi secara kimiawi dapat pula dideteksi secara sensori dengan adanya penurunan sifat kepahitan dan kesepatan. Hasil dari kedua percobaan tersebut sesuai dengan hipotesis awal yaitu bahwa penurunan kadar polifenol pada teh dapat dicirikan oleh adanya penurunan sifat kepahitan dan kesepatan pada ekstrak teh hijau.
Meskipun telah umum diketahui bahwa kafein sebagai salah satu komponen utama pada teh selain polifenol dapat memberikan kontribusi terhadap rasa pahit, namun dari hasil pengamatan yang dilakukan menunjukan bahwa kandungan kafein pada teh relatif tidak berubah dibandingkan dengan kondisi awal, sehingga kandungan kafein pada teh tidak memiliki korelasi yang positif serta tidak berkontribusi terhadap penurunan rasa pahit pada ekstrak teh. Dari hasil tersebut dapat disimpulkan bahwa senyawa polifenol pada teh merupakan faktor penentu penurunan kualitas pada teh.
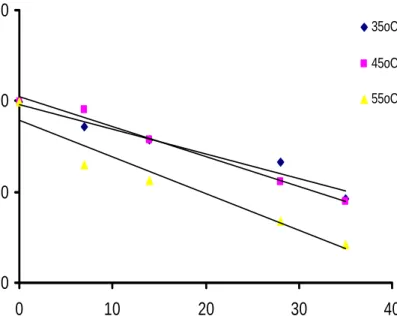
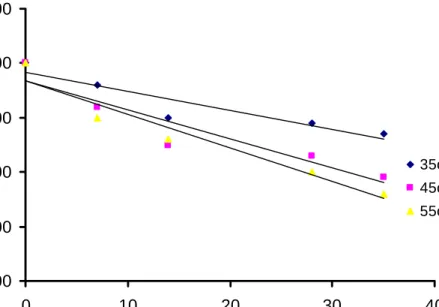
y = -0,0982x + 9,8093 y = -0,0271x + 9,2349 y = -0,0467x + 9,3442 0,00 2,00 4,00 6,00 8,00 10,00 12,00 0 10 20 30 40
Waktu penyimpanan (Hari)
S
k
or
s
ens
or
i r
as
a
35oC 55oC 45oCGambar 15. Kurva perubahan skor sensori rasa ekstrak teh hijau selama penyimpanan pada orde reaksi nol
y = -0,0031x + 2,2235 y = -0,0055x + 2,2361 y = -0,0125x + 2,2952 1,500 1,700 1,900 2,100 2,300 2,500 0 5 10 15 20 25 30 35 40
Waktu penyimpanan (Hari)
L n (S k o r s e n s o ri ra s a ) 35oC 45oC 55oC
Gambar 16. Kurva perubahan skor sensori rasa ekstrak teh hijau selama penyimpanan pada ordo reaksi satu
39 Kinetika perubahan warna ekstrak teh hijau
Perubahan warna ekstrak teh hijau diamati dalam dua fase wujud yaitu ekstrak kering (powder extract) dan air seduhan. Kurva perubahan warna ekstrak kering teh hijau yang diamati pada berbagai nilai suhu dengan menggunakan persamaan ordo nol dan satu dapat dilihat pada Gambar 17 dan 18, sedangkan kurva perubahan warna air seduhan ekstrak teh hijau ditunjukan pada Gambar 19 dan 20. Nilai konstanta reaksi perubahan warna ordo nol dan ordo satu dari ekstrak kering dan air seduhan esktrak teh hijau disajikan pada Tabel 11 dan Tabel 12. Dari hasil pengamatan perubahan warna ekstrak teh hijau yang dilakukan pada tiga perlakuan suhu yaitu 35°C 45°C dan 55°C (Gambar 23, 24, 25,& 26) maupun dari hasil perhitungan konstanta reaksi ordo nol dan ordo satu ( Tabel 6) dapat disimpulkan bahwa perubahan warna yang terjadi merupakan jenis reaksi yang tergantung dengan suhu (temperature dependent), Secara matematis fenomena tersebut dapat ditunjukan dengan semakin meningkatnya nilai konstanta reaksi ordo nol maupun ordo satu yang diakibatkan oleh semakin meningkatnya suhu reaksi.
Nilai korelasi kinetika perubahan warna ekstrak kering dan air seduhan ekstrak teh hijau pada orde reaksi nol dan satu disajikan pada Tabel 6. Dari nilai korelasinnya, tidak terdapat perbedaan yang cukup signifikan antara persamaan laju reaksi orde nol dengan orde satu. Selain itu, tidak semua nilai korelasi baik reaksi orde nol dan satu memiliki nilai >95%, sehingga pada penelitian kali ini belum dapat ditentukan jenis kinetika reaksinya.
Berdasarkan penelitian yang dilakukan oleh Wang et al. (2000) terhadap ekstrak teh hijau yang mengalami proses pemanasan (roasting dan steaming) secara signifikan telah mengalami proses perubahan warna dari hijau menjadi coklat. Proses ini disebut sebagai proses browning. Proses browning yang terjadi pada teh disebabkan oleh adanya oksidasi senyawa polifenol, hal tersebut ditunjukan oleh adanya perubahan kandungan senyawa polifenol sebelum dan setelah pengolahan. Meskipun proses browning dapat pula dihasilkan oleh adanya reaksi Maillard namun analisis kandungan gula maupun asam amino dalam teh sebelum dan sesudah perlakukan menunjukan perbedaan yang tidak terlalu signifikan sehingga Wang et al. (2000) menyimpulkan bahwa reaksi Maillard bukan merupakan faktor penting yang berperan terhadap proses browning pada ekstrak teh hijau.
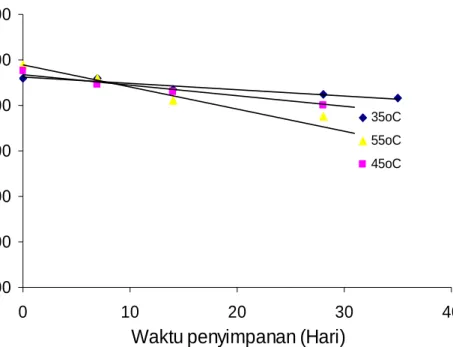
y = -0,0249x + 9,7186 y = -0,0414x + 9,6349 y = -0,0583x + 9,6395 6,00 7,00 8,00 9,00 10,00 11,00 0 10 20 30 40
Waktu penyimpanan (hari)
S k or s ens or i w ar na 35oC 45oC 55oC
Gambar 17. Kurva perubahan skor warna ekstrak kering teh hijau selama penyimpanan pada ordo nol
y = -0,0027x + 2,2742 y = -0,0046x + 2,2667 y = -0,0067x + 2,2668 2,000 2,050 2,100 2,150 2,200 2,250 2,300 2,350 0 5 10 15 20 25 30 35 40
Ln Skor sensori warna powder
W ak tu peny im pa nan ( har i) 35oC 45oC 55oC
Gambar 18. Kurva perubahan skor warna ekstrak kering teh hijau selama penyimpanan pada ordo reaksi satu
41 y = -0,0347x + 9,8233 y = -0,0537x + 9,6814 y = -0,0621x + 9,6837 6,00 7,00 8,00 9,00 10,00 11,00 0 10 20 30 40
Waktu penyimpanan (hari)
S k o r s ens or i pe nam pak an 35oC 45oC 55oC
Gambar 19. Kurva perubahan skor warna air seduhan teh hijau selama penyimpanan pada ordo reaksi nol
y = -0,0037x + 2,2849 y = -0,0061x + 2,2708 y = -0,0072x + 2,2722 2,000 2,100 2,200 2,300 2,400 0 10 20 30 40
Waktu penyimpanan (hari)
S k or s e ns or i pena m pak an 35oC 45oC 55oC
Gambar 20. Kurva perubahan skor warna air seduhan teh hijau selama penyimpanan pada ordo reaksi satu
Hasil percobaan kali ini menunjukan adanya korelasi yang positif antara penurunan jumlah kandungan senyawa polifenol dengan kecenderungan perubahan warna pada ekstrak teh hijau baik pada ekstrak kering maupun pada air seduhan sehingga terdapat kesesuaian dengan hasil percobaan yang dilakukan oleh Wang et al. (2000).
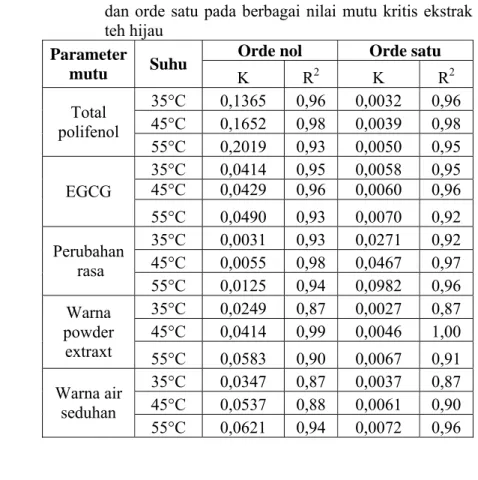
Tabel 6. Nilai konstanta dan korelasi kinetika reaksi orde nol dan orde satu pada berbagai nilai mutu kritis ekstrak teh hijau
Orde nol Orde satu Parameter mutu Suhu K R2 K R2 35°C 0,1365 0,96 0,0032 0,96 45°C 0,1652 0,98 0,0039 0,98 Total polifenol 55°C 0,2019 0,93 0,0050 0,95 35°C 0,0414 0,95 0,0058 0,95 45°C 0,0429 0,96 0,0060 0,96 EGCG 55°C 0,0490 0,93 0,0070 0,92 35°C 0,0031 0,93 0,0271 0,92 45°C 0,0055 0,98 0,0467 0,97 Perubahan rasa 55°C 0,0125 0,94 0,0982 0,96 35°C 0,0249 0,87 0,0027 0,87 45°C 0,0414 0,99 0,0046 1,00 Warna powder extraxt 55°C 0,0583 0,90 0,0067 0,91 35°C 0,0347 0,87 0,0037 0,87 45°C 0,0537 0,88 0,0061 0,90 Warna air seduhan 55°C 0,0621 0,94 0,0072 0,96
Penentuan umur simpan ektrak teh hijau
Penentuan nilai konstanta reaksi pada suhu penyimpanan (28°C)
Nilai konstanta reaksi dapat ditentukan dengan memasukkan suhu penyimpanan yang diinginkan (28°C) pada persamaan garis orde rekasi nol atau orde reaksi satu yang diperoleh pada kurva Arrhenius. Kurva Arrhenius diperoleh dengan menghubungkan nilai Ln K (logaritma natural dari tetapan laju reaksi pasa suhu pengamatan) dengan 1/T (suhu pengamatan dalam satuan kelvin).
Kurva persaamaan Arrhenius pada orde reaksi nol dan satu berdasarkan parameter mutu kritis kadar total polifenol, kandungan EGCG, perubahan rasa,
43 perubahan warna ekstrak kering, dan peruhanan warna air seduhan secara berturut-turut disajikan pada gambar 21, 22, 23, 24, 25, 26, 27, 28, 29, dan 30. Nilai korelasi dan persamaan garis kurva Arrhenius pada berbagai parameter mutu kritis disajikan pada Tabel 7.
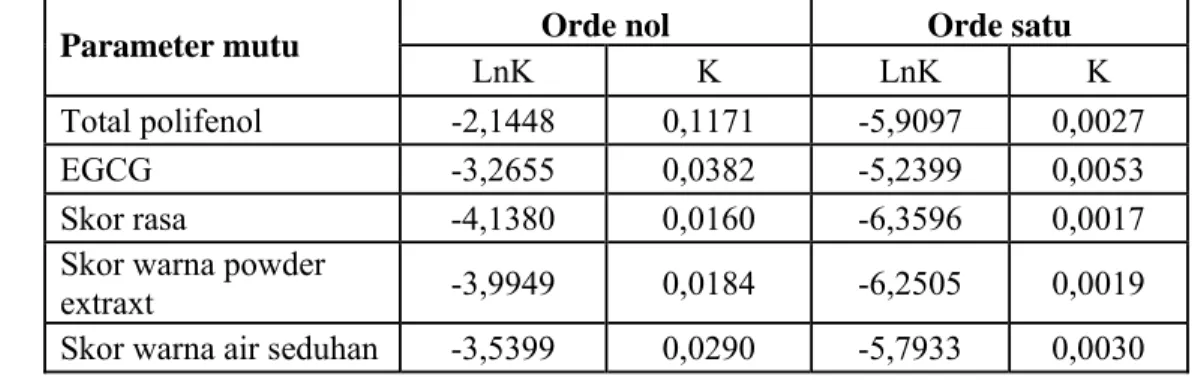
Tabel 7. Nilai korelasi dan persamaan garis kurva Arrhenius pada berbagai parameter mutu kritis
Persamaan garis Korelasi (%) Parameter mutu
Orde nol Orde satu Orde
nol Orde satu Total polifenol y = -1978,7x + 4,4289 y = -2173,6x + 1,3115 99,89 99,36 EGCG y = -851,59x - 0,4363 y = -936,7x - 2,128 89,16 90,15 Skor rasa y = -6493,6x + 17,435 y = -7030,8x + 16,999 98,86 98,45 Skor warna powder extraxt y = -4301,5x + 10,296 y = -4643,5x + 9,1764 99,15 98,99 Skor warna air
seduhan y = -2953,7x + 6,2731 y = -3311,8x + 5,2093 93,35 93,65
Dari berbagai persamaan garis tersebut kemudian dapat ditentukan nilai konstanta reaksi pada semua parameter mutu menggunakan persamaan reaksi orde nol dan orde satu. Dengan memasukan nilai suhu (1/T) dalam satuan kelvin pada persamaan garis dan dengan melakukan penyelesaian matematis, selanjutnya akan diperoleh nilai konstanta laju reaksi (Tabel 8).
Tabel 8. Nilai konstanta reaksi pada suhu penyimpanan (28°C) menggunakan persamaan reaski orde nol dan orde satu
Orde nol Orde satu
Parameter mutu
LnK K LnK K
Total polifenol -2,1448 0,1171 -5,9097 0,0027
EGCG -3,2655 0,0382 -5,2399 0,0053
Skor rasa -4,1380 0,0160 -6,3596 0,0017
Skor warna powder
extraxt -3,9949 0,0184 -6,2505 0,0019
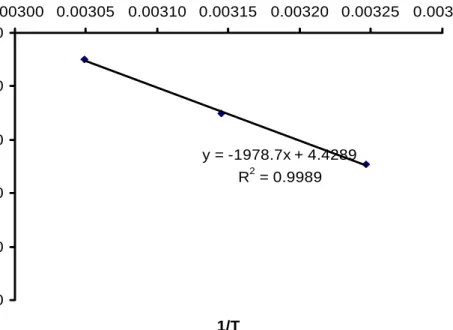
y = -1978.7x + 4.4289 R2 = 0.9989 -2.500 -2.300 -2.100 -1.900 -1.700 -1.500 0.00300 0.00305 0.00310 0.00315 0.00320 0.00325 0.00330 1/T Ln K
Gambar 21. Kurva persamaan Arrhenius untuk reaksai ordo nol pada degradasi kadar polifenol ekstrak teh hijau
y = -2173,6x + 1,3115 R2 = 0,9936 -6,000 -5,500 -5,000 0,0030 0,0031 0,0031 0,0032 0,0032 0,0033 0,0033 1/T Ln K
Gambar 22. Kurva persamaan Arrhenius untuk reaksai ordo 1 pada degradasi kadar polifenol ekstrak teh hijau
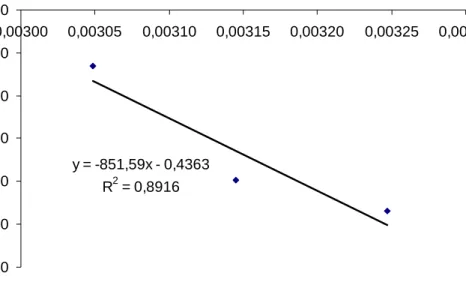
45 y = -851,59x - 0,4363 R2 = 0,8916 -3,250 -3,200 -3,150 -3,100 -3,050 -3,000 -2,950 0,00300 0,00305 0,00310 0,00315 0,00320 0,00325 0,00330 1/T Ln K
Gambar 23. Kurva persamaan Arhenius reaksai ordo nol pada penurunan kadar EGCG ekstrak teh hijau
y = -936,7x - 2,128 R2 = 0,9015 -5,200 -5,150 -5,100 -5,050 -5,000 -4,950 -4,900 0,0030 0,0031 0,0031 0,0032 0,0032 0,0033 0,0033 1/T Ln K
Gambar 24. Kurva persamaan Arhenius reaksai ordo satu pada penurunan kadar EGCG ekstrak teh hijau
y = -6493,6x + 17,435 R2 = 0,9886 -4,000 -3,000 -2,000 0,00300 0,00305 0,00310 0,00315 0,00320 0,00325 0,00330 1/T Ln K
Gambar 25. Kurva persamaan Arhenius untuk reaksai ordo 0 pada penurunan skor rasa ekstrak teh hijau
y = -7030,8x + 16,999 R2 = 0,9845 -6,000 -5,500 -5,000 -4,500 -4,000 0,00300 0,00305 0,00310 0,00315 0,00320 0,00325 0,00330 1/T Ln K
Gambar 26. Kurva persamaan Arhenius untuk reaksai ordo 1 pada penurunan skor rasa ekstrak teh hijau
47 y = -4301,5x + 10,296 R2 = 0,9915 -4,000 -3,500 -3,000 -2,500 -2,000 0,00300 0,00305 0,00310 0,00315 0,00320 0,00325 0,00330 1/T Ln K
Gambar 27. Kurva perubahan warna ekstrak kering teh hijau selama penyimpanan pada ordo reaksi satu
y = -4643,5x + 9,1764 R2 = 0,9899 -6,000 -5,800 -5,600 -5,400 -5,200 -5,000 -4,800 -4,600 0,00300 0,00305 0,00310 0,00315 0,00320 0,00325 0,00330 1/T Ln K
Gambar 28. Kurva perubahan warna ekstrak kering teh hijau selama penyimpanan pada ordo nol
y = -2953,7x + 6,2731 R2 = 0,9335 -3,500 -3,000 -2,500 0,00300 0,00305 0,00310 0,00315 0,00320 0,00325 0,00330 1/T Ln K
Gambar 29. Kurva persamaan Arhenius reaksai ordo satu pada perubahan warna ekstrak kering teh hijau
y = -3311,8x + 5,2093 R2 = 0,9365 -6,000 -5,500 -5,000 -4,500 0,00300 0,00305 0,00310 0,00315 0,00320 0,00325 0,00330 1/T Ln K
Gambar 30. Kurva persamaan Arhenius reaksai ordo nol pada perubahan warna ekstrak kering teh hijau
49
Umur simpan ekstrak teh hijau
Pada percobaan sebelumnya, jenis kinetika reaksi degradasi senyawa polifenol mengikuti kinetika reaksi orde satu sehingga penentuan umur simpan terhadap parameter mutu kandungan total polifenol dalam ekstrak teh hijau menggunakan persamaan reaksi orde satu.
Dari perhitungan diperoleh nilai konstanta reaksi degradasi kandungan total polifenol ekstra teh hijau pada suhu penyimpanan (28°C) menggunakan persamaan reaksi orde satu adalah 0,117 (Tabel 8). Nilai umur simpan ekstrak teh hijau diperoleh dengan memasukan nilai konstanta laju reaksi pada persamaan laju reaksi orde satu. Nilai batas mutu kritis kandungan polifenol adalah sebesar 35 % sehingga umur simpan ekstrak teh hijau berdasarkan parameter mutu kandungan total polifenol adalah sebesar 3,1 bulan (Tabel 9).
Tabel 9. Nilai umur simpan ekstrak teh hijau pada berbagai parameter mutu kritis
Parameter mutu Orde nol (Bulan) Orde satu (Bulan) Umur simpan (Bulan) Total polifenol 2,8 3,1 3,1 EGCG 2,5 2,8 2,5 Rasa 8,8 11,7 8,8 Warna Ekstrak kering 8,7 11,6 8,7 Warna air seduhan 5,7 7,6 5,7
Pada percobaan sebelumnya, jenis kinetika reaksi degradasi EGCG belum dapat ditentukan, sehingga penentuan umur simpan berdasarkan parameter kandungan EGCG harus dihitung menggunakan persamaan reaksi orde nol dan orde satu.
Dari nilai konstanta reaksi yang telah diperoleh kemudian ditentukan nilai umur simpan berdasarkan parameter mutu kandungan EGCG. Umur simpan kandungan EGCG adalah sebesar 2,5 bulan pada orde reaksi nol dan 2,8 bulan pada orde reaksi satu.
Dari hasil tersebut terlihat umur simpan pada persamaan reaksi ordo nol memiliki waktu yang lebih singkat. Untuk mengantisipasi adanya masalah serta menjamin mutu produk maka pemilihan orde reaksi didasarkan pada orde reaksi yang menghasilkan umur simpan yang lebih cepat. Sehingga berdasarkan parameter mutu kandungan EGCG, umur simpan ekstrak teh hijau adalah sebesar 2,5 bulan (Tabel 9).
Jenis kinetika reaksi pada perubahan rasa ekstrak teh hijau belum dapat diketahui sehingga penentuan umur simpannya harus dihitung menggunakan persamaan reaksi orde nol dan orde satu. Nilai konstanta laju reaksi perubahan rasa ekstrak teh hijau pada orde nol dan orde satu pada suhu penyimpanan (28°C) secara berturut-turut adalah sebesar 0,0160 dan 0,0017 (Tabel 8). Selanjutnya umur simpan ekstrak teh hijau diperoleh sebesar 8,8 bulan pada orde reaksi nol dan 11,7 bulan pada orde reaksi satu. Demi alasan menjaga kualitas produk, maka penentuan umur simpan pada parameter mutu rasa sementara ini ditentukan berdasarkan jenis kinetika yang menghasilkan umur simpan yang paling pendek. Sehingga, umur simpan ekstrak teh hijau berdasarkan parameter perubahan rasa adalah 8,8 bulan (Tabel 9).
Karena jenis kinetika reaksi terhadap parameter perubahan warna belum dapat ditentukan pada percobaan sebelumnya, maka penentuan jenis kinetika reaksi ditentukan berdasarkan jenis kinetika yang menghasilkan umur simpan yang paling pendek demi menjaga keamanan kualitas produk yang dihasilkan terhadap konsumen. Berdasarkan parameter perubahan warna akstrak kering umur simpan pada orde reaksi nol dan satu masing-masing adalah 8,7 bulan dan 11,6 bulan. Pada parameter perubahan warna air seduhan umur simpan pada orde reaksi nol dan satu masing-masing adalah 5,7 bulan dan 7,6 bulan. Dari hasil tersebut maka berdasarkan parameter perubahan warna ekstrak kering dan warna iar seduhan akan menghasilkan umur simpan sebesar 8,7 bulan dan 5,7 bulan secara berturut-turut.
Ditinjau dari perubahan warna secara keseluruhan perubahan warna air seduhan ekstrak teh hijau memiliki umur simpan yang lebih singkat, sehingga berdasarkan perubahan warna ekstrak teh hijau secara keseluruhan umur simpan ekstrak teh hijau memiliki umur simpan sebesar 5,7 bulan.
Umur simpan ekstrak teh hijau ditentukan dari paramter mutu paling kritis. Parameter mutu kandungan senyawa EGCG merupakan parameter mutu paling kritis, hal tersebut ditunjukan oleh nilai umur simpan yang paling pendek. Sehingga umur simpan ekstrak teh hijau adalah sebesar 2,5 bulan.