Bab IV Hasil Penelitian dan Pembahasan
IV. 1 Hasil Penelitian
IV.1. 1 Hasil Pengukuran Potensial Sel Larutan
Pengukuran potensial sel larutan selama proses titrimetri redoks berlangsung dilakukan secara kuantitatif dengan menggunakan pH-meter. Agar diperoleh hasil yang optimal maka pH-meter dikalibrasi dengan larutan buffer pada pH 4,00 dan pH 7,00. Berdasarkan hasil penelitian maka diperoleh harga potensial sel yang cukup signifikan untuk masing-masing oksidator yang digunakan (yaitu larutan K2Cr2O7, KMnO4 dan KBrO3) terhadap larutan garam Mohr dan larutan garam SnCl2.2H2O. Hasil pengukuran potensial sel pada titrasi redoks garam Mohr 0,1 M dan garam SnCl2.2H2O 0,05 M dengan oksidator K2Cr2O7 0,1 N, KMnO4 0,1 N dan KBrO3 0,1 N dapat dilihat pada Lampiran B.
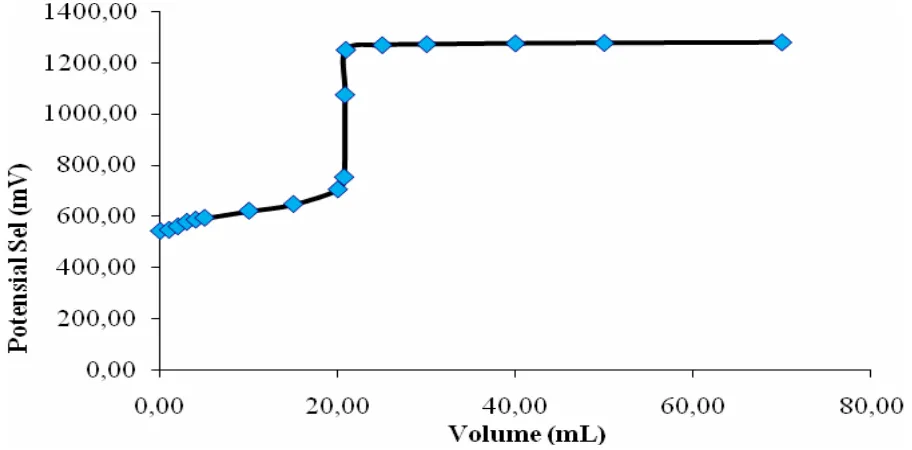
Langkah selanjutnya adalah pembuatan kurva titrasi redoks masing-masing oksidator dengan mengalurkan potensial sel larutan terhadap volume titran sehingga dapat ditentukan posisi titik ekivalen pada tiap-tiap titrasi redoks dimana kurva tersebut selanjutnya digunakan untuk melihat daya oksidator dari tiap-tiap oksidator yang telah digunakan. Kurva titrasi redoks garam Mohr 0,1 M dengan oksidator K2Cr2O7 0,1 N dapat dilihat pada Gambar IV.1 berikut :
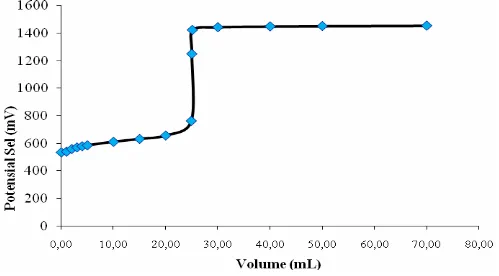
Kurva titrasi redoks garam SnCl2.2H2O 0,05 M dengan oksidator K2Cr2O7 0,1 N dapat dilihat pada Gambar IV.2 berikut :
Gambar IV. 2 Kurva titrasi redoks titrasi garam SnCl2.2H2O dengan oksidator K2Cr2O7
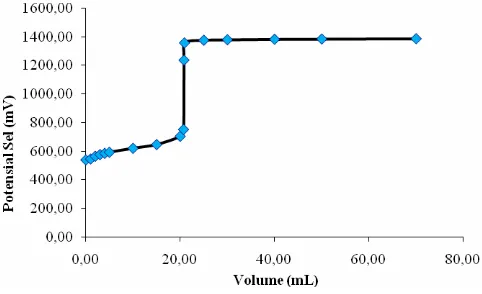
Kurva titrasi redoks garam Mohr 0,1 M dengan oksidator KMnO4 0,1 N dapat dilihat pada Gambar IV.3 berikut :
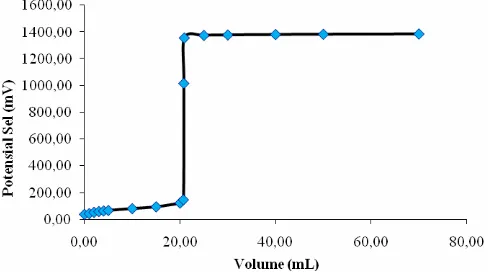
Kurva titrasi redoks garam SnCl2.2H2O 0,05 M dengan oksidator KMnO4 0,1 N dapat dilihat pada Gambar IV.4 berikut :
Gambar IV. 4 Kurva titrasi redoks titrasi garam SnCl2.2H2O dengan oksidator KMnO4
Kurva titrasi redoks garam Mohr 0,1 M dengan oksidator KBrO3 0,1 N dapat dilihat pada Gambar IV.5 berikut :
Kurva titrasi redoks garam SnCl2.2H2O 0,05 M dengan oksidator KBrO3 0,1 N dapat dilihat pada Gambar IV.6 berikut :
Gambar IV. 6 Kurva titrasi redoks titrasi garam SnCl2.2H2O dengan oksidator KBrO3
Volume titran (oksidator) yang digunakan selama titrimetri pada penelitian ini selanjutnya digunakan untuk menentukan kadar ion Fe2+ dalam garam Mohr dan kadar ion Sn2+ dalam garam SnCl2.2H2O. Hasil analisis kadar ion Fe2+ dalam garam Mohr 0,1 M dan kadar ion Sn2+ dalam garam SnCl2.2H2O dengan oksidator K2Cr2O7 0,02 M dapat dilihat pada Tabel C.1 dan Tabel C.2 (Lampiran C).
Pada proses titrimetri garam Mohr 0,1 M dengan oksidator KMnO4 terlebih dahulu diawali dengan standarisasi larutan KMnO4 dengan larutan natrium oksalat, Na2C2O4, 0,05 M. Dari proses standarisasi yang dilakukan secara duplo tersebut diperlukan KMnO4 sebanyak 25,2 mL dan 25,1 mL (volume rata-rata = 25,15 mL) sehingga diperoleh konsentrasi KMnO4 adalah sebesar 0,0199 M. Hasil analisis kadar ion Fe2+ dalam garam Mohr 0,1 M dan kadar ion Sn2+ dalam garam SnCl2.2H2O 0,05 M dengan oksidator KMnO4 0,0199 M dapat dilihat pada Tabel C.3 dan Tabel C.4 (Lampiran C).
Sedangkan hasil analisis kadar ion Fe2+ dalam garam Mohr 0,1 M dan kadar ion Sn2+ dalam garam SnCl2.2H2O dengan oksidator KBrO3 0,02 M dapat dilihat pada Tabel C.5 dan Tabel C.6 (Lampiran C).
IV. 2 Pembahasan
IV.2. 1 Perbandingan Daya Reduktor Ion Fe2+ dan Ion Sn2+
Istilah analisis titrimetri mengacu pada analisis kimia kuantitatif yang dilakukan dengan menetapkan volume suatu larutan yang konsentrasinya diketahui dengan tepat, yang diperlukan untuk bereaksi secara kuantitatif dengan larutan dari zat yang akan ditetapkan (Vogel, 1994). Penentuan titrimetri kebanyakan didasarkan pada reaksi-reaksi asam-basa, pengendapan, pembentukan kompleks dan oksidasi-reduksi yang dianggap berlangsung sempurna. Konsentrasi larutan standar yang digunakan dalam titrimetri biasanya dinyatakan dalam molaritas (Fernando, Quintos., 1997).
Dalam proses oksidasi-reduksi yang sesungguhnya, elektron-elektron dipindahkan dari zat pereduksi ke zat pengoksidasi. Oksidasi adalah proses, yang mengakibatkan kehilangan satu atau lebih elektron dari dalam atom atau ion. Reduksi adalah proses, yang mengakibatkan diperolehnya satu atau lebih elektron oleh atom atau ion. Zat pengoksidasi (oksidator) adalah zat yang memperoleh elektron dan tereduksi; zat pereduksi (reduktor) adalah zat yang kehilangan elektron dan teroksidasi. Dalam
semua proses oksidasi-reduksi (atau proses redoks), ada suatu pereaksi (reaktan) yang mengalami oksidasi, dan satu pereaksi mengalami reduksi. Karena kedua reaksi saling melengkapi (komplementer) dan terjadinya berbarengan (serempak) sehingga reaksi oksidasi tak dapat berlangsung tanpa adanya reaksi reduksi. Reagensia yang mengalami oksidasi dinamakan zat pereduksi atau reduktor, dan reagensia yang mengalami reduksi disebut zat pengoksidasi atau oksidator (Vogel, 1994).
Pada penelitian ini digunakan 3 macam oksidator yaitu K2Cr2O7, KMnO4 dan KBrO3, sedangkan sebagai reduktornya adalah ion Fe2+ dari garam Mohr dan ion Sn2+ dari garam SnCl2.2H2O. Untuk mengetahui urutan daya mengoksidasi dari masing-masing
oksidator maka dilakukan metode titrimetri redoks, masing-masing oksidator bertindak sebagai titran sedangkan reduktor bertindak sebagai titrat. Selanjutnya diukur potensial sel larutan tiap penambahan volume tertentu titran ke dalam larutan. Seperti yang dinyatakan Harjadi,W. (1993) bahwa ukuran kekuatan mengoksidasi atau mereduksi itu diberikan oleh besarnya potensial redoks sistem yang
bersangkutan.
Pada proses titrimetri redoks dengan menggunakan oksidator K2Cr2O7 terhadap ion Fe2+ dari garam Mohr dan ion Sn2+ dari garam SnCl2.2H2O diperoleh kurva titrasi redoks seperti pada kurva Gambar IV.1 dan kurva Gambar IV.2. Dari kurva tersebut dapat kita ramalkan bahwa telah terjadi reaksi redoks antara oksidator K2Cr2O7 dengan ion Fe2+ dari garam Mohr dan ion Sn2+ dari garam SnCl2.2H2O dengan persamaan reaksi redoks masing-masing sebagai berikut (Alexeyev, V., 1994) :
6Fe2+ + Cr2O72- + 14H+ 6Fe3+ + 2Cr3+ + 7H2O 3Sn2+ + Cr2O72- + 14H+ 3Sn4+ + 2Cr3+ + 7H2O
Titik akhir yang diperoleh pada reaksi redoks yang terjadi antara ion Fe2+ dalam garam Mohr terhadap oksidator K2Cr2O7 ditunjukkan oleh perubahan warna larutan titrat dari tidak berwarna menjadi hijau kebiruan hingga violet, seperti yang terlihat pada Gambar IV.7 berikut :
Sebelum titik akhir Warna Cr(III) Warna titik akhir Gambar IV. 7 Perubahan warna pada titrasi redoks dengan K2Cr2O7
Pada titrasi redoks ion Fe2+ dan ion Sn2+ dengan oksidator K2Cr2O7 ini digunakan indikator redoks diphenilamin, yang ditemukan pertama kali oleh Knop pada tahun 1924. Jika terdapat oksidator kuat maka diphenilamin akan bereaksi sebagai berikut :
Reaksi pertama membentuk difenilbenzidin yang tak berwarna; reaksi ini tidak reversibel. Pada reaksi yang kedua membentuk violet difenilbenzidin, reversibel, dan merupakan reaksi indikator yang sebenarnya (Harjadi, W., 1993). Namun pada penggunaannya, diphenilamin ini terdapat kekurangan yakni indikator ini harus dilarutkan dalam asam sulfat pekat karena sukar larut dalam air.
Berdasarkan data tabel potensial sel pada literatur (Alexeyev, V., 1994), diketahui bahwa potensial sel untuk ion Cr2O72-, Fe2+ dan ion Sn2+ berturut-turut adalah +1,33 V; +0,77 V; dan +0,15 V. Dari data tersebut maka dapat diketahui bahwa ion Fe2+ mempunyai potensial sel lebih besar dibandingkan ion Sn2+ yang menunjukkan bahwa ion Fe2+ bersifat oksidator lebih kuat dibandingkan ion Sn2+, atau dengan kata lain ion Sn2+ merupakan reduktor kuat dibandingkan ion Fe2+. Hal ini sebenarnya dapat dilihat dari kurva titrasi redoks yang telah diperoleh berdasarkan hasil penelitian di atas dimana kurva titrasi redoks ion Sn2+ dengan oksidator K2Cr2O7 terlihat lebih tajam dibanding kurva titrasi redoks ion Fe2+ dengan oksidator K2Cr2O7.
Kenyataan ini menunjukkan bahwa ion Sn2+ mempunyai harga Esel yang lebih rendah dibandingkan ion Fe2+ sehingga memberikan kurva titrasi redoks yang cukup tajam.
Pada reaksi redoks yang terjadi antara ion Fe2+ dan ion Sn2+ dengan oksidator KMnO4 tidak digunakan indikator karena oksidator KMnO4 sendiri telah berwarna violet yang akan berubah warna menjadi merah muda jika telah mencapai titik akhir, seperti pada Gambar IV.8 berikut :
Sebelum titik akhir Warna titik akhir
Gambar IV. 8 Perubahan warna pada titrasi redoks dengan KMnO4
Persamaan reaksi redoks yang terjadi adalah sebagai berikut (Alexeyev, V., 1994) : 5Fe2+ + MnO4- + 8H+ 5Fe3+ + Mn2+ + 4H2O
3Sn2+ + MnO4- + 16H+ 3Sn4+ + Mn2+ + 8H2O
Kurva titrasi redoks yang diperoleh pada reaksi redoks yang terjadi antara ion Fe2+ dan ion Sn2+ dengan oksidator KMnO4 seperti yang terlihat pada kurva Gambar IV.3 dan IV.4 di atas, juga dapat digunakan untuk meramalkan kekuatan oksidator antara ion Fe2+ dan ion Sn2+. Berdasarkan kurva yang diperoleh ternyata kurva titrasi redoks ion Sn2+ terhadap oksidator KMnO4 juga lebih tajam dibandingkan kurva titrasi
redoks ion Fe2+ terhadap oksidator KMnO4. Hal ini menunjukkan bahwa ion Sn2+ mempunyai harga potensial sel yang lebih kecil dibandingkan ion Fe2+. Kenyataan ini sesuai dengan data tabel potensial sel pada literatur dimana ion Fe2+ mempunyai harga potensial sel sebesar + 0,77 Volt sedangkan ion Sn2+ sebesar +0,15 Volt (Alexeyev, V., 1994).
Pada reaksi redoks yang terjadi antara ion Fe2+ dan ion Sn2+ dengan oksidator KBrO3, seperti halnya dengan titrasi redoks dengan oksidator K2Cr2O7, juga digunakan indikator methyl orange, dimana warna larutan akan berubah dari merah menjadi berwarna jingga pada saat tercapai titik akhir, seperti yang terlihat pada Gambar IV.9 berikut :
Sebelum penambahan
titran Menjelang titik akhir Warna titik akhir Gambar IV. 9 Perubahan warna pada titrasi redoks dengan KBrO3
Persamaan reaksi redoks yang terjadi adalah sebagai berikut (Alexeyev, V., 1994) : 6Fe2+ + BrO3- + 6H+ 6Fe3+ + Br- + 3H2O
3Sn2+ + BrO3- + 6H+ 3Sn4+ + Br- + 3H2O
Kurva titrasi redoks yang diperoleh pada reaksi redoks yang terjadi antara ion Fe2+ dan ion Sn2+ dengan oksidator KBrO3 seperti yang terlihat pada Gambar IV.5 dan
IV.6 di atas, selanjutnya juga digunakan untuk meramalkan kekuatan oksidator antara ion Fe2+ dan ion Sn2+. Berdasarkan kurva yang diperoleh ternyata kurva titrasi redoks ion Sn2+ terhadap oksidator KBrO3 juga lebih tajam dibandingkan kurva titrasi redoks ion Fe2+ terhadap oksidator KBrO3. Hal ini menunjukkan bahwa ion Sn2+ mempunyai harga potensial sel yang lebih kecil dibandingkan ion Fe2+. Kenyataan ini sesuai dengan data tabel potensial sel pada literatur dimana ion Fe2+ mempunyai harga potensial sel sebesar +0,77 Volt sedangkan ion Sn2+ sebesar +0,15 Volt (Alexeyev, V., 1994).
IV.2. 2 Perbandingan Daya Oksidator K2Cr2O7, KMnO4 dan KBrO3
Reaksi oksidasi reduksi berasal dari transfer langsung elektron dari donor ke akseptor. Bermacam reaksi redoks dapat digunakan untuk analisis titrasi volumetri asalkan kesetimbangan yang tercapai pada setiap penambahan titran dapat berlangsung dengan cepat. Selain itu diperlukan juga indikator yang mampu menunjukkan titik ekivalen stoikiometri dengan akurasi yang tinggi. Banyak titrasi redoks dilakukan dengan menggunakan indikator warna. Dua setengah reaksi untuk setiap sistem titrasi redoks selalu dalam kesetimbangan pada seluruh titik setelah mulainya titrasi, sehingga potensial reduksi untuk separuh sel adalah identik pada seluruh titik. Sedangkan potensial sel, Esel, berubah selama titrasi dimana perubahannya spesifik. Pada sekitar titik ekivalen perubahan potensial adalah yang paling besar. Variasi Esel dengan volume titran menunjukkan bahwa sistem titrasi redoks dapat digunakan untuk menentukan titrasi yang sulit ditentukan titik ekivalennya (Purba, Michael., 2002).
Data potensial sel (Esel) yang diperoleh pada hasil penelitian ini dibuat kurva titrasi redoks yaitu dengan mengalurkan kurva Esel dengan volume dari titran, dalam hal ini adalah volume dari oksidator K2Cr2O7, KMnO4 dan KBrO3. Pada pembuatan kurva titrasi yang perlu diingat bahwa pada setiap tahap titrasi selalu terbentuk kesetimbangan antara titran yang sudah ditambahkan dengan titrat. Ini merupakan dasar utama perhitungan titik-titik kurva titrasi. Dalam hal ini, ordinat ialah potensial
larutan, sebab inilah yang mencirikan keadaan larutan pada setiap saat titrasi dan berubah bersama dengan penambahan titran. Selanjutnya ditentukan titik ekivalen dari kurva titrasi redoks tersebut. Titik ekivalen ditandai dengan perubahan yang cukup besar pada fungsi ordinat. Kurva titrasi adalah simetri di sekitar titik ekivalen, karena pada saat itu perbandingan ekivalen keadaan teroksidasi dan keadaan tereduksi sama dengan satu (E. Harris, Walter., -)
Menurut Harjadi,W. (1993) dan Quane, Denis (1971), secara umum titik ekivalen untuk titrasi berdasar :
OksA + ne RedA OksB + me RedB
+
m.OksA + n.RedB m.RedA + n.OksB dapat dinyatakan sebagai berikut :
ETE = n.EoA + m.EoB
n + m . . . Pers.(2)
dengan syarat bahwa (i) tidak ada zat lain yang terlibat kecuali oksidator dan reduktor, (ii) tidak ada perubahan koefisien reaksi antara oksidator dan hasil reduksinya, maupun reduktor dengan hasil oksidasinya. Namun pada kenyataannya, pada penelitian ini faktor pH ikut menentukan ETE karena ion hidrogen terlibat dalam reaksi titrasi dan disamping itu konsentrasi Cr3+, Mn2+ dan Br- juga ikut berpengaruh dimana koefisien reaksi ion Cr2O72-, MnO4-, BrO3- sebagai oksidator tidak sama dengan koefisien Cr3+, Mn2+, Br- sebagai hasil reduksi tersebut.
Disamping faktor-faktor di atas, indikator yang digunakan pada titrasi redoks juga sangat mempengaruhi pengukuran harga Esel larutan dimana suatu indikator harus berubah warna pada atau dekat titik ekivalen. Jika titrasi dilaksanakan maka akan ada perubahan besar dari potensial pada titik ekivalen dan ini akan cukup menyebabkan perubahan warna pada indikator. Misalnya saja pada titrasi redoks garam Mohr dengan oksidator kalium dikromat dalam suasana asam sulfat-posfat yang menggunakan indikator redoks natrium difenilamin sulfonat. Bentuk reduksi
indikator ini tidak berwarna, sedangkan bentuk oksidasinya violet (ungu tua) dan mempunyai potensial peralihan yang cukup tinggi yaitu 0,85 V dan untuk menurunkan pengaruh potensial tersebut maka ke dalam larutan ditambahkan asam posfat sehingga potensial indikator menjadi 0,60 V. Pada pengerjaan titrasi redoks yang menggunakan konsentrasi larutan kurang dari 0,1 M maka perlu adanya suatu larutan blanko sehingga dapat diperoleh harga Esel larutan yang tanpa dipengaruhi oleh indikator, namun karena pada penelitian ini digunakan larutan sampel dengan konsentrasi ~0,1 M maka pada penelitian ini tidak dibuat larutan blanko sebagai perbandingan karena pengaruh penambahan indikator redoks pada larutan yang sangat kecil (yaitu ~0,01 V).
Berdasarkan kurva titrasi yang diperoleh pada titrasi redoks ion Fe2+ dengan oksidator K2Cr2O7, KMnO4 dan KBrO3, yaitu kurva Gambar IV.1; IV.3 dan IV.5, maka dapat kita lihat bahwa harga Esel di titik ekivalen pada masing-masing kurva adalah sebagai berikut :
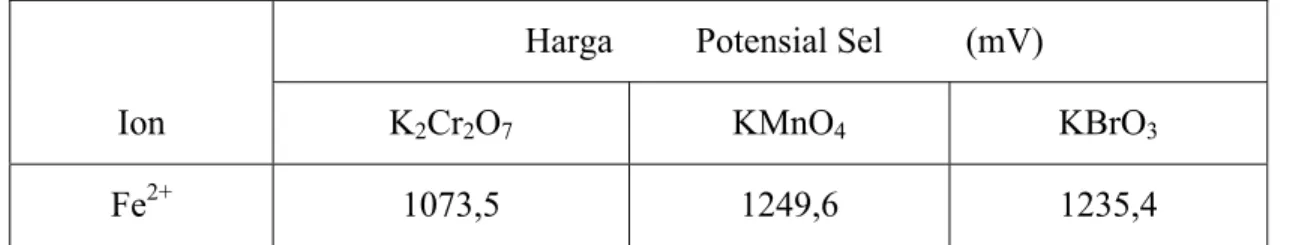
Tabel IV. 1 Harga potensial sel (Esel) pada titik ekivalen
Harga Potensial Sel (mV)
Ion K2Cr2O7 KMnO4 KBrO3
Fe2+ 1073,5 1249,6 1235,4
Berdasarkan Tabel IV.1, maka dapat diramalkan urutan daya oksidator dari masing-masing oksidator yang digunakan pada penelitian ini yaitu KMnO4 > KBrO3 > K2Cr2O7. Jika merujuk kembali pada data berdasarkan literatur (Alexeyev, V., 1994), data potensial sel masing-masing oksidator adalah sebagai berikut :
Cr2O72- + 14H+ + 6e 2Cr3+ + 7H2O ; Eo = +1,33 V MnO4- + 8H+ + 5e Mn2+ + 4H2O ; Eo = +1,51 V BrO3- + 6H+ + 6e Br- + 3H2O ; Eo = +1,44 V.
Dengan demikian, metode titrimetri yang dilakukan dapat menunjukkan urutan kekuatan (daya) oksidator dari ketiga oksidator yang digunakan pada penelitian ini, yakni KMnO4 merupakan oksidator yang terkuat dibandingkan KBrO3, sedangkan K2Cr2O7 merupakan oksidator yang terlemah diantara ketiganya.
Urutan daya oksidator yang sama ternyata juga ditunjukkan pada gambar kurva titrasi redoks yang diperoleh pada reaksi redoks ion Sn2+ terhadap oksidator K2Cr2O7, KMnO4 dan KBrO3, yaitu kurva pada Gambar IV.2; IV.4 dan IV.6, dengan harga Esel dititik ekivalen pada masing-masing kurva adalah sebagai berikut :
Tabel IV. 2 Harga potensial sel (Esel) pada titik ekivalen
Harga Potensial Sel (mV)
Ion K2Cr2O7 KMnO4 KBrO3
Sn2+ 874,2 1131,7 1015,8
Berdasarkan kurva titrasi redoks yang diperoleh, dapat dijelaskan bahwa bentuk kurva (kecuraman) tergantung dari harga n (jumlah elektron yang terlibat dalam reaksi sistem) dimana semakin besar harga n, maka semakin datar kurva tersebut (Harjadi W., 1993). Hal ini dapat dilihat perbandingannya antara kurva titrasi redoks ion Fe2+ dan kurva titrasi redoks ion Sn2+ terhadap masing-masing oksidator. Sedangkan besarnya perubahan potensial sekitar titik ekivalen tergantung dari selisih Eo titrat dan Eo titran yang bersangkutan.
Dalam suatu titrasi potensiometrik, titik akhir ditemukan dengan menentukan volum yang menyebabkan suatu perubahan relative besar dalam potensial apabila titran ditambahkan. Dengan demikian kadar ion Fe2+ dalam garam Mohr dan ion Sn2+ dalam garam SnCl2.2H2O dapat ditentukan berdasarkan banyaknya volume titran
(oksidator) yang digunakan saat mencapai titik akhir titrasi, dimana pada keadaan jumlah ion titran (Cr2O72-, MnO4-, BrO3-) ekivalen dengan ion Fe2+ dan ion Sn2+. Jika volume dan kemolaran tidak sama maka berlaku persamaan :
Vtitrat x Mtitrat x ntitrat = Vtitran x Mtitran x ntitran . . . Pers.(3)
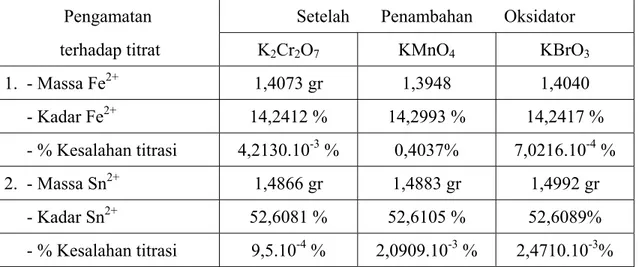
Sehingga diperoleh kadar ion Fe2+ dan ion Sn2+ masing-masing seperti pada Tabel IV.3 berikut :
Tabel IV. 3 Kadar ion Fe2+ dalam garam Mohr dan ion Sn2+ dalam garam SnCl2.2H2O setelah dititrasi dengan oksidator K2Cr2O7, KMnO4 dan KBrO3
Pengamatan Setelah Penambahan Oksidator
terhadap titrat K2Cr2O7 KMnO4 KBrO3
1. - Massa Fe2+ 1,4073 gr 1,3948 1,4040 - Kadar Fe2+ 14,2412 % 14,2993 % 14,2417 % - % Kesalahan titrasi 4,2130.10-3% 0,4037% 7,0216.10-4 % 2. - Massa Sn2+ 1,4866 gr 1,4883 gr 1,4992 gr - Kadar Sn2+ 52,6081 % 52,6105 % 52,6089% - % Kesalahan titrasi 9,5.10-4 % 2,0909.10-3 % 2,4710.10-3%
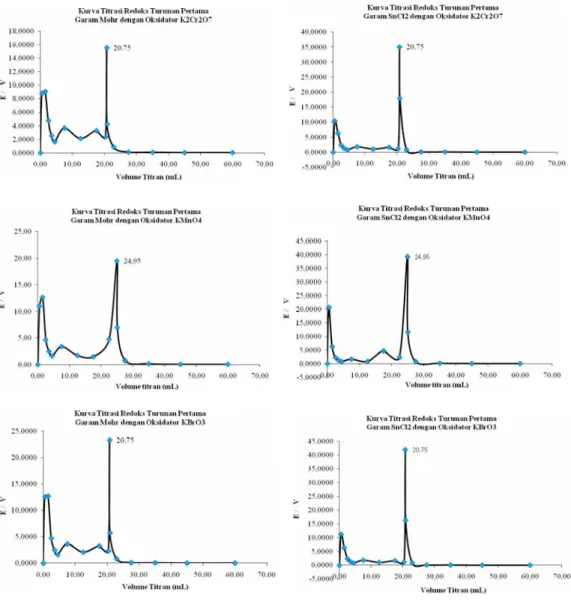
Berdasarkan Tabel IV.3 dapat terlihat bahwa pelaksanaan metode titrimetri yang dilakukan memiliki ketelitian yang cukup tinggi karena dari hasil perhitungan persen kesalahan titrasi rata-rata dibawah 0,01%. Ketelitian perolehan hasil dari penelitian ini juga dapat kita lihat dari hasil pengukuran titik akhir titrasi yang rata-rata mendekati titik ekivalen reaksi. Hal ini ditunjukkan kurva pada Gambar IV.10 :
Gambar IV. 10 Kurva titrasi redoks turunan pertama garam Mohr dan garam SnCl2.2H2O terhadap oksidator K2Cr2O7, KMnO4 dan KBrO3
Jika ditinjau dari hasil potensial sel yang diperoleh, ternyata masih cukup berbeda dari harga potensial sel literatur, hal ini disebabkan karena banyaknya faktor-faktor yang mempengaruhi selama pelaksanaan titrimetri, antara lain kondisi pH larutan; kemungkinan adanya pengotor pada bahan yang ikut terlibat selama reaksi redoks; adanya indikator serta adanya perubahan koefisien reaksi pada sistem reaksi redoks.
IV.2. 3 Reaksi Redoks dengan Konsep Laboratory Based-Learning
Hakikat ilmu kimia adalah ilmu yang berlandaskan pada eksperimen sehingga metode praktikum mendominasi sebagian besar pokok bahasan dalam pelajaran kimia. Praktikum dapat mengembangkan kreativitas dan membekali siswa bagaimana cara belajar yang efektif dan efisien serta mandiri. Praktikum merupakan kegiatan siswa dengan melibatkan kegiatan fisik dan mental, yang memberikan pengalaman dan usahanya mengkonstruksi pengetahuan (Arifin, M. 2003).
Hakikat ilmu kimia sebagai ilmu eksperimen juga dikemukakan oleh Bradley, J.D. (1998). Namun menurutnya tidak jarang ilmu kimia di dalam kelas disampaikan tanpa eksperimen. Dan ketika para guru ditanya oleh para siswa tentang mengapa eksperimen tersebut tidak dilakukan, maka seringkali diungkapkan beberapa alasan berikut :
¾ Keterbatasan alat atau bahan kimia
¾ Tidak ada laboratorium
¾ Keterbatasan waktu
¾ Tidak mempunyai asisten laboratorium (analis)
¾ Bekerja di laboratorium sangat berbahaya
¾ Peraturan-peraturan keselamatan seringkali menghalangi pekerjaan praktis
¾ Pekerjaan praktis di laboratorium sukar diuji
¾ Guru merasa kurang persiapan atau kurang berpengalaman.
Alasan-alasan di atas tidak sepenuhnya valid karena hanya sebagian kecil guru yang berpendapat demikian. Sebagian besar guru malah berpendapat bahwa eksperimen merupakan bagian integral dari ilmu kimia karena dengan eksperimen :
¾ Ilmu kimia menjadi lebih menarik dan nyata
¾ Konsep yang bersifat abstrak menjadi lebih mudah untuk dimengerti
¾ Menggambarkan metoda-metoda dari ilmu pengetahuan
Pengetahuan dibentuk dalam struktur konsepsi seseorang. Struktur konsepsi membentuk pengetahuan bila konsepsi itu berlaku dan berhadapan dengan pengalaman seseorang (Suparno, P., 1997). Kegiatan praktikum memiliki kelebihan dibandingkan dengan metode yang lain karena kegiatan praktikum memberikan
pengetahuan bertahap, dimana siswa akan mengalami semua kejadian nyata yang
ada. Pengetahuan bertahap merupakan pengetahuan yang memiliki resistensi yang
tinggi sehingga dapat lebih lama diingat dan lebih mudah untuk digunakan kembali.
Menurut Hofstein dan Lunetta (1982), kegiatan laboratorium merupakan pengalaman belajar yang direncanakan agar murid berinteraksi dengan dengan bahan-bahan pelajaran dengan pengamatan gejala. Pengalaman ini mungkin mempunyai susunan yang berbeda-beda, yang ditentukan oleh guru, buku pedoman laboratorium, fase-fase perencanaan, analisis dan interpretasi, aplikasi dan juga fase pelaksanaannya. Kegiatan laboratorium tidak dapat dipisahkan dengan pelajaran IPA karena seringkali dikatakan bahwa sains bukanlah sains sebenarnya, jika tidak disertai eksperimen dan kegiatan laboratorium.
Sedangkan Romey (1978) berpendapat bahwa kegiatan laboratorium yang berorientasi sebagai sarana untuk menjelaskan keterangan guru atau buku pelajaran sangat berlawanan dengan sains sebenarnya. Sains adalah suatu ilmu pegetahuan eksperimental, observasional, dan berkiblat pada laboratorium, oleh karena itu pelajaran sains yang efektif seharusnya berpusat pada laboratorium, bukan berpusat pada buku pelajaran.
Berdasarkan kenyataan di atas, peneliti dalam hal ini berupaya untuk membuat satu modul praktikum yang dapat mengefektifkan pemanfaatan laboratorium yang selanjutnya dapat digunakan dalam pembelajaran kimia pada umumnya, dan pada materi redoks dan elektrokimia pada khususnya.
Laboratorium merupakan suatu media yang diharapkan dapat mendorong dan membantu para siswa membangun pengetahuannya dan keterampilannya dalam menggunakan alat. Siswa diberi kesempatan untuk melaksanakan eksperimen-eksperimen dan selanjutnya menginterpretasikan hasil-hasilnya. Para siswa juga diajarkan untuk bisa bekerja sama dalam kelompok-kelompok kecil sehingga metode belajar dengan memanfaatkan laboratorium (Laboratory Based-Learning) ini bukan hanya membangun pengetahuan konsep/ilmu melainkan juga membangun pengetahuan sosial pada diri siswa.Dalam hal ini para siswa perlu belajar bagaimana caranya mengembangkan kerjasama dan mempercayai teman kerjanya di laboratorium dan mengajarkan para siswa untuk saling tolong-menolong dalam belajar ilmu kimia sehingga dapat mengembangkan suatu sikap positif tentang ilmu kimia (Ivan A.Shibley Jr., 2002).
Kegiatan di dalam laboratorium tersebut juga dirancang untuk memberi pengalaman kepada para siswa tentang analisis serta penguasaan teknik-teknik pokok dalam laboratorium (seperti menimbang, penggunaan pipet, titrasi dan penggunaan labu ukur), sehingga dapat juga digunakan sebagai bahan untuk penilaian keterampilan praktis siswa di laboratorium (Williams, K.R., 1998).
Dalam Kurikulum Kimia untuk SMA/MA, reaksi redoks dipelajari di Kelas XII Semester pertama dengan Standar Kompetensi : Memahami reaksi oksidasi reduksi dan sel elektrokimia serta penerapannya dalam teknologi dan kehidupan sehari-hari. Beberapa indikator yang ingin dicapai pada materi ini adalah sebagai berikut :
• Menyetarakan persamaan reaksi redoks dengan cara bilangan oksidasi.
• Menyetarakan persamaan reaksi redoks dengan cara setengah reaksi (ion elektron). • Menyimpulkan ciri reaksi redoks yang berlangsung spontan berdasarkan hasil
pengamatan.
• Menggambarkan susunan sel volta atau sel galvani dan menjelaskan fungsi tiap bagiannya.
• Menghitung potensial sel berdasarkan data potensial standar dan membandingkan hasil pengukuran dengan hasil perhitungan.
• Menjelaskan bagaimana energi listrik dihasilkan dari reaksi redoks dalam sel volta.
• Menjelaskan prisnsip-prinsip sel-sel volta yang banyak digunakan dalam kehidupan sehari-hari (Purba, M., 2002).
Modul praktikum yang telah disusun, dibuat sedemikian rupa sehingga beberapa indikator di atas dapat tercapai dalam satu kegiatan praktikum. Dari praktikum yang dilaksanakan, siswa dapat meramalkan urutan daya oksidator dari oksidator-oksidator yang digunakan serta dapat meramalkan kekuatan reduktor dari ion Cr2O72-, MnO4-, BrO3, Fe2+ dan ion Sn2+ tanpa melihat tabel data potensial sel dari buku/literatur. Disamping itu juga akan memberikan keterampilan pada siswa dalam metode titrimetri serta keterampilan stoikiometri siswa dalam menghitung kadar ion Fe2+ dan ion Sn2+ dalam garam Mohr dan garam SnCl2.2H2O berdasarkan reaksi redoks yang terjadi.
Sedangkan bagi guru, banyak hal yang bisa dijelaskan dari pelaksanaan modul praktikum yang telah disusun ini, yakni tidak hanya menjelaskan tentang konsep reaksi redoks secara umum, melainkan juga tentang stoikiometri reaksi redoks, potensial sel (sel Volta) dan metode titrimetri.