LAPORAN PRAKTIKUM BIOFISIKA POTENSIAL ELEKTROKIMIA
(B.PE)
Nama : Ruth Ellisa Christiani
NIM : 1208305012
Tanggal : 24 Mei 2013
Kelompok : III
NamaAnggota : 1. I Putu Agus Sumardika (1208305009) 2. Gusti Ayu Putri Arnila (1208305010) Dosen Pengajar : Gusti Ngurah Sutapa,S.Si.,M.Si
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA
I. POTENSIAL ELEKTROKIMIA
(B.WR)
I. Tujuan
Menyelidiki reaksi-reaksi elektrokimia antara sebuah electrode dan suatu larutan ionic dan menggali penggunaan electrode sebagai sensor kimia.
II. Dasar Teori
Ketika reaksi – reaksi kimia terjadi antara berbagai bahan di dalam sebuah sistem, termaksud bahan penyusun elektroda docelupkan kedalam suatu larutan, sevara umum susunan sistem akan berubah sampai dicapai suatu kesetimbangan. Reaksi – reaksi kimia pada umumya melibatkan banyak zat –zat kimia, misalnya :
CH3CH2OH + CH3COOH CH3COOCHCh3 + H2O (1.1) (ethyl alcohol) (Asam asetat) (ethylasetat) (air)
Bila reaksi kimia telah mencapai keseimbangan, yaitu dimana konsentrasi dari berbagai zat tidak berubah lagi terhadap waktu, reaksi kimia kedua arah (ke kanan dank ke kiri) pada reaksi kimia di atas berlangsung dengan kelajuan yang sama.
Syarat kesetimbangan untuk reaksi – reaksi kimia semacam itu dapat dihubungkan dengan potensial kimia dari komponen – komponen penyusun sistem. Hal ini dapat kita lihat dari contoh berikut. Perhatikan sebuah reaksi kimia umum :
v1X1 + v2X2 + v3X3 + … v1Xi + v1+1Xi+1 + v1+2Xi+2 + … (1.2)
Persamaan kimia (1.2) dapat ditulis dalam bentuk yang lebih pendek yaitu :
i
X
i= 0
(1.3)Dimana Xi mewakili berbagai zat kimia yang terlibat didalam reaksi dan v1 disebut koefisien
dihasilkan ketika reaksi berlangsung dari kiri ke kanan dan v1 negatif jika zat tersebut lenyap
ketika reaksi erlangsung dari kiri ke kanan. Aturan ini hanya diperlukan agar kita konsiiten dalam maslah pemberian tanda untuk koefisien stoichiometri. Perhatikan reaksi berikut :
2A + B C (1.4)
Maka koefisien stoichiometri adalah :
Xi = A, vi = -2, X2 = B, v2 = -1, X3 = C, v3= +2
Keadaan kesetimbangan reaksi kima berlangsung dengan perubaham entropy sistem yang bersangkutan karena perubahan komposisi kimianya. Kelangsungan reaksi kimia dapat dijelaskan dengan suku perubahan jumlah,dNi, dari salah satu bahan penyususun, tetapi jika koefisisen stoichiometri tidak sama, pengukuran kelangsungan reaksi bisa berbeda untuk bahan yang berbeda. Suatu besaran yang mudah digunakan dalam mengukuran kelangsungan reaksi adalan koefisisen stoichiometri harganya akan sama untuk semua bahan. Maka dapat didefinisikan perubahan komposisi suatu sistem sebagai berikut :
d
(1.5)
Besaran ini harganya sama untuk semua komponen “i” yang terlibat dalam reaksi.
Perubahan entropy dalam suatu sistem muncul sebagai akibat perubahan di dalam berbagai parameter termodinamik, misalnya energi dakhil, volume dll. Begitu pula dengan perubahan didalam komposisi sistem. Persamaan umum untuk perubahan entropy diberikan oleh :
dS = idNi (1.6)
Suku terakhir persamaan (1.6) mewakili perubahan entropy akibat perubahan komposisi itu
bermuatan listrik ( sebuah ion ), potensial kimia pada persamaan (1.6) harus diganti dengan
potensial elektrokimia Kedua bersamaan ini diberikan oleh :
I + Zi F (1.7)
Dimana :
F = Konstanta Faraday
= Potensial elektrostatik local
Potensial kimia untuk larutan encer dari bahan kimia “i” diberikan oleh :
i,o + RTIn Ci (1.8)
Dimana :
Ci = Konsentrasi bahan “i”
i,o = Potensial kimia standar bahan “i”
R = Tetapan gas (8.31 J/(mol.K)
T = Suhu absolute (K)
Sehingga dapat ditulis perubahan entropy akibat perubahan komposisi adalah :
Pada kesetimbang untuk perubahan komposisi yang kecil, yaitu d ≠ 0, perubahan
entropynya harus nol (pada suhu dan volume konstanta) dan oleh karena itu dari persamaan (1.9) dapat ditulis syarat untuk kesetimbangan sebagai berikut :
i i
= 0
(1.10)
APLIKASI:
1. Elektroda Ag/AgCl
Perhatikan system berikut yang terdiri dari sebuah kawat perak yang dilapisi dengan perak khlorida yang bersentuhan dengan suatu larutan berisi ion khlorida. System berikut ditunjukkan pada gambar 1.1. Reaksi kimia yang terlibat di dalam sistem ini adalah sebagai berikut :
Kawat Perak
Lapisan Ag/AgCl Larutan Ag+ Cl
-Gambar 1.1. Elektroda Ag/AgCl digunakan sebagai sensor
Reaksi 1, di dalam elektroda logam (Ag)
Ag Ag+ + e
Reaksi 2, pada lapisan Ag/AgCl
Ag+ + Cl- AgCl
Perak khlorida (AgCl) sangat sulit larut, karena memiliki produk kelarutan K 10-14. karena
selalu konstan baik terhadap purubahan Ag+ maupun Cl-. Akan tetapi konsentrasinya berubah terhadap suhu.
Untuk kesetimbangan, dari pembahasan (1.10) reaksi 1, kita dapatkan :
-
Ag+
Ag++
e- = 0 (1.11)Konsentrasi Ag selalu konstan, begitu pula dengan elektron di dalam kawat perak. Substitusi ke dalam persamaan potensial elektrokimia (persamaan 1.7 dan 1.8) kita peroleh :
Ag+ = Konstanta + F ele
Dimana ele adalah potensial elektrostatik pada elektroda dan telah disamaratakan berbagai
suku konstan termaksud potensial kimia standar untuk Ag+. Namun perhatikan, bahwa sementara konstanta ini tergantung terhadap konsentrasi dan konsentrasi tergantung pada suhu.
Untuk reaksi 2 pada kesetimbangan dengan menggunakan syarat persamaan (1.10) diperoleh :
-
Ag+ Cl-+
AgCl = 0Maka
Ag+
=
AgClCl-
(1.12)
Penggabungan persamaan (1.11) dengan persamaan (1.12) akan menghasilkan :
F ele + Konstanta = AgCl Cl
F ele + Konstanta1 = Konstanta2 – RT ln Ccl-+ F lar
Maka potensial elektroda adalah beda potensial antara elektroda dengan larutan yang diberikan oleh :
V = ele lar = Konstanta lnCcl
-Atau,
V = Vo 1nCcl- (1.13)
Dimana Vo adalah konstanta yang hanya tergantung pada suhu. Maka potensial elektroda tergantung pada konsentrasi ion khlorida.
2. Larutan – larutan tak encer
Bila konsentrasi dari ion sangat tinggi, interaksi antar ion akan mengurangi potensial kimia, maka konsentrasi efektif dalam bentuk persamaan (1.8) juga berkurang. Dalam
memperhitungkan pengaruh ini dikenal koefisien aktifatas , maka dapat ditulis potensial
elektrokimia (persamaan 1.8) sebagai berikut :
i
=
i + RT ln iCi + ziF (1.14)Seringkali perkalian YiCi ditulis dalam bentuk :
Dan ai menunjukkan aktivitas. Perlu diperhatikan bahwa secara umum aktivitas ai 1.
Sebagai contoh, koefisien aktivitas 1 mM larutan KCl 1. Namun untuk larutan 100 mM KCl
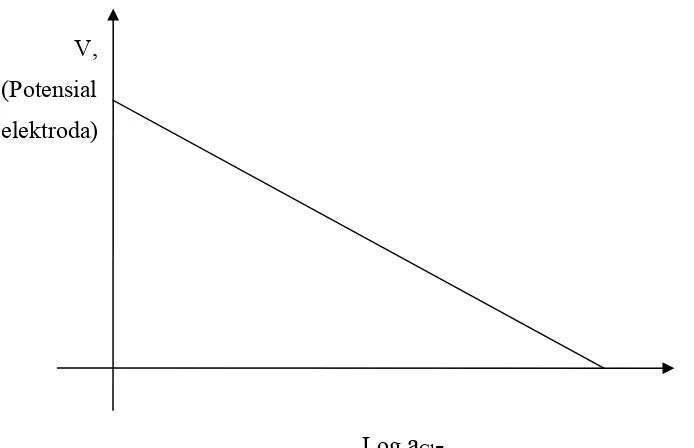
koefisien aktivitas untuk ion Cl- adalah 0,7. Perubahan potensial elektroda untuk sebuah elektroda Ag/AgCl sebagai fungsi dari aktivitas ion Cl- mempunyai bentuk gambar seperti Gambar 1.2
V, (Potensial elektroda)
Log
a
Cl-Gambar 1.2. Perubahan potensial elektroda Ag/AgCl sebagai fungsi dari aktifitas ion Cl- di dalam larutan.
III. Alat dan Bahan
a. Dua utas kawat perak berdiameter 0,5 mm masing-masing sepanjang 4 cm yang dilapisi Ag/AgCl
b. Multimeter digital c. Dua liter air suling
d. Dua buah gelas beaker 250 ml e. Tabung ukuran 250 ml
h. Larutan KCl
IV. Cara Kerja
1) Larutan KCl 1 mM dimasukkan ke dalam dua gelas beaker.
2) Kedua elektroda Ag/AgCl dimasukkan ke dalam gelas beaker A dan beda potensial diukur antara keduanya. Beda potensial ini harus dekat ke nilai nol (mV). Catat setiap perbedaan dan catat elektroda mana yang lebih positif dari yang lainnya. Semua pengukuran beda potensial berikutnya harus dikoreksi dengan kesalahan nilai nol ini. 3) Jembatan garam diletakkan antara kedua gelas beaker.
4) Elektroda Ag/AgCl dimasukkan kedalam gelas beaker. Beda potensial diukur antara kedua elektroda Ag/AgCl dan ketika kedua gelas beaker berisi larutan 1mM, beda potensial ini harus hampir nol (mV).
5) Kedua elektroda dicuci dan jembatan garam dengan air suling dan dilap hingga kering menggunakan kertas tisu.
6) Larutan KCl 0,1 mM dimasukkan ke dalam gelas beaker A.
7) Larutan didalam gelas beaker B diganti dengan larutan KCl 0,1 mM dan diukur beda potensial antara kedua elektroda Ag/AgCl.
8) Langkah 4 diulangi untuk larutan KCl 1,5; 10; 50; 100; 500; 1000 mM di dalam beaker B.
9) Plot beda potensial sebagai fungsi konsentrasi KCl dalam gelas beaker B.
10) Plot perubahan teoritis beda potensial sebagai fungsi konsentrasi KCl dalam beaker B, dianggap bahwa koefisien aktivitas larutan selalu berharga 1.
11) Setiap perubahan antara plot teoritis dengan plot percobaan dicatat. Dan apa yang dapat disimpulkan.
12) Langkah 4 sampai 9 diulangi dengan larutan KCl 100 mM dalam beaker A, dan konsentrasi 0,1 sampai 1000 mM dalam beaker B.
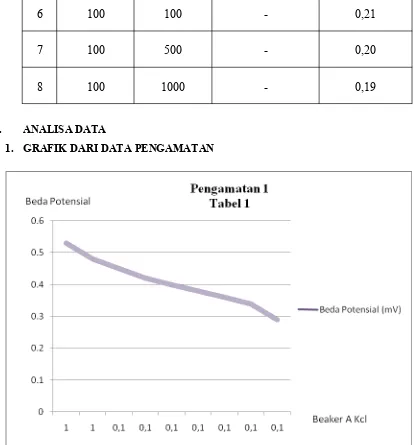
V. DATA HASIL PENGAMATAN
KCl (mM) KCl (mM) (mV)
1 1 1 √ 0,53
2 1 1 √ 0,48
3 0,1 0,1 √ 0,45
4 0,1 1,5 √ 0,42
5 0,1 10 √ 0,40
6 0,1 50 √ 0,38
7 0,1 100 √ 0,36
8 0,1 500 √ 0,34
9 0,1 1000 √ 0,29
No. Beaker A KCl (mM)
Beaker B KCl (mM)
Jembatan Garam Beda potensial (mV)
1 100 1 - 0,29
2 100 0,1 - 0,27
3 100 1,5 - 0,25
5 100 50 - 0,22
6 100 100 - 0,21
7 100 500 - 0,20
8 100 1000 - 0,19
VI. ANALISA DATA
VII. PEMBAHASAN
Dari grafik, dapat diketahui bahwa semakin besar perbedaan molaritas atau larutan yang digunakan, semakin besar pula beda potensial yang ditimbulkan. Hal ini dikarenakan jumlah molaritas larutan sangat berpengaruh dalam menjaga kenetralan muatan listrik.
Jika kedua elektrolit pada sel dipisahkan sama sekali tanpa adanya jembatan garam, maka dapat dilihat bahwa aliran electron akan segera berhenti. Hal ini terjadi karena pada kedua elektroda terjadi ketidaknetralan listrik, di satu bagian kelebihan muatan positif dan di bagian lain kelebihan muatan negatif. Dengan adanya jembatan garam dapat terjadi penetralan muatan listrik di setiap elektroda melalui difusi ion-ion, akan tetapi kedua larutan elektroda tetap dapat dijaga untuk tidak saling bercampur secara bebas.
Adanya jembatan garam menyebabkan adanya pertemuan cairan elektrolit. Hal ini menyebabkan munculnya potensial perbatasan di kedua cairan, tapi potensial cairan-perbatasan (Ej) antara larutan KCl (pekat dalam agar-agar) dengan larutan encer pada setengah sel sangat kecil. Hal ini terjadi karena larutan KCl yang digunakan pekat sehingga potensial perbatasan terutama ditentukan oleh ion-ion dari larutan tersebut, sementara ion-ion dari larutan encer memberikan kontribusi yang dapat diabaikan terhadap potensial perbatasan.
Karena mobilitas ion K+ dan Cl- dalam air hampir sama, maka ion-ion ini berdifusi keluar dari jembatan garam ke dalamlarutan encer pada kecepatan yang hampir sama dan oleh karena itu potensil perbatasannya juga sangat kecil.
Pertemuan cairan perbatasan dengan adanya jembatan garam ada dua pertemuan yakni antara KCl jenuh dengan kedua larutan encer dari setiap bagian elektroda. Hal ini akan semakin memperkecil potensial perbatasan nettonya karena adanya pengurangan sebagai akibat dari arahnya yang saling berlawanan.
Pada praktikum yang telah dilakukan, kami mengalami beberapa kendala saat praktikum. Kendala tersebut seperti kesulitan dalam penggunaan alat – alat yang tersedia di laboratorium dan ketidaktepatan alat dalam mengukur beda potensial maupun berat benda.
VIII. KESIMPULAN
difusi ion-ion, akan tetapi kedua larutan elektroda tetap dapat dijaga untuk tidak saling bercampur secara bebas.
b) Adanya jembatan garam menyebabkan adanya pertemuan cairan elektrolit. Hal ini menyebabkan munculnya potensial perbatasan di kedua cairan, tapi potensial cairan-perbatasan (Ej) antara larutan KCl (pekat dalam agar-agar) dengan larutan encer pada setengah sel sangat kecil. Hal ini terjadi karena larutan KCl yang digunakan pekat sehingga potensial perbatasan terutama ditentukan oleh ion-ion dari larutan tersebut, sementara ion-ion dari larutan encer memberikan kontribusi yang dapat diabaikan terhadap potensial perbatasan
DAFTAR PUSATAKA
Ngurah Sutapa, Gusti. 2012. Modul Praktikkum Biofis. Jurusan biologi FMIPA Udayana. Bukit Jimbaran.
Anonim. 2011. Elektromekanik. http://ferdianaelektromekanik2007.blogspot.com/ (Diakses : 26 Mei 2013)
Anonim. 2011. Sel elektrokimia.