HASIL DAN PEMBAHASAN
Fenotipe organ reproduktif kelapa sawit normal dan abnormal.
Dalam perkembangannya, organ reproduktif mengalami perubahan yang mengakibatkan terjadinya perbedaan fenotipe antara kelapa sawit normal dan abnormal. Secara visual, perbedaan antara organ reproduktif normal dan abnormal pada infloresen yang belum terbuka (fase bunga 1) belum terlihat jelas (Gambar 5.b & 5.c). Namun setelah infloresen bunga terbuka, perbedaan antara organ reproduktif normal dan abnoramal mulai terlihat jelas yaitu dengan terbentuknya tangkai bunga (pedunkulus) yang tidak teratur serta densitas bunga yang terbentuk lebih sedikit pada kelapa sawit abnormal (Gambar 5.d & 5.e). Perbedaan yang lebih jelas dapat dilihat pada bunga secara individu (Gambar 5.f – 5.i) dan menjadi semakin jelas setelah menjadi buah (Gambar 5.j) yaitu dengan terbentuknya semacam lapisan daging buah baru pada buah sawit abnormal sehingga bagian daging buah tampak seperti terpecah atau terbelah (Gambar 5.k). Abnormalitas buah kelapa sawit seperti inilah yang disebut sebagai buah bersayap atau mantled (Subronto et al., 1995; Soh et al., 2006).
Gambar 5. Sumber RNA total organ reproduktif tanaman kelapa sawit: (a) Sampel
pohon kelapa sawit, (b) tandan bunga 1 normal, (c). tandan bunga 1 abnormal, (d) tandan bunga 2 normal, (e) tandan bunga 2 abnormal, (f)
a b c d e
18 S rRNA
bunga 1 normal, (g). bunga 1 abnormal, (h) bunga 2 normal, (i) bunga 2 abnormal, (j) buah normal dan (k) buah abnormal.
Isolasi RNA total
Gambar 6 menyajikan hasil elektroforesis RNA total yang diisolasi dari bunga dan buah kelapa sawit normal dan abnormal. Sedangkan Tabel 1 adalah hasil pengukuran secara kuantitatif konsentrasi RNA dan kemurniannya. Dari Gambar 6 nampak bahwa kedua pita 28 S rRNA dan 18 S rRNA pada semua sampel terlihat cukup jelas baik pada kelapa sawit normal maupun normal mulai dari bunga 1, bunga 2 dan buah. Hal ini menunjukkan bahwa RNA yang dihasilkan tidak terdegradasi. Di samping itu, Gambar 6 juga menunjukkan bahwa RNA yang dihasilkan bebas dari kontaminasi DNA.
1 2 3 4 5 6
Gambar 6. Hasil isolasi RNA total organ reproduktif tanaman kelapa sawit: bunga 1
normal dan abnormal (lajur 1 & 2), bunga 2 normal dan abnormal (lajur 3 & 4) dan buah normal dan abnormal (lajur 5 & 6). Bg1= bunga 1, Bg2= bunga 2 dan Bu= buah.
Kuantitas RNA total pada semua sampel berkisar antara 430 – 1.652 ng/µl. Nampak bahwa konsentrasi RNA yang dapat diisolasi semakin menurun seiring dengan bertambahnya fase perkembangan organ reproduktif (Tabel 1). Hasil pengukuran kemurnian RNA menggunakan spektrofotometer menunjukkan bahwa rasio serapan pada λ 260/280 umumnya lebih besar dari 1,6 kecuali pada bunga 1 AN sebesar 1,431. Sedangkan rasio serapan pada λ 260/230 umumnya lebih besar dari 1,4 kecuali pada bunga 2 AN sebesar 1,1. Kemurnian RNA total dari kontaminan merupakan syarat penting untuk sintesis cDNA (Sambrook et al., 1989). Rasio absorbansi pada λ260 dengan λ280 menunjukkan kemurniannya terhadap kontaminan protein, sedangkan rasio λ260 dengan λ230 menunjukkan kemurniannya terhadap kontaminan polisakarida. Menurut Sambrook et al. (1989), RNA yang murni mempunyai rasio serapan pada λ
Bg1 Bg2 Bu 28 S rRNA
260/280 dan λ 260/230 lebih dari 1,8. Meskipun pada percobaan ini tidak semua sampel mempunyai λ260/280 dan λ 260/230 lebih besar dari 1,8, namun hasil percobaan menggunakan RT-PCR menunjukkan bahwa RNA yang diperoleh memiliki kualitas yang cukup memadai untuk digunakan sebagai templat dalam RT-PCR.
Tabel 1. Konsentrasi dan kemurnian RNA total hasil isolasi dari organ reproduktif kelapa sawit normal dan abnormal.
Kemurnian Fase reproduktif Konsentrasi (ng/µl)
260/280 260/230 Bunga 1 N 1.496 1,689 2,054 Bunga 1 AN 1.652 1,431 1,613 Bunga 2 N 908 2,128 1,432 Bunga 2 AN 712 1,946 1,124 Buah N 968 1,769 2,196 Buah AN 432 2,447 1,997
Catatan : N = normal; AN = abnormal
Perancangan Primer Spesifik AG dan LFY
Gambar 7 dan Gambar 8 masing-masing menunjukkan sekuen DNA AG dan
LFY yang digunakan untuk input sekuen dalam program Primer3 dan posisi primer AG
(AGF dan AGF) serta tiga pasang primer LFY (LFY_1F/R; LFY_2F/R dan LFY_3F/R). Berdasarkan Gambar tersebut, maka pasangan primer AGF dan AGR akan mengamplifikasi fragmen berukuran sekitar 564 pb, sedangkan pasangan primer
LFY_1F/R; LFY_2F/R dan LFY_3F/R berturut-turut akan mengamplifikasi fragmen
berukuran sekitar 534 pb, 511 pb dan 233 pb. Susunan nukleotida, panjang fragmen produk amplifikasi dan Tm (titik leleh) dari primer tersebut dapat dilihat pada Tabel 3. Berbeda dengan pasangan primer AGF/R yang dirancang menggunakan sekuen DNA gen AG asal kelapa sawit, ketiga pasangan primer untuk LFY dirancang menggunakan sekuen DNA dari gen yang sama tetapi berasal dari Gennaria diphylla, karena sekuen
LFY asal kelapa sawit belum terdeposit dalam GenBank. Untuk itu sebelum dilakukan
perancangan primer menggunakan program Primer3, terlebih dahulu ditentukan daerah konservatif yang akan menjadi target amplifikasi melalui penjajaran beberapa sekuen
gen LFY yang berasal dari berbagai spesies tanaman. Hasil penjajaran dapat dilihat pada Lampiran 4. tcctctaactctggatctgtctctgcccctcagactttctcctcccactaaccaaacccc tcctccactttcccatcttataccggcgaagagaggacgaaagaagcagctacgctggat cggccggggaagatgggtcggggaaagatcgaaatcaagaggatagagaacacaaccaac cggcaggtgaccttctgcaagcgccgcaatggcctgctcaaaaaggcctatgaattgtcc gtgctctgcgacgctgaggttgctctcatcatcttctcgagccgtggccgcctctacgag tatgccaacaatagtgygaaagctactatcgagaggtacaaaaagcatgtacttgatacc tctaactctggatctgtctctgaagctgattcccagtattatcaacaagaatcattgaaa ctgcgccagcaaataaccagcctacagaattcaaacagaaatttgatgggagattctctt ggctctatgagccttagggacctgaagyaactggagggaaggttggaaaagggcataaac aaaataagaactaagaagaatgagttgctatttgctgaaattgaatacatgcagaaaagg gagacggagctgcaaaatgccaacatgtacctaaggaacaagatagccgagaatgaggga gcacaacaacagatgaatatgttacccgctacgactgaatatgaggtcatgccgccatat gattcarggaacttcctgcaagtgaatctaatgcaaagcaatcagcattactctcaccag cagcagacagctctccaactaggatgagaccaggaaatgatccatgattggtggttctgc gacatcaaacctgtaggtgtagagctggamtgcttgcatgtagtttgttggtaagttatg ttgagaaaactaaacagatgatgtgggtgaagattgcccgagttggtagcctttcatcca aaatggactcataagacaattggttgtagtatatacaaacaattccacttgtatgctctt aactgcatgcggttgtcacttcatattgcagcatataggactttatattgtttttgttat ttgtcgtgttcatcaaagataatgttattttccgacaaaaaaaa
Gambar 7. Sekuen DNA gen AG (AJ581463) dan posisi primer AGF (anak panah
merah) dan primer AGR (anak panah biru).
atggtgctggccacatcgcagcaacaccagcagcataaccctcacgaagtccagccgcac ctgcagcctcattcgaccgcagcagagtcgtcgcgggagctagaggaggtgttcgagggg tacggagttcggtactcgacgattgctcggattggggatctgggcttcacggcgagcacg ctggcagggatgagggaggaggaggtggacgatatgatggccacactgtcgcatctcttc cggtgggatcttcttgtcggcgaacgttatgggatcaaagcagcaattagggcggagcgt cgccgacttgaagccctcattttttctcatgtctccggcgcaccccacctcaaccatcaa caccaaatgggatacctcttttcctctgccgccacaggccaccacttaatgcctgatgat ccgcgcaggaggctccttctcctctcccccgaccaccacagcgctctcgacgcactttcc caagaaggactctctgaggagccagtgcagctggagagggaggcagctggcagcggtggc gaagtggtaggcaggagagatggaaaggggaagaaccaacaacggcaaacctcgggaaag aagaaggatgcctcctctacgaagagcaagaaaaagaagaagaaagggatcgaagaagga gacgatgatgaagaggaggtcgaagtgtgggggcgcggggccagcattgagagtgatgag gacgacgacggggaggagtcgcaatcagagcagagcagcgctgcagagcggcagagggag cacccgttcatcgtgacggagccaggcgaggtggcgcgagctaagaagaatgggctcgat tacctcttcaatctttacgagcagtgccatgaatttctgctccaggtccagtccgtggcc aaggagcgcggggacaagtgcccaactaaggtgacgaacctggtattccgatatgcgaag aagaaagtgggagcaagctacatcaataagccgaagatgaggcactacgtgcactgctac gcgctgcacgtgctggaggaggaggcgtcgaactcgttgaggcgggcgttcaaggagcgc ggggagaacgtgggcgcgtggcggctggcctgctacaagcctctggtggccatctccgcc tcccacggtttcgacatggacgccgtgttcaacgcgcatccccgcctctccatctggtac gtccccactaagttacgccagctctgccacctcgcccgcagctccacctctcagctcccg cagtcctctcccccgaccaccacaacgctctcgacgcactttcccaaggcgttcaagact cagctgcagcagtctcctcccgtccgcccatgttctaattag
Gambar 8. Sekuen DNA gen LFY (gi|60683943) dan posisi primer LFY_1F/R
(anak panah merah), primer LFY_2F/R (anak panah biru), dan
LFY_3F/R (anak panah hijau)
Pada Tabel 2 juga disajikan susunan nukleotida dari primer ACT (ACTIN) hasil perancangan menggunakan sekuen asal kelapa sawit. Pasangan primer tersebut selanjutnya digunakan sebagai kontrol internal pada studi ekspresi kedua gen target. Produk amplifikasi diprediksi berukuran sekitar 700 pb. Sekuen ACT dan posisi primer dapat dilihat pada Lampiran 8.
Tabel 2. Nama primer spesifik beserta susunan nukleotida hasil rancangan.
Nama
primer Susunan nukleotida (ºC) Tm
Panjang fragmen yang diharapkan (bp) AGF 5’- GCCTATGAATTGTCCGTGCT -3’ 60,10 AGR 5’- TGTCTGCTGCTGGTGAGAGT -3’ 59,76 LFY_1F 5’- RRGAGRRGKTSGAARTRTGG -3’ 59,30 LFY_1R 5’- GGACGTACCAGATGGMSAGK -3’ 59,53 LFY_2F 5’- GCMYTYTCSCAAGARGGWY -3’ 57,27 LFY_2R 5’- TGTAGCWTGCTCCCAYTTTC -3’ 58,10 LFY_3F 5’- TGCSAAWCMGAGCASAGC -3’ 58,57 LFY_3R 5’- CCCAYTTTCTTCTTMGCRTA -3’ 57.97 ACTF 5’- CCCAAGGCAAACAGAGAA -3’ 64,2 ACTR 5’- GAACCACCAATCCAAACAGAA -3’ 63,6
Optimasi Kondisi untuk Amplifikasi Fragmen Gen AG dan LFY
Reaksi RT-PCR pada suhu anealing 57 oC menggunakan pasangan primer
AGF/R dapat menghasilkan amplikon yang spesifik dengan ukuran sebagamana
diharapkan yaitu antara 500 - 600 pb. Pada suhu anealing 55 oC tidak dihasilkan amplikon yang spesifik (Gambar tidak ditampilkan). Gambar 9 menyajikan hasil amplifikasi menggunakan pasangan primer AGF/R dengan beberapa jumlah siklus PCR yang berbeda, yaitu 28, 30, 32 dan 35. Variasi jumlah siklus diperlukan terutama agar diperoleh perbedaan intensitas fragmen DNA yang nyata antara fenotipe normal dan abnormal. Dari Gambar 9 nampak bahwa pada jumlah siklus 30, 32 dan 35 perbedaan intensitas antara kedua fenotipe cukup jelas. Namun karena pada siklus 35 intensitas fragmen lebih jelas, maka jumlah siklus ini digunakan untuk RT-PCR dalam studi ekspresi berikutnya.
Berbeda dengan AG, amplifikasi fragmen LFY tidak memberikan hasil/amplikon. Meskipun dicoba variasi suhu anealing (40 oC, 45 oC, 50 oC dan 57 oC) pada optimasi kondisi RT-PCR serta penggunakan ketiga pasang primer spesifik lFY (LFY_1F/R, LFY_2F/R dan LFY_3F/R), ternyata hasil yang diharapkan tidak diperoleh.
564 700 534 511 233 28
500 pb 650 pb 850 pb
M 1 2 3 4 5 6 7 8 9 10
Gambar 9. Hasil RT-PCR AG menggunakan templat RNA dari bunga 2 abnormal
(lajur 1,3,5,7,9) & bunga 2 normal (lajur 2,4,6,8,10) dengan jumlah siklus 28 (lajur 1,2), 30 (lajur 3,4), 32 (lajur 5,6), 34 (lajur 7,8) dan 35 (lajur 9,10). M : Marker 1 kb plus DNA ladder.
Analisis Akumulasi mRNA AG dengan RT-PCR
Gambar 10.b menunjukkan hasil elektroforesis fragmen produk RT-PCR untuk
AG dan ACT. Secara visual nampak bahwa, pada organ reproduktif abnormal
akumulasi mRNA AG lebih besar dibandingkan dengan pada organ yang normal, terutama pada bunga 2 dan buah. Perbedaan yang paling besar terlihat pada buah. Namun ternyata peningkatan ekspresi juga terjadi dengan ACT. Pada ketiga organ reproduktif yang diteliti, akumulasi ACT pada organ abnormal selalu lebih besar dibandingkan dengan pada yang normal. Namun, akumulasi ACT tersebut relatif sama atau konsisten pada semua fase perkembangan organ reproduktif baik pada abnormal maupun normal.
Gambar 10. (a). Hasil isolasi RNA organ reproduktif kelapa sawit. (b). Fragmen gen
AG hasil RT-PCR dan kontrol internal ACT secara berpasangan dari kelapa ACTIN AGAMOUS M 1 2 3 4 5 6 a b 500 pb 29
sawit normal dan abnormal pada: bunga 1 (lajur 1,2), bunga 2 (lajur 3,4) dan buah (lajur 5,6). M : Marker 1 kb plus DNA ladder.
Data kuantifikasi yang diperoleh mendukung hasil elektroforesis (Tabel 3). Kuantitas ekspresi atau akumulasi mRNA AG dan ACT yang dihasilkan organ reproduktif abnormal lebih besar dibandingkan dengan pada yang normal. ACT merupakan housekeeping gene yang diekspresikan terus-menerus pada setiap sel. Oleh karena itu gen ini sering digunakan sebagai internal kontrol dalam studi ekspresi gen-gen target yang dipelajari.
Tabel 3. Hasil kuantifikasi ekspresi AG dengan kontrol internal ACT pada kelapa sawit normal dan abnormal dengan program UN-SCAN-IT gel 6.1.
Nilai kuantitas ekspresi Fase AG ACT Bunga 1 N 2.117 2.233 Bunga 1 AN 2.240 3.666 Bunga 2 N 2.233 2.400 Bunga 2 AN 2.952 3.526 Buah N 1.835 2.236 Buah AN 2.030 3.354
Baik secara visual (Gambar 10) maupun secara kuantitatif (Tabel 3) terlihat bahwa ekspresi AG meningkat dari bunga fase 1 ke bunga fase 2, kemudian turun kembali pada fase buah. Pola ekspresi demikian terjadi baik pada organ normal maupun abnormal. Namun, tidak demikian pada ACT. Meskipun terdapat sedikit perbedaan ekspresi pada ketiga fase perkembangan, namun relatif sangat kecil sehingga dapat dikatakan ekspresi ACT selama perkembangan organ reproduktif adalah sama, baik pada organ normal maupun abnormal. Perbedaan yang nampak mencolok adalah antara organ abnormal dengan organ normal.
Analisis Akumulasi mRNA LFY dengan RT-PCR
RT-PCR untuk LFY menggunakan ketiga pasang primer pada ketiga organ reproduktif yang diteliti tidak menghasilkan amplikon, baik pada fenotipe normal
maupun abnormal. Ada dua kemungkinan penyebab tidak dihasilkannya amplikon Pertama rendahnya homologi antara sekuen DNA primer yang digunakan dengan sekuen DNA gen LFY dari kelapa sawit, karena input sekuen yang digunakan dalam merancang primer bukan dari kelapa sawit. Kemungkinan kedua adalah gen LFY memang tidak terekspresi pada ketiga fase perkembangan organ reproduktif yang dianalisis. Namun kemungkinan pertama telah diminimalisasi dengan membuat primer degenerate (Tabel 2) berdasar hasil penjajaran sekuen dengan program ClustalW (Lampiran 4), sehingga primer yang digunakan telah mengakomodir berbagai kemungkinan perbedaan sekuen. Oleh karena itu, diduga penyebab tidak dihasilkannya produk RT-PCR LFY adalah karena gen tersebut tidak terekspresi pada ketiga fase perkembangan organ reproduktif yang dianalisis. .
Kloning Fragmen DNA Hasil RT-PCR
Tahapan ini dilakukan bukan hanya untuk mengklon fragmen yang diperoleh, tetapi juga diperlukan terutama untuk mengkonfirmasi bahwa fragmen hasil RT-PCR adalah fragmen DNA dari gen penyandi AG. Untuk itu produk RT-PCR diisolasi dan dimurnikan dari gel, kemudian dicek ulang pada gel elektroforesis. Gambar 11 menunjukkan hasil elektroforesis fragmen produk RT-PCR yang telah dimurnikan. Fragmen produk RT_PCR tersebut selanjutnya diklon ke dalam E. coli kompeten dengan vektor pGEM-T Easy.
Gambar 11. Elektroforesis hasil pemurnian fragmen DNA produk RT-PCR bunga 2
normal (lajur 1) dan abnormal (lajur 2) menggunakan primer AGF/AGR. M : Marker 1 kb plus DNA ladder.
650 pb 500 pb
1 2 M
Koloni putih dari E. coli hasil transformasi yang tumbuh pada media seleksi dianalisis untuk mengecek ada tidaknya sisipan DNA AG dengan PCR koloni. Hasil PCR koloni menunjukkan bahwa 10 koloni hasil transformasi E. coli dengan fragmen gen AG dari bunga normal dan 4 koloni hasil transformasi E. coli dengan fragmen AG bunga normal terbukti positif mengandung sisipan DNA berukuran di sekitar 500 – 600 pb sebagimana yang diharapkan (Gambar 12). Konfirmasi bahwa fragmen terklon adalah fragmen gen AG, dilakukan melalui sekuensing. Untuk itu, plasmid rekombinan diisolasi dan didigesti dengan enzim restriksi EcoR1. Pada peta plasmad pGEM-T Easy, dua situs restriksi enzim ini tepat berada dekat daerah tempat DNA produk PCR menyisip, sehingga digesti plasmid rekombinan pGEM-T/AG menggunakan enzim ini sangat tepat untuk membuktikan bahwa fragmen DNA target telah terinsersi. Hasil isolasi plasmid dan digestinya ditampilkan pada Gambar 13. Dari gambar tersebut nampak bahwa digesti plasmid menghasilkan satu fragmen berukuran di atas 3 kb dan dua fragmen masing-masing berukuran >300 pb dan >200 pb, tetapi tidak dihasilkan fragmen DNA berukuran > 500 pb. Fragmen berukuran lebih besar dari 3 kb adalah pGEM-T Easy. Diduga kedua fragmen berukuran >300 pb dan >200 pb adalah fragmen AG (> 500 pb) yang terdigesti oleh EcoRI. Apabila hal ini benar, maka berarti dalam fragmen tersebut terdapat satu situs pemotongan EcoRI. Untuk menjawab hal tersebut dilakukan analisis peta restriksi menggunakan program BioEdit. Hasil analisis mengkonfirmasi bahwa terdapat satu situs restriksi pada fragmen AG produk RT-PCR kelapa sawit normal maupun abnormal yaitu masing-masing pada posisi nukleotida ke 223 (Lampiran 10) dan 339 (lampiran 11).
1 2 3 4 5 6 7 8 9 10 M 11 12 13 14 15 16 17 18 19 20
Gambar 12. PCR koloni hasil transforman menggunakan fragmen produk RT-PCR AG
dari bunga 2 normal (lajur 1-10) dan dari bunga 2 abnormal (lajur 11-20). M : Marker 1 kb plus DNA ladder.
M 1 2 3 4 5 6 7 8
Gambar 13. Hasil isolasi plasmid rekombinan dan digestinya dengan EcoR1 dari
koloni yang teruji positif mengandung fragmen produk RT-PCR AG. M : Marker 1 kb plus DNA ladder, lajur 1,2 = digesti plasmid rekombinan pada bunga 2 normal; lajur 3,4 = digesti plasmid rekombinan pada bunga 2 abnormal; lajur no. 5,6 = plasmid rekombinan yang mengandung produk RT-PCR AG dari bunga 2 normal; dan lajur no. 7,8 = plasmid rekombinan yang mengandung produk RT-PCR AG dari bunga 2 abnormal.
Sekuensing dan Analisis DNA Fragmen Terklon
Plasmid rekombinan yang positif mengandung sisipan DNA disekuen untuk memastikan bahwa fragmen terklon adalah fragmen gen AG. Sekuensing dilakukan menggunakan primer universal M13F. Sebelum dianalisis untuk mengetahui homologinya dengan gen AG, sekuen DNA hasil sekuensing terlebih dahulu dibersihkan dari kontaminasi vektor dengan program Blast Screen Sequence for Vector
Contamination dari NCBI. Sekuen DNA dari bungan normal dan abnormal setelah
dibersihkan dari kontaminasi vektor disajikan pada Gambar 14 dan 15. Panjang sekuen yang diperoleh masing-masing adalah 411 dan 412 masing-masing untuk yang normal dan abnormal. Untuk mendapatkan sekuen sepanjang fragmen terklon (antara 500 – 600 pb) diperlukan sekuensing dari arah sebaliknya menggunakan primer M13R.
Dari Gambar 14 dapat dilihat susunan nukleotida dari primer AGF yang menunjukkan bahwa fragmen AG hasil RT-PCR dari organ normal terklon dengan orientasi yang benar dalam vektor kloningnya. Sebaliknya, pada sekuen yang dihasilkan dari organ reproduktif abnormal (Gambar 15), sekuen primer AGF tidak
500 pb 300 pb 200 pb 2000 pb
dapat diidentifikasi, dan yang terdeteksi adalah sekuen nukleotida dari primer AGR. Hal ini menunjukkan bahwa fragmen tersebut terklon dengan orientasi yang terbalik.
Gambar 14. Susunan nukleotida hasil sekuensing menggunakan primer M13F dari
fragmen gen AG terklon asal kelapa sawit normal. Warna merah menunjukkan sekuen primer AGF.
Gambar 15. Susunan nukleotida hasil sekuensing menggunakan primer M13F dari
fragmen gen AG terklon asal kelapa sawit abnormal. Warna biru menunjukkan sekuen primer AGR.
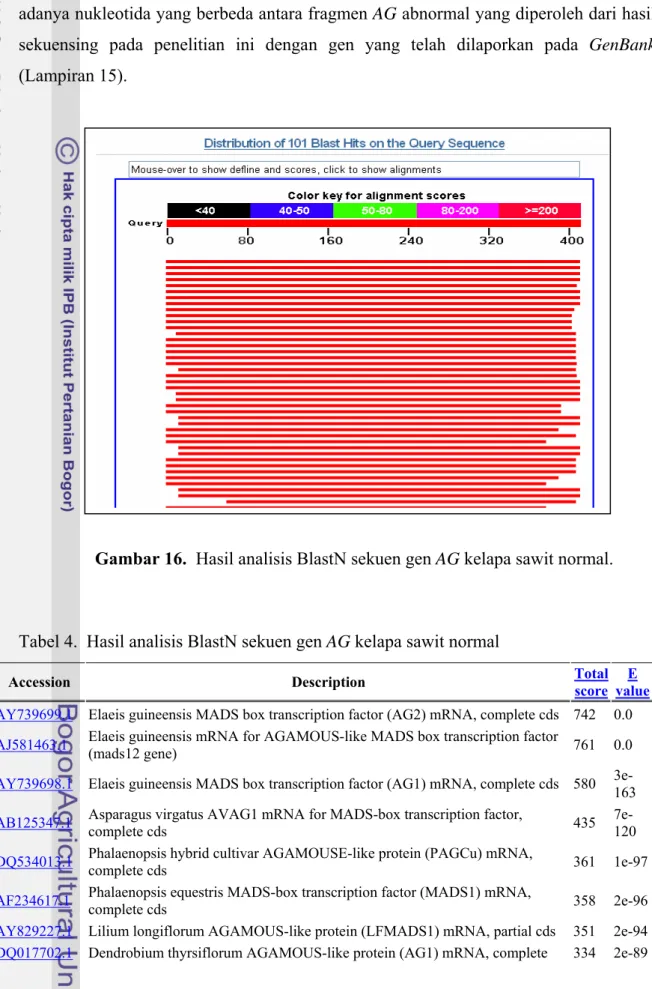
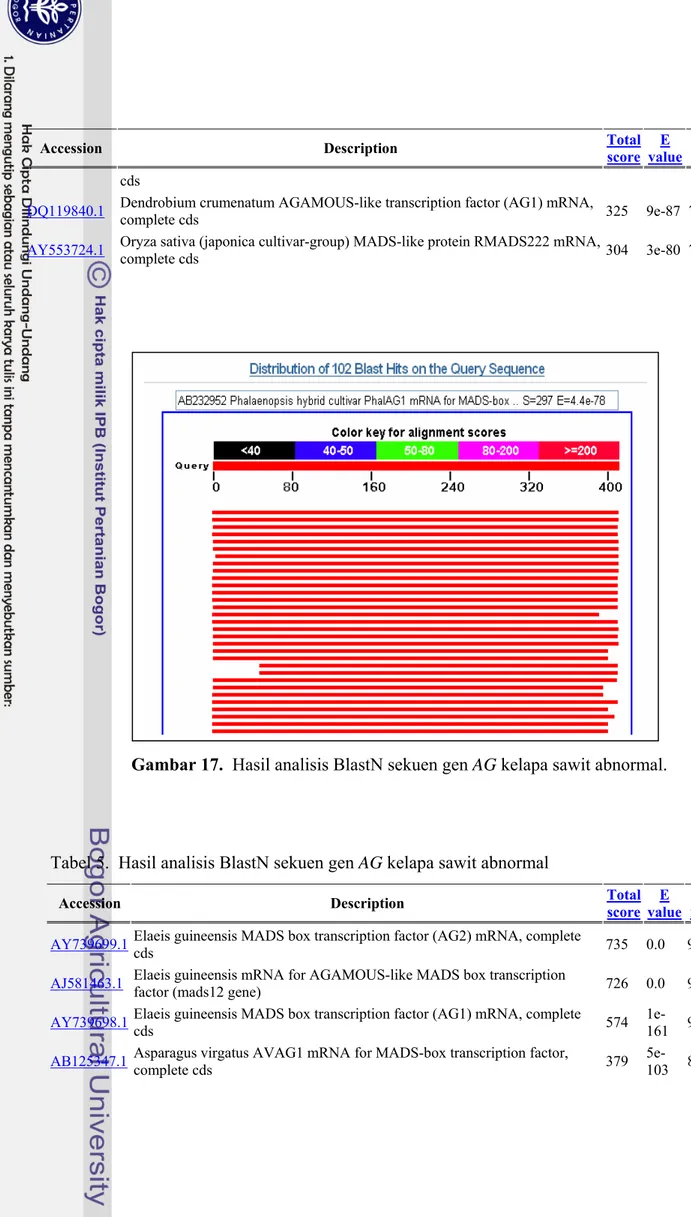
Hasil analisis BlastN dari kedua sekuen fragmen AG tersebut disajikan pada Gambar 16 dan 17. Sedangkan daftar gen yang menunjukkan homologi tinggi dengan sekuen fragmen tersebut dapat dilihat pada Tabel 4 dan Tabel 5. Dari Tabel tersebut dapat diketahui bahwa fragmen gen AG menunjukkan nilai/score yang tinggi yaitu sebesar 742 dengan E value yang sangat rendah (0,0) dan Max. Identity mencapai 100%. Hal ini menunjukkan bahwa gen AG yang diisolasi dari organ reproduktif kelapa sawit normal memiliki sekuen AG sama persis dengan sekuen AG sawit dalam database pada
GenBank (Lampiran 14). Sebaliknya, score fragmen AG pada kelapa sawit abnormal
lebih rendah yaitu 735 dengan E value 0,0 dan Max. Identity 99%. Hal ini menunjukkan TGTCTGCTGCTGGTGAGAGTAATGCTGATTGCTTTGCATTANATTCACTTGCAGGAA GTTCCTTGAATCATGTGGCGGCATGACCTCATATTCAGTCGTAGCGGGTAACATATT CATCTGTTGTTGTGCTCCCTCATTCTCGGCTATCTTGTTCCTTAGGTACATGTTGGC ATTTTGCAGCTCCGTCTCCCTTTTCTGCATGTATTCAATTTCAGCAAATAGCAACTC ATTCTTCTTAGTTCTTATTTTGTTTATGCCCTTTTCCAACCTTCCCTCCAGTTGCTT CAGGTCCCTAAGGCTCATGGAGCCAAGAGAATCTCCCATCAAATTTCTGTTTGAATT CTGTAGGCTGGTTATTTGCTGGCGCAGTTTCAATGATTCTTGTTGATAATACTGGGA ATCAGCTTCAGAG GCCTATGAATTGTCCGTGCTCTGCGACGCTGAGGTTGCTCTCATCATCTTCTCGAGC CGTGGCCGCCTCTACGAGTATGCCAACAATAGTGTGAAAGCTACTATCGAGAGGTAC AAAAAAGCATGTACTGATACCTCTAACTCTGGATCTGTCTCTGAAGCTGATTCCCAG TATTATCAACAAGAATCATTGAAACTGCGCCAGCAAATAACCAGCCTACAGAATTCA AACAGAAATTTGATGGGAGATTCTCTTGGCTCCATGAGCCTTAGGGACCTGAAGCAA CTGGAGGGAAGGTTGGAAAAGGGCATAAACAAAATAAGAACTAAGAAGAATGAGTTG CTATTTGCTGAAATTGAATACATGCAGAAAAGGGAGACGGAGCTGCAAAATGCCAAC ATGTACCTAAGG 34
adanya nukleotida yang berbeda antara fragmen AG abnormal yang diperoleh dari hasil sekuensing pada penelitian ini dengan gen yang telah dilaporkan pada GenBank (Lampiran 15).
Gambar 16. Hasil analisis BlastN sekuen gen AG kelapa sawit normal.
Tabel 4. Hasil analisis BlastN sekuen gen AG kelapa sawit normal
Accession Description Total score valueE identMax
AY739699.1 Elaeis guineensis MADS box transcription factor (AG2) mRNA, complete cds 742 0.0 100% AJ581463.1 Elaeis guineensis mRNA for AGAMOUS-like MADS box transcription factor (mads12 gene) 761 0.0 100% AY739698.1 Elaeis guineensis MADS box transcription factor (AG1) mRNA, complete cds 580 3e-163 91% AB125347.1 Asparagus virgatus AVAG1 mRNA for MADS-box transcription factor, complete cds 435 7e-120 83% DQ534013.1 Phalaenopsis hybrid cultivar AGAMOUSE-like protein (PAGCu) mRNA, complete cds 361 1e-97 79% AF234617.1 Phalaenopsis equestris MADS-box transcription factor (MADS1) mRNA, complete cds 358 2e-96 79% AY829227.1 Lilium longiflorum AGAMOUS-like protein (LFMADS1) mRNA, partial cds 351 2e-94 79% DQ017702.1 Dendrobium thyrsiflorum AGAMOUS-like protein (AG1) mRNA, complete 334 2e-89 78%
Accession Description Total score valueE identMax
cds
DQ119840.1 Dendrobium crumenatum AGAMOUS-like transcription factor (AG1) mRNA, complete cds 325 9e-87 78% AY553724.1 Oryza sativa (japonica cultivar-group) MADS-like protein RMADS222 mRNA, complete cds 304 3e-80 76%
Gambar 17. Hasil analisis BlastN sekuen gen AG kelapa sawit abnormal.
Tabel 5. Hasil analisis BlastN sekuen gen AG kelapa sawit abnormal
Accession Description Total score valueE identMax
AY739699.1 Elaeis guineensis MADS box transcription factor (AG2) mRNA, complete cds 735 0.0 99% AJ581463.1 Elaeis guineensis mRNA for AGAMOUS-like MADS box transcription factor (mads12 gene) 726 0.0 98% AY739698.1 Elaeis guineensis MADS box transcription factor (AG1) mRNA, complete cds 574 1e-161 90% AB125347.1 Asparagus virgatus AVAG1 mRNA for MADS-box transcription factor, complete cds 379 5e-103 80%
Accession Description Total score valueE identMax
AF099937.2 Hyacinthus orientalis AGAMOUS homolog transcription factor (HAG1) mRNA, complete cds 318 1e-84 77% AY555580.1 Crocus sativus agamous MADS-box transcription factor 1b (AG1) mRNA, complete cds, alternatively spliced 307 2e-81 76% DQ017702.1 Dendrobium thyrsiflorum AGAMOUS-like protein (AG1) mRNA, complete cds 307 2e-81 76% AB232952.1 Phalaenopsis hybrid cultivar PhalAG1 mRNA for MADS-box transcription factor, complete cds 297 4e-78 75% AY829227.1 Lilium longiflorum AGAMOUS-like protein (LFMADS1) mRNA, partial cds 268 2e-69 74% DQ119840.1 Dendrobium crumenatum AGAMOUS-like transcription factor (AG1) mRNA, complete cds 264 3e-68 73%
Hasil analisis BlastX dari kedua sekuen fragmen AG juga mendukung hasil BlastN tersebut yang menunjukkan homologi tinggi dengan sekuen fragmen tersebut (Lampiran 16 dan 17). Dari hasil analisis BlastX tersebut dapat diketahui bahwa fragmen gen AG menunjukkan score yang tinggi yaitu sebesar 254 dengan E value yang sangat rendah (1e-67). Sebaliknya, score fragmen AG pada kelapa sawit abnormal lebih rendah yaitu 249 dengan E value 2e-66.
Untuk mengetahui perbedaan susunan nukleotida, maka dilakukan analisis penjajaran sekuen dengan Program BlastN ditunjukkan pada Lampiran 18 dan 19. Lampiran 8 menunjukkan bahwa, sekuen fragmen AG pada kelapa sawit normal tidak terdapat perbedaan susunan nukleotida dengan gen AG pada database. Sebaliknya, setelah dibandingkan dengan gen AG yang terdapat di dalam database pada GenBank (Lampiran 19), diketahui bahwa pada fragmen AG kelapa sawit abnormal terdapat 2 perbedaan susunan nukleotida, namun yang jelas berbeda hanya satu (ditunjukkan dengan lingkaran biru) sedang yang satunya masih ada kemungkinan sama (ditunjukkan dengan lingkaran hijau) karena basanya tertulis N sehingga masih mempunyai peluang kesamaan sebesar 25%.
Analisis lebih jauh untuk mengetahui ada tidaknya perbedaan nukleotida antara fenotipe normal dan abnormal, terlebih dahulu dilakukan analisis nukleotida sekuen komplementer dari sekuen DNA fragmen abnormal, menggunakan program Reverse
Complement pada BioEdit. Hasil sekuen komplementer dapat dilihat pada Lampiran 20.
Sekuen komplementer yang diperoleh kemudian disejajarkan sekuen DNA AG asal kelapa sawit normal yang diperoleh sebagaimana dicantumkan pada Gambar 14. Hasil penjajaran disajikan pada Gambar 18. Dari Gambar tersebut, terlihat pada bagian sekuen yang saling overlap, tidak ditemukan adanya nukleotida yang berbeda. Dari Gambar tersebut juga dapat diketahui bahwa fragmen terklon berukuran 564 pb.
AG-AN
---AG-N GCCTATGAATTGTCCGTGCTCTGCGACGCTGAGGTTGCTCTCATCATCTTCTCGAGCCGT 60 AG-AN
---
AG-N GGCCGCCTCTACGAGTATGCCAACAATAGTGTGAAAGCTACTATCGAGAGGTACAAAAAA 120 AG-AN---
CTCTGAAGCTGATTCCCAGTATTATCAA 28 AG-N GCATGTACTGATACCTCTAACTCTGGATCTGTCTCTGAAGCTGATTCCCAGTATTATCAA 180 **************************** AG-AN CAAGAATCATTGAAACTGCGCCAGCAAATAACCAGCCTACAGAATTCAAACAGAAATTTG 88 AG-N CAAGAATCATTGAAACTGCGCCAGCAAATAACCAGCCTACAGAATTCAAACAGAAATTTG 240 ************************************************************ AG-AN ATGGGAGATTCTCTTGGCTCCATGAGCCTTAGGGACCTGAAGCAACTGGAGGGAAGGTTG 148 AG-N ATGGGAGATTCTCTTGGCTCCATGAGCCTTAGGGACCTGAAGCAACTGGAGGGAAGGTTG 300 ************************************************************ AG-AN GAAAAGGGCATAAACAAAATAAGAACTAAGAAGAATGAGTTGCTATTTGCTGAAATTGAA 208 AG-N GAAAAGGGCATAAACAAAATAAGAACTAAGAAGAATGAGTTGCTATTTGCTGAAATTGAA 360 ************************************************************ AG-AN TACATGCAGAAAAGGGAGACGGAGCTGCAAAATGCCAACATGTACCTAAGGAACAAGATA 268 AG-N TACATGCAGAAAAGGGAGACGGAGCTGCAAAATGCCAACATGTACCTAAGG---
411 *************************************************** AG-AN GCCGAGAATGAGGGAGCACAACAACAGATGAATATGTTACCCGCTACGACTGAATATGAG 328 AG-N---
AG-AN GTCATGCCGCCACATGATTCAAGGAACTTCCTGCAAGTGAATNTAATGCAAAGCAATCAG 388 AG-N---
AG-AN CATTACTCTCACCAGCAGCAGACA 412 AG-N---
Gambar 18. Hasil penjajaran antara sekuen AG kelapa sawit normal (N) dan abnormal
(AN).