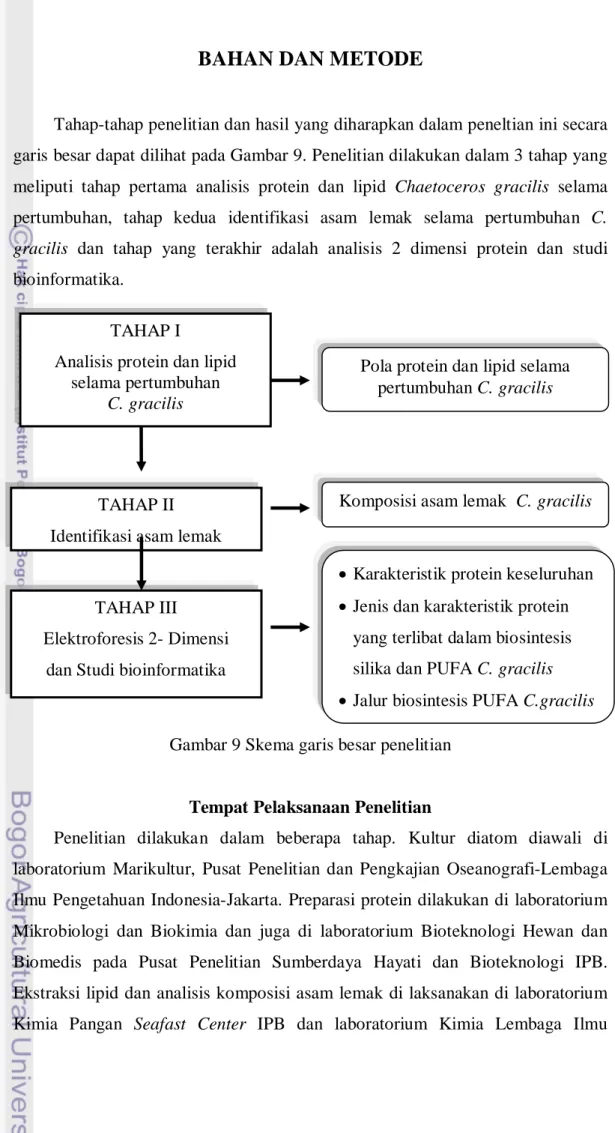
Tahap-tahap penelitian dan hasil yang diharapkan dalam peneltian ini secara garis besar dapat dilihat pada Gambar 9. Penelitian dilakukan dalam 3 tahap yang meliputi tahap pertama analisis protein dan lipid Chaetoceros gracilis selama pertumbuhan, tahap kedua identifikasi asam lemak selama pertumbuhan C. gracilis dan tahap yang terakhir adalah analisis 2 dimensi protein dan studi bioinformatika.
Gambar 9 Skema garis besar penelitian
Tempat Pelaksanaan Penelitian
Penelitian dilakukan dalam beberapa tahap. Kultur diatom diawali di laboratorium Marikultur, Pusat Penelitian dan Pengkajian Oseanografi-Lembaga Ilmu Pengetahuan Indonesia-Jakarta. Preparasi protein dilakukan di laboratorium Mikrobiologi dan Biokimia dan juga di laboratorium Bioteknologi Hewan dan Biomedis pada Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB. Ekstraksi lipid dan analisis komposisi asam lemak di laksanakan di laboratorium Kimia Pangan Seafast Center IPB dan laboratorium Kimia Lembaga Ilmu
TAHAP I
Analisis protein dan lipid selama pertumbuhan
C. gracilis
Pola protein dan lipid selama pertumbuhan C. gracilis
TAHAP II Identifikasi asam lemak
TAHAP III
Elektroforesis 2- Dimensi dan Studi bioinformatika
Komposisi asam lemak C. gracilis
• Karakteristik protein keseluruhan • Jenis dan karakteristik protein
yang terlibat dalam biosintesis silika dan PUFA C. gracilis • Jalur biosintesis PUFA C.gracilis
Pengetahuan Indonesia-Bandung. Analisis 2 dimensi dilakukan di laboratorium Biokimia dan Teknologi Enzim, Fakultas Teknobiologi Universitas Katolik Atmajaya-Jakarta dan laboratorium terpadu Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan dan Alat
Diatom Chaetoceros gracilis merupakan organisme yang menjadi objek penelitian studi protein diperoleh sebagai kultur murni dari Pusat Penelitian dan Pengkajian Oceanologi-LIPI yang diambil dari perairan Teluk Jakarta Indonesia. Medium kultur modifikasi f/2 Guilard meliputi makronutrien (NaNO3,
NaH2PO4.2H2O, Na2SiO3.9H2O), mikronutrien (FeCl3.6H2O dan Na2EDTA),
dan vitamin (B1, B12, biotin) serta trace metal (CuSO4.5H2O, ZnSO4.7H2O,
NaMoO4.2H2O, (NH4)6Mo7O24.4H2O, MnCl2.4H2O, 0.6 µM CoCl2.6H2
Ekstraksi protein total menggunakan bahan kimia yang terdiri dari Tris-Cl pH 6.8 SDS, EDTA, aseton, HF, NH
O). Perangkat kultur sistem batch dilengkapi dengan sumber cahaya, pengatur waktu dan aerator.
4F. Pengukuran kadar protein menggunakan
metode Bradford dengan pelarut yang terdiri dari etanol, asam fosforat, Serva Blue G dan dibaca menggunakan Spektrofotometer UV. Ekstraksi lipid dan analisi komposisi asam lemak menggunakan CHCl3, KOH, MeOH, 20% BF3/MeOH,
NaCl, petroleum benzen, Na2SO4, gas N2
Analisis 2 dimensi terdiri dari preparasi protein, elektroforesis 1 dimensi dan 2 dimensi. Bahan kimia yang digunakan meliputi Tris-Cl pH 7.5, MgCl
, heksan dan isooktan. Identifikasi asam lemak menggunakan Gas Chromatograph Mass Spectrophotometer QP-5000.
2, KCl,
EDTA, PMSF, Triton X-100, TCA; urea, Triton X-100, β-merkaptoetanol, ampholine pH 3-10, SDS, Tris-HCl pH 8.8, gliserol, DTT, iodoasetamida. Elektroforesis 1 dimensi menggunakan peralatan Protean IEF-Biorad, sedangkan elektroforesis 2 dimensi menggunakan peralatan Mini Elektrophoresis SDS-PAGE-Biorad. Pewarnaan gel hasil 2 dimensi menggunakan pewarnaan Coomassie blue yang mengandung Coomassie blue R-250, metanol dan asam asetat glasial. Bahan-bahan kimia yang digunakan dalam penelitian ini merupakan bahan kimia dengan kategori analysis grade. Hasil elektroforesis 2 dimensi
dipindai menggunakan High Resolution Scanner – Image Scanner (Amersham Pharmacia Biotech).
Karakterisasi protein dilakukan menggunakan perangkat lunak Melanie 7.0 (http://www.genbio.com/product/melanie/processDownloadForm.php). Identi-fikasi protein menggunakan program TagIdent (http://www. expasy. proteomic.tools).
Penelitian Tahap I
Penelitian tahap pertama adalah kultivasi C. gracilis dalam kultur sistem
curah atau batch dengan kondisi yang diterapkan. Kultur sistem batch adalah sistem kultur dalam suatu media dan kondisi lingkungan yang terbatas dalam periode waktu tertentu. Setelah pelet sel dikumpulkan, selanjutnya dilakukan analisis baik kandungan seluler protein total termasuk protein silaffin maupun analisis kandungan seluler lipid selama pertumbuhan C. gracilis. Skema penelitian tahap pertama dapat dilihat pada Gambar 10.
Gambar 10 Skema penelitian tahap I
Kultivasi dalam medium modifikasi f/2 Guilard
HASIL
Profil protein dan lipid selama pertumbuhan C. gracilis
Kultur murni C. gracilis
Analisis kandungan seluler protein total dan protein silaffin
Analisis kandungan seluler lipid
Kultivasi Diatom C. gracilis
Media pertumbuhan yang digunakan untuk menumbuhkan C. gracilis adalah media f/2 Guillard (Round et al. 1990) yang dimodifikasi oleh P3O-LIPI sebagai kurator. Medium f/2 mengandung air laut alami yang ditambah dengan sejumlah mineral dengan komposisi makronutrien 0.99 mM NaNO3, 0.07 mM
NaH2PO4.2H2O, 5.3 µM Na2SiO3.9H2O; mikronutrien 5.4 µM FeCl3.6H2O dan
26.9 µM Na2EDTA serta vitamin yang terdiri dari 0.6 µM vitamin B1, 0.001 µM
vitamin B12, 0.004 µM biotin serta trace metal 0.8 µM CuSO4.5H2O, 2.1 µM
ZnSO4.7H2O, 0.5 µM NaMoO4.2H2O, 0.005 µM (NH4)6Mo7O24.4H2O, 18.2
µM MnCl2.4H2O, 0.6 µM CoCl2.6H2
Diatom C. gracilis dikulturkan dalam kultur sistem batch dengan suhu 16-19 °C, inokulum 10
O. Media kultur diatur pada pH 8 dan salinitas 28‰.
5
sel/ ml, aerasi secara kontinyu dan pencahayaan sebesar 4000-5000 lx dilakukan dengan periode 12 jam terang:12 jam gelap. Pertambahan sel diatom dimonitor setiap hari dengan menggunakan kotak hitung Haemocytometer Neubauer. Hasil penghitungan sel diplot sebagai sumbu y dan waktu dalam hari sebagai sumbu x untuk pembuatan grafik kurva pertumbuhan.
Ekstraksi Protein Total (Rousch et al. 2004)
Protein keseluruhan sel adalah protein yang diperoleh dari ekstraksi seluruh sel. Pelet biomasa sel C. gracilis yang diperoleh, diresuspensi dengan larutan bufer yang mengandung 100 mM Tris-HCl, pH 6.8 dan 4% SDS, kemudian dididihkan untuk mengekstrak protein terlarut. Hasil ekstraksi selanjutnya disentrifugasi dengan kecepatan 14 000 xg, suhu 4°C selama 30 menit untuk memisahkan material yang tak larut. Filtrat yang diperoleh, disiapkan untuk analisis kadar protein terlarut.
Ekstraksi Protein Silaffin (Kroger et al. 1999)
Protein silaffin terletak di dalam SDV yang telah terintegrasi dengan dinding sel diatom, sehingga untuk memperolehnya perlu mendapatkan dinding sel murni terlebih dahulu. Pelet sel diekstrak dengan 2% SDS/ 3.7% EDTA lalu dididihkan selama 15 menit, kemudian disentrifugasi dengan kecepatan 9000 xg, suhu 4 °C,
selama 20 menit. Endapan yang diperoleh dicuci 2 kali dengan air bebas ion, dilanjutkan dengan aseton 2 kali dan diulang kembali dengan air bebas ion. Setelah proses pencucian kemudian dikeringudarakan, untuk memperoleh dinding sel silicaceous (frustule).
Frustule yang telah diperoleh dilarutkan ke dalam bufer 2 M HF dalam 8 M NH4F (pH 5) pada suhu 4°C hingga tidak ditemukan adanya endapan. Larutan bufer dihilangkan dengan metode dialisis cut off 3 kDa dalam air bebas ion, suhu 4 °C, selama 4 jam yang dilakukan sebanyak 9 kali. Dialisat kemudian disentrifus dengan kecepatan 10 000 xg, 20 menit, suhu 4 °C. Endapan protein yang diperoleh disuspensi dengan air bebas ion lalu disimpan dalam suhu -4 °C.
Analisis Kadar Protein (Bollag & Edelstein 1991)
Pengukuran kadar protein menggunakan metode Bradford dengan Bovine Serum Albumiun (BSA) sebagai standar. Sebanyak 100 µl filtrat protein direaksikan dengan 2 ml larutan Bradford diinkubasi sekitar 5 menit lalu diamati dengan spektrofotometer pada λ 595 nm.
Ekstraksi dan Kuantifikasi lipid (Dunstan et al. 1994)
Pelet sel diatom yang diperoleh, diekstrak menggunakan sonikasi selama 3x3 menit pada 20 KHz (Soniprep 150 MSE) dalam larutan 5 ml CHCl3
-MeOH-H2O (5:10:4). Campuran larutan tersebut lalu ditambah larutan CHCl3-H2O (1:1)
sehingga menjadi larutan CHCl3-MeOH-H2O dengan perbandingan 10:10:9
sehingga terbentuk 2 fase. Fase kloroform dikumpulkan kemudian diuapkan dengan gas N2 hingga kering dan ditimbang sebagai berat total lipid. Analisis
lipid dilakukan setiap hari untuk memperoleh profil kandungan lipid sel selama pertumbuhan.
Penelitian Tahap II Analisis Komposisi Asam Lemak (Dunstan et al. 1994)
Analisis asam lemak dilakukan dari fase akhir eksponensial hingga fase kematian (berdasarkan profil lipid selama pertumbuhan). Gambar 11 merupakan skema langkah-langkah penelitian dalam tahap II.
Gambar 11 Skema tahap analisis komposisi asam lemak
Lipid yang diperoleh (Tahap I) disaponifikasi menggunakan prinsip hidrolisis kalium hidroksida dalam metanol (100 ml 0.5 M KOH/ MeOH), kemudian direfluk selama 5-10 menit untuk melepaskan asam lemak menjadi asam lemak bebas. Asam lemak yang telah dilepaskan selanjutnya diesterifikasi sehingga membentuk derivat metil ester dari asam lemak (Fatty Acid Methyl Esther = FAME). Setelah direfluk ditambahkan 5 ml 20% BF3 dalam MeOH. Larutan tersebut dididihkan sebentar kemudian ditambah sedikit isooktan pekat lalu dididihkan kembali.
Tahap selanjutnya ditambah 20% NaCl, dikocok kuat dan sedikit dipanaskan hingga terbentuk 2 fase. Fase atas (isooktan dan lipid) diambil, dilarutkan dalam petroleum benzen (40-60 °C) dan disaring dalam corong pisah. Kemudian larutan petroleum benzene dicuci dengan akuades sampai bebas asam (untuk mengetahuinya dibantu dengan kertas lakmus universal). Fase petroleum benzene kemudian ditambahkan Na2SO4, disaring masuk ke dalam labu evaporator dan
dilanjutkan evaporasi untuk menguapkan pelarutnya. Selanjutnya dikeringkan
LIPID
(dari umur kultur terpilih)
Saponifikasi (0.5 M KOH/ MeOH)
Esterifikasi (20% BF3/ MeOH
Identifikasi asam lemak (GC/MS)
HASIL
Komposisi asam lemak selama pertumbuhan C. gracilis
dengan gas N2
FAME dalam pelarut isooktan sebanyak 1 µl diinjekkan pada CG/MS dengan kolom DB-17 (panjang 30 m, diameter 0,25 mm). Kondisi kolom dengan suhu injektor and detektor 250 °C, setelah 1 menit suhu dinaikan sampai 100 °C selama 3 menit, lalu dinaikkan 10 °C per menit hingga 230 °C dan ditahan selama 3 menit, dinaikkan terus hingga 260 °C, ditahan 10 menit. Tekanan gas 64.5 Kpa dan flow rate 1 ml menit
sehingga akan terbentuk metil ester. Metil ester yang terbentuk dilarutkan dalam isooktan konsentrasi 5% untuk identifikasi asam lemak menggunakan GC/ MS.
-1
.
Penelitian Tahap III
Penelitian tahap ke tiga merupakan tahap identifikasi dan karakteristisasi protein menggunakan analisis elektroforesis 2 dimensi. Protein hasil ekstraksi dilakukan separasi ke dalam titik isoelektrik (elektroforesis 1 dimensi) kemudian diekulibrasi sebelum dilakukan seperasi ke dalam berat molekul (elektroforesis 2 dimensi). Hasil elektroforesis 2 dimensi dideteksi dan diidentifikasi jenis protein target (yang terlibat dalam sintesis silika dan sintesis PUFA). Penelusuran jenis protein dilakukan berdasarkan studi bioinformatika.
Secara khusus untuk protein yang teridentifikasi sebagai protein yang terlibat dalam sintesis PUFA digunakan untuk memprediksi jalur biosintesis PUFA bersama profil PUFA dari Penelitian Tahap II. Diagram alir tahapan Penelitian Tahap III dapat dilihat pada Gambar 12.
Analisis 2 dimensi (
Analisis 2 dimensi dilakukan untuk memperoleh informasi protein yang dimiliki berdasarkan perkiraan berat molekul dan titik isoelektrik. Analisis 2 dimensi merupakan analisis dengan dasar elektroforesis gel poliaklilamid, sehingga juga sering disebut elektroforesis 2 dimensi. Secara teknis adalah suatu metode pemisahan protein kompleks ke dalam titik isoelektrik pada arah horisontal (isoelekteric focusing) dan berat molekul pada arah vertikal (SDS-PAGE).
Phillips & Bogyo 2005)
Dengan menggunakan metode ini, protein dipisahkan sesuai dalam dimensi pertama (titik isoelektrik atau Isoelectric point (pI)) dan dengan BM pada
dimensi ke dua (SDS-PAGE). Analisis ini diawali dengan preparasi protein kemudian elektroforesis 1 dimensi, ekuilibrasi kemudian elektroforesis 2 dimensi.
Gambar 12 Skema penelitian tahap III.
Preparasi Protein C. gracilis (Dőhler et al. 1995; Wang et al. 2003).
Protein yang disiapkan untuk analisis 2 dimensi adalah protein total sel dan protein silaffin yang diekstrak dari silika dinding sel diatom. Yang dimaksud dengan protein total sel adalah protein yang diekstrak dari keseluruhan sel (the whole cell) diatom tersebut dan protein silaffin diekstrak dari silika dinding sel.
Elektroforesisi 1 dimensi : separasi titik isoelektrik
Elektroforesis 2 dimensi : separasi berat molekul Tahap Ekuilibrasi
Jenis dan karakteristik BM dan pI protein yang terlibat dalam
biosintesis PUFA Profil asam
lemak C. gracilis
Studi bioinformatika protein terlibat dalam biosintesis silika dan
PUFA
Jalur biosintesis PUFA
Jenis dan karakteristik BM dan pI protein yang terlibat dalam
biosintesis nanosilika
EKSTRAK PROTEIN
Pelet sel diatom diresuspensi dengan bufer sonikasi (50 mM Tris-Cl pH 7.5, 10 mM MgCl2
Elektroforesis 1 dimensi. Tahap ini adalah tahap untuk memisahkan
protein berdasarkan titik isoelektriknya. Tahap pertama adalah merehidrasi gel strip. Gel yang digunakan adalah Ready Strip IPG Strips 7 cm pH 3-10. Metode rehidrasi yang digunakan adalah rehidrasi pasif, yakni protein sampel dilarutkan dalam bufer rehidrasi (Dohler et al. 1995) yang dimodifikasi (9.5 M urea, 2% Triton X-100, 5% β-merkaptoetanol dan 5% ampholine pH 3-10) dalam rehidration tray. Protein dalam bufer selanjutnya diinjekkan pada gel, didiamkan sekitar satu jam, ditutup mineral oil lalu diinkubasi dalam rehidration tray selama 11-16 jam pada suhu -65 °C. Gel yang telah direhidrasi dan mengandung sampel protein dipindahkan ke dalam focusing tray yang sebelumnya telah diberi electrode wick basah dan ditutup kembali dengan mineral oil.
, 25 mM KCl, 1 mM EDTA, 0.5 mM PMSF, 0.1 mM Triton X-100, 0.1% β-merkaptoetanol. Sonikasi dilakukan secara diskontinyu 3x3 menit pada 20 KHz, 16 psi mikroamplitudo (Soniprep 150 MSE). Hasil sonikasi disentrifugasi dengan kecepatan 6000 xg, suhu 4°C, selama 30 menit. Filtrat yang diperoleh dipresipitasi dengan 10% TCA dalam aseton yang mengandung 0.07% β-merkaptoetanol selama semalam pada suhu sekitar -20°C. Endapan yang diperoleh dicuci beberapa kali dengan aseton mengandung 0.07% β-merkaptoetanol (Wang et al. 2003), dikeringkan dengan pengering vakum dan disimpan pada suhu -20 °C. Protein silaffin disiapkan seperti pada Tahap I kemudian dilanjutkan desalting dengan kolom HiTrap desalting 5 ml.
Gel dalam focusing tray kemudian dijalankan dalam PROTEAN IEF dengan voltase bertahap yakni: 250 V 20 menit, 400 V 6 jam dilanjutkan 800 V 2 jam dengan kondisi suhu 10 °C (Rousch et al. 2004). Setelah running selesai, gel dibekukan pada suhu sekitar -80 °C (Wang et al. 2003).
Tahap Ekuilibrasi. IPG strip beku dari hasil elektroforesis 1 dimensi
dicairkan dalam suhu ruang 10 menit, direndam bufer ekuilibrasi I (6 M urea, 2% SDS, 0.375 M Tris-HCl pH 8.8, 20% gliserol dan 130 mM DTT) selama 10-15 menit. Perendaman dilanjutkan dalam bufer ekuilibrasi II (6 M urea, 2% SDS, 0.375 M Tris-HCl pH 8.8, 20% gliserol dan 135 mM iodoasetamida) 1-3 jam.
Elektroforesis 2 Dimensi. Gel strip yang telah diekuilibrasi, diseparasi
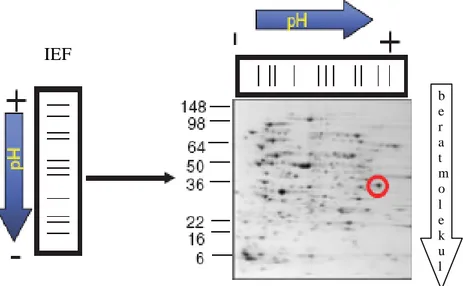
dengan menyisipkan gel strip tersebut di posisi gel penahan pada 10% gel separasi elektroforesis SDS-PAGE, dengan voltase 150 V kurang lebih 80 menit. Pewarnaan gel dilakukan dengan pewarna coomassie blue (Bollag & Edelstain 1991). Selanjutnya gel dipindai dengan 256 dpi (dot per inch) pada grey level. Prinsip kerja elektroforesis 2 dimensi dapat dilihat pada Gambar 13.
Gambar 13 Prinsip kerja metode elektroforesis 2 dimensi (Phillips & Bogyo 2005)
Estimasi Berat Molekul dan Titik Isoelektrik. Hasil pindai digunakan
untuk mendeteksi noktah protein yang terekspresi menggunakan program Melanie 7.0. Hasil deteksi protein menggunakan program Melanie 7.0 menghasilkan noktah-noktah protein yang dapat diestimasi berat molekul dan titik isoelektrik berdasarkan titik koordinatnya. Titik koordinat noktah protein selanjutnya digunakan untuk memprediksi titik isoelektrik yang didasarkan pada rumus persamaan kurva standar titik isoelektrik (Lampiran 1a) (Bollag & Edelstain 1991). Untuk mengestimasi berat molekul berdasarkan rumus persamaan kurva standar berat molekul protein BSA (Low Molecular Weight) (Lampiran 1b).
Studi Bioinformatika. Tahapan ini merupakan tahapan dalam
mengidentifikasi protein. Data berat molekul dan titik isoelektrik yang diperoleh selanjutnya digunakan untuk mengidentifikasi noktah protein dengan program
IEF b e r a t m o l e k u l IEF
TagIdent (http://www.expasy.proteomic.tools) yang dikombinasikan dengan informasi dari koleksi data protein yang terdeposit dalam pangkalan data UniProt Consortium (NCBI, SBI, PIR, EBI, EMBL) (http://www.uniprot.org).
Noktah protein yang diketahui mendekati karakteristik BM dan pI protein target dari pangkalan data, dipilih untuk diidentifikasi menggunakan TagIdent. Informasi nilai BM dengan kisaran 20% dan nilai pI dengan kisaran 0.1% dari noktah protein yang akan diidentifikasi diinputkan di dalam golongan jenis enzim atau protein (desaturase atau elongase atau silaffin) dan kelompok organisme (Chaetoceros gracilis atau Chaetoceros atau diatom). Dengan memasukkan data tersebut, program TagIdent selanjutnya akan memberikan informasi balik seluruh protein yang termasuk dalam golongan yang dipilih dan berasal dari organisme yang dipilih tersebut. Selanjutnya jenis protein ditentukan berdasarkan kesamaan karakteristik protein dari pangkalan data.
Hipotesis Jalur Biosintesis PUFA
Jalur biosintesis PUFA C. gracilis diprediksi berdasarkan protein yang telah teridentifikasi terlibat dalam sintesis PUFA dan profil PUFA yang dimiliki C. gracilis. Metode untuk memprediksi jalur biosintesis PUFA berdasarkan kombinasi metode yang dilakukan oleh Nunn et al. (2009) dan Domergue et al. (2003). Nunn et al. (2009) memprediksi jalur biosintesis asam lemak menggunakan ekspresi protein yang diidentifikasi dari protein total diatom Thalassiosira pseudonana. Domergue et al. (2003), membuat hipotesis jalur biosintesis EPA berdasarkan gen yang mengkode protein enzim yang terlibat dalam sintesis asam lemak dan komposisi asam lemak pada fase eksponensial diatom Phaeodactylum tricornutum.