Bacillus sp. ASAL RIZOSFER KEDELAI
YANG BERPOTENSI SEBAGAI PEMACU PERTUMBUHAN
TANAMAN DAN BIOKONTROL FUNGI PATOGEN AKAR
ASRI WIDYAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul “Bacillus sp. Asal Rizosfer Kedelai yang Berpotensi sebagai Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen Akar” adalah benar hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2008
Asri Widyawati G351060221
RINGKASAN
ASRI WIDYAWATI. Bacillus sp. Asal Rizosfer Kedelai yang Berpotensi sebagai Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen Akar. Dibimbing oleh ARIS TRI WAHYUDI dan ABDJAD ASIH NAWANGSIH.
Rizosfer tanaman telah diketahui di dalamnya terdapat mikroorganisme yang bersimbiosis dengan akar. Adanya mikroorganisme tersebut dapat memberikan efek positif maupun negatif bagi perakaran tanaman. Berbagai jenis mikroorganisme seperti bakteri telah diketahui dapat dimanfaatkan sebagai agens hayati untuk meningkatkan pertumbuhan dan produksi tanaman yang dikenal luas dengan istilah Plant Growth Promoting Rhizobacteria (PGPR) atau Rizobakteria Pemacu Pertumbuhan Tanaman. Bacillus sp. merupakan salah satu kelompok bakteri yang dapat diisolasi dari tanah dengan karakter Gram positif, berbentuk batang dan mempunyai kemampuan membentuk endospora pada kondisi lingkungan yang tidak menguntungkan sehingga dapat toleran pada kondisi lingkungan kritis. Compant et al. (2005) melaporkan bahwa Bacillus sp. mempunyai banyak potensi yaitu mampu memproduksi IAA, melarutkan fosfat, mensekresi siderofor dan berperan sebagai agens biokontrol dengan menginduksi sistem kekebalan tanaman serta menghasilkan antibiotik.
Penelitian ini bertujuan menapis rizobakteria Bacillus sp. asal rizosfer tanaman kedelai secara in vitro yang dapat berperan sebagai pemacu pertumbuhan tanaman dan pengendali fungi patogen penyebab penyakit akar tanaman kedelai serta identifikasi molekulernya. Karakter yang yang diuji meliputi kemampuan isolat dalam memproduksi IAA, reaksi hipersensitivitas, pemacuan pertumbuhan, kemampuan melarutkan fosfat, kemampuan mengkelat besi (dengan memproduksi siderofor) serta kemampuan mengendalikan fungi patogen akar khususnya
Rhizoctonia solani dan Sclerotium rolfsii. Penelitian ini juga dimaksudkan untuk mengetahui identitas bakteri yang berpotensi sebagai PGPR berdasarkan sekuen gen yang menyandikan 16S rRNA.
Pada penelitian ini dilakukan isolasi dan karakterisasi Bacillus sp. yang berasal dari rizosfer kedelai asal Cirebon dengan metode pengenceran secara berseri menggunakan media Nutrient Agar (NA). Karakterisasi fisiologi secara parsial genus Bacillus mengikuti metode standar Bergey’s Manual of Determinative Bacteriology (Buchanan & Gibbon 1974) yang meliputi pewarnaan Gram, pewarnaan endospora dan uji katalase. Genus Bacillus memiliki karakter Gram positif, berbentuk batang, mampu membentuk endospora dan bersifat katalase positif. Dari hasil isolasi dan karakterisasi ini diperoleh sebanyak 60 isolat merupakan kelompok Bacillus sp.
Kemampuan isolat dalam memproduksi IAA diuji menggunakan metode kolorimetri dengan menambahkan reagen Salkowski yang diukur pada panjang gelombang 510 nm. Pada uji ini diperoleh sebanyak 45 isolat mampu memproduksi IAA dengan konsentrasi yang berbeda-beda dengan kisaran antara 0.06 ppm (Cr 72) hingga 44.66 ppm (Cr 55). Adanya perbedaan dalam memproduksi IAA oleh bakteri dimungkinkan karena pengaruh perbedaan aktifitas enzim indolpiruvat dekarboksilase yang terkait dengan tingkat ekspresi gen ipcd yang menyandikan struktur protein tersebut. Konsentrasi IAA yang
dihasilkan oleh bakteri juga bergantung kepada aktifitas dan jumlah sel, ketersediaan nutrisi dan substrat L-trp dalam media.
Hasil uji pelarutan fosfat diperoleh sebanyak 36 isolat mampu melarutkan fosfat yang terkandung dalam media Phikovkaya dengan kemampuan yang berbeda-beda ditunjukkan oleh zona bening yang terbentuk di sekeliling koloni bakteri. Adanya kemampuan melarutkan fosfat yang berbeda ini mungkin terkait dengan jenis asam organik yang disintesis oleh bakteri yang mungkin memiliki kecocokan ataupun efektifitas dalam memutuskan ikatan pada kompleks kation logam dengan anion fosfat.
Kemampuan isolat Bacillus sp. dalam memproduksi siderofor diuji dengan menumbuhkan isolat pada media Chrome Azurol Sulfonat (CAS) agar yang mengandung Fe dan diinkubasikan semalam. Hasil uji menunjukkan bahwa sebanyak 43 isolat memproduksi siderofor ditandai dengan terbentuknya zona berwarna kuning oranye jernih di sekeliling koloni bakteri. Menurut Compant et al. (2005) siderofor pada berbagai bakteri memiliki kemampuan berbeda dalam mengkelat besi, namun pada umumnya digunakan untuk menekan cendawan patogenik yang mempunyai afinitas siderofor rendah. Adanya pengambilan besi oleh bakteri PGPR ini dapat bertindak sebagai pesaing (competitor) bagi mikrob fitopatogen.
Seluruh isolat yang mampu memproduksi IAA sebelum ditelaah kemampuannya dalam pemacuan pertumbuhan diuji hipersensitivitas. Hasil uji hipersensitivitas menunjukkan bahwa seluruh isolat tidak memberikan reaksi hipersensitif terhadap tanaman tembakau. Hal ini menunjukkan bahwa seluruh isolat tidak bersifat sebagai patogen bagi tanaman.
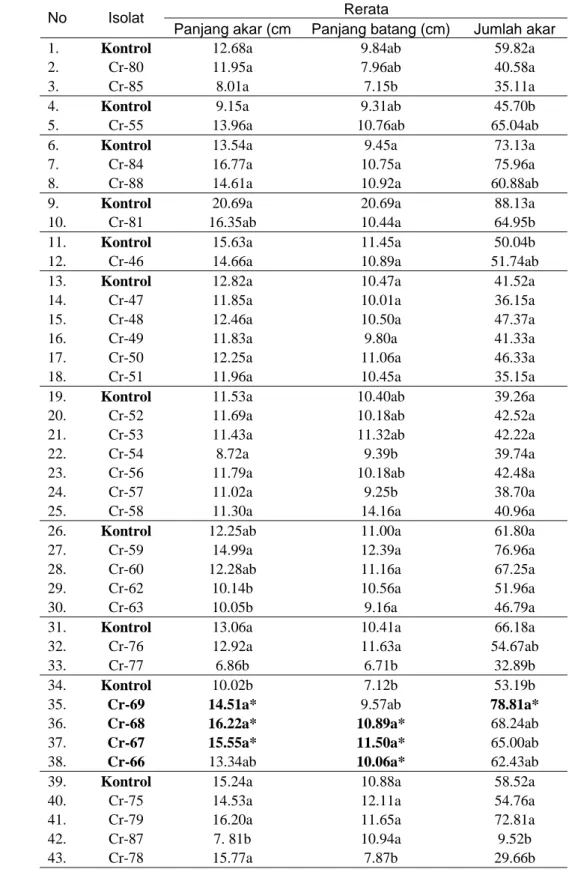
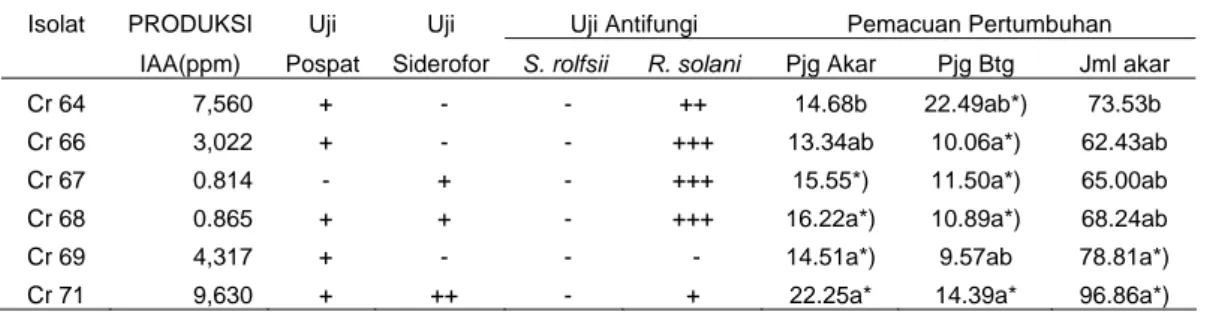
Pada telaah pemacuan pertumbuhan diperoleh sebanyak 6 isolat mampu memacu secara signifikan taraf 95% terhadap pertumbuhan panjang batang, panjang akar, dan jumlah akar lateral dan sublateral kecambah kedelai kultivar Slamet. Isolat Cr 67, Cr 68, Cr 69, dan Cr 71 berhasil memacu pemanjangan akar primer, isolat Cr 64, Cr 66, Cr 67, Cr 68, dan Cr 71 berhasil memacu pemanjangan batang, isolat Cr 69 dan Cr 71 mampu memacu pembentukan akar lateral dan sub lateral. Sedangkan pengaruh inokulasi dengan isolat Cr 77, Cr 82, Cr 83, Cr 87, Cr 89, Cr 90, dan Cr 91 menyebabkan pertumbuhan panjang akar kecambah lebih pendek daripada kontrol. Rerata panjang batang kecambah juga lebih pendek pada kecambah yang diinokulasikan dengan isolat Cr 77 dan Cr 78 dibandingkan dengan kontrol. Jumlah akar lateral dan sub lateral lebih sedikit daripada kontrol setelah diberi perlakuan dengan isolat Cr 77, Cr 78, Cr 81, Cr 82, Cr 83, Cr 87, Cr 89, Cr 90, dan Cr 91. Isolat-isolat yang mampu memacu pertumbuhan tersebut relatif memproduksi IAA justru pada konsentrasi yang rendah yaitu pada kisaran 0.81 ppm hingga 9.63 ppm. Sedangkan isolat yang memproduksi IAA yang tinggi antara lain Cr 55 (44.66 ppm), Cr 78 (32.84 ppm), Cr 84 (30.30), Cr 90 (22.79 ppm) dan Cr 91 (20.32 ppm) tidak mampu memacu pertumbuhan kecambah kedelai. Hal ini memperkuat pernyataan Husen et al. (2006) bahwa peningkatan pertumbuhan tanaman terjadi pada pemberian IAA dengan konsentrasi sangat rendah (0.01 μg/ml-1
) sedangkan pada konsentrasi lebih tinggi cenderung menurunkan pertumbuhan tanaman. Selain itu Glick (1995) juga menambahkan bahwa produksi IAA yang berlebihan akan memacu hormon etilen yang dalam konsentrasi tinggi justru menghambat perkembangan / pemanjangan akar.
Kemampuan isolat Bacillus sp. dalam menekan pertumbuhan cendawan
Rhizoctonia solani dan Sclerotium rolfsii diuji secara kualitatif dan kuantitatif menggunakan metode kultur ganda selanjutnya dihitung besarnya persentase penghambatan (Dikin et al. 2006). Sebanyak 28 isolat mempunyai kemampuan menghambat pertumbuhan R. solani dan sebanyak 2 isolat mempunyai kemampuan menghambat pertumbuhan radial S. rolfsii. Penghambatan pertumbuhan cendawan oleh biokontrol dapat terjadi melalui mikolisis yaitu hilangnya protoplasma pada struktur dinding sel fungi dan enzim tidak larut pada dinding sel fungi (Lim et al. 1991). Adanya sejumlah besar isolat yang mampu menghambat pertumbuhan cendawan kemungkinan karena genus Bacillus mampu mensintesis berbagai senyawa yang aktif melawan cendawan dan mampu memproduksi siderofor sehingga bertindak sebagai competitor bagi patogen akar tersebut. Menurut Compant et al. (2005) dinding sel cendawan S. rolfsii, R. solani dan Pythium ultimum dapat dihancurkan oleh enzim ß-1,3-glukanase yang dihasilkan oleh B. cepacea.
Hasil uji karakter PGPR pada isolat Bacillus sp. menunjukkan bahwa empat isolat diantara 6 isolat yang memacu pertumbuhan kecambah kedelai kultivar Slamet yaitu isolat Cr 64, Cr 66, Cr 68, dan Cr 71 memiliki karakter yang lengkap sebagai PGPR yaitu mampu memproduksi hormon IAA, mampu memacu pertumbuhan tanaman tanpa menyebabkan reaksi hipersensitif, mampu melarutkan fosfat, mampu memproduksi siderofor serta memiliki kemampuan sebagai biokontrol fungi patogen akar tanaman kedelai R. solani.
Keragaman 6 isolat Bacillus sp. yang telah diisolasi dan telah diuji kemampuannya sebagai PGPR yang memacu pertumbuhan tanaman dapat dianalisis menggunakan pendekatan molekuler berdasarkan sekuen gen 16S rRNA. DNA hasil isolasi diamplifikasi sebanyak 30 siklus menggunakan mesin PCR dengan primer 63f dan 1387r (Marchesi et al. 1998) diperoleh panjang basa nukleotida ± 1300 pb. Selanjutnya hasil identifikasi sekuen parsial gen 16S rRNA hasil amplifikasi menunjukkan bahwa isolat memiliki persentase homologi tertentu terhadap isolat yang terdapat pada GenBank. Hasil analisis sekuen parsial gen 16S rRNA dengan program BLAST-N menunjukkan bahwa Cr 64 memiliki persentase similaritas 92% dengan Bacillus sp. NRS-800, Cr 66 memiliki persentase similaritas 94% dengan B. cereus HNR10, Cr 67 memiliki persentase similaritas 94% dengan B. pumilus str M-1-9-1, Cr 68 memiliki persentase similaritas 93% dengan B. thuringiensis str FWAW, Cr 69 memiliki persentase similaritas 98% dengan B. cereus AD2, sedangkan Cr 71 memiliki persentase similaritas 99% dengan Bacillus shandongensis str SD.
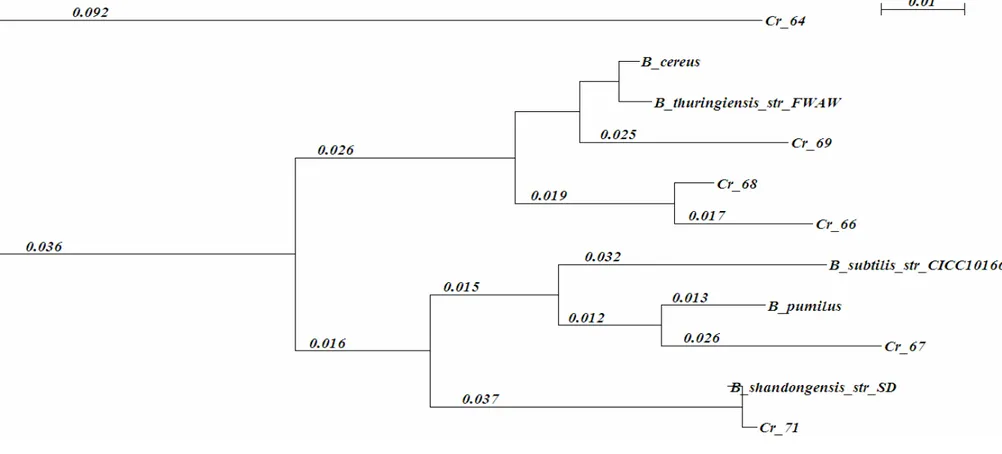
Hasil pengolahan sekuen parsial gen 16S rRNA menggunakan program NJplot diperoleh dendrogram pohon filogenetik yang memperlihatkan hubungan kekerabatan antara isolat Bacillus dengan spesies Bacillus spp. Keenam isolat membentuk 3 kelompok yang berbeda. Cr 64 memisah tersendiri, isolat Cr 66, Cr 68, dan Cr 69 membentuk kelompok sendiri yang terpisah dengan Cr 67 dan Cr 71. Masing-masing isolat memiliki jarak evolusi yang berbeda-beda dengan spesies Bacillus spp. yang ada pada GenBank. Diversitas keenam isolat cukup tinggi dan masing - masing isolat memiliki kedekatan kekerabatan pada spesies yang berbeda-beda.
ABSTRACT
ASRI WIDYAWATI. Bacillus sp. Isolated from Rhizosphere of Soybean Plant as Plant Growth Promoting Rhizobacteria and Biocontrol of Root Pathogenic Fungi. Under the direction of ARIS TRI WAHYUDI and ABDJAD ASIH NAWANGSIH.
Bacillus sp. is one of the rhizosphere bacteria that have important role as plant growth promoter, known as plant growth-promoting rhizobacteria (PGPR). Sixty isolates identified as Bacillus sp. were successfully isolated from rhizosphere soil of soybean plant of Plumbon, Cirebon, West Java, based on their morphologies and physiologies characters. 45 Bacillus sp. isolates grown in Nutrient Broth (NB) medium supplemented with tryptophan (0.2 mM) had ability to produce IAA. Bacillus sp. Cr 55 had ability to produce the highest IAA was about 44.66 ppm. Hypersensitivity test revealed that all of Bacillus sp. isolates were classified as non-pathogenic bacteria. Six Bacillus sp. isolates that have been characterized to produce IAA were able to induce elongation of primary root and stem, and numerous of lateral and sub lateral roots. Furthermore, 36 isolates of
Bacillus sp. had ability to solubilize phosphate as indicated by clear zone surrounding the colonies on Pikovskaya agar, 43 isolates of Bacillus sp. had ability to produce siderophore, 2 isolates were capable to produce antifungal compounds to inhibit of S. rolfsii and 28 isolates of them were capable to produce antifungal compounds to inhibit of R. solani. This study has demonstrated that 4 isolates of Bacillus sp. isolated from rhizosphere of soybean plant can be determined as potential isolates that can be used as inoculants to promote plant growth based on the specific characters. The result of identified use 16S rRNA partial sequence genes of 6 isolates that had ability as PGPR showed that all of them had similarity with Bacillus spp. from GenBank. Cr 64 had 92% similarity with Bacillus sp. NRS-800, Cr 66 had 94% similarity with B. cereus HNR10, Cr 67 had 94% similarity with B. pumilus str M1-9-1, Cr 68 had 93% similarity with
B. thuringiensis str FWAW, Cr 69 had 98% similarity with B. cereus AD2 and Cr 71 had 99% similarity with B. shandongensis str SD.
Key Words : Bacillus sp., Indole Acetic Acid (IAA), Phosphate Solubilization, Germination Seedling Bioassay, Siderophore, Anti Fungi.
© Hak cipta milik Institut Pertanian Bogor, tahun 2008 Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah;
b. pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
Bacillus sp. ASAL RIZOSFER KEDELAI
YANG BERPOTENSI SEBAGAI PEMACU PERTUMBUHAN
TANAMAN DAN BIOKONTROL FUNGI PATOGEN AKAR
ASRI WIDYAWATI
Tesis
Sebagai salah satu syarat
untuk memperoleh gelar Magister Sains pada Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Bacillus sp. Asal Rizosfer Kedelai yang Berpotensi sebagai Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen Akar
Nama : Asri Widyawati NRP : G351060221 Program Studi : Biologi
Disetujui, Komisi Pembimbing
Dr. Aris Tri Wahyudi, M.Si. Dr. Ir. Abdjad Asih Nawangsih, M.Si.
Ketua Anggota
Diketahui,
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi S, DEA Prof. Dr Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Syukur alhamdulillah penulis panjatkan kepada Allah SWT atas rahmat, karunia serta ridlo-Nya sehingga tesis yang berjudul ”Bacillus sp. Asal Rizosfer Kedelai yang Berpotensi sebagai Pemacu Pertumbuhan Tanaman dan Biokontrol Fungi Patogen Akar” ini dapat diselesaikan.
Terima kasih penulis ucapkan kepada Dr. Aris Tri Wahyudi, M.Si dan Dr. Ir. Abdjad Asih Nawangsih, M.Si. selaku dosen pembimbing yang selalu memberikan bimbingan dan arahannya dalam penyusunan tesis ini. Di samping itu penulis juga menyampaikan ucapan terima kasih kepada Departemen Agama RI yang telah memberikan kesempatan sehingga penulis dapat mengikuti program pendidikan pascasarjana. Terima kasih juga penulis sampaikan kepada Drs. Komari Zaman selaku Kepala Madrasah Aliyah Negeri (MAN) Godean, Sleman, Yogyakarta atas dukungan dan kesempatan yang diberikan sehingga penulis dapat mengikuti program pendidikan pascasarjana IPB.
Penelitian ini sebagian didanai oleh Program Insentif Penelitian Dasar Kementrian Negara Riset dan Teknologi (KNRT) kepada Aris Tri Wahyudi dan sebagian lagi didanai dari Departemen Agama RI melalui Kerjasama antara IPB dengan Departemen Agama RI. Untuk itu kami mengucapkan terima kasih.
Ucapan terima kasih juga penulis sampaikan kepada Bapak, Kakak-kakak, Adik dan keponakan atas segala doa, perhatian dan dukungan yang diberikan. Demikian juga kepada Mbak Rina, Rika, Mbak Ari, teman-teman dan pengelola Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB atas kerjasamanya selama penelitian ini dilaksanakan.
Semoga tesis ini memberikan manfaat.
Bogor, Mei 2008 Asri Widyawati
RIWAYAT HIDUP
Penulis dilahirkan di Sleman pada tanggal 22 Mei 1975 dari ayah Drs. Asri dan ibu Sri Wijati (almh). Penulis merupakan anak keenam dari 7 bersaudara.
Tahun 2000 penulis menyelesaikan program Strata 1 pada Universitas Negeri Yogyakarta mengambil jurusan Pendidikan Biologi. Selanjutnya penulis mengajar pada sekolah menengah swasta dari tahun 1998 hingga tahun 2003. Pada tahun 2004 penulis mengajar di MAN Godean, Sleman, Yogyakarta hingga sekarang.
Pada bulan Juli 2006 penulis mendapatkan kesempatan mengikuti program beasiswa pendidikan Pascasarjana dari Departemen Agama RI dan mengambil Program Studi Biologi, Subprogram Studi Mikrobiologi pada Sekolah Pascasarjana IPB.
DAFTAR ISI
Halaman
DAFTAR ISI... xii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
TINJAUAN PUSTAKA Bacillus sp. ... 4
Karakter Bacillus sp. sebagai PGPR ... 4
Fungi Patogen Akar Kedelai ... 9
Gen 16S rRNA ... 10
BAHAN DAN METODE Isolasi dan Karakterisasi Fisiologi secara Parsial Bacillus sp. ... 11
Uji Karakteristik Bacillus sp. sebagai PGPR Uji Produksi Indole Acetic Acid (IAA) ... 11
Uji Pelarutan Fosfat ... 12
Uji Produksi Siderofor ... 12
Uji Hipersensitivitas ... 13
Telaah Pemacuan Pertumbuhan Tanaman ... 13
Uji Antagonisme terhadap Fungi Patogen Akar ... 13
Identifikasi Berdasarkan Sekuen Gen 16S rRNA Isolasi DNA ... 14
Amplifikasi DNA ... 15
Analisis Sekuen Gen 16S rRNA ... 15
HASIL Isolasi dan Karakterisasi Fisiologi secara Parsial Bacillus sp. ... 16
Karakter Bacillus sp. sebagai PGPR Produksi Indole Acetic Acid (IAA) ... 16
Uji Pelarutan Fosfat ... 18
Uji Produksi Siderofor ... 18
Uji Hipersensitivitas ... 18
Telaah Pemacuan Pertumbuhan ... 21
Uji Antagonisme terhadap Fungi Patogen Akar ... 24
PEMBAHASAN
Isolasi dan Karakterisasi Fisiologi secara Parsial Bacillus sp. ... 29
Karakter Bacillus sp. sebagai PGPR ... 30
Analisis Sekuen Gen 16S rRNA ... 37
SIMPULAN DAN SARAN Simpulan ... 39
Saran ... 39
DAFTAR PUSTAKA ... 40
DAFTAR TABEL
Halaman
1 Hasil uji produksi IAA, pelarutan fosfat, uji siderofor dan uji anta- gonisme terhadap cendawan S. rolfsii dan R. solani pada 45 isolat
Bacillus sp. yang mampu memproduksi IAA ... 20 2 Rerata panjang akar, panjang batang dan jumlah akar lateral dan sub
lateral pada kecambah kedelai kultivar Slamet yang diberi perlakuan dengan isolat Bacillus sp. dan diinkubasikan selama 7 hari pada
media agar – agar 1% beserta kontrol ... 23 3 Karakteristik isolat Bacillus sp. yang mampu memacu pertumbuhan
kecambah kedelai kultivar Slamet secara signifikan ... 35 4 Karakteristik PGPR isolat Bacillus sp. dan hasil analisis sekuen gen
DAFTAR GAMBAR
Halaman 1 Penampilan koloni isolat Bacillus sp. Cr 66 berumur 24 jam yang
ditumbuhkan pada media cawan gorea Nutrient Agar (A); (B) penampilan sel Bacillus sp. yang dilakukan perwarnaan gram menunjukkan Gram positif berbentuk batang; (C) struktur endospora ditunjukkan dengan tanda anak panah diamati menggunakan
mikroskop cahaya perbesaran 1000 kali ... 17 2 Isolat Bacillus sp. Cr 90 yang ditumbuhkan pada media Phikovkaya
dan diinkubasikan selama 3 hari pada suhu ruang mempunyai kemampuan melarutkan fosfat yang ditandai oleh terbentuknya zona bening di sekeliling koloni bakteri (A); (B) penampilan koloni
Bacillus sp. yang ditumbuhkan pada media agar-agar CAS dengan metode replika dan diinkubasikan semalam menampilkan zona berwarna oranye jernih di sekeliling koloni bakteri yang
menunjukkan dihasilkannya siderofor ... 19 3 Panjang akar dan jumlah akar kecambah kedelai kultivar Slamet
berumur tujuh hari pada media agar-agar 1%, (A) kecambah
diinokulasi dengan Bacillus sp. Cr 69; (B) kontrol ... 22 4 Penampilan cendawan R. solani yang diinkubasikan selama 2 hari
pada media PDA pertumbuhan radialnya dihambat oleh isolat
Bacillus sp. Cr 64 (A); penampilan cendawan S. rolfsii yang diinkubasikan selama 5 hari pada media PDA pertumbuhan
radialnya dihambat oleh isolat Bacillus sp. Cr55 ... 25 5 Elektroforesis gel Agarose 1% dari gen 16S rRNA hasil amplifikasi
PCR sebanyak 30 siklus menggunakan primer 63f dan 1387r
memiliki panjang basa nukleotida sekitar 1.3 kb ... 27 6 Dendrogram pohon filogenetik yang mengindikasikan kekerabatan
dari keenam isolat berdasarkan sekuen gen 16S rRNA hasil amplifikasi PCR dengan isolat dari GenBank (angka di atas garis cabang menunjukkan panjang percabangan yang mengindikasikan
DAFTAR LAMPIRAN
Halaman
1 Sekuen parsial gen 16S rRNA 6 isolat pemacu pertumbuhan tanaman 44 2 Hasil analisis sekuen parsial gen 16S rRNA menggunakan program
BLAST-N ... 46 3 Komposisi media tumbuh (dalam liter) ... 47 4 Bahan – bahan untuk karakterisasi fisiologi secara parsial genus
PENDAHULUAN
Latar Belakang Masalah
Pertambahan jumlah penduduk yang sangat pesat menyebabkan kebutuhan pangan juga meningkat. Berbagai langkah dilakukan masyarakat dan pemerintah untuk menjaga tetap tersedianya pangan dunia. Langkah-langkah yang diambil hingga menjelang abad 20 antara lain dengan intensifikasi melalui penggunaan pupuk sintetis, pestisida dan bibit unggul. Langkah-langkah tersebut ternyata memberikan efek samping pencemaran lingkungan. Hal ini mendorong berkembangnya bioteknologi dengan menggunakan mikroorganisme sebagai agens untuk meningkatkan pertumbuhan dan produksi tanaman sekaligus sebagai agens pengendali hayati terhadap patogen.
Salah satu kelompok organisme yang sering mengganggu tanaman kedelai adalah cendawan, dua diantaranya adalah Rhizoctonia solani dan Sclerotium rolfsii. Keduanya merupakan jenis cendawan yang sering menyerang perakaran tanaman kedelai dan menyebabkan penyakit busuk akar. Hal ini memerlukan penanganan lanjut yang lebih efektif.
Rizosfer tanaman telah diketahui di dalamnya terdapat mikroorganisme yang bersimbiosis dengan akar. Rizosfer atau daerah sekitar perakaran tanaman relatif kaya akan nutrisi yang berkaitan dengan keadaan di akar yaitu berupa hilangnya 5 – 21 % hasil fotosintesis tanaman yang dilepaskan sebagai eksudat akar (Marscher 1995). Sebagai akibatnya, keberadaan nutrisi pada akar ini mendukung populasi mikrob aktif berkembang dan mampu memproduksi senyawa yang mungkin menguntungkan, netral atau merugikan bagi tanaman di atasnya. Adanya mikroorganisme tersebut dapat memberikan efek positif maupun negatif bagi perakaran tanaman. Berbagai jenis mikroorganisme seperti bakteri telah diketahui dapat dimanfaatkan sebagai agens hayati untuk meningkatkan pertumbuhan dan produksi tanaman yang dikenal luas dengan istilah Plant Growth Promoting Rhizobacteria (PGPR) atau Rizobakteria Pemacu Pertumbuhan Tanaman. Bakteri ini secara aktif mengkolonisasi rizosfer dan permukaan akar serta memberikan pengaruh positif untuk pemacuan pertumbuhan tanaman melalui penyediaan nutrisi dan hormon bagi tanaman, serta dapat bersifat antagonistik terhadap bakteri dan fungi patogen (Kloepper et al. 1999; Gray &
2 Smith 2005). Adanya PGPR dapat memberikan keuntungan melalui berbagai mekanisme antara lain produksi metabolit sekunder seperti antibiotik, kitinase, 1,3 - β-glukanase, sianida, substansi hormon, sebagai agens pengendali biologi melalui kompetisi, induksi sistem pertahanan terhadap patogen, produksi siderofor, pelarut fosfat, dan fiksasi N2. (Glick 1995; Husen 2003). Bakteri rizosfer yang telah diketahui dapat menghasilkan auksin antara lain Pseudomonas
sp., Azospirillum sp., Azotobacter sp., Bacillus sp., Lactobacillus sp.,
Paenibacillus polymyxa, Enterobacter sp., Serratia marcescens, Klebsiella sp.,
Algaligenes faecalis, dan sianobacteria (Torres-Rubio et al. 2000).
Adapun bakteri yang menjadi topik dalam kajian penelitian ini adalah bakteri kelompok Bacillus sp. merupakan salah satu kelompok bakteri yang dapat diisolasi dari tanah dengan karakter Gram positif, berbentuk batang dan mempunyai kemampuan membentuk endospora pada kondisi lingkungan yang tidak menguntungkan sehingga dapat toleran pada kondisi lingkungan kritis. Compant et al. (2005) melaporkan bahwa Bacillus sp. mempunyai banyak potensi yaitu mampu memproduksi IAA, melarutkan fosfat, mensekresi siderofor dan berperan sebagai agens biokontrol dengan menginduksi sistem kekebalan tanaman serta menghasilkan antibiotik.
Berbagai penelitian menunjukkan bahwa sangat banyak jenis mikrob khususnya bakteri di tanah termasuk Bacillus sp. dapat dimanfaatkan sebagai PGPR sekaligus dapat berperan untuk mengendalikan penyakit pada tanaman. Pada genus Bacillus kemampuan biokontrolnya didukung oleh kemampuannya membentuk spora yang dapat bertahan dan tetap dapat melepaskan metabolit aktifnya pada kondisi lingkungan yang tidak menguntungkan sehingga memungkinkan untuk membuat formulasi produk yang stabil (Kloepper et al.
1999).
Adanya bakteri yang diisolasi dari tanah perakaran kedelai yang berpotensi sebagai pemacu pertumbuhan tanaman dan pengendali hayati patogen akar tanaman kedelai diharapkan dapat dimanfaatkan sebagai alternatif galur inokulan yang dapat meningkatkan pertumbuhan dan produksi tanaman kedelai. Berdasarkan latar belakang di atas maka perlu dilakukan penelitian untuk mengisolasi dan mengkarakterisasi potensi Bacillus sp. sebagai pemacu
3 pertumbuhan tanaman dan pengendali pertumbuhan fungi patogen akar. Selanjutnya dilakukan identifikasi molekulernya untuk menentukan galur inokulannya.
Tujuan
Penelitian ini bertujuan menapis rizobakteria Bacillus sp. asal rizosfer tanaman kedelai secara in vitro yang dapat berperan sebagai pemacu pertumbuhan tanaman dan pengendali fungi patogen penyebab penyakit akar tanaman kedelai serta identifikasi molekulernya.
TINJAUAN
PUSTAKA
Bacillus sp.
Bacillus sp. merupakan bakteri gram positif, berbentuk batang yang mempunyai kemampuan membentuk endospora pada kondisi yang kurang menguntungkan. Bakteri ini dapat ditemukan dan dapat diisolasi dari tanah. Bentuk endospora merupakan nilai lebih bagi bakteri yang sangat terkait secara ekologi di dalam tanah. Kemampuannya membentuk endospora menyebabkan bakteri ini relatif lebih tahan terhadap kondisi lingkungan yang kurang menguntungkan dan kritis misalnya radiasi, panas, asam, desinfektan, kekeringan, nutrisi yang terbatas dan dapat dorman dalam jangka waktu yang lama hingga bertahun-tahun. Struktur spora tidak akan terjadi jika sel sedang berada pada fase pembelahan secara eksponensial tetapi akan dibentuk terutama pada kondisi nutrisi esensial misalnya karbon dan nitrogen terbatas. Pada Bacillus subtilis
sporulasi terjadi sekitar 8 jam dengan melibatkan hingga 200 gen (Madigan et al.
2000). Selain itu Bacillus sp. mempunyai sifat katalase positif sehingga mampu menguraikan peroksida toksik menjadi air dan oksigen. Bacillus sp. termasuk kelompok PGPR yang memiliki banyak potensi karena mampu memproduksi IAA, melarutkan fosfat, memsekresi siderofor dan berperan sebagai agens biokontrol dengan menginduksi sistem kekebalan tanaman serta menghasilkan antibiotik (Compant et al. 2005).
Karakter Bacillus sp. sebagai PGPR
Plant Growth Promoting Rhizobacteria (PGPR) pertama kali didefinisikan oleh Kloepper dan Schroth (1978) untuk mendeskripsikan bakteri tanah yang berkumpul di akar setelah benih ditanam. PGPR dapat meningkatkan pertumbuhan tanaman dengan berbagai mekanisme antara lain fiksasi nitrogen, produksi siderofor, sebagai pengkelat besi dan sintesis fitohormon. Bakteri tersebut dapat meningkatkan pertumbuhan tanaman dengan meningkatkan sistem perakaran tanaman. Menurut Enebak et al. 1998 (diacu dalam Mello et al. 2004) PGPR dapat mempengaruhi pertumbuhan tanaman melalui satu mekanisme atau lebih termasuk meningkatkan fiksasi nitrogen, produksi auksin, giberelin,
5
sitokinin, etilen, melarutkan fosfat dan oksidasi sulfur, meningkatkan ketersediaan nitrat, produksi antibiotik ekstraseluler, enzim litik, asam hidrosianik, meningkatkan permiabilitas akar dan kompetisi dalam nutrisi. Kemampuan rizobakteria dalam meningkatkan pertumbuhan tanaman sangat bergantung pada karakter yang merupakan ciri khas dan spesifik gen yang dimilikinya (Nelson 2004).
Mikroorganisme mampu menghasilkan hormon tumbuhan seperti auksin, sitokinin dan giberelin (Leveau & Lindow 2005). Asam indol asetat atau Indol acetic acid (IAA) merupakan hormon auksin pertama pada tumbuhan yang mengendalikan berbagai proses fisiologi penting meliputi pembelahan dan perkembangan sel, diferensiasi jaringan serta respons terhadap cahaya dan gravitasi (Salisbury & Ross 1992). Tumbuhan mungkin saja tidak mampu mencukupi kebutuhan auksin untuk pertumbuhannya secara optimal sehingga diperlukan tambahan hormon pemacu pertumbuhan dari luar. Menurut Patten dan Glick (2002) respons tanaman terhadap IAA yang dihasilkan mikrob berbeda-beda bergantung pada spesies tanaman dan konsentrasi IAA yang dihasilkan.
Menurut Leveau dan Lindow (2005) hormon IAA atau yang dikenal sebagai auksin merupakan hormon pemacu pertumbuhan dan mengontrol berbagai proses fisiologi seperti pembelahan sel, diferensiasi jaringan dan respons terhadap cahaya dan gravitasi. Bakteri penghasil IAA mempunyai kemampuan membantu berbagai proses tersebut dengan memasukkan IAA ke dalam pool auksin tanaman. Akar merupakan organ tanaman yang paling sensitif terhadap fluktuasi kadar IAA dan responsnya pada peningkatan jumlah IAA eksogenous meluas dari pemanjangan akar primer, pembentukan akar lateral dan akar liar, sampai penghentian pertumbuhan.
Biosintesis IAA oleh mikrob ditingkatkan oleh prekursor fisiologi tertentu yaitu L-Tryptophan (Husen 2003). Protein –TRAP (AT) yang diproduksi oleh
trpA pada Bacillus subtilis dapat mengikat dan menghambat aktifitas triptofan protein yang berikatan lemah antara Trp-RNA (TRAP). Pada Bacillus subtilis
diperlukan ekspresi dari tujuh gen untuk berlangsungnya biosintesis L-triptofan dari asam korismat termasuk prekursor asam amino amoniak. Enam dari tujuh gen terorganisasi sebagai operan triptofan, suboperan dalam superoperon aromatik.
6
Gen triptofan yang ketujuh trpG (pabA) terletak pada operan folat dan menghasilkan polipeptida yang berperan dalam biosintesis triptofan dan folat (Wen & Charles 2005).
Manulis et al. (1998) mengemukakan bahwa beberapa lintasan sintesis IAA pada bakteri yang melibatkan senyawa intermediat indole-3-pyruvate (IpyA) yaitu indole-3-acetamide (IAM), tryptamine (TAM) dan indole-3-acetonitrile (IAN). Jalur utama yang ada pada bakteri yaitu lintasan IAM dan IPyA. Bakteri yang memproduksi IAA menstimulasi pertumbuhan sistem perakaran inang.
Sel tumbuhan memproduksi IAA dari L-tripthofan melalui intermediet IAM, lintasannya melalui enzim triptofan 2-monooksenase yang mengkatalisis konversi triptofan menjadi IAM dan enzim indoleacetamid hidrolase yang mengkatalisis konversi IAM menjadi IAA (Mazzola & White 1993). Tien et al.
(1979) mengamati bahwa produksi IAA meningkat sesuai dengan peningkatan konsentrasi triptofan dari 1 – 100 ug / ml. Konsentrasi IAA juga meningkat seiring dengan umur kultur sampai bakteri mencapai fase stasioner. Pengocokan lebih disukai untuk memproduksi IAA, terutama pada yang mengandung nitrogen sedangkan fitohormon lainnya juga terdeteksi pada media kultur yaitu giberelin dan senyawa serupa sitokinin.
Produksi IAA tidak berfungsi nyata sebagai hormon dalam sel bakteri, dimungkinkan terdapat dalam sel bakteri karena hormon tersebut berperan penting dalam interaksi antara bakteri dan tanaman. Pada penelitian yang dilakukan Patten dan Glick (2002) diperoleh bahwa bakteri yang memproduksi IAA menstimulasi pertumbuhan sistem perakaran inang. Keuntungan dari asosiasi tanaman dengan bakteri adalah mensuplai sebanyak produk metabolit fiksasi karbon oleh tumbuhan yang telah hilang ke rhizosfer sebagai eksudat (Martens et al. 1994, diacu dalam Patten & Glick 2002).
Reaksi awal pengubahan triptofan menjadi indol-3-piruvat dikatalisis oleh aminotransferase aromatik, dimana empat enzim berhasil diidentifikasi pada
Azospirillum lipoferum. Enzim-enzim yang ditemukan ini spesifik terhadap berbagai asam amino aromatik dan tidak hanya pada triptofan, sehingga deteksi pada protein-protein ini kurang membuktikan bahwa IAA disintesis melalui indole-3-piruvat pada Azospirillum.
7
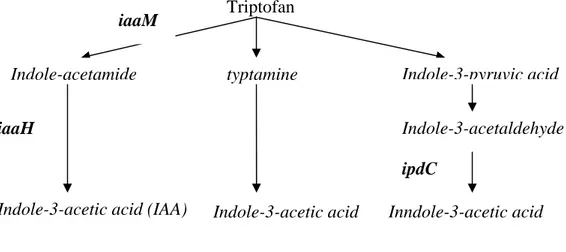
Triptofan
Indole-acetamide typtamine Indole-3-pyruvic acid
Indole-3-acetic acid (IAA) Indole-3-acetic acid
Indole-3-acetaldehyde
Inndole-3-acetic acid
Gambar 1 Diagram alir lintasan biosintesis IAA pada Bakteri (Hartman et al. 1983; Brandl et al. 1996; Manulis et al. 1980). Gen-gen iaaM, iaaH dan ipdC masing-masing menyandikan tryptohan-2-monooygenase, indole-3-acetamide hydrolase dan indole-pyruvat decarboxylase.
iaaM
iaaH
ipdC
Fosfat merupakan salah satu unsur hara yang sangat diperlukan oleh tanaman. Di dalam tanah hanya sebagian kecil saja fosfat yang dapat diserap oleh tanaman karena masih terikat dengan kation logam misalnya Fe, Ca dan Al. Adanya kemampuan bakteri dalam melarutkan fosfat berpotensi untuk meningkatkan penyerapan unsur fosfat ke dalam tanaman apabila tersedia cukup endapan fosfat dalam tanah. Bakteri pelarut fosfat dapat menyediakan fosfat terikat menjadi fosfat yang dapat terlarut sehingga dapat diserap oleh tanaman. Mekanisme utama pelarutan fosfat pada bakteri dengan memisahkan kation dari senyawa asam menggunakan asam organik yang disintesisnya (Altomare et al.
1999). Bakteri pelarut fosfat melepaskan ikatan ion fosfat anorganik yang sukar larut dengan mensekresikan sejumlah asam organik. Beberapa bakteri yang dilaporkan mempunyai aktifitas fitase (enzim kelompok fosfomonoesterase) yang mampu menghidrolisis polifosfat organik tak larut (fitat) menjadi rangkaian ester fosfat dengan bobot molekul yang rendah dari myo-inositol dan fosfat yang penting untuk prokariot dan eukariot. Bakteri yang mempunyai kemampuan melarutkan fosfat antara lain Bacillus amyloliquefaciens, B. subtilis, Klebsiella terrigena, Pseudomonas spp. dan Enterobacter sp. (Idriss et al. 2002).
8
Siderofor merupakan molekul atau ligan pengkelat besi (Fe3+ ) yang diproduksi oleh bakteri terutama pada tanah netral dan alkalin yang banyak diteliti saat ini. Siderofor disekresikan oleh mikroorganisme dan tanaman dari famili Gramineae sebagai respons terhadap defisiensi unsur besi (Crowley 2001, diacu dalam Nawangsih 2006). Jenis agen pengkelat besi, siderofor, yang dihasilkan oleh mikroorganisme antara lain berupa hydroxamate dan enterobactin (pada E. coli). Hidroxamate mengikat besi ferric (Fe3+) yang direduksi dan dilepaskan ke dalam sel bakteri sebagai besi ferro (Fe2+) (Madigan 2003). Menurut Nawangsih (2006) hasil deteksi pada beberapa galur Pseudomonas fluorescens, Bacillus subtilis, dan B. cereus positif menghasilkan senyawa siderofor. Adanya siderofor pada bakteri ini mendukung kemampuan bakteri sebagai PGPR karena dapat bertindak dalam kompetisi dengan mikroorganisme patogen dalam menggunakan Fe3+ yang konsentrasinya sangat terbatas dalam tanah. Namun pengambilan Fe3+ oleh mikroorganisme ini tidak mempengaruhi kebutuhan tanaman akan besi yang sangat sedikit dibandingkan dengan mikroorganisme
Kemampuan Bacillus sp. sebagai pengendali penyakit tanaman antara lain karena kemampuannya memproduksi antibiotik yang diekskresikan saat kultur memasuki fase stasioner (Madigan et al. 2000) dan produksi metabolit sekunder misalnya enzim kitinase, mycobacilin, basitrasin dan zwittermicin. Menurut Benhamou et al. (1996) bakteri endofit Bacillus pumilus strain SE34 dapat digunakan untuk menginduksi ketahanan secara sistemik pada buncis (Pisum sativum). Bakteri ini dapat merangsang penebalan dinding sel terutama pada jaringan korteks dengan produksi kitin sehingga patogen tidak dapat melakukan penetrasi. Patogen hanya terdistribusi pada jaringan epidermis dan tidak dapat menyebar ke jaringan korteks. Bacillus subtilis diketahui menunjukkan aktifitas antagonis terhadap bakteri dan fungi fitopatogen. Sedangkan Bacillus cereus
diketahui dapat mereduksi pertumbuhan miselia Sclerotium rolfsii., Fusarium oxysporum, Pythium aphanidermatum, Helminthosporium maydis dan Rhizoctonia solani dengan zona inhibisi 35.3% - 53.3 % (Muhammad & Amusa 2003).
9
Kemampuan Bacillus sebagai biokontrol juga dapat terjadi melalui mekanisme resistensi terinduksi oleh B. subtilis pada tanaman yang diserang cendawan A. niger (Sailaja et al. 1997).
Fungi Patogen Akar Kedelai
Penyakit-penyakit pada tumbuhan baik pada bagian akar, batang, daun dan bunga ataupun biji sebagian besar disebabkan oleh fungi. Fungi masuk ke dalam jaringan tanaman melalui struktur terbuka yang alami pada jaringan tanaman misalnya stomata lentisel, dan hidatoda atau melalui jaringan tanaman yang terluka. Beberapa fungi mengkolonisasi tanaman kedelai dan benih secara asimtom. Beberapa fungi yang dikenal menyerang akar tanaman kedelai antara lain Rhizoctonia solani penyebab penyakit busuk akar dan rebah kecambah (damping off) serta Sclerotium rolfsii penyebab penyakit busuk akar dan batang (Hartman et al. 2001) dan damping off pada benih (Agrios 2004). Kedua fungi ini menyebabkan penyakit yang cukup serius baik pada akar, batang dan bagian-bagian tanaman lainnya.
Rhizoctonia solani merupakan fungi saprofit yang dapat bertahan walau tidak berada pada tanaman inang. R. solani memiliki sel multinukleat yang hifanya berwarna coklat dan mampu membentuk sklerotia berwarna coklat hingga hitam. Fungi ini menginfeksi pada saat penanaman benih dan menginfasi hipokotil selanjutnya menyebabkan damping off atau jika tidak akan menyebabkan busuk akar. Semua Rhizoctonia terdapat sebagai miselium steril dan kadang-kadang sebagai sklerotia kecil tanpa diferensiasi jaringan internal (Agrios 2004). Penggunaan Bacillus megaterium diketahui dapat menurunkan tingkat penyakit yang disebabkan fungi ini (Hartman et al. 2001).
Tanaman kedelai sangat rentan terhadap serangan S. rolfsii yang menyerang tanaman sejak pembenihan. S. rolfsii memiliki hifa hialin berseptat, tidak memproduksi spora aseksual, dan mampu membentuk struktur pertahanan berupa sklerotia sperikel. Massa miselium yang menyerang jaringan memproduksi sekret berupa asam oksalat, pektinolitik, selulolitik dan enzim-enzim yang dapat membunuh dan mengurai jaringan tanaman sebelum penetrasi (Agrios 2004).
10
Gen 16S rRNA
RNA di dalam sel dapat dikelompokkan menjadi 2 kelompok yaitu kelompok RNA yang berhubungan dengan ekspresi gen yaitu mRNA, tRNA dan kelompok rRNA yang tidak berhubungan dengan ekspresi gen. Ribosomal RNA merupakan salah satu makromolekul yang menarik karena molekul ini bersifat stabil, terdapat sekitar 83% dari keseluruhan RNA dalam sel dan merupakan kerangka ribosom yang sangat berperan dalam mekanisme translasi. Semua rRNA identik secara fungsional yakni terlibat dalam produksi protein, walaupun demikian sekuen-sekuen di bagian tertentu terus berevolusi dan mengalami perubahan pada level struktur primer sambil mempertahankan struktur sekunder dan tersier yang homolog (Gutell et al. 1994).
Kemampuannya mewakili semua informasi filogenetik dan kepraktisannya menyebabkan sekuen 16S rRNA lebih sesuai digunakan untuk identifikasi bakteri daripada menggunakan 5S rRNA atau 23S rRNA. Menurut Bottger (1996) aplikasi molekuler untuk menganalisis keragaman mikrob melalui analisis gen 16S rRNA sesuai untuk mengidentifikasi mikroorganisme karena gen ini terdapat pada semua organisme prokariot. Molekul 16S rRNA memiliki daerah-daerah berbeda berupa sekuen yang konservatif dan sekuen lain yang sangat variatif. Terdapat lebih dari 4000 entri (sekuen yang terdaftar ) yang ada pada database 16S rRNA yang mencakup sekitar 1800 species yang terus bertambah jumlahnya. Strategi yang sering digunakan untuk melihat keragaman mikrob meliputi tahap-tahap isolasi DNA dari komunitas alami, amplifikasi gen 16S rRNA menggunakan PCR, penapisan klon-klon untuk variabilitas genetik, pemilihan klon unik untuk disekuen dan menentukan hubungan filogeniknya (Marchesi et al. 1998). Gen 16S rRNA bersifat relatif stabil dalam sel bakteri daripada rRNA yang biasanya didegradasi dan hanya terdapat pada fase-fase tertentu saja.
BAHAN DAN METODE
Isolasi dan Karakterisasi Fisiologi secara Parsial Bacillus sp.
Isolasi dilakukan dengan cara mengambil 0.5 gram sampel tanah yang diperoleh dari rizosfer kedelai asal Cirebon dimasukkan ke dalam 4.5 ml akuades steril yang sudah terlarut NaCl 0.85% di dalamnya. Sampel divortek dan dipanaskan pada suhu 80 oC selama 10 menit, selanjutnya dilakukan pengenceran secara berseri hingga pengenceran 10-6. Sebanyak 100 µl suspensi ditumbuhkan dalam media Nutrient Agar (NA) dengan metode cawan sebar dengan komposisi 8 g NB, 15 g agar-agar bacto dalam 1 liter akuades. Cawan selanjutnya diinkubasi selama 24 jam. Koloni yang tumbuh dimurnikan dengan menggunakan media yang sama. Selanjutnya koloni tunggal diamati karakter morfologinya dan digoreskan pada media agar miring NA sebagai biakan stok.
Karakterisasi fisiologi isolat untuk menapis isolat meliputi perwarnaan gram, pewarnaan endospora dan uji katalase mengikuti prosedur Bergey’s Manual of Determinative Bacteriology (Buchanan & Gibbon 1974) untuk menentukan isolat tersebut termasuk ke dalam kelompok Bacillus sp. Pewarnaan Gram menggunakan pereaksi ungu kristal, iodium, etanol 95% dan safranin sebagai pewarna tandingan. Pewarnaan endospora menggunakan pereaksi malakit hijau dan safranin. Pengamatan meliputi bentuk sel dan warna sel menggunakan mikroskop cahaya perbesaran 1000 kali. Uji katalase dilakukan dengan menggunakan pereaksi hidrogen peroksida 3%.
Uji Karakteristik Bacillus sp. sebagai PGPR
Uji Produksi Indole Acetic Acid (IAA). Produksi IAA dilakukan dengan menggunakan metode standar sesuai metode yang dilakukan oleh Dey et al. (2004). Satu lup penuh isolat Bacillus sp. yang dikulturkan pada 10 ml media
Nutrient Broth (NB) yang ditambahkan L-triptofan 0.2 mM diinkubasikan dan dikocok dengan kecepatan 150 rpm pada suhu ruang selama 24 jam dalam ruang gelap. IAA yang diproduksi oleh Bacillus diuji dengan metode kolorimetri dengan menggunakan reagen Salkowski (Patten & Glick 2002) yang mengandung 150 ml H2SO4 pekat, 250 ml Aquades, 7.5 ml FeCl3.6 H2O 0.5 M. Sebanyak 3 ml kultur
12
dari tiap perlakuan dimasukkan ke dalam 2 tabung ependorf kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit. Sebanyak 2 ml filtrat yang diperoleh dimasukkan ke dalam tabung reaksi steril dan ditambahkan 2 ml reagen Salkowski (perbandingan filtrat: reagen = 1:1). Suspensi kemudian diinkubasikan selama 60 menit pada suhu ruang di dalam ruang gelap. Selanjutnya dilakukan pengukuran serapan IAAnya dengan menggunakan spektrofotometer (Spectronic 20) pada panjang gelombang 510 nm.
Uji Pelarutan Fosfat. Uji ini dilakukan dengan menggunakan metode standar yaitu menggunakan media Pikovskaya (Subba Rao & Shinha 1962; Subba Rao 1999), dengan komposisi glukosa 10 g, Ca3HPO4 5 g, (NH4)2SO4 0.5 g, KCL 0.2 g, MgSO4.7H2O 0.1 g, ekstrak khamir 0.5 g, MnSO4 25 mgdanFeSO4 25 mg, serta agar-agar Bacto 20 g dalam 1l akuades. Suspensi isolat bakteri berumur 24 jam ditumbuhkan pada media Phikovkaya yang mengandung trikalsium fosfat (Ca3PO4) dengan metode sebar, zona bening yang dihasilkan di sekitar koloni setelah diinkubasi selama 3 hari menunjukkan adanya aktivitas bakteri dalam melarutkan fosfat.
Uji Produksi Siderofor. Produksi siderofor oleh isolat Bacillus sp. diuji menggunakan media Chrome Azurol Sulfonat (CAS) agar dengan modifikasi larutan garam (Husen 2003). Larutan 1 (larutan indikator Fe-CAS) mengandung 10 ml (1mM FeCl3.6H2O didalam 10 mM HCL), 50 ml larutan CAS (1.21 mg ml -1
), dan 40 ml larutan hexadecyl-trimetylammonium bromide (HDTMA) (1.82 mg ml-1). Larutan 2 merupakan larutan buffer, disiapkan dengan melarutkan 30.24 g PIPES (peperazine-N,N’-bis[2-ethanesulfonic acid]) kedalam 750 ml larutan garam (3 gr KH2PO4, 5 g NaCl, 10 g NH4Cl, 20 mM MgSO4, 1 mM CaCl2). Akuades ditambahkan untuk mencapai volume larutan 800 ml sebelum diukur pH nya hingga 6.8 dengan 50% KOH, kemudian 20 g agar-agar bacto ditambahkan sebelum diautoklaf. Larutan 3 mengandung 2 g glukosa, 2 g manitol dan mikro elemen ( 493 mg MgSO4.7H2O, 11 mg CaCl2, 1.17 mg MnSO4.H2O, 1.4 mg H3BO3, 0.04 mg CuSO4.5H2O, 1.2 mg ZnSO4.7H2O dan 1.0 mg NaMoO4.2H2O) didalam 70 ml akuades. Larutan 4 berupa 30 ml 10% (w/v) cassamino acid yang difilter dengan membran milipor 0.45 µm. Media ini dibuat dengan mencampurkan larutan 2 dan 4 pada suhu 50 οC setelah sterilisasi, kemudian
13
ditambahkan larutan 3 dan larutan 1 secara perlahan-lahan dan dilakukan homogenisasi dengan menggunakan stirer. Isolat yang telah diremajakan terlebih dahulu, diuji menggunakan metode replika dengan cara ditotol atau digores pada media agar CAS dengan dua ulangan. Isolat yang mampu memproduksi siderofor akan menghasilkan zona berwarna oranye disekitar koloni setelah diinkubasi semalam.
Uji Hipersensitivitas. Isolat berumur 24 jam dikulturkan pada media NB cair dan dikocok dengan kecepatan 150 rpm selama 24 jam pada suhu ruang. Isolat tersebut disuntikkan menggunakan syringe sebanyak 1 ml (diperkirakan >
106 CFU/ml) pada area intervena ruas daun tembakau (Lelliot & Stead 1987) dengan masing-masing isolat 3 ulangan. Kontrol perlakuan pada uji ini menggunakan E. coli dan akuades sebagai kontrol negatif serta Ralstonia solanacearum sebagai kontrol positif. Pengamatan dilakukan setelah 24 jam hingga 48 jam untuk mengetahui perubahan warna dan kondisi daun tembakau setelah disuntikkan dengan isolat. Adanya bercak nekrosis kecoklatan dan kekeringan pada jaringan daun menunjukkan adanya reaksi hipersensitif positif.
Telaah Pemacuan Pertumbuhan Tanaman. Inokulan dari isolat yang akan diuji disiapkan dengan meresuspensikan sel berumur 24 jam dari cawan agar-agar tersebut ke dalam NB. Sebanyak 9 kecambah steril yang berumur 24 jam diletakkan di atas media agar-agar 1%. Masing-masing kecambah diinokulasikan dengan 100 μl suspensi bakteri dengan konsentrasi sel kira-kira 1010 sel/ml. Masing-masing perlakuan dilakukan sebanyak 3 kali ulangan dan 1 perlakuan kontrol. Pada perlakuan kontrol masing-masing kecambah ditambahkan NB saja. Setelah 7 hari perlakuan, diamati dan diukur pertumbuhannya yang meliputi panjang batang, panjang akar utama dan jumlah akar lateral dan sublateral kemudian dibandingkan dengan kontrol (Dey at al. 2004). Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) dan diuji lanjut dengan uji Duncan pada taraf kesalahan 5% menggunakan software
SAS.
Uji Antagonisme terhadap Fungi Patogen Akar. Uji antagonis dilakukan secara kualitatif dan kuantitatif dengan menggunakan metode standar kultur ganda. Isolat Bacillus sp. digores pada medium Potato Dextros Agar (PDA)
14
dalam cawan petri berdiameter 9 cm, berjarak 3 cm dari kultur cendawan
Sclerotium rolsfii dan Rhizoctonia solani yang ditumbuhkan di tengah-tengah cawan petri. Kultur dan biakan cendawan diinkubasikan selama 5 hari untuk S. rolfsii dan 2 hari untuk R. solani dan diamati pertumbuhannya. Adanya interaksi antagonis ditandai dengan terbentuknya zona penghambatan antara isolat Bacillus
sp. dengan cendawan. Uji kuantitatif dilakukan dengan metode oposisi langsung untuk mengetahui besarnya persentase penghambatan pertumbuhan radial cendawan oleh bakteri. Besarnya persentase penghambatan dihitung menggunakan rumus 1-(a/b) x 100%, dimana a menunjukan jarak antara titik pusat cendawan ke arah isolat Bacillus sp., b menunjukkan jarak antara titik pusat cendawan ke daerah kosong tanpa isolat Bacillus sp. (Dikin et al. 2006). Selanjutnya penentuan kategori kemampuan antagonisme terhadap R. solani dan
S. rolsfii dikelompokkan menjadi empat kategori berdasarkan besar persentase zona penghambatan yaitu kuat (> 40%) dengan simbol +++; sedang (40%≤x≥30%) dengan simbol ++; lemah (<30%) dengan simbol + dan tidak memiliki kemampuan antagonisme (0%) dengan simbol -.
Identifikasi Berdasarkan Sekuen Gen 16S rRNA
Isolasi DNA. Isolasi DNA terhadap 6 isolat terseleksi mengikuti metode seperti yang dipaparkan oleh Sambrook et al. (1989). Isolat bakteri berumur 24 jam dikulturkan pada media cair NB selama 24 jam. Sebanyak 1,5 – 3 μl kultur disentrifugasi pada kecepatan 12.000 rpm selama 4 menit dan peletnya disuspensikan dalam 1 ml buffer STE dan diresuspensi dengan buffer STE dilakukan berulang 3 kali. Supernatan ditambahkan 8 μl lisozim dan diinkubasikan selama 60 menit pada suhu ruang. Selanjutnya ditambahkan 200 μl buffer STE dan 40 μl SDS 10% dan digoyang-goyang perlahan selanjutnya diinkubasikan 30 menit pada suhu 65 0C. Setelah dingin (suhu ruang) ditambahkan 4μl prot-K (10mg/ml) dan diinkubasikan selama lebih dari 3 – 4 jam pada suhu 370 C. Suspensi yang telah diinkubasi ditambahkan 200 - 400 μl buffer STE dan ditambahkan larutan P:C (perbandingan 3:5) sebanyak 250 μl disentrifugasi 12.000 rpm selama 10 menit. Langkah ini dilakukan sebanyak 4 – 5 kali. Pelet ditambahkan 200 μl kloroform dan disentrifugasi 12.000 rpm selama
15
10 menit. Langkah ini diulangi 2 kali. Supernatan yang terbentuk ditambahkan 1 ml EtOH 95% dan 50 μl NaOAc 3M digoyang-goyang perlahan dan diinkubasikan semalam. Selanjutnya disentrifugasi 12.000 rpm selama 10 menit, dibuang supernatannya dan dikeringkan pada suhu ruang. Pelet yang kering dilarutkan dalam 20 μl ddH2O dan diinkubasikan pada suhu 65 0C selama 10 menit selanjutnya DNA hasil isolasi disimpan pada suhu 4 0C.
Amplifikasi DNA. Amplifikasi terhadap DNA hasil isolasi menggunakan mesin PCR dengan primer 63f ( 5’-CAG GCC TAA CAC ATG CAA GTC – 3’) dan 1387r (5’- GGG CGG WTG GTA CAA GGC-3’) (Marchesi et al. 1998) dengan total volume reaksi 50 μl. Sebanyak 50 μl volume reaksi dalam ependorf yang mengandung 0.25 μl Taq polimerase, 12.5 μl buffer GC, 4 μl dNTP, 5 μl DNA template, 1 μl primer forward, 1 μl primer reverse dan 1.25 μl ddH2O steril dimasukkan ke dalam perangkat PCR. Amplifikasi dilakukan selama 45 menit dengan 30 siklus dengan pengaturan kondisi denaturasi awal dengan suhu 94 oC selama 2 menit dilanjutkan siklus amplifikasi yang terdiri atas denaturasi dengan suhu 92 oC selama 30 detik, annealing dengan suhu 55 oC selama 30 detik, ekstensi dengan suhu 75 oC selama 1 menit dan ekstensi akhir dengan suhu 75 oC selama 5 menit. Hasil PCR dicek pada gel elektroforesis selama 45 menit yang diwarnai dengan EtBr menggunakan UV Transluminator (Hoefer Scientific Instrumens, San Fransisco).
Analisis Sekuen Gen 16S rRNA. DNA murni hasil amplifikasi dengan mesin PCR dipurifikasi dan selanjutnya disekuen menggunakan mesin DNA
sequencer ABI 310 menggunakan jasa PT Charoen Pokphand. Hasil sekuen dicek urutan basa nukleotidanya menggunakan program BioEdit kemudian diolah menggunakan program Basic Local Alligment Search Tool – Nucleotide (BLAST-N) melalui situs layanan National Centre for Biotechnology Information (NCBI). Hal ini bertujuan mengetahui tingkat homologi isolat dengan Bacillus spp. dari data GenBank. Sekuen diurutkan menggunakan program ClustalX, selanjutnya melalui DNADIST diperoleh matriks jarak untuk menyusun pohon filogenetik menggunakan program Neighbour Joining Plot (NJPlot).
HASIL
Isolasi dan Karakterisasi Fisiologi secara Parsial Bacillus sp.
Rizobakteria diisolasi dari rizosfer tanaman kedelai asal Plumbon, Cirebon, Jawa Barat dan dikarakterisasi secara fisiologi untuk menapis isolat yang memiliki karakter Bacillus. Sebanyak 60 isolat Bacillus sp. telah berhasil diisolasi dan dikarakterisasi sifat-sifat fisiologi secara parsial untuk genus Bacillus mengikuti metode standar Bergey’s Manual of Determinative Bacteriology
(Buchanan & Gibbon 1974).
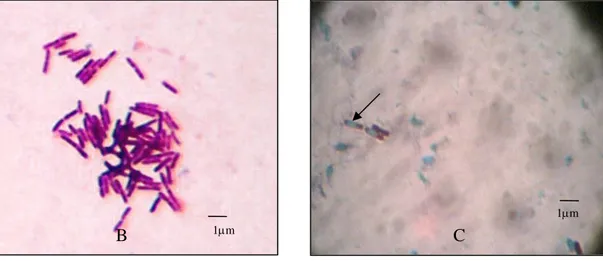
Koloni isolat - isolat Bacillus sp. bervariasi dalam bentuk, tepian, elevasi maupun warna koloni. Penampilan koloni isolat Bacillus sp. Cr 66 berumur 24 jam yang ditumbuhkan pada media cawan gores Nutrien agar ditunjukkan pada Gambar 1A. Karakteristik fisiologi parsial yang dimiliki isolat – isolat ini meliputi Gram positif, bentuk sel batang dengan ukuran dan penataan yang berbeda-beda (Gambar 1B), mampu membentuk endospora (Gambar 1C), serta bersifat katalase positif.
Karakter Bacillus sp. sebagai PGPR
Produksi Indole Acetic Acid (IAA). Isolat yang akan digunakan untuk uji produksi IAA ditumbuhkan pada media cair NB yang ditambahkan L-Trp. Produksi IAA isolat Bacillus sp. ditunjukkan oleh adanya perubahan warna supernatan yang ditambah dengan reagen Salkowski dan diinkubasikan selama satu jam pada suhu ruang dalam kondisi gelap. Perubahan warna terjadi dari warna kuning menjadi warna merah muda hingga merah ungu jernih. Sebanyak 45 isolat Bacillus sp. memiliki kemampuan mensintesis IAA dengan konsentrasi yang bervariasi antara 0.06 ppm sampai dengan 44.66 ppm (Tabel 1). Sebanyak 32 isolat Bacillus sp. (71%) memproduksi IAA dengan konsentrasi kurang dari 10 ppm; sebanyak 8 isolat Bacillus sp. (18%) memproduksi IAA pada kisaran konsentrasi antara 10 ppm hingga 20 ppm. Sedangkan 5 isolat Bacillus sp. (11%) mampu memproduksi IAA lebih dari 20 ppm. Isolat Bacillus sp. Cr 55 diketahui mensintesis IAA dengan konsentrasi tertinggi yaitu 44.66 ppm sedangkan isolat
17
A
1μm 1μm
B C
Gambar 1 Penampilan koloni isolat Bacillus sp. Cr 66 berumur 24 jam yang ditumbuhkan pada media cawan gores Nutrien agar (A); (B) penampilan sel Bacillus sp. yang dilakukan pewarnaan Gram menunjukkan Gram positif berbentuk batang; (C) struktur endospora ditunjukkan dengan tanda anak panah diamati menggunakan mikroskop cahaya perbesaran 1000 kali.
18
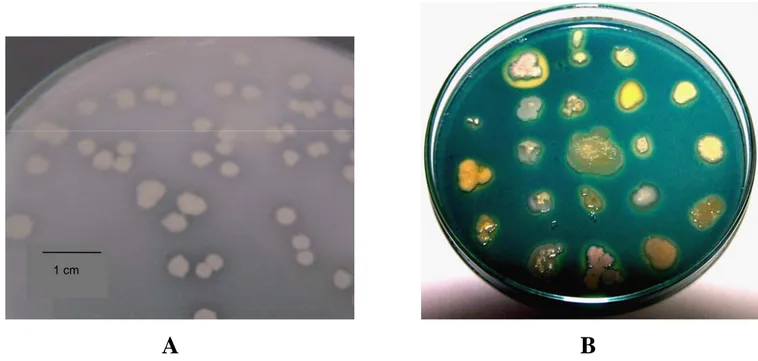
Uji Pelarutan Fosfat. Isolat yang berumur 24 jam ditumbuhkan dengan metode sebar pada media Phikovskaya yang mengandung trikalsium fosfat (Ca3PO4). Kemampuan melarutkan fosfat ditandai dengan terbentuknya zona bening di sekeliling koloni bakteri (Gambar 2A). Kemampuan isolat dalam melarutkan fosfat yang terkandung pada media ditandai oleh luas zona bening yang terbentuk di sekeliling koloni bakteri yang berbeda-beda. Dari 45 isolat yang diuji sebanyak 36 isolat Bacillus sp. (80%) mampu melarutkan fosfat yang terkandung dalam media Phikovskaya. (Tabel 1).
Uji Produksi Siderofor. Isolat yang telah diremajakan ditumbuhkan pada media agar-agar Chrome Azurol Sulfonat (CAS) yang mengandung FeCl3.6H2O, dan indikator CAS yang berwarna hijau kebiruan untuk mencari isolat yang mempunyai kemampuan mensekresi siderofor. Selanjutnya isolat diinkubasikan semalam pada suhu ruang. Isolat positif memproduksi siderofor ditandai dengan adanya zona berwarna kuning oranye jernih di sekitar koloni bakteri. Sebanyak 43 isolat Bacillus sp. (96%) mampu mengkelat besi dalam media CAS agar (Tabel 1). Kemampuan isolat dalam memproduksi senyawa pengkelat besi / siderofor berbeda-beda. Hal ini dapat dilihat dari luas zona di sekitar koloni bakteri yang mengalami perubahan warna menjadi oranye seperti diperlihatkan pada Gambar 2B. Kepekatan warna dan luas zona oranye yang terbentuk menunjukkan adanya perbedaan afinitas isolat dalam mengkelat besi.
Uji Hipersensitivitas. Uji ini dilakukan untuk mencari isolat yang tidak memberikan respons hipersensitif atau hipersensitif negatif pada tanaman yang bukan inangnya. Daun yang disuntikkan dengan isolat bersifat hipersensitif positif jika menunjukkan gejala kematian sel, kekeringan dan nekrosis pada area daun yang disuntikkan dengan isolat. Dari 45 isolat yang memproduksi IAA yang diuji seluruh isolat diketahui tidak memberikan reaksi hipersensitif pada daun tanaman yang disuntikkan dengan isolat sehingga tidak bersifat patogen terhadap tanaman.
19
1 cm
Gambar 2 Isolat Bacillus sp. Cr 90 yang ditumbuhkan pada media Phikovskaya dan diinkubasikan selama 3 hari pada suhu ruang mempunyai kemampuan melarutkan fosfat yang ditandai dengan terbentuknya zona bening di sekeliling koloni bakteri (A); (B) penampilan koloni Bacillus sp. yang ditumbuhkan pada media agar-agar CAS dengan metode replika dan diinkubasikan semalam menampilkan zona berwarna oranye jernih di sekeliling koloni bakteri yang menunjukkan dihasilkannya siderofor.
20
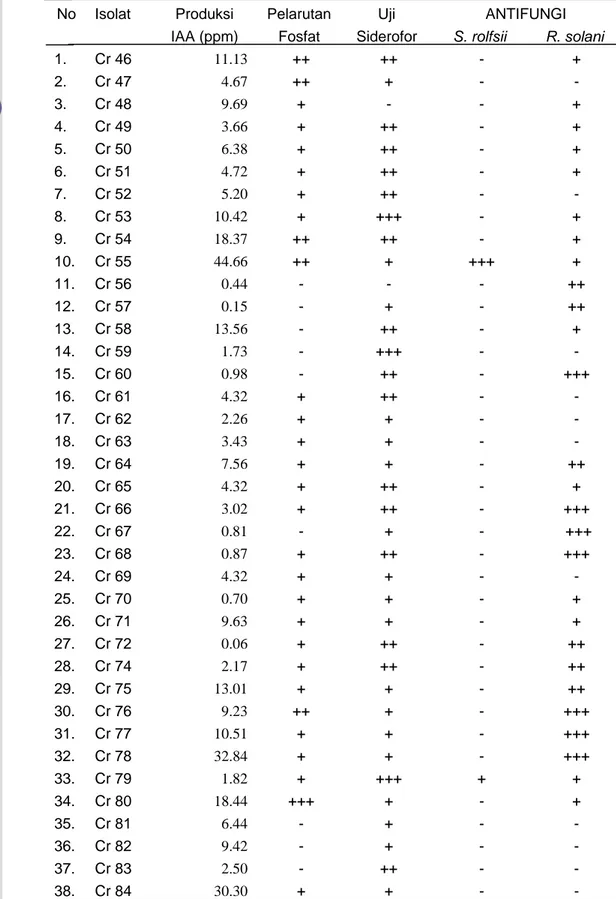
Tabel 1 Hasil uji produksi IAA, uji pelarutan fosfat, uji siderofor, dan uji antagonisme terhadap cendawan S. rolfsii dan R. solani pada 45 isolat
Bacillus sp. yang mampu memproduksi IAA
No Isolat Produksi Pelarutan Uji ANTIFUNGI
IAA (ppm) Fosfat Siderofor S. rolfsii R. solani
1. Cr 46 11.13 ++ ++ - + 2. Cr 47 4.67 ++ + - - 3. Cr 48 9.69 + - - + 4. Cr 49 3.66 + ++ - + 5. Cr 50 6.38 + ++ - + 6. Cr 51 4.72 + ++ - + 7. Cr 52 5.20 + ++ - - 8. Cr 53 10.42 + +++ - + 9. Cr 54 18.37 ++ ++ - + 10. Cr 55 44.66 ++ + +++ + 11. Cr 56 0.44 - - - ++ 12. Cr 57 0.15 - + - ++ 13. Cr 58 13.56 - ++ - + 14. Cr 59 1.73 - +++ - - 15. Cr 60 0.98 - ++ - +++ 16. Cr 61 4.32 + ++ - - 17. Cr 62 2.26 + + - - 18. Cr 63 3.43 + + - - 19. Cr 64 7.56 + + - ++ 20. Cr 65 4.32 + ++ - + 21. Cr 66 3.02 + ++ - +++ 22. Cr 67 0.81 - + - +++ 23. Cr 68 0.87 + ++ - +++ 24. Cr 69 4.32 + + - - 25. Cr 70 0.70 + + - + 26. Cr 71 9.63 + + - + 27. Cr 72 0.06 + ++ - ++ 28. Cr 74 2.17 + ++ - ++ 29. Cr 75 13.01 + + - ++ 30. Cr 76 9.23 ++ + - +++ 31. Cr 77 10.51 + + - +++ 32. Cr 78 32.84 + + - +++ 33. Cr 79 1.82 + +++ + + 34. Cr 80 18.44 +++ + - + 35. Cr 81 6.44 - + - - 36. Cr 82 9.42 - + - - 37. Cr 83 2.50 - ++ - - 38. Cr 84 30.30 + + - -
21
Isolat Cr 67, Cr 68, Cr 69, dan Cr 71 berhasil memacu peningkatan panjang akar primer; isolat Cr 64, Cr 66, Cr 67, Cr 68, dan Cr 71 mampu memacu peningkatan panjang batang; isolat Cr 69 dan Cr 71 mampu memacu pembentukan akar lateral dan sublateral (Tabel 2). Pada telaah ini pengaruh inokulasi dengan isolat Cr 77, Cr 82, Cr 83, Cr 87, Cr 89, Cr 90, dan Cr 91 menyebabkan pertumbuhan panjang akar kecambah lebih pendek daripada kontrol. Sedangkan panjang batang kecambah juga lebih pendek pada kecambah yang diinokulasikan dengan isolat Cr 77 dan Cr 78. Jumlah akar lateral dan sub lateral lebih sedikit daripada kontrol setelah diberi perlakuan dengan isolat Cr 77, Cr 78, Cr 81, Cr 82, Cr 83, Cr 87, Cr 89, Cr 90, dan Cr 91.
No Isolat P Pelarutan Uji ANTIFUNGI
IAA (ppm) Pospat Siderofor S. rolfsii R. solani
39. Cr 85 1.43 +++ + - - 40. Cr 86 12.82 + + - - 41. Cr 87 3.34 ++ ++ - - 42. Cr 88 6.37 + + - - 43. Cr 89 0.24 + + - - 44. Cr 90 22.79 ++ + - ++ 45. Cr 91 20.32 +++ ++ - -
Keterangan: 1. Tanda / simbol +++, ++ dan +, berturut - turut menunjukkan kuat / tinggi, sedang dan lemah/rendah. Pada uji antagonis fungi patogen akar penentuan kategori berdasarkan
besar persentase zona penghambatan : kuat (> 40%) dengan simbol +++; sedang (40%≤x≥30%)
dengan simbol ++; lemah (<30%) simbol +; dan tidak bersifat antagonis (0%) dengan simbol -.
Telaah Pemacuan Pertumbuhan Tanaman. Empat puluh lima isolat
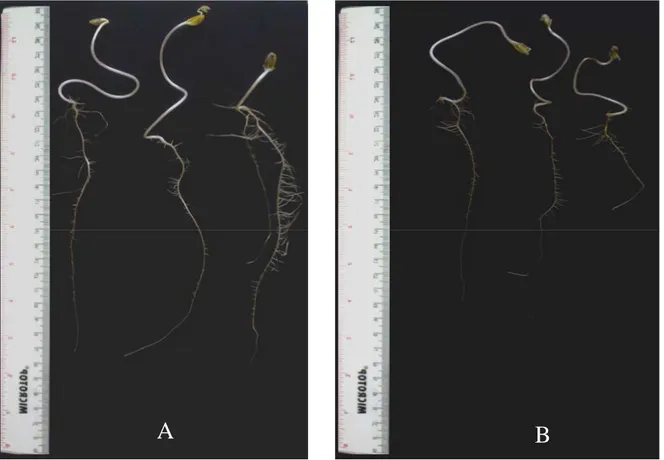
Bacillus sp. yang diketahui mensintesis IAA dan tidak memberikan reaksi hipersensitif pada tanaman, diuji kemampuannya dalam pemacuan pertumbuhan tanaman menggunakan kecambah biji kedelai kultivar Slamet yang dibandingkan dengan kontrol. Sebanyak 6 isolat (13.2%) memiliki kemampuan dalam pemacuan pertumbuhan tanaman meliputi peningkatan panjang akar primer, panjang batang, dan jumlah akar lateral dan sub lateral jika dibandingkan dengan kontrol (kecambah kedelai yang tidak diinokulasi dengan bakteri) (Tabel 2). Kecambah tanaman kedelai yang diinokulasi dengan Bacillus sp. Cr 69 secara signifikan memacu peningkatan panjang akar dan pertumbuhan jumlah akar lateral dibandingkan dengan kontrol (Gambar 3).
22
Gambar 3 Panjang akar dan jumlah akar kecambah kedelai kultivar Slamet berumur 7 hari pada media agar-agar 1%; (A) kecambah diinokulasi dengan Bacillus sp Cr 69; (B) kontrol.
B
A
23
Tabel 2 Rerata panjang akar, panjang batang dan jumlah akar lateral dan sub lateral pada kecambah kedelai kultivar Slamet yang diberi perlakuan dengan isolat Bacillus sp. dan diinkubasikan selama 7 hari pada media agar-agar 1% beserta kontrol
Rerata No Isolat
Panjang akar (cm Panjang batang (cm) Jumlah akar
1. Kontrol 12.68a 9.84ab 59.82a
2. Cr-80 11.95a 7.96ab 40.58a
3. Cr-85 8.01a 7.15b 35.11a
4. Kontrol 9.15a 9.31ab 45.70b
5. Cr-55 13.96a 10.76ab 65.04ab
6. Kontrol 13.54a 9.45a 73.13a
7. Cr-84 16.77a 10.75a 75.96a
8. Cr-88 14.61a 10.92a 60.88ab
9. Kontrol 20.69a 20.69a 88.13a
10. Cr-81 16.35ab 10.44a 64.95b
11. Kontrol 15.63a 11.45a 50.04b
12. Cr-46 14.66a 10.89a 51.74ab
13. Kontrol 12.82a 10.47a 41.52a
14. Cr-47 11.85a 10.01a 36.15a
15. Cr-48 12.46a 10.50a 47.37a
16. Cr-49 11.83a 9.80a 41.33a
17. Cr-50 12.25a 11.06a 46.33a
18. Cr-51 11.96a 10.45a 35.15a
19. Kontrol 11.53a 10.40ab 39.26a
20. Cr-52 11.69a 10.18ab 42.52a
21. Cr-53 11.43a 11.32ab 42.22a
22. Cr-54 8.72a 9.39b 39.74a
23. Cr-56 11.79a 10.18ab 42.48a
24. Cr-57 11.02a 9.25b 38.70a
25. Cr-58 11.30a 14.16a 40.96a
26. Kontrol 12.25ab 11.00a 61.80a
27. Cr-59 14.99a 12.39a 76.96a
28. Cr-60 12.28ab 11.16a 67.25a
29. Cr-62 10.14b 10.56a 51.96a
30. Cr-63 10.05b 9.16a 46.79a
31. Kontrol 13.06a 10.41a 66.18a
32. Cr-76 12.92a 11.63a 54.67ab
33. Cr-77 6.86b 6.71b 32.89b
34. Kontrol 10.02b 7.12b 53.19b 35. Cr-69 14.51a* 9.57ab 78.81a*
36. Cr-68 16.22a* 10.89a* 68.24ab 37. Cr-67 15.55a* 11.50a* 65.00ab 38. Cr-66 13.34ab 10.06a* 62.43ab
39. Kontrol 15.24a 10.88a 58.52a
40. Cr-75 14.53a 12.11a 54.76a
41. Cr-79 16.20a 11.65a 72.81a
42. Cr-87 7. 81b 10.94a 9.52b
24
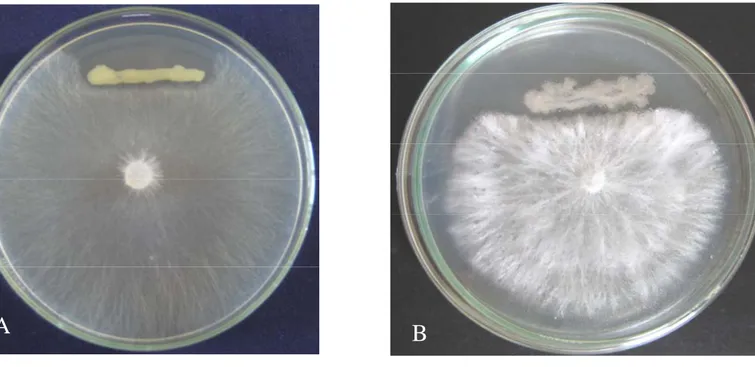
Uji Antagonisme terhadap Fungi Patogen Akar. Kemampuan isolat sebagai antagonis terhadap cendawan Rhizoctonia solani dan Sclerotium rolsfii ini diukur secara kualitatif dan kuantitatif. Pada uji ini pertumbuhan cendawan terhenti dan menebal saat mendekati isolat sehingga terbentuk area yang memisahkan antara cendawan dengan bakteri. Pada uji antagonis terhadap R. solani diperoleh 28 isolat Bacillus sp. (62.2%) mampu menghambat pertumbuhan cendawan R. solani pada media PDA. Sebanyak 7 isolat (15.6%) memiliki persentase penghambatan termasuk sebagai kategori kuat, 7 isolat (15.6%) termasuk kategori sedang, dan 14 isolat (31.1%) termasuk kategori lemah
(Tabel1). Sedangkan 2 isolat Bacillus sp. (4.4%) yaitu Cr 55 dan Cr 79 memiliki
kemampuan dalam menghambat cendawan S. rolsfii dengan kategori berturut-turut kuat dan lemah. Penampilan cendawan R. solani dan S. rolfsii yang dihambat pertumbuhan radialnya oleh isolat bakteri ditunjukkan pada Gambar 4A dan 4B.
Rerata No Isolat
Panjang akar (cm Panjang batang (cm) Jumlah akar
44. Kontrol 13.44b 10.70c 65.14b 45. Cr-64 14.68b 22.49ab* 73.53b
46. Cr-65 9.42b 8.73c 48.71b
47. Kontrol 13.02b 8.61b 52.24b
48. Cr-71 22.25a* 14.39ab 96.86a*
49. Cr-72 16.12ab 11.67ab 70.15ab
50. Cr-74 14.86b 11.80ab 78.95ab
51. Cr-70 14.13b 11.92ab 80.72ab
52. Kontrol 20.95a 9.40a 77.97a
53. Cr-83 11.00b 6.57ab 37.95b
54. Cr-89 13.31b 8.23a 43.88b
55. Cr-90 13.39b 6.71ab 40.14b
56. Cr-91 12.40 b 6.03ab 39.93b
57. Cr-82 10.66b 6.48ab 42.69b
58. Kontrol 12.47a 9.49a 51.82a
59 Cr-61 12.07a 6.52ab 43.85ab
60. Cr-86 9.80 a 6.57ab 32.59ab
Tabel 2 (Lanjutan)
*) signifikan memacu pertumbuhan kecambah dibandingkan dengan kontrol pada hasil pembandingan dengan uji Duncan pada taraf 95%
25
Gambar 4 Penampilan cendawan R. solani yang diinkubasikan selama 2 hari pada media PDA, pertumbuhannya dihambat oleh isolat Cr 64 (A); penampilan cendawan S. rolsfii yang diinkubasikan selama 5 hari pada media PDA, pertumbuhan radialnya dihambat oleh isolat Cr 55 (B).
B
A
26
2
2
Analisis Sekuen Gen 16S rRNA
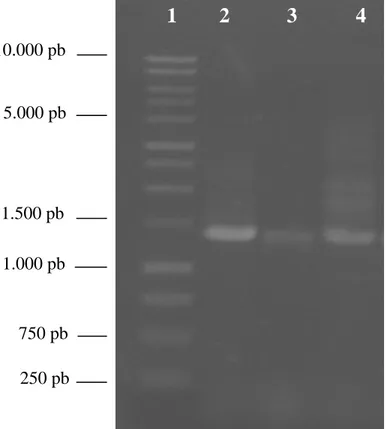
Enam isolat yang memiliki karakter unggul memacu pertumbuhan kecambah biji kedelai kultivar Slamet diisolasi DNA-nya dengan metode seperti dikemukakan oleh Sambrook et al. (1989). Dari hasil amplifikasi gen 16S rRNA dengan teknik PCR telah diperoleh fragmen DNA dengan panjang masing-masing ± 1300 pb (Gambar 5).
Hasil analisis sekuen parsial gen 16S rRNA dengan program BLAST-N menunjukkan bahwa Cr 64 memiliki persentase similaritas 92% dengan Bacillus
sp. NRS-800, Cr 66 memiliki persentase similaritas 94% dengan B. cereus
HNR10, Cr 67 memiliki persentase similaritas 94% dengan B. pumilus str M-1-9-1, Cr 68 memiliki persentase similaritas 93% dengan B. thuringiensis str FWAW, Cr 69 memiliki persentase similaritas 98% dengan B. cereus AD2, sedangkan Cr 71 memiliki persentase similaritas 99% dengan Bacillus shandongensis str SD. Setelah sekuen diurutkan menggunakan program ClustalX maka untuk mengetahui kedekatan kekerabatan isolat satu dengan isolat lainnya digunakan program Njplot. Selanjutnya tingkat kedekatan dan kekerabatan isolat-isolat tersebut dicantumkan pada dendogram seperti terlihat pada Gambar 6.
Keenam isolat membentuk 3 kelompok yang berbeda. Cr 64 memisah tersendiri, isolat Cr 66, Cr 68, dan Cr 69 membentuk kelompok sendiri yang terpisah dengan Cr 67 dan Cr 71. Masing-masing isolat memiliki jarak evolusi yang berbeda-beda dengan spesies Bacillus spp. yang ada pada GenBank. Keenam isolat memiliki diversitas cukup tinggi dengan masing - masing isolat memiliki kedekatan kekerabatan pada spesies yang berbeda-beda.
27
1
1
2
3
4
5
6
7
10.000 pb 5.000 pb 1.500 pb 1.300 pb 1.000 pb 750 pb 250 pbGambar 5 Elektroforesis gel Agarose 1% dari gen 16S rRNA hasil amplifikasi PCR sebanyak 30 siklus menggunakan primer 63f dan 1387r memiliki panjang basa nukleotida ± 1.3 kb; Ket: 1 = marker; 2 = Cr 71; 3 = Cr 69; 4 = Cr 64; 5 = Cr 66; 6 = Cr 67; 7 = Cr 68.
28
Gambar 6 Dendrogram pohon filogenetik yang mengindikasikan kekerabatan dari 6 isolat berdasarkan sekuen parsial gen 16S rRNA hasil amplifikasi PCR dengan isolat dari GenBank (angka di atas garis cabang menunjukkan panjang percabangan yang mengindikasikan jarak evolusi antar isolat).
PEMBAHASAN
Isolasi dan Karakterisasi Fisiologi Parsial Bacillus sp.
Bacillus merupakan kelompok bakteri yang banyak ditemukan pada habitat tanah. Kelompok bakteri ini diperkirakan terdapat sangat melimpah di tanah sehingga isolasi dilakukan dengan metode pengenceran secara berseri hingga 10-6. Isolasi Bacillus sp. sedikit berbeda dengan isolasi bakteri tanah lainnya di mana suspensi tanah dalam larutan garam 0.85% dipanaskan terlebih dahulu pada suhu 800C selama 10 menit. Hal ini bertujuan untuk menapis Bacillus sp. dari bakteri lain yang tidak membentuk endospora. Bakteri yang tidak membentuk endospora umumnya tidak mampu bertahan pada suhu yang relatif tinggi tersebut. Karakterisasi fisiologi parsial meliputi pewarnaan gram, pewarnaan endospora, dan uji katalase menunjukkan bahwa isolat yang diperoleh merupakan bakteri gram positif yang berbentuk batang, mampu membentuk endospora dan bersifat katalase positif.
Bacillus merupakan bakteri yang termasuk kelompok gram positif, memiliki dinding sel yang mengandung 90% lapisan peptidoglikan dengan polisakarida berupa asam tekoat yang tertanam di dalam dinding sel. Bacillus dapat membentuk endospora pada kondisi lingkungan yang kritis termasuk keterbatasan nutrisi misalnya kekurangan karbon dan nitrogen tetapi tidak akan membentuk endospora saat sel sedang membelah secara eksponensial. Untuk itu pewarnaan endospora hanya dapat dilakukan paling tidak setelah isolat berumur lebih dari 48 jam. Struktur endospora dapat tetap bertahan terhadap radiasi, suhu, kekeringan, asam, desinfektan serta dapat dorman dalam waktu yang lama.
Kemampuan Bacillus membentuk endospora sangat menguntungkan bagi bakteri tanah terkait dengan habitatnya atau kondisi lingkungan yang selalu berubah dan tidak menguntungkan. Hal ini merupakan nilai tambah sehingga bakteri ini dapat dimanfaatkan sebagai pupuk hayati ataupun sebagai agens pengendali hayati yang stabil. Struktur spora dapat bertahan dan tetap dapat melepaskan metabolit aktifnya pada kondisi lingkungan yang tidak menguntungkan sehingga memungkinkan untuk membuat formulasi produk yang stabil (Kloepper et al. 1999). Bacillus termasuk bakteri aerob atau fakultatif aerob yang menggunakan oksigen sebagai penerima elektron terakhir pada respirasi