PENERAPAN TEKNOLOGI FOTOBIOREAKTOR
MIKROALGA JENIS AIR-LIFT UNTUK MENYERAP
EMISI GAS CO
2Agus Setiawan, Rahmania A. Darmawan, Arif D. Santoso, Abdil H. Stani, dan Kardono
Peneliti di Pusat Teknologi Lingkungan Badan Pengkajian dan Penerapan Teknologi
Abstract
This study investigated the ability of microalgae to reduce the emission of CO2 from the atmosphere. Airlift photobioreactor used in this investigation in order to cultivate Chaetoceros gracilis in batch and close system. The experiments were conducted by two different initial cell numbers, 10,000 and 40,000 cells / mL respectively..Carbon dioxide with concentration of 12% and flow rate 0.5 mL/minute were injected into the reactor and monitored its reduction. It can be found that the trend of growth rate shown similar results with Wu and Merchuk(1), but its value was smaller than that obtained by Sutomo(2). As increasing of initial cell number from 10.000 and 40.000 cells / mL,
carbon dioxide reduction increased slightly. Generally, both experiments shown that at the first day injection, the concentration of CO2 in the gas holder reduced significantly by 4% (from 12% to 8%), indicating that high gas holdup was occurred in the riser. This concentration decrease gradually by 50% after 5 days and 75% after 8-9 days due to utilization of CO2 in photosynthesis.
Key words: microalgae, airlift photobioreactor, Chaetoceros gracilis, carbon dioxide, photosynthesis
1. PENDAHULUAN
Selain potensinya yang besar sebagai sumber bahan baku bagi energi baru dan terbarukan, mikroalga juga dapat berperan dalam menurunkan emisi gas CO2 di atmosfer. Mikroalga sebagai tumbuhan mikroskopis bersel tunggal yang hidup di lingkungan yang mengandung air, tumbuh dan berkembang dengan memanfaatkan sinar matahari sebagai sumber energi dan nutrien anorganik sederhana seperti CO2, komponen nitrogen terlarut dan fosfat.
Teknologi fotobioreaktor sendiri d i k e t a h u i m a m p u m e n i n g k a t k a n produktivitas alga 2 hingga 5 kali lebih tinggi dari kondisi normalnya1). Gas CO2 yang keluar dari cerobong asap selanjutnya dapat langsung disambungkan ke fotobioreaktor dan dimanfaatkan oleh alga
untuk pertumbuhannya melalui mekanisme fotosintesis. Dalam proses fotosintesis, alga mengubah CO2 menjadi bahan organik. Elektron dalam reaksi reduksi ini berasal dari air, yang diubah menjadi oksigen dan proton. Energi yang dibutuhkan dalam proses ini berasal dari cahaya yang diserap oleh pigmen-pigmen (terutama klorofil dan karotenoid). Fotosintesis merupakan proses 2 fasa. Fasa I (reaksi terang) bergantung pada cahaya dan membutuhkan energi cahaya untuk membuat molekul pembawa energi yang digunakan dalam proses kedua. Fasa II (reaksi gelap) tidak bergantung pada cahaya dan terjadi ketika hasil dari fasa I digunakan untuk membentuk ikatan kovalen C-C dari karbohidrat. Namun demikian bukti-bukti terkini menegaskan pentingnya
cahaya dalam siklus gelap (dark cycles)3) dan menyatakan bahwa enzim utama dari reaksi gelap (dark reaction) didorong secara tidak langsung oleh cahaya, sehingga istilah reaksi gelap sebenarnya agak sedikit kurang cocok.
Sebagai tempat berlangsungnya proses biokimia dengan bantuan cahaya, fotobioreaktor dapat dibuat seoptimal mungkin dengan mengontrol faktor-faktor lingkungannya. Pengaturan ini dilakukan agar pertumbuhan optimal alga dapat dicapai4). Secara umum, sebuah fotobioreaktor terdiri atas 6 subsistem, yaitu sumber cahaya, sistem transmisi optis, daerah reaksi, sistem pertukaran gas, sistem filtrasi, dan sistem pemantauan5). Beberapa dari subsistem tersebut ada yang saling berinteraksi, misalnya: sistem transmisi optis dan sistem pertukaran gas berinteraksi melalui percampuran yang terjadi di dalam daerah reaksi, alga bergerak masuk dan keluar daerah yang terang melalui percampuran.
Cahaya sebagai sumber energi yang dibutuhkan dalam proses fotosintesis adalah salah satu faktor kunci dalam mendesain fotobioreaktor. Pengaturan cahaya perlu dilakukan agar produktivitas maksimal dapat dicapai. Rasio luas permukaan yang terkena cahaya terhadap volume fotobioreaktor harus dibuat sebesar mungkin. Kepadatan populasi alga dalam fotobioreaktor juga dapat menghalangi transmisi cahaya, dimana konsentrasi alga sebesar 10 gr/liter akan mengakibatkan kehilangan energi cahaya sebesar 68% pada kedalaman 1 mm6).
Ada beberapa bentuk fotobioreaktor yang dapat digunakan untuk membudidayakan mikroalga, yaitu pipa (tubular) horisontal dan vertikal, spiral (helical) dan panel tipis horisontal (horizontal thin-panel). Dalam penelitian ini dipilih fotobioreaktor berbentuk pipa vertikal dengan sistem airlift (ALR,
airlift reactor). Reaktor dengan tipe airlift
ini diketahui memiliki beberapa kelebihan jika dibandingkan dengan sistem kolom gelembung (bubble columns), dimana pola
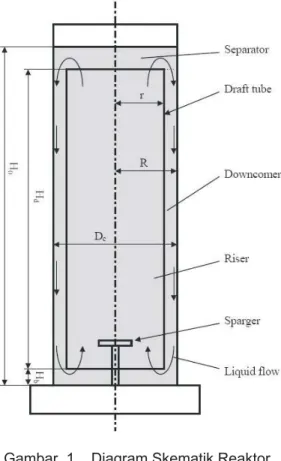
Gambar 1 Diagram Skematik Reaktor Jenis Air-Lift Simpal (Loop) Internal1)
sirkulasi fluida ditentukan oleh desain reaktor yang memiliki saluran untuk aliran air-udara ke atas (riser) dan saluran terpisah untuk aliran ke bawah (downcomer)7,8). Di dalam riser, injeksi gas menghasilkan daerah turbulen yang tinggi yang membawa gas dalam jumlah yang besar. Di downcomer, fluida bergerak kembali ke bawah setelah terpisah dari gelembung gas yang terlepas dalam pemisah gas. Sebagian kecil gas mungkin saja terperangkap di dalam
downcomer, bergantung pada geometri
reaktor dan kondisi operasinya. Namun demikian, gas yang dibawa di dalam downcomer lebih rendah daripada di riser, dan perbedaan gas di kedua daerah ini menghasilkan perbedaan densitas fluida yang nyata yang membangkitkan sirkulasi media tumbuh (lihat Gambar 1).
Jika mikroalga ada di dalam sistem, mereka akan mempengaruhi aliran yang bergantung pada beda densitas antara fasa mikroalga dan fasa media tumbuh. Dengan menganggap bahwa kecepatan partikel mikroalga relatif terhadap media tumbuh adalah kecepatan jatuh bebas (free-fall) dan kecepatan gelembung relatif terhadap media tumbuh adalah kecepatan naik bebas (free-rise), maka analisis dapat disederhanakan8).
2. METODOLOGI 2.1. Dasar Perancangan
Fotobioreaktor
Dengan asumsi bahwa spesies alga yang digunakan dalam percobaan ini adalah yang memiliki potensi yang baik dalam menyerap CO2, maka hal terpenting lainnya yang perlu dipikirkan agar penyerapan CO2 maksimal adalah desain fotobioreaktor. Untuk dapat membuat fotobioreaktor yang optimal, diperlukan pengetahuan yang mendalam tentang sistem dan model matematik, dimana model harus mampu menggambarkan sifat dasar dari kinetik alga.
D a l a m m e r a n c a n g s e b u a h fotobioreaktor, ada beberapa hal penting yang harus diperhatikan, yaitu sumber cahaya, dimensi reaktor, transfer atau pencampuran gas CO2, laju pertumbuhan alga, dan proses pengadukan atau pencampuran di dalam reaktor. Berkaitan dengan daya tembus cahaya, diameter reaktor tidak boleh terlalu besar sehingga sumber cahaya yang diberikan dapat mencapai bagian yang paling dalam, terutama ketika konsentrasi alga di dalam reaktor semakin besar. Kedalaman penetrasi cahaya dapat dihitung dengan rumus d=60/C, dimana d dan C berturut-turut menyatakan kedalaman penetrasi (dalam mm) dan konsentrasi alga (dalam gr/liter) (Javanmardian dan Palsson, 1991). Jadi, dengan konsentrasi alga sekitar 1 gr/liter, kedalaman penetrasi cahayanya adalah 60 mm (atau 6 cm).
Dalam reaktor jenis air-lift, fluks cahaya berkurang secara eksponensial dengan jarak dari permukaan yang terkena cahaya (Hukum Lambert-Beer). Alga yang dekat dengan sumber penyinaran akan terpapar densitas foton yang tinggi, yang akan meningkatkan laju pertumbuhan, jika dibandingkan dengan sel-sel yang berada di tengah reaktor yang menerima lebih sedikit cahaya karena lebih teduh sehingga pertumbuhannya pun lebih lambat. Namun demikian, cahaya yang berlebihan dapat merusak protein D1 dalam fotosistem II dan mengurangi laju pertumbuhan karena berkurangnya jumlah perangkap foton yang aktif9). Sehingga, laju pertumbuhan alga tidak hanya dipengaruhi oleh intensitas tetapi juga riwayat penyinaran10), dan perubahan periodik dalam penyinaran11).
K a r e n a f o t o b i o r e a k t o r d a l a m penelitian ini didesain untuk dapat digunakan sebagai pengurang emisi gas CO2 dan akan dimanfaatkan untuk menyerap emisi CO2 dari cerobong asap, maka transfer atau pencampuran gas CO2 dari sumber ke dalam media tumbuh perlu diperhatikan. Penyuntikan CO2 dalam konsentrasi yang langsung besar ke dalam media tumbuh (terutama pada saat t=0) dapat menurunkan pH secara seketika dan akan mempengaruhi laju pertumbuhan alga. Sistem alga diketahui mampu menghilangkan CO2 (dan NOx) dari cerobong asap8). Namun demikian, meskipun penelitian tentang budidaya mikroalga dalam fotobioreaktor untuk mengurangi CO2 di atmosfer ini telah mulai dilakukan sejak awal tahun 90-an, sejauh ini penerapannya untuk menangkap CO2 dari cerobong asap masih menemui beberapa kendala, seperti produktivitas biomassa yang masih rendah dan pemanfaatan CO2 yang belum efisien untuk memenuhi skala industri12). Hal ini berkaitan dengan berlebihnya gas CO2 yang diemisikan oleh cerobong asap, dimana konsentrasi dan temperaturnya pun bergantung pada kondisi pembakaran di
power plant. Sementara itu, biasanya gas
CO2 dialirkan ke dalam reaktor dengan laju aliran yang rendah1).
2.2. Tahapan Percobaan dan Pemantauan
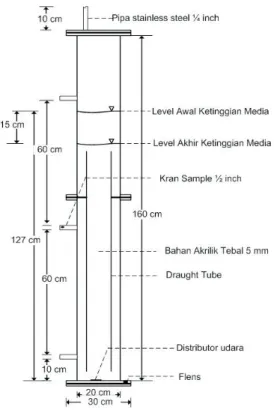
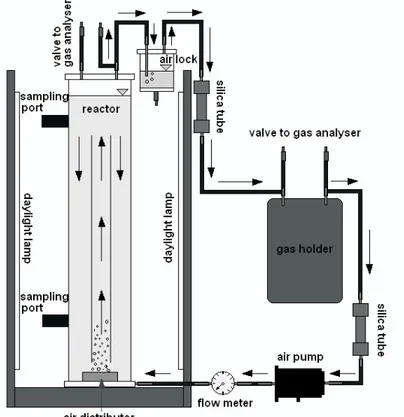
D a l a m k a j i a n a w a l i n i , d u a fotobioreaktor dengan diameter 20 cm, tinggi 160 cm dan volume 40 L (Gambar 2) dibuat dan dijalankan dengan sistem batch dan tertutup (Gambar 3). Diameter riser adalah 10 cm dengan tinggi 110 cm dan jarak dari dasar reaktor sekitar 5 cm. Percobaan dilakukan sebanyak 2 kali dengan menggunakan media tumbuh air laut yang telah disterilkan dari Pusat Penelitian Oseanologi, Lembaga Ilmu Pengetahuan Indonesia (P2O LIPI). Pada percobaan pertama, digunakan kepadatan 10.000 sel/ mL dan pada percobaan kedua digunakan kepadatan 40.000 sel/mL.
Air laut yang digunakan sebagai media tumbuh diambil dari lepas pantai Teluk Jakarta. Salinitas air laut dibuat menjadi 28 dan disterilkan dengan menggunakan pemanasan uap (autoclave) pada suhu 121oC dan tekanan 103 kPa selama 15 menit.
Air laut yang sudah disterilkan ini kemudian Gambar 2 Dimensi Fotobioreaktor Air-Lift yang Digunakan dalam Penelitian
1. Nutrien (g/L H2O) Keterangan
Na NO3 75 Dalam 1 L air laut steril digunakan 1 mL NaH2PO4H2O 5 Dalam 1 L air laut steril digunakan 1 mL Na2SiO39H2O 30 Dalam 1 L air laut steril digunakan 1 mL 2. Trace metal (g/100 mL H2O)
FeCl3.6H2O Dalam 1 L H2O digunakan 3,15 g
Na2 EDTA.2H2O Dalam 1 L H2O digunakan 4,36 g
MnCl2.4H2O 18 Dalam 1 L H2O digunakan 1 mL
Zn SO4.7H2O 2,2 Dalam 1 L H2O digunakan 1 mL COCl2.6H2O 1,0 Dalam 1 L H2O digunakan 1 mL CuSO4.6H2O 0,98 Dalam 1 L H2O digunakan 1 mL Na2MoO4.2H2O 0,63 Dalam 1 L H2O digunakan 1 mL 3. Vitamin (g/100 mL H2O)
Thiamin HCl (B1) Dalam 500 mL H2O digunakan 100 mg
Biotin 0,01 Dalam 500 mL H2O digunakan 0,5 mg
B12 0,1 Dalam 500 mL H2O digunakan 0,5 mg
diperkaya dengan lima macam larutan stok f/2 (nitrat, fosfat, silikat, trace metal dan vitamin, lihat Tabel 1). Media f/2 tersebut kemudian disaring dengan menggunakan membran filter 0,7 μm (GF/F).
Pada percobaan dengan media air laut ini dipilih mikroalga Chaetoceros gracilis yang memiliki laju tumbuh relatif yang cukup tinggi, yaitu 1,1986, dan memiliki kemampuan adaptasi yang cukup cepat2). Mikroalga ini diperoleh dari hasil budidaya yang dilakukan di Pusat Penelitian Oseanologi, Lembaga Ilmu Pengetahuan Indonesia (P2O LIPI).
Gas CO2 dengan konsentrasi 12% diberikan untuk satu siklus hidup mikroalga (sekitar 10 - 14 hari) dengan laju alir 0,5 L/ menit. Gas CO2 dialirkan ke dalam reaktor dengan sistem tertutup dari dasar reaktor dengan menggunakan distributor udara berpori halus. Sebelum percobaan dimulai, terlebih dahulu dilakukan tes kebocoran gas pada seluruh komponen fotobioreaktor.
Gambar 3 Diagram Skematik Rangkaian Sistem Fotobioreaktor
Gas CO2 berkonsentrasi 12% dibuat dengan cara mencampur CO2 murni dengan nitrogen di dalam kantung gas (gas holder). Untuk menentukan volume yang harus ditampung di dalam kantung gas agar dapat memenuhi kebutuhan mikroalga selama satu siklus, digunakan pendekatan kepadatan awal mikroalga 10.000 sel/mL dan 40.000 sel/mL dengan laju tumbuh 1,1986 sel/hari dan massa karbon fitoplankton (phytoplankton carbon, PPC) 126,1 x 10-15 gC13)(populasi didominasi oleh 60% jenis diatom dan dapat digunakan sebagai acuan karena mikroalga yang digunakan dalam penelitian ini juga jenis diatom). Dengan pendekatan ini kebutuhan CO2 12% untuk 14 hari percobaan masing-masing adalah 98 dan 390 L. Dari hasil pendekatan ini ditemukan bahwa pada kepadatan sel 40.000 sel/mL dibutuhkan volume CO2 yang melebihi kapasitas gas holder yang dimiliki.
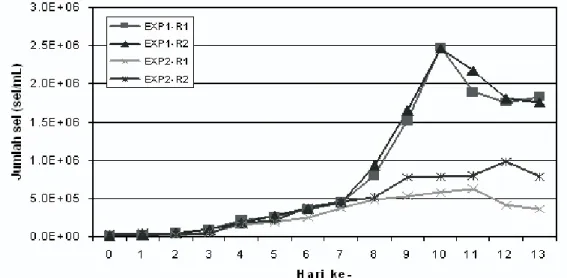
Dari Gambar 4 terlihat bahwa hingga hari ke-7, trend penambahan jumlah sel terhadap waktu relatif sama untuk dua kepadatan awal yang berbeda. Meskipun laju tumbuh relatifnya cukup kecil, namun jika dibandingkan dengan hasil percobaan yang dilakukan oleh Wu dan Merchuk1) yang sama-sama menggunakan fotobioreaktor jenis air-lift, terlihat bahwa laju tumbuh mikroalga hasil percobaan ini memiliki pola yang relatif sama, terutama untuk percobaan I (EXP1). Jumlah sel pada hari ke-1 telah bertambah 2 kali lipat dari kepadatan awalnya (hari ke-0), demikian pula untuk hari berikutnya, hingga hari ke-4, dimana jumlah sel mengalami penggandaan dari hari sebelumnya. Hal ini juga mengindikasikan bahwa pemberian CO2
3. HASIL DAN PEMBAHASAN
Dari hasil percobaan I, dengan kepadatan 10.000 sel/mL, didapatkan laju tumbuh relatif Chaetoceros gracilis di reaktor 1 dan 2 masing-masing adalah 0,559 dan 0,553 sel/ hari, masih sangat rendah jika dibandingkan dengan hasil yang diperoleh oleh Sutomo2), yaitu 1,199 sel/hari. Bahkan pada hasil percobaan II, dengan kepadatan 40.000 sel/ mL, laju tumbuh relatifnya jauh lebih kecil lagi, yaitu 0,237 dan 0,321 sel/hari.
Gambar 4. Pertumbuhan Chaetoceros gracilis Selama Masa Percobaan
(EXP1: Percobaan I, EXP2: Percobaan II, R1: Reaktor 1, R2: Reaktor 2) sebesar 12% pada hari ke-0 masih dapat ditolerir oleh mikroalga, meskipun akibat injeksi ini pH media menjadi lebih rendah daripada kondisi lingkungan ketika mikroalga tersebut diinokulasi di laboratorium14). Kondisi inilah diduga yang menjadi penyebab mengapa laju tumbuh relatif pada percobaan ini lebih rendah daripada Sutomo2).
Ditinjau dari konsentrasi CO2 yang terdapat di dalam gas holder (Gambar 5), terlihat bahwa setelah CO2 12% diinjeksikan Sumber energi cahaya yang digunakan
adalah daylight lamp dengan intensitas antara 1500 hingga 2000 luks selama 12 jam, dari pukul 06.00 hingga 18.00. Laju tumbuh mikroalga, pH dan suhu media, konsentrasi CO2 terlarut di dalam media, dan penuruan konsentrasi gas CO2 di dalam gas holder diamati setiap hari dengan melakukan pengukuran langsung. Selain itu dilakukan pula pengambilan sampel media untuk analisis nutrien dan karbon di laboratorium. Konsentrasi gas CO2 dalam rangkaian sistem fotobioreaktor diukur dengan menggunakan Portable Combination Gas Detector RIKEN Model RX-515. Pengukuran dilakukan untuk mengetahui perubahan konsentrasi gas CO2 di dalam gas holder terhadap waktu.
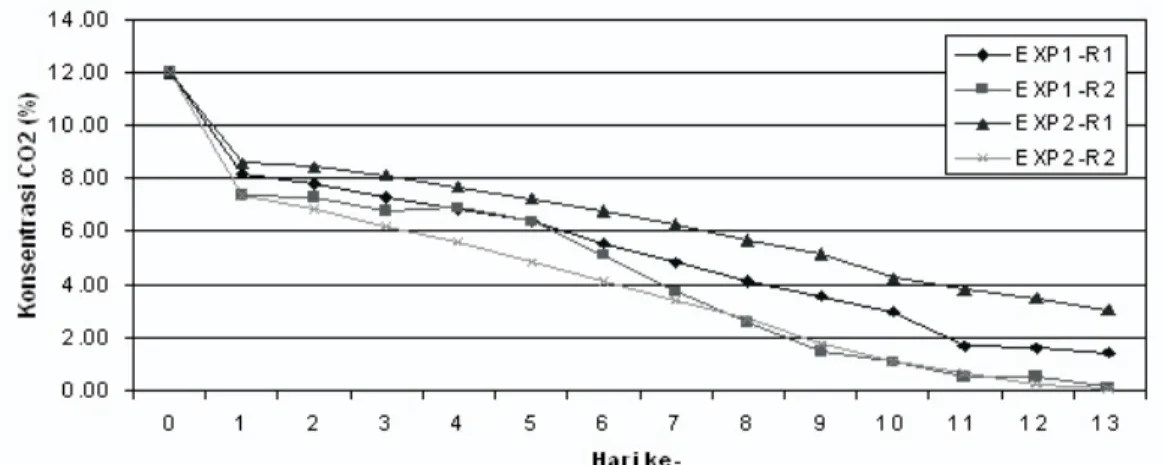
Gambar 5 Konsentrasi CO2 di Dalam Gas Holder (EXP1: Percobaan I, EXP2: Percobaan II, R1: Reaktor 1, R2: Reaktor 2)
ke fotobioreaktor pada hari ke-0, konsentrasi gas tersebut berkurang menjadi sekitar 8%. Mengingat bahwa sistem fotobioreaktor ini bersifat tertutup, maka berkurangnya konsentrasi CO2 ini terjadi karena sebagian dari gas tersebut terlarut di dalam media tumbuh. Hal ini menandakan bahwa proses percampuran di dalam fotobioreaktor berlangsung dengan cukup baik dan jumlah gas CO2 yang terbawa dalam riser cukup banyak. Setelah itu, konsentrasi CO2 berkurang secara perlahan terhadap waktu karena digunakan oleh mikroalga dalam proses fotosintesis. Konsentrasi gas CO2 di dalam gas holder berkurang 50% dari kondisi awalnya pada hari ke-5 dan 75% pada hari ke-8 atau 9. Dari hasil ini dapat dikatakan bahwa percobaan awal penerapan fotobioreaktor air-lift untuk menyerap emisi gas CO2 telah berjalan dengan cukup baik dan memberikan hasil yang positif.
4. KESIMPULAN DAN SARAN
Dari hasil penelitian ini dapat disimpulkan bahwa percobaan tentang f o t o b i o r e a k t o r m i k r o a l g a i n i t e l a h memberikan hasil dan indikasi yang positif akan kemampuan fitoplankton dalam mereduksi kandungan CO2 yang diinjeksikan ke dalam fotobioreaktor. Fitoplankton jenis Chaetoceros gracilis ini terbukti mampu beradaptasi dengan pH yang lebih rendah dari kondisi inokulasinya. Percobaan ini masih dalam tahap awalsehingga perlu dilakukan percobaan-percobaan berikutnya untuk meningkatkan laju tumbuh fitoplankton yang masih terlalu rendah. Merujuk pada percobaan yang telah dilakukan oleh Wu dan Merchuk1), beberapa penyempurnaan harus dilakukan untuk mendapatkan hasil yang lebih baik seperti: pencahayaan yang harus lebih terkonsentrasi dengan menempatkan reflektor di sekitar reaktor, rasio luas riser terhadap luas downcomer, dan dimensi fotobioreaktor.
DAFTAR PUSTAKA
1. Wu, X. dan J.S. Merchuk. 2004.
Simulation of algae growth in a bench scale internal loop airlift reactor. Chemical Engineering Science 59,
2899-2912.
2. Sutomo. 2005. Kultur tiga jenis mikroalga (Tetraselmis sp., Chlorella sp., dan Chaetoceros gracilis) dan pengaruh kepadatan awal terhadap pertumbuhan C. gracilis di laboratorium. Oseanologi dan
Limnologi di Indonesia 37, 43-58. 3. Barbosa, M.J., M. Janssen, N.
Ham, J. Tramper, R.H. Wijffels. 2003. Microalgae cultivation in air-lift
reactors: modelling biomass yield and growth rate as a function of mixing frequency. Biotechnol. Bioeng. 82(2),
170.
4. Scragg, A.H. 1991. Bioreactor in biotechnology: a practical approach.
Ellis Horwood, England. 330pp. 5. J a v a n m a r d i a n , M . d a n B . O .
P a l s s o n . 1 9 9 1 . H i g h - d e n s i t y
photoautotrophic algal cultures: design, construction, and operation of a novel photobioreactor system.
Biotechnology & Bioengineering 38, 1182-1189.
6. Ogbanna, J. C. dan H. Tanaka. 1997.
Industrial-size photobioreactors.
Chemtech 27(7), p43-49.
7. Merchuk, J. C. dan M. Gluz. 1999. Bioreactors, air-lift reactors.
E n c y c l o p e d i a o f B i o p r o c e s s Te c h n o l o g y : F e r m e n t a t i o n , Biocatalysis and Bioseparation. John
Wiley & Sons, Inc. (Eds.), 320-353. 8. Vunjak-Novakovic, G., Y. Kim, X. Wu,
I. Berzin, dan J.C. Merchuk. 2005.
Air-lift bioreactors for algal growth on flue gas: mathematical modeling and pilot-plant studies. Ind. Eng. Chem.
Res., 44(16), 6154-6163.
9. Powles, S.B. 1984. Photoinhibition of photosynthesis induced by visible light.
Annu. Rev. Plant Physiol. 35(15). 10. Lee, Y.K. dan S.J. Pirt. 1981.
Energetics of photosynthetic algal growth: influence of intermittent illumination in short (40 s) cycles. J.
Gen. Microbiol. 124(43).
11. Marra, J. 1978. Phytoplankton
photosynthetic response to vertical movement in a mixed layer. Mar. Biol.
(Berlin) 46(203).
12. Jeong, M.L., J.M. Gillis, J.Y. Hwang. 2003. Carbon dioxide mitigation
by microalgal photosynthesis. Bull.
Korean Chem. Soc. 24(12), 1763-1766.
13. Nöthig, E.M., B.v. Bodungen, Q. Sui. 1991. Phyto- and protozooplankton
biomass during austral summer in surface waters of the Weddell Sea and vicinity. Polar Biol. 11, 293-304.
14. S e t i a w a n , A . K a r d o n o , R . A . Darmawan, A.D. Santoso, A.H. Stani, Prasetyadi, L. Panggabean, D. Radini, S. Sapulete. 2008. Teknologi
penyerapan karbondioksida dengan kultur fitoplankton pada fotobioreaktor.
Makalah disajikan pada Pertemuan Ilmiah Tahunan V Ikatan Sarjana Oseanologi Indonesia 11 November 2008, ITB Bandung