CAIRAN EMPEDU
Nubli Falaah Albanna (G84120075)1, Regina Pujiyanti, Syaefudin, S. Si, M. Si.3 Mahasiswa Praktikum1, Asisten Praktikum2, Dosen Praktikum3
METABOLISME Departemen Biokimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
2014
Abstrak
Cairan empedu adalah suatu cairan garam berwarna kuning kehijauan yang mengandung kolesterol, fosfolifid, lesitin serta pigmen empedu. Cairan empedu dibuat dalam hati dan disimpan dalam kantung empedu apabila tidak digunakan. Fungsi utama empedu adalah menetralkan kondisi asam dari saluran usus dan mengawali pencernaan lemak dengan membentuk emulsi. Praktikum ini bertujuan untuk mengetahui sifat fisik cairan empedu (warna, bau, pH, kekentalan, dan bobot jenis) serta mengetahui unsur (klorida, sulfat, dan fosfat) dalam cairan empedu, melakukan uji pigmen dan uji asam cairan empedu. Cairan empedu memiliki warna hijau tua, berbau amis, konsentrasi atau kekentalannya kental dengan pH 8 (basa) serta memiliki bobot jenis 1.006 g/mL . Cairan empedu positif terhadap uji sulfat, uji fosfat dan uji klorida. Uji pigmen yaitu menggunakan uji Gmelin dan Smith menunjukkan hasil positif. Uji asam cairan empedu yaitu uji Pettenkofer dan uji modifikasi Pettenkofer oleh Mylus menunjukkan hasil positif.
Kata kunci: Cairan empedu, empedu, pigmen empedu, asam empedu.
Pendahuluan
Empedu merupakan cairan yang pahit, berwarna hijau tua kekuningan dan diproduksi secara terus menurus oleh liver pada mayoritas vertebrata. Empedu membantu proses pencernaan lemak pada usus halus. Manusia menyimpan empedu pada kantong empedu dan disekresikan ke dalam usus halus melalui duodenum. Proses sekresi empedu dimulai saat manusia makan. Komposisi kandungan empedu adalah 92% air, 0,3% bilirubin, 0,9%-2,4% lemak (asam lemak dan lesitin serta 200 mEq/L garam anorganik (Guyton et al 2011).
Pelepasan cairan empedu dipengaruhi oleh aktivitas sfingter Oddi (hepatopankreatik). Selama tidak ada proses pencernaan makanan, sfingter Oddi mengecil dan mencegah empedu berpindah ke duodenum. Karena ditutupnya saluran, terjadi peningkatan konsentrasi pada kantong empedu . Kantong empedu memiliki sel epitel yang mampu menyerap air dan elektrolit, sehingga empedu menjadi lebih pekat dan terkonsentrasi (Campbell 2008)
Kelainan pada kelenjar empedu dapat dibagi menjadi 2 macam yakni kelainan mengenai tidak dihasilkannya enzim yang mendukung sekresi empedu dan kerusakan kantong empedu secara fisik. Kelainan dan penyakit yang berkaitan dengan sekresi empedu antara lain: tidak adanya enzim Oxysterol 7a-hidroksilase, 3B-Hidroksi steroid dehidrogenase, Oxosteroid 5B-reduktase, C-25 hidroksilase. Penyakit AMACR, Zellwelger Syndrome, dan penyakit Refsume (Bove et al 2004).
Metode Praktikum
Tempat dan waktu praktikum. Praktikum mengenai cairan empedu dilaksanakan di Laboratorium Biokimia FMIPA IPB. Pada hari Jumat, 3 Oktober 2014 dimulai Pukul 13.00 hingga 16.00 WIB.
Alat dan bahan. Alat yang digunakan pada praktikum ini yaitu tabung reaksi, pipet mohr, gelas ukur, mortar. Bahan yang digunakan antara lain: akuades, cairan empedu, asam asetat, 10%, kertas saring, HNO3 10 %, AgNO3
2%, HCl 10%, BaCl2 , Urea 10%, molibdat, ferosulfat, HNO3 pekat, iod 5%,
sukrosa 5%, H2SO4, Furfural.
Prosedur Praktikum
Sifat fisik cairan empedu. Catat warna empedu, bau cairan, reaksi cairan (pH), kekentalan, Bobot Jenis cairan empedu.
Musin (lendir) dan Garam Anorganik dalam cairan empedu. Buat larutan empedu yang telah diencerkan. Asamkan 25 mL enceran cairan empedu dengan asam asetat 10%, akan terbentuk musin yaitu semacam lendir yang mengendap. Saring dengan kertas saring dan amati endapan. Filtrat diuji terhadap klorida, sulfat dan fosfat.
Uji Klorida. Sebagian filtrat diasamkan dengan larutan HNO3 10%, ke
dalam filtrat tambahkan larutan AgNO3. Endapan putih menunjukkan adanya
klor.
Uji Sulfat. Sebagian filtrat diasamkan dengan larutan HCl 10%. Ke dalam filtrat asam ditambahkan larutan BaCl2. Endapan putih menunjukkan adanya
sulfat.
Uji Fosfat. Filtrat sebanyak 1 mL ditambahkan dengan 1 mL larutan urea 10% dan pereaksi molibdat khusus. Campurkan dengan rata, kemudian tambahkan 1 mL ferosulfat khusus. Pembentukan warna biru menunjukkan adanya fosfat.
Uji pigmen empedu. Uji Gmelin: Tabung reaksi diisi dengan asam nitrat pekat, masukkan 3 mL cairan empedu yang sudah diencerkan (melalui dinding tabung) usahakan kedua cairan tidak bercampur. Amati perbatasan warna antara kedua cairan. Uji Smith: isikan tabung reaksi dengan 3 mL cairan empedu yang sangat encer. Tambahkan beberapa tetes larutan iod 5% dalam alkohol. Amati cincin hijau tuadiantara lapisan cairan
Uji asam empedu. Uji petenkofer: isikan tabung dengan 5 mL cairan empedu encer, tambahkan sukrosa 5% sebanyak 5 tetes, tambahkan 3 mL H2SO4.
Uji Modifikasi petenkofer: isikan 5 mL cairan empedu encer, tambahkan 3 tetes furfural 1:1000. Lalu tambahkan asam sulfat pekat.
Hasil dan Pembahasan
Empedu membantu proses pencernaan dengan mengemulsi kolesterol, lemak, vitamin yang larut dalam lemak sehingga lebih mudah diserap oleh usus halus. Cara kerjanya yaitu dengan menurunkan tegangan permukaan dan mengikat lemak yang ada, lalu membentuk kompleks empedu-lemak yang lebih mudah diproses oleh pencernaan. Garam-garam empedu termasuk ke dalam kelompok garam natrium dan kalium dari asam empedu yang berkonjugasi dengan glisin atau taurin suatu derivat/turunan dari sistin (Ismail et al 2013)
Hemoglobin yang berasal dari penghancuran sel darah merah dirubah menjadi bilirubin (pigmen utama dalam empedu) dan dibuang ke dalam empedu. Jumlah cairan empedu yang dihasilkan dipengaruhi oleh faktor asupan makanan dan juga faktor hormonal (Rashetnyak 2013). Sifat cairan empedu dapat diamati
dengan mengidentifikasi warna cairan, bau, reaksi kekentalan serta berat jenis. Oleh karena itu dilakukan pengujian dengan hasil sebagai berikut.
Tabel 1 Sifat fisik cairan empedu
Uji Hasil Pengamatan
Warna Hijau
Bau cairan Bau amis
pH Basa
Konsistensi/kekentalan Encer
Bobot Jenis terbaca 1.014
Bobot Jenis terkoreksi 1.006 Contoh perhitungan :
Bobot Jenis:
Diketahui: Talat = 27.5oC Bobot Jenis Terukur= 1,014 g/mL
Tcairan = 25oC Faktor Koreksi = 𝑇𝐿𝑎𝑟𝑢𝑡𝑎𝑛−𝑇𝑎𝑙𝑎𝑡 3 = 25−27,5 3 = −2,5 3 = −0,008 BJ terkoreksi = 1,014+ (-0,008) = 1,006
Hasil percobaan menunjukkan bahwa cairan empedu memiliki warna hijau tua, berbau amis, konsentrasi/kekentalannya kental dengan pH 8 serta memiliki bobot jenis 1.006 g/mL. Terlibatnya cairan empedu pada sebagian besar metabolisme gugus metabolit dan metabolisme intermediet mengakibatkan bau cairan ini amis. Bau yang dihasilkan juga akan mempengaruhi bau feses karena adanya pigmen yang dihasilkan pada cairan empedu akan teroksidasi menjadi pigmen penyusun feses (Rashetnyak 2013)
Uji garam anorganik bertujuan untuk mengetahui apakah dalam suatu sampel terdapat garam-garam anorganik. Garam empedu dapat membentuk obligat dengan lemak yang akan dicerna, pencernaan lemak akan dimulai jika sudah terbentuk misel (Poedjiadi 2007). Hasil dari uji garam anorganik dalam cairan empedu dapat dilihat pada Tabel 2.
Tabel 2 Hasil uji Musin (lendir) dan garam anorganik dalam cairan empedu
Uji Hasil Perubahan warna Gambar
Klorida positif Endapan putih
Sulfat Positif Endapan putih
Fosfat positif Biru pekat
Berdasarkan hasil yang diperoleh, menunjukkan bahwa pada cairan empedu mengandung garam anorganik khlorida dan fosfat. Terdapatnya garam anorganik khlorida ditunjukkan dengan terbentuknya endapan putih dan cairan empedu menjadi berwarna kuning keruh, sedangkan terdapatnya garam anorganik fosfat ditunjukkan dengan berubahnya cairan empedu menjadi berwarna biru pekat (Bintang 2010). Pengujian sulfat menunjukkan hasil positif dengan terbentuknya endapan putih. Percobaan ino berhasil membuktikan bahwa cairan empedu mengandung fosfat, sulfat dan klorida.
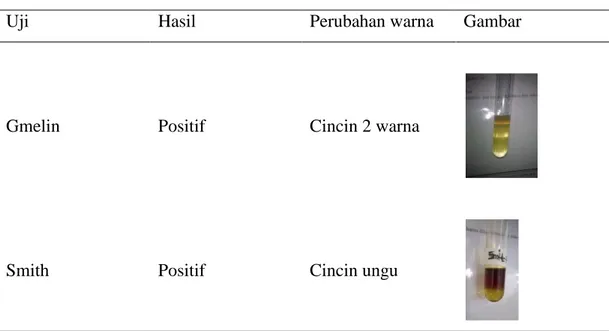
Uji pigmen empedu menggunakan dua metode, yaitu uji Gmelin dan uji Smith. Uji Gmelin menggunakan asam nitrat pekat, sedangkan uji Smith menggunakan pereaksi berupa larutan iod 5% dalam alkohol. Hasil uji pigmen dapat dilihat pada Tabel 3.
Tabel 3 Hasil uji pigmen empedu
Uji Hasil Perubahan warna Gambar
Gmelin Positif Cincin 2 warna
Smith Positif Cincin ungu
Berdasarkan data yang diperoleh, uji pigmen empedu menghasilkan reaksi positif pada uji Gmelin dan Smith. . Uji Gmelin digunakan untuk menentukan adanya pigmen empedu dalam urin dengan membentuk banyak warna dengan penambahan asam nitrat pekat (Bintang 2011). Hal ini menunjukan bahwa empedu memiliki pigmen yang dapat mempengaruhi larutan dan memberikan perubahan warna.
Uji asam empedu ini menggunakan metode Pettenkofer dan modifikasi Pettenkofer oleh Mylus. Uji Pettenkofer digunakan untuk menentukan adanya asam empedu dalam urin (Bintang 2010). Hasil dari uji asam empedu dapat dilihat pada Tabel 4.
Tabel 4 Uji asam empedu
Uji Hasil Perubahan warna Gambar
Pettenkofer Positif Cincin merah
Pettenkofer
Berdasarkan hasil pengujian, Uji Petenkofer dan Petenkofer dengan modifikasi mendapatkan hasil positif. Hal ini ditunjukkan dengan adanya cincin berwarna yang terbentuk pada kedua permukaan pada uji Pettenkofer dan pada uji modifikasi Pettenkofer oleh Mylus. Pada uji asam empedu ini dilakukan penambahan asam suflat. Asam sulfat yang ditambahkan akan merubah asam asetat dan komponen lain menjadi gula sehingga dihasilkan kompleks warna. Pengujian dengan uji Pettenkofer menghasilkan warna yang lebih pekat dibanding pengujian dengan uji modifikasi Pettenkofer oleh Mylus (Poedjiadi 2007) Pediatric and Developmental Pathology 7, 315–334
Simpulan
Cairan empedu memiliki warna hijau tua, berbau amis, konsentrasi atau kekentalannya kental dengan pH 8 (basa) serta memiliki bobot jenis 1.006 g/mL . Cairan empedu mengandung garam anorganik klorida dan fosfat dan sulfat. Uji pigmen cairan empedu menggunakan metode uji Gmielin dan uji Smith menunjukkan hasil yang positif. Uji pigmen ini bertujuan untuk menguji pigmen dalam cairan empedu. Uji asam cairan empedu menggunakan metode uji Pettenkofer dan uji modifikasi Pettenkofer oleh Mylus. Kedua uji ini menunjukkan hasil yang positif.
Daftar Pustaka
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Erlangga.
Bove KI, Heubi JE, Balistreri WF, Setchell KDR. 2004. Bile Acid Synthetic Defects and Liver Disease: A Comprehensive Review. Pediatric and Developmental Pathology 7(1): 315–334
Campbell NA, Reece JB. Urry LA, Cain ML. 2008 Biology 8th Edition.San
Fransisco: Benjamin Cummings
Guyton M , Hall B. 2007. Buku Ajar Fisiologi Kedokteran. Jakarta:EGC
Ismail E, Suhermiyati, Roesdijanto. 2013. Penambahan Tepung Kunyit (Curcuma domestica Val) dan Sambiloto (Andrographis paniculata Nees) dalam
pakan terhadap bobot hati, pankreas dan empedu broiler. Jurnal Ilmiah Peternakan 1(3): 750-758
Poedjiadi A. 2007. Dasar-Dasar Biokimia. Jakarta (ID): UI-Press.
Reshetnyak VI. 2013. Physiological and molecular biochemical mechanisms of bile formation. World Journal of Gastroenterology 19 (42): 7341-7360