PENGAYAAN UNSUR TANAH JARANG SECARA
DESTRUKSI DAN PENGENDAPAN DARI PASIR MONASIT
BANGKA
ANNA ROHANI ROIDA MANURUNG
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
iv
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengayaan Unsur Tanah Jarang Secara Destruksi dan Pengendapan dari Pasir Monasit Bangka adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2013
Anna Rohani Roida Manurung
ABSTRAK
ANNA ROHANI ROIDA MANURUNG. Pengayaan Unsur Tanah Jarang Secara Destruksi dan Pengendapan dari Pasir Monasit Bangka. Dibimbing oleh KOMAR SUTRIAH dan MUHAMMAD FARID.
Unsur tanah jarang (UTJ) merupakan unsur lantanida yang banyak dimanfaatkan untuk peralatan elektronik berteknologi tinggi. Dalam penelitian ini, pengayaan UTJ dari mineral bumi dilakukan melalui beberapa tahap, yaitu destruksi, ekstraksi menggunakan
microwave oven, dan pengendapan. Pada tahap destruksi kering dan basah dengan bantuan NaOH, masing-masing menghasilkan jumlah UTJ sebesar 25.56% dan 44.30%. Tahap ekstraksi menggunakan microwave oven dengan pelarut HCl 37% berhasil melarutkan UTJ pada daya high selama 30 menit. Kadar total UTJ yang terdapat pada fase cair hasil ekstraksi destruksi basah dan kering masing-masing sebesar 35.72% dan 29.97%. Endapan UTJ mulai terbentuk ketika pH pengendapan lebih dari 7 menggunakan NH4OH 2 N. Jumlah total UTJ yang terendapkan pada fase umpan destruksi basah dan
kering pada pH 10 masing-masing sebesar 2.76% dan 1.18%. Endapan pada pH 10 memberikan jumlah total UTJ terbesar dan fase umpan destruksi kering menghasilkan endapan yang efektif dalam pengayaan UTJ dengan berkurangnya unsur pengotor, seperti Si, P, dan tidak terdapat unsur Th, serta mengandung unsur U dengan jumlah yang sedikit, yaitu 12 ppm. Hal ini sesuai dengan nilai persen perolehan unsur non-UTJ dan radioaktif yang lebih kecil dibandingkan fase umpan dari destruksi basah, akan tetapi mengandung unsur U dalam jumlah sedikit sebesar 0.00006 g dan tanpa unsur Th. Kata kunci: destruksi, ekstraksi, pengendapan, unsur tanah jarang
ABSTRACT
ANNA ROHANI ROIDA MANURUNG. Enrichment of Rare Earth Elements by Destruction and Precipitation of Bangka Monazite Sand. Supervised by KOMAR SUTRIAH and MUHAMMAD FARID.
Rare earth elements (REEs) are lanthanide elements widely used in high-tech electronic equipment. In this study, REEs from earth minerals were enriched through several stages, namely destruction, extraction by microwave oven, and precipitation. The dry and wet destruction phases by using NaOH produced a total of 25.56% and 44.30% REEs, respectively. At the extraction by microwaves stage with HCl 37% as solvent, REEs were successfully dissolved in 30 minutes at high energy. Total amount of REEs which contained in the liquid phase from wet and dry destruction were 35.72% and 29.97%, respectively. Precipitation of REEs started when the pH value was higher than 7, reached by using NH4OH 2 N. Total precipitated REEs in wet and dry feed destruction at
pH 10 was 2.76% and 1.18%, respectively. Precipitation at pH 10 gave the highest total REEs. Dry feed destruction produced precipitate that effectively enrich REEs by decreasing impurity elements, such as Si and P, and there was no Th element found. It is also contained low U element which was only 12 ppm. This is consistent with the value of percent recovery and the non-radioactive REEs which was smaller than the wet feed destruction, but contains elements of U in the amount of not less than 0.00006 g and without Th element.
5
PENGAYAAN UNSUR TANAH JARANG SECARA
DESTRUKSI DAN PENGENDAPAN DARI PASIR MONASIT
BANGKA
ANNA ROHANI ROIDA MANURUNG
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Skripsi : Pengayaan Unsur Tanah Jarang Secara Destruksi dan Pengendapan dari Pasir Monasit Bangka
Nama : Anna Rohani Roida Manurung NIM : G440080092
Disetujui oleh
Dr Komar Sutriah, MS Drs Muhammad Farid, MSi
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
7
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Yesus Kristus atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Pengayaan Unsur Tanah Jarang Secara Destruksi dan Pengendapan dari Pasir Monasit Bangka”. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Mei hingga Desember 2012 di Laboratorium Terpadu, Laboratorium Kimia Fisik, serta Laboratorium Kimia Anorganik, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih atas semua bimbingan, dukungan, kerjasama, dan dana yang telah diberikan oleh Bapak Dr Komar Sutriah, MS selaku pembimbing I dan Bapak Drs Muhammad Farid, MSi selaku pembimbing II. Di samping itu, penghargaan penulis sampaikan kepada orang tua tercinta, kak Nelly, adik tercinta Primanto dan Wira yang telah membantu saya dalam doa maupun dana. Penulis juga sangat berterima kasih kepada Annisa Amelia, Rafael Gunawan Silaban yang selalu menemani dan memberi semangat selama penelitian, Arfin, Dumas Flish Tang, Rofiqoh, Resvina, Ryna, teman-teman komisi Diaspora PMK IPB, Pak Sawal, Pak Caca, Pak Mulyadi, Pak Mail, teh Nurul, Pak Sabur, Indah, Baim, analis Laboratorium Terpadu IPB, dan teman-teman Kimia 45 (kimceu).
Semoga karya ilmiah ini dapat bermanfaat. Terima kasih.
Bogor, Februari 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Penelitian 3
HASIL DAN PEMBAHASAN 5
Destruksi Monasit 5
Ekstraksi Unsur Tanah Jarang Dengan HCl 37% Menggunakan
Microwave 10
Pengendapan Unsur Tanah Jarang 14
Persen Keberhasilan Perolehan UTJ Melalui Proses Destruksi, Ekstraksi,
dan Pengendapan 17
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 20
DAFTAR PUSTAKA 20
3
DAFTAR TABEL
1 Bentuk unsur dominan setelah perlakuan 6
2 Probabilitas keberadaan unsur 13
DAFTAR GAMBAR
1 Cawan krus besi 5
2 Kurva termogram hasil peleburan monasit 1:6 7
3 Jumlah unsur tanah jarang sebelum perlakuan (A) dan sesudah destruksi
kering dengan NaOH (B) 7
4 Jumlah unsur non-UTJ dan radioaktif sebelum perlakuan (A) dan sesudah destruksi kering dengan NaOH (B) 8 5 Jumlah UTJ, non-UTJ, dan unsur radioaktif sebelum perlakuan (A) dan
sesudah destruksi dengan NaOH (B) 9
6 Perangkat alat destruksi basah monasit 10
7 Pemanasan secara konvensional (a) dan gelombang mikro (b) 11 8 Kelarutan UTJ pada filtrat hasil ekstraksi dengan HCl 37% menggunakan
microwave oven terhadap contoh fase padat destruksi basah (a) dan
destruksi kering (b) 12
9 Perbandingan jumlah kadar UTJ yang terlarut menggunakan microwave
oven terhadap contoh fase padat destruksi basah dan kering pada daya high 12 10 Jumlah kelarutan unsur radioaktif dan non-UTJ 13
11 Jumlah UTJ yang mengendap dengan penambahan NH4OH pada contoh
fase cair destruksi kering (a) dan basah (b) 15 12 Endapan pH 10 dari contoh fase cair destruksi kering 15 13 Endapan pH 7 dan pH 10 dari contoh fase cair destruksi basah 16 14 Jumlah UTJ, non-UTJ dan unsur radioaktif yang mengendap pada pH 10
terhadap fase umpan destruksi basah dan kering 16 15 Persen perolehan UTJ terhadap contoh fase padat destruksi kering dan
basah 17
16 Jumlah UTJ sebelum perlakuan (A), setelah perlakuan destruksi (B), ekstraksi microwave (C), dan pengendapan (D) terhadap contoh fase
padat destruksi kering (a) dan basah (b) 18
DAFTAR LAMPIRAN
1 Bagan alir penelitian 24
2 Sifat-sifat unsur tanah jarang 26
3 Hasil analisis komposisi contoh sebelum perlakuan menggunakan XRF 27 4 Hasil analisis komposisi contoh dengan perlakuan destruksi kering dan
5 Hasil analisis perbandingan kandungan unsur non-UTJ, radioaktif, dan UTJ hasil destruksi kering dan basah menggunakan XRF 29 6 Hasil analisis kelarutan unsur non-UTJ, radioaktif, dan UTJ terhadap
contoh fase padat destruksi basah menggunakan ICP-OES 30 7 Hasil analisis kelarutan unsur non-UTJ, radioaktif, dan UTJ terhadap
contoh fase padat destruksi kering menggunakan ICP-OES 32 8 Hasil analisis proses pengendapan unsur non-UTJ, radioaktif, dan UTJ
pada pH 4, 7, dan 10 dari contoh fase cair destruksi kering menggunakan
XRF 34
9 Hasil analisis proses pengendapan unsur non-UTJ, radioaktif, dan UTJ pada pH 4, 7, dan 10 dari fase cair destruksi basah menggunakan XRF 35 10 Kandungan bobot dan persen perolehan kembali (recovery) unsur
non-UTJ, radioaktif, dan UTJ pada proses destruksi, ekstraksi, dan
pengendapan 36
11 Diagram alir pengayaan unsur Ce dalam contoh dari keseluruhan proses 38 12 Diagram alir pengayaan UTJ dalam skala industri 39
1
PENDAHULUAN
Unsur tanah jarang (UTJ) merujuk pada kelompok unsur pada golongan lantanida, dengan nomor atom 57 sampai 71, serta skandium (Sc), itrium (Y), dan torium (Th) dan merupakan unsur yang sangat langka atau keterdapatannya sangat sedikit. Sumber utama UTJ dapat diperoleh dari mineral monasit, senotim, dan basnasit (Kanazawa dan Kamitani 2006). Mineral monasit ((Ln,Th)PO4)
merupakan senyawa fosfat logam tanah jarang yang mengandung 50–70% oksida unsur tanah jarang serta sumber penting torium, lantanum, dan serium (Suprapto 2009). Monasit merupakan salah satu mineral ikutan pada proses penambangan timah. Di alam, monasit terdapat dalam campuran dengan mineral lain, seperti cassiterite (SnO2), zirkon (ZrSiO4), ilmenite (FeTiO3), rutile (TiO2),
magnetit, dan garnet. Pemisahan monasit dari mineral lainnya dapat dilakukan berdasarkan perbedaan berat jenis atau sifat magnet (Spedding dan Daane 1961). Monasit memiliki kemagnetan yang sangat kecil, sehingga hanya tertarik oleh magnet yang sangat kuat, sedangkan bijih-bijih lainnya dipisahkan dengan magnet yang lebih lemah dan sisanya tidak bersifat magnet (non magnet). Konsentrat monasit dapat diperoleh hingga 60% monasit. Mineral yang mengandung UTJ banyak ditemukan pada hasil samping penambangan timah, seperti di pulau Bangka, Belitung, Singkep, Riau, dan Kalimantan (Wasito dan Biyanto 2009).
Kegunaan penting dari UTJ pada bidang industri, peralatan, maupun teknologi canggih mengakibatkan usaha untuk memurnikannya terus meningkat. Peralatan seperti superkonduktor, baterai isi ulang, transistor, katalis cracking, magnet permanen, radar, serat optik, dan layar komputer (LCD) menggunakan UTJ sebagai bagian dari komponennya (Barret dan Dhesi 2001). Logam-logam UTJ yang berasal dari mineral bumi perlu melalui beberapa proses sebelum dapat digunakan dalam keadaan murni dan bebas dari unsur radioaktif uranium, torium, serta unsur pengotor lainnya, seperti PO4, TiO2, dan lain sebagainya.
Tahapan proses yang biasa dilakukan untuk memperoleh UTJ adalah penghancuran, penggerusan, pemisahan dengan magnet, destruksi, pemisahan, dan pemurnian dari mineral campurannya (Cotton 2006). Tahap destruksi berperan penting untuk memisahkan UTJ secara sempurna dari matrik dalam campuran, sehingga dapat diproses lebih lanjut (Gupta dan Krishnamurthy 2004). Destruksi merupakan cara untuk membuat contoh menjadi bentuk yang larut atau mengubah sampel menjadi bentuk materi yang dapat diukur, sehingga analat yang terdapat didalamnya dapat dianalisis, serta dapat dilakukan secara terbuka ataupun secara tertutup. Destruksi terbuka dilakukan di dalam gelas piala atau biasa disebut destruksi basah, sedangkan destruksi tertutup atau destruksi kering dilakukan di dalam suatu wadah yang tahan terhadap pemanasan (Harvey 2000).
Destruksi mineral yang mengandung UTJ pernah dilaporkan oleh beberapa peneliti. Berdasarkan penelitian Mulyani (2007), destruksi dengan menggunakan bom teflon pada berbagai sampel tanah memberikan hasil analisis yang lebih tinggi dibandingkan dengan destruksi secara konvensional (destruksi terbuka). Akan tetapi, berdasarkan penelitian Khaldun (2009), destruksi unsur tanah jarang menggunakan bom teflon tidak memberikan hasil yang optimal karena masih terdapat 60% unsur tanah jarang tidak terdestruksi secara sempurna. Proses destruksi unsur tanah jarang yang kurang sempurna memberikan hasil analisis
2
unsur yang tidak optimal dan akan mempengaruhi perolehan unsur tanah jarang dalam tahap selanjutnya (Senovita 2008). Metode destruksi terbuka memiliki kelebihan dibandingkan dengan menggunakan bom teflon, karena dapat digunakan pada skala laboratorium bahkan industri. Selain itu, titik leleh teflon hanya 324 °C, sehingga tidak dapat menganalisis unsur dalam tanah yang harus terlebih dahulu diubah menjadi bentuk oksidanya dengan dilebur pada suhu 800 °C (Mulyani 2007).
Tahapan selanjutnya merupakan pemisahan UTJ dari hasil destruksi leburan basa, yaitu ekstraksi dengan bantuan gelombang mikro. Ekstraksi berbantuan gelombang menggunakan pelarut asam pernah dilaporkan oleh beberapa peneliti. Menurut Pratiwi (2012), pelarut asam mineral yang dapat melarutkan unsur tanah jarang dalam jumlah besar, yaitu HCl 37% dengan residu asam yang dihasilkan sebanyak 0.0141 g dan total kadar unsur tanah jarang sebesar 0.6322% dibandingkan pelarut HNO3 65%, H2SO4 98%, akuaregia, dan larutan piranha
dengan masing-masing residu sebesar 0.5069 g, 0.1093 g, 0.0846 g, dan 0.2692 g. Ekstraksi berbantuan gelombang dapat dilakukan dengan menggunakan
microwave. Menurut Lu et al. (2003), kondisi optimal proses ekstraksi, yaitu energi 60% selama 30 menit dengan alat berkekuatan 630 watt. Serta menurut Ichsan (2012), destruksi microwave lebih efektif untuk destruksi lantanum sebesar 26.24% dibandingkan destruksi menggunakan oven sebesar 18.21%.
Pemisahan atau pengayaan UTJ dari uranium dan torium dapat dilakukan dengan berbagai cara, yaitu ekstraksi, resin penukar ion, dan pengendapan (Susilaningtyas et al. 2000). Pengayaan UTJ dengan cara pengendapan juga pernah diteliti. Berdasarkan hasil penelitian Arief et al. (2001), UTJ(OH)3 dari
larutan UTJ(Cl)3 menggunakan NH4OH 2 N selama 1 jam pada suhu 30 °C
diperoleh kondisi optimal pH 9.6 dengan rekoveri UTJ(OH)3 sebesar 98.80%,
sedangkan U dan Th yang ikut mengendap masing-masing sebesar 18 ppm dan 24 ppm. Penelitian ini mengkaji perbandingan metode destruksi terbuka dengan teknik destruksi kering dan basah menggunakan pelarut NaOH, serta pengayaan UTJ dari unsur radioaktif U dan Th dan unsur non-UTJ dengan cara pengendapan menggunakan larutan umpan UTJ(Cl)3. Parameter yang diperhatikan dalam proses
pengendapan adalah pH yang digunakan.
METODE
Metode penelitian ini mengikuti diagram alir pada Lampiran 1 yang terdiri atas empat tahap, yaitu destruksi pasir monasit dengan NaOH, ekstraksi UTJ dengan HCl 37% menggunakan microwave oven, pengendapan UTJ, dan analisis dengan flouresensi sinar-X (XRF) dan spektrometri emisi optik-plasma gandeng induktif (ICP-OES).
Bahan dan Alat
Bahan-bahan yang digunakan meliputi pasir monasit hasil samping timah, pelet NaOH, larutan NaOH 50%, HCl 37%, NH4OH 2 N, akuades, asam borat,
3
pembakar gas, tanur, oven, labu kjehdal, neraca analitik, pH universal, ayakan 200 mesh, sentrifus, mesin penggerus, pengaduk magnet, hotplate, neraca analitik, gegep, microwave oven tipe Panasonic NN-5215WF/MF 800W, ICP-OES tipe Agilent 725-ES, XRF tipe ARL Advent+ XP, serta berbagai alat gelas laboratorium.
Prosedur Penelitian Destruksi Pasir Monasit Destruksi Kering
Pasir monasit hasil samping timah yang berukuran 200 mesh dan NaOH (p) ditimbang di dalam cawan krus besi menggunakan neraca analitik dengan perbandingan pasir monasit per massa NaOH sebesar 1:6 kemudian cawan beserta isinya dilebur terlebih dahulu menggunakan pembakar gas hingga pelet NaOH dalam bentuk cair. Setelah pelet NaOH beserta pasir telah tercampur dan tidak menimbulkan percikan, cawan beserta isinya dimasukkan ke dalam tanur. Suhu tanur yang digunakan sebesar 700 °C selama 2 jam, kemudian dinaikkan secara perlahan-lahan sebesar 800 °C selama 2 jam. Kemudian cawan beserta isinya dikeluarkan dari tanur dan dibiarkan dingin. Sebanyak 250 mL akuades panas dimasukkan ke dalam cawan krus besi secara perlahan-lahan. Larutan dalam cawan krus besi dituang ke dalam gelas piala, sehingga terdapat fase padat dan cair. Setelah itu, dilakukan pengendaptuangan untuk mendapatkan fase padat. Fase padat tersebut dilakukan pencucian menggunakan akuades panas sebanyak 250 mL hingga pH 13, kemudian dikeringkan menggunakan oven, sedangkan fase cair ditampung. Fase padat dianalisis menggunakan XRF.
Dekstrusi Basah
Pasir monasit hasil samping timah yang berukuran 200 mesh sebanyak 30 gram ditambah 300 mL NaOH 50% ke dalam labu kjehdal 500 mL. Setelah itu, pemanasan dilakukan dengan menggunakan pembakar bunsen hingga larutan NaOH hampir kering, setelah hampir kering larutan NaOH 50% kembali ditambahkan sebanyak 300 mL. Larutan tersebut dibakar kembali menggunakan pembakar bunsen hingga larutan hampir kering. Setelah larutan hampir kering, labu beserta isinya dituang ke gelas piala untuk memperoleh fase padat. Fase padat tersebut dilakukan pencucian menggunakan akuades panas sebanyak 1600 mL hingga pH 7, kemudian dikeringkan menggunakan oven, sedangkan fase cair ditampung. Fase padat dianalisis menggunakan XRF.
Ekstraksi Unsur Tanah Jarang Dengan HCl 37% Menggunakan Microwave Fase padat hasil destruksi kering dan basah sebanyak 1 g ditambah 80 mL HCl 37% ke dalam labu bulat, kemudian diekstraksi menggunakan microwave oven. Waktu ekstraksi diatur selama 30 menit (waktu maksimum microwave yang digunakan) serta daya diatur dengan variasi high, medium, dan low. Kemudian contoh dikeluarkan dari microwave, volume pelarut sisa hasil ekstraksi diukur menggunakan gelas ukur, dan fase padat beserta fase cair diendaptuang hingga
terpisah. Fase padat dikeringkan pada suhu kamar, sedangkan fase cair ditampung. Fase cair dianalisis menggunakan ICP-OES.
Pengendapan Unsur Tanah Jarang
Fase cair hasil ekstraksi yang mengandung unsur tanah jarang terbanyak diambil sebanyak 50 mL, kemudian diendapkan menggunakan larutan NH4OH
2 N. Fase cair tersebut diendapkan dengan beberapa pH. Larutan NH4OH 2 N
ditambah hingga larutan memiliki pH 4 (menggunakan pH universal). Fase cair yang ber-pH 4 diaduk selama 1 jam kemudian dikocok menggunakan sentrifus dengan kecepatan 5000 rpm selama 30 menit. Endapan hasil pengocokkan, setelah itu dipisahkan dari fase cair dan dikeringkan menggunakan oven. Filtrat cair sisa pengendapan pada pH 4, kemudian diendapkan kembali hingga pH 7. Fase cair yang ber-pH 7 diaduk selama 1 jam kemudian dikocok menggunakan sentrifus dengan kecepatan 5000 rpm selama 30 menit. Endapan hasil pengocokkan, setelah itu dipisahkan dari fase cair dan dikeringkan menggunakan oven. Fase cair sisa hasil pengendapan pada pH 7, kemudian diendapkan kembali hingga pH 10. Fase cair yang ber-pH 10 diaduk selama 1 jam kemudian dikocok menggunakan sentrifus dengan kecepatan 5000 rpm selama 30 menit. Endapan hasil pengocokkan, setelah itu dipisahkan dari filtrat dan dikeringkan menggunakan oven. Endapan berbagai pH (pH 4, pH 7, dan pH 10) dianalisis menggunakan XRF.
Analisis Menggunakan XRF
Tahapan preparasi menggunakan XRF sebagai berikut, pasir monasit (sebelum perlakuan dan sesudah perlakuan destruksi serta pengendapan) sebanyak 5 g yang sudah berukuran 200 mesh ditimbang, ditambahkan polivinil alkohol sebanyak 1 g kemudian dicampurkan dengan cara digerus di mortar. Setelah itu ditekan dengan alat pembuat pelet. Cincin pelet dipanaskan terlebih dahulu dalam oven sekitar 15 menit kemudian dipasang dan ditambahkan asam borat 2 g lalu diisi dengan sampel yang sudah digerus. Cross bar ditutup dan tombolnya ditekan maka akan muncul gaya tekan yang diberikan dan waktu yang diperlukan untuk terjadi pelet. Setelah itu cross bar dibuka. Pelet yang sudah jadi diambil dan dimasukkan oven selama 15 menit yang selanjutnya dianalisis menggunakan XRF, alat tekan pelet dibersihkan dengan penyedot debu serta alkohol. Pengukuran ini dilakukan di Laboratorium Pusat Survey Geologi, Bandung.
Analisis Menggunakan ICP-OES
Filtrat hasil ekstraksi microwave dianalisis menggunakan ICP-OES untuk mengetahui banyaknya unsur tanah jarang yang terlarut. Standar unsur tanah jarang dengan konsentrasi 1000 ppm ditambah larutan asam nitrat 2% dalam labu takar. Larutan stok tersebut diencerkan hingga 0.5, 1.0, 2.0, 5.0, dan 10 ppm. Larutan contoh diambil dari larutan stok menggunakan pipet sebanyak 2 mL, kemudian diencerkan hingga 50 mL menggunakan akuades dalam labu takar. Standar dan contoh dianalisis dengan ICP-OES yang ada di Laboratorium Pusat Sumber Daya Geologi, Bandung.
5
HASIL DAN PEMBAHASAN
Destruksi Monasit Destruksi kering
Destruksi kering merupakan destruksi yang dilakukan dengan memanaskan sampel pada suhu tinggi selama waktu tertentu hingga sampel menjadi abu atau berwarna putih (Mulyani 2007). Proses destruksi biasa dilakukan dengan bantuan panas atau tekanan, serta lazim dilakukan dengan penambahan pelebur asam atau basa. Asam yang biasa digunakan untuk destruksi adalah H2SO4, HNO3, dan HF
serta basa NaOH atau KOH (Harvey 2000). Destruksi yang dilakukan pada penelitian ini adalah destruksi terbuka dengan teknik destruksi basah dan kering menggunakan NaOH. Destruksi terbuka dengan teknik destruksi kering dilakukan dengan bantuan NaOH, dengan perbandingan berat pasir monasit dan berat NaOH adalah 1:6. Pasir monasit yang berukuran 200 mesh dilebur bersama NaOH menggunakan pembakar gas terlebih dahulu agar reaksi peleburan berlangsung dengan baik dalam suhu tanur yang cukup tinggi, yaitu 700 °C dan 800 °C.
Pemilihan perbandingan berat pasir monasit dan berat NaOH yang digunakan sebesar 1:6 karena setiap UTJ akan mengikat tiga buah basa saat peleburan, sehingga jumlah NaOH yang dibutuhkan akan selalu lebih banyak dibandingkan jumlah sampel yang digunakan (Senovita 2008). Hasil destruksi kering ini menghasilkan jumlah unsur tanah jarang sebesar 9.51% untuk Ce dan 4.02% untuk La, hal ini jauh berbeda dengan hasil yang dilakukan oleh Senovita (2008) yang berhasil melakukan destruksi pasir monasit menggunakan teknik destruksi tertutup (menggunakan bom teflon dalam oven) dengan jumlah UTJ yang terdestruksi sebesar 31.90% untuk Ce dan 13% untuk La dengan perbandingan bobot monasit dan NaOH sebesar 35:65. Hal ini disebabkan logam pengotor seperti Fe yang meningkat setelah perlakuan sebesar 17.95% dari sebelum perlakuan sebesar 1.60% dan dapat berpotensi mempengaruhi proses destruksi karena dapat ikut mengendap menjadi Fe(OH)3 oleh penambahan
NaOH. Peningkatan kadar logam pengotor Fe pada sampel disebabkan oleh terkikisnya cawan krus besi, yang bersifat korosif terhadap basa (Gambar 1).
Gambar 1 Cawan krus besi
Menurut Suyanti dan Aryadi (2011), analisis monasit seringkali menunjukkan logam-logam pengotor, seperti besi, aluminium, kalsium, magnesium, titanium, zirkonium, dan silika. Bentuk unsur dominan setelah perlakuan dengan penambahan NaOH ditunjukkan pada Tabel 1.
Tabel 1 Bentuk unsur dominan setelah perlakuan Unsur Perlakuan dengan basa
UTJ UTJ(OH)3(s) Ti Ti(OH)4(s) Fe Fe(OH)3(s) Si Na2SiO3(aq) Mn Mn(OH)2 (s) Zr ZrO2.nH2O (s) Sn Na2SnO3(aq)
Sumber: Barnett & Wilson (1953) dan Cotton & Walkinson (1962).
Destruksi basa menggunakan NaOH merupakan metode dektruksi basa yang lebih disarankan untuk mendestruksi monasit karena pada hasil reaksi akan terbentuk Th(OH)4 yang berbentuk padatan, sehingga torium dapat dipisahkan
dari sampel monasit yang merupakan unsur pengotor pada UTJ dan salah satu senyawa radioaktif. Selain itu, hasil samping dari pengolahannya, seperti natrium fosfat masih dapat dimanfaatkan untuk pupuk dan NaOH yang telah terpakai masih dapat didaur ulang (Calkins et al. 1957). Pada saat destruksi dengan NaOH terjadi reaksi sebagai berikut (Senovita 2008).
(Ln,Th)(PO4) (s) + 3 NaOH (s) → Na3PO4(aq) + Ln(OH)3(s) + Th(OH)3(s)
Pemilihan suhu yang digunakan pada penelitian ini sebesar 700 °C dan 800 °C, hal ini didasarkan atas kurva termogram yang dihasilkan dari Thermo Gravimetri Analysis/Differential Thermal Analysis (TGA/DTA) (Gambar 2). TGA/DTA merupakan analisis yang dapat digunakan untuk menentukan perubahan berat, temperatur peleburan, temperatur perubahan fase titik rekristalisasi, titik transisi glass, dan entalpi dari suatu bahan (Indaryati et al. 2008). Kurva DTA yang dihasilkan menunjukkan tiga puncak aliran panas yang disebabkan oleh pengurangan air (dehidrasi) dan penguraian (dekomposisi). Puncak endotermis (1) pada 91.12 °C memberikan informasi yang berkaitan dengan reaksi dehidroksilasi berupa hilangnya gugus hidroksil atau molekul air. Puncak eksotermis (2) memberikan informasi terjadinya pembentukan fase baru yang melepaskan sejumlah energi sebesar 215.63 uV dengan suhu sebesar 794.37 °C. Puncak ini memberikan informasi lebih lanjut tentang terjadinya sintering dan hilangnya matriks oksida lain pada sampel. Oleh karena itu berdasarkan data tersebut dapat diketahui pasir monasit minimal dilebur pada suhu ± 700 °C hingga 800 °C. Puncak (3) pada suhu 971.86 °C berkaitan dengan reaksi dekomposisi dengan bobot yang hilang sebesar 6.731 mg (23.061%).
7
Gambar 2 Kurva termogram hasil peleburan monasit 1:6
Monasit merupakan mineral yang mempunyai bentuk ikatan fosfat yang mengandung Th dan unsur tanah jarang (Lampiran 3). Komposisi pasir monasit Bangka sebelum didestruksi terlebih dahulu dianalisis menggunakan XRF. Jumlah fosfat sebelum destruksi dengan NaOH sebesar 8.52%, jumlah silika sebesar 6.10%, serta jumlah uranium dan torium masing-masing sebesar 0.195% dan 3.27%. Jumlah total unsur tanah jarang sebesar 34.31%. Semua komponen mayor dan minor (pengotor) tersebut saling berikatan satu sama lain karena unsur tanah jarang dapat membentuk senyawa kompleks yang menyebabkan unsur tanah jarang dapat berada pada bentuk fosfat, karbonat, silikat, oksida, dan florida (Suprapto 2009).
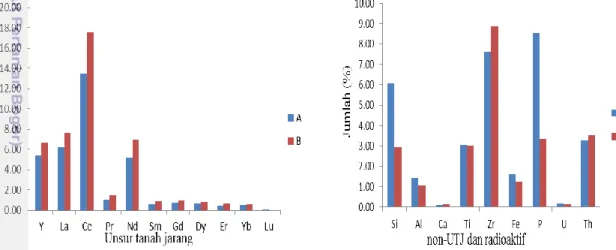
Gambar 3 Jumlah unsur tanah jarang sebelum perlakuan (A) dan sesudah destruksi kering dengan NaOH (B)
1
2
3
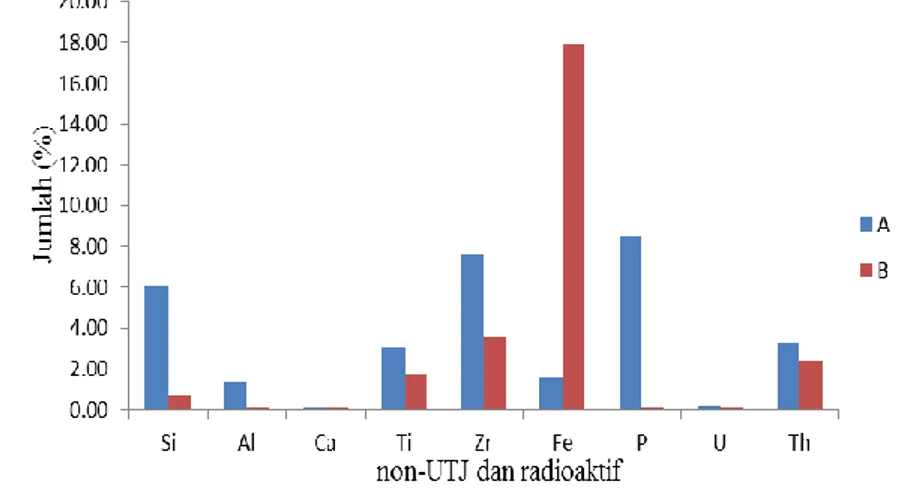
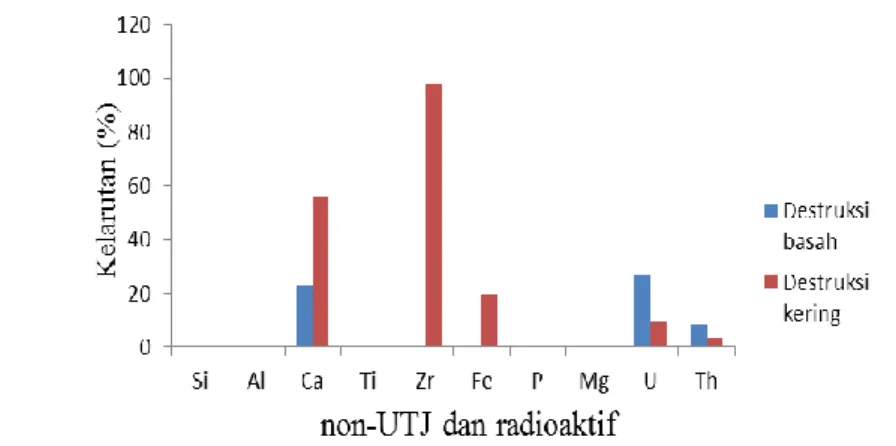
Gambar 4 Jumlah unsur non-UTJ dan radioaktif sebelum perlakuan (A) dan sesudah destruksi kering dengan NaOH (B)
Peleburan oleh NaOH mengakibatkan jumlah Y, La, Ce, Pr, Nd, Dy, Er, dan Yb menurun, jumlah Sm dan Gd meningkat, Pm dan Eu yang tidak terdeteksi sebelum dan sesudah perlakuan, serta Tb, Ho, dan Tm yang terdeteksi setelah perlakuan (Gambar 3). Penurunan kadar ini disebabkan hampir seluruh UTJ berada pada fase cairan ketika dalam tahap perendaman menggunakan akuades setelah proses destruksi, serta semakin meningkatnya jumlah logam pengotor seperti besi (Fe) yang ikut mengendap bersama UTJ, sehingga mengakibatkan jumlah UTJ menurun (Gambar 4) dan Fe tidak terlebur oleh NaOH. Menurut Pratiwi (2012), kenaikan kadar UTJ menunjukkan bahwa unsur-unsur tersebut tidak terleburkan oleh NaOH. Total UTJ yang dihasilkan pada destruksi kering sebesar 25.56% dari total UTJ sebelum perlakuan sebesar 34.31% dan selebihnya merupakan oksida-oksida non-UTJ dan radioaktif (Lampiran 4). Penurunan jumlah total UTJ ini diikuti penurunan logam pengotor (non-UTJ dan radioaktif), seperti silika, fosfat, uranium, dan torium (Lampiran 5) dan menunjukkan sebagian besar UTJ terleburkan oleh NaOH. Dengan demikian silika yang terkandung pada pasir monasit bersifat mudah bereaksi dengan NaOH (amorf), sehingga UTJ ikut terlebur juga yang menyebabkan jumlah total UTJ menjadi kecil.
Unsur radioaktif seperti torium dan uranium setelah destruksi masing-masing sebesar 2.40% dan 0.137%, hasil ini tidak jauh berbeda dengan jumlah sebelum destruksi (Lampiran 5). Kedua unsur ini memiliki nomor atom yang saling berdekatan, yaitu 90 (torium) dan 92 (uranium) dan merupakan unsur aktinida. Dengan nomor atom yang berdekatan, maka sifat kimia dari kedua unsur ini hampir sama, yaitu mudah membentuk senyawa komplek ionik atau netral, mempunyai panjang gelombang yang berdekatan (uranium 651 nm dan torium 665 nm), terhidrolisis pada pH rendah, uranium stabil pada bilangan oksidasi (VI) dengan membentuk UO22+, sedangkan torium stabil pada bilangan oksidasi (IV)
(Fatimah et al. 2009). Berdasarkan hasil pengamatan, ketika jumlah torium turun maka jumlah uranium juga ikut turun, atau sebaliknya. Proses destruksi ini, memberikan hasil yang cukup baik yang ditunjukkan dengan menurunnya jumlah non-UTJ dan radioaktif dari hasil analisis XRF, kecuali unsur Fe.
9
Destruksi Basah
Destruksi basah, yaitu destruksi yang dilakukan dengan menambahkan suatu asam atau basa terlebih dahulu, kemudian dipanaskan pada suhu dan waktu tertentu (Senovita 2008). Pelarut yang digunakan pada destruksi basah ini adalah dengan penambahan basa, yaitu larutan NaOH 50%. Pelarut NaOH 50% ini secara komersial lebih disukai karena konsentrasi NaOH yang dikatakan dapat memberikan hasil yang maksimal dengan konsentrasi antara 30–70% (Calkins et al. 1957).
Destruksi basah menggunakan pelarut NaOH 50% mengakibatkan jumlah unsur tanah jarang, seperti Y, La, Ce, Pr, Nd, Sm, Gd, Dy, Er, Yb meningkat dari sebelum perlakuan, unsur Pm, Eu, Tb, Ho, dan Tm tidak terdeteksi baik sebelum perlakuan maupun sesudah proses destruksi, serta unsur Lu tidak terdeteksi setelah perlakuan sedangkan sebelum perlakuan terdeteksi (Gambar 5). Jumlah total UTJ yang dihasilkan dari proses destruksi basah ini sebesar 44.30%, hasil ini jauh meningkat dari jumlah sebelum dilakukan destruksi sebesar 34.31% (Lampiran 5). Kenaikan jumlah UTJ ini disebabkan menurunnya masing-masing jumlah silika dan fosfat sebesar 2.92% dan 3.33% dari jumlah sebelumnya sebesar 6.10% dan 3.33%.
Gambar 5 Jumlah UTJ, non-UTJ, dan unsur radioaktif sebelum perlakuan (A) dan sesudah destruksi basah dengan NaOH (B)
Berdasarkan hasil penelitian ini, jumlah silika yang menurun menunjukkan silika pada monasit terleburkan oleh NaOH, sehingga UTJ tidak terlebur sempurna dan berada pada fase padatnya. Hal ini sesuai dengan teori yang menyatakan bahwa UTJ terkonsentrasi dalam fase silikat, sehingga jika silika terleburkan banyak oleh NaOH akan menyebabkan UTJ meningkat (Herman 2009). Jumlah silika dan fosfat sebagai unsur non-UTJ atau pengotor yang dominan pada hasil destruksi basah ini jauh lebih tinggi dibandingkan destruksi kering. Jumlah unsur Si dan P hasil destruksi kering masing-masing sebesar 0.705% dan 0.150%, sedangkan hasil destruksi basah sebesar 2.92% dan 3.33%. Kenaikan unsur-unsur ini menunjukkan bahwa unsur tersebut tidak terdestruksi secara sempurna dan masih terdapat pada fase padat yang menyebabkan UTJ jauh lebih meningkat dibandingkan dengan hasil destruksi kering.
Dalam hal ini, silika bersifat kristalin (sukar bereaksi dengan NaOH). Jumlah unsur non-UTJ yang mengalami kenaikan, yaitu unsur Ca dan Zr (Gambar 5). Jumlah unsur Ca sebelum destruksi sebesar 0.107%, nilai ini tidak jauh berbeda setelah perlakuan, yaitu sebesar 0.159%. Jumlah Zr meningkat sebesar 1.28% dari sebelum perlakuan, hal ini disebabkan ZrO2 bersifat basa dan
tidak larut dalam basa berlebih (Cotton dan Wilkinson 2007). Pengaruh peningkatan kadar total UTJ yang meningkat menyebabkan kadar torium yang ikut mengendap bersama UTJ juga meningkat.
Menurut Sulaeman et al. (2006), pemisahan unsur tanah jarang sangat sukar dilakukan karena ion-ion tersebut mempunyai sifat fisika dan kimia yang sangat mirip terutama dalam pelarut air. Hal tersebut antara lain disebabkan oleh ukuran jari-jari ion yang kecil dan hampir sama (semuanya mempunyai elektron terluar pada orbital 4f) dan bermuatan besar (+3) (Lampiran 2). Oleh karena itu, UTJ jika dalam air akan mengalami hidrasi yang kuat, kecuali serium yang memiliki sifat anomali dibandingkan dengan UTJ lainnya, yaitu satu-satunya UTJ yang dapat mempunyai bilangan oksida +4, sehingga Ce sulit larut dalam air. Oleh karena itu, pada proses destruksi basah unsur Ce memiliki jumlah yang lebih tinggi dari sebelum perlakuan.
Proses destruksi basah ini disebut juga metode destruksi konvensional, sehingga memiliki banyak kekurangan ketika menggunakan proses basah. Penambahan pelarut lebih dari satu kali bertujuan agar pelarutan berlangsung sempurna terhadap residu, menyebabkan pelarutan berlangsung lama, banyak pelarut yang hilang karena menguap, dan penggunaan metode ini dalam skala industri sangat merugikan karena boros pelarut, serta gelas kimia (labu kjehdal) yang digunakan tidak tahan terhadap pelarut basa, sehingga diperlukan gelas kimia atau wadah yang tahan terhadap basa pada metode ini (Gambar 6). Proses destruksi ini, memberikan hasil yang kurang baik dibandingkan dengan destruksi kering yang ditunjukkan dengan jumlah unsur radioaktif (Th) meningkat dan unsur non-UTJ seperti Ca dan Zr juga meningkat dari hasil analisis menggunakan XRF serta sebagian besar UTJ tidak terdestruksi dan jumlahnya meningkat.
Gambar 6 Perangkat alat destruksi basah monasit
Ekstraksi Unsur Tanah Jarang Dengan HCl 37% Menggunakan Microwave Unsur tanah jarang yang telah didestruksi dengan teknik kering dan basah menggunakan pelarut basa (NaOH), kemudian dilanjutkan dengan ekstraksi menggunakan microwave oven, yaitu ekstraksi yang memanfaatkan gelombang mikro sebagai sumber energi. Energi gelombang mikro ini merupakan energi yang
11
(Kappe et al. 2009)
sangat berguna dan telah banyak digunakan untuk analisis kimia (Lu et al. 2003). Penggunaan alat ini dipilih sebagai pelarutan unsur tanah jarang karena alat ini dapat digunakan dalam skala industri yang memiliki keuntungan, seperti suhu dan tekanan yang lebih tinggi (200–300 °C) serta tekanan mencapai 40–100 bar. Waktu proses pun tidak lebih dari 30 menit, sehingga dapat membuat waktu analisis menjadi lebih efektif (Harvey 2000). Kelebihan lain dari alat ini adalah gelombang yang dihasilkan dapat memanaskan bahan secara merata, berbeda dengan pemanasan konvensional yang hanya memanaskan bagian permukaan bahan, sehingga kurang optimal (Gambar 7).
Gambar 7 Pemanasan secara konvensional (a) dan gelombang mikro (b) (Kappe et al. 2009)
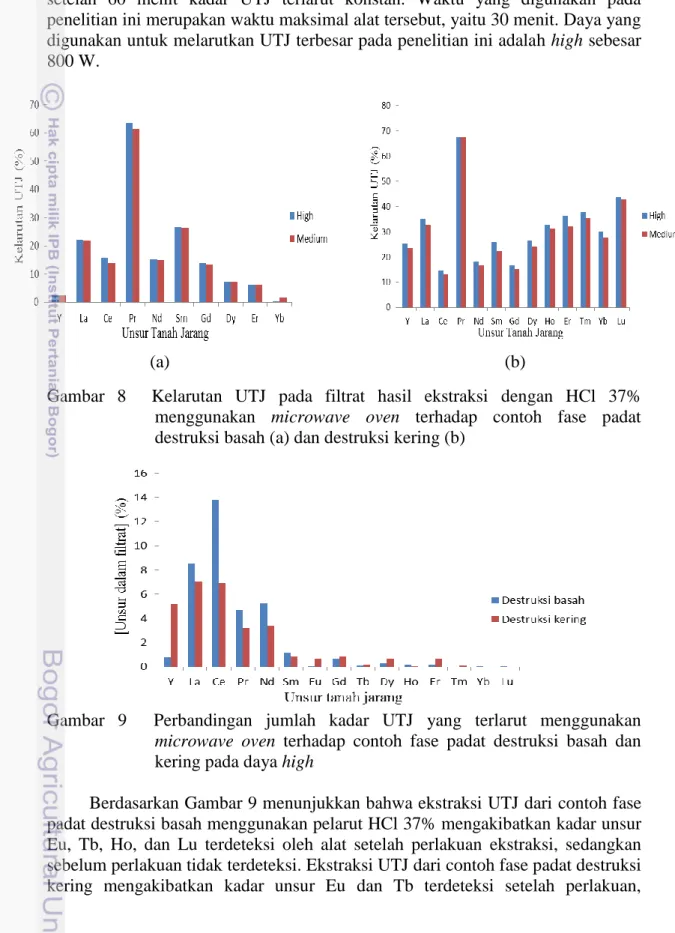
Parameter penting dalam tahap ini adalah variasi daya yang digunakan, yaitu high, low, dan medium. Penelitian ini melarutkan UTJ dari fase padat destruksi basah dengan variasi daya high, medium, dan low, sedangkan contoh fase padat destruksi kering hanya menggunakan daya high dan medium (Gambar 8). Daya low tidak digunakan pada pelarutan contoh ini didasarkan atas pengaruh pergerakan partikel-partikel terhadap energi atau daya untuk melarutkan sampel, sehingga semakin kecil daya tersebut maka pergerakan partikel-partikel pada sampel tersebut kecil untuk menghasilkan panas yang merata dalam melarutkan sampel.
Pelarut yang digunakan adalah HCl 37%. Pemilihan pelarut didasarkan atas pelarut yang digunakan dapat melarutkan logam berharga tanpa melarutkan pengotornya. Menurut Mulyani (2007), pelarut HCl merupakan pelarut yang bukan termasuk ke dalam pengoksidasi, akan tetapi pelarut tersebut akan membentuk klorida yang dapat larut dengan hampir semua elemen, kecuali Hg, Pb, dan Ag selain itu berdasarkan penelitian Sulaeman et al. (2006) HCl digunakan sebagai pelarut untuk melarutkan dan mengasamkan unsur tanah jarang, selain itu HCl dijadikan fase penerima pada proses pemisahan unsur tanah jarang menggunakan Supported Liquid Membrane (SLM) yang menyebabkan unsur tanah jarang banyak berpindah ketika konsentrasi HCl semakin tinggi.
Kelarutan UTJ dari contoh padat hasil destruksi basah dan kering dianalisis menggunakan alat ICP-OES dan menghasilkan kelarutan terbesar pada daya high
(Gambar 8). Berdasarkan penelitian Tan dan Vinh (2011), parameter yang digunakan dalam pelarutan UTJ dari pasir monasit menggunakan microwave
adalah jumlah sampel, konsentrasi pelarut, waktu reaksi, dan daya. Perbandingan jumlah pelarut dan sampel sebesar 5:1 menghasilkan UTJ terlarut sebesar 88.7%, setelah perbandingan itu jumlah UTJ yang terlarut mulai konstan, sehingga pada penelitian ini digunakan perbandingan pelarut dan sampel sebesar 80:1 dan dianggap perbandingan yang telah dapat melarutkan UTJ. Konsentrasi pelarut yang menghasilkan UTJ terlarut dengan baik pada penelitian Tan dan Vinh (2011)
sebesar 12 M untuk pelarut HCl. Hal ini yang mendasari bahwa semakin tinggi konsentrasi pelarut yang digunakan maka semakin banyak UTJ yang berpindah ke pelarut HCl dan pada penelitian ini menggunakan pelarut HCl 37%. Waktu reaksi maksimal yang dihasilkan pada penelitian sebelumnya selama 60 menit dan setelah 60 menit kadar UTJ terlarut konstan. Waktu yang digunakan pada penelitian ini merupakan waktu maksimal alat tersebut, yaitu 30 menit. Daya yang digunakan untuk melarutkan UTJ terbesar pada penelitian ini adalah high sebesar 800 W.
Gambar 8 Kelarutan UTJ pada filtrat hasil ekstraksi dengan HCl 37%
menggunakan microwave oven terhadap contoh fase padat destruksi basah (a) dan destruksi kering (b)
Gambar 9 Perbandingan jumlah kadar UTJ yang terlarut menggunakan
microwave oven terhadap contoh fase padat destruksi basah dan kering pada daya high
Berdasarkan Gambar 9 menunjukkan bahwa ekstraksi UTJ dari contoh fase padat destruksi basah menggunakan pelarut HCl 37% mengakibatkan kadar unsur Eu, Tb, Ho, dan Lu terdeteksi oleh alat setelah perlakuan ekstraksi, sedangkan sebelum perlakuan tidak terdeteksi. Ekstraksi UTJ dari contoh fase padat destruksi kering mengakibatkan kadar unsur Eu dan Tb terdeteksi setelah perlakuan,
13
sedangkan sebelum perlakuan tidak terdeteksi oleh alat XRF serta unsur Pm tidak terdeteksi sebelum dan sesudah perlakuan. Hal ini menunjukkan kemampuan alat ICP-OES yang sifatnya lebih kuantitatif menganalisis sampel UTJ dibandingkan XRF yang sifatnya semikuantitatif. Contoh fase padat destruksi kering dan basah menghasilkan unsur yang dominan dengan kadar tertinggi, yaitu unsur Ce dan La sesuai dengan jumlah unsur tersebut tertinggi sebelum ekstraksi.
Daya yang banyak melarutkan UTJ tersebut digunakan pada tahap selanjutnya pada penelitian ini. Jumlah total UTJ yang terlarut dengan metode basah dan kering pada daya high menghasilkan jumlah masing-masing sebesar 35.72% dan 29.97% (Lampiran 6 dan 7). Hasil kelarutan unsur tanah jarang yang dihasilkan tidak mencapai 100% dikarenakan ada sebagian unsur tanah jarang yang berada pada fase cair ketika proses destruksi NaOH (Gambar 8). Kelarutan UTJ pada contoh fase padat destruksi kering dan basah menghasilkan kelarutan yang terbesar pada unsur praseodimium (Pr) masing-masing sebesar 67.30% dan 63.42% dan menunjukkan bahwa unsur ini memiliki kelarutan yang cukup baik dalam HCl 37% dengan bantuan gelombang mikro. Jumlah yang menghasilkan sebagian besar UTJ terlarut dan kelarutan yang dihasilkan cukup besar, serta hasilnya dapat dibaca oleh alat adalah fase cair (filtrat) hasil destruksi dengan teknik kering (Gambar 8).
Gambar 10 Jumlah kelarutan unsur radioaktif dan non-UTJ
Kelarutan unsur radioaktif dan non-UTJ pada contoh fase padat destruksi basah masih terdapat U dan Th yang terlarutkan cukup banyak dibandingkan fase cair destruksi kering (Gambar 10). Hasil kelarutan contoh fase padat destruksi basah dapat dikatakan kurang memberikan hasil yang baik dibandingkan kelarutan contoh fase padat destruksi kering. Dari hasil kelarutan, jumlah unsur pengotor yang menurun akan menaikkan jumlah UTJ yang terlarut dan akan mempengaruhi hasil pada tahap selanjutnya. Probabilitas keberadaan unsur ketika pelarutan menggunakan HCl 37% sebagai berikut (Tabel 2).
Tabel 2 Probabilitas keberadaan unsur
Fase Unsur
Filtrat air (pencucian residu) P, V, Al, Si, Sn Filtrat HCl 37%
Residu asam
UTJ, Ti, Fe, Mn, Ca, Mg, Zn, U, Th Na, K, Zr, Hf, P, Nb, Cr Sumber: Barnett & Wilson (1953) dan Cotton & Wilkinson (1962).
Pengendapan Unsur Tanah Jarang
Unsur tanah jarang dalam bidang industri memiliki peranan yang cukup penting, oleh karena itu penelitian mengenai UTJ menjadi suatu hal yang cukup penting untuk dilakukan terutama yang terkait dengan pemisahan UTJ dari mineralnya. Teknik pemisahan yang biasa digunakan adalah teknik pemisahan dengan cara reaksi pembentukan kompleks, kristalisasi, resin penukar ion, dan membran cair berpendukung (Soe et al. 2008). Teknik pemisahan dengan cara ini memiliki kekurangan jika diaplikasikan dalam skala industri, seperti biaya yang cukup mahal karena memerlukan banyak proses ulang dan membutuhkan banyak pelarut, serta pembuatan membran yang cukup rumit.
Proses pengendapan merupakan proses pemisahan yang mudah, cepat, dan murah. Prinsip proses ini adalah pemisahan unsur-unsur berdasarkan perbedaan besarnya harga hasil kali kelarutan (solubility product constant/ Ksp). Proses
pengendapan adalah proses terjadinya padatan karena melewati nilai Ksp, yang
harganya tertentu dan dalam keadaan jenuh. Jika harga Ksp kecil atau pKsp besar,
unsur atau senyawa mudah mengendap, sedangkan jika harga Ksp besar atau pKsp
kecil, unsur atau senyawa sulit mengendap. Nilai pKsp dapat memperkirakan pH
terjadinya endapan (Suyanti et al. 2008).
Proses pengendapan yang dilakukan pada penelitian ini menggunakan pelarut NH4OH 2 N. Pelarut NaOH juga dapat digunakan untuk mengendapkan
UTJ, akan tetapi kekurangan dari pelarut ini adalah sulit dalam penanganannya, sehingga dipilih NH4OH yang lebih mudah penanganannya dan harganya lebih
murah. Faktor yang berpengaruh dalam proses pengendapan adalah pH dan konsentrasi pelarut. Penelitian ini menggunakan pelarut NH4OH 2 N didasari atas
penelitian yang dilakukan Arief et al. (2001) yang menyatakan bahwa konsentrasi NH4OH < 2 N mengakibatkan jumlah pereaksi yang diperlukan banyak sehingga
memerlukan waktu yang lama untuk mencapai pH yang diinginkan serta membutuhkan volume tangki pereaksi dan tangki pengendapan yang lebih besar, sedangkan jika konsentrasi NH4OH > 2 N kemungkinan akan terbentuk pengotor
yang diselimuti oleh endapan UTJ(OH)3, sehingga akan bersama-sama
mengendap.
Pada tahap ini UTJ dipisahkan dari U dan Th dengan cara pengendapan pada pH 4, pH 7, dan pH 10 menggunakan larutan NH4OH dari larutan induk
UTJ(Cl)3. Reaksi yang terjadi pada tahap pengendapan ini adalah diubah dalam
bentuk hidroksida, sehingga terjadi pemisahan senyawa yang cukup baik. UTJ(Cl)3(aq) + 3 NH4OH → UTJ (OH)3(s) + 3 NH4Cl
Jumlah total UTJ yang terendapkan paling banyak pada fase cair destruksi basah dan kering terdapat pada pH 10 dengan jumlah masing-masing sebesar 2.76% dan 1.18%. Hal ini sesuai dengan nilai pKsp UTJ yang disajikan pada
Lampiran 2. Nilai pKsp semakin kecil atau semakin besar harga Ksp, konsentrasi
OH- semakin besar dan nilai pOH semakin kecil, sehingga nilai pH untuk mengendapkan UTJ juga semakin besar (Suyanti et al. 2008).
15
Gambar 11 Jumlah UTJ yang mengendap dengan penambahan NH4OH pada
contoh fase cair destruksi kering (a) dan basah (b)
Pengendapan pada fase umpan destruksi kering menghasilkan jumlah endapan unsur tanah jarang terbesar pada pH 10, yaitu unsur Ce sebesar 0.325% dengan nilai pKsp sebesar 19.82. Proses pengendapan UTJ pada penelitian ini
dilakukan secara bertahap dimulai dari pengendapan pada pH 4. Unsur tanah jarang pada pH 4 hampir tidak terbentuk semua, hal ini disebabkan pengendapan UTJ akan terbentuk endapan jika pH > 7 (Lampiran 8). Unsur yang paling banyak mengendap pada pH 7 adalah Y, diikuti oleh unsur Ce, Nd, Yb, dan La (Gambar 11). Menurut Bjerrum et al. (1958) dan dari data pKsp dalam bentuk
hidroksida, Lu akan mengendap lebih dahulu dibandingkan unsur-unsur tanah jarang lainnya, akan tetapi pada pH 7 ini Lu tidak terbentuk.
Hal ini disebabkan jumlah Lu dalam umpan sangat kecil dan jumlah ini sebesar 0.09% dan hampir mendekati jumlah unsur Eu sebesar 0.00% dan Tm sebesar 0.06%. Unsur Pm tidak terbentuk endapan karena pada fase umpan unsur ini tidak terdeteksi, sedangkan unsur Tb dan Ho tidak terbentuk endapan pada pH 7 karena pada pH ini unsur tersebut belum terbentuk (Lampiran 8). Unsur paling banyak mengendap pada pH 10 adalah unsur Ce diikuti oleh unsur Y, Nd, La, Pr, Gd, Dy, Sm, Er, dan Yb, sedangkan unsur Eu,Tb, Ho, Tm, dan Lu tidak terdeteksi setelah perlakuan, serta unsur Pm tidak terdeteksi sebelum dan sesudah perlakuan (Gambar 14). Berdasarkan nilai Ksp unsur Nd seharusnya mengendap lebih dahulu
dibanding unsur Y, hal ini disebabkan unsur Y pada fase umpan memiliki jumlah yang besar dibandingkan unsur Nd. Fase umpan yang ditambahkan NH4OH akan
menghasilkan endapan yang kemungkinan besar berbentuk endapan hidroksida berupa endapan gelatin berwarna putih kekuningan. Endapan yang kaya akan unsur tanah jarang pada pH 10 disajikan pada Gambar 12.
Gambar 12 Endapan pH 10 dari contoh fase cair destruksi kering
Gambar 14 Jumlah UTJ, non-UTJ, dan unsur radioaktif yang mengendap pada pH 10 terhadap fase umpan destruksi basah dan kering
Pengendapan fase umpan destruksi basah menghasilkan jumlah endapan unsur tanah jarang terbesar pada pH 10, yaitu unsur Ce sebesar 1.43% (Lampiran 9). Proses pengendapan pada pH 4 tidak menghasilkan endapan, sehingga jumlah unsur radioaktif dan non-UTJ yang dihasilkan lebih besar dibandingkan endapan fase umpan destruksi kering (Gambar 14). Unsur tanah jarang pada pH 7 yang menghasilkan jumlah endapan terbesar, yaitu unsur Ce diikuti oleh unsur Nd, La, Pr, Y, Sm, dan Gd (Gambar 11). Berdasarkan data pKsp
unsur Pr seharusnya mengendap terlebih dahulu dibandingkan unsur Ce, Nd dan La, hal ini disebabkan jumlah unsur Pr pada fase umpan lebih kecil, yaitu sebesar 4.72% sedangkan unsur Sm dan Gd belum sempurna membentuk endapan pada pH ini. Unsur tanah jarang pada pH 10 menghasilkan jumlah endapan terbesar, yaitu unsur Ce diikuti oleh Nd, La, Pr, Y, Sm, Gd, dan Dy (Gambar 14). Jumlah ini meningkat seiring dengan jumlah unsur yang mengendap pada pH sebelumnya.
Ketidaksesuaian nilai pKsp dan pH terhadap jumlah yang terkandung pada
unsur disebabkan oleh larutan fase umpan yang akan diendapkan terdapat unsur-unsur logam tanah jarang yang lain, sehingga menyebabkan penurunan kelarutan unsur tersebut dalam endapan. Besarnya kelarutan berbanding lurus dengan besarnya hasil kali kelarutan atau Ksp. Unsur-unsur tanah jarang lain yang
ada dalam larutan akan mempercepat terbentuknya endapan, sehingga pH larutan masih rendah di bawah pH hasil perhitungan. Salah satu unsur tersebut adalah serium (Ce) mempunyai pKsp sebesar 19.82 dan akan mengendap pada pH 8.69.
Akan tetapi pada pH sebelum 8, unsur tersebut sudah terbentuk dan memiliki jumlah terbesar dengan fase umpan destruksi basah (Gambar 11). Warna endapan yang dihasilkan pada pH 7 hampir sama dengan pH 10. Hasil endapan tersebut disajikan pada Gambar 13.
Gambar 13 Endapan pH 7 dan pH 10 dari contoh fase cair destruksi basah
pH 7 pH 10
17
terhadap contoh sebelum perlakuan
Jumlah unsur radioaktif dan non-UTJ yang juga merupakan unsur pengganggu atau pengotor bagi UTJ terbesar dihasilkan pada hasil pengendapan contoh fase umpan destruksi basah, seperti unsur Si, Al, Ca, Ti, Fe, P, dan Th (Gambar 14). Endapan dari fase umpan destruksi kering mengandung unsur radioaktif seperti uranium dengan jumlah sebesar 0.0012% atau 12 ppm, sedangkan torium tidak terdeteksi. Jumlah ini lebih kecil dibandingkan penelitian yang dilakukan oleh Arief et al. (2001) yang menghasilkan kadar uranium pada pH 9.6 sebesar 18.38 ppm dan masih mengandung torium sebesar 24.03 ppm. Endapan ini juga mengandung unsur non-UTJ yang menunjukkan unsur Si yang berkurang dan tidak terdapat unsur P pada endapan, sehingga hasil endapan unsur tanah jarang ini dapat dikatakan berhasil dipisahkan dari unsur radioaktif dan pengotornya, sehingga UTJ dapat diperkaya.
Endapan dari fase umpan destruksi basah mengandung unsur radioaktif seperti torium yang cukup tinggi sebesar 0.0335% atau 335 ppm, sedangkan uranium tidak terdeteksi. Jumlah ini lebih besar dibandingkan penelitian yang dilakukan oleh Arief et al. (2001) yang menghasilkan kadar torium pada pH optimum terbentuknya UTJ sebesar 24.03 ppm. Endapan ini juga mengandung unsur non-UTJ yang menunjukkan unsur Si yang cukup tinggi bagi unsur non-UTJ sebesar 0.0375% dan unsur P dengan jumlah sebesar 0.00048%, sehingga pemisahan UTJ dari unsur non-UTJ dan radioaktif yang merupakan pengotor dapat dikatakan masih belum berhasil dibandingkan hasil endapan UTJ dari fase umpan destruksi kering.
Persen Keberhasilan Perolehan UTJ Melalui Proses Destruksi, Ekstraksi, dan Pengendapan
Penentuan persen keberhasilan perolehan UTJ diperoleh dari nilai perolehan kembali (recovery). Persen perolehan kembali (%recovery) bertujuan untuk mengetahui berapa banyak komponen yang dianalisis dapat hilang akibat proses preparasi, sehingga dapat menyatakan keakuratan metode yang digunakan. Semakin besar persen recovery, artinya semakin sedikit komponen yang hilang akibat preparasi yang dilakukan dan semakin efektif proses perlakuan yang diberikan tersebut. Menurut Harmita (2004), penentuan persen recovery dapat dilakukan dengan menambahkan sejumlah tertentu analit ke dalam sampel, kemudian diperiksa dengan metode analisis. Hasil tersebut kemudian dibandingkan dengan hasil analisis tanpa penambahan analit. Persen recovery ini dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil sebenarnya.
(b)
Unsur La, Ce, Pr, Nd, Sm perolehan, Gd, dan Dy menunjukkan persen
recovery terbesar pada endapan destruksi basah, sedangkan unsur Y menghasilkan persen recovery terbesar pada endapan destruksi kering (Gambar 15). Hasil ini disebabkan unsur Y pada endapan destruksi kering ketika proses ekstraksi memiliki jumlah unsur dalam filtrat lebih tinggi (0.0522 g) dibandingkan dengan destruksi basah (0.0079 g) (Lampiran 10). Nilai persen recovery pada fase padat destruksi basah lebih besar dibandingkan contoh fase padat destruksi kering disebabkan hasil proses awal contoh ini, yaitu destruksi menghasilkan massa unsur yang meningkat dibandingkan sebelum perlakuan. Oleh karena itu, pada proses ini tidak dapat dikatakan bahwa keseluruhan proses pada contoh fase padat destruksi basah lebih akurat dibandingkan contoh fase padat destruksi kering.
Kedua contoh fase padat terhadap keseluruhan proses memberikan persen perolehan UTJ yang kurang baik. Namun nilai recovery unsur non-UTJ dan radioaktif lebih besar pada contoh fase padat destruksi basah dibandingkan contoh destruksi kering, sehingga dapat dikatakan sedikit unsur pengotor yang hilang pada proses tersebut. Menurut Harvey (2000), persen recovery baik bila hasil > 90%. Nilai persen recovery yang kecil ini dipengaruhi oleh proses awal (destruksi) yang membutuhkan wadah yang tahan terhadap pelarut basa.
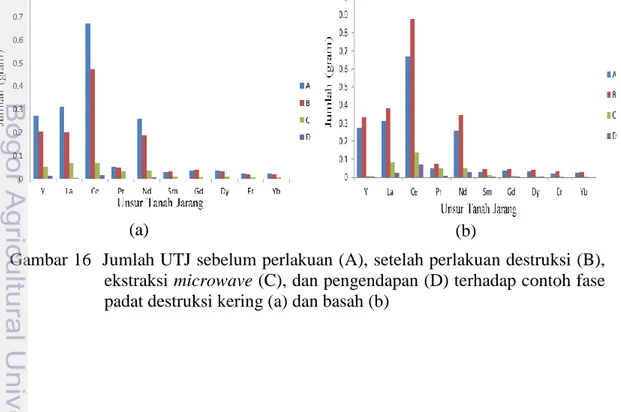
Keseluruhan proses pada kedua contoh fase padat ini menunjukkan bahwa unsur Pm tidak terdapat pada pasir monasit. Jumlah massa unsur selama perlakuan mengalami penurunan dari sebelum perlakuan, kecuali destruksi basah. Namun, setelah perlakuan ekstraksi unsur pada fase padat destruksi basah mengalami penurunan massa (Gambar 16). Hal ini dapat ditunjukkan dari jumlah unsur Ce sebelum perlakuan sebesar 0.6725 g setelah perlakuan destruksi basah jumlah ini meningkat menjadi 0.8775 g (Lampiran 11). Proses awal ini memberikan hasil yang menyimpang dari hukum kekekalan massa yang sering disebut hukum Lomonosov-Lavoisier yang menyatakan bahwa tidak ada penambahan atau pengurangan massa zat dalam reaksi (massa zat kekal/tetap), sehingga massa zat-zat hasil reaksi sama dengan massa zat-zat-zat-zat yang bereaksi (Beiser 1987) .
Gambar 16 Jumlah UTJ sebelum perlakuan (A), setelah perlakuan destruksi (B), ekstraksi microwave (C), dan pengendapan (D) terhadap contoh fase padat destruksi kering (a) dan basah (b)
19
Kenaikan massa ini disebabkan banyak unsur yang hilang setelah perlakuan, yaitu Mn, Nb, serta UTJ seperti Tb, Ho, Tm dan Lu, sedangkan unsur-unsur tersebut pada hasil destruksi kering dan sebelum perlakuan terdeteksi (Lampiran 4). Unsur ini dianalisis menggunakan XRF dan memberikan jumlah total unsur yang dianalisis seluruhnya 100%. Hasil proses destruksi basah menunjukkan unsur-unsur tersebut tidak terdeteksi, sehingga unsur-unsur yang terdeteksi akan naik agar jumlah total unsur dalam sampel tersebut 100%. Jumlah unsur hasil detruksi kering memberikan penurunan massa, akan tetapi hasil ini tidak menyimpang dari hukum Lomonosov-Lavoisier. Hal ini disebabkan ada unsur yang terikut selama pencucian dengan akuades, sehingga terjadi penurunan massa.
Keseluruhan proses ini mampu memperkaya UTJ dari unsur-unsur pengotornya dengan hasil akhir pengendapan contoh hasil destruksi basah mengandung unsur Th sebesar 0.0017 g dan tidak mengandung unsur U, sedangkan jumlah endapan pada contoh hasil destruksi kering mengandung unsur U yang sangat kecil sebesar 0.00006 g dan tidak mengandung unsur Th. Pernyataan tentang hasil analisis diatas hanya bersifat relatif yang membandingkan proses destruksi terbuka dengan teknik destruksi kering dan basah. Namun jika dihubungkan pada keadaan nyata atau dalam skala industri, hasil akhir endapan UTJ dari keseluruhan proses masih belum dapat diaplikasikan dalam bidang industri karena banyak kehilangan unsur target (UTJ), sehingga keseluruhan tahapan proses (metode) ini belum selektif dan efektif untuk menghasilkan UTJ dalam skala besar. Pernyataan ini ditunjukkan pada Lampiran 12.
SIMPULAN DAN SARAN
Simpulan
Contoh pasir monasit hasil samping timah memiliki jumlah total UTJ sebesar 34.31%, selebihnya unsur radioaktif dan non-UTJ. Tahap awal pengayaan UTJ dilakukan melalui dua teknik destruksi, yaitu destruksi kering dan basah. Jumlah total UTJ yang dihasilkan pada perlakuan dengan teknik destruksi kering dan basah masing-masing sebesar 25.56% dan 44.30%. Tahap kedua, yaitu ekstraksi UTJ dengan HCl 37% menggunakan microwave dengan daya high
selama 30 menit. Kadar total UTJ pada contoh fase cair destruksi kering dan basah masing-masing sebesar 29.97% dan 35.72%. Kelarutan terbesar UTJ dalam fase padat destruksi kering dan basah terdapat pada unsur praseodimium (Pr) masing-masing sebesar 67.30% dan 63.42%. Tahap selanjutnya untuk pengayaan unsur tanah jarang dari unsur radioaktif dan non-UTJ dengan cara pengendapan dengan pH terbaik pada pH 10. Jumlah total UTJ yang terendapkan pada fase umpan destruksi kering dan basah masing-masing sebesar 1.18% dan 2.76%. Hasil ini tidak jauh berbeda, namun proses pengendapan yang efektif dalam pengayaan UTJ dengan berkurangnya unsur pengotor, yaitu fase umpan dengan teknik destruksi kering. Hal ini sesuai dengan nilai persen recovery unsur non-UTJ dan radioaktif yang lebih kecil dibandingkan fase umpan dari destruksi
basah, akan tetapi mengandung unsur U dalam jumlah sedikit sebesar 0.00006 g dan tanpa unsur Th. Jumlah total UTJ yang dihasilkan dari keseluruhan proses (metode) belum efektif menghasilkan UTJ dalam skala industri.
Saran
Penelitian lebih lanjut diperlukan dalam penggunaan leaching agent selain NaOH yang dapat melepaskan unsur pengotor tanpa terikutnya unsur target (UTJ). Optimasi dengan variasi yang lebih banyak untuk melarutkan UTJ menggunakan pelarut lain yang lebih efektif untuk menentukan kondisi yang optimal. Penggunaan variasi konsentrasi NH4OH untuk mengendapkan UTJ serta
variasi pH pengendapan optimum UTJ.
DAFTAR PUSTAKA
Arief ER, Susilaningtyas, Widowati, Sumiarti. 2001. Pengolahan bijih uranium asal rirang: pengendapan RE dari larutan RE(Cl)3. Di dalam: P2TBDU,
editor. Prosiding Presentasi Ilmiah Daur Bahan Bakar Nuklir VI; Jakarta, 7-8 November 2001. Jakarta (ID): BATAN. hlm 55-60.
Bjerrum, Schwarzenbach, Sillen. 1958. Stability Constants of Metal Complexes.
London (GB): Chemical Soc.
Beiser A. 1987. Concepts of Modern Physics, Fourth Edition. New York (US): McGraw-Hill.
Barret SD, Dhesi SS. 2001. The Structure of Rare Earth Metal Surfaces. London (GB): Imperial Coll Pr.
Calkins GD, Worthington, Ohio, penemu; United Stated of America. Method of processing monazite sand. US patent 2 811 411. 29 Okt 1957.
Cotton FA, Wilkinson G. 1962. Advanced Inorganic Chemistry: A Comprehensive Text. London (GB): J Willey.
Cotton S. 2006. Lanthanide and Actinide Chemistry. Uppingham (US): J Wiley. Cotton FA, Wilkinson G. 2007. Kimia Anorganik Dasar. Suharto S, penerjemah;
Koestoer YRA, editor. Jakarta (ID): UI-Pr. Terjemahan dari: Basic Inorganic Chemistry.
Fatimah S, Indaryati S, Haryati I. 2009. Pengaruh thorium terhadap analisis uranium menggunakan spektrofotometer UV-VIS. Di dalam: PTBN, editor.
Prosiding Seminar Pengelolaan Perangkat Nuklir; Serpong, 19 Agustus 2009. Jakarta (ID): BATAN. hlm 1-6.
Gupta CK, Krishnamurthy N. 2004. Extractive Metallurgy of Rare Earths. Washington DC (US): CRC Pr.
Harvey D. 2000. Modern Analytical Chemistry. New York (US): McGraw-Hill. Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya.
Farmasi 1(3):117-135. Tersedia dari:
http://jurnal.farmasi.ui.ac.id/pdf/2004/v01n03/Harmita010301.pdf.
Herman DZ. 2009. Tinjauan kemungkinan sebaran unsur tanah jarang (REE) di lingkunan panas bumi (contoh kasus panas bumi Dieng, Jawa Tengah).
21
J Geo Indones 4: 1-8. Tersedia dari: http://
www.bgl.esdm.go.id/bv.41524429,d.bmk.full.pdf+html.
Indaryati S, Haryati I, Yanlinastuti. 2008. Uji fungsi alat thermal gravimetric differential thermal analysis. Di dalam: PTBN, editor. Prosiding Seminar Pengelolaan Perangkat Nuklir; Serpong, 29 Juli 2008. Jakarta (ID): BATAN. hlm 67-69.
Ichsan N. 2012. Destruksi hasil samping penambangan timah Belitung menggunakan microwave untuk ekstraksi unsur tanah jarang [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kanazawa Y, Kamitani M. 2006. Rare earth minerals and resources in the world.
J Alloy Comp.408-412:1339-1343. doi: 10.1016/j.jallcom.2005.04.033. Khaldun I. 2009. Pemisahan unsur-unsur tanah jarang dari pasir monasit Bangka
dengan metode Solvent Impregnated Resin (SIR) [disertasi]. Bandung (ID): Program Doktor, Institut Teknologi Bandung.
Kappe CO, Dallinger D, Murphree SS. 2009. Practical Microwave Synthesis for Organic Chemists. London (GB): J Willey.
Lu A, Zhang S, Shan X, Wang S, Wang Z. 2003. Application of microwave extraction for the evaluation of bioavaibility of rare earth elements in soil.
Chemosphore 53:1067-1075. Tersedia dari:
http://144.206.159.178/ft/166/198519/5063272.pdf.
Mulyani O. 2007. Studi perbandingan cara destruksi basah pada beberapa contoh tanah asal aliran sungai Citarum dengan metode konvensional dan bom
teflon [tesis]. Bandung (ID): Institut Teknologi Bandung.
Pratiwi F. 2012. Pengembangan metode destruksi unsur tanah jarang dari tailing
pasir timah pulau Bangka [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Spedding FH, Daane AH. 1961. The Rare Earth Elements. New York (US): J Willey.
Susilaningtyas, Zahardi, Pudjianto R, Erni RA. 2000. Pengolahan bijih uranium asal rirang: pemisahan LTJ dari hasil digesti basa. Di dalam: P2TBDU dan P2BGN, editor. Prosiding Presentasi Ilmiah Bahan Bakar Nuklir V; Jakarta, 22 Februari 2000. Jakarta (ID): BATAN. hlm 94-101.
Sulaeman A, Buchari, Mardiana U. 2006. Pemisahan serium dari mineral monasit dengan teknik SLM bertingkat. J Kimia Indones 1: 1-6. Tersedia dari: http://journal.kimiawan.org/index.php/jki/article/view/1.
Senovita R. 2008. Optimasi destruksi mineral monasit Bangka untuk pemungutan unsur tanah jarang [skripsi]. Bandung (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Bandung.
Soe NN, Shwe LT, Lwin KT. 2008. Study on extraction of ceric oxide from monazite concentrate. Prosiding of World Academy Science, Engineering and Technology. hlm 142-145.
Suyanti, Purwani MV, Muhadi AW. 2008. Peningkatan kadar neodimium secara proses pengendapan bertingkat memakai amonia. Di dalam: Pusat Teknologi Akselator dan Proses Bahan, editor. Prosiding Seminar Nasional IV SDM Teknologi Nuklir; Yogyakarta, 25-26 Agustus 2008. Yogyakarta (ID): BATAN. hlm 429-438.
Suprapto SJ. 2009. Tinjauan tentang unsur tanah jarang. Makalah Ilmiah. Buletin Sumber Daya Geologi, Vol 4, No 1.
Suyanti, Aryadi 2011. Ekstraksi torium dari konsentrat Th, LTJ (hidroksida) menggunakan solven bis-2-etil heksil fosfat. Di dalam: Pusat Teknologi Akselator dan Proses Bahan, editor. Prosiding Seminar Penelitian dan Pengelolaan Perangkat Nuklir; Yogyakarta, 27 Juli 2011. Yogyakarta (ID): BATAN. hlm 40-47.
Tan VV, Vinh TTC. 2011. Recovery of the total oxides of rare earth from monazite in Quang Nam. J Sci 69: 101-106. Tersedia dari: http://www.hueuni.edu.vn/hueuni/issue_file/69_11.pdf.
Unal S. 2007. Preconcentration of rare earth elements (REE) using silica gel modified with several functional groups [tesis]. Graduate School of Engineering and Sciences, Institute of Technology.
Wasito B, Biyanto D. 2009. Optimasi Proses Pembuatan Oksida Logam Tanah Jarang dari Pasir Senotim dan Analisis Produk dengan Spektrometer Pendar Sinar-X. Yogyakarta (ID): BATAN.
23
- monasit : NaOH (1:6) dalam cawan krus besi
- dilebur dengan pembakar gas - peleburan di tanur suhu 700 °C
(2 jam), 800 °C (2 jam), diambil dan didinginkan
- + 250 mL akuades panas
- diendaptuang, fase padat dilakukan pencucian dengan akuades panas (250 mL) hingga pH 13
- + 1 g sampel endapan
- + HCl 37% (80 mL) dalam labu bulat - Ekstraksi menggunakan microwave - t = 30 menit
- P = high, medium, low
- Volume pelarut sisa diukur - diendaptuang
Analisis denganICP-OES Lampiran 1 Bagan alir penelitian
digerus, diayak 200 mesh
Destruksi kering Destruksi basah
- 30 gram sampel
- + 300 mL NaOH 50% dalam labu kjehdal
- dibakar menggunakan pembakar bunsen hingga kering
- setelah hampir kering + NaOH 50% (300 mL)
- setelah hampir kering, tuang ke gelas piala
- pencucian + 1600 mL akuades panas hingga pH 7
Fase padat I dan fase padat II
Fase cair Fase cair
- Dikeringkan menggunakan oven - Analisis dengan XRF
Ekstraksi unsur tanah jarang
Fase cair I dan Fase cair II Fase padat
Pengendapan unsur tanah jarang
MONASIT
25 - Endapan pH 10 - Analisis dengan XRF - + NH4OH 2 N hingga pH 7 - Dikocok menggunakan sentrifus, 5000 rpm selama 30 menit - + NH4OH 2 N hingga pH 10 - Dikocok - menggunakan sentrifus, 5000 rpm selama 30 menit - + NH4OH 2 N hingga pH 7 - Dikocok menggunakan sentrifus,5000 rpm selama 30 menit - Endapan pH 7 - Analisis dengan XRF - + NH4OH 2 N hingga pH 10 - Dikocok menggunakan sentrifus, 5000 rpm selama 30 menit - Endapan pH 10 - Analisis dengan XRF Lanjutan
Pengendapan unsur tanah jarang
Fase cair destruksi kering - 50 mL filtrat - + NH4OH 2 N hingga pH 4 - Dikocok menggunakan sentrifus, 5000 rpm selama 30 menit
Fase cair destruksi basah
- Endapan pH 4 - Analisis dengan XRF
Fase cair sisa pH 7
- Endapan pH 7 - Analisis dengan XRF
Fase cair sisa pH 10 Fase cair sisa pH 4
Fase cair sisa pH 7
Lampiran 2 Sifat-sifat unsur tanah jarang Z Nama Lambang Konfigurasi
elektron Valensi
Jari-jari
M3+ (Å) Warna M
3+
pKSp pH
39 Itrium Y [Kr]4d15s2 3 0.88 Tak berwarna 22.00 8.14 57 Lantanum La [Xe]5d16s2 3 1.06 Tak berwarna 22.30 8.07 58 Serium Ce [Xe]4f15d1 6s2 3, 4 1.03 Tak berwarna 19.82 8.69 59 Praseodimium Pr [Xe]4f36s2 3, 4 1.01 Hijau 23.45 7.78
60 Neodimium Nd [Xe]4f46s2 3 0.99 Lila 21.49 8.27
61 Prometium Pm [Xe]4f56s2 3 0.98 Merah jambu 21.00 8.39 62 Samarium Sm [Xe]4f66s2 2, 3 0.96 Kuning 22.08 8.12 63 Europium Eu [Xe]4f76s2 2, 3 0.95 Merah jambu
pucat
23.03 7.89 64 Gadolinium Gd [Xe]4f75d 6s2 3 0.94 Tak berwarna 22.74 7.96 65 Terbium Tb [Xe]4f96s2 3, 4 0.92 Merah jambu
pucat
21.70 8.22
66 Disprosium Dy [Xe]4f106s2 3 0.91 Kuning 21.85 8.18
67 Holmium Ho [Xe]4f116s2 3 0.89 Kuning 22.30 8.09
68 Erbium Er [Xe]4f126s2 3 0.88 Lila 23.39 7.80
69 Tulium Tm [Xe]4f136s2 3 0.87 Hijau 23.48 7.78
70 Iterbium Yb [Xe]4f146s2 2, 3 0.86 Tak berwarna 23.60 7.74 71 Lutetium Lu [Xe]4f145d 6s2 3 0.85 Tak berwarna 23.72 7.71
27
Jumlah unsur lantanum = × oksida La2O3 = × 7.27% = 6.20%
Lampiran 3 Hasil analisis komposisi contoh sebelum perlakuan menggunakan XRF
No Oksida Jumlah (%) Unsur Jumlah (%)
1 SiO2 13.04 Si 6.10 2 TiO2 5.11 Ti 3.06 3 Al2O3 2.66 Al 1.41 4 Fe2O3 2.29 Fe 1.60 5 MnO 0.0965 Mn 0.0747 6 CaO 0.150 Ca 0.107 7 MgO - Mg - 8 Na2O 0.195 Na 0.144 9 K2O - K - 10 P2O5 19.52 P 8.52 11 S 0.0286 S 0.0286 12 LOI 0.44 - - 13 PbO 0.320 Pb 0.0297 14 ZrO2 10.26 Zr 7.60 15 HfO2 0.140 Hf 0.119 16 Gd2O3 0.838 Gd 0.727 17 Y2O3 6.95 Y 5.47 18 Nb2O5 0.0604 Nb 0.0422 19 Nd2O3 6.07 Nd 5.20 20 ThO2 3.72 Th 3.27 21 U3O8 0.230 U 0.195 22 La2O3 7.27 La 6.20 23 Lu2O3 0.0586 Lu 0.0515 24 Yb2O3 0.530 Yb 0.465 25 Er2O3 0.509 Er 0.445 26 Pr6O11 1.26 Pr 1.04 27 Dy2O3 0.779 Dy 0.679 28 Sm2O3 0.678 Sm 0.585 29 CeO2 16.52 Ce 13.45 30 SnO2 0.530 Sn 0.418 Contoh perhitungan
Lampiran 4 Hasil analisis komposisi contoh dengan perlakuan destruksi kering dan basah menggunakan XRF
No Oksida Jumlah (%)
Destruksi Kering Destruksi Basah
1 SiO2 1.51 6.25 2 TiO2 2.80 5.07 3 Al2O3 0.244 25.66 0.0228 0.0982 - 18.09 - 0.343 - 12.24 - - 4.88 0.0660 - 0.0547 2.73 0.161 0.221 - 5.23 4.72 11.68 0.745 4.39 - 1.16 - 0.883 0.121 0.765 0.138 0.433 0.0378 0.484 0.0448 1.97 4 Fe2O3 1.77 5 MnO - 6 CaO 0.22 7 MgO - 8 9 Na2O K2O 0.934 - 10 P2O5 7.64 11 SO3 - 12 LOI 5.16 13 NiO 0.146 14 PbO - 15 16 ZrO2 HfO2 12.00 0.269 17 Cl - 18 Nb2O5 - 19 ThO2 4.00 20 U3O8 0.189 21 SnO2 0.694 22 MoO3 0.136 23 Y2O3 8.48 24 La2O3 9.00 25 CeO2 21.55 26 Pr6O11 1.80 27 28 Nd2O3 Pm2O3 8.09 - 29 Sm2O3 1.04 30 Eu2O3 - 31 Gd2O3 1.08 32 Tb4O7 - 33 Dy2O3 1.00 34 Ho2O3 - 35 Er2O3 0.742 36 Tm2O3 - 37 Yb2O3 0.683 38 Lu2O3 -