Seminar Nasional Teknologi Proses Kimia VII
1
Oxidative Dehidrogenasi Etana Menjadi Etilen Menggunakan Katalis
B2O3/Al2O3 : Pengaruh Kandungan Boron Oksida
Setiadi
Research Group of Chemical Reaction Engineering and Catalysis, Departemen Teknik Kimia,Fakultas Teknik, Universitas Indonesia, Kampus UI, Depok – 16434, Indonesia, e-mail : setiadi@che.ui.edu
Abstrak
Etilena sebagai building block compounds merupakan bahan baku yang sangat penting bagi industri petrokimia. Senyawa olefin ini dapat diolah menjadi berbagai produk-produk petrokimia hilir seperti plastik, resin, fiber dan lain-lain. Senyawa etilen dapat diperoleh dari senyawa etana baik melalui reaksi secara katalitik maupun non katalitik( thermal cracking). Penelitian ini mengkaji tentang sintesa etilena yang dilakukan melalui reaksi katalitik dehidrogenasi etana dengan menggunakan katalis boron oksida yang didispersikan pada permukaan penyangga Al2O3. Katalis
B2O3 /Al2O3 dengan berbagai variasi kandungan B2O3 dipreparasi dengan metode impregnasi. Hasil yang diperoleh menunjukkan bahwa dengan menaikkan kadar B2O3 dalam material katalis pada
rentang 0 ~15 % berat, katalis semakin mampu menghambat reaksi oksidasi total etana dan menekan terentuknya gas CO dan CO2. Pada rentang B2O3 antara 15- 30 % berat, kenaikkan komposisi B2O3
semakin menaikkan efektivitas katalis dan mencapai maksimal di sekitar 30 % B2O3 /Al2O3, walaupun
luas permukaannya (70 m2/g) jauh lebih kecil dibanding luas permukaan Al2O3 murni (250 m2/g). Hal ini sangat terkait dengan tingginya pembentukan inti aktif katalis untuk reaksi dehidrogenasi etana menjadi etilena, yang sangat dimungkinkan adalah berupa spesies peroksida. Diperkirakan spesies tersebut spesi peroksida yang terbentuk pada bidang kontak antar partikel B2O3 dengan permukaan
YSZ. Spesies ini merupakan bentuk interaksi secara kimia anatara kedua oksida tersebut. Dan B2O3
jelas bukan merupakan inti aktif katalis yang sebenarnya dari reaksi dehidrogenasi etana. Terbukti dengan penambahan B2O3 yang berkelebihan (> 30 %), membuat kinerja katalis menjadi menurun.
Penambahan yang semakin berkelebihan tersebut menyebabkan spesi peroksida yang terbentuk akan terselimuti dan tertutupi oleh partikel B2O3.
Abstract
The most petrochemical feedstock used is ethylene. This precursor may transform to be downstream petrochemial products e.g. plastic, resin, fiber, etc. Ethylene can be prepared by the ethane dehidrogenation reaction through the catalytically reaction or non catalytically reaction ( thermal cracking). This study focuses on the ethylene synthesis which employs the ethane dehydrogenation reaction by using catalyst of boron oxide (B2O3 ) dispersed on the surface of Al2O3 support. The
various content of boron oxide were prepared by impregnation methode.
The results showed that the increasing of B2O3 in the range 0-15 %, B2O3 /Al2O3 catayst can inhibit
the total oxidation of ethane and suppress the formation of gaseous CO and CO2. In the range of 15-30 % B2O3 contents, the increasing of B2O3 leads to increasing the catalytic performance, and the highest
performance obtained at 30 % B2O3 /Al2O3., eventhougt its surface area (70 m2/g) was much lower than
the /Al2O3 itself (250 m2/g). This result is strong correlated to catalytic active site formation which is
higher concentration along with the increasing of B2O3 contents. This active site is believed to
peroxide species, which is the result of the chemically interaction between B2O3 and Al2O3 particles at
the contact surface between those particles. Naturally, B2O3 was not the actual active site for the
dehydrogenation of ethane to be ethylene. This is due to the excees B2O3 (more than 30 %) will
decrease the activity of catalyst, and its presence at the surface of catalyst makes the peroxide sites could cover and block by this particles.
1. Pendahuluan
System katalis B2O3 – Al2O3 merupakan katalis yang cukup menarik dan jarang untuk dilakukan penelitian.
B2O3 merupakan padatan yang bersifat asam sedangkan Al2O3 merupakan padatan yang dapat berfungsi sebagai
konduktor ion. B2O3 mempunyai ukuran partikel yang cukup kecil sedanngkan Al2O3 mempunyai luas
permukaan yang cukup besar (± 2505 m2
/g), sehingga partikel padatan B2O3 dapat terdispersi secara baik pada
permukaan padatan Al2O3. Sehingga keterpaduan oksida tersebut, keberadaan masing-masing oksida
diharapkan saling mendukung sehingga diharapkan menjadi katalis yang effektif dan efisien dalam reaksi parsial oksidasi.
Kinerja katalis B2O3-YSZ telah dikaji dalam reaksi oksidasi parsial metana (1). Hasil penelitian
menunjukkan bahwa kadar B2O3 memberikan pengaruh pada sifat katalitik padatan B2O3-YSZ yang sangat jauh
berbeda bila diperbandingkan antara 2 reaksi yang dikerjakan. Pada reaksi oksidasi parsial metana(2), teramati bahwa padatan Al2O3 (tanpa kandungan B2O3) merupakan katalis yang sangat aktif untuk reaksi oksidasi
sempurna metana. Namun penamabahan B2O3 yang sedikit (± 2 % wt) dalam material katalis, mengakibatkan
penurunan aktivitasnya secara drastik. Sebaliknya, penambahan tersebut dapat mengarahkan menuju produk senyawa reaksi parsial oksidasi (etana, etilen dan formal dehida) yang semakin meningkat. Atau dengan kata lain penambahan B2O3 dapat merubah perilaku katalis dari semula berkinerja tinggi dalam reaksi oksidasi metana
Seminar Nasional Teknologi Proses Kimia VII
2
sempurna menjadi semakin mampu untuk menahan terjadinya reaksi oksidasi sempurna dan mengarah padamenjadi oksidasi parsial(3). Telah dijelaskan (1) bahwa fenomena-fenomena tersebut dapat dijelaskan bahwa inti aktif untuk reaksi oksidasi sempurna metana mengalami kehancuran akibat adanya penambahan B2O3 pada
permukaan YSZ. Dan disamping itu terbentuk inti aktif untuk reaksi oksidasi parsial metana, namun diperkirakan jumlahnya sangat sediktit.
Pada penelitian ini dicoba untuk mengupas inti aktif yang sebenarnya untuk reaksi dehidrogenasi etana menjadi etilin. Mengkonfirmasikan apakah reaksi dehidrogenasi terjadi melalui reaksi katalitik dengan menggunkan katalis B2O3- Al2O3 ataukah dengan terjadi pada reaksi fasa gas (rekasi pirolisa). Serta
menguraikan mengapa terjadi perbedaan besar antara hasil reaksi oksidasi metana dengan etana dilihat dari prediksi inti aktifnya.
2. Metode Penelitian Preparasi Material Katalis
Material katalis yang digunakan adalah berupa padatan yang mengandung boron oksida dan Al2O3. YSZ
(yttria-stabilized zirconia) merupakan padatan yang kandungan utamanya adalah zirkonia, dengan ditambahakan 8 %mol yttria. Sedangkan boron oksida diperoleh dari asam borat (H3BO3) sebagai precursor oksida tersebut.
Preparasi katalis dilakukan dengan metode impregnasi dengan langkah yang dapat diuraikan sebagai berikut : menyiapkan larutan asam borat dengan melarutkan padatan asam borat padat yang telah terukur masanya ke dalam air bebas mineral ( deionized water) yang dijaga pada suhu 75 oC agar padatan terlarut sempurna. Larutan tersebut digunakan untuk mengimpregnasi padatan Al2O3 dengan cara membubuhkan padatan tersebut.
Sambil diaduk dan dijaga suhunya (± 80 o
C) sehingga pelarut air teruapkan semuanya dan mengering, didapatkan padatan yang merupakan campuran asam padat borat – Al2O3. Untuk mendapatkan campuran B2O3-
Al2O3, padatan dikalsinasi pada kondisi atmosferik secara berurutan pada suhu 300 oC dan 750 oC
masing-masing selama 2 jam. Padatan hasil kalsinasi tersebut sudah dapat digunakan untuk karakterisasi maupun diuji sifat katalitiknya terhadap reaksi dehidrogenasi etana.
Pengujian kinerja katalitik
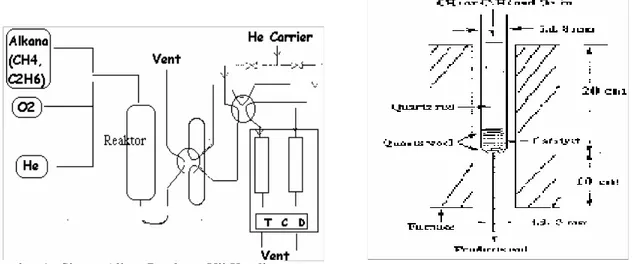
Reaksi dehidrogenasi etana dilaksanakan pada tekanan atmosferik menggunakan reaktor unggun tetap beraliran kontinyu, yang terbuat dari bahan quartz. Katalis dengan massa yang telah tertimbang ditata dalam reaktor tersebut dengan menggunakan quartz wool (lihat gambart 1). Untuk mengkondisikan suhu, reaktor dimasukkan ke dalam tungku listrik bentuk silinder dengan diupayakan posisi unggun katalis tepat pada suhu yang tertinggi dalam tungku tersebut. Suhu reaksi/suhu katalis diukur dengan menggunakan termokopel yang dimasukkan dalam pipa quatz yang dipasang sesuai kedalaman unggun katalis di dalam reaktor. Seperti terlihat
pada sistem rangkaian instalasi aliran (Gambar 1), Gas Helium yang bertindak sebagai gas carrier dan bersifat inert dialirkan terlebih dulu selama kurang lebih 30 menit untuk mengusir udara yang ada dalam perpipapaan atupun peralatan (purging).
Selanjutnya suhu reaktor dinaikkan sesui dengan kondisi yang diinginkan dengan cara mengeset suhu pada kontrol yang terhubung dengan tungku. Katalis dilakukan pretreatment untuk menghilangkan air maupun zat-zat organik yang kemungkinan terkandung dalam material katalis, dengan cara mengalirkan gas oksigen masuk kedalm reaktor selama 20 menit. Setelah pretreatment, dilakukan purging gas oksigen, dengan cara menutup alirannya dan membiarkan gas He tetap mengalir didalam sistem reaktor. Reaksi katalitik sudah siap dilakukan. Agar supaya tidak timbul reaksi yang bersifat eksplosive, maka diupayakan terlebih dulu etana dialirkan dan baru kemudian aliran oksigen secara perlahan-lahan diumpankan ke dalam reaktor. Gas carrier
Gambar 2. Profil Reaktor Unggun Tetap Beraliran kotinyu ( terbuat dari bahan Quartz) Gambar 1. Sistem Aliran Peralatan Uji Katalis
Seminar Nasional Teknologi Proses Kimia VII
3
senantiasa tetap dialirkan setiap waktu, walaupun kondisi umpan maupun suhu dilakukan perubahandimaksudkan untuk mengatasi terjadinya local heating, overheting maupun pemusatan panas pada reaktor. Gas Keluaran reaktor dihubungkan secara on line dengan gas chromatografii untuk dilakukan analisa komposisinya.
3. Hasil dan Pembahasan 3.1 Pengaruh kandungan terhadap aktivitas katalis
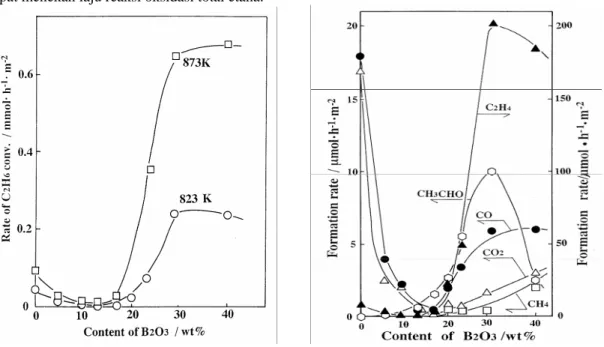
Pengujian sifat katalitik B2O3/Al2O3 untuk masing-masing kandungan B2O3 terhadap reaksi
dehidrogenasi etana, hasilnya terlihat pada gambar 3 dan 4. Kondisi reaksi dilakukan pada suhu 823 dan 873 K bertekanan atmosferik, PC2H6=PO2= 20 kPa dan total laju umpan gas 50 ml/min.
Seperti tampak pada kedua gambar tersebut, walaupun kinerja padatan Al2O3 (tanpa kandungan B2O3)
menunjukkan keaktifannya dalam mengkonversi senyawa etana, akan tetapi produk utamanya berupa CO dan CO2 yang merupakan produk oksidasi total etana. Penambahan kandungan B2O3 sampai ± 15 % berat, mampu
menurunkan selektivitas katalis secara tajam, baik dilihat dari laju konversi etana (gambar 3) maupun laju pembentukan produk (gambar 4). Penurunan ini memberikan arti bahwa adanya penambahan komponen B2O3
dapat menekan laju reaksi oksidasi total etana.
Gambar 3 Plot pengaruh kandungan B2O3
terhadap laju konversi etana.
Gambar 4. Pengaruh kandungan B2O3 terhadap laju
pembentukan produk dehidrogenasi etana
Namun, penambahan boron oksida pada rentang kandungan 15 – 40 % B2O3 tampak bahwa adanya
pengaruh sangat signifikan dengan meningkatnya secara tajam baik dari konversi etana maupun laju pembentukan produk. Disamping produk utama yang dihasilkan adalah berupa etilena, C2H4 (lihat gambar 4),
penambahan B2O3 pada rentang ini menghasilkan suatu proses reaksi dehidrogenasi etana dengan laju yang
optimal pada kadar B2O3 yakni sebesar 30 % berat, menjadikan katalis yang terbaik untuk sistem katalis
B2O3/Al2O3. Penambahan kadar B2O3 diatas 30 % berat terlihat jelas terjadi penurunan kurva, hal ini
menandakan bahwa semua katalis yang mempunyai kandungan B2O3 yang berkelebihan akan mengalami
penurunan aktivitasnya.
Hal yang sangat penting untuk dikaji adalah adanya pengaruh penambahan B2O3 diatas 15 % berat
terhadap dugaan kemungkinan terbentuknya inti aktif baru hasil interaksi anatara B2O3dan Al2O3 yang berperan
melangsungkan reaksi dehidrogenasi. Namun sebaliknya, B2O3 tidaklah mungkin merupakan inti aktif katalis,
karena jumlah B2O3 yang berkelebihan (diatas 30 %) akan membuat kinerja katalis B2O3/Al2O3 semakin tinggi.
Dan tidak mungkin terjadi titik optimal pada 30 % berat B2O3. dan secara logis penambahan B2O3 secara
berkelebihan seharusnya justru meningkatkan aktivitas katalis. Apabila dikaitkan dengan pengaruh penambahan B2O3 terhadap semakin mengecilnya luas permukaan katalis, reaksi dehidrogenasi etana akan semakin menurun
dengan semakin menciutnya luas permukaan katalis. Jadi jelas tidak mungkin senyawa B2O3 merupakan inti
Seminar Nasional Teknologi Proses Kimia VII
4
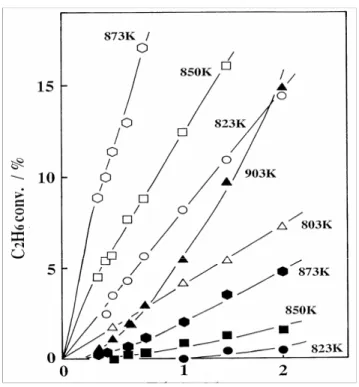
Gambar 5. Perbandingan antara reaksi tanpa katalis (blankreactor) dengan reaksi adanya katalis 30% B2O3/Al2O3
3.2 Reaksi katilitik dan fasa gas
Untuk melihat seberapa besar pengaruh adanya kontribusi reaksi fasa gas (reaksi pirolisa), maka dilakukan pengujian reaksi dehidrogenasi pada katalis terbaik 15% B2O3/Al2O3
dibandingkan dengan reaksi tanpa katalis (blank
reactor) dengan kondisi reaksi yang sama.
Hasilnya seperti tampak pada gambar 5 yang merupakan plot antara konversi etana vs F-1. Untuk hasil uji aktivitas katalis dengan titik-titik diberikan simbol isi kosong, semua kurva sesuai dengan suhu reaksinya masing-masing memperlihatkan adanya kecenderungan membentuk garis lurus serta cenderung menuju ke titik nol. Hasil ini cukup logis, karena reaksi katilitik akan berjalan dengan konversi yang secara linier semakin meningkat dengan semakin meningkatnya space timenya (F-1). Dan kecenderungan kurva menuju ke titik 0 (tanpa adanya space time), mengindikasikan reaksi berjalan tanpa perlu adanya induction period, yakni dengan waktu yang begitu singkat akan mampu mengaktivasi molekul etana (kondisi
steady state). Pada reaksi tanpa adanya katalis
tampak adanya induction period pada seluruh suhu reaksi yang dikerjakan. Semakin rendah suhu reaksi semakin besar inductuin period. Hal ini menunjukkan bahwa rekasi fasa gas membutuhkan space time minimal untuk mengaktivasi molekul etana atau mangakumulasi radikal fasa gas dalam suatu ukuran volume tertentu. Dilihat konversi yang dicapai antara kedua reaksi tersebut, konversi untuk reaksi dengan adanya katalis senantiasa lebih besar puluhan kali daripada reaksi tanpa adanya katalis untuk keseleruhan suhu reaksi. Untuk mendapatkan konversi yang sama , reaksi fasa gas (tanpa adanya katalis) memerlukan suhu yang lebih tinggi dan scace time yang lebih lama. Untuk suhu reaksi dibawah 823 K, dengan 1/F < 2 ml-1.det, berlangsungnya reaksi dengan adanya katalis secara jelas didominasi/dikendalikan oleh keberlangsungan reaksi katalitik.
3.3 Karakterisasi Luas Permukaan BET Dan XRD
Untuk melihat pengaruh penambahan terhadap perubahan luas permukaan katalis, dilakukan pengujian luas permukaan katalis untuk setiap katalis yang digunakan. Pengukuran dilakukan menggunakan metode BET dengan molekul N2 sebagai molekul pengukur luas permukaan melalui proses adsorpsi pada suhu cairnya
(-160oC). Karena secara unum, luas permukaan katalis juga dapat menjadi parameter yang menentukan keberlangsungan suatu reaksi katalitik. Seperti terlihat pada gambar 6, hasil pengukuran luas permukaan katalis di plot dengan persentase kandungan B2O3.
Gambar 6. Pengaruh persenatse kandungan B2O3
terhadap luas permukaan katalis B2O3 /Al2O3
Seminar Nasional Teknologi Proses Kimia VII
5
Tampak jelas bahwa pengaruh penambahan boron oksida berakibat luas permukaaan katalis menjadimenurun. Hal ini merupakan fenomena biasa dalam proses pembuatan katalis metode impregnasi, karena semakin besar tertutupnya struktur pori yang dipunyai oleh Al2O3. Namun, proses penurunan luas permukaan
terjadi secara gradual berawal dari Al2O3 murni sampai katalis 10 % B2O3 /Al2O3, yang menunjukkan bahwa
impregnasi berlangsung secara sempurna tanpa adanya plugging pori katalis. Dari hasil ini juga dapat diduga bahwa besar kemungkinan penambahan B2O3 dengan metode ini cukup memberikan proses penyebaran oksida
boron yang baik (high dispersion).
Karakterisasi katalis dengan menggunakan XRD dilakukan untuk melihat kemungkinan terbentuknya fasa/senyawa baru yang mungkin terbentuk selama pembuatan katalis. Terlihat spektrum XRD untuk Al2O3
murni, B2O3 serta sample 13, 30, 50 % B2O3/Al2O3 pada gambar 7. Tidak ada puncak yang muncul pada
spektrum Al2O3, karena berstruktur amorfus. Dan hal yang menarik adalah tidak adanya puncak yang muncul
walaupun ada penambahan B2O3 sampai dengan 15 %. Ketidakmunculan puncak-puncak yang dipunyai oleh
B2O3 mengindikasikan bahwa keberadaan B2O3 terdispersi secara sempurna dan berinteraksi cukup kuat dengan
permukaan YSZ dengan berbentuk amorf.
Dan kemunculan puncak baru terjadi setelah ada penambahan B2O3 sebanyak 30 % pada B2O3 dan
merupakan salah satu puncak dan posisinya dimiliki oleh spektrum XRD dari B2O3 murni. Dan komposisi
katalis ini merupakan katalis terbaik, walaupun luas permukaannya menciut menjadi hanya sekitar 70 m2/g. Kelihatannya kemunculan puncak-puncak yang posisinya menyerupai spektrum XRD B2O3 murni, menjadikan
kinerja katalis menjadi menurun, terbukti semakin menurunnya aktivitas katalis dengan semakin berkelebihan penambahan B2O3 seperti diuraikan diatas. Dan jelaslah bahwa boron oksida bukanlah inti aktif yang sebenarnya
dari sistem katalis B2O3/Al2O3 untuk reaksi dehidrogenasi etana menjadi etilena. Dan yang paling
memungkinkan adalah adanya spesies aktif baru yang merupakan hasil interaksi antara B2O3 dan Al2O3 yang
tidak terdeteksi oleh instrumen XRD sampel.
3.4 Inti Aktif Katalis
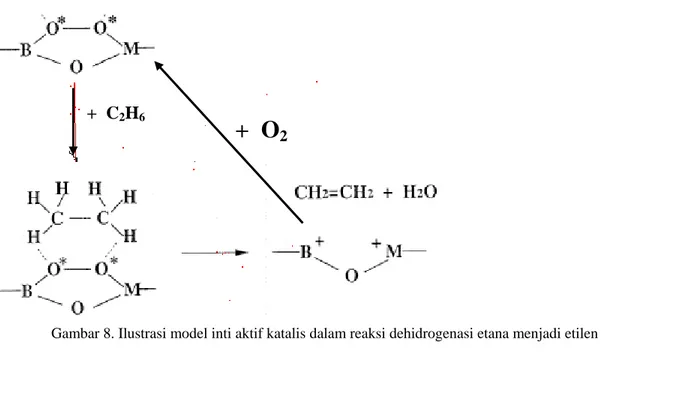
Berdasar uraian hasil diatas dapatlah dibuat suatu hypotesa untuk membuat suatu kemungkinan/spekulasi model inti aktif katalis yang terbentuk dari hasil interaksi antara B2O3 dengan YSZ pada bidang antar
permukaannya. Inti aktif tersebut kemungkinan besar adalah berupa spesi peroksida yang terikat pada atom B dan M (Si atau Y). Lebih jelasnya dapat dilihat pada ilustrasi gambar 8. Inti aktif tersebut telah terbentuk saat katalis dikalsinasi yang merupaka hasil reaksi antara molekul O2 dengan boron yang bermuatan positif serta
terbentuk boron zirkonia peroksida. Dalam penambahan B2O3 dengan jumlah yang berkelebihan (kandungan
B2O3 > 30 %) maka inti aktif tersebut makin lama akan semakin terpendam oleh partikel B2O3 pada
permukaan katalis, sehingga katalis mengalami penurunan aktivitas dalam reaksi dehidrogenasi etana. Inti aktif mencapai kadar maksimum pada penambahan saat katalis mempunyai kandungan B2O3 sebesar mendekati 30 %
berat. Pada penambahan B2O3 sampai dengan 15% berat, dapat dipastikan spesi peroksida belum terbentuk,
sesuai hasil uji aktivitas bahwa sifat katalitis katalis mengarah reaksi oksidasi total etana.
Dalam perannya sebagai inti aktif katalis, spesi peroksida mengadsorp molekul etana dengan mengikat 1 atom hidrogen pada masing-masing atom C membentuk senyawa keadaan transisi pada permukaan. Pembentukan molekul etilena melalui pemutusan ikatan C – H dan terbentuk molekul H2O. Pada tahap tersebut
katalis membutuhkan molekul O2 untuk membentuk kembali spesi peroksida. Dalam reaksi dehidrogenasi etana
ini yang menggunakan oksigen ini juga dikenal dengan sebutan reaksi oksidehidrogenasi. Siklus reaksi berulang lagi setelah atom boron bereaksi dengan oksigen.
Gambar 8. Ilustrasi model inti aktif katalis dalam reaksi dehidrogenasi etana menjadi etilen
+ C
2H
6Seminar Nasional Teknologi Proses Kimia VII
6
4. Kesimpulan
1. Pengaruh komposisi B2O3 katalis B2O3/Al2O3 terhadap reaksi dehidrogenasi katalitik etana menjadi etilena
dapat dibagi menjadi 3 macam. Pengaruh kenaikkan kandungan B2O3 sampai dengan 15% menunujukkan
katalis B2O3 /Al2O3 mampu menghambat reaksi oksidasi total etana dan menekan terbentuknya gas CO dan
CO2. dan menjadikan katalis yang aktif dan selektif untuk reaksi dehidrogenasi etana pada penambahan
B2O3 antara 5 – 15 % berat.
2. Katalis B2O3 /Al2O3 pada kenaikkan kandungan B2O3 dalam rentang 15-30 %, menjadikan kinerja katalis
sangat efektif untuk reaksi oxidative dehidrogenasi etana dan mencapai optimal pada kandungan sebesar 30 % B2O3, walaupun luas pemukaannya jauh lebih kecil (70 m2/g) dibanding B2O3 /Al2O3 murni (250 m2/g).
Rentang tersebut memberikan tingginya kadar terbentuknya inti aktif katalis dibanding dengan rentang lainnya dan mencapai kadar yang apaling efektif di sekitar 30 % B2O3.
3. Inti aktif tersebut merupakan hasil interaksi antara atom Boron dengan logam Al membentuk spesies peroksida pada bidang kontak antar permukaan partikel B2O3 dengan partiekel Al2O3. Dan B2O3 jelas bukan
merupakan inti aktif katalis yang sebenarnya dari reaksi dehidrogenasi etana. Terbukti dengan penambahan B2O3 yang berkelebihan (> 30 %), membuat kinerja katalis menjadi menurun. Penambahan yang semakin
berkelebihan tersbut menyebabkan spesi peroksida yang terbentuk akan terselimuti dan tertutupi oleh partikel B2O3.
Ucapan terima kasih
Penulis mengucapkan banyak terima kasih kepada Prof. Dr. Kiyoshi Otsuka , Tokyo Institure of Technology, Japan untuk mendorong kami menulis dan mendisseminasikan hasil penelitian ini karena relevansi masih tinggi sampai saat ini.
Daftar Pustaka
1) Setiadi, (1996), “Methane Oxidation over Boron Oxide -YSZ Catalyst”, Proceeding of Regional Symposium on Chemical Engineering, p. 3 -16, Jakarta
2) Setiadi, K.Otsuka, (1994), “ Partial Oxidation of Methane and Ethane over Boron Oxide Suported on YSZ Catalyst”, Proceedings of the third scientific Meeting, p.229-236, ATOM’94, Tokyo
3) Setiadi, (1994), “Tantai Sanka Housho shokubai ni yoru Metan to Etan no Bubun Sanka Hannou”, Master Thesis, Tokyo Institute of Technology, Tokyo
4) Miguel A. Banares, (1999), "Supported metal oxide and other catalysts for ethane conversion : a review",