i
SURTI KURNIASIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
ii
Dengan ini saya menyatakan bahwa disertasi Pemanfaatan marka molekuler untuk mendukung perakitan kultivar unggul kakao (Theobroma cacao L.) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2012
Surti Kurniasih
iii
Culltivar Construction of Cocoa (Theobroma cacao L.). Under supervised by SUDARSONO, ASEP SETIAWAN, AGUS PURWANTARA
Theobroma cacao L. is one of the important cash crop, native to the South
American rain forest. The beans are the sole source of cacao, the raw material for chocolate. Production of cacao beans can be increased by cultivar which has high production and resistant to black pod caused by Phytophthora palmivora. Identification and characterization of genetic diversity cacao germplasm were needed in constructing supe rior F1 hibrid.Diversity analyses of cacao germplasm need to be done for finding the clones that potentially as parental in the cacao hybridization programme for high yield and resistant to P. palmivora. Diversity of 29 clone cacao germplasm based on morphological characters was high. Results of the experiment indicated that all SSR primer pairs evaluated were able to produce kultivar SSR markers for 29 cacao clones. The total number of observed alleles among 29 clones were 132. N umber of allele per locus ranged from 4 to 8, with an average of 5.5 alele per locus. Results of data analysis indicated the PIC value was 0.665, the observed heterozigosity (Ho) was 0.651, the gene diversity (He) was 0.720. The PIC, Ho, and He values were considered high. Genetic distances were evaluated using NTSys version 2.1 and de ndrogram was constructed. Based on those finding, all SSR primer pairs evaluated could be used to analyze cacao genome and be useful for genetic diversity analysis of cacao germplasm. The SSR marke r analysis in ICCRI cacao collections resulted in high PIC, high observed heterozygosity, and high genetic diversity. Genetic distance among the parents and genetic distance between the F1 hybrid ind ividuals with the nature of resistance to black pod disease caused by infection with P.
palmivora were evaluated. The genetic distance between the parents used to
produce F1 hybrid strains of cocoa has a relatively high value, which ranges from 0.52 - 0.85. The farther the distance of genetic between the parents the higher genetic diversity of hybrid individuals is expected. SSR analysis results of ten individual crossed hybrids, suggest that individual genetic hybrid has a relatively high genetic diversity. Parents which have a further genetic distance were also produced hybrids with a relatively high diversity. To study the analog genes thought related to the nature of plant resistance to P. palmivora, a PCR strategy was used to clone resistance genes analogs (RGAs) and defense gene analogs (DGAs) using specific and non-specific primers. O f the eight cloned sequences, only three sequences were successfully isolated, they are one RGA sequence of Pto and two sequences of DGA of Cat1 and Cat2.
iv
Perkaitan Kultivar Unggul Kakao (Theobroma cacao L.). Dibimbing oleh SUDARSONO, ASEP SETIAWAN, dan AGUS PURWAN TARA
Kakao (Theobroma cacao L.) merupaka n salah satu tanaman perkebunan penting yang berasal dari wilayah Amerika Selatan. Biji tanaman ini merupakan bahan dasar untuk pembuatan coklat. Permintaan yang terus meningkat membuka peluang untuk terus meningkatkan produksi tanaman ini. Akan tetapi budi daya tanaman ini menemui berbagai kendala. Salah satu kendala yang cukup berarti ada lah seranga n pe nyakit busuk buah yang disebabka b oleh Phytophthora
palmivora. Salah satu upaya peningkatan produksi kakao adalah dengan
mengembangkan kultivar unggul kakao yang berdaya hasil tinggi dan resisten terhadap penyakit busuk buah yang disebabkan oleh P. palmivora. Kultivar tersebut dapat diperoleh dengan cara pengembangan hibrida F1 yang berasal dari tetua do nor yang mempunyai sifat resisten da n tetua pe nerima yang mempunyai daya hasil tinggi.
Keberhasilan penyilangan kakao ditentukan oleh pemilihan tetua yang tepat sehingga diperoleh hibrida yang sesuai dengan yang diharapkan. Untuk itu diperlukan informasi yang akurat tentang keragaman genetik plasma nutfah kakao yang aka n dipilih seba gai tetua. Analisis keragaman terhadap plasma nutfah kakao perlu dilakuka n untuk mencari klon-klon yang memiliki potensi sebagai tetua da lam upa ya perakitan klon-klon kakao yang berdaya hasil tinggi sekaligus tahan terhadap penyakit busuk buah yang disebabkan P. palmivora.
Pada kegiatan pertama dilakukan analisis keragaman plasma nutfah kakao berdasarkan karakter morfologi dan marka SSR. Hasil analisis keragaman morfologi dengan menggunakan descriptor list terhadap 22 klon kakao koleksi Puslit Kopi dan Kakao Indonesia, menunjukkan terdapat keragaman yang cukup tinggi. Dua puluh empat lok us SSR yang digunaka n mampu mengamplifika si DNA genom 29 klon kakao dan menghasilkan pita po limorfik. Hasil analisis menunjukkan rataan jumlah alel per lokus sebanyak 5.50. Hasil analisis data yang dilakukan juga menunjukkan nilai PIC untuk marka SSR yang digunakan sebesar 0.665. Untuk populasi klon kakao yang dievaluasi, diperoleh nilai rataan heterosigos itas pengamatan (Ho) sebesar 0.651, dan rataan diversitas gen (He) sebesar 0.720. N ilai PIC, Ho dan He yang didapat tergolong tinggi.
Pada penelitian sebelumnya telah dipilih lima tetua dengan ketahanan terhadap infeksi busuk buah dan daya hasil yang tinggi dan digunakan untuk memproduksi satu rangkaian populasi hibrida F1 dengan metod e semi-dialel. Tetua terpilih yang digunakan dalam persilangan tersebut adalah klon kakao ICCRI 3, TSH 858, ICS 13, DR1 dan Sca 6. Untuk menguji apakah pilihan ke-lima tetua tersebut telah dilakukan dengan benar atau belum, DNA dari ke-lima klon kakao yang digunakan untuk menghasilkan hibrida F1 telah diisolasi dan dianalisis menggunakan marker SSR pada lokus- lokus yang telah digunakan sebelumnya. Data yang dihasilkan selanjutnya dianalisis untuk mendapatkan informasi tingkat kesamaan antar klon dan digunakan untuk mengelompokkan masing- masing klon dengan analisis klaster. Hasil analisis tingkat kesamaan genetik antar lima klon tetua yang digunakan dapat diketahui bahwa tingkat
v
relatif tinggi. Dari informasi jarak genetik antar tetua tersebut mengindikasikan bahwa populasi F1 yang dihasilkan akan mempunyai tingkat keragaman genetik yang tinggi. Keragaman genetik antar individu dalam populasi F1 yang dihasilkan diduga akan terlihat mempunyai nilai yag tinggi, terutama dari hasil kombinasi persilangan antara: klon kakao DR1 x Sca 6, ICS 13 x Sca 6, dan ICCRI 3 x Sca 6.
Bagian ketiga dari penelitian dilakukan bertujuan untuk: (1) mengisolasi gen-gen analog yang diduga terkait dengan sifat resistensi kakao terhadap P.
palmivora; (2) mengidentifikasi fragmen DNA gen-gen D GA/RGA pada tanaman
kakao; (3) menentukan runutan fragmen DNA gen-gen DGA/RGA pada kakao. Selanjutnya dari hasil penelitian ini akan dikembangkan penanda molekuler spesifik untuk gen-gen DGA/RGA yang dapat digunakan untuk analisis keragaman kakao koleksi Puslit Kopi dan Kakao Indonesia. Dari penelitian ini dapat diisolasi tiga fragmen DNA yang terdiri atas dua gen yang menyandi catalase dan satu Pto. Setelah dilakukan pensejajaran dengan sekuens dari berbagai tanaman menggunakan Blast P, ditemukan bahwa sekuens yang ditemukan pada kakao ini memiliki homologi yang cukup tinggi dengan berbagai tanaman lain, ba ik untuk Cat maupun Pto.
vi
©Hak cipta milik Institut Pertanian Bogor, tahun 2012 Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
vii
SURTI KURNIASIH
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2012
viii
Penguji Pada Ujian Tertutup: Dr. Dewi Sukma, SP, M.Si. Dr. Sintho W. Ardie, SP, M.Si.
Penguji Pada Ujian Terbuka: Prof. Dr. Ir. GA Wattimena, M.Sc. Dr. Ir. Rubiyo, M.Si.
ix Nama Mahasiswa : Surti K urniasih
NRP : A161060041
Program Studi : Agronomi
Disetujui:
Komisi Pembimbing
Ketua
Prof. Dr. Ir. Sudarsono MSc
Dr. Ir. Asep Setiawan MS
Anggota I Anggota II
Dr. Ir. Agus Purwantara
Diketahui
Ketua Program Studi Agronomi Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Munif Ghulamahdi MS Dr. Ir. Dahrul Syah MScAgr
x
Puji syukur penulis panjatkan kepada Allah Subhanahuwata’ala atas segala rizki-N ya sehingga disertasi ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak Juli 2008 hingga Oktober 2011 berjudul: Pemanfaatan Marka Molekuler untuk Mendukung Perkaitan Kultivar unggul Kakao (Theobroma
cacao L.)
Terima kasih penulis sampaikan kepada Prof. Dr. Ir. Sudarsono MSc. selaku ketua komisi pembimbing, Dr. Ir. Asep Setiawan MS., dan Dr. Ir. Agus Purwantara selaku anggota komisi pembimbing yang telah banyak memberi saran dan bimbingan sejak persiapan, pelaksanaan penelitian hingga selesainya disertasi ini. Di samping itu penghargaan penulis sampaikan kepada Dr. Hugo Volkaert dari Central of Agricultural Biotechnology Kasetsart University Thailand, yang telah memberikan fasilitas serta bimbinga n selama penul is melakukan penelit ian melalui program Sandwich. Ucapan terima kasih juga disampaikan kepada pimpinan dan staf serta teknisi dari Pusat Penelit ian Kop i dan Kakao Indonesia di Jember, kepada staf dan teknisi pada Laboratorium Biologi Molekuler Tanaman IPB, Kepada Kementerian Pertanian yang telah memberikan dukunga n biaya penelitian melalui program KKP3T.
Terima kasih juga penulis sampaikan kepada Rektor Universitas Pakuan, Dekan serta seluruh rekan di Fakultas Keguruan dan Ilmu Pendidikan, khususnya di Program Studi Pendidikan Biologi atas dukunga n moril maupun material, kepada rekan-reka n di Program Studi Agronomi dan Fitopatologi FAPERTA IPB, juga kepada rekan-rekan di Laboratorum Biologi Molekuler Tanaman yang telah bersahabat dan berdiskusi selama penulis studi di IPB. Ungkapan terima kasih yang mendalam kepada Ibunda Hj. Siti N ur’aeni, suami Drs. D. Hernadi, MPd., anak-anakku R. Dela Arundina, ST dan R. Rizka Arusima, serta seluruh keluarga yang telah memberikan do’a dan kasih sayangnya. Kepada semua pihak yang telah memberikan bantuan selama penelitian dan penyusunan disertasi, penulis menyampaikan terima kasih, semoga Allah SWT membalas dengan sebaik-baik balasanN ya.
Bogor, Januari 2012
xi
ke dua dari orang tua Mas Natawiria (alm.) dan Hj. Siti Nur’aeni. Pendidikan sarjana ditempuh di Program Studi Pendidikan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam IKIP Bandung lulus pada tahun 1985. Pada tahun 1991 penulis melanjutkan studi Magister pada Program Studi Biologi, sub program studi Botani pada Program Pascasarjana IPB dan lulus pada tahun 1995. Pada tahun 2006 penulis mendapatkan kesempatan untuk melanjutkan pendidikan Doktor pada Program Studi Agronomi IPB atas dukungan dana pemerintah melalui beasiswa BPPS dari Dikti- Departemen Pendidikan Nasional.
Sejak tahun 1986 hingga sekarang penulis aktif sebagai staf pengajar pada Program Studi Pendidikan Biologi, Fakultas Keguruan dan Ilmu Pendidikan Universitas Pakuan.
xii
Halaman
DAFTAR TABEL
………... ….. xiv
DAFTAR GAMBAR
……… ….. xv
DAFTAR LAMPIRAN……….
xviii
BAB I PENDAHULUAN Latar Belakang……… 1
Pendekatan Masalah ………. 4
Tujuan Umum Penelitian ……….. 5
Manfaat Penelitian ……… 5
Ruang Lingkup Penelitian ………. 6
BAB II TINJAUAN PUSTAKA Tanaman kakao (Theobroma cacao L.) ………… 9
Penyakit busuk b uah pa da tanaman kakao (Theobroma cacao L.) ……….. 12
Marka Molekuler ……….. 14
SSR (Simple Sequence Repeats) ... 15
BAB III ANALISIS KERAGAMAN PLASMA NUTFAH KAKAO (Theobroma cacao L) BERDASARKAN MARKA MORFOLOGIS DAN MARKA SSR Abstrak ……….. 17
Abstract ……… 18
Pendahuluan ……….. 18
Bahan dan Metode ……… 21
Hasil dan Pembahasan ………... 27
Simpulan ……… 40
Daftar Pustaka ……….. 40
BAB IV HUBUNGAN ANTARA JAR AK GENETIK TETUA DAN HIBRIDA F1 KAKAO DENGAN RESISTENSI TERHADAP INFEKSI Phytophthora palmivora Butl. Abstrak ……….. 43
Abstract ……… 44
Pendahuluan ……….. 44
Bahan dan Metode ……… 46
Hasil dan Pembahasan ………... 50
Simpulan ……… 63
xiii
Abstrak ………... 65
Abstract ………. 66
Pendahuluan ………... 66
Bahan dan Metode ………. 69
Hasil dan Pembahasan ……… 72
Simpulan ………. 83
Daftar Pustaka ……… 84
BAB VI PEMBAHASAN UMUM
87
BAB VII SIMPULAN DAN SARAN Simpulan ……… 93
Saran ……….. 94
DAFTAR PUSTAKA
……….. 97
LAMPIRAN……….. 101
xiv
1. Daftar nama klon, tipe dan kelompok kakao yang digunakan dalam penelitian... 23
2. Microsatellite (SSR) yang digunakan untuk mengamplifikasi genomic DNA cacao dalam PCR... 24
3. Contoh data hasil skoring untuk masing- masing individu pada elektroferogram Gambar 7. Hasil sko ring merepresentasika n genotip individu berdasarkan lokus SSR P1 dan lokus SSR P2... .
33
4. Contoh data hasil skoring untuk masing- masing individu pada elektroferogram Gambar 8. Hasil sko ring merepresentasikan genotip individu berdasarkan lokus SSR P3 dan lokus SSR P4... 33
5. Jumlah alel dan tingkat heterosigos itas lok us-lokus SSR pada 29 klon kakao... 35
6. Tetua yang digunakan dalam persilangan hibrida kakao... 47
7. Microsatellite (SSR) yang digunakan untuk mengamplifikasi genomic DNA F1 cacao... 48
8. Tingkat kesamaan 5 klon kakao terpilih yang digunakan untuk menghasilkan populasi F1... 51
9. Klon-klon kakao yang digunakan sebagai templat DNA untuk PCR... 70
10. Primer spesifik dan non spesifik, suhu annealing dan ukuran produk PCR`untuk amplifikasi gen- gen RGA/DGA pada kakao... 73
11. Hasil penelusuran tingkat kemiripan antara Pto- like kinase pada kakao dengan sejumlah aksesi tanaman dari Gen Bank menggunakan algoritma Blast P... 76
12. Hasil penelusuran tingkat kemiripan antara Catalase pada kakao dengan sejumlah aksesi tanaman dari Gen Bank menggunakan algoritma Blast P... 77
13. Hasil desain primer spesifik gen Cat, NBS-LRR, dan Pto berdasarkan sekuen fragmen DNA kakao... 83
xv
1. Bagan alir penelitian untuk mendapatkan klon-klon kakao yang berpotensi sebagai tetua untuk merakit bibit kakao yang berdaya hasil tinggi dan resisten terhadap Phytiphthora
palmivora... 7 2. Tanaman kakao dengan buahnya yang menempel pada batang
(cauliflor) ... 11
3. Keragaman bentuk daun kakao: (a) ujung runcing; (b) ujung meruncing; (c) pangkal runcing; (d) pangkal membulat ; (e) bentuk oblong... 28
4. Keragaman bentuk buah kakao: (a) warna merah bentuk oblong; (b) warna ungu oblong; (c) ungu bulat; (d) hijau muda elips; (e) hijau elips... 28
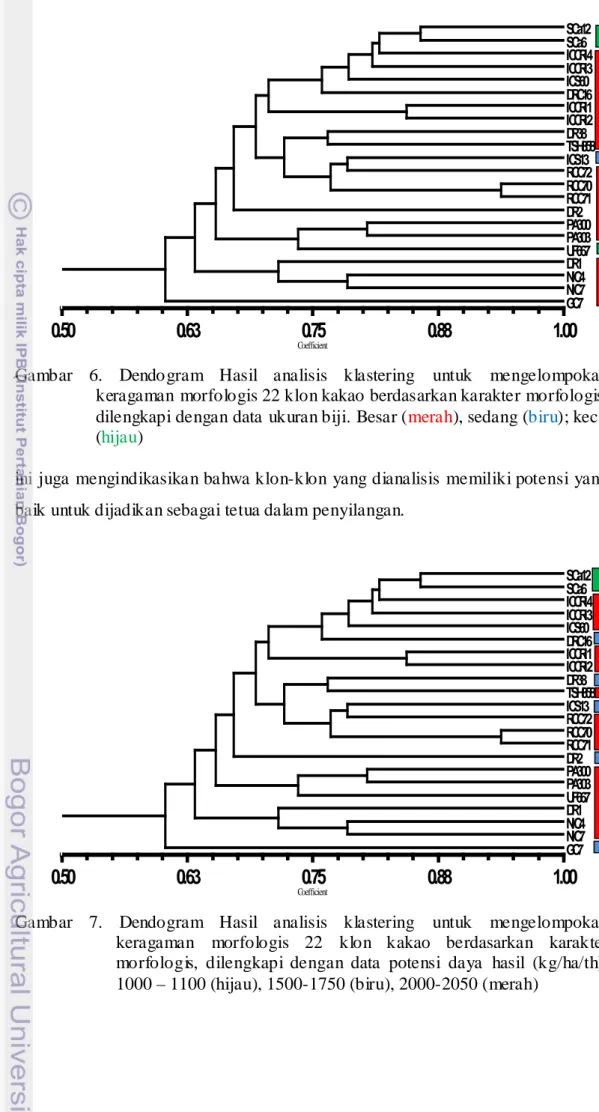
5. Dendo gram Hasil analisis klastering untuk mengelompokan keragaman morfologis 22 klon kakao berdasarkan karakter morfologis... 30
6. Dendogram Hasil analisis klastering untuk mengelompokan keragaman morfologis 22 klon kakao berdasarkan karakter morfologis
... 31
7. Dendogram Hasil analisis klastering untuk mengelompokan keragaman morfologis 22 klon kakao berdasarkan karakter morfologis………. 31
8. Contoh elektroferogram hasil PCR menggunakan dua macam primer spesific SSR (primer P1 dan P2) dengan 12 contoh DNA klon kakao….. 32
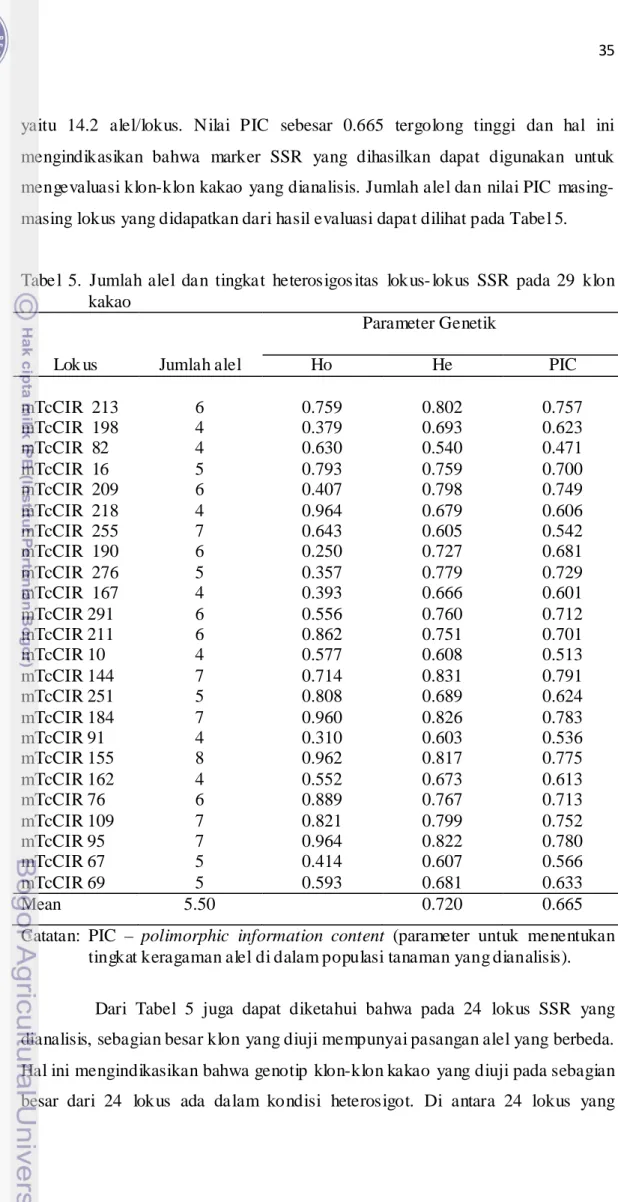
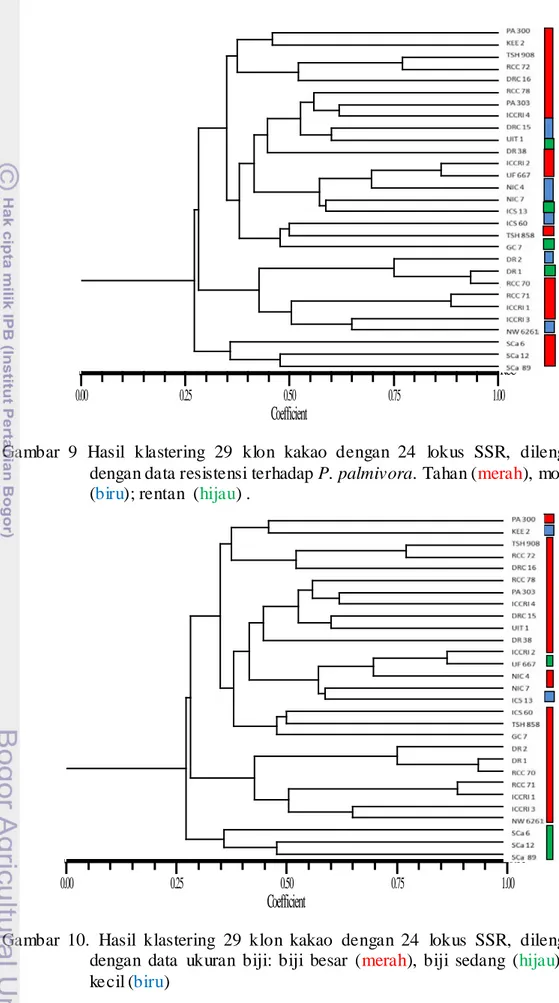
9. Hasil klastering 29 klon kakao dengan 24 lokus SSR……… 38
10.. Hasil klastering 29 klon kakao dengan 24 lokus SSR ... 38
11. Hasil klastering 29 klon kakao dengan 24 lokus SSR……… 39
12. Contoh Hasil PCR 10 Hibrida F1 dengan Primer MTcCIR 67 pada gel agrose... 51 13. Pengelompokkan lima klon tetua untuk menghasilkan populasi F1
berdasarkan marka molekuler SSR dan berdasarkan responnya terhadap infeksi Phytophtphora palmivora…... 52 14. Contoh elektroferogram hasil PCR menggunsksn primer SSR mTcCIR
xvi
Pengelompokkan aksesi hasil persilangan F1 antara klon ICCRI-3 x TSH858 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 54
16. Pengelompokkan aksesi hasil persilangan F1 antara klon ICCRI-3 x DR1 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 55 17. Pengelompokkan aksesi hasil persilangan F1 antara klon ICCRI-3 x
ICS13 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 56
18. Pengelompokkan aksesi hasil persilangan F1 antara klon ICCRI-3 x SCa6 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora……… 57 19. Pengelompokkan aksesi hasil persilangan F1 antara klon TSH-858 x
DR1 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 58 20. Pengelompokkan aksesi hasil persilangan F1 antara klon TSH-858 x
ICS-13 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 59 21. Pengelompokkan aksesi hasil persilangan F1 antara klon TSH-858 x
Sca-6 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 60
22. Pengelompokkan aksesi hasil persilangan F1 antara klon DR-1 x ICS-13 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 61
23. Pengelompokkan aksesi hasil persilangan F1 antara klon DR-1 x Sca-6 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 62
24. Pengelompokkan aksesi hasil persilangan F1 antara klon ICS-13 x Sca-6 berdasarkan marker molekuler SSR dan berdasarkan responsnya terhadap infeksi P. palmivora... 62
25. Hasil amplifikasi genom kakao ICCRI3 dengan 6 pasang primer yang
xvii
kakao hasil amplifikasi primer PTO... 78 28. Zpensejajaran sekuen asam amino yang diturunkan dari fragmen DNA
Catalase kakao hasil amplifikasi primer CAT... 80 29. Dendogram filogenetik sekuens asam amino Pto like kinase dari kakao
(PTO230705) de ngan Pto dari tanaman Oryza sativa (AAF43394.1),
Arabidopsis thaliana (CAB62020.1),Capsicum chinense
(AAQ82660.1), Rosa roxburghii (AAT28296.1), Triticum aestivum (AAL51075.1), Prunus avium, Fragaria x ananassa (ABV30740.1),
Corylus avellana (ACA05214.1), Ricinus communis (ACN87619.1), Cucumis x hytivus (XP002528705.1), Nicotiana repanda
(ACX80234.1), Potentilla tucumanensis (ACO25571.1) dengan menggunakan Clustal W...
80
30. Dendogram filogenetik sekuens asam amino catalase 1 dan 2 dari kakao (CA 229529 dan 229533) dengan catalase dari tanaman Ziziphus jujube (AET97564.1), Gossypium hirsutum (ACJ11733.1), Pisum sativum
(BAH37035.1), Prunus persica (CAD42909.1), Arabidopsis thaliana
(AAK96854.1), Brassica juncea (AAD17933.1), Nicotiana tabacum
(AAB71764.1), Zea mays (CAA42720.1), Jatropha curcas
(ACJ22771.1), da n Vitis vinifera (AAL83720.1) ... 81
31. Hasil amplifikasi DNA F1 kakao dengan primer spesifik TcCAT1 pada gel
xviii
Halaman 1. Daftar Istilah ……… 101 2. Katalog karakter pohon dan daun 22 klon kakao koleksi
Puslit Kopi dan Kakao Indonesia ……… 103 3. Katalog karakter pohon dan bunga dan biji 22 klon kakao
koleksi Puslit Kopi dan Kakao Indonesia……… 104 4. Katalog karakter pohon dan buah 22 klon kakao koleksi
Puslit Kopi dan Kakao Indonesia ……… 105 5. Contoh hasil amplifikasi DNA kakao pada gel agaros ……… 106
BAB I
PENDAHULUAN Latar Belakang
Kakao merupakan salah satu jenis tanaman perkebunan yang telah lama dikembangkan baik oleh masyarakat maupun lahan perkebunan yang dikelola oleh pemerintah. Hal ini disebabkan karena hingga saat ini berbagai produk pangan yang berbahan biji kakao sangat digemari oleh berbagai kalangan masyarakat. Oleh karena itu permintaan pasar akan tanaman ini terus meningkat dari waktu ke waktu seiring dengan peningkatan pertumbuhan penduduk, baik untuk pasar dalam negeri maupun ekspor ke berbagai negara yang merupakan prod usen makanan berbahan dasar kakao.
Permintaan biji kakao terus meningkat, terutama dari Amerika Serikat dan negara-negara Eropa Barat. Berbagai negara tersebut dikenal sebagai produsen makanan yang menggunakan kakao sebagai bahan dasar utamanya. Indo nesia sebagai salah satu negara produsen perlu memanfaatkan peluang tersebut untuk meningkatkan devisa negara dengan meningkatkan ekspor biji kakao (coklat).
Hal ini menyebabkan terbukanya peluang untuk pengembangan budi daya tanaman ini secara lebih baik, apalagi mengingat Indonesia sebagai salah satu produsen kakao terbesar di dunia (Drenth dan Sendall 2004). Di Indo nesia dibudidayakan dua tipe kakao, yaitu kakao lindak (bulk cocoa) dan kakao mulia (fine flavour cocoa) yang mempunyai harga jauh lebih tinggi dibandingkan dengan kakao lindak.
Seiring dengan peningkatan permintaan pasar terhadap biji kakao, maka upaya pengembangan budi daya kakao terus dilaksanakan untuk dapat memenuhi tuntutan pasar. Hingga kini lebih dari seratus klon kakao telah dikemba ngkan di berbagai sentra produksi kakao di Indonesia, baik melalui perkebunan rakyat maupun yang dike lola oleh pe merintah da n swasta. Namun demikian upaya pengembangannya masih menemui berbagai kendala, antara lain serangan hama dan penyakit yang dapat menurunkan kualitas serta kuantitas produksi biji kakao. Berbagai penyakit yang disebabkan oleh patogen dapat ditemukan pada tanaman kakao, salah satunya adalah penyakit busuk buah (black pod) yang disebabk an
oleh Phytophthora palmivora. Penyakit busuk buah ini menyebabkan kerugian yang bervariasi antara daerah satu de ngan yang lainnya ba hka n antar negara. Secara umum, kerugian antara 20-30% pertahun terjadi akibat penyakit busuk buah pada pertanaman kakao di lapangan (Wood dan Lass 1985).
Untuk mengatasi masalah tersebut maka berbagai upaya terus dilakukan untuk mendapatkan bibit yang unggul dan bermutu. Salah satu upaya yang telah dilakuka n Pusat Penelitian Kop i dan Kakao Indo nesia ada lah de ngan melakukan persilangan antara klon-klon kakao yang resisten terhadap penyakit sebagai tetua donor dengan kon-klon yang berdaya hasil tinggi sebagai tetua penerima. Dengan demikian diharapkan akan diperoleh klon-klon baru yang memiliki perpadua n karakter tersebut. Keberhasilan penyilangan kakao ditentukan oleh pemilihan tetua yang tepat sehingga diperoleh hibrida yang sesuai dengan yang diharapkan. Berkaitan dengan hal tersebut maka diperlukan informasi yang akurat tentang keragaman genetik p lasma nutfah kakao yang akan dipilih sebagai tetua.
Pemuliaan tanaman untuk mengembangkan varietas kakao unggul yang tahan terhadap P. palmivora sangat penting untuk dilakukan dan perlu mendapatkan perhatian khusus jika Indonesia tetap ingin menjadi produsen besar komoditas ekspor ini. Tersedianya varietas kakao yang resisten terhadap infeksi P.
palmivora membantu meringankan biaya produksi berupa pembelian fungisida
yang harus ditanggung petani produsen, sehingga berpotensi meningkatkan pendapatan. Jika telah dikembangkan, kultivar unggul kakao yang resisten terhadap infeksi P. palmivora dapat menjadi metode terbaik yang tersedia bagi petani produsen kakao di Indonesia untuk mengatasi masalah penyakit busuk buah kakao di lapangan.
Di Indo nesia, arah pe muliaan tanaman kakao ditujukan unt uk mengembangkan kultivar unggul dengan sifat-sifat seba gai berikut : (i) mempunyai potensi daya hasil yang tinggi, (ii) kualitas biji yang bermutu tinggi, dan (iii) tahan terhadap hama (seperti: penggerek buah kakao PBK da n penyakit utama (seperti busuk buah kakao P. palmivora dan vascular streak dieback (Iswanto & Winarno 1992). Program pemuliaan untuk memperoleh kultivar kakao yang resisten terhadap P. palmivora merupakan tujuan kegiatan yang dilakukan di berbagai negara produsen kakao (van der Vossen 1997).
Salah satu upa ya yang telah dikembangkan oleh Pusat Penelitian Kopi dan Kakao untuk mendapatkan kultivar kakao unggul adalah dengan menggunakan benih hibrida F1. Untuk menghasilkan hibrida F1 unggul yang berproduksi tinggi dan resisten terhadap penyakit busuk buah kakao akibat infeksi P. palmivora perlu digunakan tetua donor yang mempunyai sifat resisten dan tetua penerima yang mempunyai daya hasil tinggi. Untuk mendapatkan tetua tersebut diperlukan identifikasi dan analisis keragaman plasma nutfah kakao dari berbagai sentra produksi kakao di Indonesia.
Analisis keragaman genetik tanaman dapat dilakukan secara morfologi dengan pengamatan langsung terhadap fenotipe maupun dengan menggunakan marka molekuler. Penggunaan marka molekuler memiliki beberapa keuntungan dalam membantu pemuliaan, karena dapat digunakan untuk (1) analisis pautan dan pemetaan genetik, (2) identifikasi genotipe, (3) menduga keragaman genetik dan kekerabatan inter dan antar spesies atau varietas dan juga dapat membantu menjelaskan filogenetiknya (Weising et al. 1995).
Berbagai studi keragaman genetik tanaman kakao telah banyak dilakukan baik secara morfologi maupun pada tingkat molekuler. Berbagai jenis marka molekuler telah digunakan untuk kerakterisasi dan analisis keragaman, serta pemetaan genetik kakao (Lanaud et al. 1999). Pengembangan marka seleksi untuk program pemuliaan tanaman kakao telah mulai dilakukan o leh Schnell et al. (2007), sementara keragaman genetik kakao dengan menggunakan marka SSR telah dilakukan oleh Zang et al.(2006). Selain itu, beberapa penelitian untuk mempelajari gen- gen ke tahanan kakao terhadap P. palmivora juga telah dilakukan oleh Clement et al. (2003) dan Lanaud et al. (2004).
Dengan menggunakan marka molekuler, diversitas genetik plasma nutfah kakao sebagai calon tetua yang akan digunakan dalam program pemuliaan tanaman akan dapat ditentukan. Untuk meningkatkan kemungkinan didapatkannya kultivar unggul baru, perlu dilakukan persilangan antar dua tetua yang mempunyai jarak genetik yang tinggi. Identitas tetua dengan jarak ge netik yang tinggi dapat diketahui dengan menggunakan marka molekuler, sehingga metode ini dapat meningkatkan efektivitas dan efisiensi program pemuliaan yang akan dilakuka n.
Pendekatan Masalah
Penyakit busuk buah pada kakao yang disebabkan cendawan P. palmivora merupaka n masalah yang sulit untuk dike nda lika n. O leh karena itu cara ya ng paling efektif untuk mengatasi penyakit ini adalah dengan mengembangkan kultivar kakao yang berdaya hasil tinggi dan tahan terhadap penyakit busuk buah. Berdasarkan hal tersebut maka upaya pemuliaan tanaman kakao terutama diarahkan untuk mendapatkan kultivar unggul yang berdaya hasil tinggi dan mempunyai sifat resisten terhadap hama dan penyakit terutama penyakit busuk buah yang disebabka n P. palmivora. Namun demikian, kemajuan yang didapat untuk mencapai tujuan tersebut masih terbatas. Hal ini disebabkan beberapa permasalahan yang ditemukan, antara lain: (1) Rendahnya keanekaragaman plasma nutfah kakao; (2) Belum dibakukannya metode penapisan (screening) da n metode seleksi (selection) yang efisien; (3) Tidak dilakukannya strategi pemuliaan secara efektif.; (4) Belum tersedianya informasi dasar tentang keragaman genetik dan mekanisme dari sifat resisten terhadap P. palmivora yang ada pada plasma nutfah kakao.
Studi tentang keragaman genetik kakao koleksi internasional telah dilakukan (Zang et al. 2009), akan tetapi hingga saat ini belum ada informasi mengenai ke ragaman genetik p lasma nut fah kakao ko leksi Indo nesia. Berdasarkan hal tersebut, maka perlu tersedia data yang terkait dengan informasi genetik plasma nutfah kakao. Untuk mendapatkan informasi genetik maka perlu dilakukan analisis keragaman genetik tanaman kakao koleksi Puslit Kopi dan Kakao Indonesia, sehingga pemulian tanaman kakao akan lebih terarah. Puslit Kopi dan Kakao Indonesia mengoleksi hampir semua klon kakao yang terdapat di berbagai sentra produksi kakao di Indonesia, sehingga informasi keragaman genetik plasma nutfah kakao koleksi Puslit Kopi dan Kakao ini dapat merepresentasikan keragaman plasma nutfah kakao Indonesia.
Di samping itu telah dikembangkan pula hibrida F1 kakao yang merupakan hasil silangan tetua terpilih. Untuk itu maka perlu dilakukan analisis keragaman genetik hibrida F1 yang dihubungkan dengan tingkat resistensi kakao terhadap infeksi P. palmivora. Dengan demikian akan diperoleh informasi yang
akurat mengenai keterkaitan antara tingkat heterosigositas hibrida F1 dengan resistensinya terhadap P. palmivora.
Terkait dengan sifat resistensinya terhadap penyakit busuk buah yang disebabkan P. palmivora, maka diperlukan informasi mengenai gen-gen ya ng diduga terkait dengan sifat ketahanan kakao terhadap P.palmivora
Tujuan Penelitian
Penelitian ini secara umum bertujuan unt uk mempelajari penggunaan marka molekuler untuk studi ke ragaman genetik kakao. Tujuan tersebut dapa t diuraikan sebagai berikut:
1. Menganalisis keragaman plasma nutfah kakao berdasarkan karakter morfologis dan marker molekuler SSR
2. Menganalisis keragaman hibrida F1 kakao hasil silangan tetua menggunakan marker molekuler SSR
3. Mengana lisis hubungan antara jarak genetik tetua dan bibit hibrida F1 hasil persilangan antar tetua terpilih dengan respon terhadap infeksi P
palmivora
4. Isolasi dan karakterisasi fragmen DNA yang diduga terkait dengan sifat resistensi kakao terhadap P. palmivora
5. Menganalisis keragaman hibrida F1 berdasarkan marka RGA yang terkait dengan sifat ketahanan terhadap P. palmivora.
Manfaat Penelitian
Penelitian mengenai keragaman plasma nutfah maupun hibrida kakao ini diharapkan dapat memberikan informasi awal tentang identitas genetik klon-klon kakao yang dapat digunakan sebagai calon tetua. Hasil penelitian diharapk an dapat dimanfaatkan sebagai berikut:
1. Diperoleh katalog marka mor fologis untuk membedakan plasma nutfah kakao.
2. Diperoleh daftar primer yang dapat digunakan untuk analisis marka SSR da n mampu menghasilkan marka molekuler yang polimorfik.
3. Hasil analisis keragaman genetik yang diperoleh dari berba gai plasma nutfah kakao, dapat memudahkan para pemulia tanaman kakao untuk menentukan calon tetua yang digunakan da lam persilangan.
4. Persilangan dari tetua yang telah diketahui karakteristiknya diharapkan akan menghasilkan hibrida F1 yang memiliki karakter unggul.
5. Dengan banyaknya hibrida F1 yang dihasilkan, maka akan menambah keragaman klon kakao, sehingga diperoleh bibit yang berdaya hasil tinggi dan tahan terhadap P. palmivora.
Ruang Lingk up Penelitian
Tujuan akhir da ri pe nelitian ini adalah mendapatkan informasi mengenai klon-klon kakao yang dapat dijadikan tetua dalam persilangan untuk mendapatkan bibit unggul, yaitu kakao yang berdaya hasil tinggi sekaligus tahan terhadap pe nyakit busuk buah yang disebabka n oleh P. palmivora. Untuk mencapai tujuan tersebut, maka dilakukan serangkaian penelitian yang meliputi: I. Analisis keragaman plasma nutfah kakao (Theobroma cacao L.)
berdasarkan karakter morfologis dan marka molekuler SSR
II. Hubungan antara heterosigositas hibrida F1 kakao (Theobroma cacao L.) Dengan tingkat resistensinya terhadap Phytophthora palmivora.
III. Isolasi dan karakterisasi fragmen DNA yang diduga terkait dengan sifat resistensi kakao terhadap Phytophthora palmivora
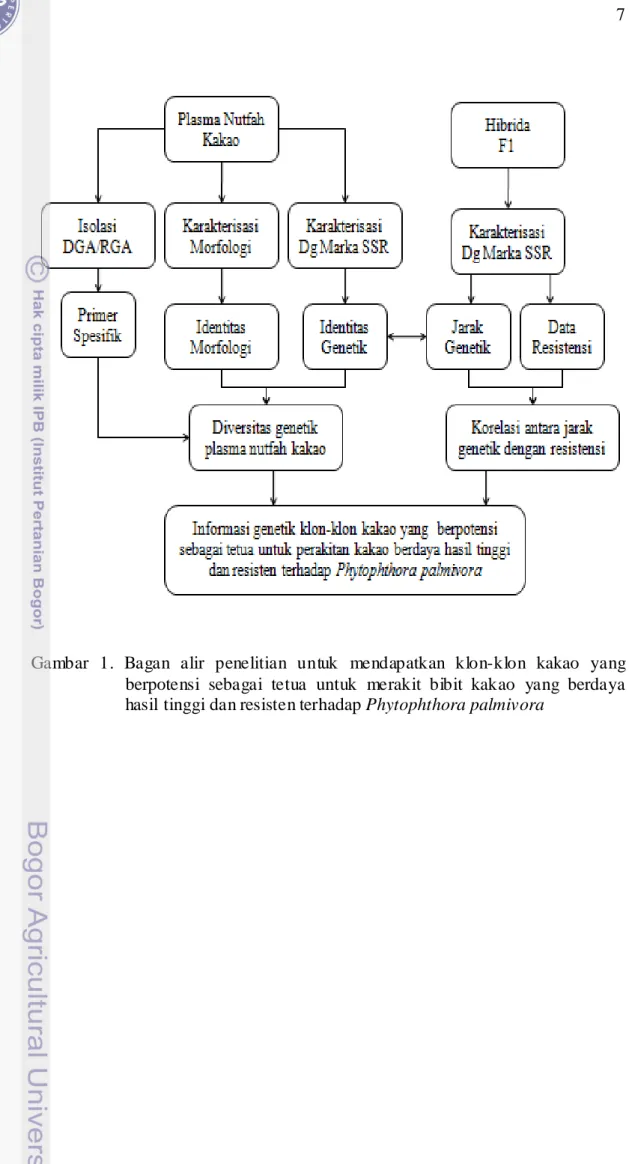
Gambar 1. Bagan alir penelitian untuk mendapatkan klon-klon kakao yang berpotensi sebagai tetua untuk merakit bibit kakao yang berdaya hasil tinggi dan resisten terhadap Phytophthora palmivora
BAB II
TINJAUAN PUSTAKA
Tanaman kakao (Theobroma cacao L.)
Asal Tanaman Kakao
Kakao merupakan tanaman perkebunan penghasil biji coklat yang berasal dari hutan-hutan tropis Amerika Tengah dan bagian utara Amerika Selatan. Secara umum tanaman kakao dikelompokkan menjadi tiga jenis yaitu Forastero, Criollo, dan Trinitario yang merupakan hasil persilangan antara Forastero dengan Criollo (Moramayor 2008). Sebagian besar klon-klon kakao yang dikembangkan sekarang merupakan pengembangan dari tipe Forastero.
Tanaman ini mulai masuk dan diperkenalkan ke Indonesia oleh bangsa Spanyol pada tahun 1560 di Manado, dan beberapa tempat di Sulawesi. Di Jawa kakao mulai ditanam pada tahun 1880 di perkebunan Djati Runggo, sehingga kemudian dikenal dengan klom DR yang merupakan kakao mulia, dan hingga kini masih tetap ditanam (Prawoto 2008). Selanjutnya dihasilkan klon-klon lain seiring dengan berkembangnya perkebunan kakao di berbagai wilayah di Indonesia, baik klon-klon yang tergolong mulia maupun lindak. Saat ini lahan pe nanaman kakao di Indo nsia menempati peringkat ke tiga setelah Pantai Gading da n Ghana.
Botani Tanaman Kakao
Kakao (Theobroma cacao L.) merupaka n tanaman be rbe ntuk po hon, bercabang dengan tinggi berkisar antara 6 – 7.5 m. Daun tunggal bentuk memanjang (oblongus), dengan tulang daun menyirip. Bunga tunggal dengan tangkai panjang yang menempel pada batang (cauliflor), berwarna putih. Buah kakao mempunyai panjang 20-27 cm dengan diameter 5–10 cm dengan warna yang bervariasi sesuai varietasnya (Gambar 2). Dalam klasifikasi tanaman kakao termasuk ke dalam divisi Spermatophyta/Magnoliophyta; Classis Magnoliopsida/ Dicotyledoneae; Ordo Malvales; dan Family Sterculiaceae (Concruist, 1984).
Tanaman kakao dimanfaatkan bijinya, meskipun buahnya juga dapat dimakan. Biji kakao mengandung alkaloid Theobromin yang merupakan stimulan ringan. Biji kakao merupakan bahan dasar pembuatan coklat yang
diperoleh dengan memanggang dan menggilingnya menjadi bubuk coklat, dan diolah menjadi berbagai jenis makanan maupun minuman yang banyak digemari. Indonesia merupakan salah satu produsen kakao terbesar di Asia Tenggara, dan sentra produksinya tersebar di berbagai wilayah. Kakao merupakan tanaman yang cocok ditanam di daerah tropis dengan suhu optimal 27 o
C dan kelembaban yang cukup tinggi yaitu antara 80 – 90%. Akan tetapi iklim tersebut juga mendukung untuk pertumbuhan dan perkembangan patogen P. palmivora (Wood dan Lass, 1989).
Gambar 2. Tanaman kakao dengan buahnya yang menempel pada batang (cauliflor).
Tanaman kakao dapat hidup di daerah yang mempunyai kelembaban dan curah hujan rendah, tetapi peka terhadap perubahan suhu dan kelembaban, sehingga tanaman ini dapat tumbuh dengan baik di daerah yang memiliki iklim tetap. Selain itu, pohon kakao juga tidak tahan terhadap angin kencang, karena percabangannya kurang kuat sehingga mudah patah. Angin yang kencang akan mudah merusak pertanaman kakao, mematahkan batang dan merusak buahnya. Untuk menghindari hal ini, biasanya pertanaman kakao dilindungi oleh tanaman pelindung sehingga dapat terhindar dari kerusakan.
Di antara tiga jenis kakao, Criolo merupakan jenis kakao tertua yang mulai ditanam oleh suku Maya sekitar 3000 tahun yang lalu di Amerika Tengah. Kakao jenis ini menghasilkan bubuk coklat dengan kualitas terbaik, tetapi tidak tahan terhadap berbagai penyakit (Argout et al. 2010). Kakao jenis criolo mempunyai
buah berwarna merah atau kuning, dengan kulit yang tebal dan berujung runcing. Kakao jenis ini memiliki biji berbentuk bulat, warna kotiledon putih berkualitas tinggi tetapi kurang tahan terhadap penyakit (Prawoto 2008).
Jenis Forastero berasal dari wilayah Amazon, yang kemudian tersebar luas ke berbagai belahan dunia termasuk Afrika. Saat ini penghasil biji kakao terbesar adalah Pantai Gading dan Ghana, dimana Forastero telah dikembangkan sejak awal. Berdasarkan hal tersebut, dan karena ketahanannya terhadap penyakit, sepuluh produsen kakao terbesar dunia terutama mengembangkan jenis ini. Sebagian besar coklat yang diproduksi di seluruh dunia, d ibuat dari biji Forastero.
Buah kakao jenis ini mempunyai lekukan kulit yang lebih dalam dengan permukaan yang halus, bentuknya agak bulat menyerupai bulbus. Daging buahnya lebih keras dari pada jenis Criolo, sehingga lebih sulit dibuka. Warna buah bervariasi dari kuning, merah, orange maupun ungu, seda ngkan bijinya berwarna ungu tua hampir sama dengan Criolo.
Karena karakter agonomisnya yang lemah dan tidak tahan terhadap penyakit, maka kemudian jenis Criolo disilangkan dengan Forastero yang menghasilkan produksi tinggi dan tahan penyakit, yang kemudian dikenal dengan Trinitario. Jenis kakao inilah yang kemudian hingga sekarang banyak dikembangkan di berbagai pertanaman kakao dunia (Argout 2010). Sifat morfologi dan fisiologi keturunannya amat beragam demikian juga daya hasil dan mutu bijinya. Beberapa klon dari kelompok ini disebut sebagai kakao mulia apabila keping biji segarnya berwarna putih atau sebagai kakao lindak apabila keping biji segarnya berwarna ungu. Klon-klon DR1, DR2, dan DR38 merupakan contoh kelompok Trinitario yang termasuk kakao mulia (Prawoto 2008).
Penyak it busuk buah pada tanaman kakao ( Theobroma cacao L.)
Phytophthora bersifat patogenik pada semua bagian tanaman kakao, mulai
dari kecambah sampai tanaman dewasa, menyebabkan sejumlah penyakit. Hingga kini ada delapan species Phytophthora yang telah diisolasi dari tanaman kakao yaitu: P. palmivora, P. megakarya, P. capsici, P. tropicalis, P. katsurae, P.
Diantara berbagai penyakit yang disebabkan oleh Phytophthora, yang paling sering ditemukan adalah penyakit busuk buah (Phytophthora Pod
Rot/PPR). Gejala pertama ditunjukkan dengan adanya bercak warna coklat
kehitaman pada buah kakao yang dimulai pada sisi buah tempat masuknya patogen pertama kali. Perkembangan gejala sangat cepat bahkan menutupi seluruh pe rmukaan buah. Drenth dan Guest (2001) mengidentifikasi berapa faktor yang menyebabkan organisme ini cukup efektif sebagai patogen, yaitu: 1) kemampuannya menghasilkan berbagai jenis spora seperti sporangia dan zoospora untuk daya tahan dan penyebaran jangka pendek dan klamidospora dan oospora untuk jangka panjang; 2) kecepatan sporulasi pada jaringan tanaman inang yaitu pada 3-5 hari setelah infeksi; 3) kemampuan zoospora Phytophthora untuk menembus ujung akar melalui rangsangan kimia (kemotaksis pos itif); 4) kemampuan bertahan hidup di dalam maupun di luar tubuh inang sebagai oospora atau klamidospora dalam waktu yang lama; 5) produksi sporangia, yang dapat disebarkan melalui udara ataupun dibawa air hujan, aliran irigasi maupun angin menuju ke pertanaman tetangga. Sporangia ini dapat langsung menginfeksi jaringan inang. Pada kondisi lembab dan dingin, sporangia yang sama dapat berkecambah menjadi 4 -32 zoospora yang berbeda dan menyebabkan multiple infeksi, tetapi penyebarannya terbatas; 6) Phytophthora memiliki lintasan biokimia yang berbeda dari fungi lainnya, sehingga beberapa fungisida kurang efektif terhadap patogen ini; 7) Phytophthora berkembang pada kondisi basah dan lembab, sehingga sulit dikendalikan, dan sulit mengaplikasikan fungisida pada kondisi ini. Pada perkebunan kakao dengan kelembaban tinggi ≥ 90%, miselium dan spora dapat terlihat yang dibentuk pada permukaan buah yang terserang (Drenth dan Guest 2004).
Penyakit busuk buah dapat menyerang kakao pada berbagai bagian dan umur tanaman, tetapi kerugian paling besar terjadi jika penyakit ini menyerang buah, terutama pada umur dua bulan menuju pematangan. Pada saat ini P.
palmivora dapat dengan mudah menembus dari daging buah ke kulit biji.
Penyakit ini sulit dikendalikan, karena miselium banyak terdapat pada jaringan yang terinfeksi, dan spora Phytophthora dapat bertahan hidup pada jaringan buah selama lebih dari tiga bulan.
Pada pertumbuhan awal, serangan pada daun adalah yang paling berbahaya, karena jaringan daun yang masih muda dapat mudah terinfeksi P.
palmivora. Biasanya pertulangan daun muda dan sekelilingnya yang terinfeksi
membentuk bercak nekrotik. Nekrotik pada daun berkembang dengan cepat seiring dengan bertambahnya umur daun (Erwin dan Ribiero 1996). Serangan penyakit ini tentu mengakibatkan turunnya produksi kakao.
Marka Molekuler
Analisis keragaman genetik tanaman dapat dilakukan secara morfologi dengan pengamatan langsung terhadap fenotipe maupun dengan menggunakan marka molekuler. Karakter morfologi telah lama digunakan untuk mengidentifikasi varietas, spesies, genus, maupun famili dari suatu jenis tanaman. Akan tetapi pengamatan langsung terhadap karakter morfologi memiliki kelemahan karena seringkali dipengaruhi oleh faktor lingkungan. Marka molekuler memiliki kelebihan dibandingkan dengan marka fenotipe, dapat meningkatkan efisiensi seleksi dalam pemuliaan tanaman dengan cara seleksi secara tidak langsung terhadap karakter yang diharapkan, tetapi terhadap marka molekuler yang terpaut dengan kareakter tersebut. Selain itu, marka molekuler tidak diregulasi lingkungan sehingga tidak dipengaruhi oleh kondisi dimana tanaman tersebut berada, juga marka tersebut dapat terdeteksi pada semua tahap perkembangan tanaman (Mohan et al. 1997).
Marka molekuler pada tingkat DNA memiliki beberapa kelebihan dibandingkan dengan morfologi atau alozim, antara lain: (1) karena genotipe suatu organisme diuji secara langsung, sehingga pengaruh lingkungan dan perkembangan terhadap fenotipe tidak menjadi masalah; (2) karena bagian yang berbeda dari DNA berevolusi dengan kecepatan yang berbeda, sehingga bagian yang cocok dapat digunakan untuk studi tertentu, misalnya bagian yang variabilitasnya tinggi untuk identifikasi kultivar atau yang variabilitasnya rendah untuk studi filogenetik; (3) karena jumlah polimorfisme yang ada tidak terbatas; dan (4) berbagai macam teknik telah dikembangkan yang masing- masing dapat menyediaka n marka ya ng sesuai de ngan tujuan tertentu (Weising et al. 1995). Keuntungan lain dari marka DNA adalah dapat mencerminkan perubahan pada
tingkat DNA sehingga menunjukkan jarak genetik yang sesungguhnya antara individu secara lebih akurat dari pada dengan marka fenotipe.
Seiring dengan berkembangnya teknologi di bidang molekuler, berbagai teknik telah dikembangkan, antara lain Restriction Fragment Length
Polymorphism (RFLP), Random Amplified Polymorphic DNA (RAPD), dan Amplified Fragment Length Polymorphism (AFLP), dan Simple Sequence Repeats (SSR).
RFLP merupakan salah satu jenis analisis molekuler yang didasarkan pada pemotongan situs DNA dengan menggunakan enzim restriksi, menghasilkan frgmen- fragmen DNA dengan berba gai ukuran. Perbedaan ukuran fragmen tersebut disebabkan adanya perbedaan jumlah dan distribusi situs restriksi yang terdapat pada DNA sehingga mempengaruhi aktivitas enzim tersebut. Hal ini menyebabkan teknik RFLP dapat digunakan sebagai penduga variasi sekuen DNA, sehingga dapat digunakan untuk menduga hubungan kekerabatan dari beberapa individu atau untuk analisis keragaman ge netik (Mumm da n Dudley, 1994). Akan tetapi analisis dengan RFLP membutuhkan DNA dalam jumlah banyak dan tingkat kemurnian DNA yang tinggi, juga sering menggunakan radio isotop sehingga teknik ini menjadi tidak efisien.
RAPD merupakan salah satu metode yang dapat digunakan untuk berbagai keperluan penelitian pada tingkat molekuler. Analisis RAPD mempunyai beberapa kelebihan dibanding dengan RFLP antara lain lebih murah, regenerasi lebih cepat, membutuhkan DNA lebih sedikit, tidak menggunakan radio isotop, dan tahapannya tidak terlalu rumit (Demeke dan Adams 1994).
Teknik AFLP merupakan kombinasi RAPD dan RFLP yang dapat digunakan untuk menganalisis keragaman genetik melalui penggandaan fragmen DNA yang dihasilkan dari pemotongan enzim restriksi dengan menggunakan primer spesifik (Maughan et al. 1996).
SSR (Simple Sequence Repeats)
SSR (Simple Sequence Repeats) yang dikenal juga sebagai mikrosatelit adalah lokus spesifik, kodominan, merupakan marka molekuler yang didasarkan pada sekuens DNA repetitif. SSR tersusun atas dua sampai enam DNA seperti
(AT)n, (AGC)n, atau (GACA)n
Pemanfaatan marka SSR untuk mengidentifikasi keragaman genetik telah banyak dilakukan pada berbagai jenis tanaman baik tanaman monokotil maupun dikotil. Freeman et al. (2004) menggunakan marka SSR untuk menentukan keragaman pada tanaman teh, Priolli et al. (2002) pada kedelai; Kacar et al (2005) pada chery; Solodenko et al. (2005) pada helianthus, serta masih banyak komoditas lainnya. Hal ini menunjukkan bahwa dengan berbagai kelebihan yang dimiliki, marka SSR sangat potensial untuk dikembangkan sebagai marka
molekuler terutama untuk keperluan identifikasi dan studi keragaman genetik.
yang tersebar pada genom mahluk hidup eukariotik. Variasi alel pada lokus mikrosatelit dengan mudah dapat diperoleh dengan teknik PCR menggunakan primer spesifik. Mikrosatelit telah digunakan secara luas pada berbagai jenis tanaman karena tingkat polimorfisme yang tinggi, lokus yang spesifik, mudah diperbanyak, hanya membutuhkan sedikit DNA, dan yang terpenting adalah sifatnya yang kodominan (Pugh 2004).
BAB III
ANALISIS KERAGAMAN PLASMA NUTFAH KAKAO (Theobroma cacao L.) BERDASARKAN MARKA MORFOLOGIS DAN
MARKA SSR Abstrak
Analisis keragaman terhadap plasma nutfah kakao perlu dilakukan untuk mencari klon-klon yang memiliki potensi sebagai tetua dalam upaya perakitan klon- kakao yang berdaya hasil tinggi sekaligus tahan terhadap penyakit busuk buah yang disebabka n Phytophthora palmivora. Penelitian ini be rtuj uan unt uk: 1) menganalisis keragaman plasma nutfah kakao berdasarkan karakter morfologis; 2) karakterisasi kakao koleksi Puslit Kopi dan Kakao Indonesia menggunakan marka SSR; 3) menganalisis keragaman genetik klon-klon kakao koleksi Puslit Kopi dan Kakao Indonesia dengan menggunakan marka SSR. Dalam penelitian ini, karakter morfologi dianalisis menggunakan descriptor list yang telah dikembangkan untuk kakao. Marka SSR yang digunakan untuk amplifikasi DNA genomik dari 29 klon kakao terdiri atas 39 pasangan primer SSR. Skoring pita SSR hasil amplifikasi menggunakan masing- masing pasangan primer dilakukan secara terpisah dan digunakan untuk menentukan jarak genetik diantara klon kakao yang dievaluasi. Hasil analisis karakter morfologi menunjukkan bahwa klon-klon kakao koleksi Puslit Kopi dan Kakao Indonesia memiliki keragaman yang tinggi. Semua pasangan primer SSR yang digunakan mampu mengamplifikasi DNA 29 klon kakao yang diuj i. Hasil penelitian menunjukkan bahwa 24 dari 39 lok us SSR yang dianalisis bersifat po limorfik dan dapat diskoring, sedangkan lima primer yang lain bersifat monomorfik. Jumlah total alel yang berhasil diamplifikasi dari 29 klon kakao yang dievaluasi, sebanyak 132 alel, dengan kisaran antara 4 – 8 alel/locus. Rataan jumlah alel per lok us sebanyak 5.50. Hasil analisis data yang dilakukan juga menunjukkan nilai PIC untuk marka SSR yang digunakan sebesar 0.665. Untuk populasi klon kakao yang dievaluasi, diperoleh nilai rataan heterosigositas pengamatan (Ho) sebesar 0.651, dan rataan diversitas gen (He) sebesar 0.720. Nilai PIC, Ho dan He yang didapat tergolong tinggi.
Kata kunci : Theobroma cacao L, mikrosatelit, marka molekuler, keragaman genetik, heterosigositas
DIVERSITY ANALYSES OF CACAO (Theobroma cacao L) GERMPLASM BASED ON MOFOLOGY AND SSR MARKER
Abstrac t
Diversity analyses of cacao germplasm need to be done for finding the clones that po tentially as parental in the cacao hybridization programe for high yield and resistant to Phytophthora palmivora. The objectives of this research were to 1) analyses diversity of cacao germplasm based on morfological characters ; 2) characterisation of ICCRI collection based on SSR marker; 3) analyses diversity of ICCRI cacao germplasm based on SSR marker. In this research, descriptor list was used to characterize morphology. 39 SSR primer pairs were used to amplify ge nomic DNA of 29 cacao clones. Amplified SSR fragments for each primer pairs were scored as ind ividual band and used to determine genetic distance among evaluated cacao clones. Results of the experiment indicated that all SSR primer pairs evaluated were able to prod uce SSR markers for 29 cacao clones. The results also indicated that 34 out of 39 microsatellite loci evaluated were polymorphic, while 5 ot hers were monomorphic. The total number of observed alleles among 29 clones were 132. Number of alele per locus ranged from 4 – 8, with an average of 5.5 alele per locus. Results of data analysis indicated the PIC value was 0.665, the observed heterozigosity (Ho) was 0.651, the gene diversity (He) was 0.720. The PIC, Ho, and He values were considered high. Genetic distances were evaluated using NTSys version 2.1 and dendrogram was constructed. Based on those finding, all SSR primer pairs evaluated could be used to analyze cacao genome and be useful for genetic diversity analysis of cacao germplasm. The SSR marker analysis in ICCRI cacao collections resulted in high PIC, high observed heterozygosity, and high genetic diversity.
Pendahuluan
Kakao merupakan tanaman perkebunan penghasil biji coklat yang berasal dari hutan-hutan tropis Amerika Tengah dan bagian utara Amerika Selatan. Secara umum tanaman kakao dikelompokka n menjadi tiga jenis yaitu Forastero, Criollo, dan Trinitario yang merupaka n hasil pe rsilangan antara Forastero dengan Criollo (Motamayor et al. 2003). Sebagian besar klon-klon kakao yang dikembangkan sekarang merupakan pengembangan dari tipe Forastero (Hunter 1990).
Tanaman ini mulai masuk dan diperkenalkan ke Indonesia oleh bangsa Spanyol pada tahun 1560 di Manado, dan beberapa tempat di Sulawesi. Di Jawa kakao mulai ditanam pada tahun 1880 di perkebunan Djati Runggo, sehingga
kemudian dikenal dengan klon DR yang merupaka n kakao mulia, dan hingga kini masih tetap ditanam (Prawoto 2008). Selanjutnya dihasilkan klon-klon lain seiring dengan berkembangnya perkebunan kakao di berbagai wilayah di Indonesia, baik klon-klon yang tergolong mulia maupun lindak. Saat ini lahan penanaman kakao di Indonsia menempati peringkat ke tiga setelah Pantai Gading dan Ghana.
Kakao dapat dikembangkan menjadi komoditas ekspor andalan Indonesia yang amat potensial. Peningkatan produksi kakao di Indonesia dapat dilakukan melalui program intensifikasi maupun ekstensifikasi penanaman kakao. Pelaksanaan program ini memerlukan tersedianya bibit dan benih kakao yang unggul dan bermutu, sehingga diperlukan pengembangan kultivar kakao yang unggul.
Berba gai upa ya terus dilakuka n untuk mendapa tka n bibit yang unggul dan bermutu, diantaranya ada lah dengan melakukan persilangan antara klon-klon kakao yang resisten terhadap penyakit sebagai tetua donor dengan kon-klon yang berdaya hasil tinggi sebagai tetua resipien. Dengan demikian diharapkan akan diperoleh klon-klon baru yang memiliki perpaduan karakter tersebut. Keberhasilan penyilangan kakao sangat dipengaruhi oleh pemilihan tetua yang tepat sehingga diperoleh hibrida yang sesuai dengan yang diharapkan. untuk itu diperlukan informasi yang akurat tentang keragaman genetik p lasma nutfah kakao yang aka n dipilih sebagai tetua.
Keragaman genetik tanaman dapat dianalisis secara morfologi dengan cara pengamatan langsung terhadap fenotipe maupun dengan menggunakan marka molekuler. Pengamatan seperti ini lebih muda hdan efisien, tetapi karakter morfologi sangat dipengaruhi lingkungan sehingga sering berubah. Penggunaan marka molekuler memiliki beberapa keuntungan dalam membantu pemuliaan, karena dapat digunakan untuk (1) analisis pautan dan pemetaan genetik, (2) identifikasi genotype, (3) menduga keragaman genetik dan kekerabatan inter dan antar species atau varietas dan juga dapat membantu menjelaskan filogenetiknya (Weising et al. 1996).
Berbagai studi keragaman genetik tanaman kakao telah banyak dilakukan baik secara morfologi maupun pada tingkat molekuler. Berbagai jenis marka molekuler telah digunakan untuk kerakterisasi dan analisis keragaman, serta
pemetaan genetik kakao (Lanaud et al. 1999). Pengembangan marka seleksi untuk program pemuliaan tanaman kakao telah mulai dilakukan oleh Schnell et al. (2007), sementara keragaman genetik kakao dengan menggunakan marka SSR telah dilakukan oleh Zang et al. ( 2006). Selain itu, beberapa penelitian untuk mempelajari gen-gen ketahanan kakao terhadap P palmivora juga telah dilakuka n oleh Clement et al. (2003) dan Lanaud et al. (2004).
Analisis keragaman genetik secara molekuler dapat dilakukan dengan berbagai teknik yang telah dikembangkan, antara lain Restriction Fragment
Length Polymorphism (RFLP), Random Amplified Polymorphic DNA (RAPD),
dan Amplified Fragment Length Polymorphism (AFLP), dan Simple Sequence
Repeats (SSR). Masing- masing metode memiliki kelebihan dan keterbatasan. Di
antara berbagai metode yang telah dilakukan, SSR merupakan salah satu teknik yang lebih banyak d ipilih.
SSR (Simple Sequens Repeats) yang dikenal juga sebagai mikrosatelit adalah lokus spesifik, kodominan, merupakan marka molekuler yang didasarkan pada sekuens DNA repetitif. SSR tersusun atas dua sampai enam DN A seperti (AT)n, (AGC)n, atau (GACA)n
Pemanfaatan marka SSR untuk mengidentifikasi keragaman genetik telah banyak dilakukan pada berbagai jenis tanaman baik tanaman monokotil maupun dikotil. Freeman et al. (2004) menggunakan marka SSR untuk menentukan keragaman pada tanaman teh, Priolli et al. (2002) pada kedelai; Kacar et al. (2005) pada chery; Solodenko et al. (2005) pada helianthus, serta masih banyak komoditas lainnya. Hal ini menunjukkan bahwa dengan berbagai kelebihan yang dimiliki, marka SSR sangat potensial untuk dikembangkan sebagai marka molekuler terutama untuk ke perluan ide ntifikasi da n studi keragaman genetik.
yang tersebar pada genom mahluk hidup eukariotik. Variasi alel pada lokus mikrosatelit dengan mudah dapat diperoleh dengan teknik PCR menggunakan primer spesifik. Mikrosatelit telah digunakan secara luas pada berbagai jenis tanaman karena tingkat polimorfisme yang tinggi, lokus yang spesifik, mudah diperbanyak, hanya membutuhkan sedikit DNA, dan yang terpenting adalah sifatnya yang kodominan (Pugh 2004)
Penggunaan marka SSR untuk studi keragaman genetik kakao koleksi internasional telah dilakukan (Saunders et al. 2004) ; (Zang et al. 2009), akan
tetapi hingga saat ini belum ada informasi mengenai keragaman genetik plasma nutfah kakao koleksi Indo nesia. Sebagai salah satu negara produsen kakao yang sedang mengembangkan upaya pemuliaan tanaman ini, maka infor masi genetik plasma nutfah kakao koleksi Indonesia sangat diperlukan. Untuk mendapatkan infor masi genetik maka perlu dilakuka n analisis keragaman genetik tanaman kakao koleksi Puslit Kopi dan Kakao Indonesia, sehingga pemulian tanaman kakao akan lebih terarah. Puslit Kop i da n Kakao Indo nesia mengoleksi hampir semua klon kakao yang terdapat di berbagai sentra produksi kakao di Indonesia, sehingga informasi keragaman genetik plassma nutfah kakao koleksi Puslit Kopi dan Kakao ini dapat merepresentasikan keragaman plasma nutfah kakao Indo nesia.
Penelitian ini bertujuan untuk : (1) menganalisis keragaman plasma nutfah kakao berdasarkan karakter morfologis; (2) karakterisasi kakao koleksi Puslit Kopi dan Kakao Indonesia menggunakan marka SSR; (3) menganalisis keragaman genetik klon-klon kakao koleksi Puslit Kopi dan Kakao Indonesia dengan menggunakan marka SSR.
Bahan Dan Metode
Penelitian ini terdiri atas dua tahap, yaitu: 1) karakterisasi tanaman berdasarkan ciri morfologi; 2) penggunaan marka SSR untuk analisis keragaman genetik plasma nutfah kakao.
1. Karakterisasi tanaman kakao berdasarkan marka morfologi
Tempat dan Waktu
Penelitian dilakukan di Puslit Kopi dan Kakao Indonesia di Jember dan Laboratorium Biologi Molekuler Tanaman, Program Studi Agronomi dan Hortikultura, Fakultas Pertanian IPB, mulai bulan Juli sampai dengan September 2008.
Prosedur
Tahap ini dilakukan untuk mendeskripsikan karakter morfologis 22 klon kakao dengan menggunakan deskriptor list yang telah dikemba ngka n untuk kakao. Hasil kegiatan pada tahap ini akan digunakan untuk melaksanakan kegiatan selanjutnya.
Pengamatan dilakukan secara langsung terhadap karakter-karakter yang telah ditentuka n. Adapun karakter morfologi yang akan diamati meliputi: 1)Deskrips i Pohon, berupa : Vigor Tanaman; Tipe percabangan; Tinggi jorket, 2) Deskripsi Daun : Panjang ; Lebar ; Bentuk helai daun; Bentuk ujung; Bentuk pangkal; Tepi helai daun; Tekstur permukaan; Tekstur permukaan; Warna flush; Warna daun, 3) Deskrips i Bunga, meliputi: K eadaan staminode ; Warna kelopak; Warna mahko ta; Pewarnaan anthocyanin; Intensitas pe warnaan anthocyanin; Warna kuncup bunga; Warna tangkai, 4) Buah: Intensitas buah; Bent uk buah; Bentuk pangkal/leher botol; Bentuk ujung; Ukuran buah; Ketebalan kulit; Permukaan; Kedalaman alur; Warna kulit buah muda; Warna kulit buah masak; Pewarnaan anthocyanin pada alur, 5) Biji: Bentuk; Warna kot iledo n; Panjang; Lebar; Ketebalan; Bobot biji kering; Jumlah biji/tongko l; Kadar kulit ari.
Karakter morfologi plasma nutfah kakao yang telah diidentifikasi pada kegiatan sebelumnya selanjutnya dianalisis dengan bantuan perangkat lunak NTSys versi 2.02, untuk mendapatkan dendogram keragaman genotipe kakao berdasarkan marka morfologis.
2. Penggunaan marka SSR untuk studi keragaman genetik plas ma nutfah kakao
Tempat dan Waktu
Penelitian dilaksanaka n di Laboratorium “Biodiversity and Conservation”, Central of Agricultural Biotechnology Kasetsart University Thailand, mulai bulan September 2008 sampai dengan Januari 2009
Bahan tanaman dan ekstraksi DNA kakao
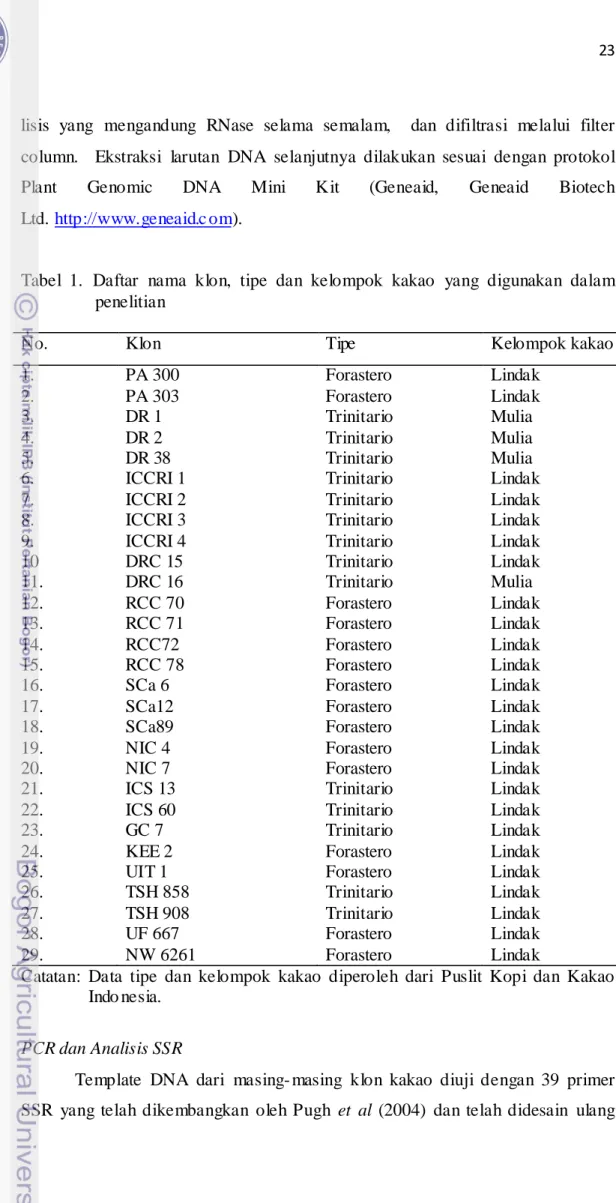
Seluruh bahan tanaman yang berupa 29 klon kakao diperoleh dari Puslit Kopi dan Kakao Indonesia, Jember (Tabe l 1). Dari 29 klon tersebut, 15 di antaranya merupakan klon-klon yang biasa digunakan sebagai tetua dalam persilangan. Lebih kurang 20-30 mg daun kering dipotong kecil-kecil dan dimasukkan ke dalam tabung eppendorf bersama bola gir kecil. Sampel daun diha ncurka n dalam mesin penghancur jaringan (Retsch MM301) selama 3 menit dengan frekuensi 300 hertz. Jaringan yang sudah hancur diinkubasi dengan buffer
lisis yang mengandung RNase selama semalam, dan difiltrasi melalui filter column. Ekstraksi larutan DNA selanjutnya dilakukan sesuai dengan protokol Plant Genomic DNA Mini Kit (Geneaid, Geneaid Biotech Ltd. http://www.geneaid.c om).
Tabel 1. Daftar nama klon, tipe dan kelompok kakao yang digunakan dalam penelitian
No. Klon Tipe Kelompok kakao
1. 2. 3. 4. 5. 6. 7. 8. 9. 10 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. PA 300 PA 303 DR 1 DR 2 DR 38 ICCRI 1 ICCRI 2 ICCRI 3 ICCRI 4 DRC 15 DRC 16 RCC 70 RCC 71 RCC72 RCC 78 SCa 6 SCa12 SCa89 NIC 4 NIC 7 ICS 13 ICS 60 GC 7 KEE 2 UIT 1 TSH 858 TSH 908 UF 667 NW 6261 Forastero Forastero Trinitario Trinitario Trinitario Trinitario Trinitario Trinitario Trinitario Trinitario Trinitario Forastero Forastero Forastero Forastero Forastero Forastero Forastero Forastero Forastero Trinitario Trinitario Trinitario Forastero Forastero Trinitario Trinitario Forastero Forastero Lindak Lindak Mulia Mulia Mulia Lindak Lindak Lindak Lindak Lindak Mulia Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak Lindak
Catatan: Data tipe dan kelompok kakao diperoleh dari Puslit Kopi dan Kakao Indo nesia.
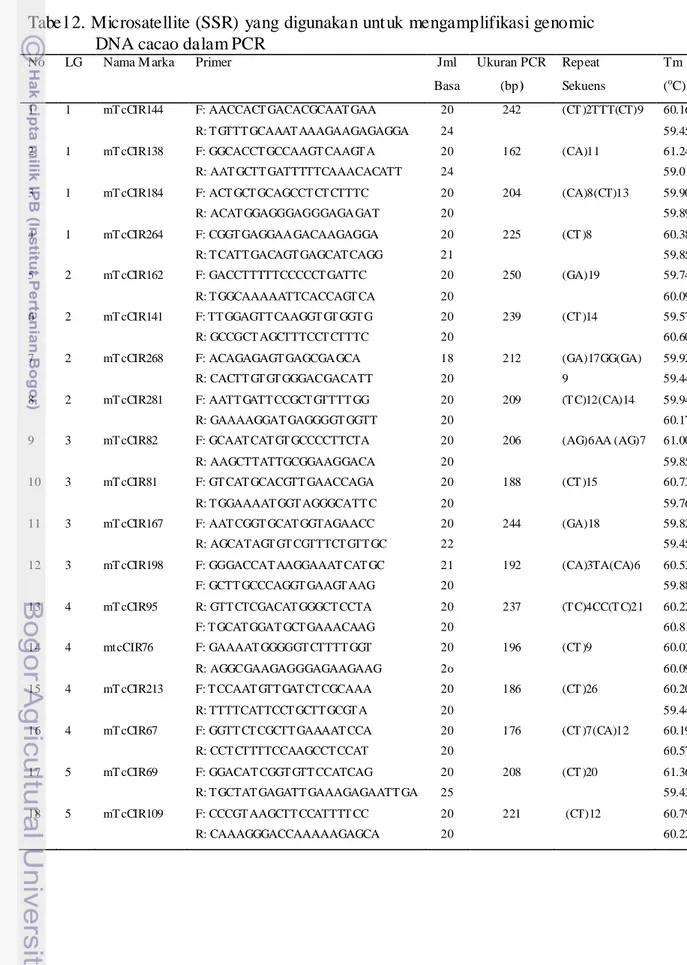
PCR dan Analisis SSR
Template DNA dari masing- masing klon kakao diuji dengan 39 primer SSR yang telah dikembangkan oleh Pugh et al (2004) dan telah didesain ulang
urutan nukleotidanya dengan menggunakan program Primer 3 (tabel 2). PCR dilakukan de ngan total volume 15 µl, terdiri atas 2 µl DNA template, 1 µl primer (kons. 10 pmol), 1.5 µl 10x buffer, 0.15 µl MgCl, 0.075 µl Taq DNA po lymerase, dan 2.7 µl dNTP.
Tabe l 2. Microsatellite (SSR) yang digunakan unt uk mengamplifikasi genomic DNA cacao dalam PCR
No LG Nama M arka Primer Jml
Basa Ukuran PCR (bp) Repeat Sekuens Tm (oC)
1 1 mT cCIR144 F: AACCACT GACACGCAAT GAA R: T GTTT GCAAAT AAAGAAGAGAGGA
20 24
242 (CT )2TTT(CT)9 60.16 59.45 2 1 mT cCIR138 F: GGCACCT GCCAAGT CAAGT A
R: AAT GCTT GATTTTTCAAACACATT
20 24
162 (CA)11 61.24 59.01 3 1 mT cCIR184 F: ACT GCT GCAGCCT CT CTTTC
R: ACAT GGAGGGAGGGAGA GAT
20 20
204 (CA)8(CT)13 59.90 59.89 4 1 mT cCIR264 F: CGGT GAGGAA GACAAGAGGA
R: T CATT GACAGT GAGCAT CAGG
20 21
225 (CT )8 60.38 59.85 5 2 mT cCIR162 F: GACCTTTTTCCCCCT GATTC
R: T GGCAAAAATTCACCAGT CA
20 20
250 (GA)19 59.74 60.09 6 2 mT cCIR141 F: TT GGAGTT CAAGGT GT GGT G
R: GCCGCT AGCTTTCCT CTTTC
20 20
239 (CT )14 59.57 60.60 7 2 mT cCIR268 F: ACAGAGAGT GAGCGA GCA
R: CACTT GT GT GGGACGACATT 18 20 212 (GA)17GG(GA) 9 59.92 59.44 8 2 mT cCIR281 F: AATT GATT CCGCT GTTTT GG
R: GAAAAGGAT GAGGGGT GGTT
20 20
209 (T C)12(CA)14 59.94 60.17 9 3 mT cCIR82 F: GCAAT CAT GT GCCCCTTCTA
R: AAGCTTATTGCGGAAGGACA
20 20
206 (AG)6AA (AG)7 61.00 59.85 10 3 mT cCIR81 F: GT CAT GCACGTT GAACCAGA
R: T GGAAAAT GGT AGGGCATT C
20 20
188 (CT )15 60.73 59.76 11 3 mT cCIR167 F: AAT CGGT GCAT GGTAGAACC
R: AGCATAGT GT CGTTTCT GTT GC
20 22
244 (GA)18 59.82 59.45 12 3 mT cCIR198 F: GGGACCAT AAGGAAAT CAT GC
F: GCTT GCCCAGGT GAAGT AAG
21 20
192 (CA)3TA(CA)6 60.53 59.88 13 4 mT cCIR95 R: GTT CTCGACAT GGGCT CCTA
F: T GCAT GGAT GCT GAAACAAG
20 20 237 (T C)4CC(T C)21 60.22 60.81 14 4 mtcCIR76 F: GAAAAT GGGGGT CTTTT GGT R: AGGCGAAGAGGGAGAAGAAG 20 2o 196 (CT )9 60.03 60.09 15 4 mT cCIR213 F: T CCAAT GTT GAT CT CGCAAA
R: TTTTCATTCCT GCTT GCGT A
20 20
186 (CT )26 60.20 59.44 16 4 mT cCIR67 F: GGTT CT CGCTT GAAAAT CCA
R: CCT CTTTTCCAAGCCT CCAT
20 20
176 (CT )7(CA)12 60.19 60.57 17 5 mT cCIR69 F: GGACAT CGGT GTT CCATCAG
R: T GCTAT GAGATT GAAAGAGAATT GA 20 25
208 (CT )20 61.36 59.43 18 5 mT cCIR109 F: CCCGT AAGCTT CCATTTT CC
R: CAAAGGGACCAAAAAGAGCA
20 20
221 (CT)12 60.79 60.22
19 5 mT cCIR106 F: GGGAGTT AAAAT GGGGCAA G R: TT GCT GTT GTT GT CTT GCTTTT 20 22 246 (GA)9TT G(CA) 3 60.66 59.96 20 5 mT cCIR10 F: CGAATT GACAGAT GGCCT ACA
R: CCCAAGCAAGCCT CATACT C
21 20
122 (T G)13 61.04 59.84 21 6 mT cCIR16, F: CTT CACCAGCT CACCGAT CT
R: AT CAAT GGGTTCGGGT AGT G
20 20
207 (CT )13 60.41 59.67 22 6 mT cCIR255 F: GCCTTACAGCATT CCCAT GA
R: AT CT GCAGGACTT GGACCAC 20 20 193 (AC)11 61.00 60.12 23 6 mT cCIR276 F: T GT GT GTTTAATT GCT CCT GCT R: T GT CT GCCCTTTGACCTTTC 22 20 199 (GA)14 59.81 60.23 24 6 mT cCIR291 F: TT GCAATT GTCCCAAGCAT A
R: AT GT CAAGCAT GGCAGT GTT
20 20
212 (CT )12 60.07 59.17 25 7 mT cCIR186 F: GCGT GT GT GT GCAAAT GATA
R: CCGAT AAAT GGGCGTT GTAG
20 20
155 (T G)8 59.15 60.34 26 7 mT cCIR190 F: CT GAAGCACAATTATTCCAT CAA
R: CCAATT GCT CCACAAAGAGC
23 20
172 (T G)12 59.13 60.78 27 7 mT cCIR7 F: GCTTTCAGT CCTTTGCTTTCA
R: CAGACAAGCCAT GGT CAGT G
21 20
122 (CT )14 59.62 60.31 28 8 mT cCIR99 F: TT CGGAAAT GT CGAGAGAGG
R: CCT CT GCCCAT GATCCT AT G 20 20 167 (GA)9 60.33 60.44 29 8 mT cCIR103 F: CT CCAAGAAAAAGAGGCACA R: TT GT GGTTATT GCGAACGT G 20 20 175 (GA)10 58.08 60.56 30 8 mT cCIR211 F: GGGATT GCACTTCACAAGGT
R: T CCAAGTT CCGT AT GT GCT G
20 20
179 (CT )9 59.97 59.72 31 8 mT cCIR218 F: CAT GCGTT GACCAAGGAAG
R: AT CAAT GCAT GGGAACACCT
19 20
181 (CT )11 60.25 60.20 32 9 mT cCIR90 F: CCAGTTCAAAAAT CAT GTT CAGT G
R: TT GT GGAGCAACT GT CAACC
24 20
155 (CT )10 60.78 59.73 33 9 mT cCIR145 F: T GGAAGGCT GT CCAAAATTC
R: T GTTT GT GT CT GGCTTTT GC
20 20
241 (CT )17 60.05 59.89 34 9 mT cCIR251 F: T CAT GCCCAGT GACACAAAT
R: AAT GGACT GGAGCAT GGAAG
20 20 228 (CT )7(CA)12 59.97 60.07 35 9 mT cCIR287 F: GCGTT GT CT CGCTTT CTTCT R: GGGAAAGCCAT GTT CAT GTT 20 20 160 (T C)9 59.76 59.80 36 10 mT cCIR91 F: GCCCAT GCTT CTCTT CAT GT
R; GGGAAAT GAGAAGGGT GT GA 20 20 191 (CT )10 60.23 59.90 37 10 mT cCIR155 F: CTTAGAGGCTT GT GCCGT GA R: GCCAT GCCAATTTCCAAT AA 20 20 197 (T C)12 61.50 60.65 38 10 mT cCIR209 F: T GT CCTT CACATAAGCCAT GA R: T GTT GCCCTTCCTT GTTAGG 21 20 243 (GT)6AT(GA)9 59.14 60.10 39 10 mT cCIR229 F: T CT GGCCCTT GAGAAT GAGT
R: T CCGCAAT CCT ACAACACAA 20 20 151 (T C)8 59.80 60.11
Proses PCR dilakukan dengan 39 siklus, diawali denaturasi pada 94 oC selama 4 menit, kemudian 39 siklus berikutnya yang terdiri atas denaturasi pada 94 oC selama 45 detik, penempelan (annealing) pada suhu 55 oC selama 45
detik, dan perpanjangan (extension) pada suhu 72 oC selama 30 detik. Tahap terakhir dilanjutkan dengan perpanjangan akhir (final extension) pada suhu 72 oC selama 5 menit dan pendinginan (cooling) sampai suhu 16 oC selama 5 menit. Hasil amplifikasi PCR dievaluasi dengan melakukan running pada gel agarose 1% selama 20 menit pada mesin elektroforesis dengan arus 300 Am dan 200 Volt untuk konfirmasi ada tidaknya produk amplifikasi.
Running PAGE DNA hasil amplifikasi dengan SSR
Proses elektroforesis dimulai dengan penyiapan kaca. Pertama, siapkan dua kaca panjang dan pendek. Kaca panjang dibersihkan dengan etanol 95%, dan dilanjutkan dengan clear view. Untuk kaca pendek dibersihkan dengan etanol 95%, dilanjutkan dengan campuran antara Bind Silane dan asam asetat. Kemudian, dua kaca disusun dengan diberi plat plastik sebagai pembatas dan dijepit dengan empat pasang penjepit. Sementara itu, disiapka n “Microsatelite gel polyacrilamide” yang terdiri atas: 60 ml 4.5% acrilamide ditambah 10% APS µl dan 90 µl TEMED, kemudian diaduk perlahan sampai tercampur. Cairan acrilamide selanjutnya dituangkan secara perlahan ke celah diantara dua kaca, ke mudian disisipka n sisirnya dan dibiarkan sampai gel terpo limerisasi.
Sampel berupa produk PCR sebanyak 2 µl ditambah 3-4 µl pewarna kemudian diaduk dan didenaturasi pada suhu 94° C selama 10 menit. Sementara itu dilakukan pre running elektroforesis dengan buffer 1X TBE hingga mencapai suhu 60o
Pewarnaan perak nitrat dimulai dengan perendaman kaca dalam larutan acetic acid 10% selama 30 menit. Selanjutnya dicuci dengan akuades sebanyak 3x masing- masing selama 10 menit, kemudian dilakukan perendaman pada larutan perak nitrat selama 30 menit, selanjutnya dicuci dengan akuades. Selanjutnya kaca direndam pada larutan developer sambil digoyang hingga nampak pita. Setelah nampak pita, larutan developer dibuang dan terakhir dicuci dengan acetic acid selama 5 detik dan dilanjutkan pencucian terakhir dengan air.
C. 2 µl sampel hasil amplifikasi dimasukka n pada celah sisir sampai semua sampel masuk, dan sampel siap di running pada mesin elektroforesis dengan kondisi 3000 volt, 300 mA, 65 Watt selama 2,5 jam. Setelah selesai, kaca dikeluarkan da n kaca penutupnya dilepaskan dengan hati-hati. Hasil elektroforesis siap untuk diwarnai.
Skoring dan analisis data
Skoring dilakukan terhadap posisi alel hasil amplifikasi PCR untuk masing- masing genotipe pada tiap lokus SSR. Hasil skor ing dilakukan analisis untuk melihat keragaman genetik dengan menggunakan software NTSys, sedangkan tingkat heterosigositas ditentukan dengan menggunakan software CERVUS.
HASIL DAN PEMBAHASAN
Karakterisasi morfologi kakao
Pengamatan karakter morfologi kakao dilakukan secara langsung di lapangan, dengan mengamati bentuk dan karakteristik pohon, bentuk dan karakteristik daun, bentuk dan karakteristik bunga dan bagian-bagiannya, bentuk dan karakteristik buah, dan karakteristik biji. Dari 29 klon kakao yang direncanaka n, hanya 22 klon kakao yang berhasil dikarakterisasi dengan menggunakan deskriptor list yang sudah dikembangkan untuk kakao.
Bentuk daun kakao bervariasi, mulai dari elips, oblong maupun obovate bergantung kepada klonnya. Demikian pula dengan bentuk ujung dan pangkalnya, memiliki keragaman yang cukup tinggi. Variasi bentuk ujung dan pangkal daun berupa runcing, meruncing, maupun membulat terdapat pada berbagai klon kakao yang diamati. Warna flush atau daun muda juga bervariasi diantara berbagai klon yang berbeda (Gambar 3a). Variasi warna flush yang ditemukan pada 22 klon kakao yang diamati adalah coklat, kuning, kuning kecoklatan, coklat kemerahan, dan merah kecoklatan (Gambar 3b). Keragaman warna daun muda ini terjadi karena belum ada klorofil yang terbentuk, tetapi terdapat banyak pigmen kain seperti antosianin, karoten, daqn xantofil. Klorofil baru terbentuk ketika daun mencapa i ukuran sempurna yaitu setelah berumur 3-4 minggu (Prawoto, 2008).