BAB 2
TINJAUAN PUSTAKA
2.1. Baterai
2.1.1. Pengertian Baterai
Baterai adalah unit mandiri yang menyimpan energi kimia dan pada proses charging, mengubahnya langsung menjadi energi listrik untuk daya berbagai aplikasi. Baterai dibagi menjadi tiga kelas umum: baterai primer yang dipakai sekali dan langsung dibuang; sekunder, baterai isi ulang yang bisa di charge dan kemudian dikembalikan ke kondisi semula dengan membalikkan aliran arus melalui sel; dan baterai khusus yang dirancang untuk memenuhi tujuan tertentu (Winter, 2004; Ralph,2004). Ada dua jenis baterai, yaitu baterai primer dan baterai sekunder atau disebut juga non-isi ulang dan isi ulang (Armand,2008). Baterai primer adalah sel, atau sekelompok sel, untuk pembangkitan energi listrik yang dimaksudkan untuk penggunaan sampai habis dan kemudian dibuang. Baterai primer dirakit untuk melepaskan beban yang banyak hal tersebut adalah proses primer selama operasi. Baterai sekunder adalah kelompok sel dari sel untuk pembangkit energi listrik dimana sel, setelah keluar, dapat dikembalikan ke posisi semula disebabkan oleh arus listrik mengalir dalam arah berlawanan dengan aliran arus ketika arus itu dikembalikan ke semula. Istilah lain untuk baterai isi ulang atau akumulator. Baterai sekunder biasanya dirakit di suatu tempat penghabisan, lalu harus diisi terlebih dahulu sebelum dapat menjalani pengembalian dalam proses sekunder (Winter, 2004).
Produksi untuk baterai berbeda, tergantung pada aplikasi. Sementara susunan sel hibrida baterai membutuhkan daya yang tinggi untuk memanfaatkan energi, mobil listik membutuhkan energi untuk kepadatan energi yang tinggi untuk mendapatkan jarak tempuh yang lebih besar. Terdapat kriteria yang berbeda pada baterai tergantung pada aplikasi dan telah memberikan peluang untuk menemukan satu “ solusi emas” yang lebih baik untuk setiap situasi. Sebaliknya,
untuk masa mendatang mungkin akan banyak baterai kimia yang berbeda dan disesuaikan dengan aplikasi bidang tertentu (Nordh, 2013)
Sebuah baterai khusus adalah baterai primer yang diperoduksi secara terbatas untuk penggunaan tertentu. Dalam hal ini baterai khusus tidak akan dibahas pertama. Anoda adalah elektroda negatif dari sel yang terkait dengan reaksi kimia oksidatif yang melepaskan elektron ke dalam sirkuit eksternal. Katoda adalah elektroda positif dari sel yang terkait dengan reaksi kimia reduksi yang memperoleh elektron dari sirkuit eksternal. Massa aktif adalah bahan yang menghasilakan listrik saat ini dengan cara reaksi kimia dalam baterai.
Elektrolit adalah bahan yang menyediakan ionic murni konduktifitas antara elektroda positif dan negatif dari sel. Sebuah pemisah adalah penghalang fisik antara elektroda positif dan negatif dimasukkan ke dalam desain paling sel untuk mencegah korslet listrik. Itu pemisah bisa menjadi elektrolit gel atau mikro yang film plastik atau bahan inert berpori lainnya diisi dengan elektrolit. Pemisah harus permeabel untuk ion dan ionik dalam lingkungan baterai. Sebuah sel bahan bakar adalah perangkat konversi elektrokimia yang memiliki kelangsungan penyediaan bahan bakar seperti hidrogen, gas alam, atau metanol dan oksidan seperti oksigen, udara, atau hidrogen peroksida.
Hal ini dapat memiliki bagian tambahan untuk memberi makan perangkat dengan reaktan sebagai serta baterai untuk memasok energi untuk pemulaan. Discharge adalah operasi di mana baterai memberikan energi listrik ke beban eksternal. Charge adalah operasi di mana baterai dikembalikan ke kondisi terisi aslinya oleh pembalikan dari aliran arus (Nordh, 2013)
2.1.2. Pengoprasian Baterai
Dalam reaksi redoks, salah satu material aktif teroksidasi dengan memberikan elektron sehingga bilangan oksidasi naik dan material aktif lain tereduksi dengan menerima elektron dan dengan demikian mengurangi bilangan oksidasinya. Secara fisik, reaksi oksidasi terpisah dari reaksi reduksi dan membawa elektron melalui sirkuit eksternal sehingga elemen galvanik (atau sel baterai) terbentuk. Selama elektron bergerak melalui sirkuit eksternal maka akan ada arus yang dapat digunakan, sebagai contohnya kekuatan bola lampu di senter. Tujuan dari semua
baterai adalah untuk mengkonversi energi kimia yang tersimpan menjadi energi listrik. Setiap reaksi redoks memiliki tegangan tertentu yang terkait dengan itu. Ada nilai absolut praktis untuk potensi ini, sehingga sistem pengukuran relatif digunakan sebagai gantinya.
Dalam sel baterai, site reduksi selalu disebut katoda dan site oksidasi disebut anoda. Yang elektroda yang bertindak sebagai anoda dan yang bertindak sebagai katoda ditentukan oleh seberapa potensial reduksi standar mereka berhubungan satu sama lain, dan dengan demikian yang mereka lebih mudah teroksidasi. Elektroda dengan potensial standar yang lebih tinggi akan bertindak sebagai katoda, dan potensi yang lebih rendah sebagai anoda (Winter, 2004).
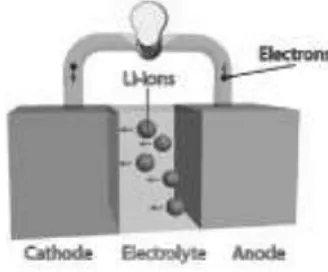
Skema dasar baterai (menggunakan elektrolit Li-ion) ditunjukkan pada Gambar (2.1) dua elektroda dipisahkan oleh elektronik isolasi dan ionically melakukan elektrolit, saat sedang terhubung dengan sebuah sirkuit eksternal yang mengalir elektron. elektrolit biasanya larutan garam. Jika elektrolit tidak elektronik isolasi, elektron akan diangkut melalui elektrolit bukan melalui sirkuit eksternal, dan baterai akan hubung pendek, sehingga menimbulkan kerugian kapasitas. Namun demikian, banyak elektrolit memiliki beberapa konduksi elektronik dan meskipun itu rendah, masih ada. Sementara konduksi ini tidak cukup untuk baterai sirkuit pendek dan rate yang cepat, hal itu akan menyebabkan lambat self-discharge dari waktu ke waktu, sehingga dalam waktu penyimpanan yang terbatas dari baterai (Winter, 2004).
Gambar 2.1. Skema baterai Lithium ion yang sederhana
Gambar (2.1) menampilkan skema yang sangat sederhana dari baterai. Namun, ada beberapa komponen yang lebih diperlukan untuk sebagian besar baterai agar berfungsi praktis. Skema dari baterai bekerja lebih sering terlihat seperti pada Gambar (2.2) elektroda harus dipisahkan secara mekanis, jika baterai akan pendek sirkuit dan bisa hancur. elektrolit cair lebih disukai karena konduktivitas ionik
yang tinggi, tetapi cairan elektrolit memiliki stabilitas mekanik yang kurang untuk mencegah kontak antara elektroda. Solusi untuk ini telah menjadi pemisah, sering kali polimer atau gelas berpori serat direndam dengan cairan elektrolit untuk mengabungkan pemisahan fisik dan konduktifitas ionik. Bahan aktif itu sendiri sering disebut dengan konduktor elektronik rendah, dan oleh karena itu elektroda dibuat sebagai komposit dengan bahan aditif untuk meningkatkan konduktivitasnya. Saat current collector memberikan kontak yang baik antara elektroda dan sirkuit eksternal (Winter, 2004).
Gambar 2.2. Skema lengkap baterai Lithium ion
Menunjukan bahwa baterai yang mengandung air hanya memiliki jendela potensial yang stabil antara -0.83V dan 1.229 V tanpa menghasilkan gas hidrogen atau oksigen. Kebanyakan baterai Li-ion komersial memiliki potensial bekerjanya dibawah -0.83 V, dan oleh karena itu yang terpenting untuk memastikan agar menghilangkan semua air saat pembuatan baterai Li-ion jika ada semburan gas beracun itu harus dihindari.
Ada beberapa cara untuk menentukan kinerja baterai. Empat konsep umum yang terpenting untuk energi dan listrik. Energi dapat dinyatakan dalam energi spesifik yang diukur dengan Wh/kg dan kepadatan energi diukur dengan Wh/L. kepadatan energi juga dapat diukur dengan gravimetrik dan velumetri, masing-masing daya listrik yang spesifik dinyatakan dalam (W/kg) dan kerapatan daya (W/L) (Nordh, 2013).
Kerapatan daya/ power spesifik dan kepadan energi/ energi spesifik dari baterai dapat diubah oleh desain sel. Ketebalan lapisan bahan elektroda memberikan energi yang tinggi akibatnya peningkatan jumlah pada bahan aktif, tetapi ini juga meningkatkan panjang difusi ion dalam materi ion yang ada,yang pada dasarnya
menurunkan daya. Sebaliknya, lapisan tipis elektroda memberikan jalur difusi singkat dan power lebih tinggi. Tetapi mereka berisi materi aktif kurang banyak dan akibatnya densitas energi tersebut menurun. Dengan demikian, perbaikan satu sifat (ketebalan coating) sering dapat mengurangi biaya produksi (Nordh, 2013).
2.1.3. Komponen dalam Lembaran Elektroda
Lembaran elektroda dalam baterai sering digabungkan dari beberapa bahan; tiga komponen utama komponen yang yaitu bahan aktif, konduktor elektronik dan pengikat. Bahan aktif adalah bahan yang mengambil bagian dalam reaksi redoks yang menghasilkan arus dalam baterai. Bahan aktif memiliki konduksi elektronik yang rendah, dan karena itu konduktor elektronik perlu ditambahkan. Karena bahan aktif dan ditambah konduktif dan dicampur dalam bentuk bubuk, pengikatnya ditambahkan untuk membuat pegangan elektroda bersama-sama. Campuran elektroda ini dilapiskan ke kolektor dalam proses manufaktur dan karena itu tidak dapat dipisahkan lagi (Nordh, 2013).
2.2. Baterai Ion Lithium
Baterai lithium pertama kali diusulkan pada tahun 1976 dan telah banyak digunakan dalam aplikasi portable sejak awal 1990-an. Dalam beberapa tahun terakhir, tingginya harga minyak telah memberikan inisiatif bagi para peneliti untuk melihat ke dalam teknologi baterai baru yang dapat digunakan dalam aplikasi kendaraan listrik. Di Kalangan baterai lithium, ada tiga kategori pembagian, yaitu: logam lithium, lithium polymer dan ion lithium. (Whitingham,1976).
Lithium ion tidak memiliki definisi kimia yang unik seperti asam timbal, nikel metal hidrida atau Baterai Nickel Cadmium. Sebuah sel lithium ion memiliki tiga utama komponen: elektroda positif (katoda), elektroda negatif (anoda) dan separator. Di setiap sel memiliki kelebihan dan kekurangan. Di satu sisi, berbagai bahan katoda dan anoda memberikan fleksibilitas untuk merancang baterai untuk kebutuhan aplikasi yang spesifik, namun di sisi lain dalam jumlah yang besar,
kemungkinan menimbulkan kebingungan pada reaksi kimia tertentu yang dikembangkan dan berhasil diuji di lapangan. (Whittingham, 1976).
Berbagai pilihan yang tersedia untuk masing-masing komponen (manfaat dan kerugian) dijelaskan secara rinci di bawah ini. Karakteristik listrik dan kinerja baterai seperti tegangan, kapasitas, kepadatan energi, tingkat kemampuan, siklus hidup, dan lama hidup akan berubah sebagai salah satu konsekuensi dalam memilih bahan yang berbeda untuk anoda, katoda, elektrolit dan separator. Seperti yang akan ditampilkan nanti, tidak ada satu kombinasi tertentu komponen sel tersebut yang dapat memenuhi setiap kebutuhan di semua aplikasi. Harus memilih salah satu dan memodifikasi komponen sel untuk memenuhi kebutuhan aplikasi. Selain itu, kita juga dapat merubah komposisi bahan katoda dan anoda, ukuran partikel dan morfologi untuk mencapai kinerja baterai tertentu, baterai lithium jauh lebih kecil dan lebih ringan dibandingkan dengan semua teknologi lainnya. Seperti yang diketahui bahwa baterai lithium adalah baterai yang memiliki aliran paling besar di antara semua teknologi penyimpanan energi. (Whittingham, 1976)
2.2.1. Spesifikasi Kimia Baterai Ion Lithium
Sejak dikomersialisasi baterai Lithium-ion yang dapat diisi ulang awal 1990-an, lithium yang berbasis kimia telah memiliki pangsa yang semakin meningkat dari pasar global. Hal ini karena lithium memiliki beberapa bahan sifat kimia dan fisik yang jauh dari yang diinginkan. Pertama, lithium adalah unsur yang paling elektronegatif dalam NPT reduksi standar potensi seri dengan potensial elektroda negatif -3.05 V. Hal ini memungkinkan untuk memproduksi baterai dengan tegangan sel 6 V, meskipun 3-3.5 V adalah rentang tegangan yang paling umum untuk baterai lithium. Hasil tegangan tinggi dalam baterai mampu melakukan lebih banyak pekerjaan dengan jumlah pembawa muatan yang sama, yaitu, baterai memiliki energi spesifik yang lebih tinggi dari sel setara dengan tegangan yang lebih rendah. Kedua, lithium adalah salah satu unsur paling ringan dan terkecil dalam tabel periodik. Hal ini membuat lebih mudah untuk membuat desain baterai lebih ringan dan lebih kecil, dan akibatnya lithium memiliki kepadatan energi gravimetri dan volumetrik lebih tinggi dari sel setara dengan elemen yang lebih
berat. Jari-jari ionik juga membuat baterai relatif mudah untuk menemukan bahan interkalasi yang baik (Nordh, 2013).
Lithium logam murni akan menghasilkan energi volumetrik dan gravimetrik tertinggi untuk baterai lithium. Logam lithium sendiri adalah elektronik konduktif yang memiliki sifat mekanik yang baik, sehingga tidak ada tambahan yang diperlukan. Dengan adanya elektrolit dalam baterai baterai, lithium memiliki spesifik yang lebih tinggi. Namun, dengan menggunakan logam lithium menimbulkan masalah besar dalam sel sekunder. Setelah pengisian, ketika ion lithium kembali pindah ke lithium logam foil, terjadi pembentukan dendrit. Setelah berulang kali dendrit ini mencoba tumbuh ke sisi positif dari baterai dan dengan demikian terjadi arus pendek pada seluruh baterai, dengan kemungkinan dalam scenario kasus terburuk terjadi ledakan. Masalah keamanan ini terlalu besar untuk diabaikan , dan karena itu alternatif sumber lithium perlu digunakan. Ketika memecahkan masalah dendrit yang berhubungan dengan litium logam, banyak jalan alternatif yang dieksplorasi dan hasil yang paling menjanjikan berasal dari senyawa interkalasi. Suatu senyawa interkalasi bekerja sebagai matrik dimana lithium ion disimpan. Struktur host materi secara keseluruhan tidak berubah ketika dimasukan lithium dalam senyawa interkalasi; lithium sebaliknya menemukan lubang dalam struktur dimana ia dapat disimpan (Nordh, 2013).
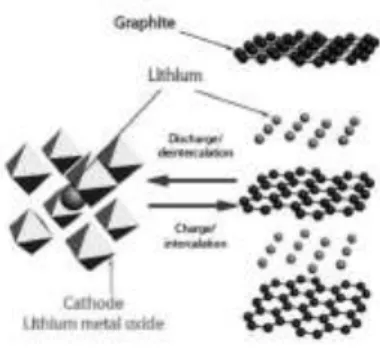
Salah satu elektroda negatif yang paling umum digunakan dalam baterai saat ini adalah grafit. Atom-atom karbon dalam grafit tersusun dalam lapisan halus dengan ikatan van deer waals. Atom lithium kemudian dapat bergerak antara lapisan tersebut dan disimpan (gambar 2.3). Di tengah lapisan terdapat cicin karbon yang memungkinkan satu atom lithium dapat disimpan dalam enam karbon dan membentuk LiC6. Masalah keamanan yang dapat diatasi karena bahan interkalasi yang umumnya tidak mengalami pembentukan dendrit, namun berpengaruh pada energi dan daya spesifik (Nordh 2013). Dapat dilihat pada Gambar 2.3 bahan elektroda menggunakan logam lithium oksida katoda dan anoda grafit. Lithium diselingi antara lapisan grafit saat baterai terisi dan dalam struktur host oksida ketika habis
Gambar 2.3. Skematik bahan elektroda dalam baterai Lithium-ion
2.2.2. Katoda (elektroda positif)
Katoda adalah elektroda positif dari sel yang terkait dengan reaksi kimia reduksi yang memperoleh elektron dari sirkuit eksternal. Katoda disusun dari campuran bahan elektroda (90%), aditif konduktif (6%), bahan pengikat (4%), dan dilukis pada arus kolektor. Li-TMs dengan konduktivitas elektron yang rendah umumnya digunakan sebagai bahan elektroda, penurunan konduktivitas elektroda. Maka, beberapa karbon konduktif seperti grafit, Acethylene Black (AB), Ketjen Black (KB) kembali ditambahkan untuk meningkatkan sifat konduktif dari elektroda. Polimer fluorocarbon seperti Polytetra Fluoroethylene (PTFE), Polyvinylidene-difluoride (PVdF), dan Polyvinyl-fluoride (PVF) biasanya digunakan sebagai pengikat untuk menghubungkan setiap partikel dari bahan elektroda. Foil biasanya digunakan sebagai arus kolektor, karena harus bertahan dengan kondisi oksidasi yang tinggi (~4V vs Li+/Li).
2.2.3. Elektrolit
Elektrolit adalah bahan yang menyediakan ionic murni konduktifitas antara elektroda positif dan negatif dari sel. Elektrolit dalam sel komersial memilki sejumlah aditif untuk meningkatkan kinerja baterai dan keselamatan, resep khusus untuk sebagian besar elektrolit komersial menjadi rahasia yang dijaga ketat. Secara umum, kebanyakan elektrolit komersial mengandung karbonat organik dan
garam lithium, dimana LiPF6 adalah garam yang paling umum digunakan (Ronci, 2002).
2.2.4. Anoda
Anoda adalah elektroda negatif dari sel yang terkait dengan reaksi kimia oksidatif yang melepaskan elektron ke dalam sirkuit eksternal. Anoda tersusun oleh karbon (seperti grafit dan karbon berat) sebagai bahan dasar (90%) dan bahan pengikat (10%). Untuk mencegah paduan Li pada kondisi reduksi rendah, terdapat Cu-foil yang digunakan sebagai pengganti arus kolektor dari Al-foil.
2.3. Grafit sebagai Anoda
Baterai yang paling umum, lithium-ion memiliki grafit sebagai anoda, bekerja pada -2.5 V vs elektroda hidrogen standar. Dan bahkan interkalasi lain, umumnya oksida logam transisi, sebagai katoda bekerja sekitar 1.0 V. Memiliki satu elektroda yang bekerja pada -2.5V dan yang lainnya di 1.0 V, sehingga total potensial dimana baterai beroperasi adalah 3.5 V. Potensial ini memang cukup besar untuk membuat elektrolit tetap stabil secara kimiawi dari kedua reaksi, oksidasi dan reduksi. Bahkan, sebagian besar elektrolit tidak stabil dalam potensial yang ada dalam baterai lithium (Xu, 2004).
2.4. Li2Ti5O12 sebagai Anoda
Potensi elektrokimia yang rendah terkait dengan interkalasi lithium dalam grafit menimbulkan resiko dalam keadaan tertentu; masalah dengan dendrit lithium tidak sepenuhnya dihindari, dan dalam kondisi dingin atau kepadatan arus tinggi, lithium plating dan pembentukan dendrit dapat terjadi pada permukaan grafit. Dalam hal ini, LTO disarankan sebagai pengganti grafit dalam aplikasi dayanya tinggi karena potensi kerjanya 1.55 V mengurangi resiko pembentukan dendrit dibandingkan dengan grafit. Selain itu, lithiated dan delithiated dari KPP memiliki parameter sel yang sama, sehingga volume berubah menjadi nol selama cycling,
sehingga membuat bahan nol menjadi sebuah tegangan. Grafit mengalami perubahan volume 10% selama cycling yang menyebabkan SEI retak dan memungkinkan elektrolit dekomposisi ikut terlibat. Hal ini dianggap sebagai salah satu mekanisme degradasi jangka panjang dalam baterai dengan anoda grafit ( Vetter, 2005; Verma, 2010). Perubahan volume yang akan diperpanjang untuk proses cycling akan diperpanjang tanpa adanya kegagalan mekanis atau retak dari SEI. Pemilihan KPP sebagai pengganti LIB anoda juga dianggap karena relatif kelebihan elemen yang diperlukan, memungkinkan produksi pada skala besar dengan biaya yang rendah. Namun, meskipun tegangan operasi tinggi, itu belum sepenuhnya eksperimental yang diverifikasi bahwa LTO adalah bahan SEI bebas (Kitta, 2012; Song, 2014) tidak konklusif, dan tori-teori dalam literatur mencakup kemungkinan adanya sebuah SEI, (Jang, 1996).
2.5. SEI sebagai Anoda
Yang paling sering terjadi adalah anoda akan bertindak sebagai katalis dan garam organik dalam elektrolit bereaksi membentuk zat baru pada permukaan anoda. Layer baru ini bersifat pasif pada permukaan elektroda, sehingga mencegah reaksi lebih lanjut dalam elektrolit. Lapisan ini disebut Solid Electrolyte Interface (atau SEI) (Nordh, 2013).
Dapat dilihat dari Gambar 2.4 kemungkinan kombinasi bahan di lapisan SEI pada grafit, dengan ketebalan yang khas. SEI bermanfaat bagi baterai, dalam arti bahwa SEI merupakan elektroda pasif yang bereaksi dengan elektrolit, tetapi juga memiliki beberapa kelemahan. Difusi ion dapat menurun dengan lapisan SEI, sehingga mengurangi daya maksimum yang dapat diekstraksi dari baterai.
Pembentukan lapisan SEI juga mengkonsumsi bahan aktif, sehingga mengurangi kapasitas baterai. Selain itu, selama interkalasi dan deinterkalasi, bahan dasar sering mengalami perubahan volume. Perubahan volume ini akan membentuk retakan di SEI dan SEI baru akan terbentuk pada saat terjadi retakan. Setelah itu terjadi berulang-ulang, maka perlahan-lahan akan mengurangi kapasitas dari baterai (Winter, 2004; Palacin, 2009).
2.6. Lithium Titanate
Lithium titanate bekerja sebagai material anoda dengan perpindahan dari Li4Ti5O12 ke Li7Ti5O12 selama charge. Rumus reaksi berikut ini juga menunjukkan perubahan struktur (Koshiba, 1994).
Pembentukan SEI mengarah pada hilangnya kapasitas ireversibel misalnya karena komsumsi bahan aktif, ketebalan lapisan tipis pada umumnya negatif. Jumlah SEI terbentuk tergantung pada luas permukaan aktif materi, yang pada umumnya menghalangi penggunaan bahan berstruktur nano di elektroda, karena ini akan memiliki kekurangan yang terlalu tinggi dari kapasitas sesuai pembentukan SEI. Jika LTE adalah pasif bebas, akan membuka kemungkinan untuk membuat berstruktur nano elektroda, yang yang akan meningkatkan kekuatan dan operasi kemampuan khusus dari anoda karena jalur difusi lebih sedikit daerah reaksi yang lebih besar.
Potensi tertinggi dari lithium titanat harus memungkinkan menggunakan aluminium sebagai anoda kolektor yang mengandung tembaga, yang akan mengurangi biaya produksi dan juga meningkatkan keamanan baterai. Sebuah potensi kerja lebih dekat dengan lithium logam akan beresiko pada pembentukan lithium logam pada permukaan anoda, dan dengan demikian kemungkinan pembentukan dendrit yang merupakan potensi yang berbahaya.
LTO memiliki potensi kerja sebesar 1.55 V vs lithium dan LMO yang memiliki potensi kerja sekitar 4 V vs lithium. Oleh karena itu, sel dengan LTO vs LMO akan menghasilkan tegangan tinggi sekitar 2.5 V. LTO menunjukkan
kemampuan yang baik dengan beberapa ribu siklus perputaran dan masih mempertahankan lebih dari 80% dari kapasitas awal (80% dari kapasitas awal adalah pedoman komersial untuk benchmark, ketika baterai diturunkan dibawah 80% dari yang sebelumnya maka kapasitas itu dianggap sebagai kelemahan baterai tersebut).
Umur panjang dipandang sebagai faktor sebagai yang sangat penting ketika memproduksi baterai. Ini dipandang sebagai salah satu keuntungan yang kuat dari bahan LTO, rendering itu sangat cocok untuk kendaraan hybrid yang siklus baterainya sangat banyak. Selanjutnya sifat yang menjadi bahan zero-regangan membuat LTO salah satu bahan anoda dengan kemampuan tingkat tertinggi yang ada. Ini juga keuntungan besar di industri otomotif, dimana kendaraan besar harus mempercepat dan memperlambat pada proses pengereman regenerative, yaitu, dengan menggunakan tingkat tinggi (Wu, 2012; Pasquier, 2009).
2.7. Proses Pembuatan
2.7.1. Proses Metalurgi Serbuk
Metalurgi serbuk adalah suatu kegiatan yang mencakup pembuatan bahan komersil dari serbuk logam melalui penekanan. Proses ini dapat disertai milling, penekanan dan pemanasan. Selama proses penekanan atau sesudahnya disebut sinter, menghasilkan pengikat partikel halus. Dengan demikian kekuatan dan sifat fisis lainnya meningkat. Produk hasil metalurgi serbuk dapat terdiri dari produk campuran serbuk berbagai logam atau dapat berupa bahan bukan logam untuk meningkatkan ikatan partikel dan mutu benda secara keseluruhan.
Ukuran serbuk, partikel, bentuk dan distribusi logam mempengaruhi karakteristik dan sifat fisis dari benda yang dimamfaatkan, serbuk dibuat menurut spesifikasi antara lain bentuk, kehalusan, distribusi ukuran, mampu alir, berat jenis dan sifat sinter (Amstead, 1995).
2.7.2. Proses Pirolisa
Pirolisis adalah dekomposisi kimia bahan organik memalui proses pemanasan tanpa atau sedikit oksigen atau reagen lainnya, dimana material mentah akan mengalami pemecahan struktur kimia mejadi fase gas. Pirrolisis adalah kasus khusus termolisis. Pirolisis ekstrim, yang hanya meninggalkan karbon sebagai residu, disebut karbonisasi. Pirolisis adalah kasus khusus dari termolisis yang terkait dengan proses kimia charring, dan yang paling sering digunakan untuk organik bahan. Hal ini terjadi secara spontan pada temperatur tinggi ( misalnya d atas 300oC untuk kayu, itu berbeda untuk bahan lainnya), misalnya dalam kebakaran atau ketika vegetasi datang kedalam kontak dengan lava dalam letusan gunung barapi. Secara umum, gas dan cairan menghasilkan produk dan meninggalkan residu pada kaya kandungan karbon. Ekstrime pirolisis, yang daun karbon sebagai residu, disebut karbonisasi. Hal itu melibatkan reaksi dengan oksigen atau reagen lainnya, tetapi dapat terjadi dalam kehadiran mereka.
Pirolisis yang banyak digunkaan dalam industry kimia, misalnya, untuk menghasilkan arang, karbon aktif, methanol dan bahan kimia lainnya dari kayu, untuk mengubah ethylene dichloride ke yinil kloride untuk membuat PVC, untuk memproduksi kokas dari batu bara, untuk mengubah biomassa menjadi gas sintesis, untuk mengubah limbah menjadi bahan sekali pakai dengan aman, dan untuk retak-menengah-berat hidrokarbon dari minyak untuk memproduksi lebih ringan yang seperti bensin.( https://arumaarifu.wordpress.com/2010/02/05/apa-itu-pirolisis/)
2.7.3. Kalsinasi
Kalsinasi merupakan proses penghilangan kandungan air kristal atau inherent moisture pada suatu bubuk. Temperatur yang digunakan dalam proses ini harus lebih tinggi dari proses pengeringan (drying), tapi tidak melebihi temperatur lelehnya, dan juga tanpa adanya penambahan reagen (binder aditif). Proses kalsinasi ini sering disebut juga proses dekomposisi termal. Artinya pemanasan
pada suhu tinggi yang akan menyebabkan terurainya suatu senyawa dan akan membentuk senyawa baru yang lebih kompleks.
Proses kalsinasi terdiri dari 3 tujuan utama.
1. Tujuan pertama adalah untuk menghilangkan air yang diserap sebagai air Kristal atau air konstitusi.
2. Tujuan kedua adalah untuk menghilangkan CO2, SO2 dan zat volatile lainnya. 3. Tujuan ketiga adalah oksidasi zat sepenuhnya atau sebagian.
Kalsinasi juga dilakukan dalam proses pembakaran, di bawah titik didih zat. Aplikasi yang paling umum, di mana proses kalsinasi dilakukan, adalah dekomposisi CaCO3 ke CaO dan CO2 untuk menghasilkan semen. (Anonim, 2014)
2.7.4. Sintering
Sintering adalah teknik pengolahan yang digunakan untuk memproduksi kerapatan atau densitas yang dikendalikan bahan dan komponen dari logam atau bubuk keramik dengan menerapkan energi panas. Oleh karena itu, sintering dikategorikan dalam elemen sintesis/pengolahan antara empat elemen dasar ilmu dan teknik material. Dalam pengembangan ilmu bahan, sintesis material dan pengolahan telah menjadi penting dalam beberapa tahun terakhir, pentingnya sintering meningkat sebagai teknologi pengolahan material. Sintering adalah salah satu teknologi manusia tertua, yang berasal dari era prasejarah dengan penembakan tembikar. Produksi alat dari besi spons juga dibuat mungkin dengan sintering. Namun demikian, itu hanya setelah tahun 1940-an sintering yang dipelajari fundamental dan ilmiah. (Kang Suk-Joong L, 2005).
2.8. Karakterisasi
Karakterisasi yang dilakukan dalam penelitian ini meliputi : 2.8.1. Karaterisasi X-Ray Diffraction
XRD merupakan alat yang digunakan untuk mengkarakterisasi struktur Kristal, ukuran Kristal dari suatu bahan padat. Semua bahan yang mengandung Kristal tertentu ketika dianalisa menggunakan XRD akan dimunculkan puncak-puncak yang spesifik. Sehingga kelemahan alat ini tidak dapat untuk mengkarakterisasi bahan yang bersifat amorf.
Metode difraksi umumnya digunakan untuk mengindentifikasi senyawa yang belum diketahui yang terkandung dalam suatu padatan dengan cara membandingkan dengan data difraksi database yang dilekuarkan oleh International Centre for Diffarction Data berupa PDF Powder Diffraction File (PDF).
Hasil sintering prekursor dan telah menjadi bahan aktif kemudian dikarakterisasi melalui rangkaian pengujian XRD untuk melihat struktur Kristal dan ukuran kristalit dari bahan aktif Na2Li2Ti6O14. Pada proses pengujian XRD, sejumlah sampel serbuk bahan aktif yang telah disinterring, dimasukan kedalam container kecil untuk ditembaki dengan gelombang yang berasal dari K-Cu α dengan kecepatan sudut penembakan sekitar 5o/menit, untuk menghasilkan data indentifikasi bidang Kristal yang minim akan noise. Pengujian XRD ditujukan untuk mengidentifikasi bidang Kristal Na2Li2Ti6O14 dengan membandingan data difraksi bidang Kristal Li4Ti5O12.
2.8.2. Karakterisasi Electrochemical Impedance Spectroscopy
Spektroskopi impedasi elektrokimia merupakan metode untuk mengetahui proses yang terjadi pada elektroda dengan mengukur perubahan impedansi dan memplot fungsi tersebut kedalam bentuk kompleks. Spektroskopi impedansi elektrokimia dapat mengukur nilai arus dan mengetahui respon lain yang terjadi ketika diterapkan potensial tertentu. Respon elektrik akan memberikan perubahan
impedansi pada permukaan antara elektrolit dan elektroda. Ketika elektroda (permukaan logam) dimasukkan ke dalam elektrolit, muatan listrik pada elektroda menarik ion muatan yang berlawanan dari elektrolit sehingga terjadi penyerahan (polarisasi) muatan. Terjadi polarisasi menyebabkan adanya lapisan antara elektroda dan elektrolit disebut electrical double layer (Leiden, D. 2002). Fenomena ini menujukkan bahwa pada sel baterai memiki sifat kapasitansi. Pengukuran menggukan spektroskopi impedansi dilakukan menggunakan sinyal AC dengan frekuensi tertentu. Spectrum frekuensi yang dibandingkan akan mengindefikasi perubahan impedansi (Z) yang terkait dengan reaksi elektrokimia pada sel baterai. Baik material katoda ataupun anoda yang berupa komposit memungkinkan untuk memiliki sifat kapasitansi dari dari proses sintesis yang terjadi. Impedansi merupakan perluasan konsep hambatan (R) pada rangkaian AC sehingga disebut impedansi AC.
2.8.3. Karakterisasi Cyclic Voltammetry
Teknik analisis elektrokimia modern didasarkan pada beberapa jenis teknik analisis seperti teknik sweep, teknik step dan teknik pulsa. Teknik sweep diantaranya yaitu Linear sweep Voltammetry (LSV), Cyclic Voltammetry (CV) dan Palaografi. Linear sweep voltammetry merupakann metode yang paling dasar dalam metode potensial sweep. LSV merupakan teknik satu kali sweep. Dalam LSV, elektroda diberikan potensial mulai dari potensial awal (Ef) sampai potensial akhir (Ei), selama pemberian potensial perubahan nilai diukur melalui pergerakan kurva. Proses yang terjadi dalam sel pada keadaan awal atau tidak ada potensial (open circuit). Kation dan anion berada pada keadaan diam ditengah antara elektroda kerja/working electrode (WE) dan elektroda pembanding/ counter electrode (CE).
Ketika potensial diberikan pada sel elktrolisis mulai terjadi pergerakan kation dan anion. Penentuan secara voltammetry didasarkan pada respon analit ketika diberi potensial dan memberikan perubahan arus yang membentuk sutau gelombang. Besarnya arus puncak sebanding dengan konsentrasi analit dalam
larutan. Cyclic Voltammetry merupakan teknik yang banyak digunakan untuk mendapatkan informasi tentang reaksi elektrokimia. Cyclic Voltammetry diperoleh dari scan potensial melawan densitas arus dengan berbagai kecepatan scan. Dari CV didapatkan beberapa nilai parameter penting seperti potensial puncak anoda (Epa), potensial puncak katoda (EPc), puncak arus anoda (ipa), puncak arus katoda (ipc) dan potensial setengah gelombang (E1/2).
2.8.4. Karakterisasi Kapasitas baterai (Charge/Discharge)
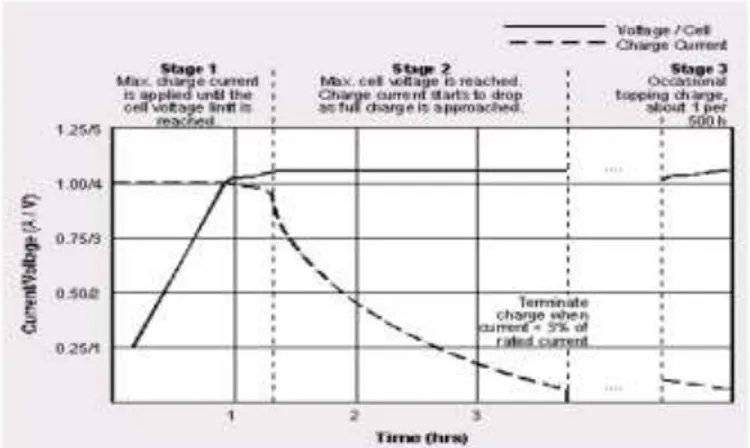
Untuk mendapatkan performasi sebuah baterai maka diperlukan pengujian charge/discharge sehingga akan didapatkan besar kapasitas sel baterai. Baterai lithium sekunder memilki pola pengisian yang agak berbeda dengan baterai lainnya. Dipergulungan charge dengan profil I-V yang memenuhi karakteristik sebagai sumber arus dan sekaligus diakhir tahap pengisian berkarakteristik sebagai sumber tegangan. Gambar 2.5 menunjukkan profil I-V pengisian baterai lithium ion rechargeable. Terdiri dari 3 tahapan. tahap 1: baterai diisi dengan sumber arus tetap, tahap 2: baterai diisi dengan sumber tegangan tetap. tahap 3: baterai diisi dengan sumber tegangan tetap. (Achmad, 2011).
Gambar 2.5. Profil tegangan yang harus dipenuhi selama mengisi ulang sebuah baterai lithium.