DAFTAR PUSTAKA
Alexeyev, V. (1994) : Quantitative Analysis A Textbook, Foreign Languages Publishing House, Moscow, 290-361.
Amy L.Cox and James R.Cox. (August 2002) : Determining Oxidation-Reduction on a Simple Number Line, J. Chem. Edu, 79 (8), 965-967.
Arifin, M. (2003) : Inovasi Pembelajaran Mata Kuliah Perencanaan Pengajaran Kimia melalui Pendekatan Pembelajaran Praktikum Skala Mikro Berbasis Kompetensi di Jurusan Kimia UPI, Penelitian Dosen, Bandung : UPI, 6-15. Baharudin. (2000) : Analisis Kesulitan Siswa pada Pokok Bahasan Reaksi
Reduksi-Oksidasi, Thesis pada Program Pasca Sarjana UPI, Bandung, Tidak diterbitkan, 1-10.
Basset, J., Denny, R.C., Jeffrey, G.H., and Mendham, J. (1994) : Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik, Alih Bahasa : Hadyana, A.P dan Setiono, L,Ir. Penerbit Buku Kedokteran EGC, Jakarta, 406-459.
Bradley, J.D., Durbach, S., Bell, B., and J.Mungarulire, (November 1998) : Hands-On Practical Chemistry for All-Why and How, J. Chem. Edu, 75 (11), 1406-1407.
Dick, J.G. (1973) : Analytical Chemistry, International Student Edition, McGraw-Hill Kogakusha LTD, Tokyo, 285-300.
E. Harris, Walter., Kratochvie, Byron. (-) : An Introduction to Chemical Analysis, Sounders College Publishing, Philadelphia, 209-260.
Fernando, Quintos&D.Ryan,Michael. (1997) : Kimia Analitik Kuantitatif, Edisi Pertama, Penerbit Andi Yogyakarta, 285-294.
Firman, H. (2000) : Beberapa Pokok Pikiran tentang Pembelajaran Kimia di SLTA, Makalah pada diskusi Guru Kimia Aliyah Jawa Barat, BPG Bandung, [Online], Tersedia : http://www.harryfirman.com., diakses 15 Januari 2005.
Harjadi., W. (1993) : Ilmu Kimia Analitik Dasar, Penerbit PT Gramedia Pustaka Utama, Jakarta, 119-127, 190-233.
Henderleiter, J. and Pringle, D.L. (January 1999) : Effects of Context-Based Laboratory Experiments on Attitudes of Analytical Chemistry Students, J. Chem. Edu, 76 (1), 100-106.
Hiskia Ahmad. (2001) : Elektrokimia dan Kinetika Kimia, Penerbit PT Citra Aditya Bakti, Jakarta, 1-21.
Hofstein, Avi and Lunetta. Vincent N, (1982) : The Role of Laboratory in Science Teaching : Neglected Aspects of Research, Rev. Edu. Res, 52(2), 201-217. Ivan A. Shibley Jr., Down M. Zimmaro, (June 2002) : The Influence of Collaborative
Learning on Student Attitudes and Performance in an Introductory Chemistry Laboratory, J. Chem. Edu, 79 (6), 745-748.
Khopkar, S.M. (1990) : Konsep Dasar Kimia Analitik, Penerjemah : A. Saptorahardjo, Pendamping : Agus Nurhadi, Cetakan Pertama, Penerbit UI-Press, Jakarta, 48-58.
Purba, Michael, (2002) : Kimia 3A untuk SMA Kelas XII, Penerbit Erlangga, Jakarta, 35-57.
Pusat Kurikulum Depdiknas. (2003) : Model Pembelajaran pada Kurikulum Berbasis Kompetensi, [Online] : http://www.puskur.go.id., diakses 31 Juli 2006.
Quane, Denis., (February 1971) : Redox Titration Calculations, J. Chem. Edu, 48 (2), A104-A105.
Richardson, John N., Stauffer, Mark T., and Henry, Jennifer L. (January 2003) : Microscale Quantitative of Hard Water Samples Using an Indirect Potassium Permanganate Redox Titration, J. Chem. Edu, 80 (1), 65-67.
Romey, D. William, (1978) : Inquiry Techniques for Teaching Science, Prentice-Hall. Inc, New Jersey, 18.
Senkbeil, Edward G. (January 1999) : Inquiri-Based Approach to a Carbohydrate Analysis Experiment, J. Chem. Edu, 76 (1), 80-81.
Suparno, P. (1997) : Filsafat Konstruktivisme dalam Pendidikan, Penerbit Kanisius, Jogjakarta, 10-23.
Underwood.,A.L., Day., R.A. (1983) : Analisa Kimia Kuantitatif, Edisi Keempat, Penerbit Erlangga, Jakarta, 283-305, 612-623.
Williams, Kathryn R., (September 1998) : Automatic Titrators in the Analyical and Physical Chemistry Laboratories, J. Chem. Edu, 75 (9), 1133-1134.
Lampiran A Bagan Rancangan Penelitian
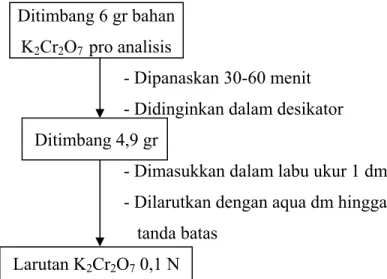
A.1 Pembuatan Larutan K2Cr2O7 0,1 N
Bagan rancangan pembuatan larutan K2Cr2O7 0,1 N dapat dilihat pada Gambar B.1.
berikut :
Ditimbang 6 gr bahan K2Cr2O7 pro analisis
- Dipanaskan 30-60 menit - Didinginkan dalam desikator Ditimbang 4,9 gr
- Dimasukkan dalam labu ukur 1 dm3 - Dilarutkan dengan aqua dm hingga tanda batas
Larutan K2Cr2O7 0,1 N
Gambar A.1 Bagan rancangan pembuatan larutan K2Cr2O7 0,1 N
A.2 Pembuatan Larutan Garam SnCl2.2H2O 0,05 M
Bagan rancangan pembuatan larutan Garam SnCl2.2H2O 0,05 M dapat dilihat pada
gambar berikut ini :
Ditimbang 2,8206 gr Garam SnCl2.2H2O
- Dilarutkan dengan aqua dm dalam labu ukur 250 mL
Larutan Garam SnCl2.2H2O 0,05 M
A.3 Pembuatan Larutan KMnO4 0,1 N
Bagan rancangan pembuatan larutan KMnO4 0,1 N dapat dilihat pada gambar di
bawah ini :
Ditimbang 3,25 gr KMnO4 pro analisis
- Dimasukkan dalam gelas piala 1000 cm3 - Ditambahkan 1 liter air
Larutan KMnO4
- Dipanaskan hingga mendidih (15-30 menit) - Didinginkan larutan hingga suhu ruang - Larutan disaring
Filtrat
(Larutan KMnO4 0,1 N)
- Disimpan dalam botol kaca berwarna gelap
Distandarisasi dengan Natrium oksalat
A.4 Pembuatan Larutan KBrO3 0,1 N
Bagan rancangan pembuatan larutan KBrO3 0,1 N adalah sebagai berikut :
5,0 gr bubuk KBrO3 pro analisis
- Dikeringkan selama 12 jam pada 120oC - Didinginkan dalam desikator
Timbang 2,783 gr
- Larutkan dalam 1 dm3 aqua dm dalam labu ukur
Larutan KBrO3 0,1 N
Gambar A. 4 Bagan rancangan pembuatan larutan KBrO3 0,1 N
A.5 Pembuatan Larutan Garam Mohr, (NH4)2SO4.FeSO4.6H2O 0,1 M
Bagan rancangan pembuatan larutan Garam Mohr, (NH4)2SO4.FeSO4.6H2O 0,1 M
dapat dilihat pada gambar di bawah ini :
Ditimbang 9,80 gr Garam Mohr
- Dilarutkan dengan aqua dm dalam labu ukur 250 mL - Ditambahkan H2SO4 2 N setengah volume larutan - Larutan dihomogenkan Larutan Garam Mohr 0,1 M
Gambar A. 5 Bagan rancangan pembuatan larutan garam Mohr, (NH4)2SO4.FeSO4.6H2O 0,1 M
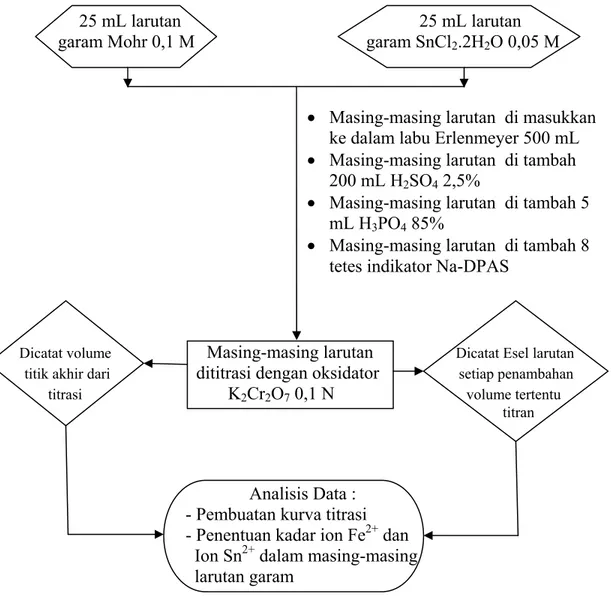
A.6 Titrimetri Garam Mohr 0,1 M dan Garam SnCl2.2H2O 0,05 M dengan
Oksidator K2Cr2O7 0,1 N
Bagan rancangan pelaksanaan titrimetri garam Mohr 0,1 M dan garam SnCl2.2H2O
0,05 M dengan oksidator K2Cr2O7 0,1 N dapat dilihat pada gambar di bawah ini :
25 mL larutan 25 mL larutan garam Mohr 0,1 M garam SnCl2.2H2O 0,05 M
Dicatat volume Masing-masing larutan Dicatat Esel larutan
titik akhir dari dititrasi dengan oksidator setiap penambahan
titrasi K2Cr2O7 0,1 N volume tertentu
titran
Analisis Data :
- Pembuatan kurva titrasi - Penentuan kadar ion Fe2+ dan Ion Sn2+ dalam masing-masing larutan garam
Gambar A. 6 Bagan rancangan pelaksanaan titrimetri garam Mohr 0,1 M dan garam SnCl2.2H2O 0,05 M dengan oksidator K2Cr2O7 0,1 N
• Masing-masing larutan di masukkan ke dalam labu Erlenmeyer 500 mL • Masing-masing larutan di tambah
200 mL H2SO4 2,5%
• Masing-masing larutan di tambah 5 mL H3PO4 85%
• Masing-masing larutan di tambah 8 tetes indikator Na-DPAS
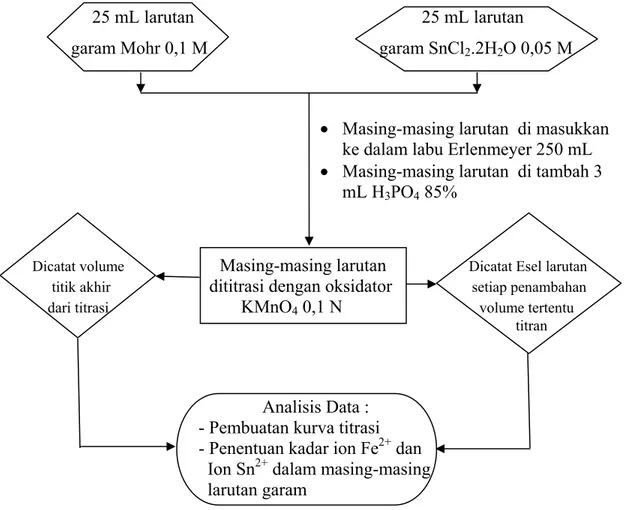
A.7 Titrimetri Garam Mohr 0,1 M dan Garam SnCl2.2H2O 0,05 M dengan
Oksidator KMnO4 0,1 N
Bagan rancangan pelaksanaan titrimetri garam Mohr 0,1 M dan garam SnCl2.2H2O
0,05 M dengan oksidator KMnO4 0,1 N dapat dilihat pada gambar di bawah ini :
25 mL larutan 25 mL larutan garam Mohr 0,1 M garam SnCl2.2H2O 0,05 M
Dicatat volume Masing-masing larutan Dicatat Esel larutan
titik akhir dititrasi dengan oksidator setiap penambahan
dari titrasi KMnO4 0,1 N volume tertentu
titran
Analisis Data :
- Pembuatan kurva titrasi - Penentuan kadar ion Fe2+ dan Ion Sn2+ dalam masing-masing larutan garam
Gambar A. 7 Bagan rancangan pelaksanaan titrimetri garam Mohr 0,1 M dan garam SnCl2.2H2O 0,05 M dengan oksidator KMnO4 0,1 N
• Masing-masing larutan di masukkan ke dalam labu Erlenmeyer 250 mL • Masing-masing larutan di tambah 3
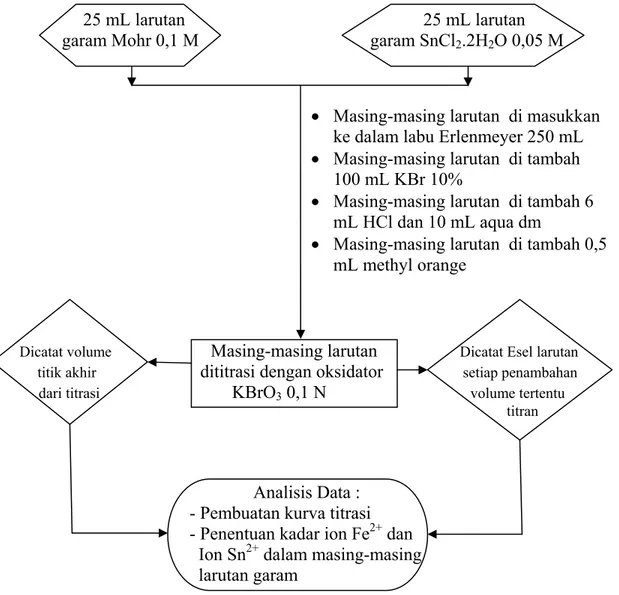
A.8 Titrimetri Garam Mohr 0,1 M dan Garam SnCl2.2H2O 0,05 M dengan
Oksidator KBrO3 0,1 N
Bagan rancangan pelaksanaan titrimetri garam Mohr 0,1 M dan garam SnCl2.2H2O
0,05 M dengan oksidator KBrO3 0,1 N dapat dilihat pada gambar di bawah ini :
25 mL larutan 25 mL larutan garam Mohr 0,1 M garam SnCl2.2H2O 0,05 M
Dicatat volume Masing-masing larutan Dicatat Esel larutan
titik akhir dititrasi dengan oksidator setiap penambahan
dari titrasi KBrO3 0,1 N volume tertentu
titran
Analisis Data :
- Pembuatan kurva titrasi - Penentuan kadar ion Fe2+ dan Ion Sn2+ dalam masing-masing larutan garam
Gambar A. 8 Bagan rancangan pelaksanaan titrimetri garam Mohr 0,1 M dan garam SnCl2.2H2O 0,05 M dengan oksidator KBrO3 0,1 N
• Masing-masing larutan di masukkan ke dalam labu Erlenmeyer 250 mL • Masing-masing larutan di tambah
100 mL KBr 10%
• Masing-masing larutan di tambah 6 mL HCl dan 10 mL aqua dm
• Masing-masing larutan di tambah 0,5 mL methyl orange
Lampiran B Data Hasil Pengukuran Potensial Sel Larutan selama Proses Titrasi Redoks Garam Mohr dan Garam SnCl2.2H2O terhadap
Oksidator K2Cr2O7, KMnO4 dan KBrO3
B.1 Potensial sel selama titrasi garam Mohr dengan oksidator K2Cr2O7
Tabel B. 1 Potensial sel selama titrasi garam Mohr dengan oksidator K2Cr2O7
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 539,90 541,10 540,50 1,00 543,20 546,60 544,90 2,00 558,00 559,00 558,50 3,00 573,40 578,40 575,90 4,00 583,10 586,30 584,70 5,00 590,50 593,50 592,00 10,00 617,20 621,80 619,50 15,00 643,60 648,00 645,80 20,00 701,90 704,50 703,20 20,70 749,30 752,90 751,10 20,80 1071,60 1075,40 1073,50 20,90 1247,70 1251,30 1249,50 25,00 1266,90 1269,90 1268,40 30,00 1268,40 1275,20 1271,80 40,00 1271,90 1278,10 1275,00 50,00 1274,50 1279,10 1276,80 70,00 1277,00 1281,00 1279,00
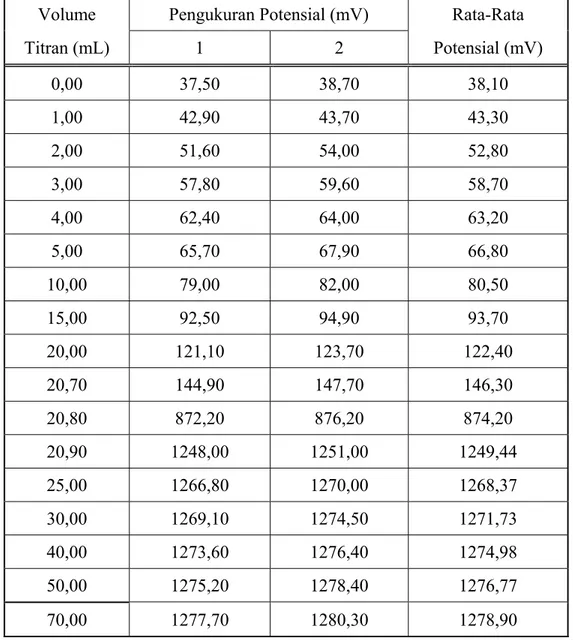
B.2 Potensial sel selama titrasi garam SnCl2.2H2O dengan oksidator K2Cr2O7
Tabel B. 2 Potensial sel selama titrasi garam SnCl2.2H2O dengan oksidator K2Cr2O7
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 37,50 38,70 38,10 1,00 42,90 43,70 43,30 2,00 51,60 54,00 52,80 3,00 57,80 59,60 58,70 4,00 62,40 64,00 63,20 5,00 65,70 67,90 66,80 10,00 79,00 82,00 80,50 15,00 92,50 94,90 93,70 20,00 121,10 123,70 122,40 20,70 144,90 147,70 146,30 20,80 872,20 876,20 874,20 20,90 1248,00 1251,00 1249,44 25,00 1266,80 1270,00 1268,37 30,00 1269,10 1274,50 1271,73 40,00 1273,60 1276,40 1274,98 50,00 1275,20 1278,40 1276,77 70,00 1277,70 1280,30 1278,90
B.3 Potensial sel selama titrasi garam Mohr dengan oksidator KMnO4
Tabel B. 3 Potensial sel selama titrasi garam Mohr dengan oksidator KMnO4
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 533,60 535,40 534,50 1,00 539,60 540,40 540,00 2,00 557,90 559,90 558,90 3,00 570,20 570,80 570,50 4,00 578,40 579,60 579,00 5,00 585,70 586,30 586,00 10,00 610,30 612,10 611,20 15,00 631,80 632,20 632,00 20,00 656,60 657,80 657,20 24,90 762,50 763,90 763,20 25,00 1248,40 1250,80 1249,60 25,10 1422,70 1423,90 1423,30 30,00 1441,90 1444,70 1443,30 40,00 1448,20 1449,80 1449,00 50,00 1451,30 1451,90 1451,60 70,00 1453,60 1455,60 1454,60
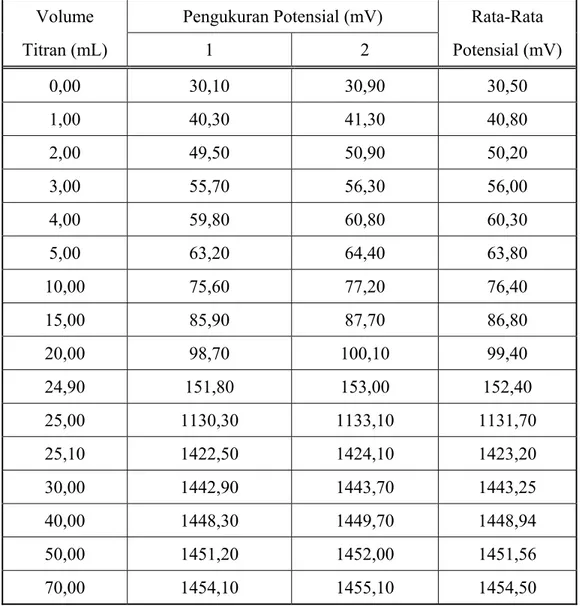
B.4 Potensial sel selama titrasi garam SnCl2.2H2O dengan oksidator KMnO4
Tabel B. 4 Potensial sel selama titrasi garam SnCl2.2H2O dengan oksidator KMnO4
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 30,10 30,90 30,50 1,00 40,30 41,30 40,80 2,00 49,50 50,90 50,20 3,00 55,70 56,30 56,00 4,00 59,80 60,80 60,30 5,00 63,20 64,40 63,80 10,00 75,60 77,20 76,40 15,00 85,90 87,70 86,80 20,00 98,70 100,10 99,40 24,90 151,80 153,00 152,40 25,00 1130,30 1133,10 1131,70 25,10 1422,50 1424,10 1423,20 30,00 1442,90 1443,70 1443,25 40,00 1448,30 1449,70 1448,94 50,00 1451,20 1452,00 1451,56 70,00 1454,10 1455,10 1454,50
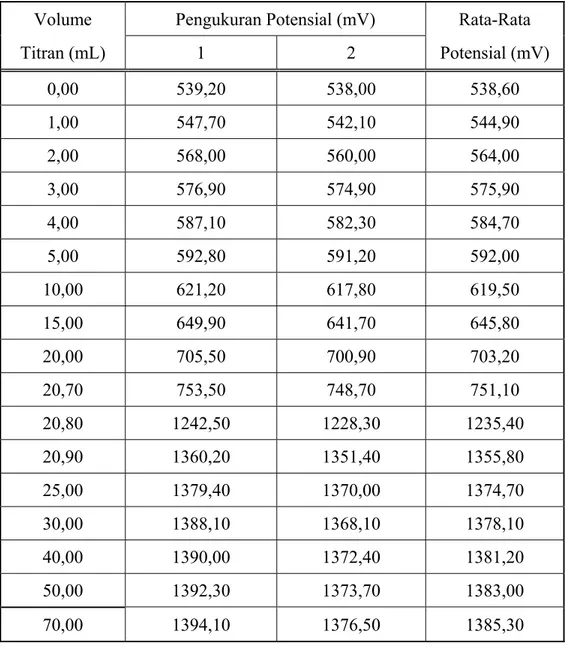
B.5 Potensial sel selama titrasi garam Mohr dengan oksidator KBrO3
Tabel B. 5 Potensial sel selama titrasi garam Mohr dengan oksidator KBrO3
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 539,20 538,00 538,60 1,00 547,70 542,10 544,90 2,00 568,00 560,00 564,00 3,00 576,90 574,90 575,90 4,00 587,10 582,30 584,70 5,00 592,80 591,20 592,00 10,00 621,20 617,80 619,50 15,00 649,90 641,70 645,80 20,00 705,50 700,90 703,20 20,70 753,50 748,70 751,10 20,80 1242,50 1228,30 1235,40 20,90 1360,20 1351,40 1355,80 25,00 1379,40 1370,00 1374,70 30,00 1388,10 1368,10 1378,10 40,00 1390,00 1372,40 1381,20 50,00 1392,30 1373,70 1383,00 70,00 1394,10 1376,50 1385,30
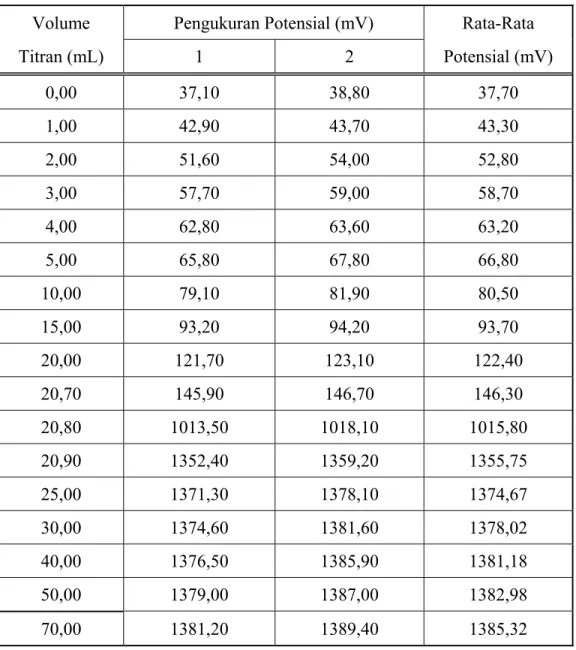
B.6 Potensial sel selama titrasi garam SnCl2.2H2O dengan oksidator KBrO3
Tabel B. 6 Potensial sel selama titrasi garam SnCl2.2H2O dengan oksidator KBrO3
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 37,10 38,80 37,70 1,00 42,90 43,70 43,30 2,00 51,60 54,00 52,80 3,00 57,70 59,00 58,70 4,00 62,80 63,60 63,20 5,00 65,80 67,80 66,80 10,00 79,10 81,90 80,50 15,00 93,20 94,20 93,70 20,00 121,70 123,10 122,40 20,70 145,90 146,70 146,30 20,80 1013,50 1018,10 1015,80 20,90 1352,40 1359,20 1355,75 25,00 1371,30 1378,10 1374,67 30,00 1374,60 1381,60 1378,02 40,00 1376,50 1385,90 1381,18 50,00 1379,00 1387,00 1382,98 70,00 1381,20 1389,40 1385,32
Lampiran C Hasil Perhitungan Kadar Ion Fe2+ dan Ion Sn2+ terhadapOksidator K2Cr2O7, KMnO4 dan KBrO3
C. 1 Hasil Perhitungan Kadar Ion Fe2+ terhadap Oksidator K2Cr2O7 0,1 N (~
0,02 M)
Persamaan reaksi : 6Fe2+ + Cr2O72- + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O
Titik akhir : 1. pada volume = 21,0 mL 2. pada volume = 21,0 mL 3. volume rata-rata = 21,0 mL mmol garam Mohr = mmol K2Cr2O7 x (6/1)
= (21,0 mL x 0,02 M) x 6 = 2,52 mmol
mg garam Mohr = mmol garam Mohr x Mr garam Mohr = 2,52 x 392,139
= 988,1903 mg/25 mL
Jadi, dalam 250 mL larutan, terdapat 9881,903 mg = 9,8819 g
Massa Fe2+ dalam garam Mohr = (Ar Fe/Mr garam Mohr) x massa garam Mohr = (55,947/392,139) x 9,8819 g
= 1,4073 g
Kadar Fe2+ dalam garam Mohr (teoritis) = (massa Fe2+/massa garam Mohr) x 100%
= (1,3957/9,8819) x 100 % = 14,2418 %
Kadar Fe2+ dalam garam Mohr (penelitian) = (massa Fe2+/massa garam Mohr) x 100%
= (1,4073/9,8819) x 100 % = 14,2412 %
Persen kesalahan titrasi = |(% penelitian - % teoritis) | x 100 % % teoritis
= |(12,2412 % - 14,2418 %)| x 100 % 14,2418 %
Tabel C. 1 Hasil analisis kadar ion Fe2+ dengan K2Cr2O7 0,1 N (~ 0,02 M)
D a t a Hasil Perhitungan 1. Volume awal K2Cr2O7 (mL) pada buret 0 mL
2. Volume akhir K2Cr2O7 (mL) pada buret a. Titik akhir 1 = 21,0 mL
b. Titik akhir 2 = 21,0 mL 3. Volume rata-rata K2Cr2O7 (mL) yang digunakan 21,0 mL
4. Molaritas K2Cr2O7 0,02 M
5. mmol K2Cr2O7 yang digunakan 0,42 mmol
6. mmol garam Mohr 2,52 mmol
7. Massa Fe2+ (g) dalam garam Mohr 1,4073 gram
8. Massa garam Mohr 9,8 gram
9. Persentase Fe2+ dalam garam Mohr 14,2412%
C. 2 Hasil Perhitungan Kadar Ion Sn2+ terhadap Oksidator K2Cr2O7 0,1 N
(~ 0,02 M)
Persamaan reaksi : 3Sn2+ + Cr2O72- + 14H+ → 3Sn4+ + 2Cr3+ + 7H2O
Titik akhir : 1. pada volume = 20,9 mL 2. pada volume = 20,9 mL 3. volume rata-rata = 20,9 mL
mmol garam SnCl2.2H2O = mmol K2Cr2O7 x (3/1)
= (20,9 mL x 0,02 M) x 3 = 1,254 mmol
mg garam SnCl2.2H2O = mmol garam SnCl2.2H2O x Mr garam SnCl2.2H2O
= 1,254 x 225,646 = 282,9601 mg/25 mL
Jadi, dalam 250 mL larutan, terdapat 2829,601 mg = 2,8296 g
Massa Sn2+ dalam garam SnCl2.2H2O = (Ar Sn/Mr garam SnCl2.2H2O) x massa
garam SnCl2.2H2O
= (118,710/225,646) x 2,8296 g = 1,4886 g
Kadar Sn2+ dalam garam SnCl2.2H2O (teoritis) = (massa Fe2+/massa garam) x 100%
= (1,4839/2,8206) x 100 % = 52,6094 %
Kadar Sn2+ dalam garam SnCl2.2H2O (penelitian) = (massa Fe2+/massa garam) x 100%
= (1,4886/2,8296) x 100 % = 52,6081 %
Persen kesalahan titrasi = |(% penelitian - % teoritis) | x 100 % % teoritis
= |(52,6081 % - 52,6094 %)| x 100 % 52,6094 %
= 2,4710.10-3 %
Tabel C. 2 Hasil analisis kadar ion Sn2+ dengan K2Cr2O7 0,1 N (~ 0,02 M)
D a t a Hasil Perhitungan 1. Volume awal K2Cr2O7 (mL) pada buret 0 mL
2. Volume akhir K2Cr2O7 (mL) pada buret a. Titik akhir 1 = 20,9 mL
b. Titik akhir 2 = 20,9mL 3. Volume rata-rata K2Cr2O7 (mL) yang digunakan 20,9 mL
4. Molaritas K2Cr2O7 0,02 M
5. mmol K2Cr2O7 yang digunakan 0,418 mmol
6. mmol garam SnCl2.2H2O 1,254 mmol
7. Massa Sn2+ (g) dalam garam SnCl2.2H2O 1,4886 gram
8. Massa garam SnCl2 2,8206 gram
C. 3 Hasil Perhitungan Kadar Ion Fe2+ terhadap Oksidator KMnO4 0,1 N
(~ 0,02 M)
Standarisasi KMnO4 dengan 25 mL Na-oksalat 0,05 M :
Titik akhir : 1. pada volume = 25,20 mL 2. pada volume = 25,10 mL 3. volume rata-rata = 25,15 mL
Persamaan reaksi : 5C2O42- + 2MnO4- + 16H+ → 10CO2 + 2Mn2+ + 8H2O
mmol KMnO4 = mmol Na2C2O4 x (2/5)
= (25 mL x 0,05 M) x (2/5) = 0,5 mmol
M KMnO4 = mmol KMnO4/Volume KMnO4
= 0,5 mmol/25,15 mL = 0,0199 M
Persamaan reaksi : 5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
Titik akhir : 1. pada volume = 25,10 mL 2. pada volume = 25,10 mL 3. volume rata-rata = 25,10 mL mmol garam Mohr = mmol KMnO4 x (5/1)
= (25,10 mL x 0,0199 M) x 5 = 2,49745 mmol
mg garam Mohr = mmol garam Mohr x Mr garam Mohr = 2,49745 x 392,139
= 979,3475 mg/25 mL
Jadi, dalam 250 mL larutan, terdapat 9793,475 mg = 9,7935 g
Massa Fe2+ dalam garam Mohr = (Ar Fe/Mr garam Mohr) x massa garam Mohr = (55,947/392,139) x 9,7935 g
= 1,3948 g
Kadar Fe2+ dalam garam Mohr (teoritis) = (massa Fe2+/massa garam Mohr) x 100%
= (1,3957/9,8819) x 100 % = 14,2418 %
Kadar Fe2+ dalam garam Mohr (penelitian) = (massa Fe2+/massa garam Mohr) x 100%
= (1,3948/9,7543) x 100 % = 14,2993%
Persen kesalahan titrasi = |(% penelitian - % teoritis) | x 100 % % teoritis
= |(14,2993 % - 14,2418 %)| x 100 % 14,2418 %
= 0,4037 %
Tabel C. 3 Hasil analisis kadar ion Fe2+ dengan KMnO4 0,1 N (~0,02 M)
D a t a Hasil Perhitungan 1. Volume awal KMnO4 (mL) pada buret 0 mL
2. Volume akhir KMnO4 (mL) pada buret a. Titik akhir 1 = 25,10 mL
b. Titik akhir 2 = 25,10 mL 3. Volume rata-rata KMnO4 (mL) yang digunakan 25,10 mL
4. Molaritas KMnO4 0,0199 M
5. mmol KMnO4 yang digunakan 0,4995 mmol
6. mmol garam Mohr 2,4975 mmol 7. Massa Fe2+ (g) dalam garam Mohr 1,3948 gram
8. Massa garam Mohr 9,8 gram
9. Persentase Fe2+ dalam garam Mohr 14,2993 %
C. 4 Hasil Perhitungan Kadar Ion Sn2+ terhadap Oksidator KMnO4 0,1 N (~
0,02 M)
Persamaan reaksi : 5Sn2+ + 2MnO4- + 16H+ → 5Sn4+ + 2Mn2+ + 8H2O
Titik akhir : 1. pada volume = 25,20 mL 2. pada volume = 25,20 mL 3. volume rata-rata = 25,20 mL mmol garam SnCl2.2H2O = mmol MnO4- x (5/2)
= (25,20 mL x 0,0199 M) x 2,5 = 1,2537 mmol
mg garam SnCl2.2H2O = mmol garam SnCl2.2H2O x Mr garam SnCl2.2H2O
= 1,2537 x 225,646 = 282,8924 mg/25 mL
Jadi, dalam 250 mL larutan, terdapat 2828,924 mg = 2,8289 g
Massa Sn2+ dalam garam SnCl2.2H2O = (Ar Sn/Mr garam SnCl2.2H2O) x massa
garam SnCl2.2H2O
= (118,710/225,646) x 2,8289 g = 1,4883 g
Kadar Sn2+ dalam garam SnCl
2.2H2O (teoritis) = (massa Fe2+/massa garam) x 100%
= (1,4839/2,8206) x 100 % = 52,6094 %
Kadar Sn2+ dalam garam SnCl2.2H2O (penelitian) = (massa Fe2+/massa garam) x 100%
= (1,4883/2,8289) x 100 % = 52,6105 %
Persen kesalahan titrasi = |(% penelitian - % teoritis) | x 100 % % teoritis
= |(52,6105 % - 52,6094 %)| x 100 % 52,6094 %
= 2,0909.10-3 %
Tabel C. 4 Hasil analisis kadar ion Sn2+ dengan KMnO4 0,1 N (~0,02 M)
D a t a Hasil Perhitungan 1. Volume awal KMnO4 (mL) pada buret 0 mL
2. Volume akhir KMnO4 (mL) pada buret a. Titik akhir 1 = 25,20 mL
b. Titik akhir 2 = 25,20 mL 3. Volume rata-rata KMnO4 (mL) yang digunakan 25,20 mL
4. Molaritas KMnO4 0,0199 M
5. mmol KMnO4 yang digunakan 0,5015 mmol
6. mmol garam SnCl2.2H2O 1,2537 mmol
7. Massa Sn2+ (gr) dalam garam SnCl2.2H2O 1,4883 gram
8. Massa garam SnCl2 2,8206 gram
C. 5 Hasil Perhitungan Kadar Ion Fe2+ terhadap Oksidator KBrO3 0,1 N
(~ 0,02 M)
Persamaan reaksi : 6Fe2+ + BrO3- + 6H+ → 6Fe3+ + Br- + 3H2O
Titik akhir : 1. pada volume = 20,90 mL 2. pada volume = 20,90 mL 3. volume rata-rata = 20,95 mL mmol garam Mohr = mmol KBrO3 x (6/1)
= (20,95 mL x 0,02 M) x 6 = 2,514 mmol
mg garam Mohr = mmol garam Mohr x Mr garam Mohr = 2,514 x 392,139
= 985, 8374 mg/25 mL
Jadi, dalam 250 mL larutan, terdapat 9858,374 mg = 9,8584 g
Massa Fe2+ dalam garam Mohr = (Ar Fe/Mr garam Mohr) x massa garam Mohr = (55,947/392,139) x 9,8584 g
= 1,4040 g
Kadar Fe2+ dalam garam Mohr (teoritis) = (massa Fe2+/massa garam Mohr) x 100%
= (1,3957/9,8819) x 100 % = 14,2418 %
Kadar Fe2+ dalam garam Mohr (penelitian) = (massa Fe2+/massa garam Mohr) x 100%
= (1,4040/9,8584) x 100 % = 14,2417 %
Persen kesalahan titrasi = |(% penelitian - % teoritis) | x 100 % % teoritis
= |(14,2417 % - 14,2418 %)| x 100 % 14,2418 %
Tabel C. 5 Hasil analisis kadar ion Fe2+ dengan KBrO3 0,1 N (~0,02 M)
D a t a Hasil Perhitungan 1. Volume awal KBrO3 (mL) pada buret 0 mL
2. Volume akhir KBrO3 (mL) pada buret a. Titik akhir 1 = 20,90 mL
b. Titik akhir 2 = 21,0 mL 3. Volume rata-rata KBrO3 (mL) yang digunakan 20,95 mL
4. Molaritas KBrO3 0,02 M
5. mmol KBrO3 yang digunakan 0,419 mmol
6. mmol garam Mohr 2,514 mmol
7. Massa Fe2+ (gr) dalam garam Mohr 1,4040 gram
8. Massa garam Mohr 9,8 gram
9. Persentase Fe2+ dalam garam Mohr 14,2417 %
C. 6 Hasil Perhitungan Kadar Ion Sn2+ terhadap Oksidator KBrO3 0,1 N
(~ 0,02 M)
Persamaan reaksi : 3Sn2+ + BrO3- + 6H+ → 3Sn4+ + Br- + 3H2O
Titik akhir : 1. pada volume = 20,90 mL 2. pada volume = 21,00 mL 3. volume rata-rata = 20,95 mL mmol garam SnCl2.2H2O = mmol MnO4- x (3/1)
= (20,95 mL x 0,02 M) x 3 = 1,257 mmol
mgr garam SnCl2.2H2O = mmol garam SnCl2.2H2O x Mr garam SnCl2.2H2O
= 1,257 x 225,646 = 283,6370 mgr/25 mL
Jadi, dalam 250 mL larutan, terdapat 2836,370 mgr = 2,8364 gr
Massa Sn2+ dalam garam SnCl2.2H2O = (Ar Sn/Mr garam SnCl2.2H2O) x massa
garam SnCl2.2H2O
= (118,710/225,646) x 2,8364 gr = 1,4922 gr
Kadar Sn2+ dalam garam SnCl2.2H2O (teoritis) = (massa Fe2+/massa garam) x 100%
= (1,4839/2,8206) x 100 % = 52,6094 %
Kadar Sn2+ dalam garam SnCl2.2H2O (penelitian) = (massa Fe2+/massa garam) x 100%
= (1,4922/2,8364) x 100 % = 52,6089 %
Persen kesalahan titrasi = |(% penelitian - % teoritis) | x 100 % % teoritis
= |(52,6089 % - 52,6094 %)| x 100 % 52,6094 %
= 9,5.10-4 %
Tabel C. 6 Hasil analisis kadar ion Sn2+ dengan KBrO3 0,1 N (~ 0,02 M)
D a t a Hasil Perhitungan 1. Volume awal KBrO3 (mL) pada buret 0 mL
2. Volume akhir KBrO3 (mL) pada buret a. Titik akhir 1 = 20,9 mL
b. Titik akhir 2 = 21,0 mL 3. Volume rata-rata KBrO3 (mL) yang digunakan 20,95 mL
4. Molaritas KBrO3 0,02 M
5. mmol KBrO3 yang digunakan 0,419 mmol
6. mmol garam SnCl2.2H2O 1,257 mmol
7. Massa Sn2+ (gr) dalam garam SnCl2.2H2O 1,4922 gram
8. Massa garam SnCl2 2,8206 gram
Lampiran D Hasil Perhitungan Turunan Pertama Kurva Titrasi Redoks Garam Mohr dan Garam SnCl2.2H2O terhadap Oksidator
K2Cr2O7, KMnO4 dan KBrO3
D.1 Hasil perhitungan turunan pertama kurva titrasi redoks garam Mohr 0,1 M terhadap oksidator K2Cr2O7 0,1 N (~ 0,02 M)
Tabel D. 1 Hasil perhitungan turunan pertama kurva titrasi redoks garam Mohr 0,1 M terhadap oksidator K2Cr2O7 0,1 N (~ 0,02 M)
Volume Potensial Sel NO. Titran (mL) (mV) ∆V ∆ E ∆ E / ∆V 1 0,00 540,50 0,00 0,00 0,0000 2 1,00 544,90 0,50 4,40 8,8000 3 2,00 558,50 1,50 13,60 9,0667 4 3,00 575,90 2,50 11,90 4,7600 5 4,00 584,70 3,50 8,80 2,5143 6 5,00 592,00 4,50 7,30 1,6222 7 10,00 619,50 7,50 27,50 3,6667 8 15,00 645,80 12,50 26,30 2,1040 9 20,00 703,20 17,50 57,40 3,2800 10 20,70 751,10 20,35 47,90 2,3538 11 20,80 1073,50 20,75 322,40 15,5373 12 20,90 1249,50 20,85 176,00 8,4412 13 25,00 1268,40 22,95 18,90 0,8235 14 30,00 1271,80 27,50 3,40 0,1236 15 40,00 1275,00 35,00 3,20 0,0914 16 50,00 1276,80 45,00 1,80 0,0400 17 70,00 1279,00 60 2,2 0,0367
D.2 Hasil perhitungan turunan pertama kurva titrasi redoks garam SnCl2.2H2O 0,05 M terhadap oksidator K2Cr2O7 0,1 N (~ 0,02 M)
Tabel D.2 Hasil perhitungan turunan pertama kurva titrasi redoks garam SnCl2.2H2O
0,05 M terhadap oksidator K2Cr2O7 0,1 N (~ 0,02 M)
Volume Potensial Sel NO. Titran (mL) (mV) ∆V ∆ E ∆ E / ∆V 1 0,00 38,10 0,00 0,00 0,0000 2 1,00 43,30 0,50 5,20 10,4000 3 2,00 52,80 1,50 9,50 6,3333 4 3,00 58,70 2,50 5,90 2,3600 5 4,00 63,20 3,50 4,50 1,2857 6 5,00 66,80 4,50 3,60 0,8000 7 10,00 80,50 7,50 13,70 1,8267 8 15,00 93,70 12,50 13,20 1,0560 9 20,00 122,40 17,50 28,70 1,6400 10 20,70 146,30 20,35 23,90 1,1744 11 20,80 874,20 20,75 727,90 35,0795 12 20,90 1249,44 20,85 375,24 17,9971 13 25,00 1268,37 22,95 18,93 0,8248 14 30,00 1271,73 27,50 3,36 0,1222 15 40,00 1274,98 35,00 3,25 0,0929 16 50,00 1276,77 45,00 1,79 0,0398 17 70,00 1278,90 60 2,13 0,0355
D.3 Hasil perhitungan turunan pertama kurva titrasi redoks garam Mohr 0,1 M terhadap oksidator KMnO4 0,1 N (~ 0,02 M)
Tabel D. 3 Hasil perhitungan turunan pertama kurva titrasi redoks garam Mohr 0,1 M terhadap oksidator KMnO4 0,1 N (~ 0,02 M)
Volume Potensial Sel NO. Titran (mL) (mV) ∆V ∆ E ∆ E / ∆V 1 0,0 534,5 0,00 0,00 0,00 2 1,0 540,0 0,50 5,50 11,00 3 2,0 558,9 1,50 18,90 12,60 4 3,0 570,5 2,50 11,60 4,64 5 4,0 579,0 3,50 8,50 2,43 6 5,0 586,0 4,50 7,00 1,56 7 10,0 611,2 7,50 25,20 3,36 8 15,0 632,0 12,50 20,80 1,66 9 20,0 657,2 17,50 25,20 1,44 10 24,9 763,2 22,45 106,00 4,72 11 25,0 1249,6 24,95 486,40 19,49 12 25,1 1423,3 25,05 173,70 6,93 13 30,0 1443,3 27,55 20,00 0,73 14 40,0 1449,0 35,00 5,70 0,16 15 50,0 1451,6 45,00 2,60 0,06 16 70,0 1454,6 60,00 3,00 0,05
D.4 Hasil perhitungan turunan pertama kurva titrasi redoks garam SnCl2.2H2O 0,05 M terhadap oksidator KMnO4 0,1 N (~ 0,02 M)
Tabel D.4 Hasil perhitungan turunan pertama kurva titrasi redoks garam SnCl2.2H2O 0,05 M terhadap oksidator KMnO4 0,1 N (~ 0,02 M)
Volume Potensial Sel NO. Titran (mL) (mV) ∆V ∆E ∆ E / ∆V 1 0,0 30,50 0,00 0,00 0,0000 2 1,0 40,80 0,50 10,30 20,6000 3 2,0 50,20 1,50 9,40 6,2667 4 3,0 56,00 2,50 5,80 2,3200 5 4,0 60,30 3,50 4,30 1,2286 6 5,0 63,80 4,50 3,50 0,7778 7 10,0 76,40 7,50 12,60 1,6800 8 15,0 86,80 12,50 10,40 0,8320 9 20,0 99,40 17,50 81,90 4,6800 10 24,9 152,40 22,45 53,00 2,3608 11 25,0 1131,70 24,95 979,30 39,2505 12 25,1 1423,20 25,05 291,50 11,6367 13 30,0 1443,25 27,55 20,05 0,7278 14 40,0 1448,94 35,00 5,69 0,1626 15 50,0 1451,56 45,00 2,62 0,0582 16 70,0 1454,50 60,00 2,94 0,0490
D.5 Hasil perhitungan turunan pertama kurva titrasi redoks garam Mohr 0,1 M terhadap oksidator KBrO3 0,1 N (~ 0,02 M)
Tabel D. 5 Hasil perhitungan turunan pertama kurva titrasi redoks garam Mohr 0,1 M terhadap oksidator KBrO3 0,1 N (~ 0,02 M)
Volume Potensial Sel NO. Titran (mL) (mV) ∆V ∆ E ∆ E / ∆V 1 0,00 538,60 0,00 0,00 0,0000 2 1,00 544,90 0,50 6,30 12,6000 3 2,00 564,00 1,50 19,10 12,7333 4 3,00 575,90 2,50 11,90 4,7600 5 4,00 584,70 3,50 8,80 2,5143 6 5,00 592,00 4,50 7,30 1,6222 7 10,00 619,50 7,50 27,50 3,6667 8 15,00 645,80 12,50 26,30 2,1040 9 20,00 703,20 17,50 57,40 3,2800 10 20,70 751,10 20,35 47,90 2,3538 11 20,80 1235,40 20,75 484,30 23,3398 12 20,90 1355,80 20,85 120,40 5,7746 13 25,00 1374,70 22,95 18,90 0,8235 14 30,00 1378,10 27,50 3,40 0,1236 15 40,00 1381,20 35,00 3,10 0,0886 16 50,00 1383,00 45,00 1,80 0,0400 17 70,00 1385,30 60 2,3 0,0383
D.6 Hasil perhitungan turunan pertama kurva titrasi redoks garam Mohr 0,1 M terhadap oksidator KBrO3 0,1 N (~ 0,02 M)
Tabel D.6 Hasil perhitungan turunan pertama kurva titrasi redoks garam SnCl2.2H2O 0,05 M terhadap oksidator KBrO3 0,1 N (~ 0,02 M)
Volume Potensial Sel NO. Titran (mL) (mV) ∆V ∆E ∆ E / ∆V 1 0,00 37,70 0,00 0,00 0,0000 2 1,00 43,30 0,50 5,60 11,2000 3 2,00 52,80 1,50 9,50 6,3333 4 3,00 58,70 2,50 5,90 2,3600 5 4,00 63,20 3,50 4,50 1,2857 6 5,00 66,80 4,50 3,60 0,8000 7 10,00 80,50 7,50 13,70 1,8267 8 15,00 93,70 12,50 13,20 1,0560 9 20,00 122,40 17,50 28,70 1,6400 10 20,70 146,30 20,35 23,90 1,1744 11 20,80 1015,80 20,75 869,50 41,9036 12 20,90 1355,75 20,85 339,95 16,3046 13 25,00 1374,67 22,95 18,92 0,8244 14 30,00 1378,02 27,50 3,35 0,1218 15 40,00 1381,18 35,00 3,16 0,0903 16 50,00 1382,98 45,00 1,80 0,0400 17 70,00 1385,32 60 2,34 0,0390
Lampiran E Kurva Turunan Pertama Titrasi Redoks Garam Mohr dan Garam SnCl2.2H2O terhadap Oksidator K2Cr2O7, KMnO4 dan
KBrO3
E.1 Kurva turunan pertama titrasi redoks garam Mohr 0,1 M terhadap oksidator K2Cr2O7 0,1 N (~ 0,02 M)
Gambar E. 1 Kurva titrasi redoks turunan pertama garam Mohr 0,1 M terhadap oksidator K2Cr2O7 0,1 N (~ 0,02 M)
E.2 Kurva turunan pertama titrasi redoks garam SnCl2.2H2O 0,05 M terhadap
oksidator K2Cr2O7 0,1 N (~ 0,02 M)
Gambar E. 2 Kurva titrasi redoks turunan pertama garam SnCl2.2H2O 0,05 M
E.3 Kurva titrasi redoks turunan pertama garam Mohr 0,1 M terhadap oksidator KMnO4 0,1 N (~ 0,02 M)
Gambar E. 3 Kurva titrasi redoks turunan pertama garam Mohr 0,1 M terhadap oksidator KMnO4 0,1 N (~ 0,02 M)
E.4 Kurva titrasi redoks turunan pertama garam SnCl2.2H2O 0,05 M terhadap
oksidator KMnO4 0,1 N (~ 0,02 M)
Gambar E. 4 Kurva titrasi redoks turunan pertama garam SnCl2.2H2O 0,05 M
E.5 Kurva titrasi redoks turunan pertama garam Mohr 0,1 M terhadap oksidator KBrO3 0,1 N (~ 0,02 M)
Gambar E. 5 Kurva titrasi redoks turunan pertama garam Mohr 0,1 M terhadap oksidator KBrO3 0,1 N (~ 0,02 M)
E.6 Kurva titrasi redoks turunan pertama garam SnCl2.2H2O 0,05 M terhadap
oksidator KBrO3 0,1 N (~0,02 M)
Gambar E. 6 Kurva titrasi redoks turunan pertama garam SnCl2.2H2O 0,05 M
Lampiran F Modul Praktikum Reaksi Redoks
Satuan Pendidikan : SMA Mata Pelajaran : Kimia
Kelas / Semester : XII IPA / 1 Alokasi Waktu : 3 x 35 menit
A. STANDAR KOMPETENSI :
Menerapkan konsep reaksi oksidasi-reduksi dan elektrokimia dalam teknologi dan kehidupan sehari-hari.
B. KOMPETENSI DASAR :
2.1. Menerapkan konsep reaksi oksidasi reduksi dalam sistem elektrokimia yang melibatkan energi listrik dan kegunaannya dalam mencegah korosi dan dalam industri.
C. MATERI
Persamaan reaksi redoks yang rumit dapat disetarakan dengan metode setengah reaksi dan metode bilangan oksidasi. Metode setengah reaksi (ion-elektron) didasarkan pada pengertian bahwa jumlah elektron yang dilepaskan pada setengah reaksi oksidasi sama dengan jumlah elektron yang diserap pada setengah reaksi reduksi. Sedangkan metode bilangan oksidasi didasarkan pada pengertian bahwa jumlah pertambahan bilangan oksidasi dari reduktor sama dengan jumlah penurunan bilangan oksidasi dari oksidator.
Reaksi redoks spontan adalah reaksi redoks yang berlangsung serta merta. Pada reaksi redoks terjadi pemindahan elektron dari reduktor ke oksidator. Pengukuran potensial sel dapat digunakan untuk membandingkan kecenderungan logam-logam atau spesi lain untuk mengalami oksidasi atau reduksi. Potensial sel volta dapat ditentukan melalui percobaan dengan
menggunakan voltmeter; pH-meter yang dilengkapi voltmeter; atau potensiometer.
Titrimetri merupakan suatu metode dimana analit direaksikan dengan suatu pereaksi sedemikian rupa, sehingga jumlah zat-zat yang bereaksi itu satu sama lain ekivalen. Ekivalen artinya zat-zat yang direaksikan itu tepat bereaksi sempurna sehingga tidak ada yang sisa. Untuk penambahan larutan secara sedikit demi sedikit digunakan buret, yaitu suatu tabung gelas yang diberi tanda tera untuk volume dan kran untuk mengatur cairan yang dikeluarkan. Pada saat titran yang ditambahkan kira-kira mendekati titik ekivalen, maka penambahan titran harus dihentikan; saat ini dinamakan titik akhir titrasi. Larutan yang ditambahkan dari buret disebut titran, sedang larutan yang ditambah titran disebut titrat. Pada keadaan jumlah ion titran ekivalen dengan ion titrat sedangkan volume dan kemolaran tidak sama, maka berlaku persamaan :
Vtitrat x Mtitrat x ntitrat = Vtitran x Mtitran x ntitran . . . (Pers.1)
D. TUJUAN
Dari percobaan yang dilakukan, siswa diharapkan :
1. Mempunyai kemampuan dalam meramalkan urutan potensial sel dari ion Cr2O72-, MnO4-, BrO3-, Fe2+ dan Sn2+.
2. Mempunyai kemampuan dalam menuliskan reaksi redoks yang terjadi. 3. Dapat menghitung kadar ion Fe2+ dalam garam Mohr dan kadar ion Sn2+
dalam garam SnCl2.2H2O.
4. Mempunyai keterampilan dalam menggunakan alat-alat laboratorium pada umumnya dan melakukan metode titrasi pada khususnya.
E. ALAT DAN BAHAN
1. Alat : - buret 50 mL - statif dan klem
- labu Erlenmeyer 250 mL - Pipet Volume 25 mL - Gelas Ukur 10 mL - Termometer - Pemanas - pH-meter 2. Bahan : - Larutan K2Cr2O7 0,02 M - Larutan KMnO4 0,02 M - Larutan KBrO3 0,02 M
- Larutan Garam Mohr,(NH4)2SO4.FeSO4.6H2O 0,1 M
- Larutan Garam SnCl2.2H2O 0,05 M
- Indikator Methyl Orange
- Indikator Diphenyl Aminsulfonat - Asam Posfat 85%
- Larutan Asam sulfat encer (2,5%) - Larutan KBr 10%
- Larutan HCl pekat - Aqua dm
F. PROSEDUR KERJA
F.1. Titrasi Garam Mohr 0,1 M dan Garam SnCl2.2H2O 0,05 M dengan Oksidator
K2Cr2O7 0,1 N
¾ Pipet larutan garam Mohr dan garam SnCl2.2H2O masing-masing
sebanyak 25 mL dan masukkan ke dalam labu Erlenmeyer 250 mL.
¾ Tambahkan 200 mL asam sulfat encer (2,5%), 8 tetes (0,4 mL) natrium difenilaminasulfonat sebagai indikator dan 5 mL asam posfat 85%.
¾ Titrasi larutan dalam labu Erlenmeyer dengan menambahkan secara perlahan-lahan larutan K2Cr2O7 sambil larutan terus diaduk (digoyang)
hingga terbentuk warna hijau kebiruan atau biru keabu-abuan pada larutan.
¾ Hubungkan larutan dengan alat pH-meter. Catat potensial sel pada setiap penambahan volume titran (Lihat Tabel Data Pengamatan).
¾ Dicatat volume titran yang diperlukan untuk mencapai titik akhir titrasi. ¾ Lakukan duplo.
F.2. Titrimetri Garam Mohr 0,1 M dan Garam SnCl2.2H2O 0,05 M dengan
Oksidator KMnO4 0,1 N.
¾ Pipet larutan garam Mohr dan garam SnCl2.2H2O masing-masing
sebanyak 25 mL dan masukkan ke dalam labu Erlenmeyer 250 mL.
¾ Hubungkan larutan dengan alat pH-meter. Catat potensial sel pada setiap penambahan volume titran (Lihat Tabel Data Pengamatan).
¾ Titrasi larutan secara perlahan dengan KMnO4, dan pada saat terbentuk
warna kuning dalam larutan (warna Fe3+) tambahkan 3 mL H3PO4 85%.
¾ Lanjutkan titrasi hingga terbentuk warna merah muda pada larutan (sekitar 25-30 detik).
¾ Dicatat volume titran yang diperlukan untuk mencapai titik akhir titrasi. ¾ Lakukan duplo.
F.3. Titrimetri Garam Mohr 0,1 M dan Garam SnCl2.2H2O 0,05 M dengan
Oksidator KBrO3 0,1 N.
¾ Pipet larutan garam Mohr dan garam SnCl2.2H2O masing-masing
sebanyak 25 mL dan masukkan ke dalam labu Erlenmeyer 250 mL.
¾ Tambahkan 10 mL larutan KBr 10%, 6 mL HCl, 10 mL aqua dm dan 0,5 mL indikator methyl orange ke dalam masing-masing labi erlenmeyer. ¾ Hubungkan larutan dengan alat pH-meter. Catat potensial sel pada setiap
¾ Titrasi larutan dengan larutan KBrO3 0,1 N secara perlahan-lahan sambil
diaduk hingga terjadi perubahan warna dari tidak berwarna menjadi berwarna kuning.
¾ Dicatat volume titran yang diperlukan untuk mencapai titik akhir titrasi. ¾ Lakukan duplo.
G. HASIL PENGAMATAN
Tabel Pengamatan G.1. Data potensial sel selama titrasi garam Mohr 0,1 M dengan oksidator K2Cr2O7 0,02 M.
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 1,00 2,00 3,00 4,00 5,00 10,00 15,00 20,00 20,70 20,80 20,90 25,00 30,00 40,00 50,00 70,00
Tabel Pengamatan G.2. Data potensial sel selama titrasi garam SnCl2.2H2O 0,1 M
dengan oksidator K2Cr2O7 0,02 M.
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 1,00 2,00 3,00 4,00 5,00 10,00 15,00 20,00 20,70 20,80 20,90 25,00 30,00 40,00 50,00 70,00
Tabel Pengamatan G.3. Data potensial sel selama titrasi garam Mohr 0,1 M dengan oksidator KMnO4 0,02 M.
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 1,00 2,00 3,00 4,00 5,00 10,00 15,00 20,00 24,90 25,00 25,10 30,00 40,00 50,00 70,00
Tabel Pengamatan G.4. Data potensial sel selama titrasi garam SnCl2.2H2O 0,1 M
dengan oksidator KMnO4 0,02 M.
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 1,00 2,00 3,00 4,00 5,00 10,00 15,00 20,00 24,90 25,00 25,10 30,00 40,00 50,00 70,00
Tabel Pengamatan G.5. Data potensial sel selama titrasi garam Mohr 0,1 M dengan oksidator KBrO3 0,02 M.
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 1,00 2,00 3,00 4,00 5,00 10,00 15,00 20,00 20,70 20,80 20,90 25,00 30,00 40,00 50,00 70,00
Tabel Pengamatan G.6. Data potensial sel selama titrasi garam SnCl2.2H2O 0,1 M
dengan oksidator KBrO3 0,02 M.
Volume Pengukuran Potensial (mV) Rata-Rata Titran (mL) 1 2 Potensial (mV) 0,00 1,00 2,00 3,00 4,00 5,00 10,00 15,00 20,00 20,70 20,80 20,90 25,00 30,00 40,00 50,00 70,00
H. PERHITUNGAN
Tabel H.1. Hasil perhitungan kadar ion Fe2+ dengan K2Cr2O7
D a t a Hasil Perhitungan 1. Volume awal K2Cr2O7 (mL) pada buret
2. Volume akhir K2Cr2O7 (mL) pada buret a. Titik akhir 1 =
b. Titik akhir 2 = 3. Volume rata-rata K2Cr2O7 (mL) yang digunakan
4. Molaritas K2Cr2O7
5. mmol K2Cr2O7 yang digunakan
6. mmol garam Mohr
7. Massa Fe2+ (gr) dalam garam Mohr 8. Massa garam Mohr
9. Persentase Fe2+ dalam garam Mohr
Tabel H.2. Hasil perhitungan kadar ion Sn2+ dengan K2Cr2O7
D a t a Hasil Perhitungan 1. Volume awal K2Cr2O7 (mL) pada buret
2. Volume akhir K2Cr2O7 (mL) pada buret a. Titik akhir 1 =
b. Titik akhir 2 = 3. Volume rata-rata K2Cr2O7 (mL) yang digunakan
4. Molaritas K2Cr2O7
5. mmol K2Cr2O7 yang digunakan
6. mmol garam SnCl2.2H2O
7. Massa Sn2+ (gr) dalam garam SnCl
2.2H2O
8. Massa garam SnCl2
9. Persentase Sn2+ dalam garam SnCl2.2H2O
Tabel H.3. Hasil perhitungan kadar ion Fe2+ dengan KMnO4
D a t a Hasil Perhitungan 1. Volume awal KMnO4 (mL) pada buret
2. Volume akhir KMnO4 (mL) pada buret a. Titik akhir 1 =
b. Titik akhir 2 = 3. Volume rata-rata KMnO4 (mL) yang digunakan
4. Molaritas KMnO4
5. mmol KMnO4 yang digunakan
6. mmol garam Mohr
7. Massa Fe2+ (gr) dalam garam Mohr 8. Massa garam Mohr
Tabel H.4. Hasil perhitungan kadar ion Sn2+ dengan KMnO4
D a t a Hasil Perhitungan 1. Volume awal KMnO4 (mL) pada buret
2. Volume akhir KMnO4 (mL) pada buret a. Titik akhir 1 =
b. Titik akhir 2 = 3. Volume rata-rata KMnO4 (mL) yang digunakan
4. Molaritas KMnO4
5. mmol KMnO4 yang digunakan
6. mmol garam SnCl2.2H2O
7. Massa Sn2+ (gr) dalam garam SnCl2.2H2O
8. Massa garam SnCl2
9. Persentase Sn2+ dalam garam SnCl2.2H2O
Tabel H.5. Hasil perhitungan kadar ion Fe2+ dengan K2Cr2O7
D a t a Hasil Perhitungan 1. Volume awal KBrO3 (mL) pada buret
2. Volume akhir KBrO3 (mL) pada buret a. Titik akhir 1 =
b. Titik akhir 2 = 3. Volume rata-rata KBrO3 (mL) yang digunakan
4. Molaritas KBrO3
5. mmol KBrO3 yang digunakan
6. mmol garam Mohr
7. Massa Fe2+ (gr) dalam garam Mohr
8. Massa garam Mohr
9. Persentase Fe2+ dalam garam Mohr
Tabel H.6. Hasil perhitungan kadar ion Sn2+ dengan KBrO3
D a t a Hasil Perhitungan 1. Volume awal KBrO3 (mL) pada buret
2. Volume akhir KBrO3 (mL) pada buret a. Titik akhir 1 =
b. Titik akhir 2 = 3. Volume rata-rata KBrO3 (mL) yang digunakan
4. Molaritas KBrO3
5. mmol KBrO3 yang digunakan
6. mmol garam SnCl2.2H2O
7. Massa Sn2+ (gr) dalam garam SnCl2.2H2O
8. Massa garam SnCl2
I. PEMBAHASAN/DISKUSI
K. PERTANYAAN
1. Ramalkan urutan daya oksidator yang digunakan pada percobaan di atas ?
2. Diantara ion Fe2+ dan ion Sn2+, kira-kira manakah yang merupakan reduktor paling kuat ?
3. Selesaikan persamaan reaksi redoks berikut ! a. Fe2+ + Cr2O72- → . . . .
b. Sn2+ + MnO4- → . . . .
c. Fe2+ + BrO3- → . . . .
4. Diketahui persamaan reaksi : S2O82- + 2e → 2SO4
Mn2+ + 4H2O → MnO4- + 8H+ + 5e
Hitung berapa mol S2O82- yang diperlukan untuk mengoksidasi satu mol ion Mn2+?
5. Berapa gram KMnO4 (Mr = 158) yang diperlukan untuk bereaksi dengan 60 gram
FeSO4 ? (Mr FeSO4 = 151,9)
L. DAFTAR PUSTAKA
1. Basset, J., Denny, R.C., Jeffrey, G.H., and Mendham, J. (1994), Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik, Alih Bahasa : Hadyana, A.P dan Setiono, L,Ir. Penerbit Buku Kedokteran EGC, Jakarta.
2. Hiskia Ahmad. (2001), Elektrokimia dan Kinetika Kimia, Penerbit PT Citra Aditya Bakti, Jakarta.
3. Purba, Michael., Drs., M.Si. (2002), Kimia 3A untuk SMA Kelas XII, Penerbit Erlangga, Jakarta.
PANDUAN UNTUK GURU PROSEDUR PEMBUATAN LARUTAN
A. Penyiapan Larutan Kalium Dikromat 0,1 N (0,0167 M)
Sebanyak 6 gr bahan pro analisis Kalium dikromat, K2Cr2O7, digerus dalam sebuah
lumping (mortar) dari kaca atau akik. Bahan dipanaskan dalam tungku udara pada 140-150oC selama 30-60 menit dan kemudian didinginkan dalam sebuah bejana tertutup dalam desikator. Selanjutnya sebanyak 4,9 gram kalium dikromat kering tersebut ditimbang dengan teliti dalam sebuah botol timbang dan dipindahkan secara kuantitatif ke sebuah labu volumetrik 1 L dengan menggunakan corong kecil untuk mencegah kehilangan bahan. Garam dilarutkan di dalam labu ukur dengan aqua dm dan diencerkan hingga tanda batas labu. Larutan dikocok hingga homogen.
B. Penyiapan Larutan Kalium Permanganat 0,1 M (0,02 M)
Sebanyak kira-kira 3,25 gram kalium permanganat, KMnO4, pro analisis ditimbang di
atas kaca arloji dengan menggunakan neraca analitik, selanjutnya dipindahkan ke gelas piala 1 L. Kemudian ditambahkan 1 liter aqua dm dan gelas piala ditutup dengan kaca arloji besar. Larutan dipanaskan hingga mendidih dan dididihkan secara perlahan-lahan selama 15-30 menit, dan kemudian didinginkan hingga mencapai temperatur laboratorium. Larutan selanjutnya disaring dengan sebuah corong atau krus saring dari kaca masir atau porselin. Filtrat dikumpulkan dalam sebuah bejana yang telah dibersihkan dengan campuran asam kromat, lalu dibilas dengan air suling. Larutan yang telah disaring itu harus disimpan dalam sebuah botol kaca yang bersih, dan disimpan di tempat gelap, kecuali bila sedang digunakan; sebagai pilihan lain, boleh disimpan dalam botol dari kaca yang berwarna coklat tua.
C. Standarisasi Larutan Kalium Permanganat dengan Natrium Oksalat
Sebanyak kira-kira 2 gram natrium oksalat pro analisis dikeringkan selama 2 jam pada suhu 105-110oC, dan kemudian didinginkan dalam sebuah bejana bertutup
0,335 gr natrium oksalat kering tersebut, dan selanjutnya dimasukkan ke dalam piala 250 mLdan ditambahkan aqua dm hingga tanda batas. Larutan diaduk hingga oksalat melarut. Sebanyak 25 mL dari larutan di atas dipipet dan dimasukkan ke dalam labu erlenmeyer kemudian ditambahkan 10-15 mL asam sulfat pekat (dengan hati-hati) dan didinginkan hingga menjadi 25-30oC. Selanjutnya larutan dipanaskan hingga mencapai 55-60oC dan dititrasi dengan menambahkan larutan permanganat hingga berwarna merah jambu.
D. Penyiapan Larutan Kalium Bromat, KBrO3 0,1 N (0,0167 M)
Sebanyak 5 gr kalium bromat pro analisis yang telah dijadikan bubuk halus dikeringkan selama 12 jam pada pada suhu 120oC, kemudian didinginkan dalam sebuah bejana tertutup dalam desikator. Selanjutnya ditimbang dengan cermat 2,783 gr kalium bromat murni kering tersebut, dan dilarutkan dalam 1 L air aqua dm dalam sebuah labu volumetrik.
E. Pembuatan Larutan Garam Mohr, (NH4)2SO4.FeSO4.6H2O 0,1 M
Sebanyak 9,80 gr garam Mohr ditimbang dengan teliti dan kemudian dimasukkan ke dalam labu ukur 250 mL. Selanjutnya dilarutkan dengan menambahkan aqua dm hingga tanda batas labu ukur (ditambahkan pula larutan asam sulfat 2 N kira-kira setengah dari volume larutan, ~125 mL). Larutan dihomogenkan dengan membolak-balik labu takar secara perlahan.
F. Pembuatan Larutan Garam SnCl2.2H2O 0,05 M
Sebanyak 2,8206 gr garam SnCl2.2H2O ditimbang dengan teliti, kemudian
dimasukkan ke dalam labu ukur 250 mL. Selanjutnya dilarutkan dengan menambahkan aqua dm hingga tanda batas labu ukur (ditambahkan pula larutan asam sulfat 2 N kira-kira setengah dari volume larutan, ~125 mL). Larutan dihomogenkan dengan membolak-balik labu takar secara perlahan.