x
INTISARI
Asam sinamat diketahui mempunyai aktivitas sebagai pengawet dan pewangi serta penghambat pertumbuhan sel caco-2 yang menyebabkan tumor. Adanya aktivitas yang dimiliki oleh asam sinamat sehingga asam sinamat merupakan senyawa yang penting untuk disintesis. Tujuan penelitian ini adalah untuk mensintesis asam sinamat menggunakan asam malonat dan benzaldehid dengan katalis etilendiamin dan mengetahui jumlah rendemen yang dihasilkan.
Penelitian ini merupakan penelitian non eksperimental yang dilakukan dengan mereaksikan benzaldehid 30 mmol dan asam malonat 30 mmol menggunakan katalis etilendiamin selama 2,5 jam pada suhu 80º C. Analisis secara kualitatif meliputi uji organoleptis, uji kelarutan, pemeriksaan titik lebur, kromatografi gas, elusidasi struktur senyawa hasil sintesis dengan spektrofotometri ultraviolet, spektrofotometri inframerah (IR), spektrometri resonansi magnetik inti proton (1H-NMR) dan spektrometri massa. Sedangkan analisis hasil penelitian secara kuantitatif dilakukan dengan perhitungan rendemen.
Sintesis asam sinamat menghasilkan rendemen sebesar 50,4%. Senyawa hasil sintesis berupa serbuk kristal halus berwarna putih dan berbau khas. Larut dalam etanol, metanol, kloroform, dimetil sulfoksida, air panas dan aseton; sangat sukar larut dalam air dingin. Titik lebur senyawa hasil sintesis 130-131º C. Kromatografi gas menunjukkan satu puncak dengan waktu retensi 13,27 menit. Elusidasi struktur dengan spektrofotometri ultraviolet, spektrofotometri inframerah, spektrometri 1H-NMR, dan spektrometri massa menunjukkan bahwa senyawa hasil sintesis adalah asam sinamat.
Kata kunci: Sintesis, asam sinamat, rendemen
xi
ABSTRACT
Cinnamic acid has known to have activity as preservative, flavor and inhibited growth of Caco-2 cell in tumor deseases. With that activity, cinnamic acid is very important to be sythetized. The purpose of this research is to synthesis cinnamic acid from malonic acid with ethylenediamine as catalyst and to know the rendement of synthetic product.
The research could be classified as the non experimental research with succeded of synthesizing of cinnamic acid as the parameter. The research was done by reacting benzaldehyde 30 mmol and malonic acid 30 mmol with ethylenediamine as catalyst. The qualitative analysis was done by organoleptic test, solubility test, melting point estimation, gas chromatography, elucidation of synthesized compound with ultraviolet (UV) spectrophotometry, infrared (IR) spectrophotometry, proton nuclear magnetic (H1NMR) spectrophotometry and mass spectometry. The quantitative analysis was done by estimating the yield of synthesized compound.
The rendement of cinnamic acid synthetic was 50,4% with white small crystal and specified odor. The synthetic product was soluble in ethanol, methanol, chloroform, dimethyl sulfoxide, hot water and acetone; very slightly soluble in cold water. The melting point of synthesized compound was between 130-131 ºC. The gas chromatography showed that the synthesized compound has one peak with retention time was 13,27 minute. Structure elucidation by ultraviolet spectrophotometry, infrared spectrophotometry, 1H-NMR spectrometry, and mass spectrometry showed that synthetic product was cinnamic acid.
Key words : synthesis, cinnamic acid, rendement
iii
iv
v
HALAMAN PERSEMBAHAN
“Sesuatu yang dapat dibayangkan pasti dapat diraih,
sesuatu yang bisa diimpikan pasti dapat diwujudkan”
(William Arthur Word)
“Sukses tidak diukur dari posisi yang dicapai seseorang dalam
hidup, tapi dari kesulitan-kesulitan yang berhasil diatasi ketika
berusaha meraih sukses”
(Booker T Washington)
Kupersembahkan karya ini buat:
Bapa dan Mama tercinta, Chen, Oshi, Ones,T.Angela,
dan almamaterku.
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Edvansius Sarani NIM : 048 114 029
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
SINTESIS ASAM SINAMAT DARI BENZALDEHID DAN ASAM MALONAT DENGAN KATALIS ETILENDIAMIN
berserta perangkat yang diperlukan. Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikan di internet atau media lain untuk kepentingan akademis tanpa perlu meminta izin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya. Dibuat di Yogyakarta
Pada tanggal 14 Februari 2009 Yang menyatakan,
Edvansius Sarani
vii PRAKATA
Puji syukur kepada Tuhan Yesus Kristus atas berkat, rahmat dan penyertaanNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul “Sintesis Asam Sinamat dari Benzaldehid dan Asam Malonat dengan Katalis Etilendiamin”. Skripsi ini disusun dalam rangka memenuhi salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta
Selama penelitian dan penyusunan skripsi ini, penulis mendapat bantuan dan dukungan berbagai pihak. Pada kesempatan ini penulis mengucapkan terimakasih atas segala bantuan dan dukungan yang telah diberikan kepada : 1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata
Dharma.
2. Jeffry Julianus, M.Si., selaku dosen pembimbing atas kesediaannya dalam memberikan arahan, dukungan dan masukan dalam penelitian dan penyusunan skripsi ini.
3. Lucia Wiwid Widjayanti, M.Si., selaku dosen penguji yang telah banyak
memberikan masukan kepada penulis.
4. Christine Patramurti, M.Si., Apt., selaku dosen penguji yang telah banyak
memberikan masukan kepada penulis.
5. Yohanes Dwiatmaka, M.Si., atas izin yang diberikan kepada penulis dalam
penggunaan laboratorium.
6. Dr. Pudjono, S.U., Apt., atas masukan yang diberikan selama berjalannya penelitian.
viii
7. Dr. Supardjan A.M., M.S., Apt. atas masukan yang diberikan selama berjalannya penelitian.
8. Mas Parlan, Mas Kunto, Mas Bimo, Mas Wagiran, dan segenap laboran
Fakultas Farmasi yang telah membantu dan memberi kepercayaan selama bekerja di laboratorium.
9. Staf Laboratorium Kimia Organik Fakultas MIPA Universitas Gadjah Mada
Yogyakarta.
10. Leo, Bob, Elvan, terima kasih atas persahabatan, kerjasama, bantuan,
dukungan, dan semangat selama kuliah dan berjalannya skripsi.
11. Coco, Fadhjhar, Yusak, terimakasih atas bantuan, kerjasama, suka dan duka selama perjuangan berat di laboratorium.
12. Boris, Robby, Probo, Adit, dan mas Budiarto, terimakasih atas bantuan, kerjasama, suka dan duka selama perjuangan berat di laboratorium.
13. Semua pihak yang tidak dapat disebutkan satu persatu, yang turut membantu dalam penyusunan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan yang terdapat dalam penyusunan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun. Semoga skripsi ini dapat memberikan manfaat bagi semua pihak dan mendukung perkembangan ilmu pengetahuan.
ix
PERNYATAAN KEASLIAN KARYA
Penulis menyatakan dengan sesungguhnya bahwa skripsi yang penulis tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 21 Oktober 2008
Penulis
x INTISARI
Asam sinamat diketahui mempunyai aktivitas sebagai pengawet dan pewangi serta penghambat pertumbuhan sel caco-2 yang menyebabkan tumor. Adanya aktivitas yang dimiliki oleh asam sinamat sehingga asam sinamat merupakan senyawa yang penting untuk disintesis. Tujuan penelitian ini adalah untuk mensintesis asam sinamat menggunakan asam malonat dan benzaldehid dengan katalis etilendiamin dan mengetahui jumlah rendemen yang dihasilkan.
Penelitian ini merupakan penelitian non eksperimental yang dilakukan dengan mereaksikan benzaldehid 30 mmol dan asam malonat 30 mmol menggunakan katalis etilendiamin selama 2,5 jam pada suhu 80º C. Analisis secara kualitatif meliputi uji organoleptis, uji kelarutan, pemeriksaan titik lebur, kromatografi gas, elusidasi struktur senyawa hasil sintesis dengan spektrofotometri ultraviolet, spektrofotometri inframerah (IR), spektrometri resonansi magnetik inti proton (1H-NMR) dan spektrometri massa. Sedangkan analisis hasil penelitian secara kuantitatif dilakukan dengan perhitungan rendemen.
Sintesis asam sinamat menghasilkan rendemen sebesar 50,4%. Senyawa hasil sintesis berupa serbuk kristal halus berwarna putih dan berbau khas. Larut dalam etanol, metanol, kloroform, dimetil sulfoksida, air panas dan aseton; sangat sukar larut dalam air dingin. Titik lebur senyawa hasil sintesis 130-131º C. Kromatografi gas menunjukkan satu puncak dengan waktu retensi 13,27 menit. Elusidasi struktur dengan spektrofotometri ultraviolet, spektrofotometri inframerah, spektrometri 1H-NMR, dan spektrometri massa menunjukkan bahwa senyawa hasil sintesis adalah asam sinamat.
Kata kunci: Sintesis, asam sinamat, rendemen
xi ABSTRACT
Cinnamic acid has known to have activity as preservative, flavor and inhibited growth of Caco-2 cell in tumor deseases. With that activity, cinnamic acid is very important to be sythetized. The purpose of this research is to synthesis cinnamic acid from malonic acid with ethylenediamine as catalyst and to know the rendement of synthetic product.
The research could be classified as the non experimental research with succeded of synthesizing of cinnamic acid as the parameter. The research was done by reacting benzaldehyde 30 mmol and malonic acid 30 mmol with ethylenediamine as catalyst. The qualitative analysis was done by organoleptic test, solubility test, melting point estimation, gas chromatography, elucidation of synthesized compound with ultraviolet (UV) spectrophotometry, infrared (IR) spectrophotometry, proton nuclear magnetic (H1NMR) spectrophotometry and mass spectometry. The quantitative analysis was done by estimating the yield of synthesized compound.
The rendement of cinnamic acid synthetic was 50,4% with white small crystal and specified odor. The synthetic product was soluble in ethanol, methanol, chloroform, dimethyl sulfoxide, hot water and acetone; very slightly soluble in cold water. The melting point of synthesized compound was between 130-131 ºC. The gas chromatography showed that the synthesized compound has one peak with retention time was 13,27 minute. Structure elucidation by ultraviolet spectrophotometry, infrared spectrophotometry, 1H-NMR spectrometry, and mass spectrometry showed that synthetic product was cinnamic acid.
Key words : synthesis, cinnamic acid, rendement
xii DAFTAR ISI
HALAMAN JUDUL ... ii
PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
HALAMAN PERSEMBAHAN ... v
HALAMAN PERNYATAAN PUBLIKASI ... vi
PRAKATA ... vii
PERNYATAAN KEASLIAN KARYA ... ix
INTISARI ... x
ABSTRACT ... xi
DAFTAR ISI ... xii
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xix
BAB I. PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 2
2. Keaslian penelitian ... 2
3. Manfaat penelitian ... 3
B. Tujuan penelitian ... 3
BAB II. PENELAAHAN PUSTAKA... 4
A. Asam Sinamat ... 4
xiii
C. Benzaldehid dan Kerektifannya ... 6
D. Etilendiamin dan Kebasaannya ... 7
E. Kondensasi Knoevenagel ... 8
F. Rekristalisasi ... 10
G. Uji Pendahuluan ... 11
1. Pemeriksaan organoleptis ... 11
2. Pemeriksaan kelarutan ... 11
3. Pemeriksaan titik lebur ... 12
4. Kromatografi gas ... 13
H. Elusidasi Struktur Senyawa Hasil Sintesis ... 13
1. Spektroskopi ultraviolet ... 13
2. Spektroskopi inframerah ... 14
3. Spektroskopi resonansi magnetik inti (1H-NMR) ... 14
4. Spektrometri massa ... 17
I. Landasan Teori ... 20
J. Hipotesis ... 21
BAB III. METODE PENELITIAN ... 22
A. Jenis dan Rancangan Penelitian ... 22
B. Parameter Penelitian dan Definisi Operasional... 22
1. Starting material ... 22
2. Molekul target ... 22
3. Katalis ... 22
xiv
C. Bahan / Materi Penelitian ... 23
D. Alat ... 23
E. Tata Cara Penelitian ... 24
1. Sintesis asam sinamat ... 24
2. Rekristalisasi senyawa hasil sintesis ... 24
3. Uji pendahuluan ... 24
a. Uji organoleptis ... 24
b. Uji kelarutan ... 24
c. Titik lebur ... 25
d. Kromatografi gas ... 25
4. Elusidasi struktur senyawa hasil sintesis ... 25
a. Spektrofotometri ultraviolet ... 25
b. Spektroskopi inframerah ... 26
c. Spektroskopi resonansi magnetik inti (1H-NMR) ... 26
d. Spektrometri massa ... 26
F. Tata cara analisis hasil ... 27
1. Perhitungan rendemen ... 27
2. Analisis pendahuluan ... 27
3. Elusidasi struktur ... 27
BAB IV. HASIL DAN PEMBAHASAN ... 28
A. Sintesis Asam Sinamat ... 28
B. Rekristalisasi Senyawa Hasil Sintesis ... 31
xv
1. Uji organoleptis ... 31
2. Uji kelarutan senyawa hasil sintesis ... 32
3. Uji titik lebur ... 33
4. Uji kemunian dengan kromatografi gas ... 34
D. Elusidasi Struktur Senyawa Hasil Sintesis ... 34
1. Interpretasi spektra ultraviolet... 34
2. Interpretasi spektra inframerah ... 36
3. Interpretasi spektra 1H-NMR ... 41
4. Interpretasi spektra massa ... 44
BAB V. KESIMPULAN DAN SARAN ... 48
A. Kesimpulan ... 48
B. Saran ... 48
DAFTAR PUSTAKA ... 49
xvi
DAFTAR TABEL
Tabel I. Urutan kebasaan senyawa amina ... 8 Tabel II. Istilah kelarutan zat menurut Farmakope Indonesia IV ... 12 Tabel III. Hasil uji organoleptis senyawa hasil sintesis dibandingkan
dengan starting material dan asam sinamat standar ... 31 Tabel IV. Hasil uji kelarutan senyawa hasil sintesis dibandingkan dengan
litertur ... 32 Tabel V. Perbandingan pita vibrasi gugus senyawa hasil sintesis dengan
literatur ... 37 Tabel VI. Perbandingan pita vibrasi gugus benzaldehid dengan literatur ... 39
Tabel VII. Perbandingan pita vibrasi gugus asam malonat dengan literatur ... 40 Tabel VIII Interpretasi spektra inframerah senyawa hasil sintesis dengan asam
xvii
DAFTAR GAMBAR
Gambar 1. Struktur asam sinamat ... 5
Gambar 2. Bentuk isomer trans dan cis pada asam sinamat ... 5
Gambar 3. Struktur asam malonat ... 6
Gambar 4. Deaktivasi gugus karboksilat ... 6
Gambar 5. Struktur benzaldehid ... 6
Gambar 6. Resonansi pada benzaldehid ... 7
Gambar 7. Struktur etilendiamin ... 7
Gambar 8. Reaksi kondensasi Knoevenagel antara benzaldehid dan asam malonat ... 8
Gambar 9. Proses dekarboksilasi pada senyawa dengan gugus karbonil β-karboksilat ... 9
Gambar 10. Dekarboksilasi pada asam malonat dan tautomerasi keto-enol ... 10
Gambar 11. Reaksi umum pembentukan asam sinamat... 20
Gambar 12. Reaksi pembentukan garam malonat... 28
Gambar 13. Reaksi pembentukan ion enolat ... 29
Gambar 14. Reaksi adisi ion enolat pada karbon karbonil ... 29
Gambar 15. Reaksi dehidrasi dan dekarboksilasi ... 30
Gambar 16. Reaksi etilendiamin dengan asam klorida ... 31
Gambar 16. Senyawa hasil sintesis ... 32
Gambar 17. Kromatogram senyawa hasil sintesis ... 34
Gambar 18.Gugus kromofor dan auksokrom pada asam sinamat... 35
xviii
Gambar 20. Spektra IR senyawa hasil sintesis ... 37
Gambar 21. Spektra inframerah benzaldehid ... 39
Gambar 22. Spektra inframerah asam malonat ... 40
Gambar 23. Spektra 1H-NMR senyawa hasil sintesis ... 42
Gambar 24. Spektra massa senyawa hasil sintesis ... 45
xix
DAFTAR LAMPIRAN
Lampiran 1. Data perhitungan rendemen ... 52
Lampiran 2.Perhitungan pergeseran kimia dari senyawa hasil sintesis pada spektroskopi H1NMR...55
Lampiran 3. Hasil pengujian titik lebur ... 56
Lampiran 4. Spektra inframerah asam malonat sebagai pembanding ... 57
Lampiran 5. Spektra infrmerah benzaldehid sebagai pembanding ... 58
Lampiran 6. Spektra inframerah senyawa hasil sintesis ... 59
Lampiran 7. Spektra H1NMR senyawa hasil sintesis... 60
Lampiran 8. Kondisi kromatografi gas ... 61
Lampiran 9. Kromatogram GC senyawa hasil sintesis ... 62
1 BAB I PENGANTAR
A. Latar belakang
Asam sinamat merupakan salah satu senyawa aktif produk alam yang digunakan sebagai pengawet, pewangi dalam makanan, kosmetik, sabun, dan produk-produk farmasi lainnya (Anwar et al., 1994). Selain itu, asam sinamat dapat menghambat profilerasi dari sel caco-2 yang menyebabkan tumor (Ekmekcioglu et al., 1998).
Melihat banyaknya fungsi asam sinamat, hal ini memacu dikembangkannya produksi asam sinamat. Asam sinamat dapat diperoleh dengan mengisolasinya dari kulit kayu manis (Cinnamomum burmani). Pada penelitian yang dilakukan oleh Kanghear et al (2005), jumlah rendemen asam sinamat yang dihasilkan hanya sedikit, yaitu sekitar 2,2%. Oleh karena itu, untuk mendapatkan asam sinamat dapat dilakukan dengan cara sintesis. Salah satunya adalah sintesis asam sinamat menggunakan katalis amonia yang menghasilkan rendemen 85% (Fessenden and Fessenden, 1986b).
Sintesis asam sinamat dapat dilakukan melalui reaksi Knoevenagel dan reaksi Perkin. Reaksi Knoevenagel lebih sering digunakan karena jumlah senyawa yang diperoleh lebih banyak dibandingkan dengan reaksi Perkin. Reaksi
2
katalis basa organik yang memiliki gugus amina (Fessenden and Fessenden, 1986b).
Etilendiamin (pKb = 4.07) tergolong suatu amina primer dan memiliki sifat basa lebih kuat dibandingkan amonia (pKb = 4.74). Menurut McMurry (2004), semakin kuat basa yang digunakan maka atom hidrogen α semakin mudah membentuk ion enolat. Dengan demikian, pembentukan asam sinamat diharapkan semakin cepat dan rendemen yang dihasilkan lebih banyak. Oleh karena itu perlu diteliti penggunaan etilendiamin sebagai katalis dalam sintesis senyawa asam sinamat.
1. Permasalahan
Dari latar belakang, maka dapat dirumuskan permasalahannya yaitu berapa jumlah rendemen yang dihasilkan dari sintesis asam sinamat dari sam malonat dan benzaldehid dengan katalis etilendiamin?
2. Keaslian penelitian
Senyawa turunan asam sinamat yang telah disintesis adalah asam trans 4- hidroksi sinamat dengan katalis amonia oleh Andreas Bob (2008), asam hidroksi sinamat dengan katalis piridin oleh Andrian Erwinto (2008), asam 4-hidroksi-3-metoksi sinamat dengan katalis piridin oleh Fajar Agung (2008), asam sinamat menggunakan katalis dietilamin oleh Elvan Luckyvano (2008), tetapi sintesis asam sinamat dari asam malonat dan benzaldehid dengan katalis etilendiamin, sejauh pengamatan penulis belum pernah dilakukan.
3
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan sumbangan ilmiah terhadap perkembangan sintesis obat, khususnya sintesis asam sinamat.
b. Manfaat praktis
Penelitian ini dapat memberikan manfaat berupa katalis alternatif untuk sintesis asam sinamat.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui jumlah rendemen yang dihasilkan oleh sintesis asam sinamat dari asam malonat dan benzaldehid dengan katalis etilendiamin.
4 BAB II
PENELAAHAN PUSTAKA
A. Asam Sinamat
Asam sinamat merupakan senyawa yang berasal dari isolasi kulit kayu manis (Cinnamomum burmanni) dan termasuk dalam famili Lauraceae. Kulit kayu manis berguna sebagai pewangi atau menimbulkan citarasa dalam makanan, kosmetik, sabun, dan produk-produk industri farmasi lainnya. Minyak kayu manis memiliki efek antiseptik terhadap mikroorganisme. Kandungan utama minyak kayu manis adalah sinamaldehid yang jika teroksidasi akan menghasilkan asam sinamat. Ester asam sinamat seperti etil dan metil sinamat banyak digunakan dalam industri minuman dan parfum karena memiliki bau yang harum. Dalam industri farmasi, ester sinamat digunakan untuk obat anestetik lokal dan luka bakar (Anwar et al., 1994).
Asam sinamat dikenal pula dengan nama asam 3-fenil-2-propenoat, asam
β-fenilakrilat. Asam sinamat memiliki bobot molekul 148,16 g/mol dengan rumus
molekul C9H8O2; memiliki titik lebur 133°C dan titik didih 300°C; memiliki
panjang gelombang serapan maksimum pada daerah ultraviolet (dalam pelarut etanol) sebesar 273 nm; sangat sukar larut dalam air dingin; larut dalam air panas; mudah larut dalam alkohol, etanol, dan kloroform.
5
OH O
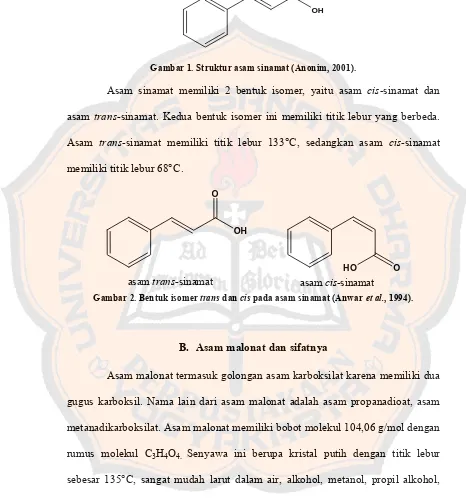
Gambar 1. Struktur asam sinamat (Anonim, 2001).
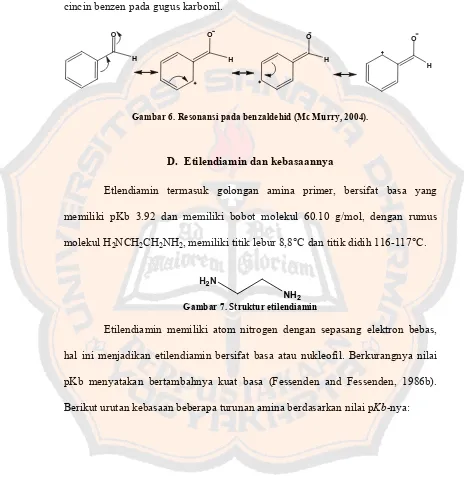
Asam sinamat memiliki 2 bentuk isomer, yaitu asam cis-sinamat dan asam trans-sinamat. Kedua bentuk isomer ini memiliki titik lebur yang berbeda. Asam trans-sinamat memiliki titik lebur 133°C, sedangkan asam cis-sinamat memiliki titik lebur 68°C.
O HO
O
OH
asamcis-sinamat asamtrans-sinamat
Gambar 2. Bentuk isomer trans dan cis pada asam sinamat (Anwar et al., 1994).
B. Asam malonat dan sifatnya
Asam malonat termasuk golongan asam karboksilat karena memiliki dua gugus karboksil. Nama lain dari asam malonat adalah asam propanadioat, asam metanadikarboksilat. Asam malonat memiliki bobot molekul 104,06 g/mol dengan rumus molekul C3H4O4. Senyawa ini berupa kristal putih dengan titik lebur
sebesar 135°C, sangat mudah larut dalam air, alkohol, metanol, propil alkohol, mudah larut dalam piridin dan larut dalam eter.
6
O
OH O
HO
Gambar 3. Struktur asam malonat (Anonim, 2001).
Reaksi antara suatu asam karboksilat dengan amina akan menghasilkan suatu garam amina. Garam amina lazim diberi nama sebagai garam amonium tersubtitusi atau sebagai kompleks amina asam (Fessenden and Fessenden, 1986b). Reaksi asam karboksilat dengan suatu amina tidak akan membentuk amida karena amina merupakan suatu basa yang mengubah keasaman gugus karboksilat menjadi bentuk anion karboksilat yang tidak reaktif
R
Gambar 4. Deaktivasi gugus karboksilat (McMurry, 2004).
C. Benzaldehid dan kereaktifannya
Benzaldehid termasuk golongan aldehid aromatik yang memiliki bobot molekul 106,12 g/mol dengan rumus molekul C7H6O. Senyawa ini berupa cairan
berwarna kuning dan memiliki karakteristik bau minyak almond. Titik lebur dan titik didih senyawa ini adalah -56,5°C dan 179°C. Sukar larut dalam air namun dapat bercampur dengan alkohol, eter, dan minyak.
O
H
Gambar 5. Struktur benzaldehid (Anonim, 2001).
7
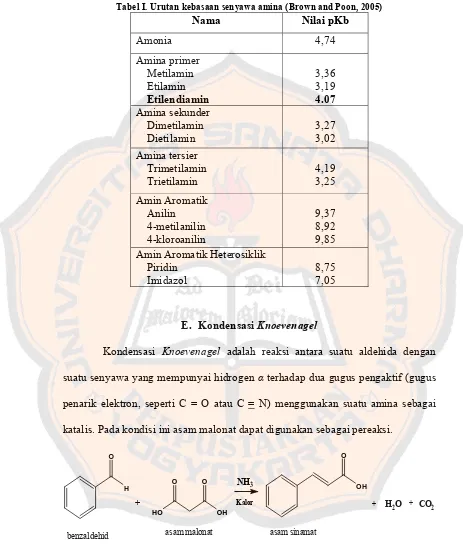
Sedikit berbeda dengan aldehid alifatik, aldehid aromatik kurang reaktif sebagai elektrofil. Hal ini disebabkan karena adanya donor elektron dari resonansi cincin benzen pada gugus karbonil.
O O O O
H H H
H
Gambar 6. Resonansi pada benzaldehid (Mc Murry, 2004).
D. Etilendiamin dan kebasaannya
Etlendiamin termasuk golongan amina primer, bersifat basa yang memiliki pKb 3.92 dan memiliki bobot molekul 60.10 g/mol, dengan rumus molekul H2NCH2CH2NH2, memiliki titik lebur 8,8°C dan titik didih 116-117°C.
H2N
NH2
Gambar 7. Struktur etilendiamin
8
Tabel I. Urutan kebasaan senyawa amina (Brown and Poon, 2005)
Nama Nilai pKb Amin Aromatik Heterosiklik
Piridin Imidazol
8,75 7,05
E. Kondensasi Knoevenagel
Kondensasi Knoevenagel adalah reaksi antara suatu aldehida dengan suatu senyawa yang mempunyai hidrogen α terhadap dua gugus pengaktif (gugus penarik elektron, seperti C = O atau C = N) menggunakan suatu amina sebagai katalis. Pada kondisi ini asam malonat dapat digunakan sebagai pereaksi.
O
benzaldehid asam malonat asam sinamat
Gambar 8. Reaksi kondensasi Knoevenagel antara benzaldehid dan asam malonat (Fessenden and Fessenden, 1986b).
9
Sintesis senyawa asam sinamat dan turunannya dapat dilakukan melalui reaksi Perkin dan Knoevenagel. Sintesis senyawa asam sinamat menurut reaksi
Perkin menghasilkan prosentase rendemen yang lebih kecil dibandingkan reaksi
Knoevenagel (Ekowati cit Norman and Coxon, Iwantono, 2003).
Aplikasi reaksi Knoevenagel ini yaitu pada kondensasi suatu keton atau aldehid dengan senyawa-senyawa yang mudah terenolisasi dan terdiri dari 2 gugus pengaktif. Ester malonat dan ester sianoasetat merupakan contoh dari senyawa yang memiliki 2 gugus pengaktif ini. Basa lemah seperti amina dapat memberikan konsentrasi ion enolat yang cukup tinggi untuk reaksi sehingga self-condensation dari komponen karbonil dapat diminimalkan. (Carey and Sundberg, 1977).
Senyawa intermediet yang telah diadisi mudah mengalami dekarboksilasi. Pada umumnya, dekarboksilasi dan eliminasi terjadi secara bersamaan (Carey and Sundberg, 1977). Dekarboksilasi ialah hilangnya CO2 dari
gugus karboksil. Pada umumnya asam karboksilat membutuhkan pemanasan yang tinggi untuk mengalami dekarboksilasi ini. Akan tetapi terdapat pengecualian pada asam karboksilat yang memiliki gugus karbonil pada posisi β dari gugus karboksilatnya, seperti asam 3-oksobutanoat. Pada senyawa tersebut, hanya dengan pemanasan secukupnya dapat menyebabkan terjadinya dekarboksilasi.
O
Gambar 9. Proses dekarboksilasi pada senyawa dengan gugus karbonil β-karboksilat (Brown and Poon, 2005).
10
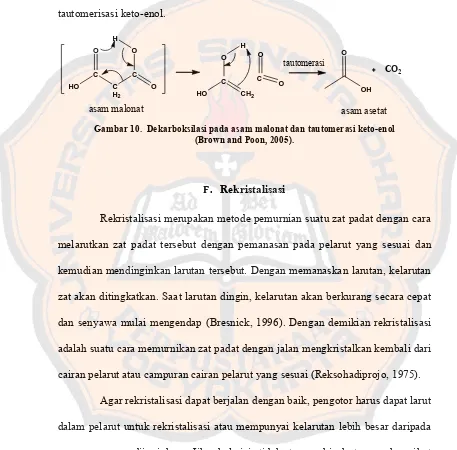
Dekarboksilasi terjadi karena adanya penataulangan enam elektron dari bentuk transisi cincin siklik sehingga menghasilkan karbondioksida dan suatu enol. Bentuk enol sebagai hasil dekarboksilasi ini selanjutnya akan mengalami tautomerisasi keto-enol.
C
Gambar 10. Dekarboksilasi pada asam malonat dan tautomerasi keto-enol (Brown and Poon, 2005).
F. Rekristalisasi
Rekristalisasi merupakan metode pemurnian suatu zat padat dengan cara melarutkan zat padat tersebut dengan pemanasan pada pelarut yang sesuai dan kemudian mendinginkan larutan tersebut. Dengan memanaskan larutan, kelarutan zat akan ditingkatkan. Saat larutan dingin, kelarutan akan berkurang secara cepat dan senyawa mulai mengendap (Bresnick, 1996). Dengan demikian rekristalisasi adalah suatu cara memurnikan zat padat dengan jalan mengkristalkan kembali dari cairan pelarut atau campuran cairan pelarut yang sesuai (Reksohadiprojo, 1975).
Agar rekristalisasi dapat berjalan dengan baik, pengotor harus dapat larut dalam pelarut untuk rekristalisasi atau mempunyai kelarutan lebih besar daripada senyawa yang diinginkan. Jika hal ini tidak terpenuhi, kotoran akan ikut mengkristal bersama senyawa yang diinginkan (Bresnick, 1996).
11
G. Uji Pendahuluan
Uji pendahuluan dilakukan untuk mengetahui karakteristik dari senyawa hasil reaksi, biasanya meliputi pemeriksaan organoleptis, pemeriksaan kelarutan, pemeriksaan titik lebur, dan kromatografi gas.
1. Pemeriksaan organoleptis
Pemeriksaan organoleptis memuat paparan mengenai sifat zat yang meliputi wujud, rupa, warna, rasa, bau. Dengan pemeriksaan organoleptis dapat diketahui ciri fisik dari senyawa baru. Sehingga pemeriksaan organoleptis dapat dijadikan sebagai pentunjuk awal dalam pemeriksaan senyawa hasil sintesis dengan membandingkanya dengan standar dan diharapkan sesuai dengan yang tercantum dalam standar.
Pernyataan dalam pemeriksaan organoleptis tidak cukup kuat dijadikan syarat baku, tetapi meskipun demikian secara tidak langsung dapat membantu penilaian pendahuluan terhadap mutu zat yang bersangkutan (Anonim, 1995). 2. Pemeriksaan kelarutan
Pemeriksaan kelarutan senyawa dilakukan untuk mengetahui sifat fisik suatu zat. Selain itu, uji kelarutan dapat digunakan untuk identifikasi atau determinasi kemurnian dari senyawa tersebut dengan membandingkannya dengan standar dan diharapkan sesuai dengan yang tercantum dalam standar. (Jenkins et al, 1965).
12
tersendiri dan disertai cara ujinya secara kuantitatif. Pernyataan bagian dalam kelarutan berarti 1 gram zat padat atau 1 ml zat cair dalam sejumlah ml pelarut (Anonim, 1979).
Tabel II. Istilah kelarutan zat menurut Farmakope Indonesia IV (Anonim, 1995)
Istilah kelarutan
Jumlah bagian pelarut yang diperlukan untuk melarutkan 1 bagian zat Sangat mudah larut
Mudah larut Larut Agak sukar larut
Sukar larut Sangat sukar larut Praktis tidak larut
Kurang dari 1 1 sampai 10 10 sampai 30 30 sampai 100 100 sampai 1.000 1.000 sampai 10.000
Lebih dari 10.000
3. Pemeriksaan titik lebur
Titik lebur adalah proses perubahan fisika pada suhu tertentu yang mengakibatkan padatan mulai berubah menjadi cair pada tekanan 1 atmosfer. Jika suhu dinaikkan, terjadi penyerapan energi oleh molekul senyawa sehingga bila energi yang diserap cukup besar maka akan terjadi vibrasi dan rotasi dari molekul tersebut. Bila suhu tetap dinaikkan terus maka molekul akan rusak dan berubah menjadi cairan (Brandstatter, 1971).
Pemeriksaan titik lebur merupakan aspek yang sangat penting, yang seringkali dilakukan dalam penelitian sintesis suatu senyawa. Pemeriksaan titik lebur dapat memberikan informasi mengenai kemurnian dari suatu produk hasil sintesis. Pada umumnya suatu senyawa mempunyai kemurnian yang baik bila jarak leburnya tidak lebih dari 2°C. Rentangan lebih besar dari harga ini dapat dikatakan senyawa kurang murni (MacKenzie, 1967).
13
4. Kromatografi gas
Kromatografi gas merupakan instrumen analitis yang memberikan informasi baik kualitatif maupun kuantitatif mengenai komponen suatu sampel. Sampel akan mengalami proses pemisahan dalam kolom, kemudian dideteksi dan direkam sebagai pita elusi (Day and Underwood, 1996).
Data kromatografi gas biasanya terdiri atas waktu tambat atau retensi berbagai komponen campuran. Waktu retensi diukur mulai dari titik penyuntikan sampai titik maksimum puncak dan sangat khas untuk senyawa tertentu pada kondisi tertentu (kolom, suhu, gas pembawa, laju aliran). Adanya komponen tertentu dapat diidentifikasi dengan cara spiking jika tersedia senyawa murninya. Senyawa murni ditambahkan kedalam cuplikan yang diduga mengandung senyawa yang diinginkan dan dikromatografi. Jika puncak yang sesuai diperkuat secara simetris pada dua sistem fase diam yang berlainan dan kepolarannya berbeda, komponen itu mungkin ada (Gritter, 1991).
H. Elusidasi Struktur Senyawa Hasil Sintesis
1. Spektroskopi ultraviolet
14
Panjang gelombang serapan merupakan ukuran pemisahan tingkat tenaga dari orbital-orbital suatu molekul. Pemisahan tenaga yang paling tinggi diperoleh bila elektron-elektron dalam ikatan σ tereksitasi yang menimbulkan serapan pada daerah dari 120 hingga 200 nm. Daerah ini dikenal sebagai daerah ultraviolet vakum dan tidak banyak memberikan keterangan. Diatas 200 nm, eksitasi elektron dari orbital-orbital p, d, dan orbital π terutama sistem terkonjugasi dapat diukur dan spektra yang diperoleh memberikan banyak keterangan. Dalam praktek, spektrofotometri ultraviolet digunakan terbatas pada sistem-sistem terkonjugasi (Sastrohamidjodjo, 2001).
2. Spektroskopi inframerah
Spektrofotometri inframerah biasanya digunakan untuk mengetahui gugus fungsional yang terdapat dalam sampel. Namun demikian, spektrofotometri ini tidak memberikan informasi mengenai struktur sebanyak yang diberikan spektroskopi Nuclear Magnetic Ressonance (spektroskopi NMR).
Semua ikatan kimia memiliki frekuensi khas yang membuat ikatan mengulur (stretch) atau menekuk (bend). Bila frekuensi energi elektromagnetik inframerah yang dilewatkan pada suatu molekul sama dengan frekuensi mengulur atau menekuknya ikatan maka energi tersebut akan diserap. Serapan inilah yang dapat direkam oleh detektor pada spektrofotometri inframerah (Bresnick, 2004).
3. Spektroskopi resonansi magnetik inti (1H-NMR)
15
batang magnet kecil. Bila sejumlah proton ditempatkan dalam medan magnet, beberapa proton akan terletak searah sedangkan yang lain terletak berlawanan arah terhadap medan magnet yang digunakan. Proton yang terletak searah dengan medan magnet dianggap lebih stabil, sehingga untuk membalik medan magnet proton kearah yang berlawanan dibutuhkan energi yang lebih besar. Apabila inti yang berputar ini dikenai radiasi elektromagnetik pada frekuensi yang tepat (frekuensi radio), proton yang berenergi spin lebih rendah dapat menyerap energi dan akan berpindah ke keadaan spin yang memiliki energi lebih tinggi (Bresnick, 2004).
Spektroskopi 1H-NMR memberi informasi struktural mengenai atom-atom hidrogen dalam suatu molekul organik. Pada spektra 1H-NMR, posisi serapan oleh sebuah proton bergantung pada kuat bersih medan magnet yang mengitarinya. Proton dikatakan terperisai bila medan imbasan disekitarnya relatif kuat dan absorpsinya terletak di atas medan megnet. Sedangkan proton dikatakan tidak terperisai bila medan imbasan disekitarnya lemah dan absorpsinya berada di bawah medan. Adanya atom elektronegatif menyebabkan berkurangnya rapatan elektron disekitar proton akibat efek induksi. Proton ini tidak terperisai dan menyerap di bawah medan.
Proton yang berada dalam lingkungan magnetik dari suatu molekul, mempunyai geseran kimia yang sama dalam spektra 1H-NMR dan disebut proton ekuivalen. Proton yang berada dalam lingkungan magnetik berbeda akan mempunyai geseran kimia yang berlainan dan dikatakan proton tak ekuivalen.
16
diperoleh luas yang proporsional dengan banyaknya proton yang menimbulkan puncak-puncak tersebut. Sebagian besar spektrometri 1H-NMR dilengkapi dengan integrator yang akan menunjukkan luas relatif area di bawah puncak dalam spektranya. Integrasi muncul sebagai deretan anak tangga yang digambarkan bertumpuk dalam spektra 1H-NMR. Tinggi anak tangga tiap puncak berbanding lurus dengan luas area di bawah puncaknya.
Bila suatu spektra memiliki daya pisah tinggi, maka pita absorpsi akan terpisah (resolved atau split) menjadi sekelompok puncak. Pemisahan semacam ini disebut pemisahan spin-spin (spin-spin splitting) dan disebabkan oleh adanya proton tetangga (proton pada atom karbon didekatnya) tak ekuivalen. Proton yang puncaknya memisah dikatakan telah mengalami kopling spin-spin. Pemisahan puncak berasal dari spin (paralel dan antiparalel) proton tetangganya. Banyaknya puncak yang terpisah secara spin-spin dari suatu proton tertentu atau sekelompok proton tak ekuivalen dapat diramalkan dengan mencacah proton-proton tetangga (n) tak ekuivalen dengan proton yang sedang dibahas dan menambah 1 pada n itu. Aturan ini disebut aturan n + 1. Sebuah proton yang tidak memiliki proton tetangga tak ekuivalen akan menunjukkan puncak tunggal yang disebut singlet. Jika sebuah proton memiliki satu proton tetangga tak ekuivalen akan memberikan suatu isyarat terbelah menjadi satu puncak rangkap yang disebut doublet. Demikian seterusnya untuk proton yang memiliki dua atau tiga buah proton tetangga tak ekuivalen akan menunjukkan puncak yang disebut triplet dan kuartet (Fessenden and Fessenden, 1986b).
17
4. Spektrometri massa (GC-MS)
Metode kromatografi gas dan spektrometri massa memberikan keuntungan saat keduanya digunakan secara bersamaan. Proses pemisahan dilakukan oleh kromatografi gas, sedangkan proses fragmentasi dilakukan oleh spektrometri massa. Keuntungan dari kromatografi gas-spektrometri massa antara lain metode ini dapat digunakan untuk hampir semua jenis analit, memiliki batas deteksi yang rendah, dan memberi informasi penting tentang spektra massa dari suatu senyawa organik (Dean, 1995).
Dalam spektrometri massa, molekul-molekul organik ditembak dengan elektron berenergi tinggi. Penembakan elektron pada suatu molekul menyebabkan pelepasan elektronnya dan terbentuknya ion molekuler.
e + M 70 eV M + 2e
18
Aturan-aturan yang berhubungan dengan proses fragmentasi adalah sebagai berikut:
1. Pemutusan ikatan σ dekat gugus alkana
Ini dapat terjadi dengan anggapan bahwa terdapat tenaga eksitasi cukup yang terkonsentrasi pada pemutusan ikatan hingga terionisasikan.
2. Pemutusan ikatan σ dekat gugus fungsional
Hal ini dapat terjadi disebabkan lebih mudah terionisasinya gugus-gugus orbital tersebut, seperti dalam alkohol, dimana orbital tak berikatan (elektron-elektron bebas) oksigen lebih mudah terionisasi daripada orbital-orbital σ.
3. Aturan elektron genap
Aturan ini menyatakan bahwa spesies-spesies elektron genap biasanya tidak akan pecah menjadi dua spesies yang mengandung elektron ganjil yang tidak akan pecah menjadi radikal dan ion radikal karena tenaga total dari campuran ini akan sangat tinggi. Spesies-spesies ini lebih suka untuk pecah menjadi ion lain dan molekul netral. Ion radikal, yaitu spesies elektron ganjil dapat melepaskan molekul netral dan ion radikal sebagai hasil ikatannnya. Ion radikal juga dapat pecah menjadi radikal dan ion.
4. Hukum nitrogen
19
5. Efek suatu heteroatom atau gugus karbonil
Ikatan-ikatan C–C dekat dengan heteroatom sering dipecah meninggalkan muatan pada fragmen yang mengandung heteroatom yang mempunyai elektron-elektron tak berikatan untuk membentuk stabilisasi resonansi. Tipe fragmentasi semacam ini disebut pembelahan α (α – fission) (Sastrohamidjojo,2001).
6. Efek percabangan
Percabangan dalam suatu rantai hydrogen menghasilkan fragmentasi yang terjadi terutama pada cabang, karena radikal ion sekunder dan karbokation sekunder lebih stabil daripada padanan primernya. Stabilitas karbokation adalah faktor yang lebih penting daripada radikal bebas. Sebagai contoh, ion molekul metal propan menghasilkan terutama suatu kation isopropil dan radikal metal, dan bukan kebalikannya.
7. Hilangnya sebuah molekul kecil
Molekul-molekul kecil yang lebih stabil seperti H2O, CO2,dan C2H4
dapat terlepas dari dalam sebuah ion molekul. Misalnya, sebuah alkohol mudah kehilangan H2O dan menunjukkan suatu peak yang 18 satuan massa
lebih kecil daripada peak ion molekul tersebut. Peak ini dirujuk sebagai peak M – 18. Dalam banyak alkohol, eliminasi H2O sedemikian mudah sehingga
peak ion molekul itu bahkan tidak dijumpai dalam spektrum. 8. Penataan-ulang McLafferty
20
Dalam penataan-ulang ini akan terlepas suatu alkena dari dalam ion molekul tersebut (Fessenden dan Fessenden 1986 b).
I. Landasan Teori
Reaksi Knoevenagel adalah reaksi antara suatu aldehida dengan suatu senyawa yang mempunyai hidrogen α terhadap dua gugus karbonil menggunakan suatu basa amina sebagai katalis. Oleh karena itu, sintesis asam sinamat ini dapat dilakukan dengan mereaksikan benzaldehid yang memiliki gugus aldehid dan asam malonat yang memiliki hidrogen α terhadap dua gugus karbonil menggunakan etilendiamin sebagai katalis.
O
benzaldehid asam malonat asam sinamat H
Gambar 11. Reaksi umum pembentukan asam sinamat
21
maka jumlah rendemen asam sinamat yang dihasilkan lebih banyak dibandingkan dengan katalis amonia.
J. Hipotesis
Asam sinamat dapat disintesis dari benzaldehid dan asam malonat dengan katalis etilendiamin dan menghasilkan rendemen yang lebih banyak dibandingkan dengan katalis amonia.
22 BAB III
METODE PENELITIAN
A. Jenis dan rancangan penelitian
Penelitian ini merupakan suatu penelitian non eksperimental karena tidak ada manipulasi terhadap subjek uji.
B. Parameter penelitian dan Definisi Operasional
1. Starting material (SM) adalah bahan awal yang digunakan untuk menghasilkan produk. Bahan awal yang digunakan pada penelitain ini adalah asam malonat dan benzaldehid.
2. Molekul target (MT) adalah senyawa yang diharapkan dapat terbentuk dari bahan awal. Senyawa yang diharapkan terbentuk dalam penelitain ini adalah asam sinamat.
3. Katalis adalah suatu senyawa yang digunakan dalam reaksi untuk meningkatkan laju reaksi kimia. Katalis yang digunakan dalam penelitian ini adalah etilendiamin.
4. Rendemen adalah jumlah molekul target yang terjadi dan dapat diperhitungkan dari jumlah starting material yang digunakan. Rendemen senyawa hasil sintesis yang diharapkan dalam penelitian ini adalah rendemen asam sinamat.
23
C. Bahan / materi penelitian
Asam malonat (p.a, E. Merck), piridin (p.a, E. Merck), benzaldehid (p.a, E. Merck), pelarut : aquadest (laboratorium Farmasi Universitas Sanata Dharma), asam klorida (p.a, E. Merck), etanol (p.a, E. Merck), n-heksan (teknis, Brataco Chemika), etil asetat (teknis, Brataco Chemika), kloroform (p.a, E. Merck), asam asetat glasial (teknis, Asia Lab), aseton (teknis, Asia Lab), besi (III) klorida (teknis, Brataco Chemika), petroleum eter (p.a, E. Merck), eter (teknis, Brataco Chemika), dimetil sulfoksida (p.a, E. Merck), kertas saring, es batu.
D. Alat
Pendingin alihn (Vuline), kompor listrik (Herdolph MR 2002), beaker glass (Duran schott mainz), klem, erlenmeyer bertutup (Duran schott mainz),
stirrer magnetik, selang air, baskom, termometer, corong buchner, tabung
buchner, pompa vakum (Robinair High Vacuum Pump model no. 15100), corong kaca, cawan petri, oven (Memmert oven model 400), flakon, gelas pengaduk, timbangan elektrik (Mextler PM 100), lampu UV254 nm, kaca arloji, gelas ukur
24
E. Tata cara penelitian 1. Sintesis Asam Sinamat
Asam malonat 30 mmol (3,138 g) dilarutkan dalam etilendiamin 90 mmol (3 ml) dengan cara dipanaskan di atas penangas air, kemudian ke dalam campuran tadi dimasukkan benzaldehid 30 mmol (3,032 ml) dan dipanaskan pada suhu 800C dilanjutkan dengan pengadukan selama 2,5 jam. Asam klorida 2N 50 ml ditambahkan ke dalam larutan, didinginkan dan diaduk sampai terbentuk endapan. Endapan disaring dengan corong Buchner dan dicuci dengan larutan HCl 2N, air dan petroleum eter. Endapan yang diperoleh selanjutnya dimurnikan dengan rekristalisasi menggunakan akuades panas.
2. Rekristalisasi Senyawa Hasil Sintesis
Kristal hasil sintesis dilarutkan dalam air panas, kemudian disaring dan filtrat ditampung dalam labu alas bulat. Filtrat tersebut kemudian didinginkan dalam ice bath hingga terbentuk kristal. Kemudian air disaring dan kristal dikeringkan dalam oven hingga kering. Setelah kering, timbang dan hitung rendemen yang dihasilkan.
3. Uji Pendahuluan
a. Uji organoleptis. Dilakukan dengan cara mengamati warna, bentuk, dan bau senyawa hasil sintesis. Kemudian hasil pengamatan dibandingkan dengan
starting material yang digunakan dalam penelitian yaitu asam malonat dan benzaldehid.
b. Uji kelarutan.Senyawa hasil sintesis 50 mg dimasukkan ke dalam
25
kelarutannya. Prosedur yang sama dilakukan dengan pelarut lain yaitu etanol, akuades panas, petroleum eter, dan kloroform. Kemudian bandingkan dengan asam sinamat standart.
c. Titik Lebur. Kristal senyawa hasil sintesis diisikan kedalam
electrothermal capillary tubes, kemudian dimasukkan ke dalam alat pengukur titik lebur (Thermophan). Amati peleburan kristalnya dan catat suhu waktu pertama kali melebur hingga semua kristal melebur dengan kenaikan suhu 0,2° C per menitnya.
d. Kromatografi gas. Pemisahan dan pemeriksaan kemurnian senyawa hasil sintesis dilakukan menggunakan instrumen kromatografi gas dengan kondisi alat:
- suhu injektor : 300°C - jenis kolom : Rtx-5MS - panjang kolom : 30 meter
- suhu kolom diprogram : 100-300°C - gas pembawa : helium
- tekanan : 22 kPa
- kecepatan alir fase gerak : 0,5 ml/menit - detektor ionisasi nyala.
26
kedalam kolom Rtx-5MS yang dilapisi fase cair dimethylpolysiloxane. Selanjutnya cuplikan diukur oleh detektor hingga diperoleh suatu kromatogram. 4. Elusidasi struktur senyawa hasil sintesis
a. Spektrofotometri ultraviolet.Larutkan senyawa hasil sintesis dalam
etanol sehingga kadarnya 0,1 mg/100ml. Larutan tersebut diukur serapannya pada panjang gelombang 200-450 nm. Panjang gelombang maksimum senyawa hasil sintesis ditentukan berdasarkan serapan maksimum dari hasil scanning panjang gelombang serapan larutan.
b. Spektroskopi infra merah. Sebanyak kurang lebih 0,5-1 mg senyawa hasil sintesis dicampur homogen dengan kurang lebih 10 mg KBr, kemudian dikempa dan dibuat tablet. Cahaya inframerah dari sumber dilewatkan melalui cuplikan, kemudian dipecah menjadi frekuensi-frekuensi individu dalam monokromator. Intensitas relatif dari frekuensi individu diukur oleh detektor hingga didapat spektra infra merah dari senyawa hasil sintesis.
c. Spektroskopi resonansi magnetik inti (1H-NMR). Sampel sebanyak 10-50 mg dimasukkan dalam tabung dan tambahkan pelarut CDCl3 serta 1-2 tetes
tetrametilsilan (TMS) sebagai standar internal. Sel sampel berupa tabung gelas kecil silindris diletakkan diantara kutub-kutub magnet. Sel sampel dipusingkan maka akan didapat sinar resonansi proton dari spektrometer H-NMR. Kekuatan H-NMR yang digunakan adalah 60 MHz.
d. Spektrometri massa. Uap cuplikan senyawa hasil sintesis yang
27
terfragmentasi. Jenis pengionan yang digunakan adalah EI (Electron Impact) 70 eV. Fragmen-fragmen akan melewati lempeng pemercepat ion dan didorong menuju tabung analisator, dimana partikel-partikel akan dibelokkan dalam medan magnet dan menimbulkan arus pada kolektor yang sebanding dengan kelimpahan relatif setiap fragmennya. Kelimpahan relatif setiap fragmen akan dicatat dan menghasilkan data spektra massa.
F. Tata cara analisis hasil 1. Perhitungan rendemen
Rendemen 100%
2. Analisis Pendahuluan a. Data organoleptis b. Data kelarutan c. Data titik lebur d. Data kromatografi gas
3. Elusidasi struktur:
a. Data panjang gelombang serapan maksimum b. Spektra inframerah (IR)
c. Spektra resonansi magnet inti (1H-NMR) d. Spektra Massa (MS)
28 BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis Asam Sinamat
Sintesis asam sinamat dilakukan dengan cara mereaksikan benzaldehid dan asam malonat menggunakan katalis etilendiamin berdasarkan prinsip reaksi knoevenagel. Penggunaan etilendiamin sebagai katalis karena merupakan amina primer dan mempunyai sifat basa kuat. Tahap awal dari sintesis ini yaitu pembentukan garam malonat dari reaksi antara asam malonat dan etilendiamin dengan perbandingan mol 1:3, karena untuk membentuk ion enolat dari 1 molekul asam malonat diperlukan 3 molekul etilendiamin. Reaksi pembentukan garam malonat dapat dilihat pada gambar 12.
H3N
Gambar 12. Reaksi pembentukan garam malonat
Dengan terbentuknya garam malonat, jika ada satu mol basa maka akan terbentuk enolat dari garam malonat hasil reaksi dengan etilendiamin. Hal ini disebabkan atom H alfa pada garam malonat semakin mudah dilepas bila dibantu dengan katalis etilendiamin. Reaksi pembentukan ion enolat dapat dilihat pada gambar 13.
29
Gambar 13. Reaksi pembentukan ion enolat
Proses selanjutnya yaitu mereaksikan benzaldehid yang berfungsi sebagai elektrofil dengan ion enolat dari asam malonat yang berfungsi sebagai nukleofil. Hasil reaksi ini akan membentuk suatu senyawa yang mudah mengalami dehidrasi dan dekarboksilasi. Reaksi yang terjadi sebagai berikut:
Gambar 14. Reaksi adisi ion enolat pada karbon karbonil
Proses dehidrasi dan dekarboksilasi ini terjadi ketika HCl ditambahkan sambil dipanaskan yang ditandai dengan terbentuknya gelembung gas (CO2) pada
30
sudah tidak terbentuk lagi setelah pengadukan selama 2,5 jam. Reaksinya dapat dilihat pada gambar 15.
Gambar 15. Reaksi dehidrasi dan dekarboksilasi
Pengendapan dilakukan dengan mendinginkan larutan dalam ice bath. Hal ini dilakukan karena asam sinamat adalah senyawa yang sukar larut dalam air dingin dan larut dalam air panas. Endapan yang telah terbentuk disaring menggunakan corong buchner dan dicuci dengan asam klorida, air dan petroleum eter. Pencucian dengan asam klorida dimaksudkan untuk membentuk garam dari sisa katalis etilendiamin yang larut air. Reaksinya dapat ditunjukkan pada gambar 16.
31
Gambar 16. Reaksi etilendiamin dengan asam klorida
Petroleum eter digunakan untuk menghilangkan sisa benzaldehid. Endapan yang diperoleh dilanjutkan dengan proses rekristalisasi.
B. Rekristalisasi Senyawa Hasil Sintesis
Untuk mendapatkan senyawa yang murni dilakukan rekristalisasi hasil sintesis. Serbuk yang didapatkan dari hasil sintesis dilarutkan seluruhnya dalam air panas sebab asam sinamat sukar larut dalam air dingin dan lebih mudah larut dalam air panas sehingga jika larutan didinginkan, diharapkan senyawa tersebut mengkristal kembali.
Sisa serbuk yang tidak larut dalam air panas disaring menggunakan kertas saring untuk memisahkan dari senyawa yang diinginkan. Penyaringan dilakukan saat larutan masih dalam keadaan panas karena jika larutan sudah dingin, maka senyawa yang diinginkan akan mengendap kembali. Dari hasil rekristalisasi didapatkan rendemen sebesar 52,3%. Kristal yang diperoleh dilanjutkan dengan uji pendahuluan untuk menentukan kemurnian senyawa hasil sintesis.
C. Uji Pendahuluan 1. Uji organoleptis
Uji organoleptis dilakukan untuk membandingkan senyawa hasil sintesis dengan starting material. Uji ini meliputi warna, bentuk dan bau.
32
Tabel III. Hasil Uji Organoleptis senyawa hasil sintesis dibandingkan dengan starting material dan asam sinamat standar
Pengamatan Senyawa hasil sintesis
Benzaldehid Asam malonat
Asam sinamat (Anonim,2001)
Bentuk Kristal Cair Serbuk Kristal Warna Putih Kuning Putih -
Bau Khas Khas Khas -
Gambar 17. Senyawa hasil sintesis
Dari hasil pengamatan dapat dilihat bahwa senyawa hasil sintesis memiliki ciri-ciri yang berbeda dengan starting material. Sehingga dapat disimpulkan bahwa senyawa hasil sintesis merupakan senyawa baru dan memiliki bentuk yang sesuai dengan asam sinamat standart.
2. Uji kelarutan senyawa hasil sintesis
Uji kelarutan dilakukan untuk mengetahui kelarutan senyawa hasil sintesis dalam pelarut polar maupun nonpolar. Batasan larut menurut Farmakope Indonesia IV adalah 10 sampai 30 bagian pelarut dapat melarutkan 1 bagian zat, sedangkan batasan sangat sukar larut adalah 1000 sampai 10000 bagian pelarut dapat melarutkan 1 bagian zat. Kelarutan senyawa hasil sintesis dibandingkan dengan kelarutan asam sinamat standar ditunjukkan pada tabel IV.
33
Tabel IV. Hasil uji kelarutan senyawa hasil sintesis dibandingkan dengan literatur
Pelarut Aquadest Sangat sukar larut Sangat sukar larut Aquadest panas Larut Larut
Etanol Larut Mudah larut
Metanol Larut Mudah larut
Kloroform Larut Larut
Aseton Larut
-Dimetil sulfoksida Larut
-Dari data hasil uji kelarutan senyawa hasil sintesis dibandingkan dengan data kelarutan asam sinamat standar terdapat kesamaan kelarutan beberapa pelarut. Hal ini memperkuat dugaan sementara bahwa senyawa hasil sintesis merupakan asam sinamat. Hasil uji kelarutan ini akan digunakan sebagai acuan dalam pemilihan pelarut untuk elusidasi struktur senyawa hasil sintesis menggunakan 1H-NMR dan GC-MS.
3. Uji titik lebur
Uji titik lebur digunakan untuk mengetahui informasi mengenai identifikasi dan kemurnian dari suatu senyawa hasil sintesis dengan menggunakan alat uji titik lebur. Berdasarkan pemeriksaan diketahui bahwa senyawa hasil sintesis mempunyai jarak lebur antara 130-1310C. Hasil ini menunjukkan bahwa senyawa hasil sintesis telah murni karena jarak lebur tidak lebih dari 20C, sebab jika lebih dari 20C dapat diperkirakan adanya senyawa lain yang mempengaruhi jarak lebur. Hal ini karena adanya senyawa sisa reaksi menyebabkan panas yang digunakan untuk melebur senyawa tersebut tidak sama sehingga dapat diperkirakan bahwa jarak leburnya akan lebih dari 20C.
34
Untuk uji kualitatif, titik lebur senyawa hasil sintesis dibandingkan dengan titik lebur asam sinamat. Berdasarkan literatur diketahui bahwa asam sinamat memiliki titik lebur 1330C dan titik lebur asam malonat 1350C (Anonim, 2001). Dari nilai ini terjadi perbedaan jarak lebur antara senyawa hasil sintesis dengan asam sinamat standar namun masih dalam rentang jarak lebur yang diperbolehkan yaitu ±2 dan berbeda dari titik lebur asam malonat. Dari nilai titik lebur ini dapat memperkuat dugaan sementara bahwa senyawa hasil sintesis adalah asam sinamat.
4. Uji kemurnian dengan kromatografi gas
Pengujian senyawa hasil sintesis dengan GC dilakukan dilaboratorium MIPA Universitas Gadjah Mada. Dari uji tersebut diperoleh data kromatogram GC yang diperlihatkan pada gambar 17.
Gambar 18. Kromatogram senyawa hasil sintesis
35
menunjukkan bahwa senyawa hasil sintesis merupakan senyawa murni. Data ini lebih menegaskan lagi data titik lebur yang diperoleh sebelumnya.
D. Elusidasi Struktur Senyawa Hasil Sintesis 1. Interpretasi spektra ultraviolet
Elusidasi struktur menggunakan spektrofotometri ultraviolet dilakukan dengan mengukur panjang gelombang serapan maksimum senyawa hasil sintesis dalam pelarut etanol. Hal ini bertujuan untuk membandingkan panjang gelombang serapan maksimum senyawa hasil sintesis dengan panjang gelombang serapan maksimum asam sinamat standart.
O
OH
= Auksokrom = Kromofor
Gambar 19. Gugus kromofor dan auksokrom pada asam sinamat
36
serapan meningkat) karena terjadi perpanjangan gugus kromofor. Gugus hidroksi bertindak sebagai gugus auksokrom, dimana gugus ini dapat mempengaruhi intensitas serapan senyawa yang diukur.
Gambar 20. Spektra ultraviolet senyawa hasil sintesis
Dari gambar 20, dapat diketahui bahwa senyawa hasil sintesis memiliki panjang gelombang serapan maksimum sebesar 274 nm. Hasil yang diperoleh tersebut berbeda dengan literatur yang menyatakan bahwa panjang gelombang serapan maksimum asam sinamat standar dalam pelarut etanol sebesar 273 nm (Anonim, 2001) namun masih dalam batas yang diperbolehkan yaitu ± 2 sehingga dapat disimpulkan bahwa panjang gelombang serapan maksimum senyawa hasil sintesis masih berada dalam rentang panjang gelombang serapan maksimum asam sinamat standar.
37
2. Interpretasi spektra inframerah
Spektroskopi inframerah dilakukan untuk mengetahui keberadaan gugus-gugus fungsional pada senyawa hasil sintesis. Dengan diketahuinya gugus-gugus fungsional tersebut akan dapat membantu dalam penentuan struktur senyawa hasil sintesis.
Gambar 21. Spektra IR senyawa hasil sintesis
38
Berdasarkan ketiga pita diatas yaitu pita B, E, dan G menunjukkan adanya cincin aromatis.
Pita D pada bilangan gelombang 1627,92 menunjukkan adanya gugus C=C terkonjugasi dengan cincin aromatik dan gugus karbonil. Pada bilangan gelombang 1689,64 cm-1 (pita C) tampak pita vibrasi ulur berintensitas kuat yang menunjukkan adanya gugus C=O karbonil yang khas untuk gugus karboksilat terkonjugasi dengan gugus α,β-tak jenuh. Pita A dengan bilangan gelombang 3425,56 cm-1 menunjukkan adanya gugus O-H ulur dari monomer asam karboksilat. Adanya gugus karboksilat, didukung pula oleh munculnya pita F pada 1288,45 cm-1. Pita dengan intensitas sedang ini menunjukkan adanya vibrasi tekuk gugus C-O-H asam karboksilat.
Tabel V. Perbandingan pita vibrasi gugus senyawa hasil sintesis dengan literatur
Pita Gugus Fungsional Intensitas
Bilangan gelombang (cm-1) (Silverstein,
1991)
Senyawa hasil sintesis
A O-H monomer asam
karboksilat Lemah Dekat 3520 3425,29
B C-H ulur terhibridisasi sp2 Lemah 3000-3100 3008
C C=O ulur asam karboksilat (terkonjugasi dengan gugus α, tak jenuh)
Kuat 1710-1680 1689,64
D C=C ulur alkena (terkonjugasi dengan cincin aromatik dan gugus karbonil)
Sedang Dekat 1625 1627,92
E C=C ulur aromatic
Sedang 1400-1500 dan 1585-1600
1419,61 1450,47 1496,76
F C-O-H tekuk dimer asam
karboksilat Sedang 1280-1315 1288,45
G Pendukung cincin
aromatik Sedang-tajam 675-900
39
Untuk memastikan adanya perbedaan gugus-gugus fungsional senyawa hasil sintesis dengan starting material yang digunakan, maka dilakukan perbandingan spektra inframerah antara senyawa hasil sintesis dengan benzaldehid dan asam malonat yang ditunjukkan pada gambar 21 dan 22.
Gambar 22. Spektra inframerah benzaldehid
Tabel VI. Perbandingan pita vibrasi gugus benzaldehid dengan literatur
Ket Gugus Fungsional Intensitas Bilangan gelombang (cm
-1
) (Silverstein,
1991) Benzaldehid A C-H ulur sp2 aromatik Sedang-tajam 3000-3100 3008,95
B C-H ulur sp2 alifatik
Sedang 2830-2695 2839,22; 2677,20
C C=O ulur aldehid Kuat-tajam 1710-1685 1689,64
D C=C ulur aromatik
Sedang 1400-1500 dan
1585-1600 1427,32
E Pendukung adanya cincin aromatik
40
Gambar 23. Spektra inframerah asam malonat
Tabel VII. Perbandingan pita vibrasi gugus asam malonat dengan literatur
Ket Gugus Fungsional Intensitas Bilangan gelombang (cm
-1
) (Silverstein,
1991) Asam malonat A C-H ulur sp2 alifatik
Kuat-melebar 3000-2840 2947,23 dan 2993,52 B O-H ulur dimer asam
karboksilat sedang-melebar 2500-3300
2600,04-2993,52
C C=O ulur asam karboksilat Kuat 1725-1700 1720,50
D C-O-H tekuk dimer asam
karboksilat Sedang 1280-1315 1311,59
Berdasarkan spektra inframerah perbedaan yang signifikan dengan senyawa hasil sintesis yaitu tidak terdapat pita vibrasi ulur pada bilangan gelombang 1627,92 cm-1 yang menunjukkan adanya gugus C=C alkena pada asam malonat dan benzaldehid. Dengan demikian dapat diketahui perbedan gugus-gugus fungsional yang terdapat pada senyawa hasil sintesis dengan asam malonat dan benzaldehida seperti yang ditunjukkan pada tabel VIII.
41
Tabel VIII. Interpretasi spektra inframerah senyawa hasil sintesis dengan asam malonat dan benzaldehid
Gugus fungsional Senyawa hasil
sintesis Asam malonat Benzaldehid
C-H aromatik + - +
C-H alifatik - + -
C=C aromatik + - +
C=C alkena + - -
C=O + + -
O-H karboksilat + + -
C-O-H karboksilat + + -
Keterangan : (+) = ada, ( - ) = tidak ada
Dari data hasil interpretasi spektra inframerah, mendukung bahwa senyawa hasil sintesis mempunyai gugus-gugus fungsional yang diharapkan. Namun untuk lebih meyakinkan lagi bahwa senyawa hasil sintesis merupakan asam sinamat, perlu didukung data dari 1H-NMR dan MS.
3. Interpretasi spektra 1H-NMR
42
Gambar 24. Spektra 1H-NMR senyawa hasil sintesis
Tabel IX. Analisis spektra 1H-NMR senyawa hasil sintesis
Jenis proton Determinasi δ H (dalam pelarut CDCl3)
Proton pada gugus karboksil (Ha)
O O
H 11,5 ppm (1H, singlet)
Proton pada ikatan C=C (Hb) cincin aromatik (Hc)
H
Proton pada ikatan C=C
H
α β
43
Dari gambar 24, dapat dilihat bahwa senyawa hasil sintesis memiliki 4 sinyal yang menunjukkan tipe-tipe proton yang terdapat pada struktur senyawa hasil sintesis, yaitu sinyal A, B, C dan D.
Sinyal A pada δ 11,5 ppm merupakan sinyal singlet yang menunjukkan resonansi proton yang terikat pada suatu gugus karboksil. Sinyal ini muncul sebagai sinyal singlet karena tidak mempunyai proton tetangga. Proton tersebut sangat tidak terlindungi karena adanya efek elektronegativitas dari oksigen yang terikat padanya sehingga menyebabkan pergeseran sinyal jauh di bawah medan. Pergeseran kimia ini sesuai dengan yang tertera pada literatur bahwa proton karboksilat berada pada 10-12 ppm (Fessenden, 1986b).
Sinyal B yang berada pada δ 8,2 ppm menunjukkan proton yang terikat pada C=C ena. Proton ini terletak dibawah medan karena dipengaruhi medan magnet imbasan dari cincin aromatik sehingga menyebabkan proton menjadi tidak terperisai. Pemecahan sinyal (splitting) pada proton ikatan C=C ena kurang baik karena sinyal yang seharusnya doublet muncul sebagai sinyal singlet. Hal ini disebabkan frekuensi alat yang digunakan hanya sebesar 60 MHz sehingga pemecahan sinyal menjadi tidak sempurna.
Sinyal C pada δ 7,8 ppm menunjukkan tipe proton-proton yang terletak pada cincin aromatik yang muncul sebagai peaksinglet. Proton-proton dari cincin aromatik menyerap di bawah medan karena adanya efek anisotropik. Efek anisotropik disebabkan oleh perputaran elektron-elektron π dalam cincin benzena yang terinduksi oleh medan magnet luar (H0) yang diberikan. Perputaran
44
membantu memperbesar medan magnet luar (H0). Proton-proton pada cincin
tersebut menjadi tidak terperisai sehingga menyerap dibawah medan.
Sinyal D merupakan proton yang berada pada ikatan C=C ena dengan δ 6,2 ppm. Proton ini lebih terperisai jika dibandingkan dengan proton Hb yang berada di sebelah cincin benzen (δ 8,2 ppm). Hal ini dikarenakan pengaruh efek anisotropik cincin aromatik terhadap proton Hd lebih kecil dibandingkan proton Hb.
Dalam spektra 1H-NMR luas area dibawah kurva menunjukkan kelimpahan proton-proton dalam suatu struktur senyawa. Dari spektra yang diperoleh tampak bahwa nilai AUC masing-masing peak adalah sebagai berikut 845,9; 755,6; 4752,3; 1007,4 sehingga perbandingan perbandingan luasnya yaitu 1:1:5:1. Pada sinyal A, B, dan D terdapat 1 proton sedangkan pada sinyal C terdapat 5 proton. Perbandingan kelimpahan proton senyawa hasil síntesis ini sesuai dengan kelimpahan proton asam sinamat sebagai molekul target, sehingga data spektra 1H-NMR tersebut mendukung kesimpulan bahwa senyawa hasil sintesis merupakan asam sinamat. Namun untuk lebih memastikan lagi bahwa senyawa hsil sintesis merupakan asam sinamat diperlukan lagi data dari spektra massa.
4. Interpretasi spektra massa
45
untuk penyelidikan kerangka molekul senyawa hasil sintesis melalui interpretasi fragmen-fragmennya.
Gambar 25. Spektra massa senyawa hasil sintesis Keterangan:
A = Peak dengan m/z = 148 menunjukkan ion molekuler [C9H8O2]+ B = Peak dengan m/z = 147 menunjukkan fragmen [C9H7O2]+ C = Peak dengan m/z = 131 menunjukkan fragmen [C9H7O1]+ D = Peak dengan m/z = 103 menunjukkan fragmen [C8H7]+ E = Peak dengan m/z = 77 menunjukkan fragmen [C6H5]+
Dalam spektrometer massa, penembakan molekul senyawa hasil sintesis dengan elektron berenergi tinggi (Electron Impact 70 ev) akan menghasilkan ion molekul (ion radikal positif). Peak A merupakan ion molekul dari senyawa hasil sintesis muncul pada m/z = 148. Hal ini mendukung bahwa senyawa hasil sintesis adalah asam sinamat karena berat molekul senyawa ini adalah 148 dengan rumus kimia C9H8O2.
Peak ion molekuler ini tidak stabil dan nantinya akan pecah menjadi fragmen-fragmen dengan m/z lebih kecil, baik berupa radikal bebas, fragmen netral, maupun ion-ion. Peak B dengan m/z = 147 merupakan fragmen dari ion molekul setelah mengalami pemutusan secara homolitik untuk membentuk ion baru dan radikal hidrogen. Peak ini disebut sebagai peak dasar karena memiliki intensitas paling besar, yaitu 100%.
46
Gambar 26. Fragmentasi senyawa hasil sintesis
Peak C dengan m/z = 131 merupakan fragmen [C9H7O1]+ yang
mengalami pelepasan radikal OH dan merupakan radikal bebas yang tidak terdeteksi oleh spektrometri massa. Kation [C9H7O1]+ ini akan terfragmentasi lagi
menghasilkan fragmen [C8H7]+ dengan m/z = 103 (peak D) dengan melepaskan
CO dan selanjutnya akan melepaskan C2H2 untuk membentuk kation fenil dengan
47
m/z = 77 yang ditunjukkan oleh peak E. Ion C6H5+ yang terbentuk akan
mengalami fragmentasi kembali menjadi ion C4H3+ dengan melepaskan molekul
C2H2. Ion C4H3+ ini akan muncul sebagai puncak F dengan m/z = 51.
Dari data hasil interpretasi spektra inframerah, spektra 1H-NMR, dan spektra massa maka dapat disimpulkan bahwa senyawa hasil sintesis adalah asam sinamat.
48 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan serangkaian uji yang dilakukan terhadap senyawa hasil sintesis maka dapat disimpulkan bahwa asam sinamat dapat disintesis dari asam malonat dan benzaldehid dengan katalis etilendiamin dengan rendemen sebesar 50,4%.
B. Saran
Perlu dilakukan penelitian lebih lanjut mengenai optimasi kondisi sintesis dengan melihat lama sintesis dan suhu pemasanan agar diperoleh rendemen yang optimal.
49
DAFTAR PUSTAKA
Anonim, 1979, Farmakope Indonesia, Edisi III, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1995, Farmakope Indonesia, Edisi IV, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2001, Merck Index: An Encyclopedia of Chemicals, Drugs and Biological, 13th edition, 1060, 2320, 3135, 5735, Merck and Co., Inc., USA.
Anwar, C., Purwono, B., Pranowo, H.D., Wayuningsih, T.D., 1994, Pengantar Praktikum Kimia Organik, 335, 341-342. Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Gajah Mada, Yogyakarta.
Bradstatter, M.K., 1971, Thermomicroscopy’s Analysis of Pharmaceuticals, 1-10, Pergamon Press, London.
Bresnick, S.M.D, 1996, Intisari Kimia Organik, 96-97, 101-107 Penerbit Hipokrates, Jakarta.
Bruice, P.Y., 1998, Organic Chemistry, 2nd edition, 953, 955, 960, Prentice Hall, New Jersey.
Brown, W. and Poon, T., 2005, Introduction to Organic Chemistry, 3th edition, 419-421, Willey and Sons, Inc., USA.
Carey, F.A. and Sunberg, R.J., 1977, Advanced Organic Chemistry: Reaction and Synthesis, 42, 44, Plenum Publishing Corporation, New York.
Day, Jr., R.A. and Underwood, A.L., Analisis Kimia Kuantitatif, terj. Pudjaatmaka, A.H., Edisi IV, 519, Penerbit Erlangga, Jakarta.
Dean, J.A., 1995, Analytical Chemistry Handbook, 13, 26, McGraw-Hill, Inc., New York.
Ekowati, J dan Suzana, B.T., 2005, Pengaruh Posisi Gugus Metoksi para dan
meta Terhadap Hasil Sintesis Asam para-metoksisinamat dan Asam meta -metoksisinamat, Majalah Farmasi Airlangga Vol.5 No.3
Fessenden, R.J. and Fessenden, J., 1986a, Kimia Organik, terj. Pudjaatmaka, A.H., Edisi III, Jilid 1, 327-341, Penerbit Erlangga, Jakarta.