POTENSI KAPANG Aspergillus sp. DALAM PROSES HIDROLISIS UNTUK PRODUKSI ETANOL DARI
SAMPAH SAYUR DAN BUAH PASAR WONOKROMO SURABAYA
POTENCY OF Aspergillus sp. IN HYDROLYSIS PROCESS TO PRODUCE ETHANOL FROM VEGETABLE
AND FRUIT WASTES AT WONOKROMO MARKET, SURABAYA
Mutiara Arum Kusumaningati
1, Sri Nurhatika
1, dan Anton Muhibuddin
2 1Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut teknologi Sepuluh Nopember (ITS)
Jl. Arief Rahman Hakim, Surabaya 60111 Indonesia
e-mail: mutiara.arum@yahoo.com, nurhatika@bio.its.ac.id
2
Jurusan Hama dan Penyakit Tumbuhan. Fakultas Pertanian, Universitas Brawijaya (UB)
Jl. Veteran, Malang 65145 Indonesia
e-mail: antonmhb@gmail.com
ABSTRAK
Sampah sayur dan buah berpotensi untuk dijadikan sebagai bahan baku dalam produksi etanol yang terdiri dari
beberapa tahap, yaitu pretreatment, hidrolisis, fermentasi, dan destilasi. Proses hidrolisis yang biasa digunakan adalah
hidrolisis asam karena lebih mudah dilakukan, namun kelemahannya dihasilkan produk samping yang dapat
mengganggu dalam proses fermentasi. Sehingga alternatif terbaik dengan memanfaatkan kapang dalam proses
hidrolisis, salah satunya adalah kapang Aspergillus sp. Penelitian ini dilakukan pada bulan November 2012 sampai Mei
2013 di Laboratorium Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh
Nopember. Penelitian ini bertujuan untuk mengetahui potensi kapang Aspergillus sp. dalam proses hidrolisis untuk
produksi etanol dari sampah sayur dan buah Pasar Wonokromo Surabaya pada konsentrasi inokulum bakteri
Zymomonas mobilis dan lama waktu fermentasi yang optimum. Kapang Aspergillus sp. pada penelitian ini diperoleh
dari hasil eksplorasi kapang di Taman Nasional Alas Purwo yang berhasil diuji selulolitik, menghasilkan enzim selulase
yaitu endoglukanase, eksoglukanase dan β-glikosidase. Proses fermentasi dilakukan menggunakan bakteri Zymomonas
mobilis dalam beberapa perlakuan, yaitu konsentrasi inokulum (0, 5, 10 dan 15%) dan lama waktu fermentasi (0, 2, 4, 6,
dan 8 hari). Masing-masing perlakuan diulangi sebanyak 2 kali, sehingga diperoleh 40 unit percobaan dan dianalisis
menggunakan uji ANOVA. Parameter yang diamati adalah kadar etanol. Hasil yang diperoleh, kapang Aspergillus sp.
berpotensi menghasilkan enzim selulase dalam proses hidrolisis untuk produksi etanol dari sampah sayur dan buah
Pasar Wonokromo Surabaya. Kadar etanol optimum sebesar 9,5% (v/v) dihasilkan pada interaksi konsentrasi inokulum
10% dan lama waktu fermentasi 6 hari.
Kata kunci : Sampah sayur dan buah, Pasar Wonokromo Surabaya, Hidrolisis enzim, Etanol, Aspergillus sp.,
Zymomonas mobilis.
ABSTRACT
Vegetable and fruit wastes are potential to be used as a feedstock in ethanol production that consist of several steps,
including pretreatment, hydrolysis, fermentation, and destilation. Hydrolysis process that common used is acid
hydrolysis because it is easier, but it is produced end product that can inhibit fermentation process. So, the best
alternative is mold utilization in hydrolysis process, one of the potential mold is Aspergillus sp. This research was held
on November 2012 until May 2013 in laboratories of Biology Department, Mathematic and Science Faculty, Sepuluh
Nopember Institute of Technology. This research was aimed to determine Aspergillus sp. potency in hydrolysis process
to produce ethanol from vegetable and fruit wastes at Wonokromo Market Surabaya with various treatments of
optimum Zymomonas mobilis inoculum size and fermentation duration. Aspergillus sp. in this research was obtained
from mold exploration result of Alas Purwo National Park that were succesfully tested its cellulolytic ability and
resulting cellulases enzyme such as endoglucanase, exoglucanase, and β-glycosidase. Fermentation process was
conducted using Zymomonas mobilis bacteria in several treatments, inoculum size (0, 5, 10, and 15%) and fermentation
duration (0, 2, 4, 6, and 8 days). Each of treatment was done two repeatings, so there were 40 units of trial and
analyzed using ANOVA test. The observed parameter was ethanol concentration. The result showed that Aspergillus sp.
was a potential ability to produce cellulase enzyme in hydrolysis process to produce ethanol from vegetable and fruit
wastes at Wonokromo Market Surabaya. Optimum ethanol concentration 9,5% (v/v) was obtained from interaction
between 10% inoculum size and 6 days fermentation duration.
Key words: Vegetable and fruit wastes, Wonokromo Market Surabaya, Enzyme hydrolysis, Ethanol, Aspergillus sp.,
I.
PENDAHULUAN
Masalah global yang terjadi di Indonesia salah
satunya yaitu sampah. Kurangnya usaha pemanfaatan
sampah berdampak volume sampah bertambah setiap
harinya. Jumlah rata-rata sampah di Kota Surabaya per
harinya adalah 8.700m
3. Total sampah organik 55,6%
dan sampah anorganik 44,4%. Sampah organik ini
didominasi oleh sampah sayur dan buah. Salah satu
jumlah sampah organik terbesar 87% di Pasar
Wonokromo Surabaya (Winanti, 2006). Maka, perlu
dilakukan upaya dalam memanfaatkan sampah menjadi
sesuatu yang berharga yaitu bioetanol sebagai alternatif
mengatasi masalah bahan bakar minyak dan gas yang
semakin terbatas.
Bioetanol merupakan etanol yang berasal dari
sumber hayati. Menurut John (2004) dalam Riyanti
(2010), bioetanol dapat dijadikan sebagai bahan bakar
alternatif karena sifatnya yang ramah lingkungan,
mengandung emisi gas CO lebih rendah (19-25%)
(Hening et al., 2006), memiliki kandungan oksigen
yang tinggi (35%) sehingga terbakar lebih sempurna
(Handayani, 2008 dalam Kusnadi et al, 2009), bernilai
oktan lebih tinggi (117) (Lee et al, 2008) dan dapat
diproduksi terus menerus oleh mikroorganisme
(Sardjoko, 1991). Penggunaan bahan baku selulosa
sebagai bioetanol potensial karena melimpah dan
murah, tidak diperlukannya lahan yang luas serta tidak
menimbulkan kompetisi antara ketersediaan bahan
baku pangan dan sumber energi (Wiratmaja et al,
2011). Namun, prosesnya membutuhkan beberapa
tahapan, yaitu pretreament, hidrolisis, fermentasi, dan
destilasi.
Proses hidrolisis yang biasa digunakan adalah
hidrolisis asam karena lebih mudah dilakukan, namun
kelemahannya yaitu dihasilkan produk samping yang
dapat mengganggu dalam proses fermentasi (Subekti,
2006). Sehingga alternatif terbaik dalam proses
hidrolisis yaitu dengan menggunakan hidrolisis enzim,
dimana selulosa akan dikonversi menjadi glukosa oleh
enzim selulase. Hidrolisis dengan enzim komersial
membutuhkan biaya yang mahal, sehingga diperlukan
suatu metode yang tepat, efisien dan murah. Metode
tersebut yaitu memanfaatkan kapang yang dapat
menghasilkan enzim selulase dimana selama ini jarang
dilakukan.
Kapang Aspergillus sp. dengan kode (H5) hasil
eksplorasi kapang di Taman Nasional Alas Purwo telah
berhasil diuji selulolitik yang mampu mendegradasi
selulosa dengan memproduksi enzim lignoselulolitik
seperti enzim selulase. Enzim selulase merupakan
enzim kompleks yang terdiri dari endoglukanase,
eksoglukanase,
dan
β-glikosidase. Enzim
endoglukanase memecah selulosa amorf menjadi
selulosa rantai pendek kemudian dilanjutkan enzim
eksoglukanase memecah selulosa rantai pendek
menjadi selobiosa, dan terakhir akan dipecah selobiosa
menjadi glukosa oleh enzim β-glikosidase (Pikukuh,
2012). Kemudian glukosa dikonversi menjadi etanol
dalam proses fermentasi dengan menggunakan bakteri
Zymomonas mobilis. Adapun dasar penggunaan bakteri
fermentatif ini karena memiliki kelebihan, diantaranya
tahan terhadap etanol konsentrasi tinggi (15%) (Busche
et al., 1992), lebih toleran terhadap suhu dan pH
rendah (3,5-7,5) (Nowak, 2000), serta dapat
menghasilkan etanol lebih cepat. Penggunaan jalur
Entner-Doudoroff (ED) inilah yang membuatnya lebih
cepat menghasilkan etanol dibandingkan dengan
mikroorganisme yang menggunakan jalur
Embden-Meyerhoff-Parnas (EMP). Hal ini disebabkan pada
jalur ED, dihasilkan 1 ATP dari 1 molekul glukosa
(Chrisnawati et al, 2009).
Berdasarkan penelitian sebelumnya yang
dilakukan Prasetyo et al (2010), memanfaatkan sampah
organik di Pasar Wonokromo Surabaya dengan metode
hidrolisis asam dan fermentasi menggunakan bakteri
Zymomonas mobilis terbukti mengandung etanol.
Mushlihah (2011), meneliti produksi bioetanol dari
sampah buah jeruk menggunakan bakteri Zymomonas
mobilis menghasilkan etanol 11,64% selama 6 hari,
sedangkan Faizah (2012) dari sampah buah tomat
menghasilkan etanol 9,68% selama 6 hari. Adanya
perbedaan substrat dan metode yang dilakukan dapat
mempengaruhi hasil akhir dalam pembuatan bioetanol.
Oleh karena itu, penulis akan melakukan penelitian
untuk mengetahui potensi kapang Aspergillus sp.
dalam proses hidrolisis untuk produksi etanol dari
sampah sayur dan buah Pasar Wonokromo Surabaya.
Batasan masalah dalam penelitian ini yaitu
sampah sayur dan buah yang digunakan berasal dari
Pasar Wonokromo Surabaya. Hidrolisis yang dilakukan
adalah hidrolisis enzim menggunakan kapang
Aspergillus sp. dan fermentasi menggunakan bakteri
Zymomonas mobilis. Variabel bebas dalam penelitian
ini adalah konsentrasi inokulum bakteri Zymomonas
mobilis (0, 5, 10, dan 15%) dan lama waktu fermentasi
(0, 2, 4, 6, dan 8 hari), sedangkan variabel terikat
adalah kadar etanol. Semua perlakuan disesuaikan
dengan kondisi optimum Zymomonas mobilis.
II.
METODE PENELITIAN
2.1.
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan November
2012 sampai Mei 2013 di Laboratorium Botani,
Laboratorium Mikrobiologi dan Bioteknologi,
Laboratorium Zoologi dan Laboratorium Mikologi,
Jurusan Biologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Teknologi Sepuluh
Nopember; Laboratorium Mikrobiologi, Departemen
Kimia Farmasi, Fakultas Farmasi, Universitas
Airlangga; dan Laboratorium Penelitian, Fakultas
Farmasi, Universitas Surabaya. Pengambilan sampah
sayur dan buah dilakukan di Pasar Wonokromo
Surabaya.
2.2.
Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini
adalah laminair air flow, autoklaf, oven, blender,
saringan mesh ukuran 40, gelas ukur, labu ukur, gelas
beaker, corong, neraca analitik, inkubator, magnetik
stirer, erlenmeyer, cawan Petri, tabung reaksi, jarum
ose, jarum tanam tajam, pipet tetes, pipet mikro, pipet
ukur, pipet volume, kulkas, centrifuge, centrifuge tube,
rotary shaker, termometer, spektrofotometer, kuvet,
labu ukur, botol fermentor, destilator, piknometer,
tabung gas nitrogen, rak tabung reaksi, vortex mixer,
bunsen, kantong plastik, kertas label, spatula, dan
kamera digital.
Bahan-bahan yang digunakan dalam penelitian
ini adalah sampah sayur dan buah dari Pasar
Wonokromo Surabaya, Zymomonas mobilis koleksi
Laboratorium Mikrobiologi, Jurusan Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut
Teknologi Sepuluh Nopember, Aspergillus sp. koleksi
Laboratorium Mikrobiologi, Jurusan Biologi, Fakultas
Sains dan Teknologi, Universitas Airlangga, aquades,
media NA, NaOH, HCl, glukosa, yeast extract, Nelson
A dan B, arsenomolybdat, (NH4)2SO4, K2HPO4,
MgSO4.7H2O, agar, KH2PO4, CaCl2, CMC,
FeSO4.7H2O, MnSO4.H2O, ZnSO4.H2O, CoCl2,
aluminium foil, wrap, kertas pH, sumbat karet, kapas
lemak, kassa, dan kertas saring.
2.3.
Cara Kerja
2.3.1. Sterilisasi Alat
Semua alat-alat gelas yang digunakan untuk
fermentasi dilakukan sterilisasi panas kering
menggunakan oven pada suhu 160
oC, selama 2 jam
ataupun dengan pembakaran secara langsung seperti
jarum ose dan jarum tanam tajam. Sedangkan media
yang akan digunakan dilakukan sterilisasi panas basah
menggunakan autoklaf, tekanan 2 atm pada suhu 121
oC
selama 15 menit.
2.3.2. Persiapan Bahan dan Perlakuan Awal
(Pretreatment)
Sampah diambil dari Pasar Wonokromo
Surabaya sebanyak 2 kilogram. Setelah itu sampah
dipilah, diambil sampah sayur dan buah yang
mengandung selulosa dan dicuci bersih. Perlakuan
awal (pretreatment) pada sampah dilakukan secara
fisik, mekanik dan kimia. Pretreatment secara fisik,
sampah dikeringkan di bawah sinar matahari sampai
kering (±1-2 hari). Kemudian dilakukan pretreatment
secara mekanik dengan dipotong-potong berukuran ±2
cm, dihaluskan dengan diblender, diayak dengan
saringan mesh ukuran 40 dan disimpan di tempat yang
kering. Sedangkan untuk pretreatment secara kimia,
sampah direndam dengan NaOH 2% (wt),
perbandingan 1:6 (b/v) pada suhu ruang selama 24 jam,
kemudian diautoclave pada suhu 120
oC selama 1 jam.
Setelah itu dicuci dengan air kran hingga pH netral (7)
dan dioven pada suhu 65
oC hingga diperoleh berat
konstan (Gunam et al, 2010). Penggunaan ekstrak ini
untuk proses pembuatan kurva pertumbuhan,
pembuatan starter, hidrolisis dan proses fermentasi.
2.3.3. Proses Hidrolisis Enzim Menggunakan
Kapang Aspergillus sp.
Tahap ini terdiri dari beberapa tahapan
diantaranya tahap kultur kapang Aspergillus sp. isolat
dari hasil eksplorasi kapang di Taman Nasional Alas
Purwo Jurusan Biologi, Fakultas Sains dan Teknologi,
Universitas Airlangga. Setelah tahap kulur kapang,
dilakukan tahap produksi enzim, tahap pemanenan dan
pengujian aktivitas enzim (Gunam et al, 2010). Tahap
kultur kapang Aspergillus sp. dimulai dengan membuat
media kultur Potato Dextrose Agar (PDA). Aspergillus
sp. dikultur dalam tabung reaksi yang berisi media
PDA steril menggunakan jarum tanam tajam dan
diinkubasi selama 7 hari pada suhu ruang (Safaria et al,
2013).
Tahap produksi enzim diawali dengan membuat
medium Andreoti yang dituang ke dalam botol ukuran
500 ml sebanyak 150 ml, ditambahkan ekstrak sampah
yang telah di-pretreatment sebanyak 1,5 gr (1%),
ditutup menggunakan kapas lemak dan dilakukan
pengaturan pH awal yaitu 5, selanjutnya ditutup
dengan kapas lemak, disterilisasi pada suhu 121
oC
selama 20 menit dalam autoklaf (Safaria et al, 2013).
Suspensi spora yang dibuat dari Aspergillus sp.
berumur 7 hari dipindahkan ke dalam medium
fermentasi pada konsentrasi 10% (v/v) dan diaduk
secara aseptis di atas rotary shaker dengan kecepatan
120 rpm selama 7 hari (Gunam et al, 2010).
Tahap pemanenan dan pengujian enzim
dilakukan pada akhir fermentasi yaitu hari ke-7. Enzim
kasar disentrifuse dengan kecepatan 4000 rpm selama
16 menit, diambil filtrat, dan disaring menggunakan
kertas saring sampai larutan menjadi bening. Hasil
saringan merupakan enzim kasar yang siap dianalisis.
Selanjutnya hasil hidrolisis disebut hidrolisat. Dalam
penelitian ini parameter yang diamati yaitu pengujian
aktivitas enzim endoglukanase menggunakan substrat
CMC 1%. Hasil pengukuran absorbansi filtrat enzim
(dikoreksikan dengan blanko), diplotkan dalam satuan
unit/ml filtrat enzim. Satu unit aktivitas enzim
endoglukanase sebanding dengan satu mikromol
glukosa yang dihasilkan dari perlakuan enzim terhadap
substrat larutan CMC 1% selama 1 menit, atau jumlah
mg/ml glukosa yang dihasilkan dikalikan dengan 0,185
unit (Gunam et al, 2010).
2.3.4. Pembuatan Kultur Stok dan Kultur Kerja
Isolat Zymomonas mobilis disubkultur dalam
tabung reaksi yang berisi medium NA (Nutrien Agar)
miring dan diinkubasi pada suhu 30
oC selama 24 jam.
Untuk memperkaya jumlah sel, maka medium
ditambahkan 20g/L glukosa, 10 g/L yeast extract, 1 g/L
(NH4)2SO4, 1 g/L K2HPO4, 0,5 g/L MgSO4.7H2O)
(Struch et al, 1991).
2.3.5. Pembuatan Kurva Pertumbuhan
Aktivasi Zymomonas mobilis dilakukan dengan
mengambil 1 ose kultur kerja yang diinokulasi ke
dalam erlenmeyer 50 ml yang berisi 5 ml hidrolisat
ekstrak sampah yang telah disterilisasi dan telah diatur
pH menjadi 4 dengan penambahan larutan HCl 30%
dan diinkubasi dalam inkubator suhu 30
oC selama 24
jam (aktivasi I). Setelah 24 jam, hasil dari aktivasi I
diambil sebanyak 1 ml (10%) dan diinokulasikan ke
dalam erlenmeyer 50 ml yang berisi 9 ml hidrolisat
ekstrak sampah yang telah disterilisasi kemudian
diinkubasi dalam inkubator pada suhu 30
oC selama 24
jam (Aktivasi II). Kemudian diambil 5 ml (10%) dari
hasil aktivasi II dan dimasukkan ke dalam erlenmeyer
100 ml yang berisi 45 ml hidrolisat ekstrak limbah
sayur dan limbah buah yang telah disterilisasi
kemudian diinkubasi dalam inkubator pada suhu 30
oC
selama 24 jam yang disebut sebagai kultur fermentasi
(Cazetta et al, 2007 dan Zhang et al, 2010).
Dilakukan pengenceran dari 10
-1sampai dengan
10
-9. Medium kultur diambil 1 ml dan dimasukkan ke
dalam tabung reaksi yang berisi 9 ml aquades steril.
Tabung reaksi yang berisi campuran tersebut divortex
dengan vortex mixer, dipipet sebanyak 1 ml dan
dimasukkan ke dalam tabung reaksi berikutnya.
Pembuatan grafik kurva pertumbuhan dilakukan
dengan cara pengukuran absorbansi Zymomonas
mobilis diukur pada panjang gelombang 600 nm
dengan interval tiap 1 jam sekali selama 24 jam. Dibuat
grafik kurva pertumbuhan dari nilai absorbansi dan
waktu fermentasi (Obire, 2005).
Penentuan regeneration (doubling) time (Td)
dilakukan selama fase log, dimana waktu inkubasi
dengan nilai Td tertinggi dijadikan sebagai usia starter.
Rumusnya sebagai berikut:
1
= Log2 NT – Log2 N0
Td
T – L
dimana : Td
= Waktu Doubling Time
N0
= Jumlah sel awal
NT
= Jumlah sel setelah waktu T
T
= Waktu pada jumlah sel NT
L = Waktu pada jumlah sel N0
(Hogg, 2005).
2.3.6. Pembuatan Starter
Zymomonas mobilis diambil 1 ose dan
diinokulasi ke dalam erlenmeyer 50 ml yang berisi 5
ml hidrolisat ekstrak limbah sayur dan limbah buah
steril yang telah diatur pH menjadi 4 dengan
penambahan larutan HCl 30%. Kemudian diinkubasi
dalam inkubator pada suhu 30
OC selama 24 jam
(Aktivasi I). Sebanyak 1 ml dari aktivasi I (10%)
dipipet dan diinokulasi kembali ke dalam erlenmeyer
yang berisi 9 ml hidrolisat ekstrak limbah sayur dan
limbah buah, diinkubasi dalam inkubator pada suhu
30
OC selama 24 jam (Aktivasi II). Sebanyak 5 ml dari
aktivasi II (10%) dipipet dan diinokulasi kembali ke
dalam erlenmeyer 100 ml yang berisi 45 ml hidrolisat
ekstrak limbah sayur dan limbah buah, diinkubasi
dalam inkubator pada suhu 30
OC sampai jam dimana
fase log Zymomonas mobilis terjadi (sesuai dengan
kurva pertumbuhan) (Aktivasi III) (Cazetta et al, 2007
dan Zhang et al, 2010).
2.3.7. Proses Fermentasi
Starter ditambahkan dengan konsentrasi sesuai
dengan rancangan penelitian (0, 5, 10 dan 15%) ke
dalam botol fermentor 100 ml yang berisi 50 ml
ekstrak limbah sayur dan limbah buah, diinkubasi
dengan lama sesuai dengan rancangan penelitian (0, 2,
4, 6 dan 8 hari) pada suhu kamar. Jika pada 4 hari
kadar etanol belum menurun, maka proses fermentasi
dilanjutkan. Proses fermentasi dilanjutkan pada kondisi
anaerob dilakukan dengan menggunakan teknik
Hungate, yaitu dengan mengalirkan gas nitrogen ke
dalam fermentor. Fermentor ditutup dengan penutup
sumbat karet dan kemudian dialiri gas nitrogen selama
2 menit. Untuk proses fermentasi 0 hari langsung
melalui tahap pasteurisasi. Setelah proses fermentasi
selesai, tutup botol dilepas, ditutup dengan kapas lemak
dan dipasteurisasi pada suhu ±80
oC selama 10 menit
(Puspita et al, 2010). Tujuan dari pasteurisasi ini
adalah untuk mematikan bakteri yang terkandung
dalam sampel sehingga proses fermentasi dapat
berhenti (Faizah, 2012).
2.3.8. Pengukuran Kadar Etanol
Tabung distilasi dan labu gondok 250 ml
disiapkan, selanjutnya 50 ml sampel cairan hasil
fermentasi menggunakan labu ukur 50 ml dan
dimasukkan ke dalam tabung destilasi. Dididihkan
dengan hati-hati untuk menghindari buih yang
berlebihan, destilasi campuran alkohol dan air sampai
dapat dikumpulkan tepat 5 ml distilat (Purwanto,
2004).
Sementara dilakukan destilasi, piknometer
dikalibrasi. Piknometer diisi akuades destilasi dan
ditutup. Piknometer dan akuades ditimbang, berat yang
didapat adalah W2. Kemudian piknometer
dikosongkan, akuades yang tersisa diabsorbsi dengan
aseton. Tabung piknometer dikeringkan dengan oven.
Piknometer yang telah kering ditimbang, berat yang
didapatkan adalah W1. Berat akuades (W) dihitung
dengan cara W2-W1 (Purwanto, 2004).
Distilat dipindahkan ke dalam gelas beaker
kering. Distilat diaduk supaya homogen sebelum
diisikan ke piknometer. Piknometer kering diisi dengan
distilat, permukaan luar piknometer dikeringkan dan
ditimbang. Hasil yang didapat adalah W3.
Berat distilat adalah W3-W1=L. Berat air (L)
dihitung dengan specific gravity atau spg = L/W. Nilai
spg ditentukan dengan menggunakan Tabel AOAC
(Analysis of the Association of Official Analitical
Chemist) dan selanjutnya persentase etanol dihitung
(Purwanto, 2004).
2.3.9. Pengukuran Gula Reduksi
Gula reduksi diukur dengan menggunakan
metode Nelson-Somogyi (Safaria et al, 2013). Sampel
1 ml ditambah akuades sampai volume akhir 10 ml.
Campuran diambil 1 ml dan ditambah 9 ml akuades.
Sampel diambil 1 ml dan dicampur 1 ml larutan Nelson
(campuran Nelson A&B; 25:1 v/v), kemudian
dipanaskan pada suhu 100
oC selama 20 menit. Sampel
didinginkan sampai mencapai suhu kamar. Sampel
ditambah 1 ml larutan arsenomolybdat dan 7 ml
akuades kemudian digojok menggunakan vortex.
Campuran tersebut dimasukkan kuvet dan diukur
penyerapan cahaya tampak (visible) pada panjang
gelombang 510 nm. Nilai absorbansi yang diperoleh
dikurangi nilai absorbansi blanko sehingga diperoleh
nilai absorbansi sampel. Nilai absorbansi sampel
dikonversi ke kadar gula reduksi (mg/ml) berdasar
persamaan regresi larutan standar (Dewi et al, 2005).
(Budiono, 1996).
2.4.
Rancangan Penelitian
Rancangan penelitian yang digunakan adalah
RAL (Rancangan Acak Lengkap) pola faktorial dengan
2 faktor perlakuan. Faktor pertama adalah konsentrasi
inokulum Zymomonas mobilis (0, 5, 10 dan 15%).
Faktor kedua adalah lama waktu fermentasi (0, 2, 4, 6
dan 8 hari). Masing-masing perlakuan diulang
sebanyak 2 kali, sehingga diperoleh 40 unit percobaan.
Parameter yang diamati adalah kadar etanol (%).
2.5.
Analisa Data
Data yang diperoleh dianalisis dengan ANOVA
atau Analysis Of Variance untuk mengetahui pengaruh
interaksi faktor konsentrasi inokulum Zymomonas
mobilis dan lama waktu fermentasi terhadap kadar
etanol yang dihasilkan dengan hipotesa:
Ho
: Tidak ada pengaruh interaksi antara
konsentrasi inokulum Zymomonas
mobilis dan lama waktu fermentasi
terhadap persentase (%) etanol yang
dihasilkan.
H1
: Ada pengaruh interaksi antara konsentrasi
inokulum Zymomonas mobilis dan lama
waktu fermentasi terhadap persentase (%)
etanol yang dihasilkan.
Jika H1
diterima, maka dilanjutkan dengan uji
Tukey pada taraf kepercayaan 95% (α=0,05) untuk
mengetahui perbedaan nyata antara pengaruh
kombinasi perlakuan konsentrasi inokulum dan lama
waktu fermentasi (Walpole, 1992).
III.
HASIL DAN DISKUSI
3.1. Potensi Kapang Aspergillus sp. dalam
Proses Hidrolisis
Proses hidrolisis pada penelitian ini
menggunakan kapang Aspergillus sp. isolat dari
Jurusan Biologi, Fakultas Sains dan Teknologi,
Universitas Airlangga yang didapatkan dari
hasil
eksplorasi kapang di Taman Nasional Alas Purwo dan
berhasil diuji selulolitik. Isolat dengan kode H5
yang
digunakan
ini berhasil diteliti hingga tahap genus yaitu
genus Aspergillus. Menurut Gugnani (2003), genus
Aspergillus pada umumnya bereproduksi secara
aseksual, dapat mendegradasi sejumlah komponen
organik gula, asam lemak, protein, selulosa, pektin dan
xylan.
Kapang bersifat heterotrof, memerlukan sumber
C-organik sehingga sebelum dilakukan hidrolisis,
kapang ditumbuhkan atau diremajakan pada media
potato dextrosa agar (PDA) terlebih dahulu.
Peremajaan ini berfungsi menjaga agar biakan jamur
tetap hidup, ciri-ciri genetiknya tetap stabil dan tidak
berubah. Medium PDA yang digunakan dalam
peremajaan menurut Waluyo (2006), merupakan media
padat yang umum digunakan untuk medium
pertumbuhan kapang. Kentang merupakan sumber
utama karbohidrat yang mengandung vitamin dan
mineral yang cukup tinggi. Dextrosa berfungsi
memenuhi kebutuhan karbon dalam media PDA.
Menurut Gandjar (2006), senyawa karbon ini
dimanfaatkan kapang untuk membuat materi sel baru.
Untuk mencegah kemungkinan terjadinya kontaminasi,
sebelum dilakukan peremajaan, media PDA disterilkan
terlebih dahulu dengan autoklaf 121
oC, selama 20
menit.
Usia kapang yang digunakan dalam proses
hidrolisis yaitu hari ke-7 karena menurut penelitian
Adham (2001), Lotfly et al (2006), waktu optimum
pertumbuhan spora kapang genus Aspergillus sp. hari
ke-7 yaitu pada kisaran 10
5-10
8spora/ml. Hal ini juga
selaras dengan penelitian Widyanti (2010), yang
melakukan percobaan dengan kapang Aspergillus
niger, waktu optimum pertumbuhan spora pada hari
ke-7 dengan jumlah 14,7 x 10
7spora/ml. Hal ini
dikarenakan pada hari ke-7 kapang berada pada akhir
fase log dan memasuki awal fase stasioner seperti pada
penelitian Sa’adah et al (2008), aktivitas enzim
selulase tertinggi diperoleh pada saat fase stasioner
yaitu setelah hari ke-4 fermentasi kapang Aspergilllus
sp.
Pemanenan enzim dilakukan pada akhir
fermentasi yaitu hari ke-7. Pada medium terlihat
adanya kapas-kapas berwarna putih dan tidak nampak
adanya sporulasi. Bentuk kapas tersebut adalah spora
atau konidia tunggal yang sudah tumbuh menjadi
miselium. Menurut Gandjar et al (2006), pemisahan
miselium dari medium harus melalui suatu
penyaringan. Maka dari itu, dilakukan penyaringan
dengan sentrifuse kecepatan 4000 rpm selama 16
menit. Filtrat yang telah disaring menggunakan kertas
saring sampai larutan menjadi bening, dianalisa
aktivitas enzimnya menggunakan substrat CMC 1%.
Melihat aktivitas sangat tinggi pada CMC, enzim ini
disebut sebagai CMC-ase atau biasa disebut dengan
endoglukanase (Anindyawati, 2009).
Menurut Gandjar et al (2006), nilai aktivitas
enzim dipengaruhi oleh beberapa faktor, diantaranya
substrat, kelembapan, suhu, dan pH. Aktivitas enzim
pada hari ke-1 sampai hari ke-7 mengalami
peningkatan dan mencapai titik maksimum pada hari
ke-7 serta mengalami penurunan pada hari ke-8 seperti
pada Gambar 13. Hal ini selaras dengan penelitian
Gunam et al (2010), yang menyatakan bahwa produksi
enzim selama fermentasi dapat mencapai maksimum
dalam jangka waktu tertentu, kemudian mengalami
penurunan secara cepat atau perlahan-lahan, demikian
Konversi (%) = GR awal – GR akhir x 100% GR awal
juga aktivitas enzim dapat mengalami penurunan yang
tajam sehingga waktu pemanenan harus diketahui
dengan tepat untuk mendapatkan aktivitas yang
maksimal.
Gambar 1. Grafik nilai aktivitas enzim endoglukanase menggunakan kapang Aspergillus sp.
Nutrien yang ditambahkan ke dalam media
fermentasi akan habis selama berlangsungnya proses
fermentasi sampai dihasilkan aktivitas enzim yang
maksimal, kemudian dengan berkurangnya nutrien
akan mengakibatkan aktivitas produksi enzim dan
pertumbuhan kapang semakin menurun. Sehingga
dapat disimpulkan, waktu pemanenan enzim yang tepat
menggunakan kapang Aspergillus sp. dengan substrat
sampah sayur dan buah adalah hari ke-7 dengan nilai
aktivitas enzim endoglukanase sebesar 14,477 Unit/ml.
Satu unit aktivitas enzim selulase didefinisikan sebagai
jumlah enzim yang menghasilkan satu mikromol gula
reduksi (glukosa) setiap menitnya.
Media yang digunakan dalam proses hidrolisis
yaitu medium Andreoti dengan pH awal 5, karena
menurut Gunam et al (2010), pada kondisi pH 4-5
merupakan pH yang optimal untuk pertumbuhan
Aspergillus sp. sehingga kapang dapat melakukan
aktivitas yang maksimal. Pada penelitian Widyastuti
(2008), dijelaskan bahwa secara umum kapang dapat
tumbuh dan menghasilkan berbagai macam enzim pada
kisaran pH asam. Kondisi pH yang rendah
mempermudah pelepasan enzim selulase, sedangkan
kondisi pH yang tinggi menyebabkan pelepasan enzim
selulase ke luar sel akan terhambat. Pada akhir
hidrolisis, pH mengalami perubahan menjadi pH 6.
Sampai pada suatu titik, kecepatan suatu reaksi
enzimatik meningkat sejalan dengan meningkatnya pH.
Menurut Campbell et al (2002), nilai pH optimal untuk
bekerja paling aktif pada kapang Aspergillus sp. sekitar
6 sampai 8. Aktivitas enzim dipengaruhi oleh pH
karena sifat ionik gugus karboksil dan gugus amino
yang mudah dipengaruhi pH.
Dalam penelitian ini suhunya adalah suhu
ruang, karena pada suhu tersebut merupakan suhu
optimum kapang genus Aspergillus (28-30
oC). Di atas
suhu optimum, kecepatan reaksi menurun tajam karena
enzim sebagai protein akan terdenaturasi, sedangkan
pada suhu terlalu rendah enzim tidak dapat bekerja.
Selain itu, kelembapan juga dapat mempengaruhi
aktivitas enzim, berkaitan dengan pertumbuhan
kapang. Genus Aspergillus dapat tumbuh baik pada
kelembapan nisbi 80%. Dilakukannya penggoyangan
menggunakan rotary shaker dengan tujuan menjamin
ketersediaan oksigen dalam medium, dimana menurut
Agus (1995), kecepatan goyangan yang tinggi dalam
erlenmeyer akan menyebabkan spora didespersikan
secara homogen sehingga tidak bersporulasi di
permukaan.
Jumlah substrat atau ekstrak sampah yang telah
di-pretreatment yaitu 1,5 gr ekstrak dimasukkan ke
dalam 150 ml media Andreoti atau sebesar 1% dari
total medium. Hal ini berkatitan dengan penelitian
Gunam et al (2010) yang menyatakan bahwa substrat
yang terlalu tinggi dapat menyebabkan media
fermentasi menjadi agak pekat, sehingga menimbulkan
masalah dalam sirkulasi udara, penurunan tingkat
homogenitas dan penyebaran kapang. Ukuran substrat
juga dapat mempengaruhi menurut Gandjar et al
(2006), semakin kecil substrat, maka semakin mudah
kontak enzim yang terjadi Jadi, dalam proses hidrolisis
harus diperhatikan pH, suhu, kelembapan, dan substrat
yang optimum bagi kapang sehingga dihasilkan
aktivitas enzim yang besar.
Selain itu juga harus diperhatikan nutrisi dalam
proses hidrolisis. Pada penelitian ini digunakan
medium Andreoti karena terdapat banyak nutrisi yang
dapat dimanfaatkan untuk pertumbuhan sel kapang
maupun produktivitas enzim. Misalnya, menurut
Gandjar et al (2006), (NH4)2SO4
merupakan sumber
nitrogen yang diperlukan untuk pertumbuhan kapang
dan sekresi enzim. MgSO4 dan CaCl2 diperlukan
kapang sebagai pengendapan senyawa-senyawa kimia
yang dapat mengganggu pertumbuhannya serta sebagai
kofaktor dalam mengatur jumlah enzim yang terlibat
dalam reaksi.
Sifat kapang yang heterotrof mampu
mengasimilasi karbon organik menjadi karbon organik
lain dengan bantuan oksidasi senyawa organik lain.
Sumber karbon organik yaitu selulosa akan diubah
menjadi karbon organik lain yaitu glukosa dalam
proses hidrolisis ini. Enzim extraseluler yang
dihasilkan oleh kapang Aspergillus sp. proses
hidrolisisnya terjadi di luar sel mikroorganisme bersifat
selulolitik. Dimana menurut Lynd et al, (2002),
selulase merupakan enzim kompleks yang terdiri dari
selobiohidrolase (eksoglukanase), endoglukanase atau
carboxy methyl cellulose (CMC-
ase) dan
β-glukosidase, bekerja dengan memutus ikatan
glikosidik. Menurut Onsori et al (2005) kerja enzim
selulase sebagai berikut, enzim endoglukanase bekerja
pada selulosa amorf (larut) atau pada selulosa yang
mempunyai kristalin rendah seperti carboxy methyl
cellulose (CMC) menjadi selulosa rantai pendek
dengan menghidrolisis secara acak pada bagian dalam
ikatan β-1,4-D-glikosidik di selulosa. Enzim
eksoglukanase memecah selulosa rantai pendek
menjadi selobiosa dan enzim β-glukosidase memecah
selobiosa menjadi glukosa.
Oleh karena perhitungan aktivitas enzim
menggunakan substrat CMC 1%, maka aktivitas enzim
endoglukanase saja yang dapat diketahui dalam
penelitian ini. Selain itu, enzim yang didapat
1.377 3.814 4.614 6.468 7.923 12.724 14.477 12.251 0.000 2.000 4.000 6.000 8.000 10.000 12.000 14.000 16.000 0 1 2 3 4 5 6 7 8 9 10 A k ti vi tas E n zi m ( uni t/ m l)merupakan enzim kasar yang tidak dimurnikan,
sehingga kemungkinan besar mengandung juga
enzim-enzim lain seperti enzim-enzim hemiselulase. Menurut
Wiratmaja et al (2011), hidrolisis sempurna selulosa
akan menghasilkan monomer selulosa yaitu glukosa,
sedangkan hemiselulase dapat menghasilkan glukosa,
mannosa dan galaktosa (heksosa) serta xilosa dan
arabinosa (pentosa). Enzim hemiselulase ini khususnya
enzim xilanase berperan dalam menghidrolisis
hemiselulosa menjadi gula xilosa (Widjaja et al, 2012).
Hal ini perlu pembuktian misalnya dengan analisa
HPLC, yang dapat membedakan antara glukosa dan
xilosa karena dengan metode Nelson-Somogyi yang
digunakan dalam penelitian ini hanya mampu
menganalisa total gula reduksi tanpa membedakan
jenis gula reduksinya.
Kadar gula reduksi sebelum diinokulasikan
kapang Aspergillus sp., sebesar 2,14%. Setelah
dilakukan hidrolisis, kadar gula reduksi meningkat
menjadi 10,80%. Peningkatan kadar gula reduksi ini
membuktikan bahwa penggunaan kapang Aspergillus
sp. tidak berbeda jauh dengan hidrolisis asam maupun
enzim komersial yang sering dilakukan dalam beberapa
penelitian. Misalnya pada penelitian Sulfahri et al
(2011), produksi etanol dari spirogyra dengan proses
hidrolisis menggunakan enzim komersial dapat
menghasilkan gula reduksi awal 10,05%. Sedangkan
pada penelitian Prasetyo et al (2010), dengan proses
hidrolisis asam menggunakan sampah pasar dapat
menghasilkan kadar gula reduksi awal 9,98%. Menurut
Safaria et al (2013), hidrolisis enzim memiliki
beberapa keuntungan dibandingkan hidrolisis kimia
yakni tidak terjadi degradasi gula hasil hidrolisis, dan
berlangsung pada suhu rendah karena tidak ada bahan
yang korosif. Gula reduksi inilah yang akan dijadikan
sebagai data sekunder dalam produksi etanol selain
suhu, pH dan substrat karena glukosa dari proses
hidrolisis akan diubah menjadi etanol dalam proses
fermentasi menggunakan bakteri Zymomonas
mobilis.Untuk dapat diketahui hubungan kapang
Aspergillus sp. berpotensi atau tidak untuk dijadikan
alternatif dalam proses hidrolisis enzim, dapat
diketahui melalui hasil etanol yang terbentuk.
3.2.
Produksi Etanol dari Sampah Sayur dan
Buah Pasar Wonokromo Surabaya
Sampel sampah yang digunakan dalam
penelitian ini yaitu sampah organik yang didapatkan
melalui metode sampling di Pasar Wonokromo
Surabaya, sampah yang mendominasi adalah sampah
sayur dan buah. Hal ini selaras dengan penelitian
Soedjono et al (2011) dan Winanti (2006) yang
menyatakan bahwa Pasar Wonokromo Surabaya
merupakan pasar induk, dimana volume total
sampahnya 30m
3/hari dengan komposisi sampah
organik 26m
3/hari atau sebesar 87%. Sampel sampah
sayur dan buah yang diambil yaitu terdiri dari lima
jenis sampah sayur (kangkung, kacang panjang, selada,
kenikir, dan sawi hijau) dan lima jenis sampah buah
(pisang raja, apel, jeruk, jambu biji, dan pepaya) yang
merupakan sampah terbanyak setiap harinya dengan
kandungan serat yang besar juga. Kandungan serat
pada masing-masing jenis sampah dapat dilihat pada
Tabel 1.
Sumber serat dalam sayuran dan buah-buahan
terdapat dalam struktur dinding selnya, terutama pada
jaringan parenkim dan sebagian dari jaringan
terlignifikasi. Komponen serat yang terkandung dalam
jaringan parenkim adalah selulosa, substansi pektat,
hemiselulosa, dan beberapa jenis glikoprotein.
Sedangkan komponen serat yang terkandung dalam
jaringan terlignifikasi adalah selulosa, lignin,
hemiselulosa, dan beberapa jenis glikoprotein
(Selvendran et al, 1984 dalam Muchtadi, 2001).
Sampah sayur dan buah memiliki potensi
sebagai bahan baku pembuatan bioetanol karena 65%
kandungan terbesar sampah kota adalah sampah
organik dengan biomassa berat keringnya mengandung
75% pati, hemiselulosa, dan selulosa yang terdiri atas
sayur-sayuran, buah-buahan, dedaunan, kulit buah,
bambu, dan ranting kayu. Selain itu, menurut Irawan et
al (2010), bahan baku lignoselulosa berharga murah,
melimpah, belum banyak dimanfaatkan dan dapat
menjadi alternatif penanganan sampah sehingga tidak
diperlukannya lahan yang luas serta tidak
menimbulkan kompetisi antara ketersediaan bahan
baku untuk pangan dan untuk sumber energi
(Wiratmaja et al, 2011).
Tabel 1. Kadar serat beberapa jenis sayur dan buah.
No Bahan Kadar serat Sumber pustaka
1. Kangkung 61,34 (% berat kering) (Muchtadi, 1998)
2. Kacang panjang 49,47 (% berat kering) (Muchtadi, 1998)
3. Selada 50,07 (% berat kering) (Muchtadi, 1998)
4. Kenikir 56,76 (% berat kering) (Muchtadi, 1998)
5. Sawi hijau 51,07 (% berat kering) (Muchtadi, 1998)
6. Pisang raja 10,34 (dalam 100 gr bahan) (Wirakusumah, 1994)
7. Apel 23,17 (dalam 100 gr bahan) (Wirakusumah, 1994)
8. Jeruk 6,07 (dalam 100 gr bahan) (Wirakusumah, 1994)
9. Jambu biji 5,60 (dalam 100 gr bahan) (Wirakusumah, 1994)
10. Pepaya 8,85 (dalam 100 gr bahan) (Wirakusumah, 1994)
Produksi etanol terdiri dari beberapa tahapan
yaitu pretreatment, hidrolisis, fermentasi dan destilasi.
Degradasi selulosa tidak bisa dilakukan dengan mudah
karena keberadaan selulosa dalam struktur
lignoselulosa yang sangat kompleks, antara lain dengan
adanya struktur kristalin dalam selulosa serta adanya
ikatan yang kuat antara selulosa dengan lignin sehingga
diperlukan proses pemutusan ikatan lignoselulosa yang
disebut pretreatment.
Macam pretreatment yang dilakukan dalam
penelitian ini yaitu pretreatment fisik, mekanik dan
kimiawi. Pada pretreatment fisik, sampah yang telah
dicuci bersih, dijemur di bawah sinar matahari sampai
kering (±1-2 hari) dengan tujuan untuk mengurangi
kadar air sampah sayur dan buah yang mencapai 55,38
% (Yenni et al, 2012). Setelah itu dilakukan
pretreatment mekanik dengan memotong sampah yang
sudah kering ±2 cm, diblender, diayak menggunakan
mesh berukuran 40. Hal ini dilakukan dengan tujuan
luas permukaan substrat (Sa’adah et al, 2008). Menurut
Sun et al (2002), ukuran bahan baku akan
mempengaruhi porositas, sehingga dapat
memaksimalkan kontak antara bahan baku dengan
enzim. Semakin kecil ukuran substrat, maka akan
mempermudah terdegradasinya lignin sehingga
selulosa dan hemiselulosa akan terhidrolisis secara
optimal.
Proses
pretreatment
yang terakhir yaitu
pretreatment kimia dengan menggunakan NaOH.
Proses ini biasa disebut dengan delignifikasi, yaitu
suatu proses pembebasan lignin dari suatu senyawa
kompleks. Delignifikasi dilakukan dengan larutan
NaOH karena natrium hiroksida ini akan membentuk
larutan alkali yang kuat ketika dilarutkan dalam air.
Menurut Artati et al (2009), lignin tidak akan larut
dalam larutan asam, tetapi mudah larut dalam larutan
alkali encer. Sehingga larutan NaOH ini dapat
menyerang dan merusak struktur lignin, bagian
kristalin dan amorf, memisahkan sebagian lignin dan
hemiselulosa serta menyebabkan penggembungan
struktur selulosa (Gunam et al, 2010). Proses
delignifikasi dengan NaOH menyebabkan ikatan silang
dari struktur aromatik lignin dapat memperlambat
penetrasi oleh enzim sehingga mempengaruhi proses
hidrolisis. Ion OH
-dari NaOH akan memutus
ikatan-ikatan dari struktur dasar lignin. Sedangkan ion Na
+akan berikatan dengan lignin membentuk natrium
fenolat. Garam fenolat ini bersifat mudah larut. Lignin
yang terlarut ditandai dengan warna hitam pada larutan
yang disebut lindi hitam atau black liquor (Safaria et
al, 2013).
Struktur kimia lignin akan mengalami
perubahan di bawah kondisi suhu tinggi,
mengakibatkan lignin terpecah menjadi partikel yang
lebih kecil dan terlepas dari selulosa, maka dari itu
diautoklaf pada suhu 121
oC selama 1 jam (Wiratmaja
et al, 2011). Setelah diautoklaf, dibilas dengan air
mengalir sampai pH 7. Proses penghilangan lignin ini
dapat dikatakan lama, yaitu ±12 jam. Semakin tinggi
hemiselulosa dan lignin pada limbah, semakin banyak
NaOH yang mengakses ikatan lignin dan hemiselulosa,
menyebabkan banyaknya NaOH yang kontak dengan
limbah, sehingga proses penghilangan NaOH semakin
lama (Mussato, 2010).
Hasil akhir proses pretreatment
yaitu
didapatkan ekstrak sampah sebesar 187 gr dari berat
awal sampah sayur dan buah 2000 gr. Ekstrak tersebut
kemudian dilanjutkan pada tahap hidrolisis untuk
dikonversi dari selulosa menjadi glukosa. Setelah
didapat hasil akhir proses hidrolisis yaitu glukosa,
dilanjutkan dengan tahap fermentasi dimana glukosa
dikonversi menjadi etanol. Proses fermentasi
dikondisikan pada keadaan optimum pertumbuhan
Zymomonas mobilis dengan suhu optimum 30
oC, pH
4, dan kondisi anaerob dengan menggunakan teknik
Hungate, yaitu mengalirkan gas nitrogen ke dalam
fermentor. Hal ini sesuai dengan beberapa Garrity
(2005) yang menyebutkan bahwa Zymomonas mobilis
dapat tumbuh pada rentang pH 3,5-7,5 dan optimum di
pH 4, merupakan bakteri anaerob fakultatif.
3.2.1. Penentuan Umur Starter Zymomonas mobilis
Pada Medium Fermentasi
Pada proses fermentasi yang perlu dilakukan
adalah pembuatan starter. Starter merupakan biakan
mikroba tertentu yang ditumbuhkan di dalam substrat
atau medium untuk tujuan proses tertentu. Menurut
Webster et al (2007), pembutan starter adalah tahapan
adaptasi mikroba agar dapat menyesuaikan dengan
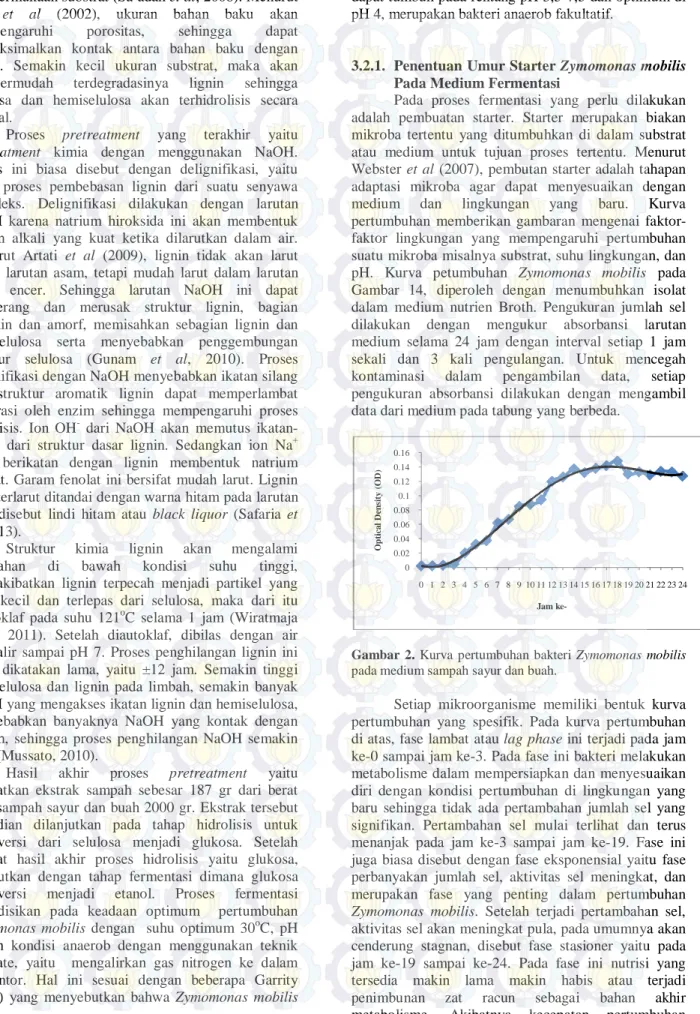
medium dan lingkungan yang baru. Kurva
pertumbuhan memberikan gambaran mengenai
faktor-faktor lingkungan yang mempengaruhi pertumbuhan
suatu mikroba misalnya substrat, suhu lingkungan, dan
pH. Kurva petumbuhan Zymomonas mobilis pada
Gambar 14, diperoleh dengan menumbuhkan isolat
dalam medium nutrien Broth. Pengukuran jumlah sel
dilakukan dengan mengukur absorbansi larutan
medium selama 24 jam dengan interval setiap 1 jam
sekali dan 3 kali pengulangan. Untuk mencegah
kontaminasi dalam pengambilan data, setiap
pengukuran absorbansi dilakukan dengan mengambil
data dari medium pada tabung yang berbeda.
Gambar 2. Kurva pertumbuhan bakteri Zymomonas mobilis pada medium sampah sayur dan buah.
Setiap mikroorganisme memiliki bentuk kurva
pertumbuhan yang spesifik. Pada kurva pertumbuhan
di atas, fase lambat atau lag phase ini terjadi pada jam
ke-0 sampai jam ke-3. Pada fase ini bakteri melakukan
metabolisme dalam mempersiapkan dan menyesuaikan
diri dengan kondisi pertumbuhan di lingkungan yang
baru sehingga tidak ada pertambahan jumlah sel yang
signifikan. Pertambahan sel mulai terlihat dan terus
menanjak pada jam ke-3 sampai jam ke-19. Fase ini
juga biasa disebut dengan fase eksponensial yaitu fase
perbanyakan jumlah sel, aktivitas sel meningkat, dan
merupakan fase yang penting dalam pertumbuhan
Zymomonas mobilis. Setelah terjadi pertambahan sel,
aktivitas sel akan meningkat pula, pada umumnya akan
cenderung stagnan, disebut fase stasioner yaitu pada
jam ke-19 sampai ke-24. Pada fase ini nutrisi yang
tersedia makin lama makin habis atau terjadi
penimbunan zat racun sebagai bahan akhir
metabolisme. Akibatnya kecepatan pertumbuhan
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 Op tica l D en sit y ( OD ) Jam
ke-menurun dan pertumbuhan akhirnya terhenti.
Pertumbuhan bakteri berlangsung dengan
mengkonsumsi nutrien sekaligus mengeluarkan
produk-produk metabolisme yang terbentuk, maka
setelah waktu tertentu laju pertumbuhannya akan
menurun dan akhirnya akan terhenti sama sekali yang
disebut dengan fase kematian (death phase). Namun,
pada penelitian ini tidak ditemukan death phase karena
pada jam ke-24 kurva tetap menunjukkan grafik yang
stagnan.
Maka, dengan membuat kurva pertumbuhan ini
dapat ditentukan waktu yang optimal untuk starter.
Sehingga saat starter diinokulasikan ke dalam
hidrolisat untuk proses selanjutnya yaitu fermentasi
dapat menjadi optimal. Umur starter ditentukan dengan
menghitung laju pertumbuhan spesifik (µ) dan waktu
doubling time (tg) berdasarkan data jumlah sel dan
waktu inkubasi pada kurva pertumbuhan (Hogg, 2005).
Umur starter Zymomonas mobilis yang digunakan
berdasarkan kurva pertumbuhan yaitu jam ke-(6-7)
dimana besar laju pertumbuhannya menunjukkan
angka terbesar µ=0,476 generasi/jam dengan waktu
doubling time tercepat 80,56 menit.
3.2.2. Hasil
Interaksi Konsentrasi Inokulum
Bakteri Zymomonas mobilis dan Lama
Waktu Fermentasi
Terhadap Produksi
Etanol
Gula merupakan faktor penting bagi sel bakteri
sebagai sumber energi untuk metabolisme yang pada
akhirnya akan berpengaruh terhadap konsentrasi etanol
yang dihasilkan. Namun, besarnya konsentrasi etanol
yang didapatkan dari proses fermentasi tidak dapat
ditentukan hanya berdasarkan konsentrasi gula reduksi
saja, karena ada banyak faktor yang mempengaruhi
seperti konsentrasi inokulum, lama fermentasi, suhu,
pH dan nutrisi.
Pada penelitian ini terdapat dua variabel bebas
yaitu konsentrasi inokulum bakteri Zymomonas mobilis
(0, 5, 10 dan 15%) dan lama waktu fermentasi (0, 2, 4,
6, dan 8 hari). Variasi konsentrasi inokulum ditetapkan
atas dasar penelitian Wignyanto et al (2001), yang
menyatakan bahwa rentang konsentrasi yang sempit (6,
8, dan 10%) tidak memberikan hasil yang berbeda
nyata. Parameter yang diamati yaitu kadar etanol yang
terbentuk.
Tabel 2. Rerata kadar etanol (%) hasil fermentasi ekstrak samapah sayur dan buah pasar wonokromo surabaya menggunakan bakteri Zymomonas mobilis.
Konsentrasi inokulum
Jumlah etanol yang dihasilkan (%) dalam waktu fermentasi
0 hari 2 hari 4 hari 6 hari 8
hari 0% 0,00 h 0,00 h 0,10 h 0,20 h 0,20 h 5% 0,00 h 0,30 h 2,70 f 4,40 e 6,60 c 10% 0,00 h 2,30 g 5,00 d 9,50 a 9,10 b 15% 0,00 h 2,40 fg 5,40 d 9,40 ab 9,20 ab
Keterangan: angka yang diikuti oleh huruf yang sama pada setiap kolom dan baris menunjukkan tidak berbeda nyata menurut uji Tukey pada selang kepercayaan 95%.
Berdasarkan hasil uji Anova, F hitung lebih
besar dari F tabel yang berarti H0 ditolak dan H1
diterima. Sehingga ada pengaruh interaksi antara
konsentrasi inokulum Zymomonas mobilis dan lama
waktu fermentasi terhadap persentase (%) etanol yang
dihasilkan. Karena H1 diterima, maka dilanjutkan
dengan uji Tukey pada taraf kepercayaan 95% untuk
diketahui apakah terjadi perbedaan nyata antara
interaksi konsentrasi inokulum dan lama waktu
fermentasi. Berdasarkan uji Tukey, didapatkan hasil
bahwa konsentrasi inokulum dan lama fermentasi
sama-sama memiliki perbedaan yang nyata. Begitu
juga dengan hasil interaksi keduanya menunjukkan
perbedaan yang nyata, ditunjukkan dengan notasi yang
berbeda dapat dilihat pada Tabel 2.
Gambar 3. Grafik kadar etanol selama proses fermentasi dengan menggunakan Zymomonas mobilis.
Pada Grafik di atas dapat dilihat bahwa
konsentrasi inokulum 0% sebagai kontrol, grafik
menunjukkan posisi stagnan yang artinya tidak ada
produk fermentasi yang dihasilkan karena tidak ada
bakteri Zymomonas mobilis yang ditambahkan.
Fermentasi pada hari ke-4 sampai ke-8, etanol mulai
terbentuk yaitu 0,2% (v/v). Hal ini diduga pada
umumnya sayur dan buah yang masak mengandung
etanol secara alami. Sesuai dengan literatur Indrawati
et al (2009), menyatakan bahwa semakin masak sayur
dan buah, semakin tinggi kadar etanolnya namun masih
di bawah 1%. Dugaan ini diperkuat dengan data
statistik yang menyatakan bahwa pada hari ke-4 sampai
ke-8 dengan hari ke-0 sampai hari ke-2 termasuk dalam
grup yang sama (notasi h) berarti tidak berbeda nyata.
Seharusnya dalam kondisi tidak ada mikroba ini,
konversi gula reduksi tidak lebih besar dari kondisi
yang ditambahkan mikroba. Tetapi, pada Tabel 3
konversi gula reduksi pada konsentrasti inokulum 0%
tinggi yaitu 49,80%. Hal ini diduga karena etanol dari
sampah sayur dan buah tanpa penambahan Zymomonas
mobilis dengan pH 4 merupakan kondisi penggunaan
konversi gula reduksi dan air yang mendukung
terjadinya peristiwa fermentasi secara enzimatis yang
dihasilkan dalam sampah sayur dan buah. Dugaan ini
selaras dengan Yang et al (2009) yang menyatakan
0.00 0.10 0.20 0.20 0.30 2.70 4.40 6.60 2.30 5.00 9.50 9.10 0.00 2.40 5.40 9.40 9.20 0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 9.00 10.00 0 1 2 3 4 5 6 7 8 9 K ad ar e tan ol ( % )
Lama fermentasi (hari)
Inokulum 0% Inokulum 5% Inokulum 10% Inokulum 15%
bahwa pada kondisi alami tanpa penambahan bakteri,
gula reduksi cenderung terkonversi menjadi asetaldehid
dan beberapa metabolit lain.
Tabel 3. Rerata gula reduksi awal dan akhir pada medium fermentasi. Inokulum GR awal (%) GR akhir (%) Konversi GR (%) Kadar etanol pada fermentasi hari ke-8 0% 10,80 5,42 49,80 0,20 5% 10,80 5,96 44,81 6,60 10% 10,80 5,37 50,27 9,10 15% 10,80 5,63 47,87 9,20
Keterangan: GR=Gula Reduksi.
Konversi gula reduksi dapat menggambarkan
seberapa besar gula reduksi yang dapat dikonversi
menjadi etanol. Hasil yang didapat bahwa rata-rata
hasil konversi gula reduksi yang terkonversi menjadi
etanol masih tergolong rendah yaitu kurang dari 80%.
Pada kadar etanol tertinggi misalnya, sebesar 9,50%
(v/v), gula reduksi yang terkonversi hanya 50,27%.
Apabila dibandingkan dengan penelitian Sulfahri et al
(2011) menggunakan hidrolisis enzim komersial, pada
kadar etanol jam ke-120 sebesar 8,61% (v/v)
menggunakan konsentrasi inokulum 10%, didapatkan
konversi gula reduksi sebesar 87,88%.
Nilai konversi gula reduksi yang tidak seberapa
besar ini diduga karena menggunakan enzim kasar dari
kapang Aspergillus sp. yang tidak dimurnikan sehingga
kemungkinan juga mengandung enzim-enzim lain
seperti hemiselulase dengan hasil akhir xilosa (pentosa)
bukan glukosa (heksosa). Bakteri Zymomonas mobilis
hanya dapat memfermentasikan gula heksosa bukan
pentosa, sehingga hanya sebagian gula reduksi yang
terkonversi. Selain itu, Juhasz et al (2003) dalam
Safaria et al (2013) menyebutkan bahwa genus
Aspergillus, menghasilkan β-glukosidase tinggi namun
endoglukanase dan eksoglukanasenya rendah. Hal ini
dapat diduga kuat dengan adanya pengukuran aktivitas
enzim eksoglukanase dan β-glukosidase juga.
Peningkatan kadar etanol terjadi seiring dengan
waktu fermentasi yang semakin lama. Misalnya pada
konsentrasi inokulum 5%, sampai pada fermentasi hari
ke-8 menunjukkan grafik yang terus meningkat. Hal ini
diduga bahwa sampai pada hari ke-8, masih terdapat
nutrisi yang ditambahkan pada medium fermentasi
seperti yeast extract yang merupakan sumber nitrogen
untuk pertumbuhan Zymomonas mobilis (Garrity,
2005). Sehingga sel bakteri akan tumbuh dan
membelah secara eksponensial sampai jumlah yang
maksimal atau masih memasuki fase logaritma. Selain
itu, glukosa pada medium fermentasi sampai pada hari
ke-8 masih banyak, nilai konversi gula reduksinya
44,81%.
Proses fermentasi ini dapat terus berlangsung
dengan memanfaatkan glukosa sebagi sumber energi
dalam siklus glikolisis yang menghasilkan piruvat.
Kemudian katabolisme piruvat secara anaerob akan
menghasilkan etanol dan CO2. Maka, dimungkinkan
dengan konsentrasi inokulum 5%, akan didapatkan
kadar etanol yang lebih besar dengan waktu fermentasi
yang lebih lama, karena pada hari ke-8 hanya
dihasilkan kadar etanol 6,6% (v/v). Maka dapat
disimpulkan bahwa penggunaan konsentrasi inokulum
5% dalam skala produksi kurang efektif untuk produksi
etanol karena membutuhkan waktu fermentasi yang
lama. Hal ini diperkuat dengan data uji statistik yang
menyatakan bahwa konsentrasi inokulum 5% (notasi b)
berbeda nyata dengan konsentrasi 10 dan 15%.
Sedangkan pada konsentrasi inokulum 10% dan
15%, menunjukkan grafik peningkatan etanol di hari
0 sampai hari 6 kemudian menurun pada hari
ke-8. Penurunan kadar etanol terjadi di hari ke-8 diduga
selama fermentasi, gula reduksi telah habis digunakan
bakteri Zymomonas mobilis untuk dikonversi menjadi
etanol. Hal ini sesuai dengan Yudoamijoyo et al (1992)
yang menyatakan bahwa semakin banyak gula reduksi
yang dapat dimanfaatkan oleh sel, semakin tinggi juga
kadar etanol yang dihasilkan. Data nilai konversi gula
reduksi jika dibandingkan dengan inokulum 5%, jauh
lebih besar yaitu pada inokulum 10% (50,27%) dan
inokulum 15% (47,87%).
Selain itu, semakin lama waktu fermentasi,
maka nutrisi dalam medium semakin berkurang dengan
adanya jumlah sel yang semakin bertambah dapat
mengakibatkan kompetisi dan akhirnya akan memasuki
fase kematian. Akumulasi etanol hasil metabolisme
mikroorganisme menurut Wignyanto et al (2001) dapat
menghambat pembelahan dan aktivitas fermentasi sel,
yang mengakibatkan jumlah etanol sedikit. Hal ini
akan lebih kuat dugaannya bila didukung dengan
adanya data perhitungan jumlah sel bakteri Zymomonas
mobilis, seperti pada penelitian Chrisnawati et al
(2009) yang menyatakan bahwa laju pembentukan
etanol tertinggi dihasilkan pada jam ke-35 sebanyak
1,301 (g/L/jam) dengan jumlah biomassa 5,75 x 1010
sel/mL, sedangkan pada jam ke-40 jumlah biomassa
meningkat yaitu 5,9 x 1010 sel/mL dengan etanol yang
dihasilkan menurun 1,156 (g/L/jam).
Untuk mengetahui jumlah konsentrasi inokulum
dan lama waktu fermentasi yang tepat agar didapatkan
produksi etanol yang optimum dapat ditentukan dengan
melihat kadar etanol tertinggi pada Tabel 4. Kadar
etanol tertinggi pada konsentrasi inokulum 10%
dengan lama fermentasi 6 hari sebesar 9,50% (v/v).
Perlakuan yang sama dalam produksi etanol
menggunakan bakteri Zymomonas mobilis dari limbah
tomat optimum di hari ke-6 sebesar 9,68% (v/v)
(Faizah, 2012) dan dari jeruk juga optimum di hari
ke-6 sebesar 11,ke-64% (v/v) (Mushlihah, 2011). Proses yang
membedakan yaitu pada hidrolisisnya, penelitian
Faizah (2012) dan Mushlihah (2011) menggunakan
hidrolisis asam dan hidrolisis enzim komersial. Maka
dapat dikatakan bahwa hidrolisis enzim menggunakan
kapang Aspergillus sp. memiliki potensi yang sama
untuk produksi etanol. Bahkan hidrolisis enzim lebih
efektif digunakan pada substrat yang memiliki
kandungan selulosa seperti pada sampah sayur dan
buah dengan kerja enzim yang lebih spesifik.
Berdasarkan uji statistik dapat dilihat bahwa
konsentrasi inokulum10% dan 15% tidak berbeda
nyata (notasi a). Namun, untuk skala produksi
menggunakan konsentrasi inokulum 15% kurang
efektif, karena hasil etanol yang dihasilkan pada hari
ke-6 (9,40%) dan ke-8 (9,20%) (notasi ab) tidak
berbeda nyata sekali dengan etanol tertinggi 9,50% di
hari ke-6 dengan konsentrasi inokulum 10% (notasi a).
Sehingga dapat disimpulkan bahwa jika dengan
konsentrasi inokulum 10% saja sudah dihasilkan etanol
tertinggi, maka tidak perlu lagi digunakan inokulum
15% yang membuat semakin tidak efisien. Bahkan
menurut Gibbson et al (1986), penggunaan konsentrasi
inokulum yang terlalu tinggi dapat menyebabkan
pengurangan viabilitas sel.
Bakteri Zymomonas mobilis dapat menghasilkan
etanol karena mampu menguraikan glukosa, fruktosa
atau sukrosa sebagai sumber karbon melalui jalur
metabolik Entner-Doudoroff. Jalur metabolisme ini
hanya menghasilkan 1 mol ATP tiap mol glukosa atau
fruktosa, sehingga Zymomonas mobilis menguraikan
glukosa dengan kecepatan tinggi supaya menghasilkan
cukup energi untuk pertumbuhannya. Oleh karena
hanya menghasilkan satu molekul ATP, maka
Zymomonas mobilis harus menguraikan glukosa
dengan cepat untuk memenuhi kebutuhan ATP. Hasil
bersih dari jalur Entner-Doudoroff ini adalah etanol
dan CO2.
Garrity (2005) menjelaskan bahwa organisme
yang menggunakan jalur Entner-Doudoroff tidak
memiliki enzim phosphofructokinase, sehingga pada
tahap glikolisis, glukosa 6-fosfat tidak dirubah menjadi
fruktosa fosfat tetapi diubah menjadi
6-fosfoglukonat. Enzim yang dimiliki organisme yang
menggunakan jalur Entner-Doudoroff dan tidak
dimiliki organisme yang menggunakan jalur
Embden-Mayerhoff adalah 6-phosphogluconate dehydratase dan
2-keto-3-deoxy-6-phosphogluconate aldolase sehingga
tahapan dari glukosa ke piruvat dan menjadi etanol
jauh lebih singkat. Selain itu, dalam penelitian Riyanti
(2010) menyebutkan bahwa adanya gen pdc dan adh
inilah yang terbukti berperan penting dalam produksi
bioetanol pada bakteri mesofilik Zymomonas mobilis
ZM4. Gen-gen kunci yang bertanggung jawab dalam
produksi bioetanol adalah pdc dan adh. Piruvat
dekarboksilase (PDC) merupakan enzim yang
mengkatalis piruvat secara irreversible menjadi
asetaldehid dan CO2, selanjutnya enzim alkohol
dehidrogenase (ADH) akan mengkatalis asetaldehida
menjadi etanol.
IV.
KESIMPULAN
Berdasarkan hasil penelitian dapat disimpulkan
bahwa kapang Aspergillus sp. berpotensi menghasilkan
enzim selulase dalam proses hidrolisis untuk produksi
etanol dari sampah sayur dan buah Pasar Wonokromo
Surabaya dengan nilai aktivitas enzim endoglukanase
sebesar 14,477 Unit/ml. Potensi kapang Aspergillus sp.
dalam proses hidrolisis enzim dapat dilihat dari kadar
etanol tertinggi yang terbentuk yaitu 9,5% (v/v)
dihasilkan pada interaksi konsentrasi inokulum 10%
dan lama waktu fermentasi 6 hari.
Sebaiknya untuk penelitian selanjutnya, proses
hidrolisis enzim juga dapat menggunakan lebih dari
dua jenis kapang untuk dapat mengkonversi selulosa
menjadi glukosa lebih optimal dengan pemurnian
enzim dan diukur aktivasi enzim baik endoglukanase,
eksoglukanase maupun β-glukosidasenya. Pengukuran
kadar gula reduksi disarankan untuk dianalisa HPLC
agar dapat dibedakan jenis gula pereduksinya.
Sedangkan pada fermentasi akan lebih baik apabila
disertai dengan pengukuran jumlah sel bakteri
Zymomonas mobilis, sehingga dapat mendukung
adanya berbagai kemungkinan hasil yang terjadi
berkaitan dengan kadar etanol yang terbentuk dan
penggunaan variasi konsentrasi inokulum bisa dicari
rentang yang lebih luas.
DAFTAR PUSTAKA
Achmadi. 1989. Kimia Kayu Diktat PAU Ilmu Hayati. Institut Pertanian Bogor: Bogor.
Adham. 2001. Attempt at Improving Citric Acid Fermentation by Aspergillus niger in Beet-Molasses. Biosource Technology 97-100.
Agus, S. 1995. Kajian Pengaruh Agitasi Mekanik Terhadap Produksi Pektinase Pada Fermentasi Terendam Buah Kako Oleh Aspergillus niger. Laporan Tugas Akhir (S1). Fakultas Teknik Pertanian. IPB: Bogor.
Ang, S.H., Cheng, P.S., Lim, E.A.C and Tambyah, S.K. 2001. Spot The Difference: Consumer Responses Towards Counterfeits. Journal of Consumer Marketing, Vol. 18 No. 3.
Anindyawati, Trisanti. 2009. Prospek Enzim dan Limbah Lignoselulosa Untuk Produksi Bioetanol. Pusat Penelitian Bioteknologi-LIPI: Cibinong.
Anonymous. 2012. Pasar Wonokromo. www.siskaperbapo.com. [25 September 2012].
Artati, Enny K., A. Effendi dan T. Haryanto. 2009. Pengaruh Konsentrasi Larutan Pemasak Pada Proses Delignifikasi Eceng Gondok Dengan Proses Organosolv. Ekuilibrium Vol.8 No.1.
Axelsson, Josefin. 2011. Separate Hydrolysis and Fermentation of Pretreated Spruce. Thesis. Department of Physics, Chemistry and Biology Linkoping University: Sweden.
Brodeur, J. C. 2011. Reduced Body Condition and Enzymatic Alterations in Frogs Inhabiting Intensive Crop Production Areas. Ecotoxicologyoik & Envtl. Safety: No.74, 1370-1380.
Buckle, Kenneth A., Edwards, Ronald A., Fleet, Graham H., and Wootton, Michael. 1987. Ilmu Pangan. Universitas Indonesia Press: Jakarta.
Budiono. 1996. Produksi Etanol Oleh Saccharomyces cerevisiae dengan Perendaman Tapioka Dalam HCl. Laporan Tugas Akhir (S1). Jurusan Kimia. FMIPA-ITS: Surabaya.
Busche R.M., Scott C. D., Davison B.H., Lynd L.R. 1992. Etanol, The Ultimate Feedstock. A Technoeconomic Evaluation of Etanol Manufacture in Fluidized Bed Bioreactors Operating With Immobilized Cells. Journal Application of Biochemistry and Biotechnology Vol.34/35 No. 395-415.
Cappuccino, James. G. And Natalie Sherman. 2011. Mocrobiology A Laboratory Manual. Benjamin Cummings: Amsterdam.
Campbell, Neil A. 2002. Biologi Edisi Kelima Jilid 1. Erlangga: Surabaya.