Materi :
ABSORBSI CO2 DENGAN LARUTAN NaOH
Oleh :
Alfiyanti NIM. 21030113120071
Andika Eko Mahendro NIM. 21030113140179 Nabila Rahmanastiti NIM. 21030113140177
LABORATORIUM PROSES KIMIA
JURUSAN TEKNIK KIMIA FAKULTAS TEKNIK UNIVERSITAS DIPONEGORO
SEMARANG 2015
HALAMAN PENGESAHAN
LAPORAN RESMI PRAKTIKUM PROSES KIMIA
Nama/NIM : Alfiyanti / 21030113120071
Nama/NIM : Andika Eko Mahendro / 21030113140179 Nama/NIM : Nabila Rahmanastiti / 21030113140177 Judul : Absorbsi CO2 dengan Larutan NaOH
Semarang, 28 Mei 2015 Telah Menyetujui,
Asisten Pembimbing
Vicky Kartika Firdaus NIM.21030112130146 Dosen Pembimbing
Dr. Andri Cahyo Kumoro, ST., MT. NIP. 197405231998021001
PRAKATA
Puji sukur dihaturkan kepada tuhan yang maha esa, atas karena limpahan rahmat dan hidayahnya laporan resmi dengan judul “Absorbsi CO2 dengan Larutan NaOH”, dapat diselesaikan dengan tanpa suatu halangan apapun. Laporan resmi ini disusun untuk memenuhi tugas mata kuliah praktikum proses kimia. Terciptanya laporannya ini tentunya dengan bantuan dan doa dari seluruh pihak yang bersangkutan oleh karena itu diucapkan terimakasih kepada :
1. Dr. Andri Cahyo Kumuro, ST.,MT. Selaku dosen pembimbing materi Absorbsi CO2 dengan Larutan NaOH.
2. Donny Ridwan Prihadi dan Vicky Kartika Firdaus selaku assisten pembimbing materi Absorbsi CO2 dengan Larutan NaOH.
3. Seluruh jajaran asisten Laboratorium Proses Kimia yang telah meluangkan waktunya untuk membimbing selama praktikum.
4. Teman-teman angkatan 2013 yang tentunya selalu mendukung dan memberi semangat.
Tersusunya laporan resmi ini tentunya masih sangat jauh dari kata sempurna maka dari itu saran dan kritik yang membangun dari pembaca sangat diharapkan.
Semarang, 29 Mei 2015
DAFTAR ISI
HALAMAN PENGESAHAN... ii PRAKATA... iii DAFTAR ISI... iv DAFTAR GAMBAR...v DAFTAR TABEL...vi INTISARI... vii SUMMARY... viii BAB I PENDAHULUAN I.1 LATAR BELAKANG...1I.2 TUJUAN PERCOBAAN...2
I.3 MANFAAT PERCOBAAN...2
BAB II TINJAUAN PUSTAKA...3
II.1 PENGERTIAN ABSORBSI...3
II.2ANALISIS PERPINDAHAN MASSA DAN REAKSI DALAM PROSES ABSORBSI GAS OLEH CAIRAN...4
BAB III RANCANGAN PERCOBAAN III.1BAHAN DAN ALAT YANG DIGUNAKAN ...8
III.2VARIABEL OPERASI...9
III.3RESPON UJI HASIL...9
III.4PROSEDUR PERCOBAAN...9
BAB IV HASIL PERCOBAAN DAN PEMBAHASAN IV.1HASIL PERCOBAAN...11 IV.2 PEMBAHASAN...12 BAB V PENUTUP V.1 KESIMPULAN...16 V.2 SARAN...16 DAFTAR PUSTAKA...17
DAFTAR GAMBAR
Gambar 2.1.Proses absorpsi dan desorpsi CO2 dengan pelarut MEA di pabrik Amonia...3
Gambar2.2.Mekanismeabsorpsi gas CO2dalamlarutanNaOH...4
Gambar 3.1 Rangkaian Alat Utama Praktikum Absorbsi...8
Gambar 4.1 Grafik Hubungan Laju Alir NaOH terhadap Jumlah Mol CO2 Terserap…….. 12
Gambar 4.2 Grafik Hubungan Laju Alir NaOH Vs Kga...12
Gambar 4.3 Grafik Hubungan Laju Alir NaOH Vs KLa...13
Gambar 4.4 Grafik Hubungan Laju Alir NaOH Vs k2...14
DAFTAR TABEL
Tabel 4.1 Tabel 4.1 Data Hasil CO2 Terserap pada Berbagai Laju Alir NaOH ...11 Tabel 4.2 Data Nilai Kga, KLa, Dan k2...11
INTISARI
Absorbsi merupakan salah satu proses separasi dalam industri kimia dimana suatu campuran gas dikontakkan dengan suatu cairan penyerap tertentu sehingga satu atau lebih komponen gas tersebut larut dalam cairannya. Dalam percobaan ini digunakan larutan NaOH sebagai cairan penyerap untuk mengabsorbsi gas CO2 dan packing tower sebagai alat absorbsi dengan packing jenis rashig rings berdiameter 1 inchi.
Pada percobaan ini digunakan variabel konsentrasi larutan NaOH yaitu 0,5 N. Larutan NaOH dipompa dan diumpankan pada bagian atas menara pada konsentrasi yang telah ditetapkan dan laju alir 1L/menit, 1,25L/menit dan 1,5L/menit. Sementara itu gas CO2 dialirkan pada bagian bawah kolom. Gas dan cairan akan saling kontak sehingga terjadi reaksi. Lalu, mengambil 10 ml sampel tiap selang waktu 1 menit untuk dititrasi dengan metode acidi alkalimetri untuk menentukan kandungan karbonat dalam larutan sampel tersebut.
Dari hasil percobaan, semakin besar laju reaksi NaOH maka CO2 yang terserap semakin sedikit. Semakin besar laju alir NaOH, baik harga kLa maupun kGa semakin besar pula. Dan pada percobaan kami, terjadi peningkatan nilai tetapan reaksi antara CO2 dan NaOH (k2) yang disebabkan karena jumlah CO2 yang terserap banyak.
Kesimpulan dari percobaan kami yaitu semakin besar laju alir NaOH maka semakin sedikit jumlah CO2 yang terserap, semakin besar koefisien perpindahan massa, dan semakin besar konstanta kecepatan reaksi antara NaOH dengan CO2. Saran untuk percobaan ini adalah pembuatan larutan NaOH lebih baik dilakukan dengan konsentrasi tinggi, setelah sisa baru diencerkan untuk variable konsentrasi selanjutnya agar tidak boros reagen.Laju alir CO2 sebaiknya dijaga agar tidak terlalu besar sehingga pengeluaran CO2 dapat diminimalisir.
SUMMARY
Absorption is one of the separation processes in the chemical industry where a gas mixture is contacted with a liquid absorbent so that one or more specific components of the gas dissolved in the liquid. In this experiment NaOH solution is used as a liquid absorbent to absorb CO2 and as a means of absorption tower packing with packing types rashig 1 inch diameter rings.
In this experiment used a variable concentration of 0.5 N NaOH solution NaOH solution was pumped and fed to the top of the tower at a predetermined concentration and flow rate of 1L / min, 1,25L / minute and 1,5L / min. While the CO2 gas flowed at the bottom of the column. Gas and liquid contact each other, causing the reaction. Then, take a 10 ml sample of each interval of 1 minute to titrated with alkalimetry acidi method for determining the carbonate content in the sample solution.
From the experimental results, the greater the rate of reaction of CO2 absorbed NaOH then less and less. The greater the flow rate of NaOH, both KLA and KGA price greater. And in our experiments, an increase in the value of constant reaction between CO2 and NaOH (k2) which is due to the amount of CO2 absorbed a lot.
The conclusion from our experiments that the greater the flow rate of NaOH then the less the amount of CO2 absorbed, the greater the mass transfer coefficient, and the greater the reaction rate constants between NaOH with CO2. Suggestions for this experiment is the manufacture of NaOH solution is better done with a high concentration, after a new residual variable diluted for further concentration in order not extravagant reagen.Laju CO2 flow should be maintained so as not too big so that expenditure can be minimized CO2.
BAB I
PENDAHULUAN
I.1 Latar Belakang
Hampir semua reaksi kimia yang diterapkan dalam industri kimia melibatkan bahan baku yang berbeda wujudnya, baik berupa padatan, gas maupun cairan. Oleh karena itu, reaksi kimia dalam suatu industri dapat terjadi dalam fase ganda atau heterogen, misalnya biner atau bahkan tersier (Coulson, 1996). Walaupun terdapat perbedaan wujud pada bahan-bahan baku yang direaksikan, namun terdapat satu fenomena yang selaluterjadi. Sebelum reaksi kimia berlangsung. Makasalah satu atau lebih bahan baku (reaktan) akan berpindah dari aliran utamanya menuju kelapisan antarfase/batas atau menuju aliran utama bahan baku yang lain yang berada di fase yang berbeda.
Absorpsi gas-cair merupakan proses heterogen yang melibatkan perpindahan komponen gas yang dapat larut menuju penyerap yang biasanya berupa cairan yang tidak mudah menguap (Franks, 1967). Reaksi kimia dalam proses absorpsi dapat terjadi di lapisan gas, lapisan antar fase, lapisan cairan atau bahkan badan utama cairan, tergantung pada konsentrasi dan reaktifitas bahan-bahan yang direaksikan. Untuk memfasilitasi berlangsungnya tahapan-tahapan proses tersebut, biasanya proses absorpsi dijalankan dalam reactor tangki berpengaduk bersparger, kolom gelembung (bubble column) atau kolom yang berisi tumpukan partikel inert (packed bed column). Proses absorpsi gas-cair dapat diterapkan pada pemurnian gas sintesis, recovery beberapa gas yang masih bermanfaat dalam gas buang atau bahkan pada industri yang melibatkan pelarutan gas dalam cairan, seperti H2SO4, HCl, HNO3, formadehid dll (Coulson, 1996). Absorpsi gas CO2 dengan larutan hidroksid yang kuat merupakan proses absorpsi yang disertai dengan reaksi kimia order 2 antara CO2 dan ion OH- membentuk ion CO32- dan H2O. Sedangkan reaksi antara CO2 dengan CO32- membentuk ion HCO3- biasanya diabaikan (Danckwerts, 1970; Juvekardan Sharma, 1972). Namun, menurut Rehm et al. (1963) proses inijuga biasa dianggap mengikuti reaksi order 1 jika konsentrasi larutan NaOH cukup rendah (encer).
Perancangan reaktor kimia dilakukan berdasarkan pada permodelan hidrodinamika reaktor dan reaksi kimia yang terjadi di dalamnya. Suatu model matematika merupakan bentuk penyederhanaan dari proses sesungguhnya di dalam sebuah reaktor yang biasanya sangat rumit (Levenspiel, 1972). Reaksi kimia biasanya dikaji dalam suatu proses batch
berskala laboratorium dengan mempertimbangkan kebutuhan reaktan, kemudahan pengendalian reaksi, peralatan, kemudahan menjalankan reaksi dan analisis, dan ketelitian.
I.2 Perumusan Masalah
1. Bagaimana pengaruh laju alir NaOH (atau CO2) terhadap jumlah CO2 yang terserap pada berbagai waktu reaksi ?
2. Bagaimana pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan perpindahan massa CO2 (kGa) ?
3. Bagaimana pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan reaksi antara CO2 dan NaOH (k2) ?
4. Bagaimana hubungan CO2 yang terserap terhadap waktu ? I.1 Tujuan Percobaan
Setelah melakukan percobaan ini, mahasiswa mampu menjelaskan mengenai beberapa hal berikut:
1. Pengaruh laju alir NaOH (atau CO2) terhadap jumlah CO2 yang terserap pada berbagai waktu reaksi.
2. Pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan perpindahan massa CO2 (kGa).
3. Pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan reaksi antara CO2 dan NaOH (k2).
4. Hubungan CO2yang terserap terhadap waktu 1.4 Manfaat Percobaan.
1. Mengetahui pengaruh laju alir NaOH (atau CO2) terhadap jumlah CO2 yang terserap pada berbagai waktu reaksi.
2. Mengetahui pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan perpindahan massa CO2 (kGa).
3. Mengetahui pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan reaksi antara CO2 dan NaOH (k2).
a b so rb e r st rip p e r
BAB II
TINJAUAN PUSTAKA
II.1 Pengertian Absorbsi
Absorbsi merupakan salah satu proses separasi dalam industri kimia dimana suatu campuran gas dikontakkan dengan suatu cairan penyerap tertentu sehingga satu atau lebih komponen gas tersebut larut dalam cairannya. Absorbsi dapat terjadi melalui dua mekanisme, yaitu absorbsi fisik dan absorbsi kimia.
Absorbsi fisik merupakan suatu proses yang melibatkan peristiwa pelarutan gas dalam larutan penyerap, namun tidak disertai dengan reaksi kimia. Contoh proses ini adalah absorbsi gas H2S dengan air, methanol, propilen karbonase. Penyerapan terjadi karena adanya interaksi fisik. Mekanisme proses absorbsi fisik dapat dijelaskan dengan beberapa model, yaitu: teori dua lapisan (two films theory) oleh Whiteman (1923), teori penetrasi oleh Dankcwerts dan teori permukaan terbaharui.
Absorbsi kimia merupakan suatu proses yang melibatkan peristiwa pelarutan gas dalam larutan penyerap yang disertai dengan reaksi kimia. Contoh peristiwa ini adalah absorbsi gas CO2 dengan larutan MEA, NaOH, K2CO3 dan sebagainya. Aplikasi dari absorbsi kimia dapat dijumpai pada proses penyerapan gas CO2 pada pabrik Amonia seperti yang terlihat pada gambar 2.1
Gambar 2.1.Proses absorpsi dan desorpsi CO2 dengan pelarut MEA di pabrikAmonia
Proses absorpsi dapat dilakukan dalam tangki berpengaduk yang dilengkapi dengan sparger, kolom gelembung (bubble column), atau dengan kolom yang berisi packing yang inert
Gas bulk flow pg
pai A*
Liq. bulk flow Gas film
Liq. film
(packed column) atau piringan (tray column). Pemilihan peralatan proses absorpsi biasanya didasarkan pada reaktifitas reaktan (gas dan cairan), suhu, tekanan, kapasitas, dan ekonomi.
II.2 Analisis Perpindahan Massa dan Reaksi dalam Proses Absorpsi Gas oleh Cairan. Secara umum, proses absorpsi gas CO2 kedalam larutan NaOH yang disertai reaksi kimia berlangsung melalui empat tahap, yaitu perpindahan massa CO2 melalui lapisan gas menuju lapisan antarfase gas-cairan, kesetimbangan antara CO2 dalam fase gas dan dalam fase larutan, perpindahan massa CO2 dari lapisan gas ke badan utama larutan NaOH dan reaksi antara CO2 terlarut dengan gugus hidroksil (OH-). Skema proses tersebut dapat dilihat pada Gambar 2.2.
Gambar2.2.Mekanismeabsorpsi gas CO2dalamlarutanNaOH Laju perpindahan massa CO2 melalui lapisan gas:
)
(pg pai
kga
Ra
(1)
Kesetimbangan antara CO2 dalam fase gas dan dalam fase larutan :
pai H A* .
(2)
Laju perpindahan massa CO2 dari lapisan gas ke badan utama larutan NaOH dan reaksi antara CO2 terlarut dengan gugus hidroksil :
] .[ . *] [ 2 A a D k OH Ra A (3) Kedaanbatas: (a) 1 ] .[ . 2 L A k OH k D (b) B A L A D D A z OH k OH k D * . ] [ ] .[ . 2
dengan z adalah koefisien reaksi kimia antara CO2 dan [OH-}, yaitu = 2.
Di fase cair, reaksi antara CO2 dengan larutan NaOH terjadi melalui beberapa tahapan proses : NaOH (s) Na+ (l) + OH- (l) (a)
CO2 (g) CO2 (l) (b)
CO2 (l) + OH- (l) HCO3- (l) (c) HCO3- (l) + OH- (l) H2O (l) + CO32- (l) (d) CO32- (l) + Na+ (l) Na2CO3(l) (e)
Langkah d dan e biasanya berlangsung dengan sangat cepat, sehingga proses absorpsi biasanya dikendalikan oleh peristiwa pelarutan CO2 ke dalam larutan NaOH terutama jika CO2 diumpankan dalam bentuk campuran dengan gas lain atau dikendalikan bersama-sama dengan reaksi kimia pada langkah c (Juvekar dan Sharma, 1973).
Eliminasi A *dari persamaan 1, 2 dan 3 menghasilkan :
Ga A A k OH k D H a OH k D pg H a Ra ] .[ . . . 1 ] .[ . . . . 2 2 (4)
Jika nilai kL sangat besar, maka: 1 ] .[ . 2 L A k OH k D
, sehingga persamaan di atas menjadi:
Ga L A L A k k OH k D H a k OH k D pg H a Ra 2 2 2 2 ] .[ . . . 1 ] .[ . . . . (5)
Jika keadaan batas (b) tidak dipenuhi, berarti terjadi pelucutan [OH-] dalam larutan. Hal ini berakibat: B A L A D D A z OH k OH k D * . ] [ ] .[ . 2 (6)
Dengan demikian, maka laju absorpsi gas CO2 ke dalam larutan NaOH akan mengikuti persamaan: Ga L L k k H a k pg H a Ra . . . 1 . . . . (7)
Dengan adalah enhancement faktor yang merupakan rasio antara koefisien transfer massa CO2 pada fase cair jika absorpsi disertai reaksi kimia dan tidak disertai reaksi kimia seperti dirumuskan oleh Juvekar dan Sharma (1973):
2 / 1 2 * . ] [ . * . ] [ 1 . ] .[ . A B A B L A D D A z OH D D A z OH k OH k D (8)
Nilai diffusivitas efektif (DA) CO2 dalam larutan NaOH pada suhu 30oC adalah 2,1 10-5
cm2/det (Juvekardan Sharma, 1973).
Nilai kGa dapat dihitung berdasarkan pada absorbsi fisik dengan meninjau
di dalam alat absorpsi. Dalam bentuk bilangan tak berdimensi, kGa dapat dihitung menurut
persamaan (Kumoro dan Hadiyanto, 2000):
3 / 1 2 2 4003 , 1 2 2 2 2 . . . 0777 , 4 . A CO CO CO CO CO A Ga D a Q D dp k (9) Dengan dp a 6(1) dan VT Vvoid
Secara teoritik, nilai kGa harus memenuhi persamaan :
. . . . ) ( . . . . ) , ( 2 32 lm lm GA p Z A CO mol p Z A liq CO mol k (10)
Jika tekanan operasi cukup rendah, maka plmdapat didekati dengan p = pin-pout.
Sedangkan nilai kla dapat dihitung secara empirik dengan persamaan (Zheng dan and Xu,
1992): 5 , 0 3 , 0 . . . 2258 , 0 . A NaOH NaOH A la D a Q D dp k (11)
Jika laju reaksi pembentukan Na2CO3 jauh lebih besar dibandingkan dengan laju difusi CO2 ke dalam larutan NaOH, maka konsentrasi CO2 pada batas film cairan dengan badan cairan adalah nol. Hal ini disebabkan oleh konsumsi CO2 yang sangat cepat selama reaksi sepanjang film. Dengan demikian, tebal film (x) dapat ditentukan persamaan:
T R CO mol p p D x A in out . ). ( ) .( 2 3 (12)
manometer
BAB III
RANCANGAN PERCOBAAN
III.1. BahandanAlat yang Digunakan 1. Bahan yang digunakan
a. Kristal Natrium Hidroksida (NaOH) : 0,5 N 18 Liter b. Gas Karbondioksida (CO2) : 6 bar
c. Udara
d. Aquadest (H2O) : 18 liter
e. larutan HCl : 0,2 N
f. Indikator PP dan MO. : @2 tetes
2. Alat yang digunakan
Gambar 3.1 Rangkaian Alat Utama Praktikum Absorbsi
III.2. Variabel Operasi a. Variabel Tetap
• Tekanan CO2 : 6 bar
• Suhu : 30 °C
• Konsentrasi NaOH : 0,5 N b. Variabel Berubah
• LajuAlirNaOH : 1L/menit, 1,25L/menit, 1,5L/menit
III.3. Respon Uji Hasil
Konsentrasi ion CO32- dalam larutan sampel dan CO2 yang terserap
III.4. Prosedur Percobaan
Pertama yang kami lakukan adalah menimbang 216 gr kristal NaOH dan melarutkannya ke dalam 18 liter aquadest. Kemudian kami menampung larutan NaOH yang sudah homogen tersebut ke dalam bak penampung, untuk segera dioperasikan. 2. Menentukan fraksi ruang kosong pada kolom absorpsi
Memastikan semua kran dalam kondisi terturup. Menyalakan pompa sehingga NaOH mengalir dari bak penampung 1 ke bak penampung 2. Kemudian mengalirkan NaOH ke dalam reaktor packing bed sampai tingginya setinggi tumpukan packing. Mengeluarkan cairan dalam packing dan mencatat volumenya sebagai volume ruang kosong dalam packing. Menghitung volume total kolom absorbsi dengan mengukur tinggi dan diameter kolom. Setelah itu menghitung fraksi ruang kosong kolom absorbsi.
3. Operasi Absorpsi
Memompa NaOH 0,5 N dan diumpankan ke dalam kolom melalui bagian atas kolom pada laju alir sesuai dengan variabel, hingga keadaan steady state tercapai. Mengalirkan gas CO2 melalui bagian bawah kolom, serta mengukur ketinggian cairan dalam manometer jika aliran sudah steady state. Kemudian mengambil 10 ml cairan dari dasar kolom absorbsi setiap 1 menit selama 10 menit dan menganalisis kadar ion karbonat atau kadar NaOH bebasnya. Kemudian melakukan kembali operasi absorbsi di berbagai variabel laju alir NaOH.
4. Menganalisis sampel
Menuang 10 ml cairan yang telah diambil tadi kedalam erlenmeyer. Menambahkan indikator fenolpthalein (PP) sampai warna cairan menjadi merah jambu, dan menitrasi cairan tersebut menggunakan larutan HCl 0,2N yang telah dibuat sebelumnya hingga warna menjadi merah hampir hilang. Mencatat kebutuhan titran. Menambahakan 2-3 tetes indikator Metil Orange (MO) , dan menitrasi kembali menggunakan HCl hingga warna jingga berubah menjadi merah. Mencatat kebutuhan titran.
BAB IV
HASIL PERCOBAAN DAN PEMBAHASAN
IV.2.1. Hasil Percobaan
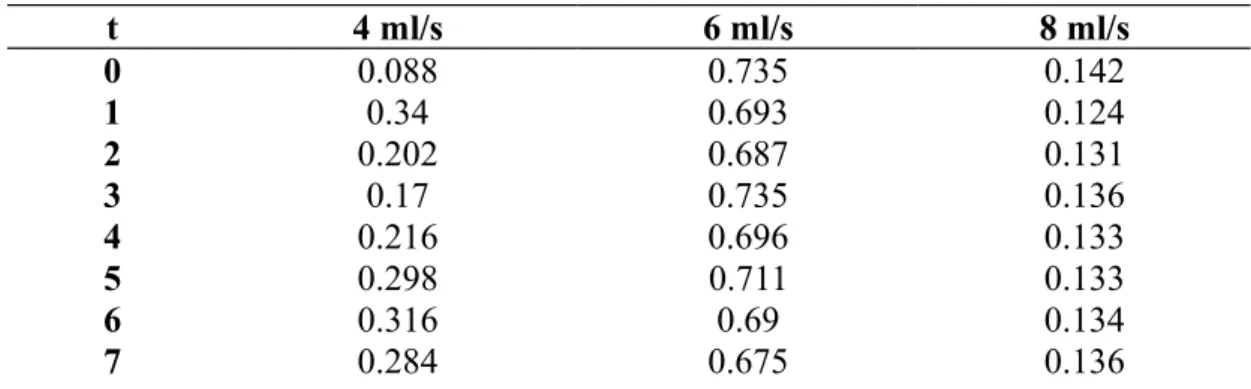
Tabel 4.1 Data Hasil CO2 Terserap pada Berbagai Laju Alir NaOH
t 4 ml/s 6 ml/s 8 ml/s 0 0.088 0.735 0.142 1 0.34 0.693 0.124 2 0.202 0.687 0.131 3 0.17 0.735 0.136 4 0.216 0.696 0.133 5 0.298 0.711 0.133 6 0.316 0.69 0.134 7 0.284 0.675 0.136
8 0.276 0.666 0.132
9 0.292 0.78 0.132
10 0.298 0.69 0.134
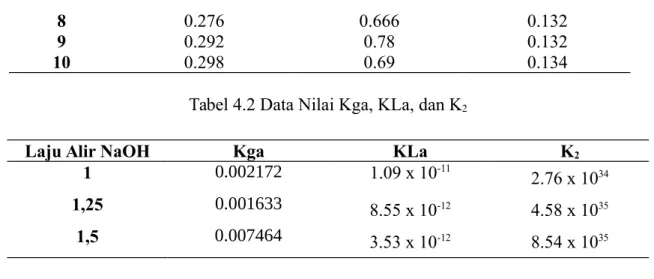
Tabel 4.2 Data Nilai Kga, KLa, dan K2
Laju Alir NaOH Kga KLa K2
1 0.002172 1.09 x 10-11
2.76 x 1034
1,25 0.001633 8.55 x 10-12 4.58 x 1035
1,5 0.007464 3.53 x 10-12 8.54 x 1035
IV.2.2. Pembahasan
IV.2.1. Pengaruh Laju Alir NaOH Terhadap Jumlah CO2 Yang Terserap
1 1.25 1.5 0 0.2 0.4 0.6 0.8 1
laju alir NaOH (L/menit) mol CO2 yang terabsorbsi
Gambar 4.1 Grafik Hubungan Laju Alir NaOH terhadap Jumlah Mol CO2 Terserap Gambar 4.1 menunjukkan banyaknya mol CO2 rata-rata yang terserap pada proses absorbs CO2 dengan NaOH pada 3 laju alir yang berbeda. Pada laju alir 1L/menit jumlah CO2 rata-rata yang terserap yaitu 0.8684 mol, pada laju alir NaOH 1,25L/menit jumlah CO2 rata-rata yang terserap yaitu 0.6529 mol, dan pada laju alir NaOH 1,5L/menit jumlah CO2 rata-rata yang terserap yaitu 0.2984 mol.
Dari gambar 4.1 dapat disimpulkan, semakin besar laju alir maka jumlah mol CO2 yang terserap justru menurun.Hal ini dikarenakan pada operasi absorbsi dengan laju alir besar, waktu kontak antara NaOH dengan CO2 untuk jumlah molekul yang sama akan
semakin kecil. Waktu kontak yang singkat ini menyebabkan transfer massa yang terjadi lebih sedikit dan jumlah CO2 yang terserap juga lebih sedikit (Fuad dan Januar, 2009).
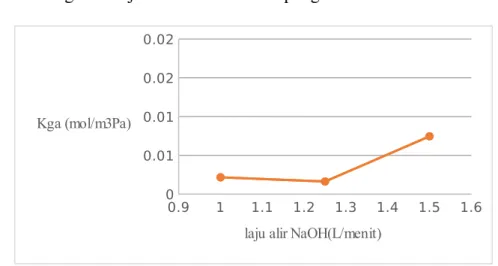
IV.2.2. Pengaruh Laju Alir NaOH terhadap Kga
0.9 1 1.1 1.2 1.3 1.4 1.5 1.6 0 0.01 0.01 0.02 0.02
laju alir NaOH(L/menit) Kga (mol/m3Pa)
Gambar 4.2 Grafik Hubungan Laju Alir NaOH vs Kga
Seperti terlihat pada Gambar 4.2 nilai Kga untuk variabel dengan laju alir NaOH 1 mL/s adalah 0.0022 mol/m3 Pa, pada laju alir NaOH 1,25L/menit nilai Kga sebesar 0.0016 mol/m3 Pa, sedangkan pada kondisi laju alir NaOH 1,5L/menit nilai Kga sebesar 0.0075 mol/m3 Pa.
Pada percobaan kami terjadi kontak antara gas CO2 dan penyerap basa yaitu NaOH pada absorber, maka proses ini termasuk dalam absorbsi kimia, di mana gas terlarut dalam larutan penyerap disertai dengan adanya reaksi kimia. Absorbsi kimia mempengaruhi peningkatan koefisien perpindahan massa (Kga) disebabkan oleh cepatnya laju transfer massa sebagai akibat beda CO2 di fase larutan yang cukup besar. Pada Gambar 4.2 dapat disimpulkan bahwa semakin besar laju aliran NaOH maka nilai tetapan perpindahan massa CO2 semakin besar. Hal ini dapat terjadi karena semakin tinggi laju alir cairan, maka kontak fase antara gas dengan cairan menjadi bertambah, sehingga jumlah gas yang dapat berpindah dari fase gas ke fase cairan juga semakin besar (Kumoro dan Hadiyanto, 2000).
0.9 1 1.1 1.2 1.3 1.4 1.5 1.6 0 2 4 6 8 10 12
laju alir NaOH(L/menit) KLa x 1012 (mol/m3Pa)
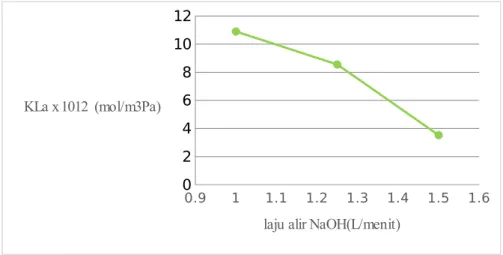
Gambar 4.3 Grafik Hubungan Laju Alir NaOH Vs KLa
Gambar 4.3 Hubungan laju alir terhadap nilai Kla (tetapan perpindahan massa) Dari Gambar 4.3 dapat diketahui nilai Kla untuk variabel dengan laju alir NaOH 1L/menit adalah 1.09x10-11, pada laju alir NaOH 1,25L/menit nilai Kla adalah sebesar 8.55x10-12, sedangkan pada kondisi laju alir NaOH 1,5L/menit nilai Kla sebesar 3.53x10-12
Pada percobaan yang telah kami lakukan, didapatkan nilai KLa menunjukkan penurunan. Penurunan KLa disebabkan oleh CO2 difase larutan banyak sehingga seolah-olah homogen difase cair. Selain itu aliran pada packed column belum mencapai keadaan steady, sehingga mempengaruhi kontak antara gas CO2 dengan larutan NaOH didalam packed column (Rizky dan Yuli, 2009)
IV.2.4. Pengaruh Laju Alir NaOH terhadap K2
0.9 1 1.1 1.2 1.3 1.4 1.5 1.6 0 10 20 30 40 50 60 70 80 90
laju alir NaOH (L/menit) K2 (mol/m3Pa)
Gambar 4.4 Grafik Hubungan Laju Alir NaOH vs K2
Dari gambar diatas dapat dilihat hubungan antara laju alir NaOH dengan nilai k2. Pada laju alir 1L/menit nilai k2 yang diperoleh adalah 2.76x1034mol/m3 Pa, sedangkan pada laju alir 1,25L/menit nilai k2 adalah 4.58x1035mol/m3 Pa, dan pada laju alir 1,5L/menit nilai K2 meningkat menjadi 8.54x1035 mol/m3 Pa.
Dilihat dari Gambar 4.4 nilai k2 semakin meningkat seiring bertambahnya kecepatan laju alir NaOH. Hal ini terjadi dikarenakan dengan bertambahnya laju alir NaOH maka akan menyebabkan terjadinya aliran turbulen yang menyebabkan molekul fluida bergerak kesegala arah dan menimbulkan tumbukan antar partikel yang semakin membesar. Disini kondisi steady sudah tercapai, dimana jumlah CO2 yang terserap oleh larutan NaOH jumlah nya sudah konstan. Hubungan antara faktor tumbukan dengan harga k2 dapat digambarkan melalui rumus Arrhenius :
k =A e −E RT
Dimana :
k = nilai konstanta kecepatan reaksi A = faktor tumbukan
E = energi aktivasi R = konstanta gas T = suhu
Berdasarkan rumus Arhenius diatas dapat dilihat bahwa semakin besarnya tumbukan antar partikel maka nilai K2 juga akan semakin besar. Sehingga semakin besar laju alir NaOH akan menyebabkan nilai K2 meningkat (Leavenspiel, 1972)
Kemudian pada variabel 2 ke 3 mengalami kenaikan nilai k disebabkan bertambahnya laju alir NaOH maka akan menyebabkan terjadinya aliran turbulen yang menyebabkan molekul fluida bergerak kesegala arah dan menimbulkan tumbukan antar partikel yang semakin membesar. Jadi, semakin besar laju alir NaOH akan membuat nilai k2 semakin besar pula (Kusnarjo, dkk. 2009)
0 2 4 6 8 10 12 0 0.2 0.4 0.6 0.8 1 Variabel 1L/menit Variabel 1,25L/menit Variabel 1,5L/menit Waktu(menit) n CO2 (mol)
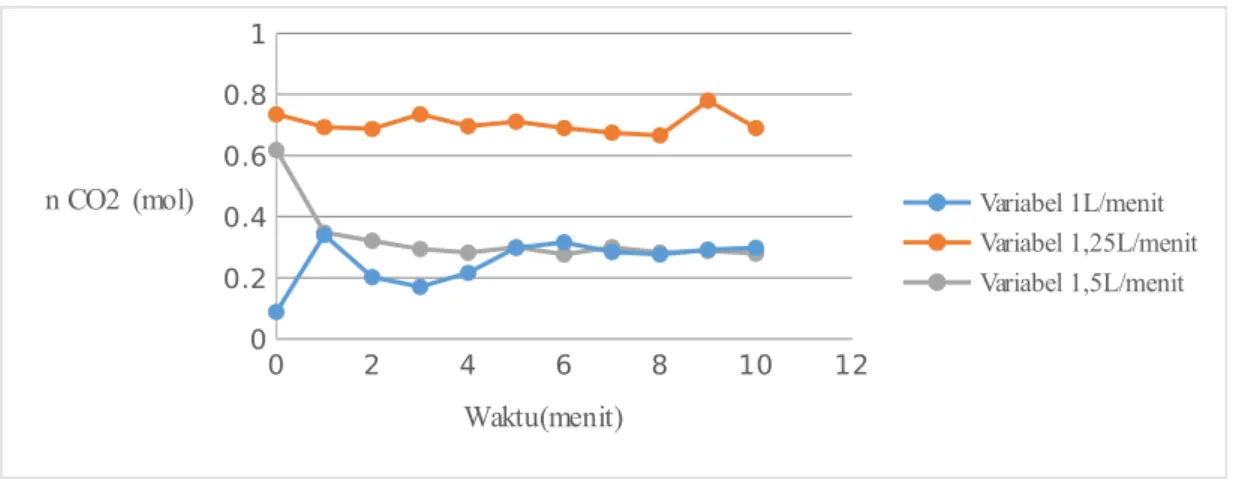
Gambar 4.5 GrafikHubunganJumlah CO2TerserapTerhadapWaktu
Dari hasil percobaan, dapat dilihat bahwa hasil jumlah CO2 yang terserap berbanding lurus. Semakin lama waktu yang digunakan dalam proses absorbsi, maka akan semakin banyak juga gas CO2 yang terserap dalam NaOH dalam absorber.
Pada variabel laju alir pada percobaan yang kami lakukan, kurva yang dihasilkan cenderung membentuk garis lurus yang konstan. Pada kondisi ini, CO2 yang diinjeksi ke dalam aliran NaOH bisa jadi tidak terserap secara sempurna akibat laju alir yang terlalu cepat. Pada laju alir yang besar, waktu kontak antara CO2 dan NaOH relative singkat, sehingga tidak terabsorpsi secara optimal. Hasilnya menunjukkan bahwa kurva yang terbentuk cenderung konstan membentuk garis lurus (Fuad dan Yanuar, 2009)
BAB V
PENUTUP
V.1. Kesimpulan
1. Semakin besar laju alir NaOH maka jumlah CO2 yang terserap semakin kecil 2. Semakin besar laju alir NaOH, nilai Kga akan semakin besar.
3. Semakin besar laju alir NaOH , nilai Kla akan semakin kecil. 4. Semakin besar laju alir NaOH, nilai k2 akan semakin besar.
5. Jumlah CO2 yang terserap berbanding lurus terhadap waktu.
V.2. Saran
1. Penggunaan valve yang baik agar mudah dalam pengaturan laju alir NaOH.
2. Jaga valve untuk laju alir NaOH diatur sesuai dengan variable yang ditentukan agar tetap konstan.
3. Jaga tekanan pada tangki CO2 agar CO2 yang keluar tidak berlebihan.
4. Jaga tekanan pada kompresor agar raksa yang ada pada inverted manometer tidak keluar ke pipa pembuangan.
DAFTAR PUSTAKA
Arai, 2007, Absorbsi Gas CO2Dengan NaOH, http://tekimerzitez.wetpaint.com
Coulson, J.M. dan Richardson, J.F., 1996, Chemical Engineering: Volume 1: Fluid th flow, heat transfer and mass transfer, 5 ed. Butterworth Heinemann, London, UK.
Danckwerts, P.V. dan Kennedy, B.E., 1954, Kinetics of liquid-film process in gas absorption. Part I: Models of the absorption process, Transaction of the Institution of Chemical Engineers, 32:S49-S52.
Danckwerts, P.V., 1970, Gas Liquid Reactions, McGraw-Hill Book Company, Inc., New York, pp. 42-44,
Fatih, Selvy, dan Tri Wulandari, 2009, Absorbsi Gas CO2 Dengan NaOH, Laporan Resmi
Praktikum Unit Proses, IV, 12-13.
Franks, R.G.E., 1967, Mathematical modeling in chemical engineering. John Wiley and Sons, Inc., New York, NY, USA, pp. 4-6.
Higbie, R., 1935, The rate of absorption of a pure gas into a still liquid during short period of exposure, Transaction of the Institution of Chemical Engineers, 31,365-388.
Juvekar, V. A. dan Sharma, M.M., 1972, Absorption of CO, in a suspension of lime, Chemical Engineering Science, 28, 825-837.
Kumoro dan Hadiyanto, 2000, Absorpsi Gas Karbondioksid dengan Larutan Soda Api dalam Unggun Tetap, Forum Teknik, 24 (2), 186-195.
Levenspiel, O., 1972, Chemical reaction engineering, 2 ed. John Wiley and Sons, Inc., New York, NY, USA, pp. 210-213, 320-326.
Maarif, Fuad dan Januar Arif F. 2009,Absorbsi Gas Karbondioksida (CO2) dalam Biogas dengan Larutan NaOH secara Kontinyu..
Olutoye, M. A. dan Mohammed, A., 2006, Modelling of a Gas-Absorption Packed Column for Carbon Dioxide-Sodium Hydroxide System, African Union Journal of Technology, 10(2),132-140
Rehm, T. R., Moll, A. J. and Babb, A. L., 1963, Unsteady State Absorption ofCarbon Dioxide by Dilute Sodium Hydroxide Solutions,American Institute of Chemical Engineers Journal, 9(5), 760-765.
Rizkya dan Yuli. 2009. Model Absorpsi Gas CO2 Dalam Larutan K2CO3 Dengan Promotor MDEA Pada PackedColumn.
Zheng, Y. and Xu, X. (1992), Study on catalytic distillation processes. Part I. Mass transfer characteristics in catalyst bed within the column, Transaction of the Institution of Chemical Engineers, (Part A) 70, 459–464.
LEMBAR PERHITUNGAN
A. PERHITUNGAN REAGEN
Larutan NaOH 0,5 N sebanyak 15 Liter N= m Mr× 1000 V ×Valensi 0,5=m 40× 1000 15000× 1 m=300 gram NaOH Larutan HCl 0,4 N VHCl=0,4 ×36,5 ×1000 ml 1,167 ×0,25 ×1000 VHCl=50,04 ml
B. PERHITUNGAN FRAKSI RUANG KOSONG Vvoid=85 cm3 D=2,3 cm ; H=33 cm Vt=π × D 2 × H 4 ¿3,14 × 2,3 2 × 33 4 ¿137,037 cm3 ε=Vvoid Vt ¿ 85 cm 3 137,037 cm3 ¿0,62027
C. OPERASI ABSORBSI ∆Z = 3,5 cm = 0,035m P = 6 bar
Q = 1 L/min , 1,25 L/min , 1,5 L/min T = 30 C = 303 K
D. PERHITUNGAN LAJU ALIR Massa jenis raksa= 13,534 Kg/m3 Massa jenis CO2= 1,977 Kg/m3 D1=4,9 cm ;s 1=1 4× π × D 2 =1,8 ×10−3 m3 D 2=2,3 cm; s 2=1 4× π × D 2=0,4 ×10−3m3
E. PERHITUNGAN LAJU ALIR PADA KOMPRESOR CO2 −∆ P=∆ Z (ρraksa−ρ co2) g gc −∆ P=0,035(13,534−1,977)9,8 1 −∆ P=3,964 ba r V co2=
√
2 α × gc ×( −∆ P ρraksa−Σ F )(
s 1 s 2)
−1 V co2=√
2× 1×(3,964 1,977−0)(
1,8 0,4)
−1 V co2=1,07m s¿1,07m s × 60 s menit× 0,4 ×10 −3 m3×1000 L 1 m3 =25,68 L menit
F. PERHITUNGAN LAJU ALIR UDARA −∆ P=∆ Z (ρraksa−ρudara) g gc −∆ P=0,01(13,534−1,21)9,8 1 −∆ P=1,208 ¯¿ V udara=
√
2α × gc ×( −∆ P ρudara−Σ F)(
s 1 s 2)
−1 V udara=√
2×1 ×(1,208 1,21 −0)(
1,8 0,4)
−1 V udara=0,57m sLaju alir udara ¿V udara × s 1
¿0,57m s × 60 s menit× 1,8 ×10 −3m3×1000 L 1m3 =61,56 L menit
G. PENENTUAN KADAR CO2 MULA MULA Q udara = Q2
Q CO2 = Q1 Q gasses to coloumn = Q3
NERACA TOTAL :
Q3 ¿25,68menitL +61,56menitL =87,24menitL Neraca komponen untuk CO2 :
C3 ×Q 3=Q 1 ×C 1+Q 2× C 2(C 2=0)
C3 ¿C 1 x Q 1Q3 Tekanan CO2 dalam tabung
C1 0,08314 x L . ¯¿ gmol . K×303 K =¿ 6¯¿ ¿ ¿ ¿ 0,238 gmolL C3 ¿ 0,238 gmol L × 25,68 L menit 87,24 L menit =0,07 gmol L
H. Perhitungan hasil percobaan Jika a > b, maka
n Na2CO3 = val ×V sampel2 b × N HCl
n NaHCO3 = (val× V sampela−b)× N HCl Jika a < b, maka
n Na2CO3 = val ×V sampel2 a × N HCl
n NaHCO3 = (val× V sampelb−a)× N HCl
Variabel 1 : Q= 1 L/menit
t menit a ml b ml n Na2CO3 n NaHCO3 n CO2 terserap N
0 3,8 0,6 0,024 0,064 0,088 0
2 7,6 2,5 0,1 0,102 0,202 0.172912 3 6 2,5 0,1 0,07 0,17 0.21828 4 4 6,8 0,16 0,056 0,216 0.369792 5 11,8 3,1 0,124 0,174 0,298 0.63772 6 14 1,8 0,072 0,244 0,316 0.811488 7 12,5 1,7 0,068 0,216 0,284 0.850864 8 12,2 1,6 0,064 0,212 0,276 0.945024 9 12,9 1,7 0,068 0,224 0,292 1.124784 10 12,3 2,6 0,104 0,194 0,298 1.27544 108,6 27,9 1,104 1,676 2,78 0.595620 Variabel 2 : Q = 1,25L/menit
t menit a ml b ml n Na2CO3 n NaHCO3 n CO2 terserap N
0 12 11.5 0.72 0.015 0.735 0 1 11 12.1 0.66 0.033 0.693 0.296604 2 9.8 13.1 0.588 0.099 0.687 0.588072 3 10.1 14.4 0.606 0.129 0.735 0.94374 4 11.2 12 0.672 0.024 0.696 1.191552 5 11.2 12.5 0.672 0.039 0.711 1.52154 6 10.8 12.2 0.648 0.042 0.69 1.77192 7 10.5 12 0.63 0.045 0.675 2.0223 8 11 11.2 0.66 0.006 0.666 2.280384 9 12 14 0.72 0.06 0.78 3.00456 10 10.1 12.9 0.606 0.084 0.69 2.9532 10.88 182 12.53636 0.652909 0.052364 0.705273 1.5067156 36
Untuk NaOH 0,15 N ; Q = 1,5L/menit
t menit a ml b ml Na2CO3 NaHCO3 CO2 terserap N CO2 N
0 8.5 12.1 0.51 0.108 0.618 0.11124 0
2 4.7 6 0.282 0.039 0.321 0.05778 0.04945968 3 4.8 5 0.288 0.006 0.294 0.05292 0.06794928 4 4.4 5 0.264 0.018 0.282 0.05076 0.08690112 5 4.6 5.4 0.276 0.024 0.3 0.054 0.11556 6 4 5.2 0.24 0.036 0.276 0.04968 0.12757824 7 4.7 5.3 0.282 0.018 0.3 0.054 0.161784 8 4.7 4.7 0.282 0 0.282 0.05076 0.17380224 9 4.3 5.3 0.258 0.03 0.288 0.05184 0.19968768 10 4.3 5 0.258 0.021 0.279 0.05022 0.2149416 4.97 5.86 0.298364 0.027818 0.326182 0.058713 0.1113157
LAPORAN SEMENTARA PRAKTIKUM PROSES KIMIA
Materi :
Absorbsi Gas Karbon Dioksida dengan Larutan NaOH
Disusun oleh :
Alfiyanti 21030113120071
Andika Eko Mahendro 21030113140179 Nabila Rahmanastiti 21030113140177
LABORATORIUM PROSES KIMIA TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS DIPONEGORO SEMARANG
I. TUJUAN PERCOBAAN:
1. Pengaruh laju alir NaOH (atau CO2) terhadap jumlah CO2 yang terserap pada berbagai waktu reaksi.
2. Pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan perpindahan massa CO2 (kGa).
3. Pengaruh laju alir NaOH (atau CO2) terhadap nilai tetapan reaksi antara CO2 dan NaOH (k2).
4. Hubungan CO2yang terserap terhadap waktu
II. PERCOBAAN
II.1.Bahan yang digunakan
1. Natrium Hidroksida (NaOH) 0,5 N 2. Gas Karbondioksida (CO2)
3. Udara
4. Aquadest (H2O) 5. HCl 0,2 N
6. Indikator Titrasi (PP dan MO) II.2. Alat yang digunakan
1. Tabung CO2 2. Kolom Packing 3. Tangki NaOH 4. Pompa 5. Manometer 6. Kompresor 7. Tabung Penyampur 8. Ember
II.3. Cara kerja
1) Buat larutan induk NaOH dengan konsentrasi 0,5 N sebanyak 18 L Timbang 144 gr NaOH
Dilarutkan dalam aquadest sebanyak 18 L
Larutan NaOH ditampung dalam tangki untuk dioperasikan 2) Menentukan fraksi ruang kosong pada kolom absorpsi
Alirkan larutan NaOH dari bak penampung 2 ke dalam kolom absorpsi. Hentikan jika tinggi cairan di dalam kolom tepat setinggi tumpukan
packing.
Keluarkan cairan dalam kolom dengan membuka kran di bawah kolom, tampung cairan tersebut dan segera tutup kran jika cairan dalam kolom tepat berada pada packing bagian paling bawah.
Catat volume cairan sebagai volume ruang kosong dalam kolom absorpsi = Vvoid.
Tentukan volume total kolom absorpsi, yaitu dengan mengkur diameter
kolom (D) dan tinggi tumpukan packing (H), 4 . 2 H D VT
Fraksi ruang kosong kolom absorpsi = VT
Vvoid 3) Operasi Absorpsi
NaOH 0,5 N dipompa dan diumpankan ke dalam kolom melalui bagian atas kolom pada laju alir tertentu hingga keadaan mantap tercapai.
Alirkan gas CO2melalui bagian bawah kolom. Ukur beda ketinggian cairan dalam manometer 1, manometer 2 dan manometer 3, manometer 4 jika aliran gas sudah steady.
Ambil 10 mL sampel cairan dari dasar kolom absorpsi tiap 1 menit selama 10 menit dan dianalisis kadar ion karbonat atau kandungan NaOH bebasnya.
Ulangi percobaan untuk nilai variabel kajian yang berbeda.
4) Analisis sampel
Sebanyak 10 mL sampel cairan ditempatkan dalam gelas erlenmeyer 100 mL.
Tambahkan indikator fenol fthalein (PP) sampai merah jambu, dan titrasi sample dengan larutan HCl 0,2 N sampaiwarna merah hampir hilang (kebutuhan titran = a mL), maka mol HCl = a 0,1 mmol.
Tambahkan 2-3 tetes indikator metil jingga (MO), dan titrasi dilanjutkan lagi sampai warna jingga berubah menjadi merah (kebutuhan titran = b mL), atau kebutuhan HCl = b 0,1 mmol.
Jumlah NaOH bebas = (2a-b) 0,1 mmol di dalam 10 mL sample Konsentrasi NaOH bebas = (2a-b) 0,01 mol/L
II. 4. Hasil Percobaan
Volume Cairan : 101,5 ml P CO2 : 6 bar
ΔZ : 2,7 cm
H
: 32 cm
MENGETAHU
PRAKTIKAN ASISTEN
Alfiyanti, Andika, Nabila Vicky Kartika Firdaus 21030112130146 t Variabel 1(1 ml/s) Variabel 2 (1,25 ml/s) Variabel 3 (1,5 ml/s)
a(ml) b(ml) a(ml) b(ml) a(ml) b(ml)
0 3,8 0,6 12 11.5 8.5 12.1 1 11,5 5,5 11 12.1 5.7 5.5 2 7,6 2,5 9.8 13.1 4.7 6 3 6 2,5 10.1 14.4 4.8 5 4 4 6,8 11.2 12 4.4 5 5 11,8 3,1 11.2 12.5 4.6 5.4 6 14 1,8 10.8 12.2 4 5.2 7 12,5 1,7 10.5 12 4.7 5.3 8 12,2 1,6 11 11.2 4.7 4.7 9 12,9 1,7 12 14 4.3 5.3 10 12,3 2,6 10.1 12.9 4.3 5