UNIVERSITAS INDONESIA
SEL LIMFOSIT CD56
+PADA HATI PASIEN KO-INFEKSI
HUMAN IMMUNODEFICIENCY VIRUS (HIV) DAN VIRUS
HEPATITIS C YANG MENERIMA ANTI RETROVIRAL
THERAPY (ART)
TESIS
YOSEPHINE GRACIA SUSUFI
NPM. 1006768502
FAKULTAS KEDOKTERAN UNIVERSITAS INDONESIA PROGRAM PENDIDIKAN DOKTER SPESIALIS
PATOLOGI ANATOMIK JAKARTA
UNIVERSITAS INDONESIA
SEL LIMFOSIT CD56
+PADA HATI PASIEN KO-INFEKSI
HUMAN IMMUNODEFICIENCY VIRUS (HIV) DAN VIRUS
HEPATITIS C YANG MENERIMA ANTI RETROVIRAL
THERAPY (ART)
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh gelar Dokter Spesialis I Bidang Studi Patologi Anatomik
YOSEPHINE GRACIA SUSUFI NPM. 1006768502
FAKULTAS KEDOKTERAN UNIVERSITAS INDONESIA PROGRAM PENDIDIKAN DOKTER SPESIALIS
PATOLOGI ANATOMIK JAKARTA
iv
KATA PENGANTAR
Puji syukur saya panjatkan kepada Tuhan Yang Maha Esa atas kasih dan berkatNya sehingga saya dapat menyelesaikan tesis ini. Penulisan tesis ini dilakukan dalam rangka memenuhi persyaratan untuk menyelesaikan Program Pendidikan Spesialis I Program Studi Patologi Anatomik Fakultas Kedokteran Universitas Indonesia. Saya mengucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada:
1. dr. Ening Krisnuhoni, MS, SpPA(K) selaku pembimbing sekaligus Sekretaris Program Studi Pendidikan Spesialis I Patologi Anatomik FKUI dan DR. dr. Rino Alvani Gani, SpPD-KGEH selaku pembimbing, yang telah menyediakan waktu, memberi ide, bimbingan dan ilmu yang berharga serta memberikan kesempatan untuk meneruskan penelitiannya.
2. dr. Diah Rini Handjari, SpPA (K) selaku Kepala Departemen Patologi Anatomik FKUI/RSCM, dr. Nurjati Chairani Siregar, MS, PhD, SpPA(K) selaku Ketua Program Studi Pendidikan Spesialis I Patologi Anatomik FKUI, serta dr. Benyamin Makes, SpPA (K) selaku pembimbing akademik.
3. Professor Patricia Price dan Dr. Silvia Lee dari University of Western Australia atas masukan dan bimbingannya dalam penulisan dan publikasi penelitian ini serta Abbvie Pty. Ltd. dalam hal pembelian antibodi primer dan dukungan materiil lain yang digunakan dalam penelitian ini.
4. dr. Marini Stephanie, SpPA atas waktu dan masukannya dalam penelitian ini. 5. dr. Apriani Oendari, MKM atas masukan dan bimbingannya dalam hal
statistik dan pengolahan data pada penelitian ini.
6. Seluruh Guru besar, pada staf pengajar, PPDS dan karyawan Departemen Patologi Anatomik FKUI/RSCM.
7. Seluruh pasien yang berpartisipasi dalam penelitian ini.
8. Semua peneliti yang terlibat dalam keseluruhan rangkaian penelitian kolaborasi mengenai ko-infeksi HIV dan virus hepatitis C antara Universitas Indonesia dan University of Western Australia, dimana penelitian ini juga tercakup di dalamnya, yang tidak dapat saya sebutkan satu persatu.
9. Pendukung utama saya yaitu suami, mama, alm papa, serta seluruh keluarga besar saya yang telah memberikan doa, semangat, kesabaran, kesempatan dan dukungan, baik dalam bentuk moril maupun materiil untuk menyelesaikan pendidikan program studi spesialis ini.
Semoga Tuhan YME membalas segala kebaikan dari semua pihak yang telah membantu. Dengan segala kekurangannya, saya berharap tesis ini dapat memberikan manfaat bagi perkembangan ilmu pengetahuan dasar, khususnya dalam hubungannya dengan patogenesis ko-infeksi HIV dan virus hepatitis C.
Jakarta, 4 November 2014 Yosephine Gracia Susufi
Program Studi : Program Pendidikan Dokter Spesialis I Patologi Anatomik
Judul : Sel Limfosit CD56+ pada Hati Pasien Ko-infeksi Human
Immunodeficiency Virus (HIV) dan Virus Hepatitis C yang
Menerima Anti Retroviral Therapy (ART)
Latar Belakang: Ko-infeksi dengan human immunodeficiency virus (HIV) pada
infeksi virus hepatitis C memiliki angka mortalitas dan morbiditas yang tinggi. Salah satu defek imunologik yang terjadi pada ko-infeksi ini ialah dalam hubungannya dengan populasi sel NK (CD56+CD3-) dan NKT (CD56+CD3+) di hati, yang dalam keadaan normal berperan penting dalam jejas di hati dan fibrogenesis. Kedua populasi sel ini dikatakan menurun dan mengalami disfungsi pada ko-infeksi ini dan dikaitkan dengan progresivitas penyakit serta fibrosis di hati. Pemberian Anti Retroviral Therapy (ART) diharapkan dapat memperbaiki defek imunologik pada kedua populasi sel ini. Immune restoration disease (IRD) virus hepatitis C merupakan salah satu efek samping pemberian ART pada ko-infeksi ini dan mungkin melibatkan kedua populasi sel tersebut.
Bahan dan Metode: Pulasan imunohistokimia dengan CD56 dilakukan pada 39
spesimen biopsi pasien sebelum pemberian ART dan 26 spesimen setelah pemberian ART selama 48 minggu. Parameter klinik dan histopatologik dari penelitian sebelumnya dicatat. Rerata sel limfosit CD56+ dihitung dalam 3-5 area porta yang terlihat.
Hasil: Rerata sel limfosit CD56+ tidak meningkat setelah pemberian ART (p=0,35) dan tidak menunjukkan korelasi baik dengan skor fibrosis, jumlah sel T CD4+ di darah tepi, viral load HIV dan viral load virus hepatitis C. Tidak didapatkan pula perbedaan rerata sel limfosit CD56+ antara kelompok dengan dan tanpa IRD virus hepatitis C.
Kesimpulan: Ko-infeksi HIV dan virus hepatitis C mungkin memiliki efek
permanen pada sel NK dan NKT di hati dan pemberian ART saja tidak dapat mengembalikan jumlahkedua populasi sel tersebut.
Universitas Indonesia viii
ABSTRACT
Name : Yosephine Gracia Susufi
Study Program : Anatomical Pathology, Faculty of Medicine, Universitas
Indonesia
Title : CD56+ lymphocytes in the liver of HIV/hepatitis C virus coinfected patients commencing ART.
Background: Human immunodeficiency virus (HIV) and hepatitis C virus (HCV)
coinfection has a high mortality and morbidity rate. One of the immunological defects in this coinfection is in NK (CD56+CD3-) and NKT (CD56+CD3+) cells population in the liver, which in normal condition have important role in liver injury and fibrogenesis. Both cell populations decrease in numbers and have dysfunction in this coinfection and are related with disease progression and fibrosis in the liver. Anti retroviral therapy (ART) given to coinfected patients is expected to repair immunological defect in both NK and NKT cell populations. HCV immune restoration disease (IRD) is one of the side effects of ART in this coinfection and may also involve both cell populations.
Materials and methods: Immunostaining with CD56 was performed on 39
biopsy samples of coinfected patients at baseline and 26 biopsy samples after 48 weeks of ART. Both clinical and histopathological parameters from previous study were noted. Means of CD56+ lymphocyte were counted over 3-5 portal areas.
Result: Means of CD56+ lymphocyte counts did not increase after ART (p=0.35) and did not correlate with fibrotic score, CD4+ T cell count in peripheral blood, and neither with HIV and HCV viral load. There was no difference in CD56+ lymphocytes count between HCV IRD and non HCV IRD group.
Conclusion: HIV/HCV coinfection might have permanent effect on both NK and
NKT cells population and ART alone can not reverse NK and NKT cell numbers in this coinfection.
HALAMAN JUDUL i
HALAMAN PERNYATAAN ORISINALITAS ii
HALAMAN PENGESAHAN iii
KATA PENGANTAR iv
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH vi
ABSTRAK vii
DAFTAR ISI ix
DAFTAR TABEL xi
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
1. PENDAHULUAN 1 1.1 Latar Belakang 1 1.2 Identifikasi Masalah 3 1.3 Rumusan Hipotesis 3 1.4 Tujuan Penelitian 4 1.5 Manfaat Penelitian 4 2. TINJAUAN PUSTAKA
2.1 Ko-infeksi HIV dan Hepatitis C 5
2.2 CD56 5
2.3 Sistem Imunologi di Hati 6
2.4 Imunopatogenesis pada infeksi Hepatitis C dan HIV 9 2.5 Anti Retroviral Therapy dan Immune Restoration Disease 12
2.6 Kerangka teori 14
2.7 Kerangka konsep 15
3. METODE PENELITIAN
3.1. Desain Penelitian 16
3.2. Tempat dan Waktu Penelitian 16
3.3. Populasi dan sampel Penelitian 16
3.4 Kriteria Inklusi dan Eksklusi 16
3.5 Variabel Penelitian 17
3.6 Definisi Operasional
3.6.1. Immune restoration disease (IRD) 17
3.6.2 Antiretroviral therapy (ART) 17
3.6.3. Skor Ishak 17
3.7 Alur penelitian 19
3.8 Bahan dan cara kerja 19
3.8.1. Pengukuran parameter klinik dan biopsi hati 19
3.8.2. Pewarnaan imunohistokimia 19
3.9 Interpretasi Hasil Pewarnaan Imunohistokimia 21
x
4. HASIL PENELITIAN
4.1 Karakteristik subyek penelitian 22
4.2 Gambaran histopatologik dan pulasan imunohistokimia dengan CD56
23 4.3 Perbedaan rerata sel limfosit CD56+ di hati sebelum dan
sesudah pemberian ART dan korelasinya dengan berbagai variabel
24
4.4. Komparasi rerata sel limfosit CD56+ di hati antara kelompok dengan dan tanpa IRD virus hepatitis C
25
5. PEMBAHASAN 26
6. KESIMPULAN DAN SARAN
6.1 Kesimpulan 30
6.2 Saran 30
DAFTAR PUSTAKA 31
Tabel 3.1. Skor nekroinflamasi dan fibrosis menurut kriteria Ishak 18 Tabel 4.1 Parameter klinik dan histopatologik 22 Tabel 4.2 Perbandingan data berpasangan pada 26 pasien sebelum
dan sesudah pemberian ART.
Universitas Indonesia
xii
DAFTAR GAMBAR
Gambar 2.1. Komposisi sel-sel pada jaringan hati normal 6 Gambar 2.2. Perbedaan fungsi sel NK dan NKT pada penyakit hati 8 Gambar 2.3. Interaksi HIV dan virus hepatitis C 11 Gambar 4.1. Gambaran histopatologik pada salah satu kasus 23 Gambar 4.2. Hasil pulasan imunohistokimia dengan CD56 pada
beberapa kasus
Lampiran 1 Tabel induk 33 Lampiran 2 Uji normalitas pada berbagai variabel 37 Lampiran 3 Uji komparasi dan korelasi antar variabel 40
Lampiran 4 Surat keterangan lolos kaji etik 44
Lampiran 5 Surat persetujuan izin penelitian 45
Universitas Indonesia
1
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Virus hepatitis C menginfeksi lebih dari 170 juta orang di seluruh dunia dan merupakan penyebab utama penyakit hati kronik.1 Tahun 2010, di Indonesia terjadi 315.000 kasus baru dengan total 7,5 juta penduduk terinfeksi virus ini.2 Ko-infeksi dengan human immunodeficiency virus (HIV) pada penderita hepatitis C tidak jarang ditemukan karena keduanya memiliki rute transmisi yang sama dan merupakan salah satu penyebab utama mortalitas dan morbiditas pada keduanya.1,3
Hati merupakan organ dengan fungsi imunologik yang unik. Populasi limfosit di hati kaya akan sel natural killer (NK) dan natural killer T (NKT) yang berperan penting dalam mekanisme pertahanan imun lini pertama terhadap patogen yang masuk atau tumor, jejas pada hati. Kedua populasi sel ini juga berperan pada patogenesis penyakit hati kronik melalui aktivasi sitokin inflamasi dan regulasinya terhadap sel sekitar terutama sel stelata di hati.4,5 Sel NK pada manusia mengekspresikan CD56, sedangkan sel NKT mengekspresikan CD56 dan CD3 pada permukaannya. Gangguan fungsi sel NK dan NKT pernah dilaporkan pada individu dengan hepatitis C kronik dengan angka yang menurun secara paralel terhadap progresivitas penyakit dengan jumlah yang sangat minim pada sirosis hati.6,7
Pasien dengan ko-infeksi HIV dan hepatitis C memiliki defek kualitatif dari sel NK pada manifestasi awal penyakit ini.8 Disfungsi molekular sel NK/NKT pada pasien HIV masih belum dapat dijelaskan secara pasti. Pasien yang menerima anti retroviral therapy (ART) menunjukkan peningkatan pada jumlah sel NK dan CD8+ mendekati jumlah normal yang mengindikasikan bahwa replikasi HIV mungkin berperan dalam disfungsi sel NK.9 Baik virus hepatitis C maupun HIV secara tersendiri dapat mempengaruhi kinerja sel NK/NKT di hati dan berkontribusi terhadap menurunnya respon imun spesifik terhadap virus hepatitis C pada pasien ko-infeksi ini.10
Sepuluh sampai 30% individu dengan HIV yang mendapat terapi antiviral (ART) mengalami munculnya gejala-gejala proses imun yang dikenal dengan
immune restoration disease (IRD) yang mekanisme pastinya belum dapat
dijelaskan sampai saat ini.11 Kasus-kasus IRD yang pernah dilaporkan antara lain infeksi mycobacterium, virus herpes, hepatitis B dan C serta kriptokokus.12 Efek samping hepatotoksisitas pada pasien-pasien ini didefinisikan sebagai peningkatan level alanintransferase (ALT) serum yang sejalan dengan meningkatnya jumlah sel CD4+ di darah perifer.11-13
IRD pada pasien HIV yang menerima ART, terutama dalam hubungannya dengan virus hepatitis, terjadi karena mekanisme imun yang komples. IRD virus hepatitis B mungkin terjadi karena restorasi dari sel T CD8+. Respon sel T CD8+ yang tidak efisien karena hilangnya bantuan dari sel T CD4+ pada pasien HIV dapat meningkatkan peranan respon imun nonspesifik melalui IFN-γ-induced
chemokines yang dapat memanggil sel imun nonspesifik seperti sel NK, NKT,
neutrofil dan monosit. Mekanisme terjadinya IRD virus hepatitis C lebih tidak jelas, namun diperkirakan terdapat pernanan dari berbagai sitokin.11
Dua penelitian sebelumnya oleh Yunihastuti, et al14 dan Gani, et al15 dilakukan pada pasien yang sama dengan penelitian ini. Yunihastuti, et al14 membuktikan bahwa 9 dari 48 pasien ko-infeksi HIV dan hepatitis C yang menerima ART, mengalami IRD, dimana level mediator inflamasi lebih tinggi sedangkan antibodi anti hepatitis C lebih rendah pada kelompok ini. Penelitian oleh Gani, et al15 memfokuskan pada jumlah sel CD4+ dan CD8+ pada darah perifer dan hati dan mendapatkan bahwa terdapat peningkatan jumlah sel CD4+ dan penurunan jumlah sel CD8+ setelah mendapatkan ART selama 48 minggu.
Melalui penelitian ini, penulis mencoba membuktikan peranan sel NK dan NKT pada individu dengan ko-infeksi HIV dan virus hepatitis C melalui pemeriksaan imunohistokimia dengan marker CD56 yang diekspresikan pada kedua populasi sel tersebut. Jumlah sel limfosit CD56+ diharapkan meningkat setelah pemberian ART, berkorelasi dengan skor fibrosis, jumlah sel T CD4+ di darah perifer, serta viral load HIV dan hepatitis C. Sebagai tambahan, jumlah sel CD56+ juga diharapkan ditemukan lebih banyak pada individu dengan IRD hepatitis C. Sudah ada beberapa penelitian mengenai peranan sel NK atau NKT
Universitas Indonesia
3
pada infeksi virus hepatitis C namun penelitian yang membuktikan peranan kedua populasi sel ini pada ko-infeksi HIV dan virus hepatitis C masih sangat terbatas, khususnya penelitian dengan menggunakan pewarnaan imunohistokimia sehingga diharapkan penelitian ini dapat memberikan kontribusi dalam ilmu pengetahuan dasar patogenesis penyakit ko-infeksi ini.
1.2. Identifikasi Masalah
Sel NK dan NKT yang mengekspresikan CD56 pada permukaannya mengalami disfungsi dan berkurang jumlahnya pada jaringan hati pasien ko-infeksi HIV dan virus hepatitis C, Hal ini dikaitkan dengan progresivitas penyakit, khususnya dalam hal fibrogenesis sebagai akibat penurunan jumlah sel T CD4+ di darah tepi dan jaringan hati. Pemberian ART diharapkan dapat mengembalikan jumlah dan fungsi kedua populasi sel ini. Patogenesis IRD virus hepatitis C yang terjadi setelah pemberian ART juga diduga berhubungan dengan kedua populasi sel ini.
1.3. Rumusan Hipotesis
Terdapat peningkatan bermakna rerata sel limfosit CD56+
di hati setelah pemberian ART.
Terdapat korelasi positif antara rerata sel limfosit CD56+
di hati dengan jumlah sel T CD4+ di darah tepi, sebelum dan sesudah pemberian ART.
Terdapat korelasi negatif antara rerata sel limfosit CD56+
di hati dengan
viral load HIV dan virus hepatitis C,sebelum dan sesudah pemberian ART.
Terdapat korelasi negatif antara rerata sel limfosit CD56+
di hati dengan skor fibrosis, sebelum dan sesudah pemberian ART.
Pasien dengan IRD virus hepatitis C memiliki rerata sel limfosit CD56+ di hati yang lebih banyak dibandingkan dengan pasien yang tidak mengalami IRD virus hepatitis C.
1.4. Tujuan Penelitian
1.4.1. Tujuan Umum
Sebagai penelitian dasar untuk membuktikan peranan sel limfosit CD56+ di hati pada patogenesis penyakit ko-infeksi HIV dan hepatitis C.
1.4.2. Tujuan Khusus
Untuk mengetahui peningkatan rerata sel CD56+ di hati setelah pemberian ART, korelasinya dengan sel T CD4+, viral load HIV dan virus hepatitis C, skor fibrosis serta perbedaannya pada kelompok dengan dan tanpa IRD.
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan kontribusi terhadap ilmu pengetahuan dasar khususnya patogenesis ko-infeksi HIV dan hepatitis C.
Hasil penelitian diharapkan dapat melengkapi hasil penelitian-penelitian
sebelumnya dan menjadi acuan atau pedoman untuk penelitian selanjutnya.
Universitas Indonesia
1
5
BAB 2
TINJAUAN PUSTAKA
2.1. Ko-infeksi HIV dan Hepatitis C
Infeksi virus hepatitis C, salah satu virus RNA rantai tunggal, merupakan penyebab utama penyakit hati kronik yang diperkirakan menjangkit 3% penduduk dunia, dengan 60-80% diantaranya mengalami hepatitis kronik sedangkan 20% mengalami sirosis dalam kurun waktu 20 tahun.1,16 Infeksi virus hepatitis C juga merupakan penyebab utama karsinoma sel hati dan transplantasi hati di Amerika.1 Transmisi yang sama menyebabkan tingginya angka mortalitas dan morbiditas pada ko-infeksi HIV dan hepatitis C dan menjadi tantangan tersendiri dalam penatalaksanaannya.1,10,17 Transmisi ini terjadi melalui darah dan produknya; dimana virus hepatitis C 10x lebih menular dibanding HIV. Ko-infeksi ini sering dijumpai pada orang yang sering terpajan dengan produk darah seperti pada penderita hemofilia (60%-90% pasien) dan pengguna obat-obatan intravena yang menderita HIV (50%-70% pasien).18 Data di Amerika menyebutkan bahwa ko-infeksi ini terjadi pada 15-30% penderita HIV dan 5-10% penderita hepatitis C.1
HIV memiliki efek negatif terhadap perjalanan penyakit hepatitis C dimana pada ko-infeksi ini terjadi angka persistensi virus yang lebih tinggi, peningkatan level HCV-RNA, peningkatan inflamasi dan fibrosis di hati dan progresivitas yang cepat ke arah sirosis dan penyakit hati tahap akhir serta kematian.1,17 Terapi tunggal dengan interferon atau kombinasi dengan ribavirin pada pasien dengan hepatitis C menunjukkan respon yang lebih lambat secara signifikan pada individu dengan HIV positif dibandingkan dengan HIV negatif.18
2.2. CD56
CD56 atau yang juga dikenal dengan nama neural cell adhesion molecule (NCAM) merupakan glikoprotein yang berperan dalam pengikatan, migrasi dan diferensiasi sel. Pada sistem hematolimfoid, CD56 merupakan marker prototipik dari sel NK dan pada sebagian sel limfosit T CD4+ atau CD8+. CD56 juga diekspresikan pada berbagai jaringan normal dan tumor seperti karsinoma tiroid,
karsinoma sel ginjal, karsinoma sel hati serta pada sel dan tumor neuroendokrin.19 CD56 di hati secara normal tidak diekspresikan pada sel epitel bilier namun diekspresikan secara kuat pada penyakit obstruksi traktus bilier atau pada proses regenerasi setelah adanya kerusakan pada duktus bilier.20,21
2.3. Sistem Imunologi di Hati
Hati merupakan organ yang unik secara anatomik dan immunologik, yang tidak hanya memiliki fungsi ekskretorik, detoksifikasi dan metabolik melainkan juga merupakan organ limfoid intrinstik. Hati merupakan organ limfoid intrinsik, mengandung sel-sel limfoid yang berperan dalam respon imun innate dan
adaptive.22,5 Sistem imun di hati menentukan apakah respon yang akan diberikan terhadap paparan antigen, baik respon inflamatorik, tolerogenik, maupun anergik.23
Hati tersusun atas parenkim hati dan duktus bilier, yang mencakup 70-80% organ hati secara keseluruhan, dan sisanya terdiri atas sel endotel, sel-sel sistem imun innate seperti sel natural killer (NK) dan natural killer T (NKT) dan sel-sel sistem imun adaptive seperti sel lmfosit T dan B (gambar 2.1).5,22
Universitas Indonesia
7
Sel-sel limfosit di hati ditemukan pada area porta dan parenkim hati, dimana populasinya mencapai sebanyak 1010 sel.5,24 Perbedaan terbesar antara komposisi sel limfosit di hati dan di darah tepi terletak pada sel NK (CD3-CD56+), dan NKT (CD3+CD56+) yang ditemukan jauh lebih banyak di jaringan hati. Flow
cytometry menunjukkan bahwa rasio sel limfosit CD4+/CD8+ di hati berbanding terbalik dengan yang terkandung di dalam darah tepi yaitu sebanyak 1:3,5 dan 2:1 secara berturutan.24 Secara umum, sel-sel limfosit di hati merupakan campuran antara sel naive dan sel yang teraktivasi, dimana sebagian berpartisipasi pada respon imun lokal dan lainnya terperangkap atau mati. Sel limfosit pada hati orang sehat mengekspresikan penanda aktivasi yang mengindikasikan bahwa mereka tidak bersifat quiscent melainkan secara berkelanjutan memediasi respon imun di hati.23
Sel limfosit di hati kaya akan sel NK dan NKT yang berperan dalam pertahanan imun di hati terhadap virus dan tumor dan terlibat dalam patogenesis penyakit hati kronik.4 Sel NK, NKT, sel kupffer dan sel endotel sinusoid membentuk sistem pertahanan imun innate yang kuat terhadap eliminasi patogen, toksin, serta sel tumor yang bersirkulasi. Penelitian membuktikan bahwa deplesi sel NK/NKT secara bermakna memperkuat mudahnya penyebaran tumor ke hati. Setelah teraktivasi, sel NK dan NKT dapat secara cepat memproduksi sitokin sehingga dapat secara cepat memberikan respon dan membuang patogen, toksin dan antigen makanan yang masuk lewat peredaran darah melalui modulasi respon imun adaptive.4
Sel NK di hati mewakili populasi limfosit yang dominan di hati, mencakup sekitar 50% limfosit di hati, terletak di sinusoid dan menempel di sel endotel. Sel NK ini berperan sebagai lini pertama pertahanan tubuh terhadap infeksi virus dan transformasi tumor. Fungsi sel NK dihubungkan dengan produksi sitokin atau mematikan sel target secara langsung.4 Studi terhadap faktor transkripsi sel NK mengindikasikan bahwa sel NK di hati dapat merupakan sel NK yang sejak awal tinggal di hati ataupun sel NK konvensional di sirkulasi yang berasal dari sumsum tulang.25
Sel NK berperan dalam jejas dan repair di hati serta regulasi fibrogenesis di hati melalui efek anti fibrosisnya.26 Dibandingkan sel NK di darah perifer, sel
NK di hati mengandung granul yang lebih banyak namun lebih kecil dengan sitotoksisitas yang lebih tinggi terhadap tumor serta mengekspresikan level TRAIL, perforin dan granzyme B yang lebih tinggi.4 Sel NK hepatik berperan dalam jejas hati melalui keseimbangan antara reseptor aktivasi dan inhibisi pada sel NK dengan ligannya yang diekspresikan pada sel target, dimana pada keadaan normal, reseptor inhibisi mendominasi.4,5,25 Tidak adanya sinyal inhibisi dan adanya sitokin seperti interferon (IFN) serta ligasi reseptor aktivasi menyebabkan aktivasi sel NK dan lisis sel target.5
Limfosit di hati juga kaya akan sel NKT, yang juga dikenal dengan nama
hepatic NT cells, mencakup sekitar 10-15% populasinya. Sel NKT juga terbukti
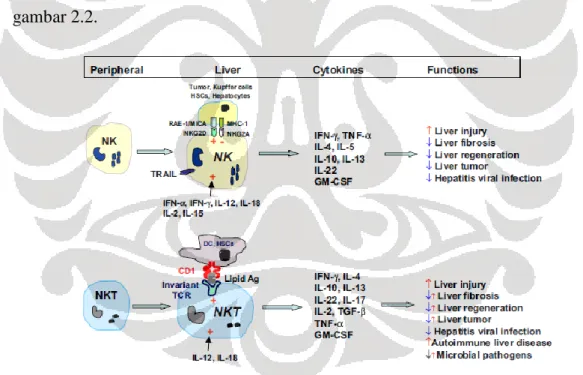
berperan penting dalam regulasi imunitas innate and adaptive melalui produksi berbagai macam sitokin. Mayoritas sel NKT teraktivasi oleh interleukin (IL-12) yang diproduksi oleh sel dendritik dan sel Kupffer dimana aktivasinya mengakibatkan lisis sel.4 Ringkasan peran sel NK dan NKT di hati terlihat dalam gambar 2.2.
Gambar 2.2. Perbedaan fungsi sel NK dan NKT pada penyakit hati. +,aktivasi; -, inhibisi; , promosi; , inhibisi; , peran ganda akibat subset atau derajat aktivasi yang berbeda pada sel NKT (dikutip dari Gao B et al.4)
Berdasarkan salah satu penelitian, sel NK dan NKT di hati lebih mengekspresikan CD27, CD28 dan CD69 pada permukaannya dibandingkan dengan sel NK dan NKT di darah perifer. Peningkatan ekspresi CD28, yang
Universitas Indonesia
9
merupakan reseptor ko-stimulatorik respon imun, pada sel NK dan NKT di hati bisa mengindikasikan tingginya potensi sitotoksik dari kedua populasi sel ini. Perbedaan yang terbesar dengan populasi di darah perifer ialah ekspresi CD69 yang merupakan penanda aktivasi akut. Hal ini menunjukkan bahwa kedua populasi sel ini secara berkelanjutan terpapar dengan sinyal aktivasi.23
Sel NK dan NKT berperan dalam jejas di hati dan fibrogenesis. Secara umum, sel NK dan NKT mempercepat proses jejas di hati melalui produksi sitokin proinflamatorik dan membunuh hepatosit. Sel yang paling berperan penting dalam fibrosis hati ialah sel stelata, yang selama proses jejas berlangsung, teraktivasi dan berdiferensiasi menjadi sel miofibroblas dengan ekspresi kolagen yang meningkat. Aktivasi sel stelata ini diregulasi oleh berbagai sitokin atau faktor pertumbuhan. Transforming growth factor-β (TGF-β) dan platelet derived
growth factor (PDGF) merupakan dua sitokin utama yang berperan dalam
transformasi dan proliferasi sel stelata secara berturutan. Interferon-γ (IFN-γ) yang dihasilkan oleh sel NK yang teraktivasi, merupakan salah satu sitokin utama yang berfungsi sebaliknya. Sel-sel sistem imun juga berperan dalam regulasi fibrosis hati dimana sel T CD8+ memicu fibrosis, sel NK menghambat fibrosis dan sel NKT memegang berbagai peranan dalam regulasi fibrosis.4 Aktivitas sel NK diperkirakan menghambat fibrosis karena terbukti berkorelasi negatif dengan derajat fibrosis dalam salah satu penelitian.26
2.4. Imunopatogenesis pada infeksi Hepatitis C dan HIV
Pada infeksi virus hepatitis C kronik terdapat infiltrasi sel mononuklear pada hati, termasuk limfosit T CD4+ dan CD8+, limfosit B, sel NK sel NKT.16 Berbagai studi menunjukkan bahwa infiltrat sel NK sangat berkurang jumlah dan fungsinya pada hati pasien hepatitis C kronik dibandingkan dengan hati normal.6,11,26,27 Infiltrat sel NK ini terlihat di daerah porta dan periporta dan berkorelasi positif dengan persentasi sel NK dan NKT di darah perifer. Pasien dengan infeksi hepatitic C kronik yang menerima terapi IFN menunjukkan peningkatan bermakna dari jumlah sel NK di darah perifer dan intrahepatik yang menunjukkan peran sel NK pada inhibisi replikasi virus hepatitis C.26
Sel NKT juga terbukti berperan dalam infeksi akut virus hepatitis C dan jumlahnya sangat berkurang baik di darah tepi maupun di hati pasien dengan infeksi kronik virus hepatitis C.28 Sel NKT di hati menurun hingga 11% pada hepatitis kronik dan 5% pada sirosis hati. Rendahnya jumlah sel NK dan NKT pada pasien hepatitis C kronik juga dihubungkan dengan kerentanan timbulnya karsinoma sel hati pada pasien-pasien ini.6
Dalam hubungannya dengan HIV, sel NK berperan penting dalam infeksi HIV karena kemampuannya dalam membunuh sel yang terinfeksi virus.29 Pada pasien dengan infeksi HIV, terdapat gangguan fungsi sel NK melalui berbagai mekanisme yang dihubungkan dengan progresivitas yang cepat ke arah acquired
immunodeficiency disease syndrome (AIDS).8,9 Baik infeksi HIV akut maupun kronik yang tidak ditangani, berhubungan dengan perubahan distribusi subset, ekspresi reseptor dan fungsi sel NK.29 Jumlah sel NK pada pasien HIV lebih rendah dibandingkan orang normal dan selama ART, jumlah sel NK ini, termasuk populasi CD8+, meningkat ke angka mendekati orang normal.8,9 Fakta ini memungkinkan adanya peranan replikasi HIV pada disfungsi sel NK meskipun mekanisme terjadinya disfungsi molekuler sel NK pada infeksi HIV belum dapat dijelaskan secara pasti. Suatu studi yang menggunakan klon sel NK CD16+ CD56+ dari pasien HIV pada berbagai stadium penyakit mendapatkan bahwa terdapat kapasitas sitolitik yang sangat menurun dibandingkan dengan individu normal, penurunan produksi IL-2, tumor necrosis factor- α (TNF-α) dan IFN-γ, serta defek pada kemampuan sel NK membentuk kompleks yang stabil dengan sel target.9
Infeksi HIV menyebabkan eksaserbasi perjalanan alamiah infeksi hepatitis C kronik dimana ko-infeksi HIV dan hepatitis C dihubungkan dengan tingginya kejadian penyakit hati tahap akhir dan angka ketahanan hidup yang lebih pendek dibandingkan infeksi tunggal hepatitis C. Alasan cepatnya perjalanan penyakit ko-infeksi ini terutama dihubungan dengan dua hal; persistensi ko-infeksi hepatitis C, yang bergantung pada perubahan imunitas cell-mediated, dan aktivasi sistem imun yang mengarah pada sekresi sitokin proinflamasi dan profibrotik.30
Mekanisme interaksi virus hepatitis C dan HIV belum dapat dijelaskan dengan pasti namun penjelasan yang paling mungkin ialah penekanan sistem imun
Universitas Indonesia
11
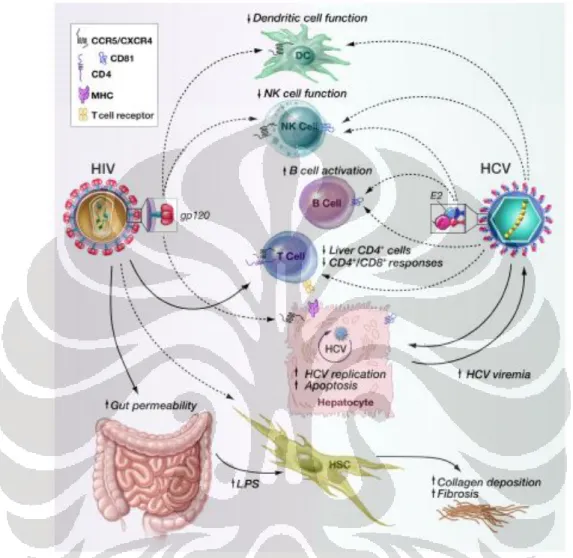
akibat penurunan jumlah sel T CD4+, interaksi intrahepatik antara virus dengan hepatosit atau sel-sel di hati lainnya dan efek tidak langsung pada hati akibat infeksi HIV pada organ lain (gambar 2.3).10
Gambar 2.3. Interaksi HIV dan virus hepatitis C. HIV tidak mempengaruhi perjalanan hepatitis C secara langsung namun melalui interaksinya dengan sel T CD4+, efek protein gp120 terhadap hepatosit dan sel imun lainnya. HIV juga bisa menginfeksi sel stelata hati (HSC) secara langsung atau melalui jaringan limfoid di saluran cerna. Virus hepatitis C juga bisa mempengaruhi sel imun dan perjalanan penyakit HIV. menggambarkan infeksi yang jelas, menggambarkan efek protein permukaan virus atau infeksi yang mungkin terjadi. (dikutip dari Rotman Y et al.10)
Supresi sistem imun akibat HIV tampaknya menjadi faktor utama dimana pada pasien HIV terjadi penurunan drastis respon sel-T spesifik yang telah diketahui berperan penting dalam pencegahan progresivitas dari akut menjadi kronik pada infeksi virus hepatitis C. Respon sel T spesifik terhadap virus hepatitis C diketahui sangat menurun pada pasien HIV yang mengidap hepatitis C akut sedangkan pada hepatitis C kronik, respon sel T spesifik ini sangat lemah
dimana pasien dengan ko-infeksi memiliki respon CD4+ dan CD8+ yang lebih rendah.10,30
Jejas pada hati dapat juga terjadi secara tersendiri terlepas dari supresi sistem imun melalui efek kombinasi dari kedua virus ini terhadap hepatosit. Efek terhadap hepatosit terjadi melalui interaksi protein pada permukaan virus dengan reseptor kemokin pada permukaan hepatosit. HIV juga bisa menginfeksi sel Kupffer yang selanjutnya akan mempengaruhi kerja sel stelata sebagai mediator utama deposisi kolagen dan fibrogenesis di hati meskipun HIV juga dapat menjadi target langsung dari HIV. Sebagai tambahan, ko-infeksi HIV dengan hepatitis C ini juga menyebabkan gangguan fungsi sel dendritik dan sel NK yang berpengaruh terhadap menurunnya respon imun spesifik terhadap virus hepatitis C.10
Hipotesis dari penelitian lain menunjukkan bahwa respon IFN-γ yang bersifat antigen spesifik berkorelasi dengan penyakit hati yang lebih ringan pada pasien ko-infeksi ini. Terdapat korelasi negatif yang signifikan antara skor inflamasi dan fibrosis dengan produksi IFN-γ dalam respon terhadap protein virus hepatitis C. Faktor yang berpengaruh dengan inflamasi yang berat ialah viral load HIV dan virus hepatitis C yang terdeteksi sedangkan prediktor inflamasi ringan ialah viral load HIV yang tidak terdeteksi dan respon yang tinggi dari IFN-γ.30
Penelitian pada tikus menunjukkan bahwa respon imun tipe 1, yang mencakup IFN-γ dan IL-12, berhubungan dengan inflamasi dan bukan fibrosis, sedangkan respon tipe 2, mencakup IL-4, IL-5 dan IL-13, berhubungan dengan fibrosis hati. Diantara banyak sitokin, IL-12 merupakan salah satu yang paling penting karena ia memperkuat fungsi sel NK dan T helper 1, menginduksi produksi sitokin lain terutama IFN-γ dan IL-2 dan pembentukan limfosit sitotoksik. Telah dilaporkan bahwa produksi IL-12 sangat berkurang pada pasien dengan infeksi HIV dan terjadi shift dari produksi sitokin tipe 1 ke tipe 2.30
2.5. Anti Retroviral Therapy dan Immune Restoration Disease
Sepuluh sampai 30% pasien infeksi HIV dengan jumlah sel T CD4+ yang rendah dan mendapat ART mengalami infeksi oportunistik baru atau perburukan gejala klinis dari infeksi yang telah ada sebelumnya, suatu kondisi yang
Universitas Indonesia
13
dinamakan immune restoration disease (IRD). Hepatotoksisitas sebagai efek samping ART yang ditandai dengan peningkatan ALT, terjadi pada 18% pasien dengan ko-infeksi virus hepatitis B atau C.11,12 Imunopatogenesis IRD pada ko-infeksi virus hepatitis B memiliki mekanisme yang lebih jelas dibandingkan hepatitis C. Menurunnya jumlah sel T CD4+ pada ko-infeksi HIV dan hepatitis B menyebabkan peningkatan peranan respon imun nonspesifik oleh sel NK, NKT, neutrofil dan monosit. Pada ko-infeksi dengan hepatitis C, peningkatan ALT dihubungkan dengan peningkatan jumlah CD8+ secara total dan peranan kemokin seperti CXCL10 dalam patogenesisnya.11
2.6. Kerangka Teori : Jelas berhubungan : Mungkin berhubungan Sitokin inflamasi Infeksi HIV Infeksi virus Hepatitis C
Sel T Sel NK (CD56+CD3-) Sel NKT (CD56+CD3+) Sel B, Sel dendritik jumlah sel CD4+ respon CD4+ /CD8+ fungsi sel NK gp120 E2 CCR5, CD4 CCR5, CD81 Sel Kupffer respon Th2
Sel stelata hati teraktivasi TGF-β
Inflamasi kronik sel-sel hati, apoptosis , viremia IFN-γ
Universitas Indonesia
15
2.7. Kerangka Konsep
KO-INFEKSI HIV DAN VIRUS HEPATITIS C
sel limfosit CD56+ intrahepatik (NK/NKT)
Sebelum ART Sesudah ART
sel limfosit CD56+ intrahepatik (NK/NKT)
IRD HCV (+) sel CD56+ intrahepatik
IRD HCV (-) sel CD56+ intrahepatik
Fibrosis (skor Ishak ) Fibrosis (skor Ishak )
Viral load HIV ,
sel T CD4+
Viral load HIV ,
sel T CD4+
* HCV: Hepatitis C Virus
BAB 3 METODOLOGI
3.1. Desain penelitian
Desain penelitian yang dipilih adalah studi kohort.
3.2. Tempat dan waktu penelitian
Penelitian ini dilakukan di Departemen Patologi Anatomik FKUI/RSCM pada bulan Maret 2014 - Juni 2014
3.3. Populasi dan sampel penelitian
Populasi terjangkau adalah semua kasus ko-infeksi HIV dan virus hepatitis C yang datang berobat ke klinik HIV/AIDS Pokdisus RSCM, Jakarta. Sampel dipilih secara konsekutif sejak awal tahun 2008 dan didapatkan jumlah sampel sebanyak 48 orang. Evaluasi awal masing-masing pasien saat datang pertama kali mencakup riwayat penyakit, pemeriksaan fisik, hitung jumlah sel T CD4+, HIV-1 RNA serum, hepatitis C virus (HCV)-RNA serum dan biopsi hati pertama. Masing-masing pasien diberikan ART berupa 2 nucleoside reverse transcriptase
inhibitors (NRTI) dan 1 non-nucleoside reverse transcriptase inhibitors (NNRTI)
selama 48 minggu. Jumlah sel T CD4+ dan level ALT dievaluasi pada minggu ke-4,8,12,24 dan 48 setelah pemberian ART. HIV-1 RNA dan HCV-RNA juga dinilai pada minggu ke-48. Biopsi hati kedua disetujui oleh 34 orang pasien dan dilakukan pada minggu ke-48.
3.4. Kriteria inklusi dan eksklusi
Kriteria inklusi ialah pasien dengan seropositivitas hepatitis C, usia 17-50 tahun, tidak ada riwayat ART atau terapi untuk hepatitis C sebelumnya dan jumlah sel T CD4+ <200/µL, setuju untuk dilakukan biopsi hati dan memiliki gambaran biopsi hati dengan jumlah porta yang cukup secara histopatologik.
Kriteria eksklusi ialah seropositivitas hepatitis B, sirosis hati yang nyata secara klinis, kontraindikasi untuk dilakukan biopsi hati, gagal ginjal atau gagal jantung, kehamilan dan konsumsi alkohol >50gr/minggu.
Universitas Indonesia
17
3.5. Variabel penelitian
- Untuk uji hipotesis komparatif rerata sel limfosit CD56+ sebelum dan sesudah pemberian ART serta pada kelompok dengan dan tanpa IRD
o Variabel bebas:
Kelompok sebelum dan sesudah pemberian ART Kelompok dengan dan tanpa IRD virus hepatitis C o Variabel tergantung: rerata sel limfosit CD56+
di hati
- Untuk uji hipotesis korelasi rerata sel limfosit CD56+ dengan jumlah sel T CD4+ di darah tepi, viral load HIV dan virus hepatitis C, serta skor fibrosis, variabelnya adalah:
o Rerata sel limfosit CD56+
di jaringan hati o Jumlah sel T CD4+
di darah tepi o HIV RNA load
o HCV RNA load o Skor fibrosis
3.6. Definisi operasional
3.6.1. Immune restoration disease (IRD) adalah munculnya gelaja klinis akibat aktivasi berlebihan dari restorasi sistem imun setelah pemberian ART pada pasien dengan infeksi HIV terhadap infeksi yang ada sebelumnya, misalnya infeksi Mycobacterium tuberculosis, cytomegalovirus (CMV),
Cryptococcus neoformans dan virus hepatitis.14
3.6.2. Antiretroviral therapy (ART) adalah pemberian terapi yang dasarnya merupakan kombinasi obat antiretroviral (ARV) untuk menekan virus HIV secara maksimal dan menghentikan progresivitas penyakit HIV.31
3.6.3. Skor Ishak merupakan salah satu metode modifikasi hepatic activity
index (HAI) untuk menilai skor aktivitas nekroinflamasi yang diberi nilai
0-18 (poin A-D pada tabel 3.1) dan skor fibrosis yang diberi nilai 0-6 (poin E pada tabel 3.1).32
Tabel 3.1. Skor nekroinflamasi dan fibrosis menurut kriteria Ishak. (dikutip dari Theise ND.32)
Kriteria Skor
A. Hepatitis interface periportal atau periseptal (piecemeal necrosis)
Tidak ada
Ringan (fokal, sedikit area portal)
Ringan/sedang (fokal, banyak area portal)
Sedang (continuous sekitar < 50% traktus atau septa)
Berat ( continuous sekitar > 50% traktus atau septa)
0 1 2 3 4 B. Nekrosis konfluen Tidak ada
Nekrosis konfluen fokal
Nekrosis zona 3 di beberapa area
Nekrosis zona 3 di banyak area
Nekrosis zona 3 dan sedikit jembatan portal-sentral
Nekrosis zona 3 dan jembatan portal-sentral multipel
Nekrosis panasinar atau multiasinar
0 1 2 3 4 5 6 C. Nekrosis litik fokal, apoptosis dan inflamasi fokal
Tidak ada
Satu fokus atau kurang per x10 obyektif
Dua sampai empat fokus per x10 obyektif
Lima sampai sepuluh fokus per x10 obyektif
Lebih dari 10 fokus per x10 obyektif
0 1 2 3 4 D. Inflamasi portal Tidak ada
Ringan, beberapa atau semua area portal
Sedang, beberapa atau semua area portal
Sedang/nyata, semua area portal
Nyata, semua area portal
0 1 2 3 4 E. Fibrosis Tanpa fibrosis
Ekspansi fibrosa dari beberapa porta dengan atau tanpa septa fibrosa pendek.
Ekspansi fibrosa dari mayoritas porta dengan atau tanpa septa fibrosa pendek.
Ekspansi fibrosa dari mayoritas porta dengan beberapa fibrosis jembatan porta ke porta.
Ekspansi fibrosa dari porta dengan jembatan porta ke porta atau porta-sentral yang nyata.
Fibrosis jembatan yang nyata dengan beberapa nodul (sirosis inkomplit).
Sirosis 0 1 2 3 4 5 6
Universitas Indonesia
19
3.7. Alur penelitian
3.8. Bahan dan cara kerja
3.8.1 Pengukuran parameter klinik dan biopsi hati
Sel T CD4+ perifer dihitung menggunakan flow cytometry. Level ALT ditentukan menggunakan ADVIA 1800 Clinical Chemistry Analyser (Bayer, Leverkusen, Germany). HIV RNA dan HCV RNA diukur menggunakan Cobas
Amplicore Monitor (Roche Molecular Systems, Pleasanton, California). Biopsi
hati dilakukan menggunakan jarum Menghini (Hepafix,B-Braun, Melsungen, Germany) untuk mendapatkan jaringan hati sepanjang 2 cm. Jaringan kemudian difiksasi dengan formalin dan dilakukan embedding hingga menjadi blok parafin. Spesimen diwarnai dengan Hematoxylin dan Eosin serta Masson-trichrome untuk menilai skor nekroinflamasi dan fibrosis.15
3.8.2 Pewarnaan Imunohistokimia
Setelah dilakukan penilaian kriteria inklusi dan eksklusi, pewarnaan dilakukan pada 39 spesimen biopsi sebelum ART dan 26 spesimen biopsi sesudah ART pada pasien ko-infeksi hepatitis C dan HIV yang telah tersedia blok parafinnya dan dilakukan pewarnaan imunohistokima dengan antibodi poliklonal anti CD56. Kontrol positif dan kontrol negatif disertakan pada pewarnaan imunohistokimia.
Pengumpulan blok parafin dan pembuatan slaid unstained
Dilakukan pulasan dengan anti CD56
Penghitungan rerata sel limfosit CD56+ pada 3-5 area porta
Analisis hasil
Pengumpulan data klinis dan histopatologik dari penelitian sebelumnya oleh Gani, et al15
Metode pewarnaan:
Jaringan yang telah dijadikan blok parafin dipotong setebal 4μm dan diletakkan pada kaca benda yang telah dilapisi poly-L-lysine. Preparasi sediaan dengan pemanasan di atas slide warmer selama 60 menit pada suhu 56,5o-60oC.
Tahapan berikutnya adalah dilakukan tiga kali deparafinisasi menggunakan xylol masing-masing 5 menit, dilanjutkan rehidrasi dalam alkohol konsentrasi menurun bertahap yaitu alkohol absolut, 95%, dan 80% masing-masing 5 menit. Dilakukan blocking peroksidase endogen dengan 1,5% H2O2/metanol selama 15 menit, dicuci dengan air mengalir selama 5 menit.
Sediaan kemuadian dimasukkan dalam cairan buffer sitrat (pH 6) yang telah dipanaskan sebelumnya selama 10 menit dalam decloacking chamber, didinginkan pada suhu ruang 45 menit, dibilas dengan PBS selama 5 menit, lalu ditandai dengan pap pen. Sediaan diberikan blocking agent selama 15 menit, dicuci dengan PBS selama 5 menit, lalu direndam di dalam larutan putih telur (2 putih telur dalam akuades sampai volume 200 ml) selama 15 menit dan dibilas dengan akuades hingga bersih. Sediaan kemudian dibilas sebentar dengan PBS, direndam dalam larutan susu skim 5% dalam PBS selama 20 menit, dicuci dengan air mengalir hingga bersih kemudian dilanjutkan dengan PBS selama 5 menit.
Sediaan diinkubasi dengan antibodi CD56 (eBioscience, San Diego, CA) dengan pengenceran 1:100 selama 60 menit. Sediaan kemudian dicuci dengan PBS selama 5 menit lalu diinkubasi dengan antibodi sekunder biotinylated
universal secondary antibody (Starrtrek Universal, Biocare Medical, USA) selama
20 menit kemudian dicuci dengan PBS selama 5 menit. Sediaan diinkubasi dengan kompleks peroksidase/streptavidin selama 10 menit, dicuci dua kali dengan PBS+Tween masing-masing 5 menit. Sediaan diinkubasi dengan DAB selama 30 detik kemudian dicuci dengan air mengalir selama 10 menit. Dilakukan counterstain dengan Hematoksilin Meyer selama 1 menit, dicuci dengan air mengalir 5 menit lalu direndam dalam larutan litium karbonat jenuh selama 1 menit dan dilanjutkan dengan air mengalir selama 2 menit. Dilakukan dehidrasi dengan alkohol konsentrasi meningkat yaitu 80%,95% dan alkohol absolut masing-masing selama 5 menit. Sediaan dimasukkan ke dalam xylol sebanyak 3
Universitas Indonesia
21
kali masing-masing selama 5 menit, kemudian sediaan ditutup dengan kaca penutup menggunakan mounting (Entellan, Merck, Germany).
Pada setiap running disertakan kontrol positif berupa jaringan tumor neuroendokrin dan kontrol negatif berupa semua sampel tanpa pemberian antibodi primer.
3.9. Interpretasi Hasil Pewarnaan Imunohistokimia
Pulasan CD56 dikatakan positif jika terdapat warna coklat pada membran sitoplasma atau sitoplasma sel limfosit. Sel limfosit CD56+ akan dinilai dan dilaporkan berupa rerata pada sejumlah area portal yang terlihat (minimal 3 area, maksimal 5 area).
3.10. Pengolahan data
Untuk mengetahui perbedaan antara rerata sel limfosit CD56+ sebelum dan sesudah ART jika data memiliki distribusi normal akan digunakan uji t berpasangan sedangkan perbedaan rerata sel limfosit CD56+ antara kelompok pasien dengan IRD dan tanpa IRD digunakan uji t tidak berpasangan. Untuk mengetahui korelasi antara rerata sel limfosit CD56+ dengan jumlah sel T CD4+ di darah tepi, viral load dan skor fibrosis menggunakan uji korelasi Pearson jika data berdistribusi normal. Signifikansi secara statistik dinilai jika p<0,05. Data sekunder berupa jumlah sel T CD4+ di darah tepi dan viral load HIV dan virus hepatitis C (HIV-RNA dan HCV-RNA) diperoleh dari penelitian sebelumnya oleh Gani, et al.15
BAB 4
HASIL PENELITIAN
4.1. Karakteristik Subyek Penelitian
Berdasarkan kriteria inklusi yang ditetapkan, pada bulan Maret 2008 hingga April 2009, diperoleh 48 pasien yang setuju untuk dilakukan biopsi hati dan diberikan ART selama 48 minggu. Dua pasien meninggal akibat meningoensefalitis tuberkulosa, 1 pasien lost to follow up, dan 11 menolak untuk dilakukan biopsi kedua sehingga pada akhir terapi diperoleh 34 pasien.
Sembilan sampel sebelum ART dan 8 sampel sesudah ART dieksklusi dari penelitian ini karena tidak memiliki jaringan yang cukup untuk dievaluasi lebih lanjut dan dilakukan pulasan imunohistokimia. Pada penelitian ini, sampel yang akan dianalisis ialah 39 sampel sebelum dan 26 sampel sesudah pemberian ART.
Dari 39 sampel awal, mayoritas pasien adalah laki-laki (92%) dan rentang usia pasien mulai dari 22 tahun hingga 35 tahun (median 29 tahun). Semuanya merupakan intravenous drug user (IDU). Tabel 4.1 mencantumkan parameter klinik awal dan parameter histopatologik yang dinilai pada 39 sampel sebelum pemberian ART dan 26 sampel setelah pemberian ART. Perbandingan data berpasangan pada 26 pasien sebelum dan sesudah pemberian ART dapat dilihat pada tabel 4.2.
Tabel 4.1. Parameter klinik dan histopatologik pada penelitian ini.
Sebelum ART (n=39) Sesudah ART (n=26) Parameter klinik
Jumlah sel T CD4+, sel/µL 28 (7-65) 122 (85-148)
HIV RNA load di plasma, log10 kopi/mL 5,3 (4,9-5,5) 0(0-0)*
HCV RNA load di plasma, log10 kopi/mL 5,7 (4,3-5,9) 5,6 (5,6-6,0) Parameter histopatologik
Skor nekroinflamasi (0-18) 5 (4-7) 4 (3-6)
Skor fibrosis (0-6) 1 (1-1) 1 (1-2)
Rerata sel limfosit CD56+ pada 3-5 area porta
0,75 (0.3-1.5) 0,67 (0,3-1,35)
Data yang ditampilkan dalam bentuk median dan interquartil range.
*Hanya 3 pasien yang masih memiliki HIV-RNA yang terdeteksi setelah pemberian ART (tabel induk pada lampiran)
Universitas Indonesia
23
Tabel 4.2. Perbandingan data berpasangan pada 26 pasien sebelum dan sesudah pemberian ART.
Sebelum ART (n=26) Sesudah ART (n=26) Parameter klinik
Jumlah sel T CD4+, sel/µL 34 (8-56) 122 (85-148)
HIV RNA load di plasma, log10 kopi/mL 5,3 (4,9-5,5) 0(0-0)*
HCV RNA load di plasma, log10 kopi/mL 5,7 (4,8-6,0) 5,6 (5,6-6,0) Parameter histopatologik
Skor nekroinflamasi (0-18) 5(4-6) 4 (3-6)
Skor fibrosis (0-6) 1(1-2) 1 (1-2)
Rerata sel limfosit CD56+ pada 3-5 area porta
0,4 (0,2-1) 0,67 (0,3-1,35)
Data yang ditampilkan dalam bentuk median dan interquartil range.
*Hanya 3 pasien yang masih memiliki HIV-RNA yang terdeteksi setelah pemberian ART (tabel induk pada lampiran)
4.2. Gambaran histopatologik dan pulasan imunohistokimia dengan CD56
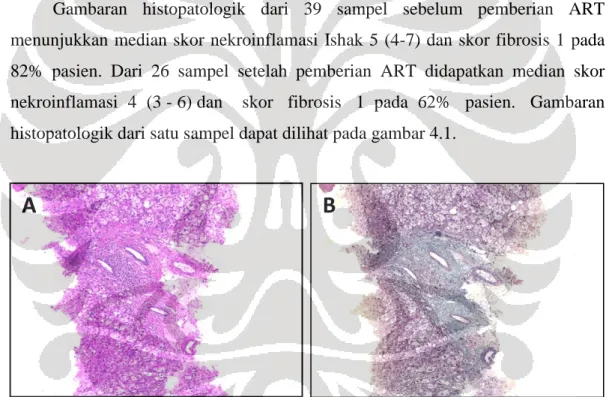
Gambaran histopatologik dari 39 sampel sebelum pemberian ART menunjukkan median skor nekroinflamasi Ishak 5 (4-7) dan skor fibrosis 1 pada 82% pasien. Dari 26 sampel setelah pemberian ART didapatkan median skor nekroinflamasi 4 (3 - 6) dan skor fibrosis 1 pada 62% pasien. Gambaran histopatologik dari satu sampel dapat dilihat pada gambar 4.1.
Gambar 4.1. A. Gambaran histopatologik pada salah satu kasus yang menunjukkan skor nekroinflamasi Ishak 10 (H&E,x100) dan B. skor fibrosis 4 (Trikrom,x100).
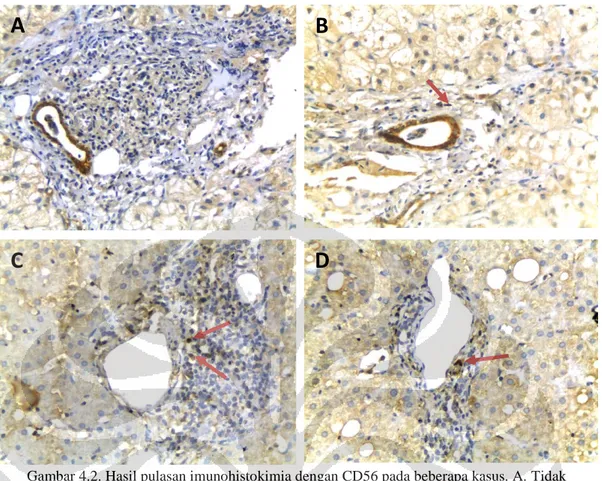
Baik sebelum maupun setelah ART, sel limfosit CD56+ tidak ditemukan (gambar 4.2A) atau ditemukan dalam jumlah minimal di area porta (gambar 4.2B-D). Sebagian kasus menunjukkan positivitas pada sel epitel duktus bilier sehingga digunakan sebagai kontrol internal pada kasus-kasus tersebut (gambar 4.2A,B).
Gambar 4.2. Hasil pulasan imunohistokimia dengan CD56 pada beberapa kasus. A. Tidak ditemukan sel limfosit CD56+. B-D. Ditemukan sedikit sel limfosit CD56+ di area porta (panah).
Beberapa kasus menunjukkan positivitas pada sel epitel duktus (A,B, x400)
4.3. Perbedaan rerata sel limfosit CD56+ di hati sebelum dan sesudah pemberian ART dan korelasinya dengan berbagai variabel
Rerata sel limfosit CD56+ sebelum terapi (median 0,75) tidak menunjukkan perbedaan bermakna dengan rerata limfosit CD56+ sesudah terapi (p=0,35). Rerata limfosit CD56+ tidak berkorelasi dengan skor fibrosis baik sebelum maupun sesudah ART (r=-0,08, p=0,63 dan r=-0,03, p=0,86 secara berturutan).
Rerata sel limfosit CD56+ di hati pada 39 sampel awal tidak memiliki korelasi, baik dengan jumlah sel T CD4+ di darah tepi (r=0,05, p=0,75), dengan HIV RNA load (r=0,09, p=0,57), dan dengan HCV RNA load (r=0,09, p=0,5). Setelah pemberian ART selama 48 minggu, rerata sel limfosit CD56+ di hati tetap tidak memiliki korelasi dengan jumlah sel T CD4+ di darah (r=0,12, p=0,57), dengan HIV RNA load (r=0,18, p=0,38), dan dengan HCV RNA load (r=0,07, p=0,71).
A
B
C
D
A
B
Universitas Indonesia
25
4.4. Komparasi rerata sel limfosit CD56+ di hati antara kelompok dengan dan tanpa IRD virus hepatitis C
Lima dari 39 sampel awal menunjukkan peningkatan level ALT >3x diatas level awal atau 5x dari nilai batas atas ALT. Pada penelitian ini, nilai batas atas atas ALT yang digunakan ialah 50 U/L dan kelima sampel ini dimasukkan dalam kelompok IRD virus hepatitis C. Tidak terdapat perbedaan bermakna (p=0,12) antara kelompok dengan IRD virus hepatitis C [0,3 (0,0-1,0)] dan tanpa IRD virus hepatitis C [0,9 (0,3-1,7)].
BAB 5 PEMBAHASAN
Karakteristik pasien pada penelitian ini secara umum serupa dengan demografik dalam beberapa penelitian lain dimana penderita ko-infeksi HIV dan virus hepatitis C mayoritas ditemukan pada jenis kelamin laki-laki dan usia dewasa muda.33,34 Penderita HIV dengan riwayat penggunaan obat-obatan melalui jarum suntik (intravenous drug user/IDU) memiliki angka kejadian ko-infeksi virus hepatitis C yang lebih tinggi dibanding rute penularan lain seperti hubungan seksual maupun penularan vertikal dari ibu ke anak.10 Hal ini sesuai dengan yang ditemukan pada penelitian ini dimana semua pasien merupakan IDU.
Berdasarkan gambaran histopatologik didapatkan median skor nekroinflamasi yang cukup rendah dan belum menderita sirosis. Gani, et al15 dalam penelitian sebelumnya terhadap sampel yang sama telah memaparkan secara rinci mengenai parameter histologik skor nekroinflamasi dan fibrosis serta hubungannya dengan pemberian ART dimana didapatkan penurunan skor nekroinflamasi dan tidak adanya perbaikan dalam skor fibrosis setelah pemberian ART selama 48 minggu.
Pada penelitian ini didapatkan sel limfosit CD56+ yang sangat minimal pada area porta pada biopsi awal dan ini tidak meningkat setelah pemberian ART. Hal ini sesuai dengan literatur dimana infeksi HIV dan virus hepatitis C baik pada mono infeksi maupun pada ko-infeksi dapat mempengaruhi jumlah maupun fungsi sel NK dan NKT .30,35
Penurunan dan disfungsi sel NK pada infeksi virus hepatitis C dikarenakan adanya ikatan antara protein permukaan virus hepatitis C (HCV-E2) dengan reseptornya CD81 pada sel NK.10,36 Hal ini menyebabkan terhambatnya aktivasi, produksi sitokin, pelepasan granul sitotoksik dan proliferasi sehingga virus hepatitis C dapat meloloskan diri dari aktivitas anti viral sel NK dan menyebabkan kronisitas dari penyakit ini.36
Hal serupa juga dialami oleh sel NKT pada infeksi virus hepatitis C. Kawarayabashi,et al6 membuktikan bahwa proporsi sel NKT mengalami penurunan bermakna pada infeksi virus hepatitis kronik dan sirosis hati jika
27
dibandingkan dengan populasi normal.
Meier et al35 membuktikan dalam penelitiannya bahwa terdapat penurunan jumlah sel NK dan shift di antara subset sel NK pada infeksi HIV dan virus hepatitis C. Penurunan jumlah sel NK di darah tepi bukan disebabkan oleh akumulasi sel tersebut di hati pada penderita virus hepatitis C karena dalam penelitian ini ditemukan rasio serupa antara sel NK di darah tepi dengan jumlahnya di jaringan hati. Penelitian ini juga menunjukkan adanya penurunan kemampuan sel NK dalam menghasilkan IFN-γ, penurunan ekspresi perforin yang berhubungan dengan penurunan kemampuan sitolitiknya serta penurunan bentuk sel NK yang matur.
Jumlah sel NKT pada infeksi kronik HIV juga sangat berkurang jika dibandingkan dengan individu normal,29,37,38 Hal ini diperkirakan sebagai akibat banyaknya sel NKT yang mengekspresikan CD4 dan CCR5 pada permukaannya sehingga mudah terinfeksi HIV.30
Sampai saat ini, literatur yang membahas secara spesifik mengenai sel NK dan NKT pada ko-infeksi virus hepatitis C dan HIV masih terbatas. Infeksi HIV diketahui memiliki efek yang lebih buruk pada sel NK jika dibandingkan dengan infeksi virus hepatitis C. Infeksi HIV dapat mengubah efek inhibisi dari sel NK untuk melisiskan sel target sehingga eliminasi virus hepatitis C pada pasien HIV menjadi terhambat dan terjadi progresivitas penyakit.30
Pemberian ART selama 48 minggu pada penelitian ini ternyata tidak meningkatkan rerata sel limfosit CD56+ di hati. Beberapa literatur mengatakan bahwa jumlah sel NK meningkat pada pemberian ART.8,9 Namun, penelitian oleh Valentin,et al39 menunjukkan bahwa meskipun dengan pemberian ART selama 2 tahun, masih terdapat DNA proviral pada sel NK pasien dengan infeksi HIV. Penelitian lain oleh Azzoni et al40 menunjukkan bahwa adanya kemungkinan tidak kembalinya fungsi produksi IFN-γ oleh sel NK setelah pemberian ART.
Hasil penelitian ini juga didukung oleh teori yang mengatakan bahwa jumlah sel NKT akan kembali meningkat dengan kombinasi terapi IL-2 dan ART, namun tidak dengan pemberian ART saja.30 Hal ini juga didukung oleh beberapa penelitian lainnya yang tidak menunjukkan peningkatan jumlah sel NKT setelah pemberian ART.37,38 Meskipun ART tidak dapat mengembalikan persentasi sel
NKT, setidaknya ART dikatakan dapat mencegah penurunan jumlah lebih lanjut.37 Di lain pihak, kombinasi terapi HIV dan virus hepatitis C berupa ART dan ribavirin ternyata tetap tidak mampu mengembalikan kehilangan sel NKT pada ko-infeksi ini.38 Berbagai teori ini mungkin dapat menjelaskan tidak kembalinya sel NK dan NKT di hati pada penelitian ini meskipun setelah pemberian ART selama 48 minggu.
Pemberian ART dilaporkan berhubungan erat dengan viral load HIV dimana terdapat korelasi terbalik antara level viremia dan kemampuan sel NK untuk mengontrol replikasi HIV.41,42 Namun demikian, Azzoni et al40 menunjukkan bahwa deplesi sel NK yang memproduksi IFN-γ tidak berkorelasi baik dengan viral load maupun hitung jenis sel T CD4+, yang menimbulkan pemikiran adanya perubahan sel NK sejak awal terjadinya infeksi. Hal ini mendukung temuan dalam penelitian ini dimana rerata sel limfosit CD56+ di hati tidak berkorelasi dengan viral load HIV maupun jumlah sel T CD4+ di darah tepi baik sebelum maupun sesudah pemberian ART.
Glassner et al43 membuktikan dalam penelitiannya bahwa pada ko-infeksi HIV dan virus hepatitis C, terdapat gangguan sekresi IL-2 oleh sel T CD4+. IL-2 dalam keadaan normal berfungsi menstimulasi ekspresi NKG2D pada permukaan sel NK sehingga fungsi anti-fibrosisnya terhadap sel stelata di hati menjadi aktif. Frekuensi IL-2 ini terbukti menurun pada ko-infeksi dibandingan dengan mono infeksi virus hepatitis C. Penelitian mereka menunjukkan bahwa disfungsi ini terjadi pada jumlah sel T CD4+ yang lebih tinggi dan jumlah viral load HIV yang lebih rendah dibandingkan dengan subyek penelitian ini. Hal ini mendukung hasil penelitian ini bahwa bahkan setelah adanya peningkatan jumlah sel CD4+ dan penurunan viral load HIV setelah pemberian ART, tetap ditemukan jumlah sel NK/NKT yang rendah di jaringan hati.
Dalam hubungannya dengan viral load virus hepatitis C, juga tidak didapatkan korelasi dengan rerata sel CD56+ di hati baik sebelum maupun setelah pemberian ART. El Aggan, et al26 menunjukkan bahwa sel NK dan NKT di darah perifer dan intrahepatik menunjukkan korelasi negatif dengan level HCV RNA serum. Perbedaan temuan ini diperkirakan sebagai akibat ko-infeksi dengan HIV +
29
baik di darah tepi maupun di jaringan hati yang tidak dapat terkoreksi hanya dengan pemberian ART saja.
Penelitian ini menunjukkan bahwa rerata sel limfosit CD56+ tidak berkorelasi dengan skor fibrosis baik sebelum maupun sesudah pemberian ART. Temuan ini berbeda dengan penelitian oleh El Aggan et al26 yang menunjukkan korelasi negatif antara sel NK dan NKT di darah tepi dan intrahepatik dengan level HCV RNA, steatosis, fibrosis dan sel stelata hati yang teraktivasi pada pasien dengan mono infeksi virus hepatitis C. Hal ini menunjukkan kemungkinan adanya pengaruh infeksi HIV terhadap progresivitas penyakit hepatitis C di hati maupun efek langsung virus HIV terhadap sel NK dan NKT sehingga terjadi disfungsi kedua populasi sel tersebut dalam pengaruhnya terhadap fibrogenesis.
Tidak adanya perbedaan bermakna dalam rerata sel limfosit CD56+ antara kelompok dengan dan tanpa IRD virus hepatitis C menunjukkan minimnya peranan sel limfosit CD56+ serta kemungkinan peranan sel imun dan sitokin lainnya dalam patogenesis IRD virus hepatitis C. Hal ini telah dibuktikan dalam penelitian sebelumnya oleh Yunihastuti et al14 yang menunjukkan peranan antibodi terhadap virus hepatitis C pada awal terapi dan kemungkinan subset sel T lain dalam patogenesis IRD virus hepatitis C.
BAB 6
KESIMPULAN DAN SARAN
6.1 Kesimpulan
Terdapat deplesi sel NK dan NKT intrahepatik pada ko-infeksi HIV dan virus hepatitis C. Ko-infeksi ini mungkin memiliki efek permanen terhadap sel NK dan NKT di hati, dan pemberian ART saja tidak bisa mengembalikan jumlah kedua populasi sel ini di jaringan hati.
6.2 Saran
1. Diperlukan penelitian lebih lanjut untuk membandingkan sel NK dan NKT di darah tepi dan jaringan hati pada pasien ko-infeksi HIV dan virus hepatitis C.
2. Diperlukan penelitian lebih lanjut dalam hal terapi untuk mengetahui apakah kombinasi ART dan terapi untuk virus hepatitis C dapat mengembalikan jumlah dan fungsi kedua populasi sel tersebut di darah tepi dan jaringan hati pada pasien ko-infeksi ini.
31
DAFTAR PUSTAKA
1. Blackard JT, Sherman KE. HCV⁄ HIV co-infection: time to re-evaluate the role of HIV in the liver? J Viral Hepatitis.2008;15:323–30.
2. Ministry of Health, Republic of Indonesia. Basic Health Research 2010 Available at: http://www.litbang.depkes.go.id
3. Talal AH, Canchis PW, Jacobson IM. The HCV and HIV coinfected Patient: what have we learned about pathophysiology? Current Gastroenterology Reports.2002;4:15–22.
4. Gao B, Radaeva S, Park O. Liver natural killer and natural killer T cells: immunobiology and emerging roles in liver diseases. J Leukoc Biol.2009;86:513-28.
5. Racanelli V, Rehermann B. The liver as an immunological organ. Hepatology.2006;43:S54-62.
6. Kawarabayashi N, Seki S, Hatsuse K, Ohkawa T, Koike Y, Aihara T, et al. Decrease of CD56+ T cells and natural killer cells in cirrhotic livers with hepatitis C may be involved in their susceptibility to hepatocellular carcinoma. Hepatology.2002;32:962-9.
7. Ahmad A, Alvarez F. Role of NK and NKT cells in the immunopathogenesis of HCV-induced hepatitis. J Leukoc Biol.2004;76:743-59.
8. Bruunsgaard H, Pedersen C, Skinhoj P, Pedersin BK. Clinical progression of HIV infection: role of NK cells. Scand J Immunol. 1997;46:91-5.
9. Scott-Algara D, Paul P. NK cells and HIV infection: Lessons from other viruses. Curr Mol Med.2002;2:757-68.
10. Rotman Y, Liang TJ. Coinfection with hepatitis C virus and human immunodeficiency virus: virological, immunological and clinical outcomes. J Virol.2009;83:7366-74.
11. Crane M, Matthews G, Lewin SR. Hepatitis virus immune restoration disease of the liver. Current Opinion in HIV and AIDS.2008;3:446–52.
12. French MA, Price P, Stone SF. Immune restoration disease after anti retroviral therapy. AIDS.2004;18:1615–27.
13. John M, Flexman J, French MAH. Hepatitis C virus-associated hepatitis following treatment of HIV-infected patients with HIV protease inhibitors: an immune restoration disease? AIDS.1998;12:2289–93.
14. Yunihastuti E, Lee S, Gani RA, Saraswati H, Sundaru H, Lesmana LA, Sukmana N, et al. Antibody and markers of T-cell activation illuminate the pathogenesis of HCV immune restoration disease in HIV/HCV co-infected patients commencing ART. Clin immunol.2011;139:32-9.
15. Gani RA, Yunihastuti E, Krisnuhoni E, Saraswati H, Lesmana L, Djauzi S,et al. Periportal CD4+ cell infiltration increases in HIV/Hepatitis C virus-coinfected patients commencing ART, whereas CD8+ cells clear from the liver. J Infect Dis.2014;210:405-9.
16. Quaranta MG. Mattioli B, Vella S. Glances in immunology of HIV and HCV infection. Advances in Virology.2012 (cited 2013 Aug 23). Available from:
http://www.hindawi.com.
17. Operskalski EA, Kovacs A. HIV/HCV co-infection: pathogenesis, clinical complication, treatment and new therapeutic technologies. Aurr HIV/AIDS Rep.2011;8:12-22
18. Rockstroh JK, Spengler U. HIV and hepatitis C virus co-infection. Lancet Infect Dis.2004;4:437–44.
19. Dabbs D. Diagnostic Immunohistochemistry 2nd ed. Philadelphia: Churchill Livingstone. 2006. p.142-3, 264
20. Mahjoub FE, Khairkhah RH, Sani MN, Irvanloo G, Monajemzadeh M. CD56 staining in liver biopsies does not help in differentiating extrahepatic biliary atresia from other causes of neonatal cholestasis. Diagnostic Pathol.2008;3:10.
21. Jain A, Ryan C, Mohanka R, Orloff M, Abt P, Romano J, et al. Characterization of CD4, CD8,CD56 positive lymphocytes and C4d deposits to distinguish acute cellular rejection from recurrent hepatitis C in post-liver transplant biopsies. Clin Transplant.2006;20:624-33.
22. Mackay IR. Hepatoimmunology: a perspective. Immunol Cell Biol.2002;80:36–44.
23. Tu Z. Bozorgzadeh A, Crispe IN, Orloff MS. The activation state of human intrahepatic lymphocytes. Clin Exp Immunol.2007;149:186-93.
24. Norris S. Collins C. Doherty DG. Smith F, McEntee G, Traynor O, et al. Resident human hepatic lymphocytes are phenotypically different from circulating lymphocytes. J Hepatol.1998;28:84-90.
25. Sun H, Sun C, Tian Z, Xiao W. NK cells in immunotolerant organs. Cell Mol Immunol.2013;10:202-12.
26. El Aggan HA, Mohamed FAS, El Deeb N, El Sawy MM, Shater MS. Peripheral blood and intrahepatic natural killer cells in chronic hepatitis C: relation to disease activity and hepatic fibrosis. J Med Res Inst.2008;29:28-39.
27. Varchetta S, Mele D, Mantovani S, Oliviero B, Cremonesi E, Ludovisi S, et al. Impaired intrahepatic Natural Killer cell cytotoxic function in chronic hepatitis C virus infection. Hepatology.2010;56:841-49.
28. Ye L, Wang X, Wang S, Wang Y, Song L, Hou W. CD56+ T cells inhibit hepatitis C virus replication in human hepatocytes. Hepatology.2009;49:753-62.
29. Gonzales VD, Landay AL, Sandberg JK. Innate immunity and chronic immune activation in HCV/HIV co-infection. Clin Immunol.2010;135:12-25. 30. Bruno R, Sacchi P, Puoti M, Maiocchi L, Patruno S, Cima S, et al.
Pathogenesis of liver damage in HCV-HIV patients. AIDS Rev.2008;10:15-24.
31. HIV/AIDS Antiretroviral therapy (homepage on the internet). World Health Organization (cited 2013 Sept 18). Available from: http://www.who.int/hiv/topics/treatment/en/
32. Theise ND. Liver biopsy assessment in chronic viral hepatitis: a personal, practical approach. Modern Pathol.2007;20:S3-14.
33. Buxton JA, Yu A, Kim PH, Spinelli JJ, Kuo M, Alvarez M, et al. HCV co-infection in HIV positive population in British Columbia, Canada. BMC Public Health.2010;10:225.
34. Ponamgi SPD, Rahamathulla S, Kumar YN, Chandra M, Lakshmi N, Habibullah CM. Prevalence of hepatitis C virus (HCV) coinfection in HIV infected individuals in south India and characterization of HCV genotypes.
33
35. Meier UC, Owen R, Taylor E, Worth A, Naoumov N, Willberg C, et al. Shared alteration in NK cell frequency, phenotype and function in chronic human immunodeficiency virus and hepatitis C virus infection. J Virol.2005;79:12365-74.
36. Crotta S, Stilla A, Wack A, D’Andrea A, Nuti S, D’Oro U, et al. Inhibition of natural killer cells through engagement of CD81 by the major hepatitis C virus envelope protein. J Exp Med.2002;195:35-41.
37. Vasan S, Poles M, Horowitz A, Siladji EE, Markowitz M, Tsuji M. Function of NKT cells, potential anti HIV-effector cells, are improved by beginning HAART during acute HIV-1 infection. Intern Immunol.2007;19:943-51. 38. Moll M, Kuylenstierna C, Gonzales VD, Andersson SK, Bosnjak L,
Sonnerborg A, et al. Severe functional impairment and elevated PD-1 expression in CD1d-restricted NKT cells retained during chronic HIV-1 infection. Eur J Immunol.2009;39:902-11.
39. Valentin A, Rosati M, Patenaude DJ, Hatzakis A, Kostrikis LG, Lazanas M, et al. Persistent HIV-1 infection of natural killer cells in patients receiving highly active antiretroviral therapy. PNAS.2002;99:7015-20.
40. Azzoni L, Papasavvas E, Chehimi J, Kostman JR, Mounzer K, Ondercin J, et al. Sustained impairment of IFN-γ secretion in suppressed HIV-infected patients despite mature NK cell recovery: evidence for a defective reconstitution of innate immunity. J Immunol.2002;168:5764-70.
41. Kottilil S, Chun T-W, Moir S, Liu S, McLaughlin M, Hallahan CW. .Innate immunity in human immunodeficiency virus infection: effect of viremia on natural killer cell function. J Infect Diseases.2003;187:1038-45.
42. Kottilil S, Shin K, Planta M, McLaughlin M, Hallahan CW, Ghany M, et al. Expression of chemokine and inhibitory receptors on natural killer cells: effect of immune activation and HIV viremia. J Infect Dis.2004;189:1193-8. 43. Glassner A, Eisenhardt M, Kokordelis P, Kramer B, Wolter F, Nischalke HD,
et al. Impaired CD4+ T cell stimulation of NK cell anti-fibrotic activity may contribute to accelerated liver fibrosis progression in HIV/HCV patients.J Hepatol.2013;59:427-33.