31 4.1. Jenis Penelitian
Penelitian ini merupakan penelitian eksperimental berbasis hewan, dengan memberi perlakuan terhadap tikus Rattus norvegicus sebagai hewan coba di laboratorium. Dipilihnya jenis penelitian ini karena dapat menghasilkan data dengan validitas yang tinggi dikarenakan perlakuan dan kondisi percobaan dapat diatur oleh peneliti sehingga dapat mengurangi bias-bias yang mungkin menggangu analisa (Zainuddin, 1999).
4.2. Tempat
Penelitian dilakukan di Laboratorium Biomedik, Laboratorium Histologi dan Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional (B2P2TOOT), Kementerian Kesehatan, Tawangmangu.
4.3. Subjek Penelitian
Subjek penelitian adalah tikus putih jantan (Rattus norvegicus) dewasa dengan berat badan 200 gram dan berumur 3-4 bulan. Bahan makanan tikus putih yang digunakan adalah BR I. Pemilihan hewan coba tikus putih berdasarkan pertimbangan bahwa paling sering dipakai pada penelitian biomedik, mempunyai sifat dan komponen darah yang mirip dengan manusia, ukuran yang relatif besar dibandingkan dengan mencit sehingga lebih mudah dilakukan prosedur CLP, dan mempunyai kemampuan beradaptasi dalam lingkungan laboratorium.
Pemilihan kelamin jantan dimaksud untuk menghindari pengaruh hormonal, umur 3-4 bulan merupakan tikus umur dewasa muda (Carson et al., 2005).
Pada penelitian ini diadakan dua kelompok yang mana pada kelompok pertama (A) untuk mengukur kadar IL-1 Beta plasma dan kelompok kedua (B) untuk mengukur aktivasi caspase-1.
Kelompok “A” (IL-1β) terdiri dari tiga sub-kelompok tikus yang masing-masing adalah satu kelompok kontrol, satu kelompok perlakuan, dan satu kelompok terapi :
1. Kelompok yang dilakukan prosedur CLP yang diberi plasebo NaCl 0,9% yang disebut ”Perlakuan-A”.
2. Kelompok yang dilakukan prosedur CLP yang diberi perlakuan dengan Chloroquine oral, yang diberi kode kelompok “Terapi-A”.
3. Kelompok Kontrol adalah kelompok tikus tanpa prosedur CLP dan diberi NaCl 0,9% peroral, disebut “Kontrol-A”.
Kelompok “B” (aktivasi Caspase-1) terdiri dari 3 sub-kelompok:
1. Kelompok yang dilakukan prosedur CLP yang diberi plasebo NaCl 0,9% peroral yang disebut “Perlakuan-B”.
2. Kelompok yang dilakukan prosedur CLP yang diberi perlakuan dengan Chloroquine oral, yang diberi kode kelompok “Terapi-B”.
3. Kelompok Kontrol adalah kelompok tikus tanpa prosedur CLP dan diberi NaCl 0,9% peroral, disebut “Kontrol-B”.
4.4. Besar Sampel
Untuk mengurangi bias sampling, maka teknik pengelompokan sampel pada penelitian ini adalah dengan menggunakan random sampling.
Untuk pengambilan besar sampel dihitung berdasarkan rumus besar sampel: n = (Steel and Torrie, 1980)
2
diambil dari studi yang sama sebelumnya atau maka diasumsikan 2 ≈ 2, sehingga hasilnya :
n = (Z½ α + Zβ) 2
n = (1,645 + 0,842) 2 = 6,185 dibulatkan menjadi 6 Keterangan :
N = besar sampel masing-masing kelompok
Z½α = nilai standar normal, yang besarnya tergantung α, bila α = 0,05, maka Z½α = 1,645
Zβ = nilainya tergantung β yang ditentukan (berdasarkan tabel)
Minimal sampel tiap kelompok adalah 6 ekor tikus putih. Dalam penelitian ini kami menggunakan minimal 6 sampel untuk setiap kelompoknya, namun dikarenakan karena tingkat mortalitas sepsis cukup tinggi, pada kelompok yang dilakukan prosedur CLP yang bersifat invasif dan diketahui akan menimbulkan tingkat sepsis yang lebih berat (Menezes et al 2008, Toscano et al 2013), kami menggunakan 10 sampel.
Penentuan besar sampel (sample size) melibatkan parameter tingkat
kesalahan (error term) atau α dan tingkat kekuatan pengujian (power test) atau 1-β. 4.5. Identifikasi Variabel 4.5.1. Variabel tergantung: a. IL-1β b. Aktivasi Caspase-1 c. Survival rate
4.5.2. Variabel bebas: Chloroquine
4.6. Definisi Operasional
Tabel 2 . Definisi Operasional Variabel
Parameter Definisi Alat
Ukur
Satuan Data
Skala Data IL-1β IL-1β adalah sitokin
pro-inflamasi dari keluarga IL-1 dengan berat molekul 17.5 kDa yang diproduksi oleh sel makrofag, monosit, sel-endotel.
ELISA dengan reagen IL-1β Tikus dari Thermo fisher, USA pada serum.
pg/ml Rasio
Aktivasi Caspase-1
Sebuah Zymogen yang diaktivasi oleh
inflammasome menjadi terbelah menjadi dua sub unit heterodimer, yaitu 20 kDa (p20) dan 10 kDa (p10). Bertugas merubah pro IL-1B menjadi bentuk aktif dan menjadi dasar mekanisme pyroptosis sel. Didapatkan terutama pada sel-sel innate immune system.
Flow cytometry dengan FLICA-660 YVAD FMK (Immunochemistry, USA) pada sampel isolate PBMC dan whole blood.
% Rasio
Survival rate
Jumlah tikus masing-masing kelompok yang tidak mati atau moribund selama rentang waktu penelitian masing-masing kelompok.
Survival rate diperiksa setiap 24 jam selama jalannya penelitian. Hewan coba dianggap mati bila detak jantung tidak terdengar, respirasi tidak terdeteksi atau dalam kondisi Moribund State,
yang kemudian
dikorbankan.
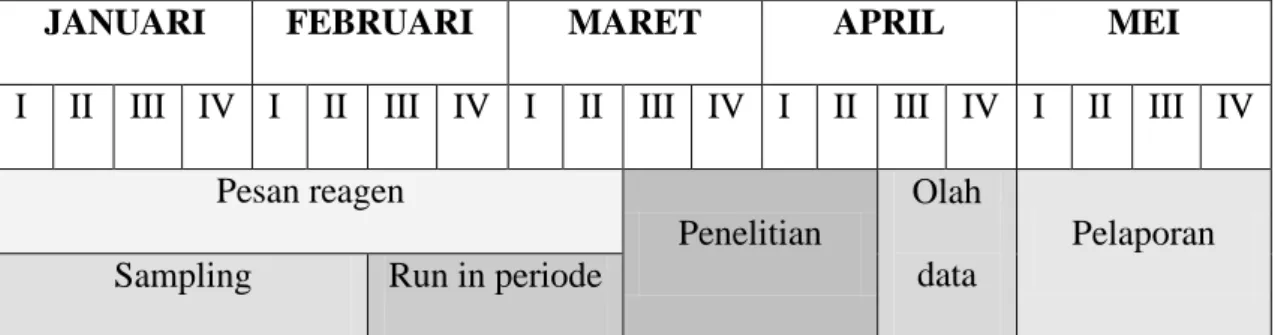
4.7. Waktu
Waktu yang diperlukan dalam penelitian ini selama 5 bulan dengan jadwal penelitian sebagai berikut.
Tabel 3. Jadwal Kegiatan Penelitian
JANUARI FEBRUARI MARET APRIL MEI
I II III IV I II III IV I II III IV I II III IV I II III IV Pesan reagen
Penelitian
Olah data
Pelaporan Sampling Run in periode
4.8. Cara Kerja
4.8.1. Pemeliharaan hewan coba
Dari 100 ekor tikus diambil secara random sampling sebanyak 70 ekor tikus. Hewan uji diadaptasi dengan kondisi laboratorium kurang lebih satu minggu. Tikus hasil randomisasi kemudian dialokasikan menjadi dua kelompok; “A” dan “B”.
Selama masa aklimatisasi dan masa percobaan, semua binatang percobaan dipelihara, dilakukaan perlakuan dan diberi terapi di fasilitas ujicoba hewan Universitas Sebelas Maret.
Hewan coba dipelihara di kandang besi berventilasi dengan ukuran 100X50X50 cm. Dalam tiap kandang maksimal populasi tikus adalah 10 ekor. Suhu ruangan tempat pemeliharaan hewan berkisar antara 25-27°C. Hewan coba diberikan akses bebas atas air dan makanan.
4.8.2. Kelompok “A” (IL-1β)
Untuk kelompok IL-1β hewan uji dikelompokkan secara acak menjadi tiga sub-kelompok. Sub-kelompok ini menggunakan 10 tikus yang dilakukan prosedur CLP + NaCl 0,9% (Perlakuan-A) dan 10 ekor tikus untuk sub-kelompok CLP + Chloroquine (Terapi-A). Sedangkan kelompok kelompok kontrol (Kontrol-A), kami menggunakan 6 ekor tikus. Tiap sub kelompok ditempatkan di dalam kandang terpisah yang telah diberi tanda.
a. Dilakukan operasi ligasi sekum dan pungsi (CLP) pada kelompok P1 dan P2. b. Pemberian perlakuan Choloroquine atau NaCl 0,9% dilakukan pada jam ke
24, 48, 73, dan 96 sejak dilakukannya CLP.
c. Sejak hari ke-1 sampai hari ke-5. Semua kelompok diberi diet standar.
d. Setiap jumlah makanan yang dihabiskan, dan diperiksa akan tanda-tanda sepsis seperti hudling, inaktivitas, diare, dan piloereksi.
e. Pemeriksaan survival rate dilakukan setiap 24 jam sejak dilakukannya CLP. f. Tikus yang menunjukkan tanda-tanda mendekati kematian (moribund state),
dikorbankan dan dicatat sebagai mortalitas.
g. Pada hari ke 6 dilakukan pengambilan sampel darah (@2ml) dan kemudian semua tikus yang masih hidup dikorbankan dengan cara dislokasi servikal.
4.8.3. Kelompok ”B” (Aktivasi Caspase-1)
Untuk kelompok Aktivasi Caspase-1 hewan uji dikelompokkan secara acak menjadi tiga sub-kelompok. Kelompok yang dilakukan prosedur CLP yang diberi plasebo NaCl 0,9% (Perlakuan-B) menggunakan 10 ekor tikus. Kelompok
yang dilakukan prosedur CLP yang diberi perlakuan dengan Chloroquine oral (Terapi-B).
a. Dilakukan operasi ligasi sekum dan pungsi (CLP) pada kelompok Perlakuan-B dan Terapi-Perlakuan-B.
b. Pemberian perlakuan Choloroquine atau NaCl 0,9% pada kelompok Perlakuan-B dan Terapi-B dilakukan pada jam ke 24, 48, 72 sejak dilakukannya CLP.
c. Sejak hari ke-1 sampai hari ke-5 semua kelompok diberi diet standar.
d. Setiap hari populasi tikus dimonitor nafsu makan dari jumlah makanan yang dihabiskan, tanda-tanda sepsis seperti hudling, inaktivitas, diare, dan piloereksi.
e. Pemeriksaan survival rate dilakukan setiap 24 jam sejak dilakukannya CLP. f. Tikus yang menunjukkan tanda-tanda mendekati kematian (moribund state),
dikorbankan dan dicatat sebagai mortalitas.
g. Pada hari ke 5 pada semua sub-kelompok dilakukan pengambilan sampel darah (@3ml) dan kemudian semua tikus yang masih hidup dikorbankan dengan cara dislokasi servikal.
4.8.4. Prosedur induksi sepsis
Hewan coba model sepsis dalam penelitian ini digunakan Cecal Ligation and Puncture (CLP) dimana pengikatan Sekum sebelah distal dari katup ileocecal dan penusukan akan menyebabkan isi dari keluar ke rongga intraperitoneal dan menyebabkan fokus infeksi polimikrobial dalam rongga abdomen diikuti oleh
translokasi bakteri ke dalam kompartemen darah yang kemudian memicu respon inflamasi sistemik (SIRS). Cara CLP diambil dikarenakan masih merupakan prosedur induksi sepsis pada hewan percobaan yang menyebabkan gejala-gejala polimikrobial sepsis paling mirip seperti yang terjadi pada manusia. Kelemahan dari teknik ini adalah teknik yang lebih sulit, waktu yang lebih lama, onset sepsis yang kadang sulit diprediksi dan tingkat kematiannya yang besar (REF). Tingkat keparahan dari sepsis, menurut referensi, dapat dimodifikasi dari letak pengikatan sekum, besar jarum yang digunakan untuk perforasi sekum, dan jumlah lubang perforasi. Pada penelitian ini, kami menggunakan prosedur CLP ini untuk mensimulasikan derajat sepsis yang lebih berat.
Tata cara CLP (Menezes GB ET AL, 2008):
a. Tikus dianestesi dengan injek I.P. solusio Ketamin 1:1 (75mg/kgBB), atau dengan nebulasi isoflurane.
b. Bulu di bagian perut tikus dicukur dan kemudian dilakukan tindakan septik aseptik di daerah yang telah dicukur dengan cairan betadine diikuti dengan alkohol 70%.
c. Dalam kondisi aseptik, buat insisi laparotomy 1 sampai 2 cm di garis mid-line ssamapi sekum terlihat.
d. Sekum kemudian diikat dengan benang silk 3.0 di distal dari katup ileo-cecal, dan kemudian diperforasi sekali pda tempat yang terdapat sedikit pembuluh darah dengan teknik “through and through” dengan jarum ukuran 23-gauge pada sisi sekum yang sama. Pengikatan sekum dilakukan pada ≥ 1 cm dari bagian paling distal sekum dengan harapan dapat menginduksi sepsis berat.
e. Sekum kemudian diremas dengan lembut sampai sejumlah kecil feses keluar dari titik perforasi. Sekum kemudian dimasukkan kembali ke dalam rongga peritoneum dan peritoneum ditutup dan dijahit dengan benang operasi silk 4.0 dengan jahitan continuous.
f. Kulit ditutup dengan jahitan interuted dengan benang nylon 4.0.
g. Kemudian tikus diresusitasi dengan injeksi intraperitoneal NaCl 0,9% yang telah dihangatkan sebelumnya dengan jarum 25 Gauge untuk menginduksi fase hiperdinamik sepsis.
h. Tikus kemudian dikembalikan ke kandang. i. Berikan makan dan minuman di dalam kandang. 4.8.5. Pemberian obat atau placebo:
a. Sub-kelompok Terapi-A/B : Chloroquine 50 mg/KgBB/hari diberikan dengan sonde dilarutkan dalam aquabidest 2ml diberikan selama 4 hari.
b. Sub-kelompok Perlakuan-A/B, diberi 2ml NaCl 0,9% diberikan dengan sonde dengan waktu dan durasi yang sama dengan sub-kelompok perlakuan Chloroquine pasangannya.
c. Kelompok Kontrol-A/B diberikan 2ml NaCl 0,9% personde pada waktu dan durasi yang sama dengan sub-kelompok perlakuan-A/B dan Terapi A/B.
4.8.6. Monitoring:
Setiap hari populasi tikus dimonitor nafsu makan dari jumlah makanan yang dihabiskan, tanda-tanda sepsis seperti hudling, inaktivitas, diare, dan piloereksi.
Pemeriksaan survival rate dilakukan setiap 24 jam sejak dilakukannya CLP. Untuk mengurangi penderitaan hewan coba, maka pada penelitian ini menerapkan “Humane End Point” yang menggunakan kriteria “Impending Death and Moribund Condition” sebagai patokan pengorbanan hewan coba. Kriteria tersebut mencakup satu atau lebih kondisi berikut ini: (OECD, 2000)
a. Gangguan aktivitas sehingga hewan coba tidak dapat mencapai tempat makanan atau minuman, atau anoreksia berkepanjangan.
b. Penurunan berat badan yang eksesif, atau dehidrasi berat. c. Kehilangan darah yang signifikan.
d. Bukti-bukti yang menunjukkan adanya gagal organ ireversibel. e. Tidak adanya respon dari rangsangan eksternal.
f. Kesulitan bernafas yang menetap. g. Tidak dapat berdiri di atas kaki-kaki. h. Kejang berkepanjangan.
i. Mutilasi diri sendiri. j. Diare berkepanjangan.
k. Penurunan suhu tubuh yang signifikan dan menetap. l. Tumor yang cukup besar.
m. Efek-efek lain yang diakibatkan oleh perlakuan yang mengindikasikan kematian yang mendekat.
Tikus yang menunjukkan tanda-tanda mendekati kematian (Moribund state), dikorbankan dengan dislokasi servikal dan dicatat sebagai mortalitas.
4.8.7. Teknik pengambilan sampel dan penanganan spesimen: a. Pemeriksaan IL-1β plasma.
Pada penelitian ini kadar IL-1β diperiksa dari plasma darah tikus. Sampel darah diambil melalui pembuluh darah sinus orbita dengan menggunakan pipet kaca dan diletakkan dalam tabung steril, lalu dibiarkan selama 2 jam pada suhu kamar kemudian disentrifugasi dengan kecepatan 1500 rpm selama 15 menit. Plasma yang terpisah kemudian diambil dan dimasukkan ke dalam sumur-sumur pemeriksaan ELISA dengan menggunakan reagen IL-1β tikus (Thermo Fisher Scientific, USA).
b. Pemeriksaan aktivasi Caspase-1.
Pada penelitian ini, pengukuran Caspase-1 dilakukan dengan cara Flow cytomery pada isolate Peripheral Blood Mono-Nuclear Cells (PBMC) dan Whole blood tikus percobaan. Reagen yang digunakan adalah FLICA 660 Caspase-1 Assay far-red fluorescence (Immunochemistry Technologies, USA) Aktivasi Caspase-1 kemudian diukur dengan bantuan alat Flow cytometry Fluorochrome detector 4.
Sebelum analisa sampel penelitian, sesuai dengan rekomendasi dari produsen reagen, maka perlu dilakukan optimasi terlbih dahulu untuk menentukan gating dan kompensasi. Pada saat optimasi,dilakukan juga penentuan Kontrol negatif dan Kontrol positif. Optimasi menggunakan darah dari 5 ekor tikus sehat yang telah menjalani masa aklimatisasi dan tidak dilakukan perlakuan. Kontrol positif menggunakan LPS yang ditambahkan pada sampel PBMC atau Whole
blood dengan dosis 100ng. Campuran kemudian dinkubasi pada incubator CO2 pada suhu 37°C selama 1 jam.
Teknik persiapan dan pemeriksaan sampel:
- Darah yang diambil dari sinus orbita tikus ditampung ke dalam tabung khusus yang telah diberi antikoagulan EDTA dan kemudian dikocok untuk menghindari clumping. Darah yang telah diberi EDTA kemudian dibagi menjadi dua aliquot dalam test tube ukuran 1,5 cc, yang mana satu aliquot digunakan untuk pemeriksaan PBMC dan satu untuk pemeriksaan whole blood.
- Isolasi PBMC dilakukan dengan cara sentrifugasi dengan terlebih dahulu ditambahkan Ficoll-paque (Sigma Aldrich, USA). Darah tikus sebanyak 500μL ditambahkan cairan Ficoll paque 1ml. Campuran disentrifugasi dengan gaya graviasi 250 G selama 10 menit.
- Lapisan PBMC yang telah terpisahkan kemudian diambil dengan hati-hari dan diletakkan dalam test tube baru.
- Isolat PBMC kemudian ditambahkan PBS sebanyak 1ml dan disentrifugasi kembali dengan kecepatan 2000 RPM selama 10 menit.
- Setelah sentifugasi, PBS kemudian dibuang dengan pipet. - Tambahkan 290 μL media kultur RPMI.
- Rekonstitusi tiap vial FLICA denga 50 μL DMSO. Encerkan menjadi 1:5 dengan menambahakan 200 μL PBS. Hasil pengenceran harus digunakan dalam 15 menit untuk meminimalisir hydrolisis dari FMK reactive group.
- Tambahkan pengenceran FLICA 660 pada rasio v/v 1:30–1:60 pada isolate PBMC yang telah ditambahkan media kultur.
- Inkubasi sel pada suhu 37°C pada incubator CO2 dan hindarkan dari cahaya langsung selama 15-45 menit, kocok sel tiap 15–20 menit untuk menghindari penumpukan sel yang berlebihan dan untuk meratakan distribusi FLICA 660. - Tambahkan 1 mL 1X Cellular Wash Buffer dan kocok perlahan.
- Sentrifugasi pada <400 X g selama 5 menit pada suhu ruangan.
- Buang supernatan dengan hati-hati. Kocok pellets untuk mencegah clumping. Suspensikan dalam 1 mL 1X Cellular Wash Buffer dan campurkan perlahan. - Sentrifugasi kembali pada <400 X g selama 5 menit pada suhu ruangan. - Buang supernatan dengan hati-hati. Kocok pellets untuk mencegah clumping. - Suspensikan PBMC dalam 300 μL 1X Cellular Wash Buffer dan letakkan di
atas es.
- Untuk pemeriksaan whole blood (WB), 150 μL WB dimasukkan ke dalam test tube ukuran 1,5ml dan ditambahkan media kultur RPMI 150 μL.
- Campuran disentrifugasi pada <400 X g selama 5 menit pada suhu ruangan. - Tambahkan reagen FLICA 660 sesuai dengan jumlah di atas.
- Inkubasi Inkubasi sel pada suhu 37°C pada incubator CO2 dan hindarkan dari cahaya langsung selama 15-45 menit, kocok sel tiap 15–20 menit untuk menghindari penumpukan sel yang berlebihan dan untuk meratakan distribusi FLICA 660.
- Tambahkan 1 mL 1X Cellular Wash Buffer dan kocok perlahan. - Sentrifugasi pada <400 X g selama 5 menit pada suhu ruangan.
- Buang supernatan dengan hati-hati. Kocok pellets untuk mencegah clumping. Suspensikan dalam 1 mL 1X Cellular Wash Buffer dan campurkan perlahan. - Sentrifugasi kembali pada <400 X g selama 5 menit pada suhu ruangan. - Buang supernatan dengan hati-hati. Kocok pellets untuk mencegah clumping. - Suspensikan WB dalam 300 μL 1X Cellular Wash Buffer dan letakkan di atas es. - Untuk analisa pewarnaan tunggal, gunakan 633 nm (emisi puncak) 15mW
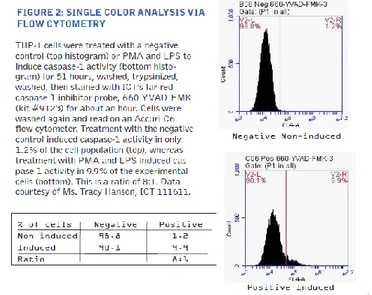
helium-neon ion laser atau yang sebanding dengan >640 nm laser illumination source. Ukur emisi FLICA 660 pada saluran FL4 atau dengan filter emisi yang kompatibel dengan emisis cahaya antara 680-690 nm. Buat sebuah histogram dengan log FL4 pada sumbu X dibadingkan dengan jumlah sel di sumbu Y. Sel Caspase-1 negatif (FLICA 660-) akan berada pada nilai log fluoresens pada sumbu X FL4, sedangakan sel caspase-1 positif (FLICA 660+) akan muncul sebagai pundak di sebelah kanan atau sebagai puncak yang terpisah di bagian kanan dari puncak histogram negatif.
4.9. Teknik Analisis Data
Data disajikan dalam bentuk mean ± SD kemudian dianalisis menggunakan SPSS 22 for windows. Pemilihan analisis statistik dilakukan setelah dilakukan uji normalitas data dengan Shapiro-Wilk. Analisis statistik dilakukan dengan uji One Way ANOVA dan dilanjutkan dengan Post Hoc Test Least Significant Difference/Fisher (LSD) menggunakan program SPSS for Windows release version 22. Post Hoc Test adalah uji hipotesis untuk membandingkan dua kelompok, yang dilakukan bila p <0,05.
Uji One Way ANOVA adalah uji parametrik untuk membandingkan perbedaan mean pada lebih dari dua kelompok. Syarat uji One Way ANOVA adalah skala numerik, distribusi normal dan homogen. Apabila data tidak memenuhi syarat distribusi normal, maka digunakan uji alternatifnya yaitu uji Kruskal-Wallis dilanjutkan dengan Mann –Whitney untuk membandingkan masing masing kelompok.
4.10. Alur Penelitian
100 ekor Rattus norvegicus
52 ekor tikus secara random
“A” (IL-1β). N=26 ekor
“B” (Aktivasi Caspse-1). N=26 N=
4.10.1. Alur penelitian kelompok “A” (IL-1β)
Adaptasi 7 hari
Chloroquine 60mg/KgBB personde pada jam ke 24, 48, 72, dan 96 pasca CLP NaCl 0,9% 2ml personde pada jam ke 24, 48, 72, dan 96 pasca CLP NaCl 0,9% 2ml personde pada jam ke 24, 48, 72, dan 96 sesuai dengan P1 dan P2
Random sampling
Kontrol-A. (N=6) Perlakuan-A (N=10) Terapi-A (N=10)
Survival rate / 24 jam.
Tikus yang masuk kriteria Moribund dikorbankan.
Tikus moribun dicatat sebagai mortalitas. Hari ke 6:
Pengambilan sampel darah. Semua tikus dikorbankan.
ANOVA dan Post Hoc Test Least Significant Difference (LSD) Operasi CLP Operasi CLP
4.10.2. Alur Penelitian Kelompok “B” (aktivasi Caspase-1)
Chloroquine 60mg/KgBB personde pada jam ke 24, 48, 72, dan 96 pasca CLP NaCl 0,9% personde pada jam ke 24, 48, 72, dan 96 pasca CLP NaCl 0,9%
personde pada jam ke 24, 48, 72, dan 96 sesuai dengan P1 dan P2
Random sampling
Kontrol-B (N=6) Perlakuan-B (N=10) Terapi-B (N=10)
Survival rate / 24 jam.
Tikus yang masuk kriteria Moribund dikorbankan.
Tikus moribun dicatat sebagai mortalitas. Hari ke 6:
Pengambilan sampel darah. Semua tikus dikorbankan.
ANOVA dan Post Hoc Test Least Significant Difference (LSD) Operasi CLP Operasi CLP