No. 04 Vol. 1315-01
LAPORAN PRAKTIKUM FISIOLOGI TUMBUHAN PENGARUH HORMON AUKSIN TERHADAP PERTUMBUHAN DAN PERKEMBANGAN AKAR
Sitatun Zunaidah (1509 100 706)
Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember Surabaya
2011 Abstrak
Hormon tumbuhan adalah senyawa organik yang disintesis di salah satu bagian tumbuhan dan di pindahkan kebagian lain dan pada konsentrasi yang sangat rendah mampu menimbulkan suatu respon fisiologis. Hormon yang memicu pertumbuhan pada tanaman, salah satunya adalah hormon auksin. Pada praktikum ini dilakukan percobaan mengenai pengaruh hormon terhadap pertumbuhan dan perkembangan tumbuhan bertujuan untuk mengetahui kadar IAA terhadap jumlah dan panjang akar. Batang tanaman yang digunakan adalah batang tanaman sirih. Auksin yang digunakan dalam percobaan ini adalah auksin alami yaitu IAA (Indole Acetid Acid) dengan kadar konsentrasi yang berbeda. Batang sirih direndam dalam IAA dengan kosentrasi 0,1; 1; 10; 100 ppm. Selain itu juga digunakan pembanding (kontrol) yaitu akuades. Diamati pertumbuhan dan jumlah akar yang tumbuh akibat perendaman dengan IAA. Dari paktikum ini didapatkan hasil bahwa perlakuan IAA pada tanaman sirih mempengaruhi jumlah dan pertumbuhan akar, baik pada perlakuan gelap maupun perlakuan terang. Konsentrasi IAA yang rendah menyebabkan pertumbuhan akar berjalan lambat baik pada perlakuan gelap maupun terang. Pertumbuhan akar paling banyak pada konsentrasi IAA 10 ppm. Sedangkan pada konsentrasi IAA yang berlebih menyebabkan akar tidak dapat tumbuh yakni pada pemperian IAA 100 ppm. Pertumbuhan akar di tempat gelap jauh lebih cepat dibanding pada tempat yang terang. Hal ini karena salah satu factor yang dapat menghambat kerja IAA / auksin adalah cahaya. Kata kunci: pertumbuhan, hormon, auksin, dan IAA
Abstract
Plant hormones are organic compounds that are synthesized in one of the plants and on the move corner to another and at very low concentrations is capable of inflicting a physiological response. Hormone that triggers the growth of the plant, one of which is the hormone Auxin. In this experiment was conducted on Practicum instructors the influence of hormones on the growth and development of plant aims to find out the number and levels of IAA on long roots. Stem plants used are the betel plant stems. Auxin is used in the experiment it is natural that IAA Auxin (Indoles Acetid Acid) with different concentration levels. The rod is immersed in the IAA with betel concentrations 0.1; 1; 10; 100 ppm. It also used a comparison (control) that is akuades. Observed growth and the number of roots that grow by soaking with the IAA. From paktikum this is the result that the IAA on plant treatment affects the number of betel and root growth, both in dark or bright treatment treatment. Low concentrations cause the growth of the IAA roots running slow at both the dark and the light treatment. Root growth in concentrations of IAA at most 10 ppm. While the excess concentration of IAA cause root could not be grown in pemperian IAA 100 ppm. The growth of roots in a dark place is much quicker than on the light. This is because the one factor that may hinder the work of the IAA/Auxin is light.
Pendahuluan Latar Belakang
Selain membutuhkan sumber nutrisi, tanaman juga memerlukan beberapa unsur (Zat) lain untuk mengendalikan dan mendukung kelangsungan hidupnya. Unsur tersebut biasa disebut dengan Zat Pengatur Tumbuh atau ZPT. Unsur ZPT ini merupakan hormon pada tumbuhan yang merupakan senyawa kimia yang diekskresi oleh suatu organ atau jaringan yang dapat mempengaruhi organ atau jaringan lain dengan cara khusus. Berbeda dengan yang diproduksi oleh hewan senyawa kimia pada tumbuhan sering mempengaruhi sel-sel yang juga penghasil senyawa tersebut disamping mempengaruhi sel lainnya. Dan salah satu tipe Zat Pengatur Tumbuhan tersebut yang telah diidentifikasi yaitu auksin (Anonim1, 2011).
Auksin merupakan hormon terhadap tumbuhan yang mempunyai peranan luas terhadap pertumbuhan dan perkembangan tumbuhan. Sifat penting auksi adalah berdasarkan konsentrasinya, dapat merangsang dan menghambat pertumbuhan. Auksin berperan penting dalam perubahan dan pemanjangan sel (Anonim1, 2011).
Pada praktikum ini dilakukan percobaan mengenai pengaruh hormon terhadap pertumbuhan dan perkembangan tumbuhan yang mana bertujuan untuk mengetahui pengaruh kadar IAA terhadap jumlah dan panjang akar. Permasalahan pada praktikum ini adalah bagaimana mengetahui pengaruh pemberian IAA terhadap jumlah dan pertumbuhan akar.
Tinjauan Pustaka
Hormon tumbuhan adalah senyawa organik yang disintesis di salah satu bagian tumbuhan dan di pindahkan kebagian lain dan pada konsentrasi yang sangat rendah mampu menimbulkan suatu respon fisiologis (Salisbury, 1995). Hormon ini dihasilkan pada ujung pucuk yang sedang tumbuh dan akan mendatangkan efek atau akibat apabila telah bergerak kebagian organ yang lain. Fungsi auksin dalam
memacu pertumbuhan tanaman adalah sebagai pengaturan perbesaran sel dan pergerakan auksin selalu menjauhi arah cahaya (Loveless, 1991). Pengaruh auksin terhadap rangsangan berbeda-beda, rangsangan yang paling kuat adalah rangsangan terhadap sel-sel meristem apikal batang dan koleoptil. Pada kadar yang sangat tinggi, auksin lebih bersifat menghambat daripada merangsang pertumbuhan. Pengaruh auksin terhadap perkembangan sel menun-jukkan adanya indikasi bahwa auksin dapat menaikkan tekanan osmotik, mening-katkan sintesa protein, meningkatkn permea-bilitas sel terhadap air, dan melunakkan dinding sel yang kemudian diikuti menurunnya tekanan dinding sel sehingga air dapat masuk ke dalam sel yang disertai dengan kenaikan volume sel. Dengan adanya kenaikkan sintesa protein, maka dapat digunakan sebagai sumber tenaga dalm pertumbuhan (Hendaryono, 1994).
Auksin yang diberikan secara eksogen tidak mempengaruhi pembentukan tunas, karena pembentukan tunas lebih dipengaruhi oleh adanya sitokinin endogen. Pertumbuhan dan perkembangan dikontrol oleh adanya keseimbangan hormon dalam tanaman. Inisiasi dan pembentukan tunas dikontrol oleh adanya interaksi antara auksin dan sitokinin. Perban-dingan antara auksin dan sitokinin yang tepat akan meningkatkan pembelahan sel dan diferensiasi sel. Kandungan sitokinin dalam sel yang lebih tinggi daripada auksin akan memacu sel untuk membelah secara cepat dan berkembang menjadi tunas, batang, dan daun (Pamungkas, 2009).
Auksin yang terlibat dalam banyak peraturan terutama yang berhubungan dengan pertumbuhan dan perkembangan tanaman proses pada tanaman. Fungsi auksin dalam transmisi isyarat lingkungan seperti cahaya dan gravitasi, regulasi percabangan proses dalam tunas dan akar, karena mereka menemukan lebih baru-baru ini, pola diferensiasi sel-sel di meristem dan organ dewasa. Hal ini tentu sinyal spasial dan temporal serbaguna. Auksin transportasi menghasilkan konsentrasi
mak-simum auksin dan terdegradasi dalam jaringan yang berperan dalam regulasi beragam proses perkembangan berbagai tanaman, termasuk embriogenesis, organogenesis pembentukan, jaringan pembuluh darah dan tropisme. Mekanisme transport auksin hanya signal molecule sebagian besar mendasari plastisitas yang luar biasa dari perkembangan tanaman dan pertumbuhan yang memungkinkan arsitektur untuk berubah sesuai dengan lingkungan (Yong, 2009).
Faktor-faktor yang mempengaruhi pertumbuhan dan perkembangan dapat dikategorikan sebagai faktor eksternal dan faktor internal, dikelompokkan sebagai berikut:
1. Faktor Eksternal a. Iklim
Cahaya, temperatur, air, panjang hari, angin, dan gas (CO2, O2, N2, SO2, nitrogen oksida, Fl, Cl, dan O3) b. Edafik (Tanah)
Tekstur, struktur, bahan organik, kapasitas pertukaran kation, pH, kejenuhan basa, dan ketersediaan nutrien.
c. Biologis
Gulma, serangga, organisme penye-bab penyakit, nematoda, macam-macam tipe herbivora, dan mikroorganisme tanah.
2. Faktor Internal
a. Ketahana terhadap tekanan iklim, tanah, dan biologis
b. Laju fotosintetik c. Respirasi
d. Pembagian hasil asimilasi dan e. Klorofil, karoten, dan kandungan
pigemn lain
f. Tipe dan letak meristem
g. Kapasitas untuk menyimpan cadangan makanan
h. Aktivitas enzim
i. Pengaruh langsung gen j. Diferensiasi
(Gardner, 1991).
Pengaruh auksin terhadap partum-buhan jaringan tanaman diduga melalui dua cara yaitu Menginduksi sekresi ion H+ keluar sel melalui dinding sel. Pengasaman dinding sel menyebabkan K+ diambil dan pengambilan ini mengurangi potensial air dalam sel. Akibatnya air masuk ke dalam sel dan sel membesar. Mempengaruhi metabolisme RNA yang berarti metabolisme protein, mungkin melalui transkripsi molekul RNA. Auksin sintetik yang sering digunakan dalam kultur jaringan tanaman dapat memacu terjadinya dominansi apical dan dalam jumlah sedikit memacu pertumbuhan akar (Hendaryono, 1994).
Metodologi
Praktikum ini dilakukan pada tanggal 15 November 2011 di laboratorium botani Biologi ITS. Peralatan yang dibutuhkan dalam praktikum ini adalah Botol Nescafe 10 buah, gelas ukur, penggaris, dan kertas label. Sedangkan bahan-bahan yang digunakan dalam praktikum ini adalah potongan tanaman herba, yakni batang tanaman sirih (Piper betle), larutan IAA 0,1,1 10, 100 ppm, aluminium foil, kertas karbon, dan aquades. Sedangkan cara kerja dalam praktikum ini adalah pertama batang tanaman sirih dipotong 10 ruas sebanyak 10 buah. Kemudian masing masing batang direndam dengan IAA. IAA yang diberikan yaitu dengan konsentrasi 0,1; 1; 10; 100 ppm dan diberi air sebagai kontrol. Tiap perlakuan perendaman terdiri dari 2 batang. Perendaman dilakukan selama 2 jam. Setelah itu batang diambil dan dimasukkan kedalam botol nescafe yang telah diisi dengan air. Kelompok pertama, 5 botol ditutup dengan kertas karbon, sedangkan kelompok kedua, 5 botol lainnya dibiarkan terbuka tanpa ditutup dengan kertas karbon.
Hasil dan Pembahasan
Percobaan pengaruh hormon terhadap pertumbuhan dan perkembangan tumbuhan bertujuan untuk mengetahui kadar IAA terhadap jumlah dan panjang akar. Pada
praktikum ini digunakan batang tanaman sirih (Piper betle). Tanaman sirih mempunyai batang yang relative kecil sehingga mudah untuk dimasukkan kedalam botol. Selain itu tumbuhan ini mempunyai nodus sehingga dapat digunakan untuk mempermudah pengamatan jumlah akar yang tumbuh. Batang tersebut dipotong sebanyak 10 ruas. Untuk mengamati pertumbuhan akar pada tiap ruasnya. Pemotongan setiap batang harus sama panjang. Untuk memberikan pengaruh yang sama pada pembentukan akar, selain itu besar dan banyak daun akan berpengaruh pada laju fotosintesis dan respirasi yang dikhawatirkan akan sangat berpengaruh pada pertumbuhan akar. Setelah itu direndam dengan IAA selama 2 jam. Perendaman ini berfungsi untuk memicu pertumbuhan akar pada tanaman sirih. Kadar IAA yang diberikan berbeda-beda, yaitu larutan IAA dengan konsentrasi 0,1; 1; 10; 100 ppm dan direndam dengan Air. Perendaman dengan kadar IAA yang berdeda berfungsi untuk mengetahui pengaruh kadar IAA terhadap pertumbuhan akar tanaman sirih. Sedangkan air sebagai kontrol atau pembanding. Setelah dua jam, batang bougenvil yang direndam tersebut diambil dan dimasukkan ke dalam botol nescafe yang telah diisi dengan air, perlakuan ini dibagi menjadi 2 bagian. Bagian pertama ditutup dengan kertas karbon, bagian kedua tidak ditutup dengan kertas karbon. Perlakuan ini untuk mengetahui pengaruh dari cahaya terhadap aktivitas auksin dalam mempengaruhi pertumbuhan tanaman sirih. Penutupan dengan kertas karbon agar cahaya tidak dapat masuk kedalam botol (perlakuan gelap) sehingga dapat diketahui perbedaan pertumbuhan antara tanaman yang diletakkan di tempat gelap dan di tempat terang. Setelah itu diamati selama 7 hari. Diukur panjang dan jumlah akar yang ada pada semua perlakuan.
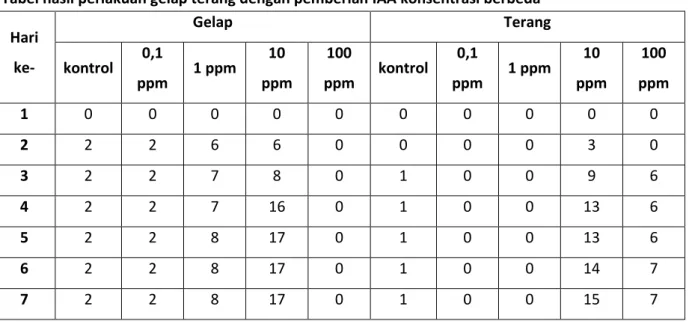
Hasil dari pengamatan yang dilakukan selama 7 hari. Pada perlakuan gelap, botol kontrol tumbuh akar sebanyak 2 buah berturut-turut sampai hari ke-7. Begitu juga pada botol dengan pemberian IAA 0,1 ppm mengalami
pertumbuhan akar yang sama dengan botol control. Pada pemberian IAA 1 ppm pertumbuhan akar bertambah banyak dan semakin meningkat dari 0, 6, 7 sampai 8 buah. Jumlah akar semakin banyak pada pemberian IAA 10 ppm (hasil dapat dilihat pada tabel). Namun pad konsentrasi IAA 100 ppm tidak ada akar yang tumbuh. Hal ini membuktikan bahwa kerja hormone pada titik optimum akan meningkatkan jumlah akar secara maksimal dalam hal ini konsentrasi IAA optimum adalah 10 ppm. Semakin tinggi konsentrasi IAA maka pertumbuhan akar akan semakin terhambat dan menyebabkan akar tidak tumbuh (konsentrasi hormone maksimal). System kerja hormone mirip dengan enzim ketika konsentrasi hormone maksimum maka pertumbuhan atau pembelahan sel akan terhenti/ tidak bertambah meskipun konsentrasinya terus ditambah. Pada pemberian auksin dengan kadar rendah disebut konsentrasi minimum dimana pertumbuhan akar tidak begitu signifikan Kondisi yang sama (tidak tumbuh akar) juga dapat terjadi karena auksin yang diberikan terlalu tinggi. Menurut Lakitan (1996) pada kadar yang sangat tinggi, auksin lebih bersifat menghambat dari pada merangsang pertumbuhan. Jika ditinjau dari keberadaan produksi hormone ethilen yang cukup banyak pada batang Bougenvil, hormone ini dapat menghambat hormone auksin (Salisbury,2005), sehingga proses terbentuknya akar terhambat. Walaupun diberi perlakuan gelap dan terang. Zat penghalang pada batang tanaman sirih juga dapat menghambat peresapan atau transport IAA kedalam batang sehingga tidak dapat memicu pertumbuhan akar dari floem luar batang sirih (Salisbury, 1995). Jika ditinjau dari kandungan lignin yang terdapat pada batang sirih, batangnya mempunyai struktur yang keras. Karakter batang yang seperti ini seharusnya dapat dipatahkan oleh auksin.
Pada perlakuan terang, botol control muncul 1 akar, botol dengan 0,1 ppm dan 1 ppm tidak tumbuh akar. Namun pada konsentrasi 10 ppm akar tumbuh semakin
banyak dan jumlah akar semakin menurun pada pemberian IAA dengan konsentrasi 100 ppm. Hal ini membuktikan factor cahaya menghambat kerja auksin terbukti dengan tidak tumbuhnya akar pada botol 0,1 ppm dan 1 ppm. Padahal pada perlakuan gelap akar tumbuh dengan konsentrasi IAA tersebut. Selain itu jumlah akar yang dihasilkan dalam perlakuan gelap lebih banyak dibanding perlakuan terang. Sehingga dapat dibuktikan bahwa salah satu factor penghambat kerja hormone adalah cahaya. Adanya cahaya akan memperlambat kerja hormone auksin. Berdasarkan hipotesis pertumbuhan asam: auksin menyebabkan sel penerima pada potongan koleoptil, atau potongan batang memerlukan H+ ke dinding sel primer yang mengelilinginya. Ion H+ ini menurunkan pH sehingga terjadi pengenduran dinding dan pertumbuhan yang cepat. pH yang rendah ini juga diduga bekerja dengan cara mengaktifkan merusak beberapa enzim perusak, yang tidak aktih pada pH tinggi. Enzim tersebut diduga memutuskan ikatan polisakarida, sehingga membuat dinding lebih mudah merenggang. Dan pembentukan atau pemanjangan akar dapat terjadi (Salisbury, 1995). Selain itu tidak terbentuknya akar juga dapat disebabkan oleh rusaknya hormon IAA yang diberikan. IAA dapat mengalami degradasi yang disebabkan oleh adanya cahaya ataupun dapat diuraikan oleh enzim oksidatif, sehingga IAA tidak dapat memicu pertumbuhan akar (Hendaryono, 1994). Untuk lebih jelasnya dapat dilihat pada grafik di bawah ini.
Grafik 1 : pertumbuhan akar pada tempat gelap
Grafik 2 : pertumbuhan akar pada tempat terang
Pada batang auksin ditransport secara basipetal (away from apex). Pada akar, transport auksin secara akropetal ke arah ujung melalui parenkim vaskuler. Transpor auksin berlangsung secara basipetal, yaitu dari ujung ke basal. Transpor auksin umumnya simplastik (dalam floem) dan aktif, yaitu laju auksin menurun tanpa oksigen atau dengan adanya karbondioksidaTingkat di atas optimal mungkin menyebabkan transpor secara apoplastik maupun transpor simplastik. Sitokinin dan giberelin mempercepat transpor auksin sedangkan penghambat pertumbuhan memperlambat transpor auksin. Natrium fluorida dan triiodobenzoat merupakan penghambat transpor (Gardner, 1991).
Gambar 1: transport auksin
(Campbell, 2002). Keterangan :
1.Pada saat auksin menemui lingkungan yang asam dari dinding sel, molekulnya akan mengikat ion hydrogen (H+) sehingga menjadi bermuatan netral. 0 5 10 15 20 1 2 3 4 5 6 7 Gelap kontrol Gelap 0,1 ppm Gelap 1 ppm Gelap 10 ppm 0 2 4 6 8 10 12 14 16 1 2 3 4 5 6 7 Terang kontrol Terang 0,1 ppm Terang 1 ppm Terang 10 ppm
2.Sebagai suatu molekul netral yang berukuran relatif kecil, auksin melintas melalui membran plasma.
3.Pada bagian sebelah dalam sel, pH lingkungan sebesar 7, menyebabkan auksin berionisasi menjadi auksin bermuatan negatif dan ion H+. Pada waktu yang singkat ini, hormon berada di dalam sel, karena membran plasma lebih permeabel terhadap ion, daripada terhadap molekul yang netral, dengan ukuran yang sama.
4.Pemompaan proton yang dikendalikan ATP, mengatur perbedaan pH antara di sebelah dalam sel dengan di sebelah luar sel.
5.Auksin dapat ke luar dari sel, hanya pada bagian basal sel, tempat protein karier spesifik terpasang di dalam membran (protein pembawa auksin)
6.Pemompaan proton, berperan terhadap aliran auksin ini, dengan cara membuat suatu potensial membran (tekanan) melewati membran, yang membantutransportasi anion auksin ke luar dari sel (Campbell,2002).
Proses sintesis auksin Menurut Larsen, 1944 dalam Abidin (1982) Indoleacetaldehyde diidentifikasikan sebagai bahan auksin yang aktif dalam tanaman. Selanjutnya zat kimia tersebut aktif dalam menstimulasi partum-buhan kemudian berubah menjadi IAA. Perubahan tersebut adalah perubahan dari Tripthopan menjadi IAA. Tryptamine sebagai salah satu zat organic, merupakan salah satu zat yang terbentuk dalam biosintesis IAA. Dalam hal ini perlu dikemukakan pula bahwa Tryptophan adalah zat organic terpenting dalam proses biosintesis IAA. Bahan organic lain yaitu Indoleacetonitrile adalah bahan organic yang ditemukan dalam tanaman Cruciferae dan dapat dikelompokkan ke dalam auksin. Zat tersebut atas bantuan enzim nitrilase dapat membentuk aksin. Indoleacetonitrile yang terdapat pada tanaman, terbentuk dari Glucobrassicin atas bantuan aktivitas enzim myrosinase. Dan zat organik lain (Indoleeethanol) yang terbentuk dari Trypthopan dalam biosintesis IAA atas bantuan
bakteri (Rayle dan Purves, 1976 dalam Abidin, 1982). Sebagaimana kita ketahui, IAA adalah endogenous auksin yang terbentuk dari Tryptophan yang merupakan suatu senyawa dengan inti Indole dan selalu terdapat dalam jaringan tanaman. Didalam proses biosintesis, Trytophan berubah menjadi IAA dengan membentuk Indole pyruvic acid dan indole-3-acetaldehyde. Tetapi IAA ini dapat pula terbentuk dari Tryptamine yang selanjutnya menjadi Indole-3-acetaldehyde, selanjutnya menjadi Indole-3-acetic acid (IAA). Sedangkan mengenai perubahan dari ndole-3-acetonitrile menjadi IAA dengan bantuan enzim nitrilase prosesnya masih belum diketahui (Abidin, 1982).
Menurut Heddy (1996), secara seder-hana bahwa gula (glukosa, arabinosa) dan lemak membentuk kompleks IAA. Pemecahan IAA dapat pula terjadi di alam. Hal ini adalah sebagai akibat adanya photo oksidasi dan enzim. Dalam photo oksidasi, pigmen pada tanaman akan menyerap cahaya, kemudian energi ini dapat mengoksidasi IAA. Adapun pigmen yang erperan adalah Ribovlavin dan B-Carotene (Abidin, 1982). Enzymatic oxidation yang terjadi pada IAA telah ditemukan oleh para ahli dalam berbagi jaringan tanaman. Oksidasi IAA oleh hydrogen peroksida, kemudian di katalisasi oleh enzim peroksida sehingga menghasilkan indolealdehyde yang bersifat naktif. Ada hubungan yang berbanding terbalik antara aktivitas oksidase IAA dengan kandungan IAA dalam tanaman. Apabila kandungan IAA tinggi, maka aktivitas IAA oksidase menjadi rendah, begitu pula sebaliknya. Di daerah meristematic yang kadar auksinnya tinggi, ternyata aktivitas IAA oksidasenya rendah. Sedangkan di daerah perakaran yang kandungan auksinnya rendah ternyata aktivitas IAA oksidasenya tinggi (Abidin, 1982). Posisi dan panjang rantai keasaman, berpengaruh terhadap aktivitas auksin. Rantai yang mempunyai carboxyl group yang dipisahkan oleh karbon atau oksigen akan memberikan aktivitas yang optimal. Sebagai contoh IAA dan
2,4-D. Dari hasil studi tentang pengaruh auksin terhadap perkembangan sel menunjukkan bahwa auksin dapat meningkatkan tekanan osmotic, meningkatkan permeabilitas sel terhdap air, meningkatkan sintesis protein, meningkatkan plastisitas dan pengembangan dinding sel. Di dalam fase pertumbuhan tanaman tediri dari dua fase yaiti fase pembelahan dan fase perrkembangan. Pada saat sel mengalami enlargement phase, sel tidak hanya mengalami peregangan akan tetapi juga mengalami penebalan dinding sel baru. Pertumbuhan sel ini distimulasi oleh auksin (Abidin, 1982). Pectic acid adalah suatu asam yang mengandung 1-4 rantai galacturonic acid. Galacturonic acid ini merupakan turunan dari galactose sebagai hasil oksidase carbon-6 suatu carbinoyl group (-CH2OH) menjadi suatu carboxyl group (-COOH). Dalam proses selanjutnya, terjadilah pergantian dari (-COOH) menjadi (-CH3) dengan mengalami proses esterisasi yang akhirnya menjadi Pectin. Tetapi pectic acid pun dapat pula berubah menjadi calcium pectate dengan penambahan Ca2+. Penambahan Ca2+ pada dinding sel dapat mengakibatkan rigiditas pada dinding sel, yang menghambat proses cell enlargement. Untuk menghindari hambatan tersebut auksin mempunyai peranan dalam menggeser Ca2+ dari pectic substance, sehingga terjadi pelunakan pada dinding sel (Abidin, 1982). Menurut Delvin, 1975 dalam Abidin (1982), kehadiran auksin berpengaruh tehadap sintesa protein. Fungsi auksin di dalam proses tersebut membebaskan DNA dari Histone untuk sintesis RNA. mRNA akan membantu pembentukan enzim-enzim, enzim-enzim ini akan meningkatkan plastisitas dan plelebaran dinding sel. Sehingga secara umum auksin mendorong perpanjangan sel dengan cara mempengaruhi dinding sel.
Gambar 2 : jalur sintesis auksin
(Anonim2, 2011) Faktor-faktor yang mempengaruhi kerja auksin dalam sel adalah:
a. Cahaya Sinar dapat merusak auksin dan dapat menyebabkan pemindahan auksin ke jurusan yang menjauhi sinar. Sinar nila merusak auksin atau mencegah terjadinya auksin. Ada dua macam pigmen yang suka meresap sinar nila, yaitu betakarotin dan riboflavin. Riboflavin terdapat di dalam ujung-ujung batang, dan meskipun tanpa betakarotin pengaruh fototropisme tetap ada, sehingga riboflavin merupakan pigmen yang meresap sinar nila yang dapat merusak enzim-enzim yang membantu pembentukan AIA dan triptofan. b. Gaya berat Peredaran auksin adalah dari puncak menuju ke dasar (bagian akar). Sisi bawah dari ujung batang menerima lebih banyak auksin daripada sisi sebelah atas sebagai akibat dari pengaruh gaya berat.
c. Kadar auksin kadar auksin yang tinggi akan menggiatkan pengembangan sel-sel batang, akan tetapi menghambat pertumbuhan sel-sel akar.
(Anonim3, 2011).
KESIMPULAN
Kesimpulan yang dapat diambil dari praktikum ini yaitu perlakuan IAA pada tanaman sirih mempengaruhi jumlah dan pertumbuhan akar, baik pada perlakuan gelap maupun perlakuan terang. Konsentrasi IAA yang rendah
menyebabkan pertumbuhan akar berjalan lambat baik pada perlakuan gelap maupun terang. Pertumbuhan akar paling banyak pada konsentrasi IAA 10 ppm. Sedangkan pada konsentrasi IAA yang berlebih menyebabkan akar tidak dapat tumbuh yakni pada pemperian IAA 100 ppm. Pertumbuhan akar di tempat gelap jauh lebih cepat dibanding pada tempat yang terang. Hal ini karena salah satu factor yang dapat menghambat kerja IAA / auksin adalah cahaya.
Daftar Pustaka
Abidin, Z. 1982. Dasar-dasar pengetahuan tentang zat pengatur tumbuh. Penerbit Angkasa. Bandung.
Anonim1. 2011. Fisiologi Tumbuhan Pengaruh Auksin. http://i-me-myself- ildah.blogspot.com-/2009/08/fisiologi-tumbuhan-pengaruh-auksin.html. diakses pada tanggal 28 November 2011 pukul 18.30 WIB.
Anonim2. 2011. Hormon Tumbuhan. http://biologigonz.blogspot.com/2011/03 /hormon-tumbuhan.-html. diakses pada tanggal 28 November 2011 pukul 19.00 WIB.
Anonim3. 2011. Fisiologi Tumbuhan Pengaruh Auksin. http://4pertanian.blogspot.com- /2011/01/fisiologi-tumbuhanpengaruh-auksin.html. diakses pada tanggal 28 November 2011 pukul 19.30 WIB.
Campbell, N. A. and J. B. Reece. 2002. Biology. Sixth Edition, Pearson Education. Inc. San Francisco.802-831.
Gardner, F. P., R. B. Pearce, dan R.L. Mitchell. 1991. Fisiologi Tanaman Budidaya. UI Press. Jakarta.
Heddy, S. 1996. Hormon tumbuhan. Raja Grafindo Persada. Jakarta.
Hendaryono, D.P dan A. Wijayani. 1994. Tehnik Kultur Jaringan: Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif-modern. Kanisius: Yogyakarta.
Lakitan,B. 1996. Fisiologi Pertumbuhan dan Perkembangan Tanaman.Raja Grasindo Persada: Jakarta.
Loveless, A.R. 1991. Prinsip-prinsip Biologi Tumbuhan untuk Daerah Tropik jilid 1. PT Gramedia Pustaka Utama: Jakarta.
Pamungkas, Febriani Tri. 2009. Pengaruh Konsentrasi dan Lama Perendaman Dalam Supernatan Kultur Bacillus sp.2 Ducc-BR-K1.3 Terhadap Pertumbuhan Stek Horisontal Batang Jarak Pagar (Jatropha curcas L.)J. Sains & Mat. Vol. 17 No. 3 Juli 2009: 131-140.
Salisbury, F.B dan K.W. Ross, 1995. Fisiologi Tumbuhan Jilid 3. ITB : Bandung.
Yong, Jean W. H. 2009. The Chemical Composition and Biological Properties ofCoconut (Cocos nucifera L.)Water.Molecules, 14, 5144-5164; doi:10.3390/molecules14125144
Lampiran 1 Diskusi
1. Factor internal : hormone dan hereditas Faktor eksternal : suhu, nutrient, oksigen
2. Auksin : merangsang perpanjangan sel, pembentukan bunga dan buah, pemanjangan titik tumbuh, pembengkokan batang, pembentukan akar lateral, dan terjadinya proses diferensiasi.
Giberelin : merangsang pembelahan sel kambium, pembungaan lebih awal sebelum awalnya,
pembentukan buah tanpa biji, tanaman tumbuh sangan cepat sehingga mempunyai ukuran raksasa
Sitokinin : merangsang proses pembelahan sel, menunda pengguguran daun, bunga, dan buah,
mempengaruhi pertumbuhan tunas dan akar, meningkatkan daya resistensi terhadap pengaruh yang merugikan, menghambat penguningan daun.
Gas Etilen : membantu memecah dormansi pada tanaman, mendukung pematangan buah,
mendukung terjadinya pelapukan pada daun, mendukung proses pembungaan, menghambat pemanjangan akar, menstimulasi perkecambahan, dan mendukung terbentuknya bulu-bulu akar.
Asam Absisat : menghambat perkecambahan biji, mempengaruhi pembungaan, memperpanjang
masa dormansi umbi-umbian, mempengaruhi pucuk tumbuhan untuk melakukan dormansi.
Asam Traumalin : mebantu penyembuhan luka atau regenerasi.
Kalin : mempengaruhi pembentukan organ. Rhizokalin(akar), Kaulokalin(batang), Filokalin(daun),
dan Anthokalin(bunga).
3. Dalam praktikum ini pemberian IAA dengan konsentrasi yang berbeda sangat berpengaruh terhadap pertumbuhan akar Tanaman sirih yakni : pemberian IAA dalam konsentrasi rendah tidak terlalu memicu tumbuhnya akar pada tanaman sirih. Namun pertumbuhan akar meningkat ketika konsentrasi IAA ditingkatkan. Dan mencapai nilai optimum pada konsentrasi 10 ppm. Semakin tinggi konsentrasi IAA yang diberikan, maka pertumbuhan akar akan semakin terhambat karena pada kadar yang sangat tinggi, auksin lebih bersifat menghambat dari pada merangsang pertumbuhan. Jika ditinjau dari keberadaan produksi hormone ethilen yang cukup banyak pada batang Bougenvil, hormone ini dapat menghambat hormone auksin (Salisbury,2005), sehingga proses terbentuknya akar terhambat. Walaupun diberi perlakuan gelap dan terang. Sedangkan pengaruh sinar matahari pada pertumbuhan akar tanaman sirih juga berpengaruh terbukti dengan tanaman sirih yang ditanam pada botol tertutup jumlah akarnya lebih banyak daripada tanaman sirih yang ditanam pada botol yang tidak ditutup. Hal ini menunjukkan bahwa kerja auksin semakin cepat ketika ditempatkan di tempat yang gelap.
Lampiran 2
Tabel perlakuan dan pengamatan
No Perlakuan Pengamatan
1 Batang sirih direndam auksin dalam berbagai konsentrasi selama 1 jam
Batang tanaman sirih terendam larutan IAA
2 10 botol (5 terang, 5 gelap) disiapkan dg diisi air
Botol berisi air
3 Ditutup aluminium foil dan batang dimasukkan
Permukaan Botol tertutup aluminium foil
4 Botol terang Tanaman sirih terndam air dalam botol terang
5 Botol gelap Tanaman sirih terndam air dalam botol gelap
6 Damati selama 7 hari dg menghitung jumlah akar
Tumbuh akar pada ruas batang tanaman sirih
Lampiran 3
Tabel hasil perlakuan gelap terang dengan pemberian IAA konsentrasi berbeda Hari ke- Gelap Terang kontrol 0,1 ppm 1 ppm 10 ppm 100 ppm kontrol 0,1 ppm 1 ppm 10 ppm 100 ppm 1 0 0 0 0 0 0 0 0 0 0 2 2 2 6 6 0 0 0 0 3 0 3 2 2 7 8 0 1 0 0 9 6 4 2 2 7 16 0 1 0 0 13 6 5 2 2 8 17 0 1 0 0 13 6 6 2 2 8 17 0 1 0 0 14 7 7 2 2 8 17 0 1 0 0 15 7