PEMURNIAN DAN KARAKTERISASI ENZIM
GLUKOSA OKSIDASE DARI ISOLAT LOKAL
Aspergillus niger (IPBCC.08.610)
RIAN TRIANA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
ABSTRAK
RIAN TRIANA. Pemurnian dan Karakterisasi Enzim Glukosa Oksidase dari
Isolat Lokal Aspergillus niger (IPBCC.08.610). Dibimbing oleh LAKSMI
AMBARSARI dan POPI ASRI KURNIATIN.
Produksi berbagai macam enzim menggunakan mikroorganisme merupakan salah
satu hal yang dapat dikembangkan dari kekayaan mikroorganisme di Indonesia.
Salah satu enzim yang banyak digunakan dan dijual secara komersial adalah
glukosa oksidase (GOD). Penelitian ini bertujuan menentukan waktu inkubasi
optimum untuk produksi GOD dari isolat lokal Aspergillus niger (IPBCC.08.610),
aktivitas spesifik ekstrak kasar dan fraksi hasil pemurnian enzim. Selain itu, untuk
menentukan suhu dan pH optimum dalam penentuan aktivitas GOD serta nilai K
mdan v
maks. Pemurnian yang dilakukan yaitu pengendapan dengan amonium sulfat
dan dialisis. Waktu inkubasi optimum untuk produksi GOD dari A. niger
(IPBCC.08.610) yaitu 48 jam dengan kecepatan awal reaksi 0.80/menit dan
aktivitas spesifik sebesar 3.21 U/mg. Amonium sulfat dengan kejenuhan 80%
optimum untuk mengendapkan protein GOD dengan aktivitas spesifik fraksi yang
didapat sebesar 22.18 U/mg dan tingkat kemurnian 6.92 kali. Aktivitas spesifik
fraksi dialisis yaitu 21.25 U/mg dan tingkat kemurniannya 6.63 kali terhadap
enzim kasar. Nilai K
Mdan v
maksyang diperoleh dari fraksi dialisis berturut-turut
adalah 46 mM dan 11 U/mg. Suhu dan pH optimum untuk berlangsungnya reaksi
GOD adalah antara 37 - 45
oC dan pH 5.5.
ABSTRACT
RIAN TRIANA. Purification and Characterization of Glucose Oxidase Enzyme
from Local Isolate of Aspergillus niger (IPBCC.08.610). Under direction of
LAKSMI AMBARSARI and POPI ASRI KURNIATIN.
Production of various enzymes using microorganisms is one way of
developing
microorganism biodiversity in Indonesia. For this study, glucose oxidase (GOD)
which is widely available for use and
purchase in the commercial market
was
used. This research intended to
determine the optimum incubation time for the
production of GOD from Aspergillus niger local isolate (IPBCC.08.610) and
determine the specific activity of the crude extract and purified enzymes fraction.
In addition, it sought to determine the optimum temperature and pH level in GOD
reaction and establish the values of K
mand v
max. Optimum
incubation
time for
GOD production of A. niger (IPBCC.08.610) was 48 hours with initial velocity of
the reaction and the specific activity at
0.80/minute and 3.21 U/mg. Ammonium
sulfate with 80% saturation was optimum to precipitate the GOD protein with
specific activity of the fraction at 22.18 U/mg and purity levels at 6.92 times.
Specific activity of the fraction of dialysis was 21.25 U/mg and the level of purity
was 6.63 times. K
mand v
maxvalues were 46 mM and 11
U/mg with optimal
temperature and pH level for GOD reaction between 37 - 45°C and pH 5.5.
Key words: Aspergillus niger, glucose oxidase, enzyme purification
PEMURNIAN DAN KARAKTERISASI ENZIM
GLUKOSA OKSIDASE DARI ISOLAT LOKAL
Aspergillus niger (IPBCC.08.610)
RIAN TRIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Skripsi : Pemurnian dan Karakterisasi Enzim Glukosa Oksidase dari Isolat
Lokal Aspergillus niger (IPBCC.08.610)
Nama
: Rian Triana
NIM
: G84080004
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS
Popi Asri Kurniatin, S.Si., Apt., M.Si.
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App. Sc.
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur kepada Allah SWT yang telah melimpahkan rahmat dan
karunia-Nya
sehingga
penulis
dapat
menyelesaikan
penelitian
yang
berjudul ”Pemurnian dan Karakterisasi Enzim Glukosa Oksidase dari Isolat Lokal
Aspergillus niger (IPBCC.08.610)”. Penelitian ini dilaksanakan mulai bulan
November 2011 sampai dengan September 2012 di Laboratorium Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada pembimbing utama Dr. Laksmi
Ambarsari, MS. serta pembimbing kedua Popi Asri Kurniatin, S.Si., Apt., M.Si.,
yang telah memberikan bimbingan, pengarahan, saran, serta waktunya selama
pelaksanaan penelitian ini. Terima kasih pula untuk kedua orang tua dan
teman-teman penulis atas doa, dukungan, dan bantuan yang telah diberikan.
Penulis menyadari masih terdapat banyak kekurangan dalam penyusunan
skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang
membangun untuk perbaikan dalam penulisan selanjutnya. Semoga penelitian ini
dapat bermanfaat baik bagi penulis maupun pembaca.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 12 Juni 1990 di Karawang. Penulis
merupakan anak tunggal dari pernikahan Mohamad Najib Soleh dan Silvia
Fitriyani. Tahun 2002 penulis lulus dari SDN Mekarmaya I, Jawa Barat kemudian
melanjutkan ke SMPN I Cilamaya, Jawa Barat dan lulus pada tahun 2005.
Penulis menyelesaikan studi di SMAN 1 Karawang, Jawa Barat pada tahun 2008
dan diterima di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi
Masuk IPB (USMI). Penulis tercatat sebagai mahasiswa di Departemen Biokimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif di beberapa organisasi kampus.
Penulis menjadi anggota UKM Forces (Forum for Scientific Studies) periode
2008-2010, anggota Badan Eksekutif Mahasiswa FMIPA divisi Komunikasi dan
Informasi pada tahun 2010, dan menjadi ketua Komisi III Dewan Perwakilan
Mahasiswa FMIPA pada tahun 2011. Penulis juga menjadi asisten praktikum pada
mata kuliah Genetika Dasar, Biokimia Umum, Struktur dan Fungsi Biomolekul,
dan Teknologi Asam Nukleat. Penulis pernah melaksanakan magang di
Laboratorium Biokimia, Balai Besar Penelitian dan Pengembangan Bioteknologi
dan Sumber Daya Genetik Pertanian, Bogor selama bulan Januari hingga Februari
2011 dengan judul “Ekstraksi Senyawa Inhibitor dari Bacillus firmus dan
Pseudomonas aeruginosa serta Uji Daya Hambatnya Terhadap Pertumbuhan
Xanthomonas oryzae pv. Oryzae”. Selain itu penulis juga pernah melaksanakan
praktik lapang di laboratorium yang sama selama periode Juli hingga Agustus
2011 dengan judul “Uji Aktivitas Daya hambat Metabolit Bakteri Endofit Padi
Terhadap Cendawan Patogen Tanaman” dan “Identifikasi Gen Ketahanan Padi
Terhadap Tungro dengan Metode Polymerase Chain Reaction (PCR)”.
Penulis mendapatkan beasiswa Eka Tjipta Foundation selama empat tahun
masa perkuliahan dan pernah meraih beasiswa Indonesian English Language
Study Program (IELSP) pada tahun 2012 untuk belajar bahasa Inggris selama
delapan minggu di Arizona State University, Arizona, Amerika Serikat. Beberapa
karya ilmiah yang pernah ditulis oleh penulis, diantaranya “Fungsionalisasi
Limbah Cangkang Udang Untuk Meningkatkan Kandungan Kalsium Susu
Kedelai sebagai Penambah Gizi Masyarakat” tahun 2010, dan “Pemanfaatan
Ekstrak Kulit Buah Delima (Punica granatum L.) Limbah Pertanian Budidaya
Lokal Bogor sebagai Inhibitor Hepatotoksik” tahun 2011 yang diikutsertakan
pada Program Kreativitas Mahasiswa (PKM) yang diselenggarakan oleh DIKTI.
DAFTAR ISI
Halaman
DAFTAR TABEL ...
ix
DAFTAR GAMBAR ...
ix
DAFTAR LAMPIRAN ...
ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA ...
2
Aspergillus niger ...
2
Glukosa Oksidase ...
2
Pemurnian Enzim ...
3
Aktivitas Enzim ...
3
Kinetika Enzim ...
4
BAHAN DAN METODE ...
5
Alat dan Bahan ...
5
Metode ...
5
HASIL DAN PEMBAHASAN ...
7
Waktu Produksi Optimum Glukosa Oksidase ...
7
Fraksinasi Amonium Sulfat ...
8
Dialisis ...
9
pH dan Suhu Optimum ...
10
Konstanta Kinetika ...
11
SIMPULAN DAN SARAN ...
12
Simpulan ...
12
Saran ...
12
DAFTAR PUSTAKA ...
12
DAFTAR TABEL
Halaman
1 Selektivitas substrat dari GOD ...
3
2 Aktivitas GOD berdasarkan waktu produksi ...
7
3 Aktivitas GOD tiap fraksi hasil pemurnian ...
9
DAFTAR GAMBAR
Halaman
1 Aspergillus niger (Gautam et al. 2011) ...
2
2 Reaksi GOD (Simpson et al. 2007)...
2
3 Kecepatan awal reaksi (v
o) ...
8
4 Pengaruh pH pada aktivitas GOD ...
10
5 Pengaruh suhu pada aktivitas GOD ...
10
6 Pengaruh konsentrasi substrat terhadap aktivitas spesifik enzim ...
11
7 Kurva Lineweaver-Burk...
12
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ...
17
2 Penentuan waktu produksi optimum ...
18
3 Pemurnian dengan amonium sulfat dan dialisis ...
20
4 Pengaruh suhu dan pH ...
23
5 Penentuan nilai K
mdan v
maks...
25
PENDAHULUAN
Indonesia merupakan negara tropis yang kaya akan keanekaragaman flora, fauna,
maupun mikroorganismenya. Kekayaan
tersebut dapat dijadikan obyek penelitian yang
potensial untuk dikembangkan.
Mikroorganisme yang ada di alam Indonesia hanya sebagian kecil yang telah dimanfaatkan untuk membuat produk yang mempunyai nilai ekonomi tinggi. Potensi alam tersebut hingga saat ini belum termanfaatkan secara optimal.
Produksi berbagai macam enzim
menggunakan mikroorganisme merupakan salah satu hal yang dapat dikembangkan. Penggunaan enzim saat ini sangat luas di berbagai bidang, seperti bidang pangan, kesehatan, pertanian, maupun energi. Namun ironisnya sampai saat ini Indonesia masih belum dapat memproduksi sendiri dan sepenuhnya masih bergantung pada produk impor (Saryono 2008). Salah satu enzim yang banyak digunakan dan dijual secara komersial adalah glukosa oksidase (GOD).
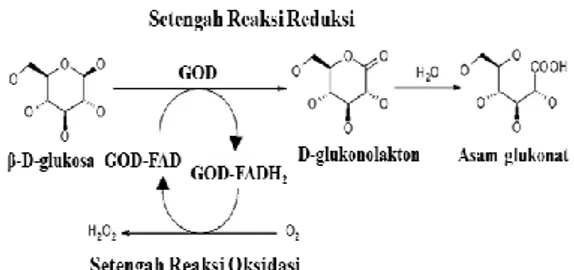
Glukosa oksidase merupakan enzim yang
mengatalisis oksidasi dari β-D-glukosa
menjadi D-glukono-δ-lakton dan hidrogen peroksida menggunakan molekul oksigen sebagai penerima elektron. D-glukono-δ-lakton lalu terhidrolisis secara non-enzimatis
menjadi asam glukonat dan FADH2-enzim
yang tereduksi dioksidasi kembali oleh molekul oksigen (Sabir et al. 2007). Enzim ini banyak digunakan dalam industri untuk produksi asam glukonat dan sumber hidrogen peroksida dalam pengawetan bahan makanan (Ahmad et al. 2007). GOD dapat menghilangkan beberapa bakteri patogen pada
makanan, seperti Salmonella infantis,
Staphylococcus aureus, Clostridium perfringens, Bacillus aureus, Campylobacter jejuni, dan Listeria monocytogens (Bankar et al. 2009). Selain itu enzim ini juga digunakan dalam biomedis untuk penentuan kadar glukosa darah. Penetapan kadar glukosa darah menggunakan enzim GOD baik secara kolorimetri maupun amperometri lebih unggul dibandingkan dengan metode non-enzimatik
lainnya karena enzim GOD memiliki
spesifitas substrat yang tinggi terhadap β-D-glukosa (Ahmad et al. 2007). Selain itu, enzim ini memiliki bilangan putaran dan kestabilan yang tinggi (Sherbenny et al. 2005).
Penggunaan enzim GOD saat ini
dikembangkan juga di dalam aplikasi
enzymatic fuel cell (EFC) atau sel bahan bakar enzimatis (Sabir et al. 2007). EFC merupakan
salah satu jenis dari sel biofuel yang menggunakan enzim sebagai biokatalis yang dapat mengubah energi biokimia menjadi energi listrik secara langsung. Pengembangan EFC dalam bidang medis digunakan sebagai sumber energi pada alat-alat implan, seperti pada alat pemacu jantung (Barton et al. 2004). Pemanfaatan EFC ini dikarenakan dapat menggunakan substrat yang ada dalam tubuh sebagai sumber energi, seperti glukosa, laktosa, dan bilirubin. Selain itu, EFC memiliki selektivitas reaksi dan spesifitas substrat yang tinggi. Selektivitas reaksi yang
tinggi pada enzim memungkinkan
perancangan fuel cell yang hanya terdiri atas sepasang anoda dan katoda dalam larutan berisi substrat dan oksidan. Selain itu, EFC juga memiliki angka turnover tinggi dan aktivitas pada kondisi sedang (Lee et al. 2011; Neto et al. 2011).
Penggunaan GOD di dalam aplikasi fuel cell mendorong banyak penelitian dan pengembangan untuk mengoptimalkan enzim ini. Fiedurek et al. (1986) menemukan bahwa Aspergillus niger merupakan sumber GOD yang paling baik karena enzim yang dihasilkan bersifat sangat stabil dibandingkan GOD yang dihasilkan oleh Penicillium sp. Stabilitas enzim ikut menentukan masa hidup biofuel cell (Kim et al. 2006; Khurshid et al. 2011). Berdasarkan penelitian Putri (2011) diketahui bahwa isolat lokal A. Niger
(IPBCC.08.610)
berpotensi untukmenghasilkan enzim GOD. Pemanfaatan GOD dari isolat lokal ini diharapkan mampu mengembangkan EFC di Indonesia secara optimal.
Penelitian ini bertujuan menentukan waktu inkubasi optimum untuk produksi GOD dari isolat lokal Aspergillus niger (IPBCC.08.610), menentukan aktivitas spesifik ekstrak kasar enzim dan fraksi enzim hasil pemurnian, menentukan suhu dan pH optimum dalam penentuan aktivitas GOD serta menentukan nilai konstanta Michaelis Menten (Km) dan kecepatan reaksi maksimum (vmaks) nya. Hipotesis penelitian ini adalah enzim GOD yang dihasilkan melalui waktu inkubasi produksi optimum memiliki aktivitas spesifik tinggi yang semakin meningkat setelah mengalami proses pemurnian. Selain itu didapatkan juga kondisi pH dan suhu
optimum bagi enzim GOD untuk
berlangsungnya reaksi enzimatis serta
diperoleh nilai Km dan vmaks nya. Penelitian ini diharapkan dapat menjadi informasi dasar untuk penggunaan enzim GOD dalam pengembangan EFC di Indonesia.
TINJAUAN PUSTAKA
Aspergillus niger
Aspergillus niger merupakan fungi yang
termasuk genus Aspergillus, famili
Trichocomaceae, ordo Eurotiales, dan filum Ascomycota (Gautam et al. 2011). A. niger
tergolong ascomycetes berfilamen yang
pertumbuhannya cepat dan toleran terhadap pH. A. niger hidup di daerah tropis dan subtropis secara aerob, serta mudah diisolasi dari tanah (Khan et al. 2007), udara dan air (Versar 1991), pangan (Perrone et al. 2007), rempah-rempah (Avasthi et al 2010), buah-buahan (Magnoli et al. 2003), dan lain-lain. Fungi ini dapat hidup pada suhu 6 - 47oC dan pH 1.4 - 9.8, sedangkan suhu optimumnya ialah 35 - 37 ºC. Aktivitas air (Aw) minimal untuk pertumbuhannya adalah 0.88. Pada larutan garam dan gula dengan konsentrasi tinggi, A. niger mampu untuk tetap hidup karena dinding selnya mempunyai tekanan osmotik sampai 250 atm (Gautam et al. 2011).
Aspergillus niger disebut juga black mold atau kapang hitam (Gambar 1) karena memproduksi spora karbon hitam atau coklat yang sangat gelap yang membuatnya berbeda dengan spesies Aspergillus lainnya. Spora A. niger berbentuk globular, konidianya
kasar, dapat berwarna hitam, coklat
kehitaman, atau ungu kecoklatan. Hifa A. niger berseptat dan sporanya berukuran besar. Hifa vegetatif berada di bawah permukaan dan digunakan untuk menyerap unsur hara sedangkan yang muncul di atas permukaan
umumnya merupakan hifa fertil yang
digunakan sebagai alat reproduksi (Anwar 2006).
Aspergillus niger memiliki peranan penting terkait dengan kerusakan pasca panen pada berbagai macam substrat (Perrone et al. 2007). A. niger menyebabkan kerusakan pada bahan pangan karbohidrat, rempah-rempah, tekstil, serta kerusakan pada kayu dan bahan kertas (Gandjar et al. 2006). Fungi ini
Gambar 1 Aspergillus niger (Gautam et al. 2011).
merupakan alergen asma serta penyebab terjadinya mikosis kuku dan rongga telinga (Gandjar et al. 2006). Menurut Vondervoort (2004), A. niger banyak digunakan dalam bidang industri untuk produksi asam-asam organik dan protein.
Glukosa Oksidase
Glukosa oksidase (β-D-glukosa:oksigen-1-oksidoreduktase, EC 1.1.3.4) merupakan enzim yang mengatalisis oksidasi dari β-D-glukosa menjadi D-glukono-δ-lakton dan hidrogen peroksida menggunakan molekul oksigen sebagai penerima elektron. D-glukono-δ-lakton lalu terhidrolisis secara non-enzimatis menjadi asam glukonat dan FADH2 -enzim yang tereduksi dioksidasi kembali oleh molekul oksigen (Sabir et al. 2007). Reaksi GOD ditunjukkan pada Gambar 2. Glukosa
oksidase termasuk golongan enzim
oksireduktase dan disebut juga sebagai glukosa aerodehidrogenase (Khurshid 2008).
Glukosa oksidase yang berasal dari A. niger memiliki bobot molekul 152 kDa dan mengandung dua rantai subunit polipeptida identik yang terikat oleh ikatan disulfida (Simpson 2005). Setiap subunit memiliki molekul FAD sebagai gugus prostetiknya. Glukosa oksidase dari A. niger mengandung
lebih banyak heksosamin dan manosa
dibandingkan glukosa, sementara glukosa oksidase yang dihasilkan Pencillium sp. mengandung lebih banyak glukosa. Glukosa oksidase banyak mengandung asam amino serin, glisin, asam glutamat, asam aspartat, dan alanin (Sherbeny et al. 2005). Sisi aktif glukosa oksidase mengandung tiga asam amino yang berperan dalam proses katalisis, yaitu His516 dan Glu412, yang berikatan hidrogen dengan His559 (Lescovac et al. 2005).
Glukosa oksidase yang dihasilkan oleh A. niger lebih stabil dan sudah banyak tersedia secara komersial. Namun, glukosa oksidase
yang berasal dari Penicillium sp.
menunjukkan afinitas dan spesifitas substrat yang lebih tinggi. Enzim glukosa oksidase
Tabel 1 Selektivitas substrat dari GOD Substrat Laju relatif oksidasi (%) β-D-Glukosa 100 2-Deoksi-D-glukosa 25 6-Deoksi-6-fluoro-D-glukosa 3 6-Metil-D-glukosa 1.85 4,6-Dimetil-D-glukosa 1.22 D-Manosa 0.98 D-Xilosa 0.98 α-D-Glukosa 0.22
Sumber: Mikkelsen & Corton (2004).
spesifik terhadap substrat β-D-glukosa, sementara bentuk anomer α-D-glukosa tidak sesuai sebagai substrat enzim ini. Tabel 1 menunjukkan selektivitas subtrat dari GOD.
Inhibitor enzim ini meliputi
p-kloromerkuribenzoat, As, Ag+, Hg2+, Cu2+, Br -, Cl-, F-, NaNO3, D-arabinosa, fruktosa, ribosa,
peroksida, hidroksilamin, hidrazin,
fenilhidrazin, natrium bisulfat, natrium kolat, dan hidroksilamin (Simpson 2005).
Dalam aplikasi farmasi, glukosa oksidase biasa digunakan sebagai biosensor untuk penentuan glukosa. Dalam industri makanan, enzim ini digunakan untuk menghilangkan glukosa atau oksigen dalam pengolahan beragam produk dengan tujuan mengubah warna, rasa, dan tekstur. Saat ini glukosa oksidase banyak dikembangkan dalam sistem biofuel cell (Bhatti & Saleem 2009).
Pemurnian Enzim
Struktur, sifat kimia maupun sifat fisika enzim yang diisolasi dari suatu organisme dapat ditentukan apabila enzim tersebut berada dalam keadaan murni. Pemurnian enzim biasanya terdiri atas beberapa tahapan, yaitu pengendapan protein dengan amonium sulfat, dialisis, dan kromatografi (Sherbeny et al. 2005). Tahap pengendapan protein dengan
amonium sulfat dilakukan dengan
menambahkan garam dalam konsentrasi tinggi. Konsentrasi garam yang rendah meningkatkan kelarutan protein karena ion-ion berinteraksi dengan gugus bermuatan pada permukaan protein dan mengganggu dengan kekuatan elektrostatik yang kuat yang disebut proses “salting in” (Metzler 2003). Pada konsentrasi garam yang tinggi, garam menarik air dari protein sehingga menimbulkan agregasi dan pengendapan dari molekul protein yang disebut proses “salting out” (Koolman & Roehm 2005).
Amonium sulfat sering digunakan dalam
pengendapan protein karena memiliki tingkat kelarutan tinggi (sekitar 3.6 M), kekuatan ionik tinggi yang setara dengan nilai kuadrat jumlah ionnya, tidak bersifat toksik, murah, dan stabil terhadap enzim (Yuningtyas 2008). Beberapa enzim dapat mengalami kerusakan apabila ditambahkan amonium sulfat. Untuk jenis enzim tersebut, pengendapan enzim biasanya dilakukan dengan penambahan pelarut organik, seperti metanol, etanol, propan-2-ol, dan aseton. Perlakuan ini dapat menurunkan konstanta dielektrik larutan tersebut sehingga kelarutan protein juga menurun. Pelarut organik jarang digunakan dalam skala besar karena mahal, mudah terbakar, dan lebih mudah mendenaturasi enzim tersebut apabila suhunya diatas 0oC (Chaplin 2004).
Tahap pemurnian enzim lebih lanjut yaitu melalui dialisis. Tahap ini penting untuk dilakukan setelah pengendapan amonium sulfat (Nelson & Cox 2008). Dialisis merupakan cara pemisahan molekul-molekul kecil dari molekul besar dengan membiarkan molekul kecil tersebut berdifusi melalui membran selektif permeabel. Dialisis biasanya digunakan untuk memisahkan garam dan molekul kecil dari larutan makromolekul (Koolman & Roehm 2005). Ekstrak enzim hasil pemurnian parsial dimasukkan ke dalam membran dialisis yang terbuat dari membran semipermeabel dan dicelupkan dalam bufer dengan volume yang lebih besar. Molekul-molekul kecil akan melewati membran hingga konsentrasi sampel di dalam dan di luar membran sama. Seiring dengan pergerakan molekul kecil melalui membran, pelarut juga ikut berpindah melalui membran dalam arah yang berlawanan. Hal ini dapat menyebabkan terjadinya pengenceran sampel (Nelson & Cox 2008).
Aktivitas Enzim
Aktivitas enzim didefinisikan sebagai
kecepatan pengurangan substrat atau
kecepatan pembentukkan produk pada kondisi optimum (Nelson & Cox 2008). Suhu, pH,
konsentrasi substrat, serta keberadaan
aktivator dan inhibitor merupakan hal-hal yang dapat mempengaruhi aktivitas enzim. Aktivitas enzim umumnya dinyatakan sebagai unit (U). Unit didefinisikan sebagai jumlah enzim yang diperlukan untuk menggunakan satu mikromol substrat per menit pada suhu dan temperatur tertentu. Aktivitas spesifik didefinisikan sebagai aktivitas enzim per satuan berat (U/mg) pada suhu dan pH
digunakan untuk menentukan kemurnian enzim. Semakin tinggi aktivitas spesifik enzim yang digunakan maka semakin tinggi tingkat kemurniannya (Mikkelsen & Corton 2004).
Aktivitas enzim dipengaruhi oleh
konsentrasi substrat. Konsentrasi substrat yang rendah menyebabkan sisi aktif enzim hanya bereaksi dengan sedikit substrat. Jika konsentrasi substrat diperbesar, maka susbtrat yang dapat berinteraksi dengan sisi aktif enzim akan semakin banyak. Hal ini
mengakibatkan aktivitas enzim semakin
meningkat dan reaksi berjalan lebih cepat. Pada batas konsentrasi substrat tertentu, sisi aktif enzim telah jenuh oleh substrat, sehingga penambahan substrat tidak meningkatkan aktivitas enzim (Nelson & Cox 2008).
Enzim diketahui sensitif terhadap
perubahan suhu. Suhu memiliki pengaruh yang cukup besar bukan hanya pada aktivitas enzim melainkan juga pada stabilitas enzim. Peningkatan suhu meningkatkan laju reaksi kimia yang dikatalisis dan di sisi lain meningkatkan juga laju inaktivasi enzim (Illanes 2008). Suhu mempengaruhi energi kinetik molekul. Kenaikan energi kinetik molekul yang terjadi seiring peningkatan suhu dapat meningkatkan frekuensi tumbukan. Kombinasi frekuensi tumbukan yang lebih sering dan lebih berenergi akan meningkatkan laju reaksi (Murray et al. 2009). Hubungan antara kecepatan reaksi enzim dan suhu adalah eksponensial (Simpson 2005). Oleh
karena itu, pada suhu rendah reaksi
berlangsung lambat, sedangkan pada suhu yang lebih tinggi reaksi berlangsung lebih cepat. Suhu memiliki pengaruh yang cukup besar bukan hanya pada aktivitas enzim
melainkan juga pada stabilitas enzim.
Peningkatan suhu meningkatkan laju reaksi kimia yang dikatalisis dan di sisi lain meningkatkan juga laju inaktivasi enzim (Illanes 2008). Enzim menunjukkan aktivitas maksimumnya pada suhu yang optimum (Simpson 2005).
Enzim memiliki pH optimum yaitu pH saat aktivitasnya maksimum. Pada pH lebih
tinggi atau lebih rendah aktivitasnya
berkurang. Enzim merupakan suatu polimer poliionik sehingga pH sangat mempengaruhi sifatnya. Perubahan pada pH dapat mengubah penyebaran muatan pada sisi aktif semua bagian permukaan dari molekul protein (Illanes 2008). Rantai samping asam amino pada sisi aktif dapat berperan sebagai asam dan basa lemah dengan fungsi kritis yang bergantung pada keadaan ionisasi tertentu.
Rantai samping tersebut mungkin berperan penting dalam interaksi yang menjaga struktur dari protein (Nelson & Cox 2008).
Kinetika Enzim
Pengukuran laju reaksi yang dikatalisis oleh enzim sebagian besar menggunakan laju awal (vo), yaitu kondisi singkat saat jumlah
produk masih sedikit, sehingga reaksi
berkebalikan dapat diabaikan. Laju awal ditentukan selama beberapa menit pertama
dari reaksi dengan melihat jumlah
pengurangan substrat maupun penambahan konsentrasi produk. Setelah keadaan ini, laju reaksi relatif lebih lambat, hingga kemudian akan berlangsung konstan. Pengukuran laju awal reaksi merupakan hal penting untuk memahami mekanisme kerja enzim serta memperkirakan aktivitas enzim tersebut. Hal ini disebabkan saat substrat yang digunakan memiliki konsentrasi molar yang besar, laju awal setara dengan konsentrasi enzim (Wilson & Walker 2000).
Peningkatan konsentrasi substrat akan meningkatkan laju reaksi hingga tercapai nilai laju maksimal (vmaks). Kecepatan ini dicapai pada konsentrasi substrat yang sangat tinggi saat semua enzim terikat pada substrat (Rogers & Gibon 2009). Jika peningkatan konsentrasi substrat tidak lagi meningkatkan laju reaksi maka reaksi tersebut telah mengalami kejenuhan (Murray et al. 2009).
Nilai Km merupakan parameter yang
menunjukkan kekuatan pengikatan enzim terhadap substrat. Nilai Km yang tinggi menandakan bahwa laju disosiasi balik (k-1)
lebih besar dibandingkan dengan laju
pembentukan kompleks enzim substrat (k1) dan hal ini dapat diartikan bahwa enzim terikat pada substrat dengan lemah (afinitas enzim terhadap substrat rendah). Kebalikan dari hal tersebut, nilai Km yang rendah menunjukkan afinitas enzim yang tinggi
terhadap substrat. Hubungan Km dengan
dengan afinitas enzim dapat dijelaskan dengan persamaan berikut:
m
1 cat 1
Berdasarkan persamaan tersebut terlihat
bahwa Km berbanding lurus dengan k-1. Oleh karena itu, ketika afinitas enzim rendah terhadap substrat maka kompleks ES akan sulit terbentuk dan reaksi cenderung mengarah ke arah penguraian ES menjadi E dan S. Hal ini menimbulkan laju disosiasi balik atau k-1 menjadi tinggi yang berdampak pada nilai Km
yang tinggi pula. Berdasarkan persamaan, nilai Km yang tinggi dapat juga dikarenakan tingginya nilai kcat (Rogers & Gibon 2009). Afinitas enzim yang tinggi mengakibatkan kompleks ES lebih mudah terbentuk sehingga laju pembentukan ES atau k1 menjadi tinggi yang berbanding terbalik dengan nilai Km
yang rendah. Berdasarkan persamaan
Michaelis-Menten,
maks m
saat v mencapai setengah vmaks maka nilai Km akan sebanding dengan konsentrasi substrat pada titik tersebut. Oleh karena itu, nilai Km dapat diartikan sebagai konsentrasi substrat saat v mencapai setengah vmaks (Rogers & Gibon 2009).
Turnover number atau bilangan putaran suatu enzim ialah nilai maksimal aktivitas katalisis enzim tersebut, atau disebut juga sebagai kcat. Nilai kcat didefinisikan sebagai jumlah molekul substrat yang diubah menjadi produk per satuan waktu pada satu molekul enzim saat enzim tersebut jenuh oleh substrat (Nelson & Cox 2008). Nilai ini dapat diperoleh dengan persamaan:
bilangan putaran maks Et
[Et] g enzim ml
bobot molekul enzim ( g mol)
BAHAN DAN METODE
Alat dan BahanBahan yang digunakan ialah isolat lokal Aspergillus niger (IPBCC.08.610) koleksi Departemen Biologi IPB yang merupakan hasil isolasi dari tanah di daerah Tarakan, Kalimantan Timur, pasir kuarsa, akuades,
amonium sulfat, sukrosa, pepton,
(NH4)2HPO4, MgSO4, NaNO3, KCl, CaCO3, (NH4)2SO4, NaOH 2 N, glukosa, bufer (natrium fosfat 0.1 M pH 6.0; fosfat sitrat 0.1 M pH 5.6; kalium fosfat 0.1 M pH 7.0), pereaksi Lowry A (Na2CO3 2% dalam NaOH 0.1 N), pereaksi Lowry B (CuSO4.5H2O 0.5%
dalam Na-K-tartrat.5H2O 1%), pereaksi
Lowry C (campuran 50 mL pereaksi Lowry A dengan 1 mL pereaksi Lowry B), pereaksi Lowry D (pereaksi Folin-Cioucalteau yang diencerkan dengan aquades 1:1), standar Bovine Serum Albumin (BSA), o-dianisidin,
horseradish peroksidase (HRP) (75
purpurogallin U/mg).
Alat-alat yang digunakan adalah alat-alat
gelas, mortar, kertas saring, membran
selulosa, neraca analitik OHAUS GA 200, waterbath, pH meter, inkubator, vortex, magnetic stirrer, spektrofotometer Genesys 10UV, Beckman High Speed Centrifuge, autoklaf TOMY High Pressure Steam Sterilizer ES-315, peralatan laboratorium yang biasa digunakan di laboratorium analitik.
Metode
Optimasi Waktu Produksi Enzim Glukosa Oksidase (modifikasi Singh & Verma 2010)
Penentuan waktu produksi optimum
dilakukan untuk mengetahui waktu inkubasi
optimum Aspergillus niger dalam
menghasilkan enzim glukosa oksidase dengan aktivitas yang tinggi. Produksi biomassa dilakukan di Laboratorium Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong. Sebanyak 500 mL media produksi disiapkan dalam labu Erlenmeyer. Media produksi mengandung 0.4 g/L (NH4)2HPO4; 0.2 g/L KH2PO4; 0.2 g/L MgSO4.7H2O; 40
g/L CaCO3; 3.3% sukrosa; dan 0.35%
glukosa. Media diatur sehingga memiliki pH
5.5. Suspensi spora dari isolat lokal
Aspergillus niger yang telah ditumbuhkan
dalam media starter selama 24 jam
dimasukkan ke dalam media tersebut
sebanyak 10% dari volume media produksi. Komposisi media starter, yaitu 0.4 g/L (NH4)2HPO4; 0.2 g/L KH2PO4; 0.2 g/L MgSO4.7H2O; 10 g/L pepton; dan 70 g/L sukrosa. Kultur tersebut kemudian diinkubasi dengan kecepatan agitasi 200 rpm pada suhu 30oC dengan dua variasi waktu, yaitu 48 dan 72 jam. Miselium lalu dipisahkan dari media
pertumbuhan dengan cara filtrasi
menggunakan kertas saring dan digunakan pada proses isolasi enzim. Enzim yang diperoleh lalu diuji aktivitasnya. Waktu inkubasi yang menghasilkan enzim dengan aktivitas total tertinggi ditetapkan sebagai waktu inkubasi optimum. Produksi GOD selanjutnya dilakukan pada waktu tersebut. Isolasi Enzim Glukosa Oksidase dari
Aspergillus niger (modifikasi Firman &
Aryantha 2003)
Miselium hasil penyaringan digerus
sampai halus dengan menggunakan pasir kuarsa dengan perbandingan 1:1. Sel yang telah lisis ditambahkan dengan bufer natrium fosfat 0.1 M pH 6.0 kemudian disentrifugasi pada kecepatan 17000 x g suhu 4oC selama 20
menit. Supernatan yang dihasilkan merupakan enzim kasar glukosa oksidase. Enzim kasar diukur kadar protein dan aktivitasnya lalu dilakukan tahap pemurnian dengan amonium sulfat dan dialisis.
Pemurnian Enzim Glukosa Oksidase
(modifikasi Sherbeny et al. 2005)
Pemurnian enzim glukosa oksidase
dilakukan melalui pengendapan dengan
amonium sulfat dan dialisis. Tahap pertama yang dilakukan ialah presipitasi enzim kasar dengan penambahan amonium sulfat. Ekstrak kasar enzim diendapkan dengan fraksinasi amonium sulfat mulai dari kejenuhan 20% sampai 80% dengan interval 20%. Larutan didiamkan selama semalam pada suhu 4 oC, kemudian disentrifus pada kecepatan 17000 x g dengan suhu 4oC selama 15 menit. Fraksi yang terendapkan dilarutkan dalam 1 mL bufer fosfat sitrat 0.1 M pH 5.6. Setiap fraksi yang diperoleh diukur kadar protein dan aktivitasnya.
Fraksi amonium sulfat dengan aktivitas spesifik tertinggi lalu dimasukkan ke dalam kantong dialisis dan didialisis selama 9 jam dengan menggunakan larutan bufer fosfat sitrat 0.001 M pH 5.6. Larutan bufer diganti setiap 3 jam. Bufer yang telah digunakan diuji
dengan larutan BaCl2 untuk menguji
keberadaan amonium sulfat dalam bufer. Hasil dialisis tersebut kemudian dianalisis kadar protein dan aktivitasnya. Fraksi dialisis digunakan pada analisis pengaruh pH dan suhu serta penentuan nilai Km dan vmaks.
Pengukuran Laju Awal dan Pengukuran Aktivitas Enzim (modifikasi Bergmeyer 1988)
Pereaksi pada pengujian aktivitas enzim terdiri atas 0.5 mL larutan glukosa 10% (b/v) yang didiamkan selama 1 jam setelah pembuatan agar terjadi mutarotasi, 2.4 mL o-dianisidin (6.6 mg o-o-dianisidin dalam 100 mL bufer kalium fosfat 0.1 M pH 7), dan 0.1 mL hidrogen peroksidase 1 mg/mL dicampurkan dalam kuvet. Campuran tersebut dibiarkan
setimbang pada suhu ruang. Nilai
absorbannya diukur pada panjang gelombang 436 nm sebagai Ao hingga stabil. Setelah itu tambahkan 0.1 mL GOD pada campuran dan diukur peningkatan nilai absorbannya setiap 30 detik selama 5 menit pertama pada panjang gelombang 436 nm sebagai At. Laju awal ditentukan saat laju linear maksimum tercapai. Waktu tercapainya laju awal digunakan sebagai waktu pengukuran untuk fraksi enzim lainnya.
Aktivitas GOD setiap fraksi diukur dengan menggunakan pereaksi yang sama dengan penentuan laju awal. Nilai absorbannya diukur pada panjang gelombang 436 nm sebagai Ao hingga stabil. Setelah itu tambahkan 0.1 mL GOD pada campuran dan diukur peningkatan nilai absorbannya sebagai At setiap 10 detik hingga waktu saat laju linear mencapai maksimum pada panjang gelombang 436 nm. Pengukuran dilakukan dengan 2 kali ulangan. Aktivitas dihitung menggunakan absorban pada detik ke-30. Nilai yield dan kemurnian lalu dihitung menggunakan persamaan pada Lampiran 6.
Analisis Kadar Protein (modifikasi Lowry
et al. 1951)
Pengujian kadar protein dilakukan setelah pembuatan kurva standar. Kurva standar dibuat dari standar BSA dengan konsentrasi 50 – 600 µg/mL. Kurva standar yang digunakan sebanyak dua kurva standar. Keduanya menggunakan dua bufer yang berbeda, yaitu bufer natrium fosfat 0.1 M pH 6.0 dan fosfat sitrat 0.1 M pH 5.6. Kurva standar dengan bufer natrium fosfat digunakan untuk mengukur kadar protein enzim kasar sedangkan kurva standar dengan bufer fosfat sitrat digunakan untuk mengukur kadar protein fraksi amonium sulfat dan dialisis.
Sebanyak 0.2 mL sampel ditambahkan 1 mL pereaksi Lowry C lalu dikocok dan dibiarkan selama 10 menit pada suhu ruang. Setelah itu ditambahkan 0.1 mL pereaksi Lowry D kemudian dikocok segera dan dibiarkan selama 30 menit pada suhu ruang. Absorbannya dibaca pada panjang gelombang 750 nm.
Penentuan pH dan Suhu Optimum
(modifikasi Simpson et al. 2007)
Bufer kalium fosfat 0.1 M dengan beragam pH (pH 5 - 8) digunakan sebagai
bufer reaksi dalam pengujian GOD.
Campuran pereaksi pengujian dibiarkan
setimbang pada suhu ruang kemudian diukur
nilai Ao nya. Sebanyak 0.1 mL GOD
ditambahkan pada campuran tersebut lalu diukur peningkatan absorbannya sebagai At.
Pereaksi pengujian aktivitas enzim diukur nilai Ao nya pada panjang gelombang 436 nm. pH bufer kalium fosfat yang digunakan disesuaikan dengan pH yang telah dioptimasi. Setelah itu diinkubasi selama 10 menit pada penangas air dengan suhu yang diujikan (26oC, 37oC, 45 oC, 55 oC, dan 65 oC). Sebanyak 0.1 mL GOD ditambahkan pada campuran tersebut lalu diukur peningkatan
absorbannya sebagai At setiap 10 detik hingga waktu saat laju linear mencapai maksimum pada panjang gelombang 436 nm.
Penentuan Km dan vmaks
(
modifikasiOdebunmi & Owalude 2007)
Larutan glukosa dengan beragam
konsentrasi (8 – 100 mM) digunakan sebagai substrat dalam pengujian GOD lalu dibuat kurva hubungan antara konsentrasi glukosa dan aktivitas spesifik enzim. Setelah itu dibuat
persamaan linear Lineweaver-Burk dan
ditentukan nilai Km dan vmaks nya
menggunakan persamaan tersebut.
HASIL DAN PEMBAHASAN
Waktu Produksi Optimum
Optimasi waktu produksi dilakukan untuk menentukan waktu inkubasi kultur A. niger
(IPBCC.08.610) yang optimum dalam
memproduksi enzim glukosa oksidase. Variasi waktu inkubasi yang digunakan yaitu 48 dan 72 jam. Enzim GOD yang dihasilkan oleh isolat lokal ini merupakan enzim intraseluler (Putri 2011). Biomassa yang dihasilkan oleh A. niger berupa sel bulat berukuran cukup besar dan berwarna putih. Pemanenan biomassa dilakukan dengan penyaringan menggunakan kain kasa. Enzim diisolasi dengan cara lisis mekanik terhadap biomassa yang dihasilkan. Miselia A. niger digerus menggunakan mortar dengan bantuan pasir kuarsa untuk mempermudah proses lisis. Ekstrak kasar yang diperoleh dari masing-masing kultur lalu diukur aktivitas dan konsentrasi proteinnya.
Pengukuran aktivitas glukosa oksidase untuk fraksi 48 dan 72 jam dilakukan dengan
menentukan kecepatan reaksi awal (vo)
terlebih dahulu. Perubahan substrat
berdasarkan waktu pada awalnya adalah linear
namun kemudian menurun. Pengukuran
aktivitas biasanya dilakukan segera setelah reaksi dimulai untuk menghindari terjadinya pengurangan laju akibat pengurangan substrat dan penumpukan produk (Metzler 2003). Oleh karena itu aktivitas enzim (v) ditentukan oleh
vo ketika pengaruh tersebut sangat kecil. Penentuan vo untuk enzim glukosa oksidase dilakukan pada fraksi 48 dan 72 jam.
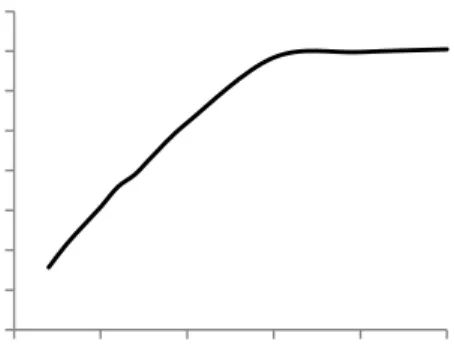
Kecepatan awal reaksi (vo) ditentukan
berdasarkan laju linear maksimum pada kurva yang menghubungkan antara waktu dan absorbansi pengujian enzim.
Kecepatan awal reaksi GOD fraksi 48 jam dan 72 jam diperoleh sebesar 0.80/menit dan 0.69/menit dengan nilai absorbansi setimbang, yaitu 0.797 dan 0.691. Setelah laju awal reaksi enzim diketahui, aktivitas masing-masing sampel diukur dengan waktu pengukuran 1 menit. Waktu ini ditentukan berdasarkan waktu yang menunjukkan terjadinya laju linear tertinggi pada reaksi enzim (to) (Gambar 3). Tabel 2 menunjukkan hasil uji aktivitas dan jumlah protein dari masing-masing kultur. Kultur 48 jam memiliki aktivitas total lebih tinggi dibandingkan dengan kultur 72 jam. Kultur 48 jam memiliki aktivitas total 134.21 U sedangkan aktivitas total kultur 72
jam yaitu 103.72 U. Aktivitas total
menunjukkan jumlah total unit enzim yang terdapat dalam suatu fraksi (Nelson & Cox 2008). Hasil ini sama dengan hasil penelitian yang dilakukan oleh Khurshid et al. (2011) yaitu waktu fermentasi yang menghasilkan GOD paling maksimal adalah 48 jam. Produksi GOD selanjutnya dilakukan dengan waktu inkubasi kultur selama 48 jam sebagai waktu inkubasi optimum.
Prinsip pengujian enzim GOD berdasarkan oksidasi β-D-glukosa oleh GOD dengan bantuan oksigen menjadi β-D-glukono-δ-lakton dan hidrogen peroksida. Hidrogen peroksida yang terbentuk digunakan untuk mengoksidasi substrat kromogen pada reaksi kedua dengan hidrogen peroksidase (HRP) menghasilkan perubahan warna. Perubahan warnanya diamati secara spektrofotometri (Sukhacheva et al. 2004). Pada penelitian ini menggunakan o-dianisidin sebagai substrat kromogen. Perubahan warna yang terjadi diukur pada panjang gelombang 436 nm. Larutan glukosa yang digunakan didiamkan terlebih dahulu selama 1 jam agar terjadi mutarotasi menjadi β-D-glukosa (Bergmeyer 1988 dalam Simpson 2005).
Tabel 2 Aktivitas GOD berdasarkan waktu produksi Waktu produksi (Jam) Aktivitas (U/mL) [Protein] (mg/mL) Volume (mL) Aktivitas total (U) Protein total (mg) Aktivitas spesifik (U/mg) 48 2.91 0.94 46.20 134.21 43.43 3.09 72 2.13 1.86 48.80 103.70 90.77 1.14
Gambar 3 Penentuan kecepatan awal reaksi (vo) fraksi 48 jam.
Sumber karbon yang digunakan dalam media produksi berupa sukrosa dan glukosa. Sukrosa yang digunakan untuk media lebih banyak dibandingkan glukosa. Hal ini dikarenakan menurut Bankar et al. (2009) sukrosa merupakan substrat yang dapat memproduksi glukosa oksidase dengan lebih optimal. Konsentrasi glukosa yang tinggi mengakibatkan penurunan massa miselia, pH kultur, dan konsentrasi glukosa oksidase (Simpson 2005). Rogalski et al. (1988) dalam
Simpson (2005) menyatakan bahwa
konsentrasi glukosa optimal untuk produksi GOD pada A. niger mutant G-13 yaitu 8% sedangkan konsentrasi yang digunakan dalam penelitian ini yaitu 0.35%. Berdasarkan
penelitian Sabir et al. (2007) yang
menggunakan berbagai macam sumber karbon dalam produksi enzim GOD dari Penicillium notatum didapat bahwa penggunaan sukrosa dalam media menunjukkan aktivitas GOD yang dihasilkan paling tinggi dibandingkan penggunaan maltosa, glukosa, fruktosa, dan pati.
Media yang digunakan pada penelitian ini memiliki konsentrasi CaCO3 4% dan pH 5.5. Konsentrasi CaCO3 optimum untuk produksi GOD menurut Hatzinikolaou et al. (1996) adalah 4%. Hatzinikolaou dan Macris (1995) dalam Simpson (2005) melaporkan bahwa
CaCO3 merupakan penginduksi yang kuat
dalam pembentukan GOD pada A. niger. Berdasarkan penelitian Hatzinikolaou et al.
(1996) didapat bahwa aktivitas enzim
glukosa-6-fosfat isomerase sebagai enzim glikolisis lebih tinggi pada media tanpa CaCO3 sedangkan aktivitas GOD dan katalase
cukup rendah. Penambahan CaCO3
mengakibatkan peningkatan aktivitas GOD dan katalase seiring dengan penurunan
aktivitas glukosa-6-fosfat isomerase.
Berdasarkan hasil tersebut diketahui bahwa adanya CaCO3 mengubah jalur metabolik A.
niger dari glikolisis menjadi jalur pentosa fosfat, yang dapat meningkatkan jumlah
glukosa oksidase (Simpson 2005).
Berdasarkan penelitian Khurshid et al. (2011), pH optimum untuk produksi GOD pada A. niger adalah 5.5. Produksi glukosa oksidase selama fermentasi dapat berlangsung pada pH minimal 4 (Simpson 2005).
Konsentrasi KH2PO4 dan MgSO4 yang digunakan dalam media produksi pada penelitian ini yaitu 0.02%. Khurshid et al. (2011) menyatakan bahwa aktivitas GOD maksimum terjadi pada konsentrasi KH2PO4
0.4% dan kemudian menurun pada
konsentrasi lebih dari itu. Selain itu
peningkatan konsentrasi MgSO4 mulai dari 0.01% mengakibatkan penurunan aktivitas
GOD sehingga penggunaan MgSO4 harus
seminimal mungkin. Yang et al. (1996) dan Hamid et al. (2003) juga menyatakan bahwa
penambahan Mg2+ pada media merupakan
inhibitor kuat pada produksi GOD. Fraksinasi Amonium Sulfat
Produksi enzim dilakukan pada 3 liter media dengan waktu fermentasi selama 48 jam. Ekstrak kasar enzim yang diperoleh lalu digunakan untuk tahap pemurnian dengan amonium sulfat. Tahap ini merupakan langkah awal pemurnian enzim yang berfungsi meningkatkan konsentrasi protein enzim,
mereduksi volume larutan enzim, dan
memisahkan protein target dari sebagian
kontaminan yang tidak diinginkan
(Yuningtyas 2008).
Protein pada ekstrak kasar enzim
diendapkan dengan fraksinasi amonium sulfat mulai dari kejenuhan 20% sampai 80% dengan interval 20%. Fraksinasi ini dilakukan untuk mengetahui kejenuhan amonium sulfat yang optimum untuk mengendapkan enzim GOD. Tabel 3 menunjukkan jumlah protein dan aktivitas yang dimiliki masing-masing fraksi hasil pengendapan. Jumlah protein total dan aktivitas spesifik meningkat seiring dengan meningkatnya tingkat kejenuhan amonium sulfat. Protein total terbanyak pada fraksinasi amonium sulfat terdapat pada fraksi dengan kejenuhan 80%, yaitu sebanyak 4.19 mg. Protein total dari fraksi 20% dan 40% sangat rendah. Protein yang terendapkan pada kedua fraksi ini hanya sedikit. Terjadi peningkatan aktivitas dan protein total yang cukup signifikan dari fraksi 40% ke fraksi 60% hingga fraksi 80%. Aktivitas spesifik tertinggi dimiliki oleh fraksi 80% sebesar 22.18 U/mg dengan yield 32.98% dan tingkat kemurnian naik hingga 6.92 kali. Peningkatan 0 0.5 1 1.5 2 0 60 120 180 240 300 360 A b so rb an λ436 Waktu (detik)
Tabel 3 Aktivitas GOD tiap fraksi hasil pemurnian
kemurnian yang cukup signifikan
menunjukkan bahwa tingkat kejenuhan 80%
amonium sulfat optimum untuk
mengendapkan protein GOD. Sherbeny et al. (2005) menyatakan hal yang sama, yaitu amonium sulfat dengan tingkat kejenuhan
80% optimum dalam meningkatkan
kemurnian GOD.
Perbedaan tingkat kejenuhan amonium sulfat berhubungan dengan jumlah asam amino hidrofilik dan hidrofobik yang terdapat pada permukaan protein enzim. Protein enzim yang memiliki lebih banyak asam amino hidrofilik membutuhkan konsentrasi garam yang lebih tinggi untuk mengendapkannya karena permukaan protein yang hidrofilik
berinteraksi kuat dengan air sehingga
diperlukan ion-ion dari garam dalam jumlah yang lebih banyak untuk mengganggu interaksi tersebut. Sebaliknya, jika protein enzim mengandung lebih banyak asam amino hidrofobik, jumlah amonium sulfat yang diperlukan lebih sedikit (Anwar 2006). Amonium sulfat ditambahkan sedikit demi sedikit sambil diaduk agar konsentrasi amonium sulfat dapat merata saat berinteraksi dengan enzim (Yuningtyas 2008). Aktivitas enzim dan konsentrasi protein tertinggi pada fraksi amonium sulfat 80% menunjukkan bahwa GOD yang dihasilkan memiliki sifat
hidrofilik yang cukup tinggi sehingga
diperlukan kejenuhan amonium sulfat yang cukup tinggi untuk membuatnya mengendap.
Asam amino pada GOD dari A. niger mengandung lebih banyak histidin, arginin, dan tirosin serta lebih sedikit lisin dan fenilalanin dibandingkan GOD dari P. Amagasakiense (Simpson 2005). Glukosa oksidase banyak mengandung asam amino serin, glisin, asam glutamat, asam aspartat, dan alanin (Sherbeny et al. 2005). Glisin dan alanin termasuk asam amino dengan gugus R yang bersifat hidrofobik. Tirosin termasuk dalam asam amino dengan gugus-R aromatik yang bersifat hidrofobik namun masih
mengandung gugus hidroksil yang hidrofilik. Serin, histidin, asam glutamat, asam aspartat, dan arginin merupakan asam amino yang bersifat polar atau hidrofilik (Nelson & Cox 2008).
Dialisis
Dialisis dilakukan terhadap fraksi 80% amonium sulfat yang memiliki peningkatan kemurnian paling tinggi. Selain itu, fraksi ini juga memiliki aktivitas total paling tinggi. Sebanyak 900 μL fraksi 80% didialisis selama 9 jam dengan penggantian bufer setiap 3 jam. Penggantian bufer ini dilakukan agar bufer yang digunakan tidak jenuh oleh amonium sulfat sehingga menghambat proses dialisis. Proses ini dilakukan hingga amonium sulfat tidak lagi ditemukan dalam bufer dialisis. Hal ini ditandai dengan tidak terbentuknya lagi endapan putih BaSO4 pada uji terhadap bufer
dialisis menggunakan larutan BaCl2.
Kecepatan dialisis bergantung pada beberapa faktor, yaitu membran, pelarut, sifat-sifat fisik, dan kesetimbangan membran Donnan (Bintang 2010).
Dialisis pada penelitian ini menggunakan membran selulosa dengan nilai cut off 12 kDa. Membran tersebut mampu menahan GOD agar tidak keluar selama proses dialisis. Hal ini dikarenakan GOD memiliki bobot molekul berkisar antara 130 - 175 kDa (Simpson 2005). Membran tersebut perlu dididihkan terlebih dahulu dalam larutan Na2CO3-EDTA untuk mencegah hilangnya aktivitas molekul-molekul yang didialisis akibat kontaminan-kontaminan yang ada pada membran (Bintang 2010). Hasil uji aktivitas pada Tabel 3
menunjukkan tidak adanya peningkatan
aktivitas spesifik setelah dilakukannya
dialisis. Aktivitas spesifik menurun sedikit dibandingkan aktivitas spesifik fraksi 80 % amonium sulfat, yaitu 21.25 U/mg. Selain itu tidak terjadi peningkatan kemurnian pada hasil dialisis dari fraksi 80%, tingkat kemurnian hasil dialisis yaitu 6.63 kali.
Fraksi Aktivitas (U/mL) [Protein] (mg/mL) Volume (mL) Aktivitas total (U) Protein total (mg) Aktivitas spesifik (U/mg) Yield (%) Kemurnian (kali) Kasar 2.82 0.88 100.00 281.50 88.00 3.21 100.00 1.00 A.s. 20% 0.91 0.25 1.00 0.91 0.25 3.71 0.32 1.16 A.s 40% 0.97 0.26 1.00 0.97 0.26 3.73 0.35 1.16 A.s. 60% 20.38 2.55 1.50 30.57 3.83 8.00 10.85 2.50 A.s 80% 61.91 2.79 1.50 92.87 4.19 22.18 32.98 6.92 Dialisis 46.13 2.17 1.50 69.20 3.26 21.25 24.57 6.63
Aktivitas total yang dihasilkan adalah 69.20 U dengan yield 24.57%, relatif terhadap enzim kasar.
Dialisis dilakukan untuk menghilangkan molekul-molekul berukuran kecil di dalam larutan enzim (Koolman & Roehm 2005). Molekul-molekul seperti ion-ion dan protein-protein yang tidak diinginkan yang berukuran lebih kecil dibandingkan molekul enzim dapat dipisahkan melalui tahap ini. Tahap ini penting untuk dilakukan setelah pengendapan amonium sulfat (Nelson &Cox 2008).
Kandungan garam yang tinggi dapat
mempengaruhi aktivitas enzim yang
terkandung di dalam fraksi (Pohl 1990). pH dan Suhu Optimum
Fraksi hasil dialisis diuji untuk mengetahui pH dan suhu optimum untuk berjalannya reaksi. Aktivitas enzim sangat bergantung pada pH karena adanya hubungan antara keadaan ionisasi dari asam amino pada enzim dengan sisi aktifnya. Gambar 4 menunjukkan pengaruh pH pada aktivitas spesifik GOD.
Terlihat bahwa pH optimum untuk
berlangsungnya reaksi yaitu pada pH 5.5. Terjadi penurunan aktivitas yang signifikan saat pH menjadi basa (pH>7) hingga kurang dari 70% aktivitas maksimum. Hal ini
menunjukkan bahwa pada pH basa
menyebabkan terjadinya perubahan ionisasi yang cukup besar pengaruhnya terhadap daya katalitik enzim. Kisaran pH optimum pada GOD A. niger, yaitu 3.5-6.5. GOD dari A. niger diketahui memiliki kisaran pH optimum yang lebih luas dibandingkan dengan GOD dari P. amagasakiense (Simpson 2005).
Perubahan pH dapat mengakibatkan
perubahan sisi aktif serta struktur enzim akibat adanya perubahan ionisasi pada asam amino penyusunnya. Saat pH optimum, struktur dan sisi aktif enzim berada pada
Gambar 4 Pengaruh pH pada aktivitas GOD.
keadaan yang paling sesuai untuk berikatan dengan substrat dan melakukan proses katalisis. Semakin jauh dari pH optimum maka struktur dan sisi aktif enzim semakin
tidak sesuai karena terjadi perubahan
pelipatan pada struktur enzim akibat
perubahan ionisasi pada asam aminonya. Sebuah studi kinetika pada nilai pH yang berbeda telah diketahui bahwa seiring dengan nilai pH media reaksi yang semakin besar maka akan selalu ada penurunan pada
aktivitas katalitik dari GOD. Hal ini
dihubungkan dengan protonasi histidin pada sisi aktif dalam molekul FAD. Histidin
terprotonasi mengakibatkan terjadinya
pengurangan penghalang kinetik untuk
transfer elektron pada oksigen. Pada pH
rendah glukosa oksidase menyediakan
lingkungan kemampuan polarisasi rendah yang polar dan kaku sehingga mengurangi pembatas intrinsik pada transfer muatan ke oksigen (Odebunmi dan Owalude 2007).
Enzim diketahui sensitif terhadap
perubahan suhu. Kebanyakan enzim
terdenaturasi pada kisaran suhu antara 40°C dan 70°C dan kehilangan aktivitasnya. Suhu yang digunakan yaitu 26oC, 37oC, 45oC, 55oC,
dan 65oC. Gambar 5 memperlihatkan
pengaruh suhu terhadap aktivitas spesifik GOD. Hasil tersebut memperlihatkan bahwa enzim GOD memiliki aktivitas maksimum pada kisaran 37-45 oC. Menurut Simpson (2005), GOD memiliki suhu optimum pada kisaran yang berbeda-beda bergantung pada mikroorganisme penghasilnya. Kisaran suhu optimum GOD dari A. niger (Sigma type VII), P. amagasakiense (ATCC 28686), dan P. canescens Tt42 berturut-turut adalah 40-60oC, 45-50oC, dan 25-30oC. Terjadi peningkatan aktivitas seiring dengan meningkatnya suhu mulai dari 26oC hingga suhu 45oC. Terjadi penurunan aktivitas secara perlahan setelah
Gambar 5 Pengaruh suhu pada aktivitas GOD. 0 10 20 30 40 50 60 70 80 90 100 5 5.5 6 6.5 7 7.5 8 A k tiv itas GOD (% m ak sim u m ) pH 0 10 20 30 40 50 60 70 80 90 100 26 37 45 55 65 A k tiv itas GOD (% m ak sim u m ) Suhu (oC)
suhu 45oC dan berlanjut hingga suhu 65oC dengan persen aktivitas maksimum sebesar 80%. Biasanya pada suhu kisaran 30oC laju inaktivasi enzim tidak signifikan dan aktivitas enzim meningkat seiring kenaikan suhu. Akan tetapi pada suhu tinggi melebihi 60-70oC untuk enzim mesofil, konsentrasi dari enzim aktif berkurang dan laju inaktivasi menjadi sangat cepat (Illanes 2008). Inaktivasi enzim
oleh suhu terjadi akibat kekuatan
intermolekuler yang menjadi lemah sehingga
mempengaruhi kestabilan struktur tiga
dimensi dari enzim yang menyebabkan pengurangan dari kemampuan katalitiknya. Inaktivasi dapat juga dikarenakan gangguan terhadap ikatan kovalen dan non-kovalen yang disusul dengan terjadinya agregasi dan pelipatan yang tidak semestinya (Bommarius & Broering 2005).
Konstanta Kinetika
Persamaan linier Lineweaver-Burk
digunakan untuk menentukan konstanta
kinetika GOD dari A. niger (IPBCC.08.610). Gambar 6 menunjukkan pengaruh konsentrasi glukosa terhadap aktivitas spesifik GOD. Berdasarkan hasil tersebut terlihat bahwa terjadi peningkatan aktivitas enzim seiring dengan peningkatan konsentrasi glukosa yang digunakan. Aktivitas enzim pada konsentrasi glukosa yang rendah meningkat secara linier terhadap konsentrasi. Akan tetapi pada konsentrasi glukosa melebihi 0.6 M, laju
peningkatan aktivitas enzim mengalami
penurunan secara progresif terhadap
konsentrasi. Mekanisme reaksi enzimatis secara umum ditunjukkan sebagai berikut:
Laju pembentukan kompleks enzim-substrat
(EA) lebih cepat dibandingkan reaksi
penguraiannya menjadi enzim bebas (E) dan produk (P) (Rogers & Gibon 2009). Pada saat konsentrasi substrat (A) rendah maka enzim akan banyak dalam kondisi bebas sehingga
dengan peningkatan substrat akan
menyebabkan kesetimbangan bergeser ke arah EA yang mengakibatkan terjadi peningkatan pembentukan EA. Saat semua enzim telah membentuk kompleks dengan substrat akibat konsentrasi substrat yang tinggi, penambahan substrat tidak lagi memberikan pengaruh pada peningkatan aktivitas enzim akibat terjadinya kondisi enzim yang jenuh oleh substrat (Nelson & Cox 2008).
Berdasarkan kurva hubungan antara
konsentrasi glukosa dan aktivitas enzim
tersebut dibuat persamaan linier Lineweaver-Burk (Gambar 7) untuk menentukan nilai Km dan vmaks. Enzim GOD yang dihasilkan dari fraksi dialisis memiliki nilai Km dan vmaks yang diperoleh berturut-turut adalah 46 mM dan 11 U/mg. Konsentrasi glukosa sebesar 46 mM merupakan jumlah glukosa yang dibutuhkan
untuk mencapai setengah kecepatan
maksimumnya. Nilai Km GOD dari A. niger (Sigma Type VIII) hasil fraksi pemurnian kromatografi kolom yaitu sebesar 30 mM (Kalisz et al. 1991). Nilai Km yang diperoleh masih relatif lebih tinggi. Semakin tinggi nilai Km maka semakin rendah afinitasnya terhadap substrat, dalam hal ini yaitu β-D-glukosa. Nilai vmaks yang diperoleh relatif masih sangat rendah dibandingkan nilai vmaks GOD dari A. niger (Sigma Type VIII), yaitu 458 U/mg (Kalisz et al. 1991). Semakin tinggi vmaks suatu enzim maka semakin tinggi kecepatan yang bisa dicapai oleh enzim tersebut.
Parameter lain yang digunakan untuk mempelajari kinetika dari suatu enzim adalah kcat atau bilangan putaran. Bilangan putaran enzim merupakan jumlah molekul substrat yang diubah menjadi produk per satuan waktu pada satu molekul enzim saat enzim tersebut jenuh oleh substrat (Nelson & Cox 2008). Bobot molekul enzim perlu diketahui untuk
menentukan bilangan putaran. Jika
diasumsikan bahwa enzim GOD yang
dihasilkan pada penelitian ini memiliki bobot molekul yang sama dengan enzim GOD yang dihasilkan oleh A. niger (Sigma Type VII) yaitu 157 kDa (Kalisz et al. 1991), maka nilai kcat enzim GOD fraksi hasil dialisis ini diperkirakan sekitar 29 s-1. Nilai ini masih sangat rendah dibandingkan kcat GOD fraksi kromatografi kolom dari A. niger (Sigma Type VII), yaitu 920 s-1 (Kalisz et al. 1991). Semakin besar nilai kcat maka semakin cepat proses katalisis terjadi (Rogers & Gibon
Gambar 6 Pengaruh konsentrasi substrat terhadap aktivitas spesifik enzim. 0.00 1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 0 0.02 0.04 0.06 0.08 0.1 A k t. sp esif ik (U/m g ) [Glukosa] (M)
Gambar 7 Kurva Lineweaver - Burk. 2009). Efisiensi fraksi enzim yang dihasilkan masih sangat kecil yaitu 0.63 s-1 mM-1 jika dibandingkan dengan efisiensi GOD fraksi kromatografi kolom dari A. niger (Sigma Type VII) yaitu 31 s-1 mM-1. Hal ini dikarenakan GOD yang dihasilkan pada penelitian ini belum murni karena hanya melalui tahap pemurnian sampai dialisis sehingga perlu dilakukan pemurnian lebih lanjut untuk meningkatkan bilangan putaran tersebut, seperti pemurnian dengan menggunakan kromatografi kolom. Semakin murni enzim tersebut maka aktivitas spesifiknya semakin tinggi sehingga vmaks semakin tinggi yang berdampak pada semakin tinggi pula kcat. Efisiensi enzim merupakan perbandingan dari kcat/Km dan dapat diartikan sebagai nilai dari spesifisitas substrat. Saat kcat lebih besar dari k-1, proses katalisis berlangsung dengan sangat cepat dan efisiensi enzim bergantung pada kemampuannya untuk mengikat substrat (Rogers & Gibon 2009). Semakin tinggi efisiensinya maka enzim tersebut semakin
tinggi spesifisitasnya terhadap substrat
tersebut.
SIMPULAN DAN SARAN
SimpulanEnzim GOD dari A. niger (IPBCC.08.610) dihasilkan secara optimal pada waktu inkubasi selama 48 jam dengan aktivitas spesifik sebesar 3.21 U/mg. Enzim terendapkan dengan baik pada pengendapan 80% amonium sulfat dengan aktivitas spesifik sebesar 22.18 U/mg dan kemurnian 6.92 kali. Proses dialisis tidak menambah kemurnian dari fraksi. Nilai Km dan vmaks yang diperoleh berturut-turut adalah 46 mM dan 11 U/mg. Suhu dan pH optimum untuk berlangsungnya reaksi GOD adalah antara 37 - 45oC dan pH 5.5.
Saran
Optimasi terhadap media produksi perlu dilakukan untuk mendapatkan enzim GOD dengan aktivitas yang lebih tinggi. Pemurnian enzim lebih lanjut belum dilakukan, seperti
pemurnian dengan menggunakan
kromatografi kolom. Bobot molekul enzim perlu diketahui. Pengukuran aktivitas perlu dilakukan pada suhu konstan yang diketahui secara pasti agar dapat berlangsung pada kondisi yang sama pada saat pengukuran.
DAFTAR PUSTAKA
Ahmad A, Syaiful A, Firman Ap, Patong AR.
2007. Imobilisasi enzim glukosa
oksidasi dari Penicillium sp-3 galur lokal. Indo. J. Chem. 7: 97 - 104. Anwar YAS. 2006. Produksi dan karakterisasi
enzim tanin asil hidrolase dari
Aspergillus niger. [tesis]. Bogor: Sekolah Pascasarjana, IPB.
Avasthi S, Gautam AK, Bhadauria R. 2010. Antifungal activity of some commonly used spices against A. niger: A potential application in the control of spoilage fungus. Biol. Forum Int. J. 2: 53-55.
Bankar SB, Bule MV, Singhal RS,
Ananthanarayan L. 2009. Optimization of Aspergillus niger fermentation for the production of glucose oxidase. Food Bioprocess Technol 2: 344 - 352. Barton SC, Gallaway J, Atanassov P. 2004.
Enzymatic biofuel cells for implantable and microscale devices. Chem. Rev 104: 4867 - 4886.
Bergmeyer HU. 1988. Methods of Enzymatic Analysis. 3rd Ed. Vol. II: Samples, Reagents, Assessment of results. Bhatti HN, Saleem N. 2009. Characterization
of glucose oxidase from Penicillium notatum. Food Technol. Biotechnol 47: 331 - 335.
Bintang M. 2010. Biokimia – Teknik Penelitian. Jakarta: Erlangga.
Bommarius AS, Broering JM. 2005.
Established and novel tools to
investigate biocatalyst stability.
Biocatal Biotransform 23: 125–139. y = 0.0044x + 0.0956 R² = 0.9982 -0.20 0.00 0.20 0.40 0.60 0.80 -40.00 0.00 40.00 80.00 120.00 160.00 1 /A k t. sp esif ik (m g /U ) 1/[Glukosa] (M-1)
Chaplin M. 2004. Concentration by precipitation. London South Bank
University. [terhubung berkala].
http://www. lsbu. ac. uk/ biology/
enztech/ concentration. html. [29
Desember 2011].
Fiedurek J, Rogalski J, Lklezuk Z., Leonwicz A. 1986. Screening and mutagenesis of moulds for improvement of glucose oxidase production. Enzyme Microb. Tech. 8: 734 – 736.
Firman P, Aryantha INP. 2003. Eksplorasi dan isolasi enzim glukosa oksidase dari fungi inperfekti (genus Penicillium dan Aspergillus) indigenus. Pertemuan Ilmiah Tahunan (PIT) Perhimpunan Mikrobiologi Indonesia; Bandung, 29 - 30 Agustus 2003.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta: Yayasan Obor Indonesia.
Gautam AK, Sharma S, Avasthi S, Bhadauria R. 2011. Diversity, pathogenicity and toxicology of A. niger: An important spoilage fungi. Res. J. Microbiol 6: 270 - 280.
Hamid M, khalil-ur-Rehman, Zia MA, Asghar M. 2003. Optimization of various parameters for the production of glucose oxidase from rice polishing using Aspergillus niger. Asian network Sci. Infor. Biotechnol. 2 : 1 - 7.
Hatzinikolaou DG, Macris BJ. 1995. Factors
regulating production of glucose
oxidase by Aspergillus niger. Enzyme. Microb. Technol. 17:530-534.
Hatzinikolaou et al. 1996. A new glucose
oxidase from Aspergillus niger
characterization and regulation studies of enzyme and gene. Appl Microbiol Biotechnol. 46:371-381.
Illanes A, editor. 2008. Enzime Biocatalysis. de Valpara´ıso: Springer Science, Business Media B.V.
Kalisz HM, Hecht HJ, Schomburg D, Schmid RD. 1991. Effects of carbohydrate depletion on the structure, stability, and activity of glucose oxidase from Aspergillus niger. Biochem. Biophys. Acta 1080: 138-142.
Khan MR, Anwer MA, Mohiddin FA. 2007. Molecular diversity in Aspergillus isolates collected from pigeon pea field in Aligarch region. Environ. Bio. Conser. 12: 59-64.
Khurshid S. 2008. Microbial production of glucose oxidase and its commercial applications. [thesis]. Pakistan: GC University Lahore.
Khurshid S, Kashmiri MA, Quershi Z, Ahmad W. 2011. Optimization of glucose oxidase production by Aspergillus niger. African Journal of Biotechnology 10: 1674- 1 678. Kim J, Jia H, Wang P. 2006. Challenges in
biocatalysis for enzyme-based biofuel cells. Biotechnology Advances 24: 296 - 308.
Koolman J, Roehm KH. 2005. Color Atlas of Biochemistry. New York: Thieme Stuttgart.
Lee JY, Shin HY, Kang SW, Park C, Kim SW. 2011. Application of an
enzyme-based biofuel cell containing a
bioelectrode modified with
deoxyribonucleic acid-wrapped single-walled carbon nanotubes to serum. Enzyme and Microbial Technology 48: 80 - 84.
Lescovac V, Trivic S, Wohlfahrt G, Kandrac J, Pericin D. 2005. Glucose oxidase
from Aspergillus niger: the
mechanism of action with molecular oxygen, quinones, and one-electron acceptors [abstrak]. The International Journal of Biochemistry & Cell Biology 37: 731-750.
Lowry OH, Roserbrough NJ, farr AL, Randall RJ. 1951. Protein measurement with the folin phenol reagent. J. Biol. Chem: 265 - 275.
Magnoli C, Violante M, Combina M, Palacio G, Dalcero A. 2003. Mycoflora and ochratoxin: A producing strains of Aspergillus section Nigri in wine grapes in Argentina. Lett. Applied Microbiol. 37:179-184.
Metzler DE. 2003. Biochemistry – The Chemical Reactions of Living Cells.