TINJAUAN PUSTAKA
Klasifikasi, Botani, Daerah Asal dan Penyebaran Manggis
Dalam sistematika tumbuhan tanaman manggis diklasifikasikan kedalam Domain: Eukaryota, Kingdom: Plantae, Subkingdom: Viridaeplantae, Phylum: Tracheophyta, Subphylum: Euphyllophytina, Kelas: Magnoliopsida, Subkelas: Dilleniidae, Superordo: Theanae Ordo: Hypericales, Famili: Clusiaceae, Subfamili: Clusioideae, Tribe: Garcinieae, Genus: Garcinia, Spesies: Garcinia mangostana L. (ZippcodeZoo.com 2009). Genus Garcinia memiliki sekitar 800 species (Osman & Milan 2006). Data Herbarium Bogoriense mencatat terdapat 100 jenis Garcinia di Indonesia (Sari 1996). Whitmore (1973) mencatat lebih kurang terdapat 39 spesies Garcinia dan diantaranya hanya beberapa yang diketahui dan digunakan untuk keperluan medis di Thailand, diantaranya G. atroviridis Griff, G. speciosa Wall., G. cowa Roxb. dan G. dulcis
Manggis berasal dari Indonesia dan kawasan Asia Tenggara (Almeyda & Martin 1976), India Timur, dan Asia Tenggara (Campbell 1966), dan Peninsular Malaysia (Verheij 1991; ICUC 2003). Morton (1987) menyatakan bahwa manggis dipercaya berasal dari Kepulauan Sunda dan Maluku walaupun terdapat bukti yang menyatakan berasal dari Semenanjung Malaya (Verheij 1991). Sebagian besar produksi komersial manggis berada di Indonesia, Papua New Guinea, Philippina, Malaysia, Thailand, Burma (Myanmar), Vietnam, dan Cambodia. Sejak dua abad yang lalu, tanaman ini telah menyebar sampai ke Madagaskar, Sri Lanka, India, Honduras, Brazil, dan Australia. Saat ini, manggis dapat dijumpai di pekarangan dan kebun pada beberapa negara dengan iklim hangat dan bebas salju (ICUC 2003). Di Australia sekitar 50 hektar manggis telah ditanam di Queensland Utara (Downtown & Chacko 1998).
Manggis membutuhkan iklimnya spesifik dengan temperatur dan kelembaban tinggi sehingga daerah penyebarannya terbatas disekitar khatulistiwa yaitu antara 10° Lintang Utara dan 10° Lintang Selatan (Verheij 1991). Manggis berhasil diintroduksi dan dibudidayakan sampai 18° dari khatulistiwa pada daerah
bebas salju di Honduras, Madagaskar dan Australia Utara. Di India manggis ditanam pada daerah dataran tinggi (Osman & Milan 2006).
Manggis tumbuh subur pada daerah dengan temperatur antara 25-35°C dan RH diatas 80%. Daerah dengan suhu 20-25°C juga cukup sesuai untuk budidaya manggis. Naungan sangat penting selama 2-4 tahun pertama baik dipembibitan maupun selama awal penanaman di lapang. Tanah terbaik untuk budidaya manggis adalah porous, dalam, lembab dengan irigasi yang baik, sedikit masam, dan kaya bahan organik (Campbell 1967; Almeyda & Martin 1978). Curah hujan diatas 1270 mm/tahun sangat baik untuk pertumbuhan tanaman (Yaacob & Tindall 1995).
Di Indonesia manggis tumbuh dalam kawasan geografi yang luas meliputi hampir semua kepulauan. Tanaman ini dapat tumbuh sampai mendekati ketinggian 1.000 meter dari permukaan laut dengan lingkungan tumbuh yang bervariasi mulai dari lahan kering sampai lahan rawa pasang surut (Mansyah et al. 2005). Daerah dengan luas panen tertinggi adalah Jawa Barat (1.471 ha), disusul oleh Sumatera Barat (1.420 ha), Jawa Timur (752 ha), Bengkulu (728 ha), Banten (706 ha), Sumatera Utara (669 ha), Riau (512 ha), Sulawesi Selatan (449 ha) serta daerah lainnya dengan luas panen yang lebih kecil (BPS 2009).
Manggis mempunyai nilai gizi yang cukup baik. Dalam 100 g daging buah terkandung 79.2 g air, 0.5 g protein, 19.8 g karbohidrat, 0.63 g asam sitrat, 0.3 g serat, 11.0 mg kalsium, 17.0 mg fosfor, 0.9 mg zat besi, 14.0 IU vitamin A, 0.09 mg vitamin B (thiamin), 0.06 mg vitamin B2, 0.1 mg vitamin B5, dan 66 mg vitamin C (Ming 1990 dalam Yaacob & Tindall 1995).
Pohon manggis terlihat selalu hijau dengan kanopi berbentuk piramid dengan tinggi antara 8-10 meter. Daunnya berhadapan, tebal dan bergetah. Buah berbentuk bulat dengan diameter 3.5-7 cm berat 75-150 g, kulit buah tebal (6-8 mm), berwarna hijau pucat ketika masih muda dan merah keunguan ketika matang penuh. Didalam buah terdapat 4-8 segmen buah berwarna putih. Buah bisa tidak berbiji atau 1-5 biji perbuah dan dapat mennghasilkan lebih dari satu tanaman per biji (poliembrioni) (ICUC 2003).
Studi tentang biologi bunga manggis oleh Horn (1940) dan Krishnamurthi dan Rao (1964) melaporkan bahwa tidak dijumpai adanya tepung sari, baik pada
stadia awal pembentukan bunga maupun setelah bunga membuka. Pengamatan benang sari secara mikroskopik telah dilakukan oleh Lim (1984) yang melaporkan bahwa anthesis terjadi antara pukul 4 sampai 6 pagi dan setelah 24 jam petal terlepas dan sepal tetap ada sampai buah matang. Pada anther muda, sel induk tepung sari terbentuk dengan baik. Setelah terjadi pembelahan meiosis juga terjadi proses degenerasi inti dan sitoplasma yang menyebabkan sebagian besar di antaranya berdegenerasi. Pada berbagai fase meiosis terjadi proses degenerasi hingga hanya sedikit terbentuk tetrad dan sel tunggal normal yang akhirnya mati. Yaacob & Tindall (1995) melaporkan bahwa manggis mempunyai bunga dengan serbuk sari yang steril.
Manggis termasuk jenis buah yang lambat perkembangannya di antara buah-buahan tropika lainnya, sehingga ketersediaannya di pasaran untuk konsumen di luar Asia Tenggara sangat terbatas. Hal ini disebabkan oleh beberapa masalah, antara lain pertumbuhan bibit yang sangat lambat, masa juvenil yang panjang, sedikitnya ketersediaan materi tanaman, serta membutuhkan tenaga kerja intensif dalam pemanenan (Chong 1992).
Metode Reproduksi Manggis
Tanaman manggis mempunyai mekanisme reproduksi secara apomiksis (Wester 1926; Horn 1940; Cox 1976; Verheij 1991). Beberapa penulis juga menyebutkan sebagai partenokarpi (Corner 1952; Whitmore 1972). Richards (1990a) menyatakan bahwa sebagian besar genus Garcinia adalah agamospermy fakultatif. Tanaman jantan dijumpai pada semua spesies kecuali G. schortechinii King dan G. mangostana. Manggis merupakan agamospermy obligat dengan reproduksi melalui sel adventif dari jaringan ovular. Reproduksi aseksual yang demikoan mengakibatkan keseragaman buah manggis di manapun ditanam dan kelihatannya hanya satu varietas (Horn 1940).
Apomiksis digunakan sebagai istilah umum untuk reproduksi aseksual pada tanaman, termasuk perbanyakan vegetatif. Untuk pemulia apomiksis hanya meliputi reproduksi aseksual melalui biji. Lebih spesifik lagi Asker & Jerling (1992) mendefinisikan apomiksis sebagai proses reproduksi aseksual yang terjadi
pada ovul tanaman berbunga. Pada apomiksis, sel dengan jumlah kromosom unreduksi yang berasal dari sel somatik atau sel germinal dalam ovul berkembang menjadi embrio tanpa penggabungan inti telur dan sperma (Ramulu et al. 1995). Beberapa penulis menyebutkan sebagai agamospermy (‘seeds without sex’) (Rhichards 1990a; Ramachandran & Raghavan 1992).
Apomixis merupakan kejadian yang umum pada tanaman. Sekitar 60% tanaman mengalami mekanisme ini namun sering diabaikan oleh ahli teori reproduktif (Rhichards 2003). Kejadian apomiksis merupakan proses pembentukan populasi yang seragam secara genetik dan merupakan pola unik dari spesiasi tanaman. Lebih kurang 400 taksa dari 35 famili tanaman berbunga tercatat sebagai apomiktik. Sebagian besar diantaranya adalah spesies pohon pohonan tropika seperti jeruk, mangga, dan rumputan tropik seperti Brachiaria dan Paspalum (Carman 2001).
Apomiksis telah diduga terjadi pada manggis sejak lama dan diyakini sebagai apomiksis obligat karena hanya dijumpai sebagai tanaman betina dan dapat menghasilkan biji fertil (Richards 1997). Dengan demikian, semua pohon manggis secara praktis termasuk varietas klonal karena karakter apomiktiknya. Beberapa peneliti lain memperkuat bahwa mekanisme reproduksi apomiksis pada manggis termasuk ke dalam embryony adventitious (Lim 1984; Richards 1990b; Asker & Jerling 1992). Spesies dengan embyony adventitious biasanya mempunyai meiosis yang teratur. Hal ini berdasarkan fakta bahwa sebagian besar di antaranya merupakan pseudogamous dan membutuhkan serbuk sari fungsional untuk fertilisasi dan pembentukan biji. Pada beberapa spesies mempunyai pembentukan endosperm secara autonomous seperti pada Alchornea ilicifolia dan Euphorbia dulcis, di mana serbuk sari tidak berfungsi dan meiosis jantan terganggu (Asker & Jerling 1992).
Informasi lain menyebutkan bahwa manggis adalah partenokarpi dengan tabung sari yang berkembang dalam waktu singkat pada stigma tetapi tidak mencapai ovul (Corner 1952; Whitmore 1972). Lim (1984) menyatakan bahwa manggis mempunyai perkembangan embryo sac (kantong embrio), dan hal ini memungkinkan terjadinya partenogenetik. Richards (1997) menambahkan bahwa haploid partenogenesis juga dijumpai pada manggis, dan mekanisme ini mungkin dapat terjadi pada spesies dengan apomiksis sporofitik.
Apomiksis merupakan proses yang secara random distimulasi oleh lingkungan dan faktor nutrisi. Analisis keturunan pada persilangan antara apomiksis dengan bentuk seksual menunjukkan bahwa kemampuan untuk reproduksi apomiksis ditentukan secara genetik. Sebagai contoh perkembangan embrio nuselar pada jeruk dikontrol oleh lokus dominan tunggal (Parlevliet & Cameron, 1959 dalam Koltunow 1993).
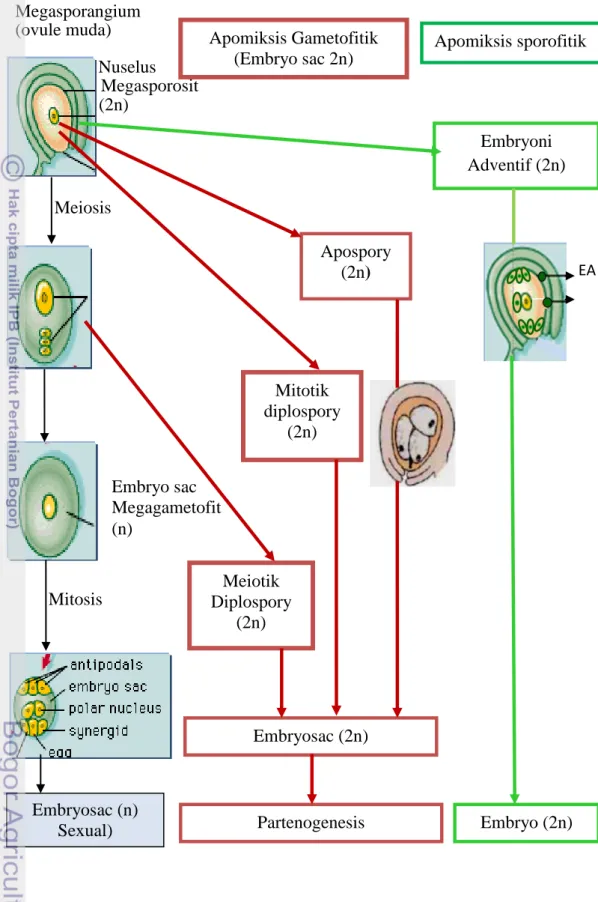
Apomiksis dikendalikan oleh sedikit gen tetapi pengaruhnya sangat besar yaitu memerintahkan sel nuselar somatik untuk membentuk kantong embrio (embryo sac) tanpa meiosis, menjadi embrio dan endosperm tanpa fertilisasi. Perbedaan penting apomiksis dari reproduksi seksual adalah bahwa embrio apomiktik berasal semata-mata dari sel jaringan ovul maternal tanpa fusi gamet jantan dan betina. Biji fertil yang dihasilkan dari reproduksi apomiktik apabila tidak mengalami mutasi mengandung embrio yang mempunyai konstitusi genetik yang sama dengan tetua betina. Pada reproduksi seksual gen apomiksis tidak ada atau tidak berekspresi (Koltunow 1993). Perbedaan mekanisme apomiksis dan seksual pada angiosperm dijelaskan melalui Gambar 2.
Gambar 2 membedakan mekanisme reproduksi apomiksis atas diplospory, apospory, dan adventitious embriony. Diplospory adalah pembentukan kantong embrio unreduksi dari sel induk megaspora (megaspore mother cell) melalui pencegahan meiosis; sel telur berkembang secara partenogenetik menjadi embrio, atau sel lain dari kantong embrio dipecah dan berkembang menjadi embrio (apogamety). Apospory adalah mekanisme di mana kantong embrio unreduksi muncul dari sel somatik pada nuselus atau integumen di samping sel induk kantong embrio (embryo sac mother cell) dalam ovul. Pada apomik diplosporous dan aposporous obligat, baik meiosis maupun fertilisasi tidak terjadi untuk menjamin berfungsinya apomiksis. Diplospory dapat dibedakan lagi atas diplospory meiotik dan mitotik. Pada diplospory meiotik sel induk megaspora berdifferensiasi dari nuselus dan memulai meiosis, tetapi kemudian meiosis dihambat oleh mekanisme yang belum diketahui dan nukleus dikembalikan ke dalam bentuk yang memungkinkan terjadinya mitosis. Pada mitotik diplospory yang umum terjadi adalah sel induk megaspora dihambat untuk mengalami meiosis (Asker & Jerling 1992; den Nijs & van Dijk 1993).
Megasporangium (ovule muda) Nuselus Megasporosit (2n) Mitosis Embryo sac Megagametofit (n) EA
Gambar 2 Mekanisme berbagai tipe apomiksis (Dimodifikasi dari Carneiro et al. 2006, Koltunow dan Grossniklaus 2003) . EA =Embrio Adventif. Meiosis Apospory (2n) Mitotik diplospory (2n) Embryosac (2n) Meiotik Diplospory (2n) Embryoni Adventif (2n) Embryo (2n)
(2n)
Apomiksis Gametofitik(Embryo sac 2n) Apomiksis sporofitik
Embryosac (n)
Apomiksis juga termasuk pembentukan embrio dari sel telur yang tidak dibuahi (haploid partenogenesis), atau sel lain dari gametofit (haploid apogamy), tetapi sebagai hasil sporofit haploid biasanya steril dan proses tersebut tidak dapat berulang dari satu generasi ke generasi berikutnya yang disebut sebagai non-recurrent apomixis. Pada recurrent apomixis inti kantong embrio biasanya diploid. Dapat juga dihasilkan diploid partenogenesis (dari ovum diploid) atau diploid apogamy (dari beberapa sel diploid gametofit) (Wardlaw 1955).
Gametofitik apomiksis dan embryo adventif terjadi baik pada spesies herbaceous dan spesies tanaman berkayu. Penelitian secara embriologi masih sedikit diantaranya telah dilakukan oleh Lim (1984) pada G, mangostana dan Ha et al. (1988) pada G. malaccensis, G. forbesii King dan G. Scortechinii King. Pada Malus apomiksis dilaporkan merupakan karakter dominan (Sax 1959, dalam Asker & Jerling 1992).
Perbedaan antara apomiksis fakultatif dan obligat penting untuk pemuliaan. Apomiksis fakultatif (sebagian) adalah bentuk apomiksis dimana beberapa kejadian seksual juga dijumpai. Misalnya pada spesies jeruk, proses seksual dan apomiktik terjadi secara bersamaan dalam ovul yang sama (Koltunow 1993). Apomiksis fakultatif yang mempunyai tendensi seksualitas rendah termasuk apomiksis obligat (den Nijs & van Dijk 1993). Sebagian besar apomik adalah fakultatif dan hanya sedikit yang 100% obligat. Tingkat reproduksi seksual sering masih ada, sehingga terjadi beberapa penyimpangan (Asker & Jerling 1992).
Apomiksis dan Poliploidi
Asker & Jerling (1992) menyatakan bahwa asosiasi antara apomiksis, poliploid dan poliembrioni dijumpai pada beberapa spesies. Apomiksis umumnya adalah poliploid, dan teraploid merupakan tingkat yang umum dan sangat sedikit yang diploid secara alami. Manggis adalah tanaman poliploid dengan jumlah kromosom 2n = 96 (Tixier 1955). Rhichards (1990c) menyatakan bahwa morfologi manggis adalah intermediet antara dua kerabat dekatnya yaitu G. hombroniana ( 2n = 48) dan G. malaccensis (2n = 42) yang merupakan
agamospermy fakultatif. Studi sitologi menunjukkan bahwa manggis mungkin merupakan derivat allotetraploid dari ke dua spesies tersebut dengan. G. hombroniana sebagai tetua betina dan G. malaccensis sebagai tetua jantan.
Mackanzie (2005) menyatakan bahwa allotetraploid dapat terjadi melalui beberapa cara yaitu ‘one-step’ dan ‘two-step’ pathways. One-step pathway adalah pembentukan dari penggabungan dua gamet unreduksi spesies berbeda, dan two-step pathways melalui jembatan triploid atau dari penggandaan kromosom somatik secara spontan dari diploid interspesifik yang steril. Secara alami allopoliploidi lebih umum dari pada autopoliploidi. Kebanyakan poliploidi merupakan produk kejadian tunggal dan spesies tetuanya mempunyai variasi genetik. Spesies poliploid terjadi dari hibridisasi secara terpisah pada lokasi berbeda sehingga membentuk serangkaian populasi yang berbeda secara genetik. Gene flow kemudian mungkin terjadi antara populasi poliploidi berbeda dan menghasilkan variabilitas genetik yang dapat meningkat melalui penyusunan kromosom kembali. Terdapat bukti bahwa allopoliploid mengalami perubahan genomik yang ekstensif setelah pembentukannya (Soltis & Soltis 1999).
Percobaan pada allopoliploid Brassica menunjukkan bahwa perkembangan diversitas genetik dan fenotipik terjadi setelah beberapa generasi (Song et al. 1995). Selanjutnya spesiasi hibrid poliploid menghasilkan bentuk dinamis yang berevolusi (Mackanzie 2005). Poliploidi penting tidak hanya untuk spesiasi tanaman, tetapi dapat memperkaya pemahaman tentang proses evolusi. Beberapa observasi menunjukkan bukti sitogenetik bahwa poliploidi terjadi secara berulang pada skala waktu evolusi dan tersebar luas pada angiospermae serta kelompok tanaman lain. Bukti tambahan tentang frekuensi terjadinya spesiasi polyploid berasal dari studi distribusi jumlah kromosom (Otto & Whitton 2000). Hasil penelitian menunjukkan bahwa kebanyakan spesies poliploid muncul secara berulang, berlawananan dengan prinsip bahwa spesies secara biologi mempunyai keunikan monophyletic origin (Soltis & Soltis 1999).
Studi molekuler pada tetraploid Tragopogon miscellus dan Tragopogon mirus, menunjukkan bahwa penyebaran setiap spesies terjadi tidak melalui single origin tetapi melalui pengulangan. Kedua spesies mungkin terbentuk melalui allopoliploidi di Amerika Selatan sebelum abad ke 20 masing-masing sebanyak
20 dan 12 kali berturut-turut dalam 70 tahun. Spesies polyploid Draba dan Saxifraga juga merupakan multiple origin dari diploid progenitornya (Brochmann et al. 1998, dalam Mackanzie 2005). Hasil penelitian ini menunjukkan bahwa genom poliploidi tidak statis karena merupakan gabungan dari dua genom berbeda pada inti dan mungkin disertai dengan reorganisasi (Wendel 2000; Liu & Wendel 2002).
Poliploidi berasosiasi dengan tingginya tingkat variasi epigenetik, yang mempunyai efek pada fenotip dan berpotensi untuk seleksi. Contoh penting epigenetik adalah variasi waktu berbunga pada allopoliploid sintetik Brassica (Schranz & Osborn 2000, diacu dalam Wendel 2000). Satu dari beberapa kemungkinan akibat duplikasi genom setelah pembentukan poliploid adalah gene silencing. Proses ini terjadi pada permulaan pembentukan poliploidi dan meningkat sejalan waktu (Wendel 2000).
Penggabungan genom pada alloppoliploid juga berpotensi untuk menyebarkan transposable element antara dua genom. Transposable elements terdapat dimana mana pada pada genom tanaman (Bennetzen 2000), yang berkontribusi pada evolusi genom, diversitas genetik dan ekspresi gen. Sebagian besar transposable element tidak aktif pada kondisi normal tetapi aktif pada kondisi stress (Wessler 1996, dalam Mackanzie 2005). Mekanisme terjadinya perubahan meliputi transposisi, translokasi, amplifikasi, dan delesi. Variasi yang dihasilkan oleh aktifitas tranposable element kelihatannya tidak stabil. Stress lingkungan eksternal dapat menginduksi mekanisme perubahan genomik secara cepat. Jika perubahan terjadi dalam meristem dan ditransmisikan ke gamet, variasi genomik dapat terjadi dalam satu generasi dan dapat diwariskan kepada generasi berikut (Walbot & Cullis 1985).
Pengaruh penyisipan elemen tergantung pada lokasinya. Penyisipan pada non coding region seperti intron dari gen dapat menghalangi ekspresi gen normal, tetapi pengeluaran elemen dapat menyembunyikan fungsi gen normal. Penyisipan pada coding region dapat menyebabkan frameshift mutation. Tranposable element tidak hanya menciptakan dan memulai mutasi, tetapi merupakan fokus dalam melanjutkan instabilitas (Walbot & Cullis 1985).
Variasi Pada Tanaman Apomiksis
Keturunan bervariasi pada apomik obligat telah dilaporkan pada Taraxacum. Studi menggunakan isozim esterase pada lima agamospesies Taraxacum menunjukkan rata-rata variasi genetik sebesar 19%. Hal ini membuktikan bahwa variasi yang muncul melalui apomik terjadi pada kecepatan yang lebih besar dari pada mutasi. Variasi juga dijumpai pada dua dari tiga famili keturunan dengan rata-rata 22%. Genus Taraxacum meliputi 200 spesies dan 90% diantaranya adalah poliploid dan mengalami reproduksi secara aseksual melalui agamospermy obligat. Empat dari sepuluh agamospesies tersebut telah diidentifikasi tidak mempunyai serbuk sari (Hughes & Richards 1985; Ford & Richards 1985).
Diketahui bahwa genom tanaman berulangkali mengalami tantangan keberadaan dan integritas genetiknya dalam waktu yang panjang. Ketersediaan mekanisme genetik yang memungkinkan genom untuk membentuk variasi genetik baru yang lebih adaptif terhadap lingkungan atau perubahan iklim di mana ia berada akan dapat mengurangi bahaya kepunahan (Kindiger & Dewald 1996). Variasi somaklonal dapat terjadi sebagai hasil dari mutasi point, autosegregasi, ‘’somatic crossing over’’, amplifikasi atau kehilangan material DNA, penyusunan kromosom kembali, dan aktivitas perubahan gen oleh transposable element. Kasus sederhana dari autosegregasi adalah ketika sel saudara yang satu menerima terlalu banyak kromosom dan yang lain terlalu sedikit dalam pembelahan sel induk kantong embrio (Walbot & Cullis 1985).
Variasi genetik pada manggis ditunjukkan oleh perbedaan pola pita DNA melalui teknik RAPD pada 23 aksesi yang berasal dari Pulau Jawa dan Sumatera Barat. (Mansyah et al. 2003), antara tetua dan turunan (Mansyah et al. 2004, Mansyah et al. 2008; Sinaga et al. 2008). Ramage et al. (2004) juga melaporkan adanya diversitas genetik pada G. mangostana. Diantara 37 aksesi G. mangostana diidentifikasi sembilan genotipe berbeda yang terdiri dari tiga kluster berbeda.
Selain variasi genetik sejumlah peneliti telah melaporkan perbedaan morfologi pada manggis, diantaranya Wester (1926) menginformasikan bahwa manggis Jolo (Filipina) mempunyai buah yang lebih besar dan lebih masam daripada di Malaya dan Jawa. Burkill (1966) menyebutkan terdapat ras manggis
di Kepulauan Sulu dengan kulit buah yang tebal dan daging buah lebih masam. Cox (1976) merangkum beberapa laporan dan menyatakan bahwa manggis di Jawa mempunyai rasa superior dengan ukuran yang lebih besar daripada manggis di Filipina. Di Nicaragua terdapat tanaman dengan daun yang besar dengan ukuran buah yang bervariasi dan daun kecil dengan buah yang kecil.
Selanjutnya pengamatan pada individu manggis Sumatera Barat (Mansyah et al. 1992) menunjukkan variasi bentuk kanopi, ukuran daun, bobot buah, diameter buah, tebal kulit buah, dan jumlah buah per kluster. Melalui pengamatan yang intensif data keragaman morfologi ini terus berkembang sehingga dijumpai variasi morfologi yang lebih spesifik. Karakter morfologi tersebut diantaranya bentuk buah (ellip, agak bulat, bulat dan agak lonjong). Selain itu dijumpai perbedaan dalam bentuk cupat (bulat dan ellip), ukuran cupat (besar, sedang dan kecil), dan jumlah segmen buah (Mansyah et al. 2005). Sobir dan Poerwanto (2007) melaporkan adanya variasi warna sepal pada manggis Wanayasa Jawa Barat.
Analisis Morfologi dan Molekuler
Marka morfologi berdasarkan kepada pengamatan secara langsung karakter fenotipik tanaman. Marka ini telah banyak digunakan sebagai dasar studi genetik dan metode praktis untuk pemuliaan tanaman (Tanksley et al. 1983). Marka morfologi mudah untuk diamati, tetapi sangat dipengaruhi oleh lingkungan. Jumlahnya sangat terbatas dan beberapa diantaranya muncul diakhir pertumbuhan misalnya warna bunga. Hal ini membuat marka morfologi tidak memungkinkan untuk penilaian secara cepat. Selain itu suatu marka morfologi dapat mempengaruhi marka morfologi lain atau sifat yang menjadi target dalam program pemuliaan karena adanya pengaruh aksi gen pleiotropik (Poehlman & Sleper 1995).
Perkembangan biologi molekuler telah menghasilkan alternatif prosedur dasar analisis DNA untuk deteksi polimorfisme. Teknik berdasarkan polymerase chain reaction (PCR) atau reaksi polimorfisme berantai telah banyak digunakan untuk identifikasi kultivar, studi filogenetik, studi pedigri, pemetaan gen, dan
estimasi kecepatan outcrossing (Williams et al. 1990; Powell et al. 1996). Marka molekuler merupakan alat tambahan untuk deskripsi varietas, dan marka DNA mempunyai keuntungan karena tidak dipengaruhi oleh lingkungan serta memberikan informasi langsung dari genom setiap individu (Lefebvre et al. 2001). Castillo et al. (1994) menyatakan bahwa PCR sangat potensial untuk marka genetik tanaman yang berumur panjang.
Berbagai teknik analisis molekuler dapat digunakan seperti RAPD (Random
Amplified Polymorphysm DNA), AFLP (Amplified Fragment Length
Polymorphysm), RFLP (Restriction Fragment Length Polymorphysm), SSR
(Simple Sequence Repeat) dan ISSR (Inter Simple Sequence Repeat) yang
memiliki kelebihan dan kekurangan masing-masing. Metode-metode tersebut mendeteksi polimorfisme melalui variasi urutan DNA dalam genom (Powell et al 1996).
Teknik RAPD mempunyai beberapa keuntungan dibandingkan metode lain, di antaranya membutuhkan DNA yang lebih sedikit (10–25 ng), tidak membutuhkan informasi urutan primer, tidak bersifat radioaktif, serta pelaksanaanya relatif lebih mudah (Gupta et al. 1996; Powell et al. 1996). Walaupun demikian teknik RAPD juga mempunyai beberapa keterbatasan, antara lain tidak dapat membedakan individu homozigot dan heterozigot karena bersifat sebagai penanda dominan (Williams et al. 1990). Perubahan kecil dalam kondisi reaksi dengan nyata dapat merubah jumlah dan intensitas produk amplifikasi sehingga keterulangan sulit untuk dipertahankan. Dilaporkan juga kesulitan untuk memperoleh pita yang identik dari set primer dan material yang sama antar laboratorium yang berbeda. Tipe thermocycler yang digunakan kelihatanya merupakan kunci penentu reprodusibilitas pola pita (Hallden et al 1996).
Analisis RAPD telah banyak digunakan untuk determinasi spesies dan genus tanaman buah-buahan, di antaranya plum (Shimada et al. 1999), pisang (Pillay et al. 2001), Passiflora (Fajardo et al. 1998), dan anggur (Vidal et al. 1999). Hasil penelitian tersebut membagi tanaman plum ke dalam dua kelompok berdasarkan daerah asalnya yaitu Japanese Group dan European Group pada koefisien kemiripan 0.55. Anggur terbagi ke dalam dua kelompok geografi yang terdiri dari varietas berkerabat dekat. Penelitian pada 31 klon pisang di Afrika
Timur dan genus Passiflora, pemisahan kelompok terjadi masing-masing pada pada koefisien kemiripan 0.30 – 0.98 dan 0.64 –0.91.
Penggunaan analisis RAPD untuk studi variabilitas pada tanaman apomiksis telah dilakukan pada ubi kayu. Hasil penelitian tersebut menyimpulkan bahwa tanaman tersebut adalah apomiksis fakultatif dan terjadi pada frekuensi rendah (Nassar et al. 1998). Selain itu juga telah digunakan pada studi apomiktik
Hypericum perforatum dan memungkinkan untuk identifikasi perbedaan
individual (Pilepic et al. 2008). Marka ISSR sangat baik untuk membedakan antar
individu berkerabat dekat dan dapat diaplikasikan untuk studi variasi didalam populasi (Gonzales et al. 2005). Penggunaan ISSR pada studi populasi Monimopetalum chinense menunjukkan bahwa 110 pita ISSR berbeda dihasilkan menggunakan 10 primer.