ISOTERM ADSORPSI CARBON AKTIF
A. Tujuan
Menentukan isoterm adsorpsi menurut Freundlich bagi proses adsorpsi asam asetat pada arang.
B. Dasar Teori
Adsorbsi secara umum adalah proses penggumpalan subtansi terlarut (soluble) yang ada dalam larutan, oleh permukaan zat atau benda penyerap, dimana terjadi suatu ikatan kimia fisika antara subtansi dengan penyerapannya. Adsorbsi dapat dikelompokkan menjadi dua, yaitu ;
a. Adsorbsi fisik, yaitu berhubungan dengan gaya Van der Waals dan merupakan
suatu proses bolak – balik apabila daya tarik menarik antara zat terlarut dan adsorben lebih besar daya tarik menarik antara zat terlarut dengan pelarutnya maka zat yang terlarut akan diadsorbsi pada permukaan adsorben.
b. Adsorbsi kimia, yaitu reaksi yang terjadi antara zat padat dan zat terlarut yang
teradsorbsi.
Kekuatan interaksi adsorbat dengan adsorben dipengaruhi oleh sifat dari adsorbat maupun adsorbennya. Gejala yang umum dipakai untuk meramalkan komponen mana yang diadsorpsi lebih kuat adalah kepolaran adsorben dengan adsorbatnya. Apabila adsorbennya bersifat polar, maka komponen yang bersifat polar akan terikat lebih kuat dibandingkan dengan komponen yang kurang polar. Kekuatan interaksi juga dipengaruhi oleh sifat keras-lemahnya dari adsorbat maupun adsorben. Sifat keras untuk kation dihubungkan dengan istilah polarizing power cation, yaitu kemampuan suatu kation untuk mempolarisasi anion dalam suatu ikatan. Kation yang mempunyai polarizing power cation besar cenderung bersifat keras. Sifat polarizing power cation yang besar dimiliki oleh ion-ion logam dengan ukuran (jari-jari) kecil dan muatan yang besar. Sebaliknya sifat polarizing power cation yang rendah dimiliki oleh ion-ion logam dengan ukuran besar namun muatannya kecil, sehingga diklasifikasikan ion lemah.
Jumlah zat yang diadsorpsi pada permukaan adsorben merupakan proses berkesetimbangan, sebab laju peristiwa adsorpsi disertai dengan terjadinya desorpsi. Pada awal reaksi, peristiwa adsorpsi lebih dominan dibandingkan dengan peristiwa desorpsi, sehingga adsorpsi berlangsung cepat. Pada waktu tertentu peristiwa adsorpsi cendung berlangsung lambat, dan sebaliknya laju desorpsi cendrung meningkat. Waktu ketika laju adsorpsi adalah sama dengan laju desorpsi sering disebut sebagai keadaan berkesetimbangan.
Pada keadaan berkesetimbangan tidak teramati perubahan secara makroskopis. Waktu tercapainya keadaan setimbang pada proses adsorpsi adalah berbeda-beda, Hal ini dipengaruhi oleh jenis interaksi yang terjadi antara adsorben dengan adsorbat. Secara umum waktu tercapainya kesetimbangan adsorpsi melalui mekanisme fisika (fisisorpsi) lebih cepat dibandingkan dengan melalui mekanisme kimia atau kemisorpsi (Castellans 1982)
Suatu permukaan padatan yang bersentuhan dengan larutan akan menyebabkan molekul-molekul terlarut terserap/ adsorp pada permukaan padatan. Adsorbsi molekul digambarkan sebagai berikut :
A + B —> A.B Dimana :
A = adsorbant B = adsorbent
A.B = jumlah bahan yang terjerap
Energi yang dihasilkan seperti ikatan hidrogen dan gaya Van Der Waals menyebabkan bahan yang teradsorp berkumpul pada permukaan penserap. Bila reaksi dibalik, molekul yang terjerap akan terus berkumpul pada permukaan karbon aktif sehingga jumlah zat diruas kanan reaksi sama dengan jumlah zat pada ruas kiri. Apabila kesetimbangan telah tercapai, maka proses adsorpsi telah selesai. (Arifin, 2008)
Isoterm adsorpsi Langmuir didasarkan atas beberapa asumsi, yaitu (a) adsorpsi hanya terjadi pada lapisan tunggal (monolayer), (b) panas adsorpsi tidak tergantung pada penutupan permukaan, dan (c) semua situs dan permukaannya bersifat homogen (Oscik J 1994). Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dengan molekul molekul zat yang tidak teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut. C merupakan konsentrasi adsorbat dalam larutan, x/m adalah konsentrasi adsorbat yang terjerap per gram adsorben, k adalah konstanta yang berhubungan dengan afinitas adsorpsi dan (x/m)mak adalah kapasitas adsorpsi maksimum dari adsorben. Kurva isoterm adsorpsi Langmuir dapat disajikan seperti pada Gambar 1
Karbon aktif merupakan senyawa karbon amorph dan berpori yang mengandung 85-95% karbon yang dihasilkan dari bahan-bahan yang mengandung karbon (batubara, kulit kelapa, dan sebagainya) atau dari karbon yang diperlakukan dengan cara khusus baik aktivasi kimia maupun fisika untuk mendapatkan permukaan yang lebih luas. Karbon aktif dapat mengadsorpsi gas dan senyawa-senyawa kimia tertentu atau sifat adsorpsinya selektif, tergantung pada besar atau volume pori-pori dan luas permukaan. Daya serap karbon aktif sangat besar, yaitu 25- 1000% terhadap berat karbon aktif. Karena hal tersebut maka karbon aktif banyak digunakan oleh kalangan industri. Hampir 60% produksi karbon aktif di dunia ini dimanfaatkan oleh industri-industri gula dan pembersihan minyak dan lemak, kimia dan farmasi. ( M.T. Sembiring, dkk, 2003)
Dalam satu gram karbon aktif, pada umumnya memiliki luas permukaan seluas 500-1500 m2, sehingga sangat efektif dalam menangkap partikel-partikel yang sangat halus berukuran 0.01-0.0000001 mm. Karbon aktif bersifat sangat aktif dan akan menyerap apa saja yang kontak dengan karbon tersebut. Dalam waktu 60 jam biasanya karbon aktif tersebut manjadi jenuh dan tidak aktif lagi. Oleh karena itu biasanya karbon aktif di kemas dalam kemasan yang kedap udara. Sampai tahap tertentu beberapa jenis karbon aktif dapat di reaktivasi kembali, meskipun demikian tidak jarang yang disarankan untuk sekali pakai.
C. Alat dan Bahan Alat:
1. Cawan Porselin 1 buah
2. Labu Erlenmeyer bertutup 250 mL 12 buah 3. Labu Erlenmeyer 150 mL 6 buah
4. Pipet 10 mL 2 buah
5. Pipet 25 mL 4 buah
6. Buret 50 mL 1 buah
7. Corong 6 buah
Bahan:
1. Larutan asam asetat 0,5 N atau larutan HCl 0,5 N 2. Adsorben arang atau jenis karbon lainnya
3. Larutan Standar NaOh 0,1 N 4. Indikator Phenofphtalein
E. Data Percobaan
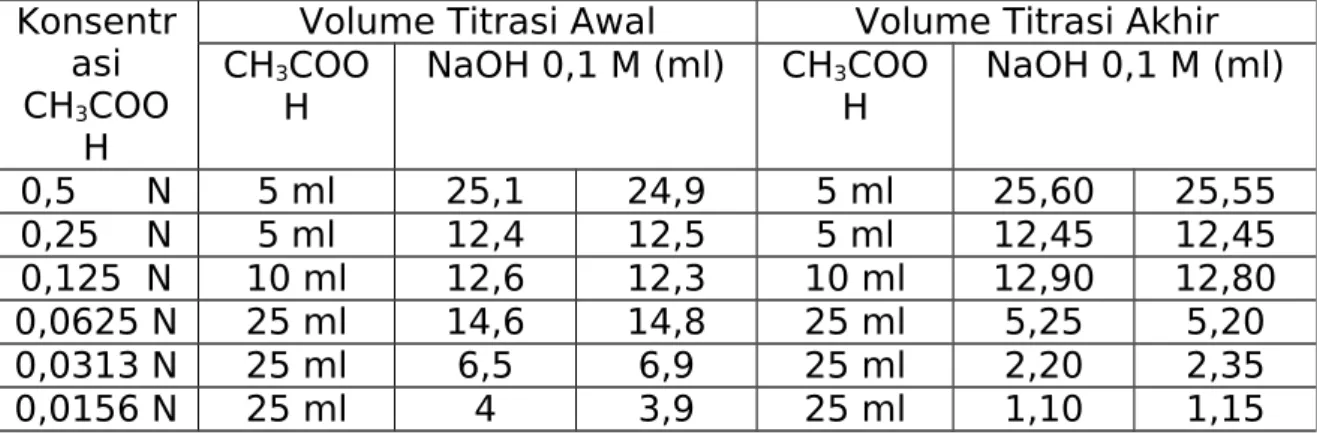
Dari percobaan yang telah dilakukan diperoleh data yang disajikan pada tabel 1. Suhu kamar : 280 C
F. Hasil Percobaan dan Pembahasan Tabel 2. Data Hasil Perhitungan
No . Massa (gra m) Konsentrasi CH3COOH (N) (gramX ) x/m
awal akhir C Log
x/m Log C 1. 1,00 4 0,5 0,485 0,015 0,09 0,089 -1,05 -1,823 2. 1,00 2 0,249 0,224 0,025 0,15 0,14 -0,85 -1,602 3. 1,00 3 0,1245 0,109 0,0155 0,099 0,052 -1,28 -1,809 4. 1,00 1 0,0588 0,0502 0,0086 0,0516 0,0516 -1,29 -2,065 5. 1,00 5 0,0268 0,0201 0,0066 0,0396 0,039 -1,40 -2,180 6. 1,00 2 0,0158 0,0124 0,0034 0,0204 0,020 -1,69 -2,46
Grafik 1. Log x/m Vs log C Konsentr
asi CH3COO
H
Volume Titrasi Awal Volume Titrasi Akhir CH3COO
H NaOH 0,1 M (ml) CH3HCOO NaOH 0,1 M (ml)
0,5 N 5 ml 25,1 24,9 5 ml 25,60 25,55 0,25 N 5 ml 12,4 12,5 5 ml 12,45 12,45 0,125 N 10 ml 12,6 12,3 10 ml 12,90 12,80 0,0625 N 25 ml 14,6 14,8 25 ml 5,25 5,20 0,0313 N 25 ml 6,5 6,9 25 ml 2,20 2,35 0,0156 N 25 ml 4 3,9 25 ml 1,10 1,15
Grafik 2. x/m VS C
Adsorbsi merupakan proses pengumpulan zat terlarut dipermukaan media dan merupakan jenis adhesi yang terjadi pada zat padat atau cair yang kontak dengan zat-zat lainnya. Contoh dari reaksi adsorpsi adalah karbon aktif arang digunakan untuk menghilangkan bau, warna dan rasa air termasuk logam-logam ion berat dalam pengolahan air minum.
Larutan asam asetat yang digunakan dalam praktikum ini memiliki beberapa variasi konsentrasi, yakni: (1) tidak mendapat perlakuan apa-apa dan (2) ditambah dengan arang aktif, ditutup rapat, dikocok, setiap jangka waktu 10 menit dalam 30 menit pertama, dan kemudian disaring. Selanjutnya, semua larutan tersebut dititrasi dengan larutan NaOH 0,1 N untuk mendapatkan konsentrasi awal (larutan asam asetat murni) dan konsentrasi akhir (larutan asam asetat + arang). Penentuan konsentrasi awal dak akhir larutan asam asetat disini menggunakan rumus pengenceran, yakni V1.M1=V2.M2
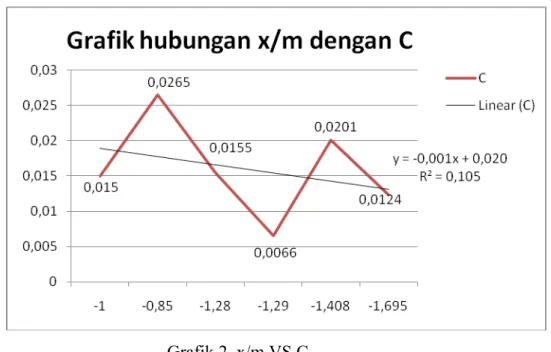
Konsentrasi awal dan akhir yang didapat berdasarkan hasil praktikum kemudian dikurangkan untuk mengetahui harga ΔC larutan asam asetat. Selain itu, data konsentrasi tersebut juga dapat digunakan untuk menghitung harga X (gram) dengan rumus X = massa x Mr x 100/1000. Akhirnya, berdasarkan analisis data yang telah dilakukan, dihasilkan 2 grafik yang berbentuk linier, yakni grafik C vs X/m dan grafik log X/m vs log C. Terbentuknya grafik linier dalam praktikum ini menunjukkan bahwa isotherm adsorbsi yang berlangsung disini memang benar merupakan isotherm adsorbsi Freundlich.
Berdasarkan persamaan grafik Isoterm Adsorpsi Freundlich (log x/m vs log c) jika dianalogikan dengan persamaan Freundlich maka akan didapat nilai k dan n. Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut:
Log (x/m) = log k + 1/n log c
sedangkan persamaan grafik Isotherm Adsorpsi Freundlich adalah y = -0,001x + 0,020
Jadi, didapat nilai Log k = +0,020 dan 1/n = -0,001. Maka nilai k adalah 0,1675 dan nilai n adalah 0,998.
Mengenai gambar grafik log x/m vs log C yang dihasilkan sudah sesuai dengan teori isotherm adsorpsi Freundlich yaitu grafik berupa garis linear sedangkan grafik C vs x/m juga sudah sesuai dengan teori isotherm adsobsi Langmuir yang grafiknya seperti setengah trapezium mengalami kenaikan dan selanjutnya terjadi kekonstanan.
G. Kesimpulan dan Saran Kesimpulan
1. Percobaan ini tergolong Isoterm Adsorpsi Freundlich. Oleh karena itu di dapat 2 kurva grafik hubungan log x/m dengan log C dan grafik hubungan x/m dengan C yang sesuai dengan teori adsorpsi Freundlich.
2. Persamaan isoterm adsorpsi Freundlich dalam percobaan ini dapat dituliskan y = -0,001x + 0,020. Dengan K = 6,0395 dan n = 0,998.
Saran
1. Praktikan hendaknya teliti dalam melakukan titrasi dan mengencerkan larutan. 2. Praktikan hendaknya teliti dalam menimbang massa zat.
3. Praktikan hendaknya menggunakan waktu seefisien mungkin.
H. Daftar Pustaka
Arifin Pajar. 2008. Adsorpsi Karbon Aktif. Diakses dari http://www.yahoo.co.id pada tanggal 19 September 2013.
Dwi, Vallentinus. 2009. Studi Adsorpsiion Cu (Ii) Dalam Larutan Tembaga Menggunakan Komposit Serbuk Cangkang Kupang-Khitosanterikatsilang. Surabaya: Skripsi FMIPA ITS.
Sembiring, dkk. 2003. Isoterm Adsorpsi ion Cr3+ oleh abu sekam padi varietas IR 64. Skripsi. Jurusan Pendidikan Kimia FPMIPA Undiksha.
Wahyuni, Sri. 2013. Diktat petunjuk Praktikum Kimia Fisik. Semarang: Jurusan Kimia FMIPA UNNES.
Semarang, 25 September 2013 Praktikan
Wahyu Widi Istiani 4301411060
LAMPIRAN Jawaban Pertanyaan diktat:
1. Percobaan ini termasuk ke dalam adsorbsi secara fisika karena ikatan yang terlibat dalam adsorbsi yaitu ikatan yang lemah yang merupakan ikatan van der waals dan melalui panas yang rendah.
2. Perbedaan kedua adsorbsi:
- Adsorpsi secara kimia merupakan adsorbsi menggunakan senyawa kimia. a. Molekul terikat pada adsorben oleh ikatan kimia.
b. Mempunyai entalpi reaksi -40 sampai -500 kJ/mol. c. Membentuk lapisan monolayer.
d. Contoh: ion exchange.
- Adsorpsi secara fisika merupakan adsorpsi menggunakan sifat fisika. a. Molekul terikat pada adsorben oleh gaya van der waals.
b. Mempunyai entalpi reaksi melibatkan energi aktivasi -4 sampai -40 kJ/mol. c. Dapat membentuk lapisan multilayer.
d. Tidak melibatkan energi aktivasi. e. Contoh: adsorpsi oleh karbon aktif. 3. Pengaktifan arang dengan cara pemanasan:
a. L-karbon (L-AC) yaitu karbon aktif yang dibuat dengan oksidasi pada suhu 300oC –
400oC (570o-750oF) dengan menggunakan udara atau oksidasi kimia. L-AC sangat
cocok dalam mengadsorbsi ion terlarut dari logam berat basa seperti Pb2+, Cu2+, Cd2+,
Hg2+. Karakter permukaannya yang bersifat asam akan berinteraksi dengan logam
basa. Regenerasi dari L-AC dapat dilakukan menggunakan asam atau garam seperti NaCl hampir sama pada perlakuan pertukaran ion.
b. H-karbon (H-AC) yaitu karbon aktif yang dihasilkan dari proses pemasakan pada suhu 800o-10000C (1470o-1830oF) kemudian didinginkan pada atmosphere inersial.
H-AC memiliki permukaan yang bersifat basa sehingga tidak efektif dalam mengadsorbsi logam berat alkali pada suatu larutan air tetapi sangat lebih effisien dalam mengadsorbsi kimia organik, partikulat hidrofobik, dan senyawa kimia yang mempunyai kelarutan yang rendah dalam air. Akan tetapi H-AC dapat dimodifikasi dengan menaikan angka asiditas. Permukaan yang netral akan mengakibatkan tidak efektifnya dalam mereduksi dan mengadsorbsi kimia organik sehingga efektif
mengadsorbsi ion logam berat dengan kompleks khelat zat organik alami maupun sintetik dengan menetralkannya.
4. Isoterm Freudlich untuk adsopsi gas pada permukaan zat padat kurang baik atau memuaskan. Hal ini terjadi karena pada adsorbsi Freudlich situs-situs aktif pada permukaan adsorben bersifat heterogen. Gas merupakan campuran yang homogen sehingga kurang cocok jika digunakan dalam isoterm Freudlich.
Batasannya: Adsorpsi Freudlich situs-situs aktif pada permukaan adsorben bersifat heterogen.
5. Karena pada isoterm Freudlich situs-situs aktif pada permukaan adsorben bersifat heterogen, sedangkan adsorpsi pada langmuir bersifat homogen. Ketika mengadsorbsi gas yang wujudnya campuran yang homogen. Ketika mengadsopsi gas yang wujudnya campuran yang homogen, maka adsorbsi Freudlich kurang cocok. Dari percobaan yang telah dilakukan adsorbsi ini terbentuk adsorbsi langmuir.
Perhitungan konsentrasi CH3COOH awal dan akhir
Awal
1. V CH3COOH x M CH3COOH = V NaOH x M NaOH
5 mL x M CH3COOH = 25 mL x 0,1 N
M CH3COOH = 0,5
2. V CH3COOH x M CH3COOH = V NaOH x M NaOH
5 mL x M CH3COOH = 12,45 mL x 0,1 N
M CH3COOH = 1,245
3. V CH3COOH x M CH3COOH = V NaOH x M NaOH
10 mL x M CH3COOH = 12,45 mL x 0,1 N
M CH3COOH = 0,1245
4. V CH3COOH x M CH3COOH = V NaOH x M NaOH
25 mL x M CH3COOH = 14,7 mL x 0,1 N
M CH3COOH = 0,0588
25 mL x M CH3COOH = 6,7 mL x 0,1 N
M CH3COOH = 0,0268
6. V CH3COOH x M CH3COOH = V NaOH x M NaOH
25 mL x M CH3COOH = 3,95 mL x 0,1 N
M CH3COOH = 0,0158
Akhir
1. V CH3COOH x M CH3COOH = V NaOH x M NaOH
5 mL x M CH3COOH = 24,25 mL x 0,1 N
M CH3COOH = 0,485
2. V CH3COOH x M CH3COOH = V NaOH x M NaOH
5 mL x M CH3COOH = 11,2 mL x 0,1 N
M CH3COOH = 0,224
3. V CH3COOH x M CH3COOH = V NaOH x M NaOH
10 mL x M CH3COOH = 10,9 mL x 0,1 N
M CH3COOH = 0,109
4. V CH3COOH x M CH3COOH = V NaOH x M NaOH
25 mL x M CH3COOH = 12,55 mL x 0,1 N
M CH3COOH = 0,0502
5. V CH3COOH x M CH3COOH = V NaOH x M NaOH
25 mL x M CH3COOH = 5,035 mL x 0,1 N
M CH3COOH = 0,020
6. V CH3COOH x M CH3COOH = V NaOH x M NaOH
25 mL x M CH3COOH = 3,1 mL x 0,1 N
M CH3COOH = 0,0124
M CH3COOH Massa Arang
(gram) 0,5 N 1,004 0,25 N 1,002 0,125 N 1,003 0,0625 N 1,001 0,0156 N 1,002 Keterangan :