44
Mukarlina , Rizkita Rachmi Esyanti , Arbayah Hamonangan Siregar
1)
Jurusan Biologi, FMIPA Universitas Tanjungpura, Pontianak
2)
Sekolah Ilmu dan Teknologi Hayati Institut Teknologi Bandung, Bandung e-mail: [email protected]
Diterima Juli 2005, disetujui untuk dipublikasi April 2006
Abstrak
Telah diteliti kandungan ajmalisin dalam kultur akar Catharanthus roseus (L). G. Don yang dielisitasi dengan homogenat jamur Pythium aphanidermatum (Edson) Fitzp. Kultur akar C. roseus pada medium Zenk (1977) dengan kombinasi zat pengatur tumbuh asam atalen asetat (NAA) 10-7 M dan 6-benzilaminopurin (BAP) 10-7 M dielisitasi
dengan homogenat jamur P. aphanidermatum konsentrasi 0,05; 0,5; 1,0 dan 5,0 mg BK/mL yang sudah diautoklaf. Pemanenan dilakukan pada jam 18, 24, 36, 48 dan 72 setelah elisitasi. Analisis ajmalisin secara kualitatif dan kuantitatif dilakukan dengan alat kromatografi cair kinerja tinggi (KCKT) yang dihubungkan dengan chromatopack CR-7A plus. Hasil menunjukkan kadar ajmalisin dipengaruhi secara bermakna oleh konsentrasi elisitor dan waktu panen. Kandungan ajmalisin tertinggi pada akar sebesar 165,6 ± 1,1 μg/g BK dengan persentase peningkatan sebesar 181,6% diperoleh dengan penambahan elisitor 5 mg BK/mL setelah 24 jam. Kandungan ajmalisin tertinggi dalam medium sebesar 291,5 ± 0,9 μg/g BK dengan persentase peningkatan sebesar 306,5% diperoleh dengan penambahan elisitor 5 mg BK/mL setelah 36 jam. Hasil ini menunjukkan bahwa elisitasi dapat menyebabkan kandungan ajmalisin lebih tinggi di dalam medium dibandingkan akumulasi kandungan ajmalisin pada akar.
Kata kunci : Elisitor, Ajmalisin, C. roseus, Kultur akar
Abstract
An experiment to study the effect of elicitor from Pythium aphanidermatum (Edson) Fitzp. on ajmalicine content of Catharanthus roseus (L) G. Don. root culture has been conducted. The C. roseus root culture in Zenk medium (1977) with the the addition of 10-7 M of napthalene acetic acid (NAA) and 10-7 M of benzylaminopurine (BAP) as growth factors was elicited with autoclaved P. aphanidermatum homogenate at concentrations of 0.05, 0.5, 1.0 and 50 mg DW/mL, then harvested at 18, 24, 36, 48, and 72 h after elicitation. The ajmalicine content was analyzed qualitatively and quantitatively by HPLC (High Pressure Liquid Chromatography) connected to chromatopack CR-7A plus. The result showed that ajmalicine content was influenced significantly by the concentration of elicitor and harvesting time. The highest ajmalicine content on the roots i.e. 165.6 ± 1.1 μg/g DW with the increment percentage of 181,6% was obtained by addition of 5.0 mg DW/mL of elicitor for 24 h, while on the media, the highest ajmalicine content i.e. 291.5 ± 0.9 mg DW/mL with the increment percentage of 306,5% was obtained by addition of 5.0 mg DW/mL elicitor for 36 hours. These results indicated that elicitation might be responsible for the higher ajmalicine content in the media compared to its accumulation in the root.
Keywords : Elicitor, Ajmalicine, C. roseus, Root culture
1. Pendahuluan
Senyawa-senyawa kimia yang digunakan dalam industri kimia, sebagian besar merupakan metabolit sekunder yang berasal dari tumbuhan. Metabolit tersebut mempunyai peranan penting dalam usaha pengembangan obat-obatan, parfum, pewarna dan bahan makanan. Salah satu metabolit sekunder tanaman yang telah dimanfaatkan sebagai bahan obat adalah ajmalisin. Ajmalisin merupakan senyawa golongan alkaloid indol yang dihasilkan oleh tanaman Catharanthus roseus (Zenk, 1977; Verpoorte, 1991). Ajmalisin dapat diisolasi terutama dari bagian akar
tanaman dan dapat digunakan untuk mengatasi penyakit hipertensi (Kulkarni and Ravinda, 1988).
Kultur jaringan dapat digunakan sebagai metode alternatif untuk memperoleh metabolit sekunder. Kultur organ, terutama kultur akar, merupakan salah satu tipe kultur jaringan yang banyak digunakan untuk mempelajari biosintesis metabolit sekunder (Hashimoto and Yamada, 1994). Pada penelitian ini digunakan kultur akar, karena beberapa penelitian membuktikan bahwa enzim-enzim yang dibutuhkan untuk biosintesis ajmalisin lebih banyak disintesis pada bagian akar tanaman (Neumann et al., 1983). Metabolit sekunder yang biasanya terakumulasi pada organ tertentu pada
umumnya akan diproduksi dengan kandungan yang lebih tinggi bila menggunakan kultur organ tertentu tersebut (Verpoorte, 1991).
Produksi metabolit sekunder dapat lebih ditingkatkan dengan penambahan elisitor dalam suatu kultur. Elisitor yang berasal dari materi dinding sel mikroba, yaitu berupa derivat senyawa oligosakarida misalnya glukan, manan dan manosa, telah banyak digunakan dan terbukti dapat meningkatkan kandungan metabolit sekunder (Di Cosmo and Misawa, 1995). Penelitian yang dilakukan oleh Eilert et al., 1986) menunjukkan bahwa elisitor terbaik yang digunakan untuk meningkatkan kandungan ajmalisin adalah jamur Pythium aphanidermatum. Elisitasi menggunakan homogenat P. aphanidermatum ternyata dapat meningkatkan kandungan ajmalisin sebesar 66,4% pada kultur kalus C. roseus (Fitriani, 1988), kemudian kultur kalus berakar yang dielisitasi dengan homogenat P. aphanidermatum mengalami peningkatan kandungan ajmalisin sebesar 148,9% pada konsentrasi elisitor 1 mg BK/mL (Aprianita, 1999).
Penelitian ini dilakukan dengan tujuan mendapatkan kombinasi zat pengatur tumbuh terbaik untuk pertumbuhan kultur akar C. roseus yang menghasilkan ajmalisin dan mengetahui konsentrasi elisitor serta waktu pemanenan terbaik yang dapat meningkatkan kandungan ajmalisin.
Hasil penelitian ini diharapkan dapat dijadikan alternatif pemecahan masalah dalam meningkatkan produksi ajmalisin sebagai bahan obat.
2. Metode
2.1 Persiapan kultur jamur Pythium aphanidermatum (Edson) Fitzp.
2.1.1 Medium pemeliharaan
Jamur P. aphanidermatum ditumbuhkan pada medium oatmeal (Aprianita, 1999) dan diinkubasi pada suhu kamar.
2.1.2 Pembuatan kurva tumbuh
Miselium dari biakan murni P. aphanidermatum yang berumur enam hari diinokulasikan pada 100 mL medium oatmeal cair. Kultur diagitasi dengan kecepatan 150 rpm dan diinkubasi pada suhu kamar dalam kondisi gelap. Miselium dipanen setiap hari sampai terjadi penurunan berat miselium. Miselium yang telah mencapai awal fase stasioner digunakan sebagai bahan elisitor (Eilert et al., 1986).
2.1.3 Persiapan bahan elisitor
Jamur yang telah mencapai awal fase stasioner diautoklaf pada suhu 121 °C dengan tekanan 15 psi selama 15 menit. Selanjutnya kultur jamur disaring dengan kertas Whatman No. 1 steril dan dikeringkan
dalam oven pada suhu 50 °C hingga mencapai berat kering konstan. Miselium kering digerus sampai berbentuk serbuk. Serbuk miselium kemudian ditimbang sesuai dengan konsentrasi elisitor yang akan digunakan, yaitu 0,05; 0,5; 1,0; dan 5,0 mg BK/mL. Serbuk miselium tersebut dilarutkan dengan menambahkan akuades steril (Eilert et al., 1986). Seluruh pekerjaan dilakukan dalam kondisi aseptik.
2.2 Kultur akar C. roseus 2.2.1 Eksplan
Eksplan yang digunakan adalah daun tanaman C. roseus yang letaknya ke-2 dari pucuk atas yang tidak berbunga atau belum berbunga.
2.2.2 Medium induksi akar
Medium yang digunakan adalah medium Zenk dengan penambahan zat pengatur tumbuh (zpt) 10-5 M NAA dan 10–7 M BAP (Aprianita, 1999).
2.2.3 Medium kultur akar
Medium yang digunakan adalah medium Zenk cair dengan penambahan NAA dan BAP dalam berbagai kombinasi konsentrasi seperti yang tercantum pada Tabel 1.
Tabel 1. Kombinasi konsentrasi NAA dan BAP yang
digunakan dalam menentukan medium cair yang terbaik untuk kultur akar C. roseus
BAP (M) NAA (M) O 10 -8 10-7 O ( N0 B0 ) ( N0 B8 ) ( N0 B7 ) 10-8 ( N8 B0 ) ( N8 B8) ( N8 B7 ) 10-7 ( N7 B0 ) ( N7 B8) ( N7 B7 ) 10-6 ( N6 B0 ) ( N6 B8) ( N6 B7 ) 10-5 ( N5 B0 ) ( N5 B8) ( N5 B7 ) Dari kombinasi tersebut ditentukan satu kombinasi yang memperlihatkan pertumbuhan akar terbaik dan dengan kandungan ajmalisin relatif tinggi. Kombinasi terbaik ini digunakan dalam tahap penelitian selanjutnya.
2.2.4 Penentuan kurva tumbuh akar
Penentuan kurva tumbuh akar dilakukan dengan membuat kurva berat kering terhadap waktu. Pemanenan akar dilakukan setiap 2 hari sampai fase-fase pertumbuhan diketahui.
2.2.5 Penentuan kurva kandungan ajmalisin
Kurva kandungan ajmalisin diperoleh berdasarkan hasil analisis kandungan ajmalisin dalam akar dan medium pada setiap waktu pemanenan. Pembuatan kurva tumbuh akar dan kurva kandungan
ajmalisin dilakukan untuk menentukan waktu perlakuan elisitasi yang tepat.
2.2.6 Elisitasi
Elisitasi dilakukan pada kultur akar yang telah memasuki subkultur ke-3 dengan menambahkan elisitor sebanyak 4 mL pada konsentrasi masing-masing 0,05; 0,5; 1,0; dan 5,0 mg BK/mL. Pada kontrol ditambahkan akuades steril dengan volume yang sama. Pemanenan dilakukan pada jam ke 18, 24, 36, 48 dan 72 setelah elisitasi.
2.3 Analisis kandungan ajmalisin 2.3.1 Ekstraksi bahan kering
Akar yang telah dikeringkan, digerus sampai halus dan diekstraksi (Aprianita, 1999).
2.3.2 Analisis kualitatif dan kuantitatif
Ajmalisin dalam kultur akar dianalisis secara kualitatif dan kuantitatif menggunakan KCKT. Fase gerak yang digunakan adalah larutan metanol, asetonitril dan 5 mM diamonium hidrogen fosfat dengan perbandingan 3:4:3 dengan kecepatan alir 1 mL/menit. Panjang gelombang UV yang digunakan adalah 298 nm (Sim et al., 1994). Jenis kolom yang digunakan adalah shim-pack CLC-ODS 0,15 m dengan diameter 6,0 mm. Kromatopak yang digunakan adalah Shimadzu CR-7A plus.
Analisis kualitatif dilakukan dengan membandingkan waktu retensi antara ajmalisin standar dengan waktu retensi sampel. Analisis kuantitatif dilakukan dengan cara mengkonversikan luas area sampel dengan luas area standar pada kurva kalibrasi standar.
2.4 Uji statistik
Uji statistik yang digunakan untuk mengetahui kandungan ajmalisin pada kultur akar C. roseus sebelum dan sesudah perlakuan elisitasi adalah analisis variansi (ANAVA), apabila terdapat beda nyata dilanjutkan dengan DMRT (Duncan’s Multiple Range Test) pada tingkat kepercayaan 95%.
3. Hasil dan Diskusi
3.1 Kurva tumbuh jamur
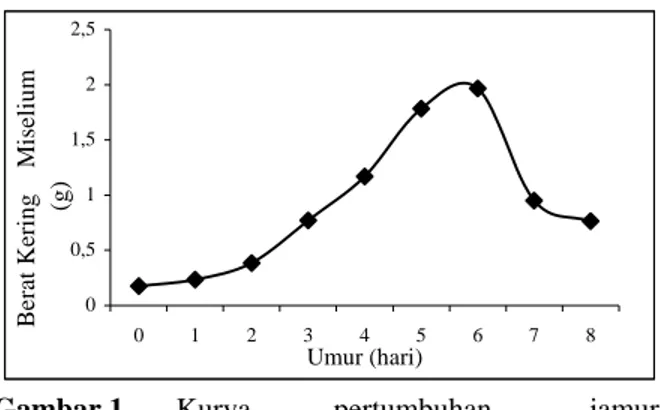
Pertumbuhan jamur P. aphanidermatum mencapai maksimum pada hari ke-6 (Gambar 1). Pada saat itu jamur siap dipanen untuk digunakan sebagai bahan elisitor, sebab pada kondisi tersebut komponen dinding sel jamur sudah terbentuk dengan sempurna. Selain itu, pada akhir fase pertumbuhan jamur juga terjadi akumulasi karbohidrat dan lipid yang berguna dalam pengenalan antar inang dan patogen (Paxton, 1984). 0 0,5 1 1,5 2 2,5 0 1 2 3 4 5 6 7 8 Umur (hari) B e rat K ering M iselium (g)
Gambar 1. Kurva pertumbuhan jamur
P. aphanidermatum pada medium oatmeal cair. 3.2 Penentuan konsentrasi zpt optimum
Hasil penentuan konsentrasi menunjukkan bahwa penambahan NAA 10-5 M dan 10-6 M, dengan atau tanpa penambahan BAP, menurunkan kemampuan kultur untuk membentuk akar, bahkan pada awal subkultur kedua cenderung terjadi dediferensiasi membentuk kalus kembali.
Proses dediferensiasi ini diduga disebabkan pada subkultur kedua, sel-sel akar telah mampu menghasilkan sitokininnya sendiri. Penambahan sitokinin eksogen menyebabkan konsentrasi sitokinin dalam kultur akar mencapai supra optimal. Konsentrasi sitokinin yang terlalu tinggi mengakibatkan perkembangan akar terhambat dan menghalangi efek auksin dalam pembentukan akar. Apabila dalam perkembangan terjadi perubahan rasio sitokinin; auksin menjadi seimbang, maka eksplan yang tadinya lebih membentuk organ tertentu akan berubah proses morfogenesisnya ke arah pembentukan kalus (George and Sherrington, 1984). Hal yang sama juga ditemukan pada kultur kalus berakar C. roseus yang mengalami dediferensiasi menjadi kalus pada akhir subkultur ke-3 (Aprianita, 1999).
Pada kesembilan kombinasi yang menunjukan respons pertumbuhan akar, ternyata kombinasi 10-7 M NAA dan 10-7 M BAP menunjukkan berat kering tertinggi (0,29±0,01 g) dan kandungan ajmalisin tertinggi dalam akar (19,7±0,1 μg/g BK), sedangkan kandungan ajmalisin tertinggi dalam medium (113,2±1,6 μg/L) diperoleh pada kultur dengan penambahan 10-8 M BAP tanpa NAA. Selanjutnya kombinasi zpt terbaik yang digunakan dalam tahapan selanjutnya adalah kombinasi 10-7 M NAA dan 10-7 M BAP. Hal ini terutama disebabkan pertumbuhan akarnya paling baik dibandingkan dengan kombinasi zpt lainnya. Produksi metabolit sekunder ajmalisin pada kultur C. roseus secara umum akan lebih baik jika sejalan dengan pertumbuhannya. Selain itu, pada kombinasi ini akumulasi ajmalisin lebih banyak dalam sel dibandingkan dengan yang dikeluarkan ke medium. Hal ini menunjukkan bahwa viabilitasi sel untuk
mensintesis, mengakumulasi dan mensekresi ajmalisin cukup baik (Zenk et al., 1977; Moreno et al., 1994). 3.3 Hubungan antara pertumbuhan akar dengan produksi ajmalisin
Pada gambar 2 terlihat bahwa ajmalisin sudah terdeteksi sejak awal subkultur ke-3. Ajmalisin yang terkandung dalam akar ini merupakan hasil sintesis pada sub kultur sebelumnya.
0 0,05 0,1 0,15 0,2 0,25 0 2 4 6 8 10 12 14 16 18 Waktu (hari) Berat Kering (BK) ak ar (g) 0 5 10 15 20 25 30 35 40 Kandungan ajma lisin dalam akar (u g/g)
Pertumbuhan akar Kandungan ajmalisin dalam akar
Gambar 2. Hubungan pertumbuhan akar dengan
kandungan ajmalisin dalam akar C. roseus.
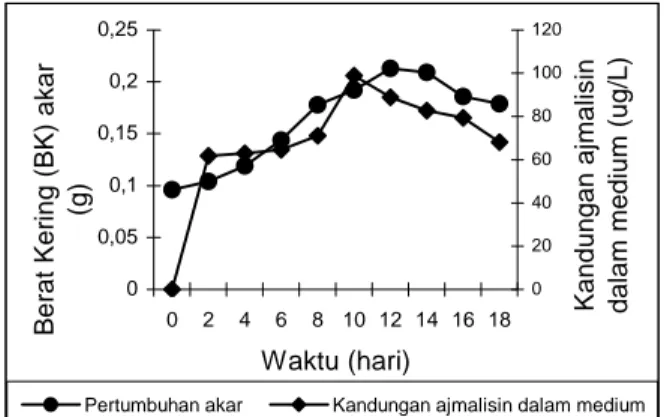
Kandungan ajmalisin dalam akar terus meningkat sampai kultur berumur 8 hari. Seiring dengan bertambahnya umur kultur, ajmalisin mulai disekresikan ke medium. Sekresi ajmalisin ke medium terjadi pada hari ke 2 kemudian terus meningkat dan mencapai puncak pada hari ke 10, setelah itu terjadi penurunan pada saat kultur berumur 12 hari (Gambar 3). Adanya penurunan ini diduga pada saat itu terjadi degradasi ajmalisin. Degradasi disebabkan adanya enzim peroksidase dalam vakuola sehingga ajmalisin dalam sel mengalami reaksi konversi menjadi serpentin, atau menjadi streoisomernya, yaitu 3,4 dehidroajmalisin (Isaac, 1992). 0 0,05 0,1 0,15 0,2 0,25 0 2 4 6 8 10 12 14 16 18 Waktu (hari) B e rat Ker ing (BK ) akar (g) 0 20 40 60 80 100 120 Kandun gan ajmalisin dalam medium (ug/L)
Pertumbuhan akar Kandungan ajmalisin dalam medium
Gambar 3. Hubungan pertumbuhan akar dengan
kandungan ajmalisin dalam medium kultur akar C. roseus.
Dilihat dari pola pertumbuhan dan pola produksi ajmalisin dalam kultur akar, ternyata pola produksi ajmalisin pada kultur akar termasuk pola pembentukan metabolit sekunder yang terjadi pada fase pertumbuhan cepat (Endress, 1994). Pola produksi metabolit sekunder yang sejalan dengan pola pertumbuhan ini diduga disebabkan pada tahap ini terjadi proses metabolisme primer yang sangat aktif, tersedianya hasil metabolisme primer dalam jumlah cukup dapat digunakan sebagai prekursor untuk sintesis metabolit sekunder (Neumann et al., 1983; Endress, 1994).
Penurunan kandungan ajmalisin pada akar mulai terlihat pada fase eksponensial pertumbuhan, hal ini kemungkinan terjadi karena ajmalisin yang disintesis dalam sitosol lebih banyak disekresikan ke medium. Akumulasi ajmalisin dalam vakuola yang terus menurun diduga karena adanya perubahan pH medium kultur yang lebih rendah dibanding pH sitosol, sehingga ajmalisin lebih banyak disekresikan ke medium (Moreno et al., 1994).
3.4 Pengaruh pemberian elisitor terhadap kandungan ajmalisin
Kultur akar setelah elisitasi mengalami perubahan warna menjadi lebih coklat, baik pada akar maupun mediumnya. Pencoklatan diduga disebabkan oleh terjadinya akumulasi ajmalisin dan senyawa-senyawa fenolik akibat adanya cekaman. Pemberian elisitor merupakan salah satu bentuk cekaman yang dapat menginduksi sintesis fitoaleksin (Isaac, 1992).
Pada gambar 4 dan 5 terlihat bahwa pemberian elisitor P. aphanidermatum pada kultur akar C. roseus dapat meningkatkan kandungan ajmalisin, baik pada akar maupun mediumnya. Pemberian elisitor pada konsentrasi tertinggi (5,0 mg BK/mL) merupakan konsentrasi terbaik yang dapat meningkatkan kandungan ajmalisin, baik pada akar maupun medium. Persentase peningkatan kandungan ajmalisin pada akar sebesar 181,6%, dan dalam medium sebesar 306,5%. Peningkatan kandungan ajmalisin pada kultur yang dielisitasi ini disebabkan terjadinya induksi sintesis enzim Triptofan Dekarboksilase (TDC) dan Striktosidin Sintase (SS), yang didahului dengan sintesis mRNA kedua enzim tersebut (Pasqualli et al., 1992). Kedua enzim ini berperan dalam mengkatalisis pembentukan prekursor-prekursor yang diperlukan dalam pembentukan ajmalisin, dan peningkatan aktivitas kedua enzim ini akan mengakibatkan peningkatan kandungan ajmalisin (Moreno et al., 1994).
0 20 40 60 80 100 120 140 160 180 0 0,05 0,5 1 5 Elisitor (mg BK/mL) K andunga n a jm al is in da la m a ka r (u g/ g BK )
0 jam 18 jam 24 jam 36 jam 48 jam 72 jam
Gambar 4. Pengaruh pemberian elisitor homogenat
jamur P. aphanidermatum terhadap kandungan ajmalisin pada akar C. roseus.
0 50 100 150 200 250 300 350 0 0,05 0,5 1 5 Elisitor (mg BK/mL) K andunga n a jm alis in d ala m m edium ( ug/L)
0 jam 18 jam 24 jam 36 jam 48 jam 72 jam
Gambar 5. Pengaruh pemberian elisitor homogenat
jamur P. aphanidermatum terhadap kandungan ajmalisin pada medium kultur akar C. roseus.
Berdasarkan hasil penelitian ini maka belum diperoleh konsentrasi elisitor optimum. Konsentrasi elisitor merupakan salah satu faktor penentu keberhasilan elisitasi sehingga untuk mendapatkan peningkatan kandungan ajmalisin tertinggi dibutuhkan penelitian lanjutan untuk mengetahui konsentrasi elisitor yang optimum.
Pada Gambar 4 dan 5 terlihat pula bahwa waktu panen mempengaruhi peningkatan kandungan ajmalisin dalam akar dan medium. Kandungan ajmalisin dalam akar diperoleh pada waktu panen jam ke-24, sedangkan untuk medium pada jam ke-36. Penurunan kandungan ajmalisin setelah waktu panen optimum ini diduga akibat menurunnya aktivitas enzim yang terlibat dalam sintesis ajmalisin (Funk et al., 1987). Faktor lain yang mempengaruhi keberhasilan elisitasi adalah waktu kontak (Eilert, 1986).
Hasil penelitian juga memperlihatkan bahwa elisitor tidak hanya meningkatkan akumulasi ajmalisin dalam akar, tetapi juga dapat menstimulasi sekresi ajmalisin ke dalam medium. Hal ini dapat disebabkan oleh adanya perubahan pH medium setelah elisitasi (Verpoorte, 1991). Elisitasi menyebabkan peningkatan respirasi sel, sehingga terjadi peningkatan senyawa-senyawa antara hasil respirasi yang bersifat asam (Moreno et al., 1994).
4. Kesimpulan
Kombinasi zat pengatur tumbuh yang menghasilkan ajmalisin pada kultur akar C. roseus adalah kombinasi 10-7 M NAA dan 10-7 M BAP. Elisitasi kultur akar C. roseus dengan homogenat jamur P. aphanidermatum dapat meningkatkan kandungan ajmalisin, baik pada akar maupun pada medium. Konsentrasi elisitor homogenat yang dapat meningkatkan kandungan ajmalisin dalam akar pada pemanenan jam ke-24 dan pada jam ke-36 untuk medium.
Daftar Pustaka
Aprianita, 1999, Pengaruh Pemberian Homogenat Jamur Pythium aphanidermatum (Edson) Fitzp. Terhadap kandungan Ajmalisin dalam Kultur Kalus Berakar C. roseus (L) G. Don. Tesis Magister, Jurusan Biologi, Institut Teknologi Bandung.
Di Cosmo, F. and M. Misawa, 1995, Plant cell and tissue culture : Alternatives for metabolites production, Biotechnology Advances, 3, 425-453.
Eilert, U., F. Constable, and W.G.W. Kurz, 1986, Elicitor stimulation of monoterpene indole alkaloid formation in suspension cultures of Catharanthus roseus, J. Plant Phys., 126, 11-22. Endress, R., 1994, Plant Cell Biotechnology, Springer –
Verlag., Berlin.
Fitriani, A., 1988, Pengaruh Pemberian Homogenat Jamur Pythium aphanidermatum (Edson) Fitzp. terhadap Kandungan Ajmalisin dalam Kultur Kalus Catharanthus roseus (L) G. Don. Tesis Magister, Jurusan Biologi, Institut Teknologi Bandung.
Funk, C., K. Gugler and P. Brodelius, 1987, Increased secondary product formation in plant cell suspension cultures after treatment with a yeast carbohydrate preparation (elicitor), J. Phytochem., 26:2, 401-405.
George, E. F. and P. H. Sherrington, 1984, Plant Propagation by Tissue Culture, Eastern Press Exegetic Ltd., England.
Hashimoto, T. and Y. Yamada, 1994, Alkaloid biogenesis: molecular aspect, J. Plant Mol. Biol.,
Isaac, S., 1992, Fungi plant interaction, Chapman and Hall Publ., London.
Kulkarni, R. N. and N. S. Ravinda, 1988, Resistance to Pythium aphanidermatum in diploids and induced autotetraploids of Catharanthus roseus, J.Planta Med., 176, 356-359.
Moreno, P. R. H., R. van der Heijden, and R. Verpoorte, Effect of elicitation on different metabolic pathways in Catharanthus roseus (L) G.Don cell suspension cultures, in Verpoorte, R., (ed.), 1994, Influence of stress factors of Secondary Metabolism in Suspension Cultured Catharanthus roseus Cell, 53-78.
Neumann, D., G. Krauss, M. Hieke, and D. Groger, 1983, Indole alkaloid formation and storage in cell suspension cultures of Catharanthus roseus, J. Medicinal Plant Research, 48, 20-23.
Pasqualli, G., O. J. M. Goddijn, A. De Wall, R. Verpoorte, R. A. Schirlperoort, J. H. C. Hoge, J. Memelink, 1992, Coordinated regulation of two indole alkaloid biosythetic genes from Catharanthus roseus by auksin and elicitors, J. Plant Mol. Biol., 18, 1121-1131.
Paxton, J. D., Fungal elicitor of phytoalexin and their potential use in agriculture, in Cutler, H. G., (ed.), 1984, Biologically active natural product: Potential use in agriculture, American Chemical Society, Washington DC, 109-119.
Sim, J. S., N. H. Chang, R. J. Liu, and N. K. Jung, 1994, Production and secretion of indole alkaloids in hairy root cultures of Catharanthus roseus: Effect of in situ adsorption, fungal elicitation and permeabilization, J. Ferment. and Bioengin., 78, 229-234.
Verpoorte, R. and R. van der Heijden, Plant biotechnology for the production of alkaloids : Present status and prospects, 1991, in Brossi A. (ed), 1991, The Alkaloid, 40, Academic Press Inc, San Diego, 109-142.
Zenk, M. H., H. El-Shagi, H. Arens, J. Stockigt, E. W. Weiler, and B. Deus, Formation of the indole alkaloids serpentine and ajmalicine in cell suspension cultures of Catharanthus roseus, in Barz, E., E. Reinhard, and M. H. Zenk., (eds.), 1977, Plant Tissue Culture and its Bio-technological Application, Springer-Verlag, Berlin.