tempat fase stasioner terimobilisasi. Efisiensi kolom akan dipengaruhi oleh besarnya partikel fase diam. Semakin kecil ukuran fase diam, semakin besar efisiensi kolom. Deteksi pada alat HPLC dilakukan oleh detektor. Detektor harus memiliki sensitivitas yang tinggi, bersifat inert untuk jangka konsentrasi tertentu dan dapat mendeteksi eluen tanpa mempengaruhi resolusi kromatogram. Hasil deteksi kemudian diolah menjadi data kromatogram dalam rekorder dan disimpan dalam sistem data.
Metode HPLC merupakan salah satu metode analisis aflatoksin yang paling banyak dilakukan. Metode ini berguna dalam penentuan kemurnian dan perhitungan kandungan aflatoksin dalam sampel secara kuantitatif, serta mampu mendeterminasi kandungan aflatoksin dalam sejumlah sampel dengan lebih akurat (Ruiqian et al. 2004).
22
A. Bahan dan Alat
Bahan yang digunakan dalam penelitian adalah Aspergillus sp. isolat lokal yang dikumpulkan dari berbagai daerah disekitar Jawa Barat dan Jabotabek, isolat Aspergillus sp. JCM, standar aflatoksin B1 (AFB1), metanol 60%, pengencer konjugat, konjugat aflatoksin peroksidase (AFB1-HRPO), tetramethilbenzidine (TMB), buffer natrium asetat, media agar miring SDA (Sucrose Dextrose Agar), media PDB (Potato Dextrose Broth), asam klorida (HCl) 1 M, natrium hidroksida (NaOH) 1 M, media GAN (Glucose Ammonium Nitrate), kloroform, akuades, akuades steril, asam sulfat (H2SO4) 1,25M, glukosa, ammonium nitrat, kalium dihidrogen fosfat, magnesium sulfat, suplemen mineral, timbal asetat, asam asetat glasial, akuabides, alkohol 85%, metanol, n-heksana, dan trifluoroasetat (TFA).
Alat-alat yang digunakan dalam penelitian antara lain botol sampel, ELISA-kit Aflavet mencakup mixing plate, antibody-coated plate dan, botol konjugat, microplate spectrophotometer, pipet 100 μl, pipet 200 μl, multi-channel pipette, tip, timer, bak cuci, komputer, printer, erlenmeyer (pyrex ® iwaki te-32) 250 ml , tabung reaksi, pipet (Boeco C000267) 1 mL, sarung tangan lateks, masker wajah, freezer, inkubator, beberapa mikroskop (Olympus mikroskop inversi cx-41rf class:student microscope; Vickers mikroskop binokular M. 750294) , hemasitometer (Marienfeld assistent No. 422), vorteks, pembakar bunsen, kapas tutup erlemenyer, alumunium foil, oven (Memmert tv50b; Binder/ed 53), autoklaf (All American/1941x), kulkas (Sanyo SR-258FG frost type), TLC-plates, TLC-reader, dan laminary air flow cabinet (Oliphant VLF4/LUS S/198), dan HPLC (Hitachi 7000 HSM: Interface D-7000, FL-Detector L-7485, Autosampler L-7200, UV-detector L-7400).
B. Metode
1. Seleksi Isolat Lokal Aspergillus sp yang Berpotensi Memproduksi
Aflatoksin
Uji potensi isolat menggunakan kit ELISA yang dikembangkan oleh Rachmawati et al. (2005). Sebanyak 10 isolat lokal yang terdiri dari 55 sampel yang telah diisolasi dari biji jagung, kacang tanah tanpa kulit, dan pakan ternak dari beberapa daerah di Jabodetabek ditumbuhkan pada media PDB (inkubasi 9 hari, suhu 25°C). Sampel-sampel tersebut kemudian diuji potensinya untuk memproduksi aflatoksin menggunakan teknik ELISA. Seleksi dilakukan dengan jumlah produksi aflatoksin B1 sebagai kriteria seleksi. Sampel dengan hasil produksi aflatoksin B1 tertinggi akan dipilih untuk evaluasi pada tahap berikutnya.
2. Evaluasi Produksi Aflatoksin pada Dua Medium Cair
a. Penyegaran Isolat Sampel Hasil Seleksi
Penyegaran isolat dilakukan untuk persiapan pembuatan suspensi isolat dalam media cair sebagai persiapan untuk tahap pembiakan isolat lokal hasil seleksi dalam media cair. Isolat lokal Aspergillus flavus dari sampel cair hasil seleksi disegarkan kembali dengan cara ditumbuhkan pada media agar miring SDA (Sucrose Dextrose Agar) selama satu minggu pada suhu 25°C. Koloni yang tumbuh kemudian disuspensikan untuk memperoleh suspensi Aspergillus sp sebanyak 109 spora/mL. Suspensi yang diperoleh kemudian diinokulasikan pada media cair yang telah disiapkan seperti yang dijelaskan di bawah.
b. Evaluasi Pertumbuhan Isolat dalam Media Cair dan Produksi
Aflatoksin
Evaluasi dilakukan terhadap isolat hasil penyegaran untuk melihat kurva produksi aflatoksin dan jumlah produksi aflatoksin dengan ilustrasi percobaan yang dapat dilihat pada Gambar 9. Suspensi Aspergillus sp. Sebanyak 109 spora/mL yang telah disiapkan dari hasil penyegaran isolat diinokulasikan sebanyak 1,5 mL pada erlemenyer yang berisi 150 mL media cair sehingga diperoleh 107 spora/mL pada media yang siap untuk ditumbuhkan. Adapun media cair yang digunakan dalam penelitian ini ialah:
I. Media Potato dextrose broth (PDB) dengan pengaturan pH pada kisaran pH 4,00 (Kusumaningtyas 2007).
II. Medium GAN (glucose ammonium nitrate) mengikuti Brian et al. (1961) termodifikasi yang terdiri atas 30 g glukosa, 30 g sukrosa, 2,4 g NH4NO3, 10,0 g KH2PO4, 2,0 g MgSO4.7H2O, dan suplemen mineral mencakup 26,6 mg ZnSO4.7H2O, 2,67 mg CuSO4.5H2O, 1,36 mg Co(NO3)2.6H2O dan 66,67 mg CaCl2 dengan pH 7,00.
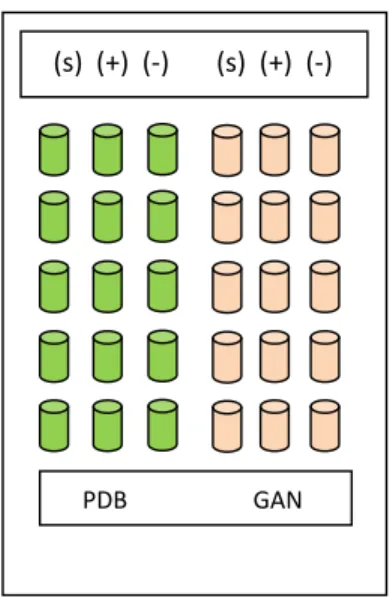
Gambar 9. Ilustrasi Percobaan dengan menggunakan isolat S.26 (s) dari dua media berbeda (PDB dan GAN) dalam lima ulangan dengan kontrol negatif (-) yakni media yang tidak
diinokulasi dan kontrol positif (+) berupa media yang diinokulasi isolat JCM. (s) (+) (‐) (s) (+) (‐)
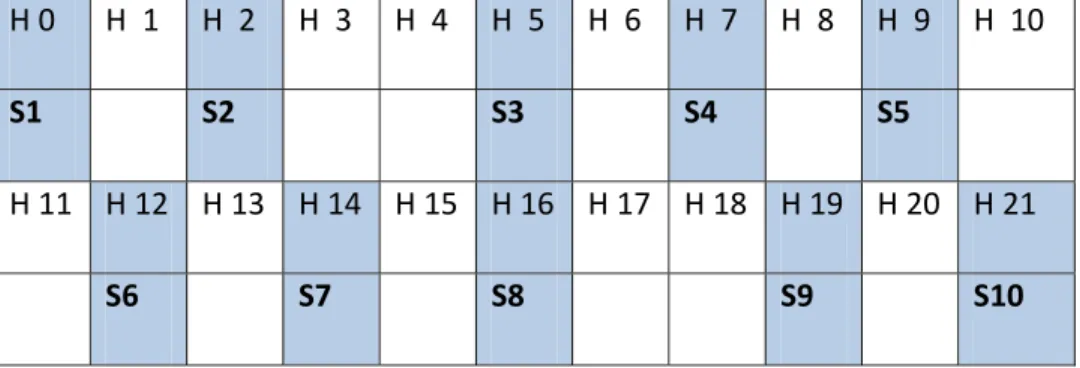
24 Kondisi pertumbuhan kemudian diatur pada suhu 25oC dengan tingkat kelembaban normal. Selanjutnya pertumbuhan pada kedua media cair tersebut diamati tren produksi aflatoksin melalui pengamatan jumlah aflatoksin yang terdapat dalam medium. Pengamatan tren produksi aflatoksin dilakukan selama 21 hari dengan mengadakan sampling pada interval waktu yang telah ditentukan seperti dapat dilihat pada Gambar 10.
H 0
H 1
H 2
H 3
H 4
H 5
H 6
H 7
H 8
H 9
H 10
S1
S2
S3
S4
S5
H 11 H 12 H 13 H 14 H 15 H 16 H 17 H 18 H 19 H 20 H 21
S6
S7
S8
S9
S10
Gambar 10. Interval sampling yang dilakukan (S1-S10) dari total 21 hari inkubasi (H0-H21)
Hasil sampling kemudian dianalisis dengan metode TLC untuk melihat total aflatoksin dalam media sebagai hasil metabolisme sekunder Aspergillus flavus. yang ditumbuhkan pada media. Total aflatoksin dari hasil sampling kemudian digambarkan dalam bentuk kurva produksi aflatoksin untuk memperoleh informasi saat produksi maksimum aflatoksin tercapai. Setelah produksi aflatoksin mencapai maksimum, media dengan nilai produksi maksimum tertinggi akan dipanen untuk selanjutnya dilakukan tahapan produksi massal.
C. Analisis
1. Seleksi Isolat Lokal Menggunakan KIT ELISA Aflatoksin Produksi
Bbalitvet
a. Preparasi Ekstrak Sampel
Metode analisis yang digunakan yaitu metode ELISA kompetitif langsung (Rachmawati 2005; Rachmawati et al. 2004). Sebanyak 1 mL sampel cair yang terdiri atas 55 sampel isolat lokal Aspergillus flavus yang telah ditumbuhkan pada media PDB (inkubasi 9 hari pada suhu 25°) dipipet ke dalam tabung reaksi kemudian ditambahkan klorofom sebanyak 1 mL dan divorteks selama 1 menit. Fase klorofom kemudian diambil dan dimasukkan ke dalam botol sampel. Kemudian ditambahkan lagi 1 mL klorofom pada larutan yang tersisa di dalam tabung untuk kemudian divorteks selama 1 menit. Fase klorofom diambil dan dimasukkan ke dalam botol sampel.
Klorofom dalam botol sampel kemudian dikeringkan dalam water bath. Selanjutnya ditambahkan metanol 60% sebanyak 1 mL pada sampel dalam botol sampel dan dikocok hingga aflatoksin terlarut dalam metanol 60%. Larutan yang dihasilkan kemudian diambil untuk dianalisis dengan cara di bawah.
b. Preparasi Konjugat Encer
Konjugat aflatoksin peroksidase (AFB1-HRPO) dicampur dengan pengencer konjugat dalam perbandingan 30 μl konjugat per mL pengencer konjugat. Konjugat yang telah dibuat kemudian disiapkan untuk dicampurkan dengan standar dalam plat pencampuran.
c. Preparasi larutan Substrat
Substrat A (buffer natrium asetat) dalam ELISA-Kit (Aflavet) dicampur dengan substrat B (tetramethilbenzidine) dalam perbandingan 30 μl substrat B per mL substrat A. Substrat yang telah siap kemudian digunakan dalam proses pencampuran.
d. Analisis Aflatoksin B1 dengan KIT ELISA
1.
Tahap Pencampuran dalam microplateSebelum pencampuran semua bahan terlebih dahulu dikondisikan dalam suhu ruang. Larutan standar aflatoksin B1 (AFB1) dengan konsentrasi 0,12; 0,37; 1,10; 3,30; 10,00; dan 30,00 ppb disiapkan. Kemudian dalam plat pencampuran dibuat campuran antara 100 μl standar AFB1 dan 100 μl konjugat yang telah diencerkan. Blanko juga dibuat dengan mencampurkan 100 μl metanol 60% dengan 100 μl metanol 60%.
2.
Tahap reaksiCampuran standar atau ekstrak sampel dan konjugat pada plat pencampuran kemudian dipindahkan sebanyak 75 μl ke dalam plat terlapis antibodi masing-masing duplo. Campuran pada plat terlapis antibodi kemudian diinkubasikan pada suhu ruang selama 5 menit. Selanjutnya larutan dibuang dan plat dicuci dengan 3 kali pencucian dalam air kemudian dikeringkan. Pada plat terlapis antibodi kemudian ditambahkan larutan substrat yang sudah disiapkan sebanyak 100 μl dan plat diinkubasikan kembali selama 10 menit dalam suhu ruang.
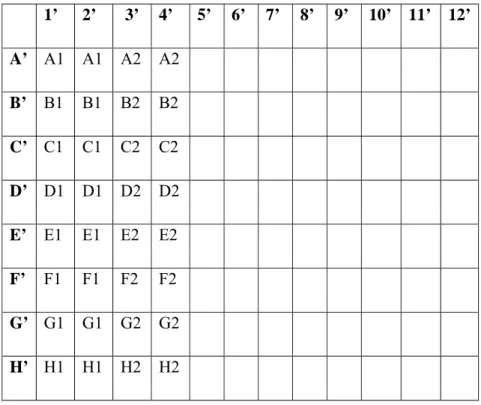
Pada tahap ini akan terbentuk warna hijau yang kepekatannya berbanding terbalik dengan konsentrasi aflatoksin yang terdeteksi pada plat. Tahap selanjutnya ialah penambahan 50 μl larutan penghenti (H2SO4 1,25 M) hingga warna larutan pada plat terlapis antibodi berubah menjadi kuning dan siap untuk dibaca pada ELISA reader (microplate spectrophotometer). Ilustrasi pada plat terlapis antibodi dapat dilihat pada Gambar 11 (Catatan: A1=campuran baris A kolom 1 pada plat pencampur).
26
1’ 2’ 3’ 4’ 5’ 6’ 7’ 8’ 9’ 10’ 11’ 12’
A’ A1
A1
A2
A2
B’ B1
B1
B2
B2
C’ C1
C1
C2
C2
D’ D1
D1
D2
D2
E’ E1
E1
E2
E2
F’ F1
F1
F2
F2
G’ G1
G1
G2
G2
H’ H1
H1
H2
H2
Gambar 11. Ilustrasi pada antibody-coated microplates
3.
Tahap Pembacaan dan PerhitunganLarutan pada plat terlapis antibodi dibaca dengan ELISA reader pada panjang gelombang 450 nm. Pembacaan dengan ELISA reader akan mendapatkan nilai serapan warna (optical density) pada tiap sumur plat. Perhitungan dilakukan dengan menggunakan persamaan yang telah tersedia pada program penunjang. Data kandungan AFB1 pada sampel diperoleh dengan memasukkan hasil pengukuran OD atau persen inhibisi sampel ke persamaan garis kurva kalibrasi standar, dikalikan faktor pengenceran dan dibagi bobot sampel. Apabila % inhibisi sampel yang diperoleh lebih besar dari persen inhibisi standar 10-30 ppb, terdapat kemungkinan sampel mengandung AFB1 dalam jumlah tinggi sehingga diperlukan perlakuan pengenceran untuk mendapat kisaran konsentrasi yang terdeteksi pada ELISA-Kit. Konsentrasi akhir kemudian harus dikalikan lagi dengan faktor pengenceran.
a.
SamplingProses sampling dilakukan dengan mengambil 1 mL media secara aseptis dan kemudian disimpan pada botol sampel yang telah disiapkan.
b. Ekstraksi Aflatoksin
Proses esktraksi dilakukan dengan mencampurkan 1 mL sampel dengan 1 mL klorofom dalam tabung reaksi bertutup kemudian divorteks selama 1 menit. Setelah itu dilakukan pemisahan fase klorofom dan hasil pemisahan dimasukkan ke dalam botol hasil ekstrak yang telah disiapkan. Larutan yang tersisa dalam tabung reaksi ditambahkan lagi klorofom sebanyak 1 mL dan divorteks selama 1 menit. Kemudian dilakukan pemisahan fasa klorofom dan hasil pemisahan dimasukkan dalam botol hasil ekstraksi. Fasa klorofom kemudian dihilangkan menggunakan waterbath. Hasil ekstraksi telah siap untuk dianalis.
c. Analisis Aflatoksin Menggunakan TLC (Bainton et al. 1980)
1.
Tahap PersiapanPersiapan dilakukan dengan penjenuhan bejana TLC dengan fase gerak (kloroform : aseton=9 : 1). Persiapan lempeng TLC dilakukan dengan mendiamkan lempeng TLC dalam oven dengan suhu 80˚C selama satu jam.
2.
Tahap IdentifikasiAnalisis aflatoksin dilakukan dengan menggunakan Thin Layer Chromatography (TLC) satu dimensi dengan fase gerak (kloroform : aseton = 9 : 1). Plat TLC yang digunakan adalah plat dengan fase diam silika gel. Ekstrak aflatoksin yang telah dihasilkan kemudian ditotolkan secara kuantitatif pada lempeng kromatografi. Setelah itu lempeng kromatografi dimasukkan ke dalam bejana yang berisi pelarut (kloroform : aseton = 9 : 1) yang telah dijenuhkan lalu dielusi dari bawah ke atas sampai pelarut mencapai batas elusi. Lempeng kromatografi kemudian dikeringkan.
3.
Tahap pengamatanHasil elusi dikeringkan dan diamati di bawah lampu UV pada panjang gelombang 365 nm. Perpendaran dan waktu rambatnya (Rf) dari bercak sampel dan standar dibandingkan.
4.
PerhitunganKandungan aflatoksin pada sampel didapatkan dengan membandingkan intensitas perpendarannya dengan standar. Hal tersebut didapatkan dari deret standar aflatoksin yang dielusi dengan pelarut. Aflatoksin dikatakan positif apabila Rf sampel
28 sama dengan standar. Kandungan aflatoksin ditentukan dengan rumus sebagai berikut (Bainton et al., 1980) :
Keterangan :
S : Volume aflatoksin standar (μL) yang memberikan perpendaran setara dengan Z μL sampel.
Y : Konsentrasi aflatoksin standar aflatoksin dalam μg/mL.
Z : Volume ekstrak sampel (μL) yang dibutuhkan untuk memberikan perpendaran setara S μL standar aflatoksin.
W : Berat aflatoksin yang diekstrak (g). V : Volume pelarut yang dibutuhkan (μL) FP : Faktor pengenceran.
d. Konfirmasi Hasil Produksi Aflatoksin Menggunakan HPLC
1.
Tahap DerivatisasiAnalisis aflatoksin konfirmasi dilakukan menggunakan High Performance Liquid chromatography (HPLC) fase terbaik (reversed phase) dengan fase gerak (akuabides : metanol grade : asam asetat glasial = 65 : 15 : 20) yang telah melalui proses vacuum filtering dengan sonikator. Sampel hasil ekstraksi sebanyak 1 mL diderivatisasi dengan menambahkan 50 µL TFA dan 200 µL n-heksana lalu didiamkan selama 15 menit dalam ruang asam. Sampel kemudian dikeringkan di dalam oven bersuhu ±50˚Cselama 10 menit, selanjutnya dilarutkan dalam 1 mL fase gerak dan diinjeksikan ke dalam HPLC.
2.
Tahap AnalisisSampel yang telah diderivatisasi divorteks sebelum kemudian diinjeksikan ke dalam HPLC. Hasil analisis kemudian ditampilkan dalam bentuk kromatogram. Setiap sampel yang dianalisis memiliki nilai faktor pengenceran yang berbeda bergantung pada intensitas aflatoksin yang teramati dalam sampel. Kondisi instrumen HPLC yang digunakan meliputi:
a. Kolom : C18 µBondapack (3,9 x 300 mm) column b. Detektor : Fluoresen, λem 425nm dan λeks 365 nm c. Volume injeksi : 20 µL
d. Laju aliran : 1,2 mL/menit
f. Lama running : 30 menit. g. Suhu : suhu ruang
3.
Tahap PerhitunganPerhitungan kadar aflatoksin yang terdapat pada sampel secara konvesional dapat dihitung menggunakan persamaan:
/
Keterangan:
Cp = Konsentrasi aflatoksin dalam sampel (ppm) Lc = Luas area contoh
Ls = Luas area standar Cs = konsentrasi standar (ppm) FP = Faktor pengenceran Bc = Bobot contoh (g)
Meskipun demikian, instrumen HPLC yang digunakan mampu memproses data secara otomatis sehingga perhitungan dapat pula dilakukan dengan persamaan:
/ Keterangan:
Cp = Konsentrasi aflatoksin dalam sampel (ppm) Ch = Konsentrasi aflatoksin dalam kromatogram (ppm) Bc = Bobot contoh (g)
IV.
HASIL DAN PEMBAHASAN
A. Hasil Seleksi Isolat Lokal Penghasil Aflatoksin Menggunakan KIT ELISA
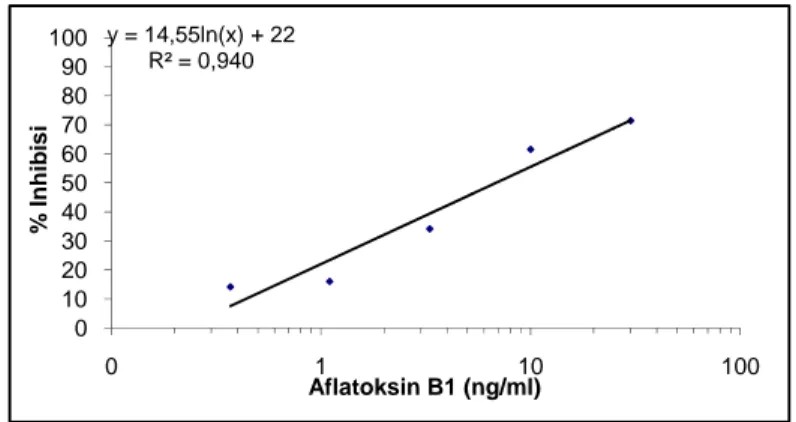
Proses seleksi sampel isolat lokal Aspergillus sp. yang dilakukan menggunakan Kit ELISA dengan format kompetitif langsung telah berhasil dilakukan. Jumlah total sampel yang telah menjalani uji potensi ialah sebanyak 55 sampel dari 10 isolat Aspergillus flavus yang diperoleh dari hasil sampling di daerah Jawa Barat dan Jabotabek, disertai isolat JCM. Hasil pembacaan dari microplate spectrophotometer kemudian diolah dengan perhitungan hingga menghasilkan nilai persen inhibisi. Nilai serapan (OD) dan persen inhibisi dari ikatan konjugat dan antibodi kemudian dijadikan kurva kalibrasi standar, yaitu plot antara nilai OD dan konsentrasi aflatoksin B1. Kedua kurva kalibrasi analisis menunjukkan linieritas yang baik. Berikut ini ialah salah satu kurva kalibrasi yang digunakan (Gambar 12).
30
Gambar 12. Tampilan kurva kalibrasi analisis untuk sampel S.3 (A) 6/8/09, S.5 (D) 29/7/09, S.26 (C) 31/7/09, dan F-0213 (B) 13/8/09 berdasarkan pembacaan dengan ELISA reader pada
panjang gelombang 450 nm dengan ELISA kit Aflavet.
ELISA-kit yang digunakan merupakan ELISA-kit yang dikembangkan oleh Balitvet yakni ELISA-kit Aflavet yang spesifik untuk analisis aflatoksin B1. Hasil seleksi dari 10 isolat lokal (S3, S5, S9, S11, S14, S17, S19, S23, S26, dan F-0213) yang terdiri atas 50 sampel dengan satu isolat kontrol positif (JCM) yang terdiri dari 5 sampel menggunakan ELISA-kit ditampilan pada Tabel 9.
Tabel 9. Kadar aflatoksin dalam sampel berdasarkan analisisg menggunakan ELISA Kitc y = 14,55ln(x) + 22 R² = 0,940 0 10 20 30 40 50 60 70 80 90 100 0 1 10 100 % Inhibi s i Aflatoksin B1 (ng/ml)
aAflatoksin B1.
bSampel isolat lokal Aspergillus flavus koleksi Bbalitvet Culture Collection (BCC) yang ditumbuhkan
dalam media PDB (inkubasi 9 hari, suhu 25°C). Data merupakan hasil sampling pada hari ke-1, 3, 5, 8, dan 11.
cELISA-Kit Aflavet dengan format direct competitive ELISA yang dikembangkan oleh Balitvet (Balai Besar
Penelitian Veteriner), Cimanggu, Bogor.
dSampel diinkubasi tambahan selama 10 menit sebelum dibaca persen inhibisi pada ELISA-reader.
eSampel isolat lokal Aspergillus flavus yang dipilih untuk dilanjutkan dalam tahapan penelitian berikutnya.
f
part per billion
gPersamaan yang digunakan dalam menentukan nilai persen inhibisi ialah: y=14,721Ln(x) + 25,931;
R2=0,9159. Pengecualian pada sampel S.3 H11, S.5 H3, S.26 H5, dan F-0213 H8 yang menggunakan persamaan y=14,551Ln(x) + 22; R2=0,9406.
Sampel dengan kadar aflatoksin tertinggi ialah sampel S.26 H5 dengan kandungan aflatoksin sebesar
1212,3 ppb.
n.d = not detected (below quantitation limit: 0,3 ng/g)
hIsolat JCM merupakan isolat kontrol positif (+)
Balitvet mengembangkan metode analisis AFB1 secara Enzyme Linked Immunosorbent Assay (ELISA) berupa Aflavet yang telah divalidasi dengan melakukan inner laboratorium study dan telah terbukti mendapatkan hasil konsisten dengan metode standar kromatografi
Sampelb Kadar aflatoksina (ppb)f Sampel Kadar aflatoksin (ppb)f Sampel Kadar aflatoksin (ppb)f S3 H1 534,0 S14 H1 27,7 S26 H1 319,7 H3 267,0 H3 29,4 H3 108,4 H5 491,4 H5 878,6 H5 1212,3 H8 n.d H8 145,7 H8 145,1 H11 31,4 H11 79,9 H11 143,7 S5 H1 219,9 S17 H1 n.d F-0213 H1 14,7 H3 234,2 H3 n.d H3 84,5 H5 219,9 H5 n.d H5 25,6 H8 101,2 H8 n.d H8 252,8 H11 433,7 H11 n.d H11 64,9 S9 H1 267,0 S19 H1 n.d JCMh H1 n.d H3 178,6 H3 n.d H3 734,6 H5 223,0 H5 n.d H5 556,7 H8 302,5 H8 n.d H8 809,4 H11 178,6 H11 n.d H11 445,9 S11 H1 38,3 S23 H1 n.d H3 135,4 H3 n.d H5 18,1 H5 n.d H8 108, 4 H8 n.d H11 249.0 H11 n.d
32 (Rachmawati et al. 2004). Analisis berlangsung dalam plat mikro. Aflatoksin B1 yang terdapat pada sampel akan berkompetisi dengan konjugat untuk berikatan dengan antibodi yang terlapis dalam plat mikro.
Data hasil seleksi menunjukkan bahwa dari 55 sampel isolat lokal yang diseleksi diperoleh 69% hasil positif. Sampel terdeteksi mengandung aflatoksin dalam kisaran 17,7-1212,3 ppb dengan 27 sampel mengandung aflatoksin <100 ppb, 27 sampel mengandung aflatoksin dalam kisaran 100-1000 ppb, dan satu sampel mengandung aflatoksin >1000 ppb dengan kandungan aflatoksin rata-rata sebesar 187,5 ppb. Jumlah aflatoksin terdeteksi tertinggi ditemukan pada sampel S.26(C) dengan jumlah aflatoksin B1 terdeteksi sebesar 1212,3 ppb. Sampel tersebut kemudian akan dipilih untuk dilanjutkan ke tahapan penelitian berikutnya. Tahapan seleksi yang dilakukan menggunakan ELISA-Kit berjalan dengan cepat dan efisien, sehingga bisa mempercepat waktu seleksi yang dibutuhkan.
Pada hasil seleksi ditemukan pula beberapa sampel yang menghasilkan nilai n.d (not detected). Hal tersebut terjadi karena jumlah aflatoksin B1 apabila ada pada sampel-sampel tersebut berada di bawah limit deteksi AFB1 ELISA-Kit Aflavet yakni 0,3 ng/g (Rachmawati et al. 2004). Hal tersebut kemungkinan disebabkan sampel-sampel tersebut menghasilkan aflatoksin B1 dalam jumlah terlalu sedikit, tidak menghasilkan aflatoksin B1 atau bahkan memang tidak menghasilkan aflatoksin samasekali. Uji ELISA seringkali memberikan hasil kesalahan positif, sehingga konfirmasi hasil uji ELISA menggunakan uji lain yang lebih spesifik seperti HPLC (High Performance Liquid Chromatography) sangatlah penting untuk dilakukan (Ruiqian et al. 2004).
B. Hasil Analisis Aflatoksin Menggunakan TLC
Sampel yang telah dibiakkan dalam media cair PDB dan GAN termodifikasi kemudian di-sampling secara aseptis untuk analisis kandungan aflatoksin menggunakan metode TLC (Thin Layer Chromatography). Sampel kemudian disimpan dalam suhu refrigerator sebelum diekstrak menggunakan klorofom. Sampel yang telah diekstrak dianalisis dengan metode TLC menggunakan teknik perbandingan dengan standar (Jones 1972). Sampel di-spotting pada lempeng silika gel (fase stasioner) dengan fase gerak kloroform-aseton (9:1) yang telah dipersiapkan dan diletakkan dalam developing chamber yang telah dijenuhkan terlebih dahulu. Secara alami aflatoksin memberikan fluoresensi pada panjang gelombang tertentu yang disebabkan oleh struktur oxygenated pentaheterocyclic aflatoksin (Fente et al. 2001). Hal tersebut memungkinkan analisis aflatoksin menggunakan TLC untuk kemudian hasil fluoresensi dibaca menggunakan UV-reader pada panjang gelombang 365 nm. Hasil fluoresensi yang diamati dalam UV-reader dibandingkan dengan hasil fluoresensi standar yang digunakan. Selanjutnya dilakukan perhitungan konsentrasi aflatoksin dalam sampel sesuai dengan rumus yang tersedia.
Hasil analisis menunjukkan bahwa semua sampel dari semua ulangan yang diperoleh dari media GAN termodifikasi tidak terdeteksi menghasilkan aflatoksin. Uji TLC yang dilakukan pada sampel dari media GAN termodifikasi telah diujikan dengan berbagai volume spotting namun tetap tidak menunjukkan keberadaan aflatoksin yang terdeteksi pada sampel. Hal tersebut berbeda dengan hasil analisis TLC pada sampel dari media PDB yang secara konstan
menunjukkan adanya produksi aflatoksin pada tiap ulangan sebagaimana dapat dilihat pada Tabel 10.
Tabel 10. Hasil uji TLCe kadar aflatoksin sampel pada media PDBa
Sampling
Kadar Aflatoksin (ppb)*
Ulangan 1 Ulangan 2 Ulangan 3 Ulangan 4 Ulangan 5 Rataan JCMb S.26c JCMb S.26c JCMb S.26c JCMb S.26c JCMb S.26c JCMb S.26c H0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 H2 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 H5 100 100 0,0 0,0 100 100 0,0 0,0 0,0 0,0 40 40 H7 100 250 250 250 150 100 50 50 100 100 130 150 H9 150 450 300 500 200 200 200 200 150 150 200 290 H12 200 300 400 300 200 150 250 200 150 200 240 230 H14 200 100 250 200 200 150 100 100 150 100 180 130 H16 100 100 100 150 150 150 100 50 100 150 110 120 H19 0,0 100 50 150 100 50 50 50 100 100 60 90 H21 0,0 0,0 50 50 50 0,0 25 25 50 50 35 25 aMedia PDB (pH 4.00, suhu 25°C)
bKontrol positif (+) berupa isolat Aspergillus flavus Koleksi JCM
cSampel berupa isolat lokal Aspergillus flavus S.26
dppm (part per billion=ng/g)
eKonsentrasi standar aflatoksin yang digunakan: B1=200 ppb, B2=100 ppb, G1=1000 ppb, G2=300 ppb. LoD
= 0.4 ppb (Meilawati 2007)
Berbeda dengan sampel pada medium GAN termodifikasi, sampel pada medium PDB menunjukkan adanya produksi aflatoksin. Perbedaan hasil yang cukup signifikan mengindikasikan adanya perbedaan kapabilitas kedua media yang digunakan dalam mendukung produksi aflatoksin pada strain S.26 dan JCM. Meskipun hasil analisis sampel dari media GAN termodifikasi tidak menunjukkan keberadaan aflatoksin, hasil pengamatan visual selama periode pembiakan kapang pada media GAN termodifikasi menunjukkan adanya pertumbuhan kapang yang ditunjukkan dengan adanya koloni pada media. Meskipun demikian, ciri-ciri morfologis koloni yang terdapat pada media GAN termodifikasi berbeda dengan koloni yang dijumpai pada media PDB. Koloni pada media PDB memiliki ciri morfologis berwarna kuning kehijauan dan berubah menjadi hijau tua pada koloni yang sudah tua (Gambar 13). Sementara itu, koloni pada media GAN termodifikasi berwarna putih yang berasal dari miselium kapang (Gambar 14).
34 Brian et al. (1961) menyatakan bahwa medium GAN (Glucose Ammonium Nitrate) mampu menunjukkan hasil produksi aflatoksin yang tinggi pada beberapa strain Aspergillus flavus. Meskipun demikian, hasil penelitian Maggon et al. (1969) menunjukkan bahwa medium GAN dapat memberikan hasil yang rendah pada beberapa strain tertentu.
Hasil percobaan yang dilakukan Moggan et al. (1969) mengindikasikan bahwa medium GAN bisa memberikan hasil yang variatif bergantung pada strain Aspergillus flavus yang diujikan. Aspergillus tidak membutuhkan garam untuk produksi toksin sehingga ketersediaan trace element dalam media sangat mempengaruhi produksi toksin. Meskipun demikian, setiap strain memiliki kebutuhan yang berbeda-beda sehingga efek dari trace element yang tersedia dalam medium GAN dapat menunjukkan hasil yang variatif (Moggan et al. 1969). Nazari (2010) menyatakan bahwa perubahan pada komposisi medium bisa mempengaruhi parameter pertumbuhan yang berbeda. Hal tersebut menjelaskan mengapa beberapa peneliti telah melaporkan adanya pengaruh yang besar dari suatu medium terhadap pertumbuhan suatu kapang
Gambar 14. Koloni Aspergillus flavus pada media PDB
Gambar 13. Koloni Aspergillus flavus pada media GAN termodifikasi
sementara beberapa peneliti lain melaporkan tidak adanya pengaruh yang signifikan terhadap pertumbuhan dari kapang yang sama. Berdasarkan hal tersebut diduga bahwa strain S.26 (C) dan JCM yang digunakan dalam analisis dengan TLC, seperti halnya strain DU/KR 79 F dan DU/KR 79 K dalam penelitian Moggan et al. (1969) tidak menunjukkan produksi aflatoksin dalam medium GAN termodifikasi karena pengaruh dari modifikasi medium berupa substitusi sukrosa pada sebagian glukosa, penetapan pH awal 7, maupun ketidakcocokan strain terhadap medium GAN. Uji TLC dilakukan pada 100 sampel yang berasal dari sampling pada lima ulangan yang berasal dari strain yang sama sehingga apabila strain yang digunakan tidak menunjukkan produksi aflatoksin pada medium GAN termodifikasi maka semua sampel yang diujikan akan memberikan hasil yang sama.
Kasno (2003) menyatakan bahwa koloni Aspergillus flavus yang sudah menghasilkan spora akan berwarna cokelat kehijauan hingga kehitaman dan miselium yang berwarna putih sudah tidak nampak lagi. Penampakkan warna putih pada koloni kapang di media GAN termodifikasi diduga terjadi karena kapang yang tumbuh belum atau tidak mampu menghasilkan spora. Bukti-bukti menunjukkan bahwa metabolit sekunder dapat diasosiasikan dengan proses perkembangan kapang seperti sporulasi dan pembentukkan sklerotia (Yu et al. 2002). Rendahnya produksi aflatoksin disebabkan pula oleh rendahnya pembentukkan biomassa miselia kapang yang mengindikasikan adanya pertumbuhan yang terhambat. Pertumbuhan yang terhambat akan mempengaruhi produksi aflatoksin karena meskipun aflatoksin merupakan metabolit sekunder namun produksinya sangat terkait dengan berbagai enzim yang ikut terhambat saat pertumbuhan terhambat.
Sardjono et al. (1992) dan Aryantha et al. (2007) menyimpulkan bahwa pertumbuhan miselia yang terhambat memiliki pengaruh langsung dan tidak langsung kepada sintesis enzim termasuk enzim yang berperan dalam produksi aflatoksin sehingga akan berpengaruh terhadap produksi aflatoksin baik langsung maupun tidak langsung. Lebih lanjut Yu et al. (2002) menyatakan bahwa hasil pengamatan menunjukkan kondisi lingkungan yang dibutuhkan untuk metabolisme sekunder dan pembentukkan spora adalah sama. Pembentukkan spora dan metabolit sekunder juga berlangsung secara bersamaan. Hal ini mungkin bisa menjelaskan alasan tidak ada aflatoksin yang terdeteksi pada uji TLC pada sampel-sampel dari media racikan. Berbeda dengan koloni pada media GAN termodifikasi, warna koloni pada media PDB menandakan bahwa koloni tersebut telah menghasilkan spora dan metabolit sekunder. Hal tersebut sejalan dengan hasil analisis TLC yang menunjukkan adanya aflatoksin yang diproduksi oleh kapang pada media PDB.
Meskipun demikian, penyebab adanya perbedaan hasil dari kedua media masih belum dapat dijelaskan dengan akurat karena faktor utama yang menyebabkan adanya perbedaan belum bisa diidentifikasi. Kedua media yang digunakan secara umum hanya memiliki perbedaan dalam pH awal dan sumber nitrat yang digunakan. Media GAN termodifikasi memiliki pH 7.00 dengan nitrat berasal dari sumber anorganik yakni ammonium nitrat. Sementara itu, media PDB yang digunakan memiliki pH awal 4.00 dengan nitrat berasal dari sumber organik. Kedua faktor tersebut diduga mempengaruhi produksi aflatoksin pada kedua media. Yu et al. (2002) menyatakan bahwa terdapat bukti potensial tentang ekspresi gen dalam produksi aflatoksin yang dipengaruhi oleh sinyal lingkungan, seperti pH dan kandungan nitrat. Meskipun demikian, pengaruh nitrat terhadap produksi aflatoksin sampai saat ini masih belum jelas. Sementara itu, Buchanan et al. (1975) dan Ruiqian (2004) menyatakan bahwa bahwa pH awal tidak mempengaruhi produksi aflatoksin pada beberapa strain secara signifikan dan universal,
36 sedangkan pengamatan lainnya menunjukkan bahwa pH asam lemah secara nyata menekan pertumbuhan kapang namun menghasilkan aflatoksin yang lebih tinggi. Hasil pengamatan menunjukkan media PDB dengan pH awal 4.00 mampu mendukung produksi aflatoksin lebih baik dibanding media GAN termodifikasi yang memiliki pH awal 7.00 terhadap strain S.26 dan JCM yang dievaluasi. Meskipun demikian, tidak diketahui signifikansi pengaruh faktor pH awal karena pH akhir pada kedua media tidak diukur. Pengaruh dari pH awal bergantung pada komposisi media sehingga pH awal yang optimum untuk tiap media akan berbeda. Namun demikian, terdapat indikasi bahwa pH awal 7.00 mungkin merupakan salah satu penyebab minimnya produksi aflatoksin pada media GAN termodifikasi. Penelitian lebih lanjut dibutuhkan untuk melihat pengaruh pH awal sekaligus menentukan pH awal yang paling optimum untuk media GAN termodifikasi.
Parameter lain selain pH awal dan komposisi media antara media GAN termodifikasi dan media PDB adalah sama. Parameter seperti ketersediaan O2 dan CO2, suhu, dan kelembaban udara dianggap seragam karena kedua media ditempatkan pada ruang inkubasi yang sama. Kedua media ditempatkan pada ruangan dengan temperatur sekitar 25˚C dan kelembaban udara normal. Temperatur ruang inkubasi diusahakan tetap konstan dalam kisaran 25˚C. Meskipun demikian, pengatur suhu yang berupa AC (Air Conditioner) memungkinkan adanya sedikit variasi suhu selama pembiakan kapang, namun variasi suhu tersebut dialami oleh biakan dalam kedua media sehingga dalam hal ini kondisi pembiakan dapat disimpulkan seragam.
Kedua jenis sampel baik dari isolat lokal S.26 dan JCM memiliki produksi tertinggi pada ulangan kedua. Sampel isolat S.26 pada ulangan kedua menghasilkan nilai produksi maksimum aflatoksin sebesar 400 ppb dan sampel isolat JCM menghasilkan nilai produksi maksimum aflatoksin sebesar 500 ppb. Sampel dari ulangan kedua kemudian dianalisis menggunakan HPLC untuk memperoleh nilai kandungan aflatoksin yang lebih akurat.
Metode TLC dalam analisis aflatoksin yang dilakukan masih memiliki beberapa kelemahan seperti tingkat sensitivitas yang lebih rendah dari metode lain seperti HPLC. Publikasi hasil penelitian yang menggunakan TLC juga telah menurun jumlahnya dalam tahun-tahun belakangan. Meskipun demikian, metode ini masih dapat digunakan untuk melihat kurva produksi aflatoksin dari sampel yang diuji. Metode TLC dengan teknik perbandingan dengan standar dalam mengestimasi konsentrasi aflatoksin merupakan pengukuran subjektif. Kesulitan dalam memperkirakan perbedaan-perbedaan kecil dalam intensitas fluoresensi secara visual menyebabkan adanya kisaran presisi sebesar ± 20% dalam kondisi ideal (Jones 1972). Faktor yang mempengaruhi tingkat presisi analisis antara lain kesalahan dalam spotting, variasi resolusi dari batch yang berbeda tiap lempeng silika gel, dan kesalahan dalam penentuan peak areas pada pengamatan di UV-reader. Akurasi dan tingkat presisi dalam analisis aflatoksin bisa ditingkatkan dengan mengembangkan instrumen pengukuran yang dapat mengukur intensitas fluoresensi secara objektif.
C. Hasil Konfirmasi Produksi Aflatoksin Menggunakan HPLC
Analisis menggunakan metode HPLC kemudian dilakukan sebagai uji konfirmasi dari analisis menggunakan metode TLC yang dilakukan sebelumnya. Analisis dilakukan dengan menggunakan HPLC fase normal secara bertahap hingga menemukan kandungan aflatoksin pada sampel dalam range pada kromatogram. Sebelum sampel diinjeksikan standar terlebih dahulu diinjeksikan. Berikut ini merupakan salah satu kromatogram standar (Gambar 15).
Gambar 15. Kromatogram standar aflatoksin: B1=5 ppb, B2=2,5 ppb, G1=25 ppb, dan
G2=7,5 ppb
Sampel ulangan kedua dari media PDB kemudian mengalami proses derivatisasi dengan trifluoroasetat (TFA) sebelum kemudian dianalisis menggunakan HPLC. Data diperoleh dalam bentuk kromatogram seperti dapat dilihat pada Gambar 16.
Gambar 16. Kromatogram sampel ulangan ke-2 S. 26 PDB H9 (AFB1=13 ppb)
38 Hasil analisis sampel ulangan kedua yang telah diderivatisasi ditampilkan dalam bentuk kromatogram. Hasil perhitungan setelah memasukkan variabel faktor pengenceran dan berat contoh sehingga menghasilkan kadar aflatoksin dalam sampel dapat dilihat pada Tabel 11.
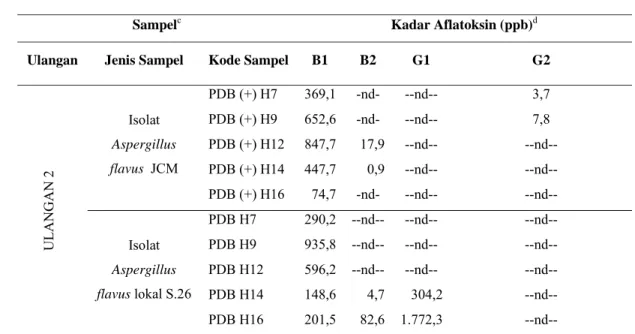
Tabel 11. Hasil uji HPLCa kadar aflatoksin sampel ulangan 2 pada media PDBb
Sampelc Kadar Aflatoksin (ppb)d
Ulangan Jenis Sampel Kode Sampel B1 B2 G1 G2
ULANG AN 2 Isolat Aspergillus flavus JCM PDB (+) H7 369,1 -nd- --nd-- 3,7 PDB (+) H9 652,6 -nd- --nd-- 7,8 PDB (+) H12 847,7 17,9 --nd-- --nd-- PDB (+) H14 447,7 0,9 --nd-- --nd-- PDB (+) H16 74,7 -nd- --nd-- --nd-- Isolat Aspergillus flavus lokal S.26 PDB H7 290,2 --nd-- --nd-- --nd-- PDB H9 935,8 --nd-- --nd-- --nd-- PDB H12 596,2 --nd-- --nd-- --nd-- PDB H14 148,6 4,7 304,2 --nd-- PDB H16 201,5 82,6 1.772,3 --nd-- a
High Performance Liquid Chromatography menggunakan fase gerak isokratik metanol:asam asetat
glasial:akubiades (15:20:65), laju alir:1,2 mL/menit, volume injeksi: 20µL, detektor: fluoresen λem (425
nm), λeks (365 nm), kolom C18µBondapack (3,9x300 mm). Nilai %SBR=0,21-2,00%. Analisis ANOVA
one-variant (fhitung=0.04953) menunjukkan kedua sampel (S.26 dan JCM) tidak berbeda nyata.
bmedia PDB (Potato Dextrose Broth) dengan pH awal 4.00
cSampel merupakan ulangan kedua dari lima ulangan
dpart per billion
Analisis menggunakan HPLC mampu mendeterminasi kandungan aflatoksin dalam sejumlah sampel dengan lebih akurat (Ruiqian et al. 2004). HPLC merupakan alat berbasis-kimia untuk kuantifikasi dan analisis sejumlah komponen kimia dalam suatu campuran kimiawi. Alat tersebut memiliki banyak kegunaan dan dapat diotomatisasi dengan mudah meskipun aplikasi yang lebih luas menjadi terbatas karena prosedurnya yang kompleks dan peralatannya yang mahal. Meskipun demikian, aplikasi pada penelitian yang beragam mampu menjadikan metode HPLC sebagai metode yang paling banyak dilakukan dalri seluruh metode kromatografi (Skoog et al. 2007). Hasil analisis aflatoksin pada kedua sampel dimulai pada sampel H-7 seperti dapat dilihat pada Gambar 17.
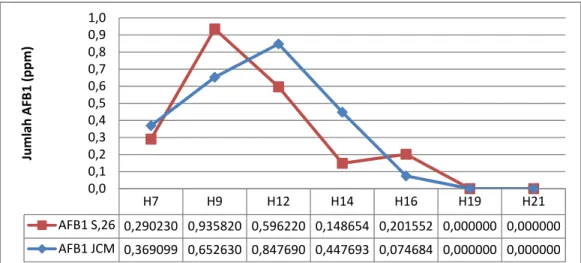
Gambar 17. Kurva produksi aflatoksin B1 isolat S.26 dan JCM pada media PDB (pH 4,00 dan suhu inkubasi 25°C) dengan interval h7-h21.
Hasil analisis menunjukkan bahwa kedua sampel memiliki nilai dan waktu produksi maksimum yang berbeda. Sampel isolat lokal memiliki nilai produksi toksin maksimum sebesar 935,8 ppb yang diperoleh pada H-9 sedangkan sampel isolat JCM memproduksi aflatoksin sebesar 847,7 ppb yang diperoleh pada H-12. Hasil tersebut dapat dibandingkan dengan percobaan yang dilakukan oleh Aryantha et al. (2007) yang menghasilkan aflatoksin sebesar 1090,1 ppb. Kandungan aflatoksin sampel isolat lokal S.26 mengalami penurunan apabila dibandingkan dengan hasil seleksi yang diperoleh menggunakan teknik ELISA, yakni sebesar 1.212,3 ppb. Hal tersebut mnegindikasikan adanya kemungkinan hasil kesalahan positif pada uji seleksi. Penurunan nilai produksi maksimum aflatoksin juga mungkin disebabkan oleh adanya pengaruh dari berbagai faktor yang membedakan sampel uji HPLC dengan sampel yang digunakan dalam seleksi. Sampel yang dianalisis menggunakan HPLC telah mengalami penyegaran dalam media padat agar miring dan berbagai serial transfer dalam proses persiapan dan pembiakan. Hal tersebut bisa mempengaruhi kemampuan sampel dalam meproduksi toksin. Strain dari Aspergillus flavus seringkali mengalami degenerasi melalui perlakuan serial transfer pada media berkultur yang menyebabkan perubahan morfologi seperti penurunan sporulasi pada area hifa, serta ketidakmampuan untuk memproduksi sklerotia diiringi penurunan produksi aflatoksin (Horn et al.. 2001).
Aspergillus flavus diketahui dapat tumbuh secara aseksual dengan baik dalam kondisi laboratorium, meskipun demikian populasinya secara alamiah sangat poliformik (Hedayati et al. 2007). Reddy et al. (1971) menyatakan bahwa produksi aflatoksin pada media sintetis untuk pertumbuhan fungi secara umum lebih rendah dari produksi pada media crude seperti media padat jagung maupun media sintetis dengan ekstrak crude. Bilgrami et al. (1988) memberikan postulasi bahwa penurunan produksi aflatoksin pada kondisi laboratorium bisa disebabkan oleh minimnya paparan terhadap lingkangan kompetitif dan kondisi stres seperti terdapat di alam. Penurunan produksi aflatoksin setelah melalui serial transfer di laboratorium mungkin dapat diartikan pada level populasi dimana seleksi lebih memilih varian Aspergillus yang tidak menghasilkan aflatoksin. Horn et al. (2001) menjelaskan bahwa dalam populasi di alam, kondisi lingkungan yang tidak menguntungkan cenderung memilih spesies tipe liar (wild type) dan
H7 H9 H12 H14 H16 H19 H21 AFB1 S,26 0,290230 0,935820 0,596220 0,148654 0,201552 0,000000 0,000000 AFB1 JCM 0,369099 0,652630 0,847690 0,447693 0,074684 0,000000 0,000000 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 Jumlah AFB 1 (ppm)
40 menyingkirkan spesies-spesies yang umumnya hanya dapat diamati di laboratorium. Meskipun demikian, efek yang lebih jelas dari kompetisi dan kondisi yang tidak menguntungkan bagi Aspergillus flavus seringkali sulit untuk dideteksi karena keberagaman yang tinggi dalam produksi aflatoksin pada tiap sampel.
Produksi aflatoksin sangat dipengaruhi oleh berbagai faktor antara lain karakteristik biologis dan kimiawi spesies, substrat, dan lingkungan seperti iklim dan faktor geografis, serta faktor-faktor lain meliputi temperatur, kelembaban, cahaya, aerasi, pH, sumber karbon dan nitrogen, faktor stress, lipida, trace metal salt, tekanan osmosis, potensi oksidasi-reduksi, dan komposisi kimiawi dari nutrien yang diberikan (Yu et al. 2002; Ruiqian et al. 2004; Hedayati et al. 2007; Martins et al. 2008).
Selain itu, pengelompokkan gen mengindikasikan bahwa produksi aflatoksin memiliki kaitan dengan fungsi kelangsungan hidup kapang. Meskipun demikian, hal tersebut masih belum sepenuhnya dipahami mengingat tidak semua Aspergillus flavus menghasilkan aflatoksin namun masih tetap dapat bersaing dengan Aspergillus flavus dalam relung yang sama (Yu et al. 2002). Berbeda dengan biosintesis kebanyakan metabolit sekunder lainnya, ekpresi gen aflatoksin terbantu dengan adanya karbohidrat sederhana seperti glukosa, sukrosa, dan maltosa, namun bukan oleh pepton maupun laktosa. Chiou et al. (2002) Melaporkan bahwa dari 18 enzim yang terlibat dalam reaksi biosintesis aflatoksin, gen Afi-J merupakan gen yang menentukan produktivitas aflatoksin. Apabila gen tersebut terganggu atau inaktif, produksi aflatoksin akan menurun dengan sangat signifikan bahkan sampai tidak memproduksi aflatoksin samasekali.
Yu et al. (2002) lebih lanjut menyatakan bahwa beberapa faktor nutrisi dan lingkungan tersebut dapat mempengaruhi akumulasi aflatoksin dengan mengubah aktivitas dari satu atau lebih enzim yang terlibat dalam biosintesis aflatoksin. Ruiqian et al. (2004) menyatakan bahwa aflatoksin hanya diproduksi pada temperatur 12-42˚C dengan temperatur optimal 25-35˚C. Produksi aflatoksin umumnya lebih optimum dalam kelembaban tinggi. Sebagai misal, kelembaban udara maksimum untuk produksi aflatoksin pada jagung adalah 25% pada 30˚C dengan kelembaban relatif bervariasi dari 83-88%. Kandungan O2 dan CO2 juga mempengaruhi pertumbuhan kapang dan produksi aflatoksin. Penurunan kandungan CO2 dalam udara sebesar 20% akan menekan produksi aflatoksin dan pertumbuhan kapang. Penurunan kandungan O2 dalam udara sebesar 10% juga akan menekan produksi aflatoksin. Meskipun demikian, pertumbuhan kapang dan produksi aflatoksin hanya akan benar-benar terhenti pada kandungan O2 dalam udara kurang dari 1% (Ruiqian et al. 2004). Kemampuan Aspergillus untuk memproduksi aflatoksin bergantung pada sistem metabolismenya, terutama metabolisme primer lipida dan enzim-enzim synthetase spesifik untuk memproduksi metabolit sekunder (Martins et al. 2008). Hal tersebut merupakan ciri-ciri spesifik yang unik dari tiap strain sehingga strain-strain yang berbeda dapat memberikan hasil yang berbeda dimana beberapa strain-strain mampu memproduksi aflatoksin, terutama aflatoksin B1 dan B2, dalam jumlah besar sementara beberapa strain yang lain tidak (Hedayati et al. 2007).
Hasil pengamatan dengan TLC dan HPLC menunjukkan bahwa kadar aflatoksin dapat turun bahkan sampai tidak terdeteksi pada beberapa ulangan. Secara alami produsen aflatoksin, yakni beberapa strain Aspergillus sp. tertentu mampu melakukan proses biodegradasi dari aflatoksin. Ciegler et al. (1966) menyatakan bahwa degradasi aflatoksin merupakan suatu proses kompleks yang melibatkan beberapa parameter. Beberapa penulis menyatakan bahwa toksin digunakan sebagai sumber energi ketika karbohidrat yang tersedia sudah habis. Meskipun demikian hal tersebut nampaknya kurang tepat ketika Ciegler et al. (1966) melaporkan bahwa
penambahan karbohdrat setelah produksi maksimum toksin tercapai tidak mencegah degradasi toksin.
Ciegler et al. (1966) lebih lanjut menyatakan bahwa lisis miselia diperlukan untuk terjadinya degradasi aflatoksin. Beberapa strain Aspergillus flavus yang tidak menunjukkan kemampuan mendegradasi aflatoksin sebelumnya bisa diinduksi untuk melakukan degradasi dengan melakukan fragmentasi pada miselianya. Sementara itu, strain yang mampu mendegradasi toksin dapat dicegah dengan menempatkan strain tersebut dalam kondisi dimana miselia lisis sulit untuk terjadi. Pengamatan lebih lanjut menyimpulkan adanya sebuah reaksi non-spesifik pada miselia yang telah lisis.
Sementara itu, Hamid dan Smith (1987) menyatakan bahwa terhambatnya degradasi toksin pada miselia yang utuh dan tidak lisis mengindikasikan adanya sejenis sistem enzim cytochrome P-450 monooxygenase dalam proses biodegradasi aflatoksin. Meskipun demikian, peranan spesifik enzim tersebut dalam lajur degradasi aflatoksin masih membutuhkan penelitian lebih lanjut. Penelitian lainnya juga menunjukkan keberadaan sistem enzim tersebut pada Aspergillus flavus, meskipun demikian lokasi yang tepat dari aktivitas enzim tersebut dalam jalur degradasi toksin masih belum diketahui.
Azab et al. (2005) menyatakan bahwa fragmentasi miselia sangat penting untuk biodegradasi aflatoksin, dimana fragmentasi akan melepaskan faktor intraselular yang bertanggung jawab untuk proses biodegradasi aflatoksin. Hasil biodegradasi fungi mengungkapkan bahwa laju degradasi tercepat diasosiasikan dengan miselia fungi berusia sembilan hari baik pada spesies Aspergillus flavus maupun Aspergillus parasiticus. Persentase aflatoksin yang mengalami biodegradasi dapat dilihat pada Gambar 18.
Gambar 18. Persentase aflatoksin yang mengalami biodegradasi oleh Aspergillus flavus dan Aspergillus parasiticus yang mengalami fragmentasi miselium (Sumber: Azab et al. 2005)
42 Hasil pengamatan pada kromatogram sampel juga menunjukkan adanya komponen-komponen lain baik yang tidak teridentifikasi maupun komponen-komponen aflatoksin selain aflatoksin B1 yang berasal dari reaksi silang yang mungkin terjadi selama proses seleksi. Hal tersebut menjadikan kemurnian aflatoksin dalam sampel belum mencukupi untuk dijadikan standar. Proses purifikasi lebih lanjut masih dibutuhkan untuk mencapai kemurnian standar yang diinginkan.
Penelitian yang sejenis pernah dilakukan oleh Reddy et al. (2009). Hasil penelitian Reddy et al. (2009) menunjukkan bahwa dari 85 strain Aspergillus flavus yang diseleksi, hanya 51% strain yang mampu menghasilkan aflatoksin B1 sebesar 200-40000 pbb dalam uji ELISA dari isolat yang ditumbuhkan pada medium YES. Hasil tersebut secara komparatif menunjukkan potensi yang jauh lebih besar dibandingkan hasil yang diperoleh pada penelitian ini yakni sebesar 17,7-1213,3 ppb. 5 sampel dengan nilai produksi aflatoksin tertinggi ditumbuhkan pada media padat beras dan menunjukkan hasil yang lebih tinggi dalam kisaran 13000-415000 ppb. Hal tersebut sesuai dengan pendapat Reddy et al. (1971) yang menyatakan bahwa produksi aflatoksin pada crude media umumnya lebih tinggi dari media sintetis.
Reddy et al. (2009) juga menemukan adanya medium yang tidak menunjukkan produksi aflatoksin pada isolat yang ditumbuhkan, yakni medium AFPA (Aspergillus flavus and parasiticus agar). Seperti halnya medium GAN termodifikasi yang tidak menunjukkan produksi aflatoksin pada penelitian ini, diduga medium AFPA tidak cocok untuk mendukung produksi aflatoksin dari isolat yang digunakan. Secara umum penelitian yang dilakukan Reddy et al. (2009) mampu menghasilkan produksi aflatoksin yang jauh lebih tinggi dibandingkan penelitian ini. Produksi aflatoksin B1 yang tinggi dari strain Aspergillus flavus potensial bisa membantu menghasilkan standar murni untuk analisis kontaminasi aflatoksin pada beras di pasar domestik dan ekspor (Reddy et al. 2009).