92 BAB II
TINJAUAN PUSTAKA
2.1 Definisi Gastritis
Secara sederhana definisi gastritis adalah proses inflamasi pada mukosa dan submukosa lambung secara histopatologi. Sedangkan definisi lain dari gastritis adalah proses inflamasi pada mukosa dan submukosa lambung sebagai respon terhadap jejas (injury) yang dapat bersifat akut maupun kronik.1,16
Mukosa lambung terdiri dari sel-sel yang memproduksi asam dan enzim. Asam dan enzim ini akan berperan dalam pencernaan makanan, sedangkan mukus berperan dalam melindungi mukosa lambung dari asam. Ketika mukosa mengalami inflamasi, maka produksi asam, enzim dan mukus akan terganggu. Gastritis merupakan gangguan kemerahan pada mukosa yang nampak pada saat pemeriksaan endoskopi dan tidak bisa mengantikan istilah dispepsia. Sampai saat ini masih belum jelas hubungan antara gambaran mikroskopi (histopatologi) dengan keluhan pada lambung. Hubungan antara gambaran mikroskopi dengan endoskopi juga tidak konsisten. Pada kebanyakan pasien dengan gambaran gastritis pada pemeriksaan PA sering tidak meunjukkan kelainan saat endoskopi.17
A.Struktur normal, B.Erosi superfisial, C.Erosi dalam, D.Ulkus gaster akut, E.Ulkus gaster kronik
Gambar 2.1. Struktur potong lintang dinding gaster (Toljamo K, 2012).
93
Gastritis merupakan masalah kesehatan yang umum ditemui dalam pelayanan klinis. Sekitar 10% kunjungan pada unit gawat darurat merupakan kasus gastritis. Berdasarkan penelitian WHO (Word Health Organization) dilaporkan prevalensi gastritis dibeberapa negara sebagai berikut : Inggris 22%, China 31%, Jepang 14,5%, Kanada 35% dan Perancis 29,5%. Sekitar 1,8-2,1 juta penduduk mengalami gastritis setiap tahunnya.18,19
Angka kejadian gastritis di Indonesia menurut WHO adalah 40,8% dan merupakan salah satu dari sepuluh penyakit terbanyak pada pasien rawat inap di rumah sakit.18
2.3 Etiologi Gastritis
Terdapat beberapa penyebab gastritis diantaranya infeksi kuman Heliobacter pylori (H.pylori) ; gangguan fungsi sistem imun ; infeksi virus seperti : enteric rotavirus, calicivirus dan cytomegalovirus ; infeksi jamur seperti : candida species, histoplasma capsulatum dan mukonacea serta obat anti inflamasi nonsteroid, konsumsi alkohol, usia, stress oleh karena trauma, tindakan operatif, luka bakar, dll.16
Infeksi kuman H.pylori merupakan penyebab gastritis yang sangat penting. Prevalensi infeksi H.pylori pada orang dewasa di negara berkembang ± 90%. Di Indonesia, prevalensi kuman H.pylori yang dinilai melalui pemeriksaan urea breath test pada pasien dispepsia menunjukkan jumlah yang menurun.16
Gastritis dapat muncul secara tiba-tiba (gastritis akut) ataupun membutuhkan waktu yang lama (gastritis kronik). Gastritis akut adalah proses inflamasi akut pada mukosa lambung biasanya berupa kondisi erosi dan hemorgik. Penyebab yang paling sering diantaranya Non Steroid Anti Inflammatory Drugs (NSAIDs), kortikosteroid, paparan zat kimia berupa alkohol, kondisi stress seperti luka bakar berat, myocard infarction, lesi intrakaranial dan periode postoperatif, kemoterapi dan iskemia. Secara endoskopi berupa hiperemis mukosa dengan erosi multipel, kecil dan superfisial serta dapat juga ditemukan ulkus. Secara mikroskopi dapat ditemukan epitel superfisial injury dan nekrosis pada kelenjar superfisial. Perdarahan pada lamina propria dapat ditemukan. Sel-sel inflamasi dijumpai dalam jumlah kecil, meskipun neutropil lebih dominan. Pada kasus ringan, pasien biasanya asimptomatik atau hanya memiliki gejala dispepsia ringan. Pada kasus sedang sampai berat, biasanya pasien dengan nyeri ulu hati, mual, muntah, hematemesis dan melena. Pada kasus berat, pasien biasanya telah mengalami ulkus yang dalam dan komplikasi berupa perforasi.20
94
jarang ditemukan. Mukosa dapat menunjukkan perubahan ke arah metaplasia intestinal. Pada stadium akhir, mukosa atropi dan sel-sel parietal tidak ditemukan, namun H. Pylori dapat ditemukan. Gejala gastritis kronik dapat asimtomatik. Beberapa gejala yang dapat ditemukan berupa : nyeri epigastrium ringan, mual dan tidak nafsu makan. Pemeriksaan endoskopi perlu dilakukan oleh karena gastritis kronik berisiko terhadap terjadinya ca gaster. Pasien gastritis tipe A, memiliki kelainan autoimun pada organ lain khususnya penyakit tiroid.20
Etiologi gastritis oleh Rugge (2011) atas dasar agen yang ditransmisikan yaitu : kimiawi, fisik, faktor imun, dan idiopatik. Rugge juga membagi etiologi gastritis berdasarkan 3 bentuk utama antara lain gastritis H.pylori, gastritis kimiawi, dan gastritis autoimun. Lalu Toljamo (2012) mengelompokkan etiologi gastritis menjadi 3 kelompok yaitu agen kimiawi, penyakit, dan faktor fisik/mekanik. Adapun Adibi (2014) menuliskan etiologi gastritis menjadi 2 bagian besar yaitu gastritis H. pylori dan gastritis non H. pylori.21,22
2.3.1 Etiologi Gastritis Berdasarkan Agen yang Ditransmisikan, Kimiawi, Fisik, Imun, dan Idiopatik
Berikut ditampilkan tabel etiologi gastritis yang ditulis oleh Rugge (2011).21
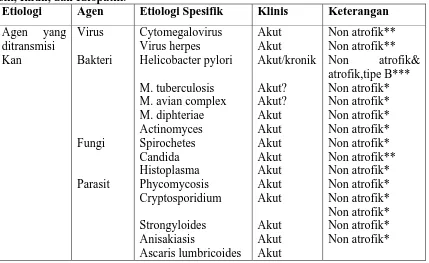
Tabel 2.1. Etiologi Gastritis Berdasarkan Agen yang Ditransmisikan, Kimiawi, Fisik, Imun, dan Idiopatik.21
Etiologi Agen Etiologi Spesifik Klinis Keterangan
95
Agen Fisik Radiasi Akut/kronik Non atrofik &
atrofik*
Idiopatik Crohn’s disease
Sarkoidosis
Keterangan: prevalensi : *** tinggi, ** rendah, * sangat rendah
2.3.2 Etiologi Utama
Adibi P menulis ada 2 etiologi utama dari gastritis yaitu gastritis H.pylori dan gastritis non H.pylori (Adibi, 2014). Berbagai macam penyebab terjadinya gastritis non H.pylori antara lain:22
1. Gastritis kimiawi i. Gastritis alkoholik
ii. Gastritis yang diinduksi obat
96
iii. Gastritis refluks (empedu atau duodenal juice) iv. Gastritis kimiawi lainnya
2. Gastritis radiasi 3. Gastritis alergi 4. Gastritis autoimun
5. Bentuk khusus gastritis, gastritis NOS/ unspecified 6. Duodenitis
2.4 Klasifikasi Gastritis
2.4.1 Klasifikasi Gastritis secara Makroskopis
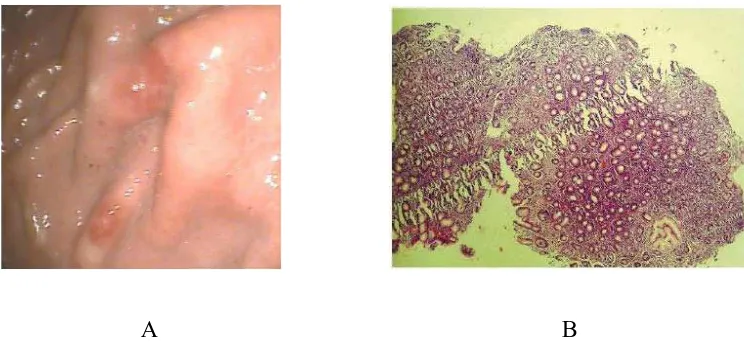
Klasifikasi ini membagi gastritis menjadi gastritis erosiva dan gastritis non erosiva. Gastritis erosiva merupakan erosi mukosa gaster disebabkan kerusakan/ defek pertahanan mukosa. Umumnya bersifat akut, bisa dengan perdarahan, namun bisa bersifat subakut atau kronik dengan sedikit gejala atau asimtomatis. Paling sering disebabkan oleh NSAID, alkohol, stres. Penyebab lain yang jarang seperti radiasi, infeksi virus, injuri vaskular, dan trauma langsung. Erosi superfisial dan lesi mukosa punktata bisa terjadi. Erosi dalam, ulkus, bahkan perforasi terjadi pada kasus berat atau yang tidak ditangani. Lesi khas muncul di korpus, tetapi antrum juga bisa terlibat. Ciri khas dari gastritis erosiva adalah lesi mukosa tidak menembus lapisan mukosa muskularis. Sementara gastritis non-erosiva mengacu pada kelainan histologis yang terutama akibat infeksi H.pylori. Kebanyakan pasien gastritis non-erosiva asimtomatis.23
A B
Gambar 2.2. A. Gastritis erosiva (Szoke D, 2009), B. Biopsi gaster menunjukkan erosi epitel permukaan dengan pembesaran 40x (Garg B, et al, 2012).
97
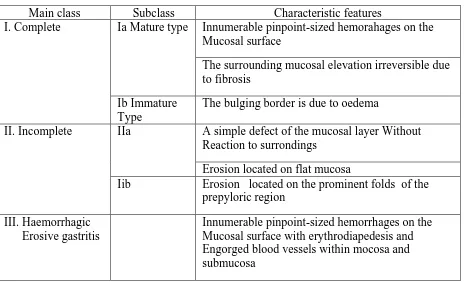
Klasifikasi ini membagi gastritis menjadi gastritis komplit dengan tipe matur dan imatur, gastritis inkomplit, serta gastritis erosif hemoragik.24
Tabel 2.2 Klasifikasi gastritis berdasarkan endoskopi24
Main class Subclass Characteristic features
I. Complete Ia Mature type Innumerable pinpoint-sized hemorahages on the
Mucosal surface
The surrounding mucosal elevation irreversible due to fibrosis
Ib Immature Type
The bulging border is due to oedema
II. Incomplete IIa A simple defect of the mucosal layer Without
Reaction to surrondings
Erosion located on flat mucosa
Iib Erosion located on the prominent folds of the
prepyloric region
III. Haemorrhagic Erosive gastritis
Innumerable pinpoint-sized hemorrhages on the Mucosal surface with erythrodiapedesis and Engorged blood vessels within mocosa and submucosa
2.5 Gastritis H.pylori
H.pylori pertama kali ditemukan oleh Robin Warren dan Marshall pada tahun 1983. H.pylori merupakan bakteri gram negatif yang ditemukan pada permukaan epitel lambung yang menginfeksi sekitar 50% dari populasi umum. H.pylori bersifat mikroaerofilik, berbentuk batang melengkung, berukuran panjang 1-3 µm dan lebar 0,3-0,6 µm serta berflagella pada satu ujung polenya. Bakteri ini memiliki adaptasi yang sangat baik pada kondisi asam. H.pylori mengekskresikan urease yang berperan dalam merubah urea menjadi amonia sehingga pH gaster meningkat. H.pylori juga dapat menghindari kontak dengan gastric juice yang bersifat asam melalui crossing lapisan tebal dari mukus dengan menggunakan flagelnya.25
Epidemiologi H.pylori sekitar 50% populasi di dunia. Di negara barat seperti USA, prevalensi H.pylori < 30% pada usia < 30 tahun dan > 75% pada usia > 60 tahun. Di Asia, prevalensi H.pylori sangat tinggi namun jika dihubungkan dengan munculnya ca gaster berbeda pada masing-masing daerahnya.25
98
Gejala klinis pada gastritis kronik biasanya asimtomatik. Tetapi pada gastritis akut oleh karena H.pylori biasanya berupa nyeri perut, mual, muntah dan kembali pulih setelah beberapa hari. Gejala khas gastritis kronik oleh karena H.pylori biasanya nyeri epigastrium, disertai kram, mual dan muntah.26,27
Gambar 2.3. Perjalanan alamiah infeksi Helicobacter pylori.28
Indikasi diagnosis dan terapi dari infeksi H.pylori berdasarkan American College of Gastroenterology guideline the management of H.pylori dpat dilihat pada tabel berikut :
Tabel 2.3 Indikasi diagnosis dan terapi H.pylori
Kondisi
• Active peptic ulcer disease (gastric or duodenal ulcer)
• Riwayat penyakit peptic ulcer ( tidak pernah diobati untuk H.pylori)
• Gastric Malt lymphoma (low grade)
• Setelah reseksi gaster oleh karena kanker gaster stadium awal
99
• Nonulcer dyspepsia
• Gastroesofageal Reflux Disease (GERD)
• Pengguna Nonsteroidal Antiinflammatory Drugs
• Anemia Defisiensi Besi
• Populasi yang memilik risiko tinggi Ca gaster
Nonulcer dyspepsia (Functional dyspepsia) merupakan kontroversi oleh karena pemeriksaan dan terapi H.pylori bergantung secara individu meliputi : usia, riwayat penggunaan NSAID, malignansi lambung (suku, riwayat keluarga men derita kanker lambung). Sedangkan GERD tidak direkomendasikan untuk diagnostik dan terapi H.pylori langsung oleh karena terdapat pendapat yang menyatakan terjadi perburukan atau perbaikan GERD pada terapi H.pylori. Pada pengguna NSAID, diagnostik dan terapi H.pylori didasarkan pada hasil yang diperoleh. Pada anemia defisiensi besi, penurunan jumlah besi biasanya disebabkan oleh karena H.pylori biasanya menyebabkan pangastritis sehingga terjadi kondisi achlorhydria dan sekresi asam ascorbat menurun dan berefek terhadap penurunan absorbsi zat besi. Selain itu juga biasanya disertai dengan occult bleeding oleh karena gastritis erosiva dan pnggunaan zat besi yang meningkat oleh H.pylori. Namun dari beberapa penelitian dilaporkan bahwa tidak terdapat hubungan sebab akibat antara H.pylori dengan anemia defisiensi besi. Pada populasi yang memiliki risiko tinggi terhadap H.pylori masih terdapat kontroversi diagnostik dan terapi H.pylori.29
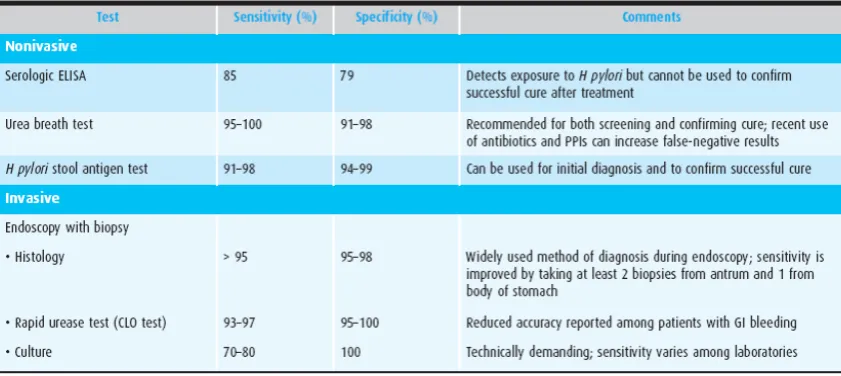
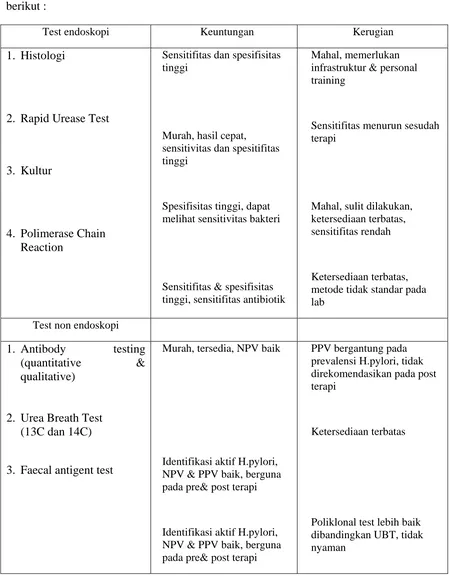
Metode diagnostik untuk mendeteksi kuman H.pylori dibagi menjadi pemeriksaan invasif dan pemeriksaan non invasif. Beberapa metode telah dikembangkan untuk mendeteksi keberadaan infeksi kuman H. pylori, yang dapat dilihat pada tabel di bawah ini.27,29
100
Selain tabel di atas, terdapat keuntungan dan kerugian dari penggunaan masing-masing test untuk diagnostik H.pylori. Keuntungan dan kerugian tersebut dapat dilihat pada tabel berikut :
Test endoskopi Keuntungan Kerugian
1. Histologi
2. Rapid Urease Test
3. Kultur metode tidak standar pada lab
3. Faecal antigent test
Murah, tersedia, NPV baik
Identifikasi aktif H.pylori, NPV & PPV baik, berguna pada pre& post terapi
Identifikasi aktif H.pylori, NPV & PPV baik, berguna pada pre& post terapi
PPV bergantung pada prevalensi H.pylori, tidak direkomendasikan pada post terapi
Ketersediaan terbatas
Poliklonal test lebih baik dibandingkan UBT, tidak nyaman
Tabel 2.5 Keuntungan dan kerugian test H.pylori 29
101
Sekitar 14% pasien tidak mengalami infeksi di antrum namun memiliki H.pylori di suatu tempat di lambung, terutama jika pasien tersebut mengalami atrofi gaster, metaplasia intestinal, ataupun refluks empedu. Selain itu, pasca-eradikasi dengan efektivitas parsial, infeksi dalam kadar rendah dapat terlewatkan pada biopsi melalui endoskopi. Hal ini menimbulkan overestimasi efikasi eradikasi dan tingkat reinfeksi. Penghambat pompa proton mempengaruhi pola kolonisasi H.pylori di lambung dan mengurangi akurasi biopsi di antrum. Oleh karena itu, pedoman konsensus merekomendasikan untuk dilakukan biopsi multipel dari antrum dan korpus untuk histologi dan satu untuk metode lain (baik kultur maupun pemeriksaan urease).29
2.5.1 Pemeriksaan invasif
1. Histologi. Meskipun H.pylori dapat dikenali dari bagian yang diwarnai dengan
hematoksilin dan eosin saja, dibutuhkan pengecatan tambahan (seperti Giemsa, Genta, Gimenez, perak Warthin-Starry, violet Creosyl) untuk mendeteksi infeksi dalam kadar rendah dan untuk menunjukkan karakteristik morfologi H.pylori. Keuntungan pemeriksaan secara histologi selain dapat disimpan, irisan dari biopsi dapat diperiksa kapanpun; dan adanya gastritis, atrofi, ataupun metaplasia intestinal dapat pula diperiksa. Spesimen biopsi dari bagian lain lambung dapat disimpan dalam formalin untuk diproses hanya jika histologi antrum tidak dapat disimpulkan.29
2. Kultur. Isolasi mikrobiologi adalah baku emas teoritis untuk identifikasi infeksi
bakteri, namun kultur H.pylori kurang dapat dipercaya. Risiko pertumbuhan berlebih maupun kontaminasi membuatnya kurang sensitif, dan metode ini adalah metode yang paling tidak mudah dikerjakan bersama endoskopi. Meskipun hanya sedikit pusat kesehatan yang secara rutin menawarkan isolasi mikrobiologis H.pylori, prevalensi strain multiresisten membuat metode kultur dan uji sensitivitas terhadap antibiotik menjadi persyaratan bagi pasien dengan infeksi persisten dengan kegagalan terapi.29
3. Uji urease. Metode ini bersifat cepat dan sederhana untuk deteksi infeksi H.pylori
102
pada pasien dengan perdarahan saluran cerna atas. Namun kondisi tersebut dapat diperbaiki dengan menempatkan beberapa sampel biopsi di dalam satu vial untuk pemeriksaan. 29
2.5.2 Pemeriksaan non-invasif
1. Serologi. Infeksi H.pylori menimbulkan respon mukosa lokal dan antibodi sistemik.
Antibodi IgG terhadap H.pylori dalam sirkulasi dapat dideteksi melalui antibodi enzyme linked immunosorbent assay (ELISA) atau uji aglutinasi lateks. Pemeriksaan tersebut umumnya sederhana, reprodusibel, tidak mahal, dan dapat dilakukan terhadap sampel yang disimpan. Metode ini banyak digunakan dalam studi epidemiologi, termasuk studi retrospektif untuk menentukan prevalensi maupun insiden infeksi. Individu sangat bervariasi terkait respon antibodi terhadap antigen H.pylori, dan tidak ada antigen yang sama yang dapat dikenali melalui serum dari semua subyek. Oleh karena itu akurasi pemeriksaan serologis bergantung kepada antigen yang digunakan sehingga penting untuk melakukan validasi lokal terhadap ELISA H.pylori. Pada orang tua dengan infeksi yang telah berlangsung lama, gastritis atrofi dikaitkan dengan hasil negatif palsu. Konsumsi obat anti-inflamasi non-steroid juga dilaporkan mempengaruhi akurasi ELISA. Titer antibodi turun secara perlahan pasca-keberhasilan eradikasi sehingga serologi tidak dapat digunakan untuk menentukan eradikasi H.pylori ataupun untuk menentukan tingkat reinfeksi. Meskipun titer antibodi IgM terhadap H.pylori menurun seiring bertambahnya usia, tidak ada assay yang menunjukkan akuisisi baru. Karena infeksi ini biasanya asimtomatik, sulit untuk mengidentifikasi dan menegakkan jalur transmisi. Keuntungan metode serologi adalah perkembangan uji finger prick yang menggunakan assay fase solid terfiksir untuk mendeteksi adanya imunoglobulin H.pylori. Near patient test (NPT) dapat dilakukan di pusat kesehatan primer dan lebih sederhana dibanding 13C-urea breath test yang merupakan satu-satunya NPT yang digunakan saat ini. Namun akurasi NPT serologis lebih rendah dibanding yang dilaporkan untuk pemeriksaan ELISA standar menggunakan preparat antigen yang sama. Pemeriksaan ini sering digunakan untuk menenangkan pasien, namun saat ini belum ada studi yang membandingkan akurasi, efektivitas biaya, dan nilai jaminan dari 13C-urea breath test dengan NPT serologis di pusat kesehatan primer.29
103
dihidrolisasi secara cepat di sepanjang mukosa lambung dan melalui sirkulasi sistemik, diekskresikan sebagai 13CO2 dalam udara ekspirasi. Pemeriksaan ini mendeteksi infeksi saat ini dan tidak bersifat radioaktif, dapat digunakan sebagai uji skrining untuk H.pylori, menilai eradikasi, dan mendeteksi infeksi pada anak. Pemeriksaan 14C-urea breath test mirip dengan 13C-urea breath test namun bersifat radioaktif dan tidak dapat dilakukan di pusat kesehatan primer.29
3. Faecal antigen test. Dalam pemeriksaan antigen di feses, ELISA sandwich sederhana
digunakan untuk mendeteksi keberadaan antigen H. pylori yang terbungkus feses. Studi melaporkan sensitivitas dan spesifisitas yang mirip dengan 13C-urea breath test (>90%), dan teknik ini berpotensi untuk dikembangkan sebagai NPT. Keutungan utama dari pemeriksaan ini adalah dalam studi epidemiologi berskala besar terhadap akuisisi H. pylori pada anak.29
2.6 Patofisiologi Gastritis
2.6.1 Patofisiologi Gastritis secara Umum
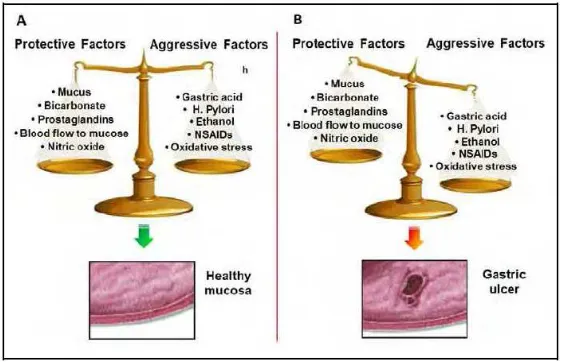
Terjadinya gastritis secara umum karena ketidakseimbangan faktor agresif dan defensif, di mana faktor agresif lebih dominan daripada faktor defensif. Yang termasuk faktor agresif antara lain asam lambung, pepsin, refluks bilier, nikotin, alkohol, NSAID, kortikosteroid, H.pylori, dan adanya radikal bebas. Yang termasuk faktor defensif antara lain mikrosirkulasi mukosa, sel epitel permukaan, prostaglandin, fosfolipid, mukus, bikarbonat, dan motilitas saluran pencernaan.30
Gambar 2.4.
Patofisiologi gastritis 31
104 2.6.2 Patofisologi Gastritis H. Pylori
H.pylori memiliki efek stimulasi terhadap respon non spesifik dan spesifik. Kolonisasi H.pylori pada mukosa gaster akan merangsang sistem imun non spesifik berupa aktivasi proinflamasi dan faktor antibakterial dari sel epitel gaster. H.pylori juga menstimulasi sistem imun spesifik yaitu selluler dan humoral. Meskipun demikian sangat sulit untuk mengeliminasi H.pylori dari mukosa gaster dan biasanya infeksi H.pylori menetap (persisten). Hal ini disebabkan H.pylori memiliki kemampuan untuk mempengaruhi respon imun untuk menghindari eliminasi serta menurunkan regulasi kerusakan jaringan. Respon H.pylori terhadap sistem imun humoral yaitu menstimulasi terbentuknya antibodi yaitu IgA dan IgG. Namun efek antibodi ini masih kontroversi yaitu melindungi sedangkan dari laporan lainnya menyebakan persistensi kolonisasi dan menghambat efek perlindungan. Sel T memiliki efek dominan dalam sistem imun
H.pylori. Sel Th1 memproduksi IFN-γ dan akan menyebabkan munculnya proinflamasi
lain seperti : TNF-α, IL-12 dan IL-18.31
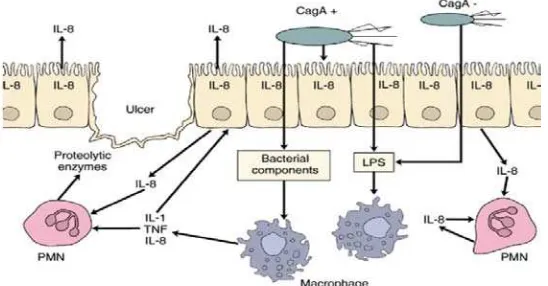
H.pylori tinggal di lapisan mukus yang melapisi epitel gaster. H.pylori mensekresikan faktor-faktor, peptida, dan lipopolisakarida yang bersifat kemotaktik terhadap neutrofil dan monosit. In vivo, infeksi H.pylori di mukosa gaster menginduksi produksi sitokin-sitokin IL-1β, IL-6, IL-8 dan TNF-α. IL-1 atau TNF-α saja, maupun TNF-α bersinergis dengan IFN-γ menginduksi produksi IL-8 di sel gaster. Peningkatan produksi IL-8 bisa disebabkan infeksi H.pylori maupun sekunder dari peningkatan kadar IL-1 atau TNF-α. Produksi IL-8 oleh sel epitel gaster berkepanjangan dapat menyebabkan rekruitmen neutrofil dan limfosit ke jaringan yang terinfeksi.23
Gambar 2.5. Imunopatogenesis infeksi H.pylori32
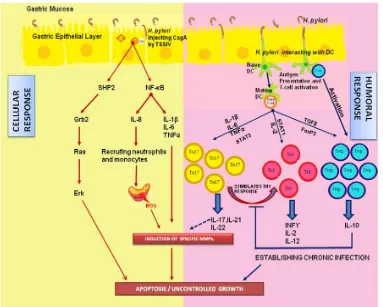
H.pylori menginduksi sitokin-sitokin proinflamasi seperti IL-1β, IL-6, TNF-α, IL-8
melalui aktivasi NF-κB. Respons inflamasi yang terjadi menyebabkan Treg
105
respon imun pejamu dan berhubungan dengan kanker. Sel T khusus tersebut mengekspresikan marker seperti CD4, CD25, dan FoxP3. Treg meningkatkan toleransi terhadap antigen diri sendiri dan pada saat bersamaan memfasilitasi pertumbuhan tumor melalui imunosupresi. Beberapa studi menyebutkan peningkatan dari TH1, TH2, Treg, mengindikasikan keseimbangan imunomodulasi pejamu untuk inflamasi. Infeksi H.pylori memiliki respon TH1 yang kuat yang dimediasi oleh sitokin TH1 termasuk IFN-γ, IL-12, TNF-α, dll. Kondisi inflamasi ini diseimbangkan dengan IL-10 dari Treg untuk menyebabkan infeksi kronik dengan imunosupresi parsial. 32
Gambar 2.6. Respons Inflamasi akibat H. pylori 32
2.6.3 Patofisologi Gastritis Non-H.Pylori
106
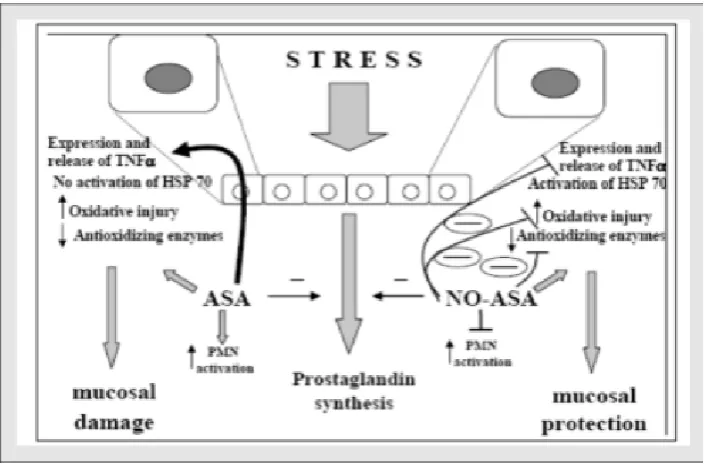
Aspirin, salah satu NSAID yang digunakan secara luas di klinis bisa menyebabkan stres ulcer dan mengeksaserbasi ulkus gaster sebelumnya. Interaksi NSAID dan stres dapat menyebabkan lesi pada gaster dengan salah satu mekanismenya adalah dengan meningkatkan sitokin inflamasi salah satunya TNF-α.34
Gambar 2.7 Pembentukan lesi gaster akibat aspirin34
107
Gambar 2.8 Pembentukan lesi gaster akibat NSAID 36
2.7 Vascular Endothelial Growth Factor (VEGF) 2.7.1 Angiogenesis
Angiogenesis adalah pembentukan pembuluh darah baru yang berasal dari pembuluh darah yang telah ada. Angiogenesis sangat dibutuhkan dalam pembentukan organ baru serta untuk diferensiasi saat embriogenesis, penyembuhan luka dan fungsi reproduksi wanita.37,38 Angiogenesis dapat dipicu oleh berbagai kondisi patologis, seperti reumatoid artritis, retinopati diabetik, degenerasi makular, psoriasis dan pertumbuhan serta metastasis tumor.38,39
Tumor membutuhkan angiogenesis untuk tumbuh di atas ukuran 1-2 mm3.38
Angiogenesis diperlukan untuk suplai oksigen, nutrien, faktor pertumbuhan dan hormon, enzim proteolitik, mempengaruhi faktor hemostatik yang mengontrol koagulasi dan sistem fibrinolitik, dan penyebaran sel-sel tumor ke tempat jauh.40
Angiogenesis merupakan proses yang sangat kompleks, yang diregulasi secara ketat oleh faktor-faktor proangiogenik (VEGF) dan faktor-faktor anti angiogenik.38,40 Suatu tumor avaskular bergantung pada difusi pasif untuk suplai oksigen dan makanan serta untuk pembuangan produk sisa. Hal ini membatasi ukuran tumor sampai sekitar 2 mm, yang disebut keadaan dorman. Sel-sel tumor yang hipoksik akan memproduksi faktor-faktor pertumbuhan, termasuk VEGF. Tumor juga memproduksi inhibitor endogen angiogenesis, seperti TGF-β. Mulanya inhibitor melebihi faktor pertumbuhan dan sel endotel tetap diam. Akan tetapi, saat tumor mampu memproduksi cukup faktor pertumbuhan dan/atau menekan ekspresi inhibitor, akan terjadi ‘angiogenic switch’
menuju proses angiogenesis.39 ‘Angiogenic switch’ merupakan pertanda proses
malignansi.40
Permulaan Angiogenesis
108
membran dasar dan mengikuti sel-sel endotel sebelumnya menuju matriks ekstraseluler. Karena itu, fungsi pertama faktor pertumbuhan angiogenik adalah menstimulasi produksi protease oleh sel-sel endotel. Hal ini merupakan faktor kunci pada rangkaian angiogenesis, sebab tanpa adanya aktivitas proteolitik, sel-sel endotel akan dihambat oleh membran dasar hingga tidak dapat keluar dari kapiler (pembuluh) induk.39
Migrasi Sel Endotel, Proliferasi dan Pembentukan Pembuluh
Setelah ekstravasasi, sel endotel terus mensekresi enzim proteolitik, yang akan mendegradasi matriks ekstraseluler. Sel endotel terus bergerak menjauhi pembuluh induk menuju tumor, membentuk tunas kecil. Sel endotel akan bertambah dari pembuluh induk hingga tunas memanjang. Awalnya tunas-tunas ini bergerak paralel satu sama lain, akan tetapi pada jarak tertentu dari pembuluh induk, mulai condong menuju tunas lainnya. Hal ini akan membentuk loop tertutup (anastomose), yang akan memungkinkan dimulainya sirkulasi pada pembuluh yang baru. Ini merupakan peristiwa penting dalam pembentukan jaringan vaskular fungsional, akan tetapi stimulus yang pasti terhadap perubahan arah tunas dan anastomosis masih belum diketahui.39
2.7.2 Famili VEGF
Famili VEGF yang secara genetik berhubungan sebagai faktor pertumbuhan angiogenik dan limfangiogenik terdiri dari 6 glikoprotein yaitu VEGF-A (biasa disebut
VEGF), VEGF-B, VEGF-C, VEGF-D, VEGF-E, dan placenta growth factor (PlGF).40
109
sirkulasi berhubungan dengan progresifitas penyakit. Hal ini menandakan bahwa ada kemungkinan untuk mengukur level VEGF dalam serum dan plasma darah.42,43,44,45
VEGF merupakan salah satu faktor penting dalam proses angiogenesis terutama pada adenokarsinoma. VEGF berkontribusi dalam neovaskularisasi tumor yang berespon untuk meningkatkan kebutuhan pengiriman nutrisi dan oksigen, hal ini dibutuhkan untuk keberlangsungan hidup sel tumor. VEGF berperan penting dalam vaskulogenesis selama embriogenesis, angiogenesis fisiologis, dan neovaskularisasi malginansi. Transkiripsi VEGF dipicu oleh hipoksia dan berbagai sinyal pertumbuhan. Sel endotel yang distimulasi oleh VEGF bermigrasi dan berproliferasi, menyebabkan peningkatan permeabilitas vaskuler, merangsang MMPs, membelah dan merekrut elemen pendukung, seperti perisit.46,47
Dalam keadaan normal, VEGF diekspresikan dalam kadar yang bervariasi oleh berbagai jaringan, termasuk di antaranya otak, ginjal, hati, dan limpa.43 Tekanan oksigen dapat berfungsi sebagai regulator VEGF. Paparan kondisi hipoksia menginduksi ekspresi VEGF dengan cepat. Sebaliknya, dalam kondisi kadar oksigen normal (normoksia), ekspresi VEGF menurun dan megalami stabilisasi. Tingkat ekspresi VEGF juga bergantung pada jumlah sitokin inflamatori dan hormon pertumbuhan, termasuk di antaranya Epidermal Growth Factor (EGF), Interleukin-1β (IL-1β), platelet derived growth factor (PDGF), tumor necrosis factor-α (TNF-α), dan transforming growth factor- β1 (TGF- β1).48
2.7.3 Peran VEGF pada Angiogenesis dan Vaskulogenesis
110
Rendahnya level oksigen dan nutrien, membatasi fungsi dan viabilitas jaringan. Respon alami terhadap keadaan iskemia jaringan adalah meningkatkan angiogenic growth factor bersama dengan pengadaan dan mobilisasi alemen-elemen seluler dalam sirkulasi untuk memfasilitasi pertumbuhan pembuluh darah baru (neovaskularisasi). Neovaskularisasi merupakan hasil dari beberapa proses yaitu vaskulogenesis, angiogenesis, dan arteriogenesis. Angiogenesis adalah sprouting kapiler baru dari kapiler yang sudah ada. Angiogenesis dirangsang terutama oleh hipoksia jaringan melalui Hypoxia-Inducable Factor (HIF)-1 expression. HIF-1 mengaktivasi transkripsi beberapa gen seperti VEGF, reseptor VEGF flt-1, neuropilin-1, dan angiopoietin-2.49
Gambar 2.9 Skema mekanisme neovaskularisasi.
A.Vaskulogenesis, pertumbuhan kapiler dari sel-sel endotel progenitor (EPC),
B. Angiogenesis, pertumbuhan kapiler baru dari pembuluh darah yang sudah ada, C. Arteriogenesis, pertumbuhan kolateral dengan remodeling dari kolateral yang sudah ada.49
2.7.4 Regulasi VEGF
Berbagai mekanisme dapat meregulasi ekspresi VEGF, yang paling penting adalah hipoksia. Studi menunjukkan hypoxia inducible factor-1(HIF-1) adalah mediator utama terhadap respon hipoksia tersebut. Berbagai studi menunjukkan bahwa berbagai faktor pertumbuhan dan sitokin dapat meregulasi ekspresi faktor angiogenik pada sel-sel tumor hingga menginduksi angiogenesis secara tidak langsung, seperti EGFR dan HER2, platelet-derived growth factor (PDGFs) dan COX-2. Beberapa onkogen berperan dalam regulasi VEGF, seperti c-src, BCR-ABL, dan ras. Gen supresor tumor p53 berperan penting dalam regulasi VEGF. Perubahan genetik yang terjadi pada p53 akan meningkatkan ekspresi VEGF.38,40
111
Hipoksia berperan penting dalam regulasi ekspresi VEGF. Hypoxia inducible factor-1(HIF-1) merupakan mediator kunci untuk respon hipoksik ini dan produk gen supresor tumor von Hipple Lindau (vHL) memiliki perang penting. Di bawah kondisi normoksik, HIF-lα secara cepat didegradasi oleh jalur ubiquitin-proteosom, suatu proses yang dikontrol oleh produk gen supresor tumor vHL. Jika vHL tidak ada atau bermutasi, HIF-lα akan bersatu dengan HIF-lβ, sehingga kompleks ini akan bentranslokasi pada nukleus dan terikat pada promotor VEGF yang mengarah pada peningkatan transkripsi VEGF.40,50,51
2). Faktor pertumbuhan dan sitokin
Beberapa studi telah menunjukkan bahwa faktor pertumbuhan dan sitokin dapat meregulasi ekspresi faktor angiogenik pada sel tumor sehingga secara tidak langsung menginduksi angiogenesis. Pentingnya sistem epidermal growth factor receptor (EGFR;ErbB1) dan HER2/neu (ErbB2) dalam regulasi VEGF dan angiogenesis telah divalidasi pada beberapa sistem tumor, termasuk karsinoma kolon, kanker pankreas, kanker lambung, kanker payudara, glioblastoma multiforme, kanker paru, dan karsinoma sel renal.40,50
Insulin-like growth factor-I receptor (IGF-IR) sering overekspresi pada beberapa kanker manusia, dan telah dihubungkan dengan agresivitas penyakit dan pembentukan metastase. Sistem model eksperimental telah menunjukkan pentingnya aktivasi sistem IGF-IR dalam menengahi angiogenesis dengan meningkatkan regulasi ekspresi VEGF pada kanker payudara, endometrium, pankreas dan kolorektal.40
Prostaglandin berperan penting dalam berbagai proses biologis, dan prostaglandin tertentu saat ini mempunyai implikasi dalam angiogenesis tumor melalui peningkatan regulasi ekspresi VEGF. Prostaglandin-endoperoxide synthase (juga dikenal dengan cyclooxigenase [COX]) merupakan enzim terbatas yang terlibat dalam transformasi oksidatif asam arakidonat menjadi berbagai senyawa prostaglandin. Dalam dekade terakhir, berbagai studi telah mengkonfirmasi hubungan antara overekspresi COX-2 dan dan progresi tumor serta peningkatan angiogenesis (ekspresi VEGF) pada berbagai keganasan solid seperti kanker lambung, colon, prostat, payudara dan pankreas. Sebagai tambahan, beberapa studi in vivo menunjukkan COX-2 menengahi ekspresi VEGF pada berbagai lapisan sel, akan tetapi hal ini kemungkinan bergantung pada jenis tumor,
karena penghambat COX-2 tidak mempunyai efek pada semua jenis tumor.40
112
Banyak onkogen telah mempunyai implikasi pada proses angiogenesis tumor solid, sebagian karena kemampuannya menginduksi faktor pertumbuhan angiogenik seperti VEGF. Protoonkogen c-src mengkode protein tyrosine kinase, yang terlibat dalam regulasi ekspresi VEGF dan dalam memajukan neovaskularisasi tumor yang sedang tumbuh. Onkogen BCR-ABL telah diidentifikasi mempunyai peran kunci dalam patogenesis molekular leukemia, yang telah dipertimbangkan sebagai keganasan yang tergantung pada angiogenesis.40
2.7.5 Aliran Darah Mikrovaskular, Regulasi, dan Respons terhadap Injuri
Endotel mikrovaskular mampu membentuk vasodilator poten seperti Nitric oxide (NO) dan prostasiklin yang melindungi mukosa gaster terhadap injuri serta melawan kerja vasokonstriktor yang bisa merusak mukosa seperti leukotrien, tromboxan A2, dan endotelin. Ketika mukosa gaster terekspos iritan terjadi peningkatan aliran darah mukosa guna menyingkirkan/ mendilusi zat tersebut.52
NO merupakan vasodilator poten yang dibentuk dari L-arginine oleh enzim NO synthase (NOS) yang diekspresikan di sel endotel. Di mukosa gaster, NO berperan penting untuk pertahanan mukosa dengan meregulasi jumlah darah yang masuk ke sirkulasi mukosa. NO melindungi mukosa gaster terhadap injuri seperti etanol, dll. Sementara menghambat NOS (menyebabkan penurunan NO) meningkatkan resiko cedera mukosa gaster.
Regenerasi mukosa setelah injuri akut terdiri dari 2 proses yaitu :52,53,54
1. Re-epitelisasi (restitusi) dan proliferasi sel
Mukosa gaster memiliki kemampuan untuk memperbaiki kerusakan. Restitusi merupakan proses sel-sel yang viabel membatasi area yang rusak dan bermigrasi untuk melapisi membran basalis. Beberapa faktor pertumbuhan terbukti menstimulasi migrasi sel dan meningkatkan aliran darah. Selain itu untuk re-epitelisasi,
memperbaiki erosi memerlukan sel epitel untuk mengisi defek mukosa,. TGF-α dan
EGF yang bersifat mitogenik terhadap sel progenitor, meningkatkan pelepasan musin gaster, menstimulasi migrasi sel.
2. Angiogenesis
113
Gambar 2.10 Proses Perbaikan Mukosa akibat Inflamasi.55
Adanya inflamasi akan meningkatkan faktor pertumbuhan untuk meningkatkan proliferasi sel guna proses penyembuhan ulkus dan perbaikan mukosa melalui peningkatan sekresi bikarbonat dan angiogenesis yang dimediasi faktor pertumbuhan proangiogenik seperti VEGF dan bFGF.55
2.7.6 VEGF pada Gastritis H. pylori
Neoangiogenesis merupakan perkembangan pembuluh darah baru dari prekursor endotelial yang ada, yang menjadi mekanisme umum yang terlibat dalam patogenesis inflamasi dan lesi epitel ulkus, dan juga pertumbuhan tumor malignan dan metastasis. Di antara faktor pro-angiogenesis sejauh ini VEGF merupakan stimulus paling poten terjadi neoangiogenesis.9
114
Gambar 2.11 Skema secara umum infeksi H. pylori pada mukosa56
(VEGF : vascular endothelium growth factor; EC : endothelial cell; TGF-β : tumor
growth factor beta; PG : prostaglandin; MMP : matrix metalloprotease; COX-2 : cyclooxygenase 2; - : inhibits; + : activates).
VEGF meningkatkan ekspresi VEGF pada sel epitel gaster manusia secara in vitro dan tampaknya efek ini bergantung pada aktivasi epidermal growth factor receptor (EGFR), MAP kinase, cyclooxygenase-2 (COX-2) mediated pathway. Kadar VEGF secara signifikan lebih tinggi pada mukosa yang terinfeksi H.pylori yaitu terutama antrum gaster. Mukosa gaster yang terinfeksi H.pylori sekitar 5,5 kali meningkat pada kadar VEGF di antrum (p< 0,05 versus mukosa antrum yang tidak terinfeksi) dan 2 kali meningkat pada korpus (p<0,05 versus mukosa korpus yang tidak terinfeksi). Dan ternyata peningkatan VEGF ini sejalan dengan jumlah pembuluh-pembuluh darah kecil baru. Jumlah pembuluh darah baru pada korpus gaster lebih tinggi pada yang terinfeksi H.pylori dibandingkan yang tidak terinfeksi walaupun secara statistik tidak signifikan. Ekspresi VEGF dan neoangiogenesis lebih terbukti pada mukosa antrum daripada korpus pada pasien yang terinfeksi H.pylori diperkirakan akibat peningkatan ekspresi dan pelepasan gastrin secara lokal dari sel G antrum. Gastrin diketahui menstimulasi ekspresi COX-2 dan hal ini menyebabkan peningkatan ekspresi VEGF.57
115
Gambar 2.12 H. pylori yang berhubungan dengan karsinogenesis melalui CagA yang menginduksi transisi mesenkimal epitel (EMT).61
H. pylori menginjeksi Cag A ke dalam sel dan mengganggu hubungan antar sel, dimana daerah yang paling terpengaruhi yaitu pada daerah apical junction compleks. Cag A ini akan mengakibatkan kehilangan polaritas antar sel dan akan menyebabkan kematian sel epitel dan terganggunya integritas sel epitel. Sel-sel epitel yang rusak harus diganti dengan sel-sel baru yang berasal dari jaringan lain. Sel-sel epitel jaringan lain harus berubah fungsi menjadi sel mesenkim yang motil dan invasif agar dapat menggantikan sel epitel pada jaringan yang rusak oleh H. pylori. Apabila membutuhkan sel-sel baru, maka program apoptosis akan dihentikan untuk mencegah jumlah sel yang ada berkurang. Dan bila terjadi pajanan Cag A secara berulang - ulang selama bertahun tahun dapat menyebabkan terjadinya karsinogenesis.61
2.7.7 VEGF pada Gastritis Non H. pylori
116 Gastritis non H. pylori
Peningkatan faktor agresif
Kerusakan endotel lambung
Perubahan morfologi, ultrastruktur dan fugsional yang mencerminkan
injuri
Kerusakan endotel mikrovaskuler menyebabkan statis mikrovaskuler, berhentinya suplai oksigen, dan
transport nutrisi
Menyebabkan iskemia dan hipoksia, sehingga terjadi nekrosis
lokal dan erosi
HIF – 1α meningkat
Migrasi sel endotel, Proliferasi, Survival
ANGIOGENESIS
Faktor agresif : etanol, NSAID, radikal bebas, asam empedu,
alkohol, dan bahan korosif
Mengaktivasi bFGF, FGF-R2 dan VEGF
Injuri mukosa gaster berhubungan dengan peningkatan signifikan 4-6x dari VEGF. Angiogenesis mukosa gaster secara bermakna distimulasi oleh VEGF, basic fibroblast growth factor (bFGF), prostaglandin E2, dan prostasiklin. VEGF merupakan faktor angiogenik poten dan mitogen spesifik sel endotel karena reseptornya (flt-1 dan flk-1) terbatas di sel endotel, walau sel lain seperti prekursor sel endotel dan beberapa sel kanker mengeskpresikan reseptor ini. VEGF (yang awalnya diidentifikasi sebagai faktor permeabilitas vaskuler) dihasilkan oleh sel otot polos vaskuler, sel tumor, dan sel endotel, dan hal ini berdampak pada stimulasi normal angiogenesis yang fisiologis untuk penyembuhan luka maupun ulkus.63
Gambar 2.13 Kejadian molekuler untuk aktivasi angiogenesis63
Keterangan : HIF-1a: hypoxia inducible factor; SRF, serum response factor; Erk, extracellular regulated protein kinase; Egr, early growth response; VEGF, vascular endothelial growth factor; bFGF, basic fibroblast growth factor; KDR, kinase domain receptor; Cox,cyclooxygenase
VEGF, bFGF, dan Ang1 menstimulasi proliferasi dan migrasi sel endotel yang
menghasilkan jaringan mikrovaskuler. Produksi VEGF distimulasi oleh PDGF, TGF-β1,
117
Peptida angiogenik Ang1, Ang2, dan reseptor spesifik endotel Tie1 dan Tie2 terlibat dalam proses angiogenik terjadi setelah kerja dari VEGF dan reseptor-reseptornya. Ang1 bekerja dengan stabilisasi pembuluh darah dan menyokong maturasi pembuluh darah sehingga Ang1 berfungsi setelah kerja dari VEGF. Ang2 mungkin tidak bekerja setelah aksi VEGF tetapi lebih mendukung fungsi VEGF dan menyebabkan rekruitmen sel otot polos vaskuler.63
2.7.8 VEGF pada Gastritis H. Pylori dengan Adenokarsinoma64
Reseptor VEGF merupakan target aksi lainnya bagi pengobatan kanker. Aktivitas reseptor VEGF akan mimicu proses angiogenesis, yaitu proses pembentukan pembuluh darah baru di sekitar tumor untuk menyuplai kebutuhan nutrisi sel. Penghambatan angiogenesis merupakan salah satu pendekatan terapi kanker, dengan cara menghentikan suplai darah ke tempat terjadinya tumor .
Sebetulnya angiogenesis adalah sebuah proses yang sehat. Tetapi pada penderita kanker, proses pembentukan pembuluh darah baru ini akan membuat tumor memiliki jaringan pembuluh darah sendiri yang akan membuatnya tumbuh dengan cepat dan ganas. Anti-angiogenesis adalah terapi yang bertujuan untuk menghentikan pembentukan pembuluh darah baru. Karena tanpa suplai darah, sel tumor/ kanker akan mati. Tanpa memiliki pembuluh darah sendiri, tumor hanya dapat tumbuh maksimal satu milimeter saja.
118 Cag A
Penderita Gastritis H. pylori
Meningkatkan berhentinya suplai oksigen, dan transport nutrisi
HIF – 1α meningkat
ANGIOGENESIS
Aktivasi sel imun (Leukosit, cytokin, growth faktor)
INFLAMASI
VEGF meningkat
Menghambat APOPTISIS
Pertumbuhan sel kanker
Sel kekurangan oksigen dan energi
HIF – 1α meningkat
ANGIOGENESIS VEGF meningkat
Gambar 2.14 Skema infeksi H. pylori dengan angiogenesis
Proses awalnya terjadi ketika manusia menghirup oksigen ke dalam tubuh. Sel tubuh manusia memerlukan oksigen yang digunakan sebagai energi menjalankan proses – proses molekuler. Kemudian oksigen tersebut dikirimkan melalui darah, dan sebagian besar sel – sel tubuh berada dalam rentang 10 milimeter dari pembuluh kapiler. Sel – sel tumor juga seperti itu, bila massa sel – sel tumor telah lebih besar dari 1 milimeter, hal tersebut menyebabkan sel kekurangan oksigen dan energi. Sel tumor akan terus berkembang bila dibentuk pembuluh darah baru (angiogenesis). Vascular endothelial growth factor atau VEGF adalah sinyal kunci yang digunakan oleh sel yang kekurangan oksigen (oxygen-hungry cells) untuk memicu pertumbuhan pembuluh darah, terutama dalam hal ini yaitu sel – sel tumor.
119
Meningkatkan lymphangiogenesis Reseptor ini selektif pada ligan C dan VEGF-D.
Gambar 2.15 Proses angiogenesis pada tumor65
Gambar 2.16 Pertumbuhan pembuluh darah baru pada tumor66
VEGF akan menempel pada vascular endothelial growth factor receptor (VEGFR). Setelah itu akan terjadi peristiwa dimerisasi atau perubahan konformasi pada VEGF reseptor. Lalu terjadi autofosforilasi atau transfosforilasi. Proses autofosforilasi ini terjadi pada tyrosine kinase reseptor yang berada di sitosol. Proses ini membutuhkan suatu fosfat, sehingga proses dapat berjalan bila fosfat menempel pada tyrosine kinase reseptor. Tirosin yang terfosforilasi (phosphotyrosine) akan bertindak sebagai tempat ikatan bagi protein lain, yaitu protein yang mengandung SH2 domains (Grb2).
120
menyebabkan pertukaran GDP dengan GTP pada suatu protein G, yaitu Ras. Nantinya Ras ini yang awalnya inaktif menjadi aktif. Ras merupakan protein penting dalam signaling RTK berfungsi mengantarkan signal dari reseptor tyrosine kinase ke dalam nukleus. Ras yang teraktivasi akan mengaktifkan kinase seluler yaitu raf-1. Kemudian Raf-1 kinase akan memfosforilasi cellular kinase yang lain yaitu MEK sehingga MEK menjadi aktif. MEK aktif ini akan diubah menjadi ERK di dalam nukleus sel. Salah satu target akhir kinase cascade adalah faktor transkripsi. Fosforilasi faktor transkripsi akan menjadi aktif dan mengikat DNA lalu akan mempengaruhi perubahan transkripsi gen. yang kemudian tumbuh dan membentuk pembuluh darah baru. Pembuluh darah baru itu akan membuat sel kanker tumbuh dengan cepat, semakin banyak mengeluarkan VEGF, dan pada gilirannya semakin memicu tumbuhnya jaringan pembuluh darah baru lagi. Ketika VEGF yang diekspresikan, dapat berkontribusi terhadap penyakit. Kanker padat tidak dapat tumbuh melampaui ukuran yang terbatas tanpa suplai darah yang cukup, kanker yang dapat mengekspresikan VEGF dapat tumbuh dan bermetastasis.
2.8 Matriks Metalloproteinase (MMPs)
Matriks metalloproteinase pertama kali diidentifikasi pada vertebra oleh Jerome Gross dan Charles M. Lapiere pada tahun 1962 yang meneliti degradasi kolagen triple-helical selama metamorfosis kecebong.67 Matriks metalloproteinase (MMP), cysteine proteinases, aspartic proteinases dan serine proteinase merupakan enzim proteolisis yang terlibat dalam degradasi matriks ekstraseluler.68
MMP merupakan famili zinc dependent endopeptidase, kumpulan besar enzim yang bertanggung jawab terhadap remodelling jaringan dan degradasi berbagai komponen dari matriks ekstraseluler, termasuk kolagen, elastin, gelatin, matriks glikoprotein dan proteoglikan.69,70
Saat ini, terdapat lebih dari 26 anggota keluarga MMP dan semuanya dapat dikelompokkan berdasarkan strukturnya.68 Struktur MMP secara garis besar terdiri dari : 1) sinyal peptida yang mengarahkan MMP untuk mensekresi atau jalur insersi membran plasma; 2) prodomain; 3) katalitik domain berikatan dengan zinc; 4) domain hemopexin yang menjadi perantara interaksi dengan substrat dan enzim spesifik; 5) regio hinge yang berhubungan dengan katalitik dan domain hemopexin.71
Antara kondisi fisiologis dan patologis, ekspresi MMP akan cepat terangsang ketika
121
kondisi fisiologis lainnya seperti proliferasi, motilitas sel, remodeling, penyembuhan luka dan proses reproduksi seperti ovulasi, implantasi embrio, proliferasi endometrium, involusi uterus, payudara serta prostat.73
MMP diekskresikan oleh bermacam connective tissue dan sel pro-inflamasi termasuk fibroblast, osteoblas, sel endotelial, makrofag, neutrofil dan limfosit.68 Ekspresi aktivasi MMP dapat dikontrol pada tingkat transkripsi gen oleh aktivasi proenzim dan inhibitor spesifik dan non spesifik. Kebanyakan MMP disekresi sebagai proenzim laten (inactive zymogen) yang mengalami pemecahan proteolisis di amino-terminal domain saat aktivasi.73,74
Ekspresi MMP yang tidak terkontrol mempunyai keterkaitan dengan patogenesis rheumatoid arthritis, invasi tumor dan metastasis. MMP berperan pada beberapa proses patofisiologi yang kompleks, antara lain: 68
Destruksi jaringan, misalnya pada invasi dan metastasis kanker, reumatoid artritis, osteoartritis, ulkus dekubitus, ulser gastrikus,ulserasi kornea, penyakit periodontal, kerusakan otak dan penyakit neuroinflamasi.
Fibrosis, misalnya pada sirosis hepatis, fibrosis paru, otosklerosis, aterosklerosis, dan multiple sclerosis.
Kelemahan matriks, misalnya pada kardiomiopati dilatasi, aneurisma aorta dan
epidermiolisis bulosa
2.8.1 Peranan MMPs dalam Angiogenesis
Angiogenesis merupakan proses yang kompleks dimana terbentuknya pembuluh darah baru yang berasal dari pembuluh darah yang telah ada, yang melibatkan interaksi multipel antara sel endotelial, perisit sekitar dan sel otot polos, matriks ekstraseluler dan
sitokin angiogenik.75 Angiogenesis penting pada proses remodelling vaskular dan
penyembuhan luka namun juga dapat terjadi pada beberapa kondisi patologis seperti rheumatoid artritis, retinopati diabetik, psoriasis dan kanker. Dasar angiogenesis adalah migrasi sel endotel kedalam jaringan longgar di sekitarnya, MMPs mempunyai peranan yang kompleks termasuk degradasi matriks ekstraseluler, pelepasan substansi proangiogenik, proses growth factor, integrin dan molekul adhesi serta menimbulkan efek keseimbangan antara proangiogenik dan antiangiogenik.68
122
Selain itu, VEGF dapat meningkatkan permeabilitas vaskular, yang akan menimbulkan kebocoran protein plasma yang terdiri dari fibronektin dan protein clotting lainnya. Aktivitasi sistem clotting menyebabkan penumpukan fibrin di stroma sementara. Fibronektin dan fibrin kemudian berikatan dan mengaktifkan reseptor integrinnya (α5β1 dan αvβ3) pada sel endotel yang aktif. Beberapa laporan menduga αvβ3 mempunyai efek antiangiogenik sebagai reseptor untuk inhibitor angiogenik endogen, trombospondin dan tumstatin. TGFβ (transforming growth factor-β) merupakan chemoattractant yang poten untuk monosit dan makrofag dan merangsang ekspresi MMP-2 dan -9 sel endotel dan menurunkan ekspresi TIMP. TGFβ juga berperan dalam maturasi pembuluh darah.75
MMPs mempunyai efek langsung terhadap sel endotelial yang diperlukan untuk migrasi sel dan pembentukan saluran. MMP-2, MMP-9 dan MMP-7 terekspresi pada sel endotel vaskular tumor. Saat berlangsungnya proses degradasi matriks ektraseluler, MMP juga dapat mengaktivasi beberapa faktor pro-angiogenik seperti VEGF, bFGF
(basic fibroblast growth factor) atau TGF-β yang berperan dalam memfasilitasi
angiogenesis tumor.68
2.8.2 MMP-9 pada Gastritis H.pylori dan Non-H.pylori
Hsiu-Chi Cheng et al (2012) melaporkan bahwa ulkus lambung yang terinfeksi oleh H.pylori mengekspresikan lebih tinggi mmp-9 dan TIMPs (The tissue inhibitor of matrix metalloproteinases) daripada ulkus lambung yang terinfeksi oleh NSAID.76
Kubben et al (2007) melakukan penelitian apakah gastritis h.pylori yang telah berhasil diterapi dengan eradikasi H.pylori mempunyai dampak reversibel terhadap kadar MMP-2 dan MMP-9. Dilakukan biopsi pada 2 lokasi di lambung, yaitu pada antrum (3-5 cm proksimal pilorus), dan pada korpus (5 cm diatas sambungan antara antrum dan korpus). Kemudian dilakukan pemeriksaan patologi berdasarkan panduan Sistem sidney yang menyediakan gradasi semi-kuantitatif dan menggunakan parameter histologi. Selanjutnya dilakukan pemeriksaan MMP-2 dan MMP-9 menggunakan Elisa. Kesimpulannya yaitu gastritis yang disebabkan h.pylori berhubungan dengan peningkatan kadar MMP-9 pada mukosa antrum dan korpus. Terjadi penurunan signifikan kadar MMP-9 pada gastritis H.pylori setelah dilakukan terapi eradikasi H.pylori dengan p<
0.001 dan tidak ada perubahan yang bermakna pada kadar MMP-2 dengan p=0.025.77
123
indometasin, NSAID lain, asam empedu, alkohol, iskemia, bahan korosif menyebabkan perubahan morfologi, ultrastruktur, dan fungsional yang mencerminkan terjadinya injuri. Kerusakan endotel mikrovaskular menyebabkan stasis mikrovaskular, berhentinya suplai oksigen, dan transport nutrisi. Kerusakan mikrovaskular terjadi sejak awal injuri mukosa, menyebabkan nekrosis sel kelenjar, dan menambah daerah yang mengalami iskemia. Adanya faktor agresif yang meningkat bisa menyebabkan pembentukan trombus dan stasis mikrovaskular, yang menyebabkan iskemia dan hipoksia, sehingga terjadi nekrosis lokal dan erosi.78
Matriks ekstraseluler memainkan peranan penting dalam penyembuhan ulkus yang disebabkan oleh NSAID. Ekspresi MMP -9 diinduksi oleh sitokin proinflamasi seperti
TNF-α dan IL-6. NSAID seperti indometasin meningkatkan MMP-9 dan menurunkan
MMP-2 dalam jaringan ulkus lambung, hal ini dimediasi oleh jalur prostaglandin independen.79
2.8.3 MMP-9 dalam Proses Keganasan
Karakteristik dasar dari kanker adalah kemampuannya untuk menginvasi jaringan sekitarnya dan metastasis regional dan jauh. Penelitian dasar kanker pada umumnya ditujukan kepada mutasi sel kanker yang menyebabkan gain-of-function onkogen atau loss-of-function tumor supressor gen. Namun, matriks ekstraseluler tumor, sel stromal pada tumor juga berperan penting terhadap progresi dari tumor.80
Matriks ekstraseluler merupakan barrier utama yang harus dilewati sel kanker untuk menimbulkan suatu metastasis. Sel kanker awalnya harus melewati membran basal epitel, kemudian sel kanker menginvasi ke stroma di sekitarnya. Setelah itu, sel kanker akan memasuki pembuluh darah atau limfatik dan ekstravasasi ke organ jauh untuk membuat proliferasi tumor yang baru.81
124
terhadap inhibitor angiogenesis.80 Aktivitas MMP juga berhubungan dengan mekanisme sel kanker terhindar dari respon sistem imun. Beberapa MMP termasuk MMP-9 mampu menekan proliferasi limfosit T dengan merusak sinyal IL-2Rα.67,82,83
MMPs memfasilitasi proses invasi dan metastasis dengan mendegradasi komponen matriks ekstraseluler. Selain itu juga memperantarai aktivasi faktor pertumbuhan, menekan apoptosis sel tumor, dan merusak perkembangan gradien kemokin respon imun host serta pelepasan faktor angiogenesis.81
Peningkatan aktivitas MMPs telah dideteksi dan menunjukkan hubungan dengan invasi dan metastasis beberapa kanker termasuk ovarium, paru, payudara, kolorektal dan kanker sel serviks.83
Davies et. al. (1993) melaporkan ekspresi pro MMP-9 dan pro MMP-2 mempunyai hubungan dengan derajat tumor kandung kemih pada 42 sampel yang dilakukan biopsi. Selain itu, ia juga melaporkan bahwa kadar MMP-9 lebih tinggi pada kanker kandung kemih dibandingkan dengan kontrol.84
Delektorskaya et. al. (2007) dengan studi kasus kontrol terhadap kanker kolorektal dengan 92 sampel yang dilakukan biopsi dengan metastasis jauh (kasus) dan 73 sampel tanpa metastasis jauh (kontrol) didapatkan overekspresi MMP-9 (61.9%) dan MMP-2 (46.7%) pada kasus dengan p=0.001. Ekspresi MMP-9 di sel kanker mempunyai hubungan signifikan dengan prognosis (p=0.032).85
Ahmad & Mohammed (2011) melakukan studi potong lintang pada 40 sampel jaringan adenokarsinoma kolorektal yang dilakukan reseksi margin dan biopsi serta memperoleh adanya perbedaan yang signifikan antara ekspresi MMP-2 dan MMP-9 in situ mRNA antara jaringan tumor dengan batas reseksi potongan jaringan tersebut (p<0.001 dan p<0.001). Selain itu, mereka juga melaporkan adanya peningkatan ekspresi MMP-2 dan MMP-9 pada tumor yang menginvasi submukosa sampai ke propria muskularis dibandingkan dengan tumor yang menginvasi di serosa (p<0.05 dan p<0.05) yang menunjukkan adanya perbedaan ekspresi MMP-2 dan MMP-9 pada kedalaman invasi tumor.83
125
berbagai tipe MMP sebagai respon terhadap sitokin, kemokin, extracellular matrix metalloproteinase inducers (EMMPRIN) yang disekresikan dari sel tumor (sel tumor menggunakan MMP yang dihasilkan untuk merusak membran basal, menginvasi jaringan yang terdekat dan metastasis organ jauh).83 Sel tumor juga dapat merangsang sel penjamu di sekitar stroma untuk mensekresi enzim MMPs atau sebaliknya.74
Aktivitas MMPs diatur pada tiga tahap yaitu transkripsi, aktivasi zimogen prekursor dan inhibisi oleh inhibitor terutama tissue inhibitors of metalloproteinases (TIMPs) dan proteinase inhibitor nonspesifik. TIMPs diekspresi awalnya oleh sel tumor dan berperan dalam sebagai regulator mekanisme aktivasi stroma MMP.87,98 TIMP terdiri dari empat anggota dan berperan kuat dalam mengatur mekanisme aktivasi dan fungsi MMPs. TIMP-1 dapat menghambat kolagenase 3 dan gelatinase. TIMP-2 mengikat MMP-2 dan juga menghambat aktivitas MMP-1, MMP-3, MMP-7 dan MMP-9. Keseimbangan lokal antara enzim MMP dan inhibitornya merupakan faktor yang sangat penting dalam
invasi dan metastasis tumor.74 Penelitian Ikebe et al (1999) terhadap 57 spesimen
karsinoma sel skuamosa oral diperoleh kadar TIMP-1 pada spesimen jaringan tumor lebih tinggi pada kasus non-metastasis dibandingkan kasus metastasis. Pada kasus dengan kadar MMP yang tinggi dan kadar TIMP yang rendah berpotensial untuk terjadi metastasis.86
Tahapan MMPs dalam proses keganasan yaitu sebagai berikut :87
• MMP membantu pembentukan microenvironment yang mendukung bagi pertumbuhan tumor yang diperkirakan terjadi melalui pelepasan growth factor matriks ekstraseluler. • MMP membantu proses angiogenesis tumor dan peningkatan kemampuan sel tumor
untuk bermigrasi dan menginvasi stroma disekitarnya.
• MMP berperan dalam proses angiogenesis pada lokasi metastasis sehingga mendukung kelangsungan hidup sel tumor metastasis
• MMP berperan dalam kerusakan membran basalis dinding pembuluh darah, sehingga memudahkan masuknya sel tumor kedalam sirkulasi darah (intravasasi) dan keluar dari sirkulasi darah (ekstravasasi).
126 2.9 Hubungan VEGF dan MMP-988
Seperti tumor solid pada umumnya, tumor gaster memerlukan vascularisasi baru, jika ingin tumbuh semakin membesar dari beberapa milimeter. Pembuluh darah baru tidak hanya diperlukan untuk memenuhi kebutuhan metabolik pada suatu tumor untuk mensuplai nutrisi tambahan, tetapi juga berpotensi membuat jalur baru untuk desiminasi dan metastasis tumor. Pertumbuhan tumor gaster, memerlukan angiogenesis, sejak terjadinya stroma tumor yang berintegrasi meningkatkan neovascularisasi melalui faktor angiogenik, seperti matrix metalloproteinases (MMPs) dan vascular epithelial growth factor (VEGF). Ketika terjadi paparan kronis oleh faktor angiogenik akan mendukung proteolysis dari membran basal atau fungsi endotelial pericyt yang berlawanan, jaringan pembuluh darah menjadi sangat permiabel, memfasilitasi terjadinya ekstravasasi dan akhirnya metastase dari sel tumor.
MMPs adalah keluarga enzim proteolitik yang mendegradasi berbagai komponen matriks ekstraselular (ECM). Tingkat ekspresi yang tinggi MMPs tertentu, baik oleh sel-sel tumor itu sendiri, oleh fibroblas stroma, atau dengan infiltrasi sel-sel-sel-sel inflamasi, yang berkorelasi erat dengan tumor invasif dan metastasis potensial. Selain itu, mereka berpartisipasi dalam degradasi membran basal pembuluh darah dan renovasi dari ECM selama angiogenesis. 72 kDa MMP-2 dan 92 kDa MMP-9 telah terbukti memainkan peran penting dalam "switch angiogenik" dan sel-sel tumor bisa mensintesis dan jumlah besar rahasia MMP-2 dan MMP-9 dalam parakrin dan / atau cara autokrin untuk merangsang angiogenesis dan meningkatkan pelepasan VEGF. VEGF itu sendiri adalah 45 kDa glikoprotein homodimeric, yang bertindak sebagai mitogen endotel ampuh dan selektif, menginduksi respon angiogenik cepat dan lengkap melalui mengikat reseptor. Baru-baru ini, bukti disajikan bahwa PTEN (fosfatase dan tensin homolog dihapus dari kromosom manusia 10) menghambat pembentukan tabung endotel in vitro dan tunas pembuluh darah dalam model ex vivo angiogenesis, karena efeknya ikut mengatur VEGF.
127
sejalan dengan kontribusi mereka untuk pengembangan pembuluh darah tumor yang memungkinkan pertumbuhan tumor padat dan metastasis.
Saat ini dinyatakan bahwa MMPs mempromosikan pertumbuhan tumor dan metastasis oleh berbagai mekanisme yang mencakup degradasi ECM dan mungkin regulasi pertumbuhan sel tumor sendiri. Ini didokumentasikan bahwa 2 dan MMP-9 berkontribusi dalam ekstraseluler dari tumor necrosis factor (TNF) -alpha dan larut dalam Fas ligan, yang mencegah sel-sel kanker menjalani limfosit-induksi apoptosis. Dengan demikian, MMP-2 dan MMP-9 yang terlibat tidak hanya dalam kemajuan, tetapi juga dalam pertumbuhan karsinoma lambung melalui proteolisis dari ECM dan penghambatan apoptosis. VEGF adalah sitokin multifungsi yang kuat dan memberikan beberapa tindakan yang berpotensi independen pada endotel vaskular, termasuk mitogenesis endotel, permeabilitas, tonus pembuluh darah, produksi molekul vasoaktif dan anti-apoptosis sel endotel pada pembuluh darah yang baru terbentuk.
Gambar 2.17 MMPs Facilitate Angiogenesis89
Kurt et al (2012) mengkonfirmasi bahwa dari penelitian pasien kanker rektum stadium ringan dan sedang yang akan dioperasi dan dilakukan biopsi dengan menggunakan endoskopi fleksibel, dilakukan pemeriksaan kadar MMP-9 dan VEGF sebelumnya, merupakan penanda onkologis yang baik untuk memprediksi rendahnya kekambuhan dan metastasis. Dengan rendahnya kadar MMP-9 dan VEGF juga dapat memprediksi respon terhadap neodjuvant kemoradiasi dan dapat merancang penyesuaian neoadjuvant dan penyesuaian terapi adjuvant secara individual. 90
128 Penderita Gastritis H. Pylori
Meningkatkan sekresi asam Aktivasi sel imun (Limfosit, Cytokin, Growth factor)
INFLAMASI
Meningkatkan faktor angiogenesis (spt. MMP, VEGF dll.)
Ekspresi MMP-9 tidak terkontrol
Pertumbuhan sel kanker meningkat dan terjadi metastase sel kanker
Sel kekurangan oksigen dan nutrisi untuk pertumbuhan sel kanker
HIF-1α meningkat
VEGF meningkat
ANGIOGENESIS
Cag A
Menghambat APOPTOSIS
Gambar 2.18 hubungan VEGF dengan MMP-9 pada gastritis H.pylori yang terinjeksi Cag A
sehingga terjadinya peningkatan Angiogenesis pada sel kanker.
memeriksakan patologi anatomi untuk memastikan diagnosa. 100 kasus disertai dengan metastasis kelenjar getah bening. Dibandingkan faktor-faktor angiogenik dengan MVD dan menemukan asosiasi positif dengan ketiga, MMP-2, MMP-9 dan VEGF. Selain itu, korelasi kuat ekspresi VEGF dengan MMP-2 dan MMP-9 ditemukan. Hal ini juga diketahui bahwa angiogenesis mempunyai tiga langkah utama yaitu: proliferasi sel endotel, kerusakan migrasi sel endotel dan ECM. Faktor angiogenik mengendalikan tiga aspek tersebut melalui berbagai mekanisme. Misalnya, MMP-2 dan MMP-9 dapat merombak ECM dan mempromosikan mobilitas sel epitel pembuluh darah. VEGF mungkin meningkatkan proliferasi sel epitel pembuluh darah dan menghambat apoptosis.
Kesimpulannya, VEGF dan MMP-9 tampak erat terlibat dalam pertumbuhan, angiogenesis dan perkembangan Gastritis H. pylori.
129 2.10 Kerangka Teori
Gambar 2.19 Kerangka Teori
Pasien Abdominal Discomfort
Menggambarkan keluhan atau kumpulan gejala yang terdiri dari nyeri atau rasa tidak nyaman di epigastrium, mual, muntah, kembung, cepat kenyang, rasa perut penuh, sendawa, regurgitasi dan rasa panas yang menjalar di dada (Djojoningrat D, 2006).
H. pylori (+) dengan peradangan pada lapisan lambung. (El-Zimaity HMT, 2007).
Infeksi lambung disebabkan oleh pajanan aspirin, indometasin, NSAID lain, asam empedu, alkohol, iskemia, bahan korosif (Adibi 2014).
Suatu kondisi medis yang ditandai dengan peradangan pada lapisan lambung yang disebabkan oleh bakteri Gram negatif khususnya H.pylori. (Adibi 2014).
VEGF adalah glikoprotein
proangiogenik yang berfungsi meningkatkan proliferasi, migrasi, survival pada sel endotel serta meningkatkan permeabilitas kapiler. (Berman HM, et al. 2000).
MMP9 diekskresikan oleh
bermacam connective tissue dan sel pro-inflamasi dan mempunyai peranan proliferasi, motilitas sel, remodeling, penyembuhan luka dll. (Amalinei C et al. 2010)
PADYQ test : kuesioner dengan 11
pertanyaan yang mengevaluasi gejala nyeri epigastrium, mual, muntah, perut kembung, dan early satiation.
Skor > 6 : dispepsia
Gastroskopi :
Suatu metode yang ditunjuk untuk melihat lebih jauh bagian-bagian yang ada dalam tubuh dengan cara memasukkan sebuah alat berupa tabung yang fleksibel yang dilengkapi kamera kecil diujung alat tersebut.
Biopsi :
pengambilan sampel kecil dari jaringan sehingga dapat diperiksa di bawah mikroskop untuk mengetahui derajat
keparahan suatu penyakit. CLO : merupakan test urease dari H.pylori untuk mendeteksi H.pylori.