PENDAHULUAN
Konsumsi terigu masyarakat Indonesia selama Januari – September 2011 naik sebesar 5.81 persen bila dibandingkan dengan tahun 2010. Dalam rangka memenuhi kebutuhan terigu, pemerintah melakukan impor terigu dari luar negri. Menurut Badan Pusat Statistik, impor terigu Indonesia dari Januari - Agustus 2011 sudah mencapai 433.429 ton (Rosallina, 2011). Padahal, masalah ketahanan pangan ini dapat diatasi dengan diversifikasi pangan berbasis bahan pangan dasar lokal. Hal tersebut juga sesuai dengan Peraturan Presiden Nomor 22 tahun 2009 tentang Kebijakan Percepatan Penganekaragaman Konsumsi Pangan Berbasis Sumberdaya Lokal (Anonim,2010).
Indonesia merupakan negara ke-4 sebagai negara penghasil gaplek dengan jumlah produksi sebesar 20 juta ton dari 220 juta ton produksi dunia (Anonim, 2007). Gaplek merupakan salah satu olahan ubi kayu (tanaman lokal) yang dikeringkan dengan energi yang dihasilkan sebesar 363 kilokalori namun kandungan protein hanya sebesar 1.1 gram per 100 gram tepung gaplek (Hidayat dkk, 2000). Padahal protein merupakan salah satu kriteria untuk menentukan nilai gizi bahan makanan (Arief, 2007). Pengayaan protein dapat dilakukan dengan fortifikasi tepung kedelai melalui proses fermentasi. Melalui fermentasi ini terjadi perombakan senyawa kompleks protein menjadi senyawa-senyawa yang lebih sederhana dan memiliki daya cerna amat tinggi (Silvia, 2009).
Berdasarkan penelitian sebelumnya (Hadinataria, 2011), kondisi optimum dalam pembuatan tepung gaplek terfortifikasi adalah tepung gaplek difermentasi dengan tepung kedelai dan ragi (25 : 5) selama 42,12 jam. Pada kondisi ini, kadar protein terlarut yang dihasilkan adalah sebesar 9,00%. Namun, pada penelitian sebelumnya ini belum dilakukan identifikasi asam amino pada tepung gaplek terfortifikasi. Padahal, mutu protein juga dinilai dari kandungan asam amino pada suatu bahan pangan (Winarno, 1997). Selain itu tepung gaplek terfortifikasi ini juga berpotensi untuk menggantikan tepung terigu.
Selama proses fermentasi, protein kedelai akan terdegradasi menjadi asam amino, sehingga protein terlarut akan meningkat dari 0,5% menjadi 2,5% (Deliani, 2008). Protein terlarut merupakan oligopeptida dan terdapat rantai kurang dari 10 asam amino serta memiliki sifat mudah diserap oleh sistem pencernaan, (Purwoko dan Handajani,
2007). Asam amino yang diperlukan tubuh adalah asam amino esensial karena asam amino esensial lebih cepat diserap dibandingkan asam amino non esensial di dalam tubuh (Linder, 1985). Selain itu, ketersediaan asam amino essensial juga menentukan kualitas gizi protein (De Man, 1997). Protein kedelai mengandung 9 jenis asam amino esensial, yaitu : sistein, isoleusin, leusin, lisin, metionin, fenilalanin, treonin, triptofan dan valin (Dwianingsih, 2010).
Berdasarkan latar belakang di atas, maka penelitian ini bertujuan untuk membandingkan kadar protein terlarut serta mengidentifikasi jenis asam amino pada tepung gaplek terfortifikasi tepung kedelai berdasarkan lama waktu fermentasi.
METODE PENELITIAN
Bahan Dan Piranti
Bahan
Singkong yang digunakan adalah singkong varietas Gatot Kaca yang didapatkan dari daerah Salatiga. Kedelai yang digunakan adalah kedelai (Glycine max (L)) varietas Galunggung dan ragi yang digunakan adalah Ragi Ra-prima yang diperoleh dari Pasar Raya Salatiga. Sedangkan bahan kimia yang digunakan adalah NaOH, CuSO4.5H2O ,
NaK-Tartat, akuades, HCl, butanol, asam asetat glasial, ninhydrin, etanol, HCN, tetrahidrofuran(THF), ortophaldehid, leusin, fenilalanin, metionin, sistein, lysin-monochloryde, dan treonin (Merck-Germany).
Piranti
Piranti yang digunakan antara lain : drying cabinet, grinder, ayakan aperture 250µm -mesh no. 60, centrifuge (EBA 21 Hettich Zentrifugen), kertas saring, Spektrofotometer (Optizen UV 2120), kuvet, alat reflux, Plat KLT (Silica Gel 60 F 254 (Merck-Germany)), chamber, waterbath, Neraca Acis AD-600H, kertas saring Whatman 0,2 c, kromatografi cair kinerja tinggi (Shimadzu LC 10), dan piranti gelas.
Metode
Pembuatan Gaplek (Hadinataria, 20011)
Singkong dibersihkan lalu dipotong kecil-kecil, selanjutnya potongan singkong direndam dengan air garam selama 1 malam. Potongan singkong kemudian dikeringkan dalam drying cabinet pada suhu 50oC selama 1 malam dan setelah kering, gaplek siap untuk perlakuan berikutnya.
Pembuatan Tepung Gaplek Terfortifikasi (Hadinataria, 2011)
Gaplek kering dikukus selama 30 menit, kemudian didinginkan. Setelah dingin, gaplek ditambah ragi dan tepung kedelai dengan perbandingan 5:25 (b/b) dari 100 gram gaplek kering dan difermentasikan dengan lama waktu 40 jam. Gaplek terfermentasi dikeringkan dalam drying cabinet dan setelah kering, gaplek terfermentasi dihaluskan dengan menggunakan grinder dan diayak dengan ayakan aperture 250µm, mesh no. 60. Penentuan Kadar Protein Tepung Gaplek Terfortifikasi dengan Metoda Biuret (AOAC, 1995)
Pembuatan kurva standar Biuret
Reagen Biuret dibuat dengan melarutkan 0,15 g CuSO4.5H2O + 0,6 g NaKTatrat
dalam labu ukur 50 mL. Kemudian larutan dimasukkan dalam labu ukur 100 mL, selanjutnya ditambah 30 mL NaOH 10% dan digenapkan akuades.
Larutan protein (BSA) dengan konsentrasi 10 mg/ml disiapkan untuk pembuatan
kurva standar. Larutan protein tersebut disiapkan dengan cara meningkatkan
konsentrasinya yaitu 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 mg/ml dalam 0,5 mL. Kemudian
masing-masing larutan ditambahkan 2 ml reagen Biuret ke dalam setiap tabung dan larutan dihomogenisasi lalu diinkubasi selama 30 menit pada suhu kamar. Masing – masing absorban larutan diukur dengan spektrofotometer pada panjang gelombang 550 nm. Pengukuran sampel
Satu gram sampel ditambah akuades dan 1 mL NaOH 1 M, kemudian dipanaskan di dalam water bath dengan suhu 90oC selama 10 menit. Setelah itu larutan dipusingkan selama 10 menit. Setengah mililiter larutan supernatan diambil dan dimasukkan ke dalam tabung reaksi. Dua mililiter reagen Biuret ditambahkan ke dalam
tabung reaksi tersebut. Setelah itu di inkubasi selama 30 menit pada suhu kamar. Kemudian absorbansi sampel diukur dengan spektrofotometer pada panjang gelombang 550 nm.
Identifikasi Asam Amino dengan Kromatografi Lapis Tipis (KLT)(Rohmer, 1991) Preparasi Sampel
Tujuh puluh lima gram sampel dihidrolisis dengan HCl 7,5 M selama 4 jam pada suhu ± 90 0C menggunakan pelarut HCl 7,5 M. Hasil hidrolisis disaring untuk menghilangkan kotoran.
Identifikasi Asam Amino
Hidrolisat ditotolkan pada plat KLT (Silica Gel F254 sebagai fase diam) lalu dielusikan di dalam chamber yang telah dijenuhkan. Fase gerak yang digunakan adalah butanol : asam asetat glasial : aquades dengan perbandingan 4:1:1 (v/v/v). Standar asam amino yang digunakan sebagai pembanding adalah lisin, metionin, leusin, sistein, fenilalanin, treonin.
Identifikasi Asam Amino dengan Kromatografi Cair Kinerja Tinggi (KCKT) Preparasi Sampel
Enam puluh miligram sampel ditambah 4 ml HCl 6 M, kemudian dipanaskan selama 24 jam dengan suhu 1100 C. Selanjutnya hasil hidrolisis dinetralkan dengan NaOH 6 M hingga 10 ml dan disaring dengan kertas saring Whatman 0,2 c.
Dua puluh lima mikroliter sampel ditambah larutan OPA ( Ortophalaldehid ) sebanyak 300 µL dan diaduk selama 5 menit. Selanjutnya, 20 µL sampel dimasukkan ke dalam injektor KCKT.
Analisis Sampel
Sampel dianalisis dengan menggunakan kromatografi cair kinerja tinggi (Shimadzu LC 10) pada fase diam kolom Licrospher ® 100 RP 18 (125 x 4 mm,5 µm ). Sebagai fase gerak adalah Eluent A : metanol : 50 mM natrium asetat : Teterahidrofuran (THF) dan Eluent B :65 % metanol. Analisa ini dilakukan pada suhu 27 0C dengan kecepatan alir 1 ml/menit serta dideteksi dengan detektor fluorosen pada panjang
gelombang 360 dan 460 nm. Standar asam amino yang digunakan sebagai pembanding adalah asam aspartat, glutamat, serin, histidin, glisin, arginin, alanin, tirosin, metionin, valin, isoleusin, leusin, lisin, dan fenilalanin.
Analisis Data
Data kadar protein dianalisis dengan menggunakan rancangan dasar RAK (Rancangan Acak Kelompok), 6 perlakuan dan 4 kali ulangan. Sebagai perlakuan adalah tepung gaplek terfortifikasi dan tepung gaplek yang hanya ditambah ragi (masing-masing pada lama waktu fermentasi 0 jam, 20 jam, dan 40 jam). Sedangkan sebagai kelompok adalah waktu analisid. Purata antar perlakuan diuji menggunakan Uji Beda Nyata Jujur (BNJ) dengan tingkat kebermaknaan 5%. Data hasil KLT dan KCKT dianalisa secara deskriptif.
HASIL DAN PEMBAHASAN
Peningkatan Kadar Protein Terlarut Tepung Gaplek Terfortifikasi
Selama proses fermentasi terjadi kenaikan kadar protein terlarut pada tepung gaplek terfortifikasi maupun tepung gaplek yang hanya ditambah ragi. Masing-masing kadar protein terlarut pada tepung gaplek terfortifikasi maupun tepung gaplek yang hanya ditambah ragi dapat dilihat pada Tabel 1. Kadar protein terlarut kedelai, gaplek, ragi, dan tepung Terigu “X” juga diukur dan dapat dilihat pada Tabel 2.
Tabel 1. Kadar Protein Terlarut (%±SE) Tepung Gaplek Kontrol dan Tepung Gaplek Terfortifikasi W G0 G20 G40 GF0 GF20 GF40 0,36 2,13 ± 0,1374a 2,30 ± 0,3606a 2,70 ± 0,5367a 18,70 ± 0,2465b 20,96 ± 0,6532c 22,86 ± 1,023d Keterangan :
G0 = Tepung Gaplek Kontrol 0 jam, G20 = Tepung Gaplek Kontrol 20 jam, G40 = Tepung Gaplek Kontrol 40 jam, GF0= Tepung Gaplek Terfortifikasi Tepung Kedelai 0 jam, GF20= Tepung Gaplek Terfortifikasi Tepung Kedelai 20 jam, GF40= Tepung Gaplek Terfortifikasi Tepung Kedelai 40 jam. *. Tepung gaplek kontrol berarti gaplek hanya ditambah ragi (tidak dilakukan fortifikasi tepung
kedelai).
*. Huruf yang berbeda menyatakan adanya perbedaan secara nyata.
Pada sampel G0, G20, dan G40 tidak terjadi perbedaan kadar protein antara masing–masing sampel. Hal tersebut dikarenakan terbatasnya sumber nitrogen pada gaplek yang digunakan oleh mikroorganisme selama fermentasi. Sehingga fermentasi
yang dilakukan dari 0 hingga 40 jam tidak menyebabkan kenaikan kadar protein terlarut G0, G20, dan G40 yang signifikan. Namun antara sampel G0-G20-G40 dan GF0-GF20-GF40 terjadi perbedaan kadar protein terlarut diantara sampel tersebut. Hal ini dikarenakan adanya sumber nitrogen lain (selain tepung gaplek maupun ragi) yaitu protein tepung kedelai. Besarnya protein tepung kedelai, tepung gaplek dan ragi dapat dilihat pada Tabel 2.
Tabel 2. Kadar Protein Terlarut Kedelai, Gaplek, Ragi (%±SE), dan Tepung Terigu “X” (%)
Tepung Kedelai
Tepung Gaplek
Ragi Tepung Terigu “X”
35,08±0,06 1,46±0,7468 3,778±0,1364 20,25
Kadar protein terlarut GF40 menunjukkan hasil yang lebih tinggi dari GF20 dan lebih tinggi dari GF0. Hal ini menunjukkan bahwa terjadi peningkatan kadar protein terlarut seiring dengan lama waktu fermentasi. Protein tepung kedelai yang cukup tinggi ini digunakan oleh mikroorganisme untuk memecahkan senyawa organik menjadi lebih sederhana (asam amino). Selain itu dengan adanya aktivitas proteolitik, protein yang berasal dari tepung kedelai menjadi lebih terurai sehingga nitrogen terlarutnya mengalami peningkatan (Aguskrisno, 2011).
Proses fermentasi ini dapat terjadi karena adanya aktivitas mikrobia yang merombak substrat organik yang sesuai. Biasanya makanan yang mengalami fermentasi akan mengalami peningkatan nilai gizi (Winarno, 1997). Selama proses fermentasi, juga terjadi hidrolisis protein (walaupun dalam jumlah yang kecil ± 5%) yang hasilnya terakumulasi dalam bentuk dalam bentuk peptida (Deliani, 2008). Hasil ini juga selaras dengan penelitian yang dilakukan oleh Aro dan Aletor (2012) yang menunjukkan bahwa kadar protein kulit ubi kayu meningkat seiring dengan bertambahnya lama waktu fermentasi. Kandungan protein terlarut pada GF40 dan GF20 juga menunjukkan hasil yang lebih tinggi dari kadar protein tepung terigu “X” (dapat dilihat pada Tabel 2). Sehingga, tepung ini berpotensi untuk menggantikan tepung terigu. Tepung gaplek terfortifikasi yang dihasilkan pada penelitian ini juga memiliki kadar protein terlarut yang lebih tinggi daripada hasil penelitian Hadinataria (2011) yaitu hanya sebesar 9%.
Hal tersebut dikarenakan perbedaan penggunaan jenis kedelai pada penelitian Hadinataria (2011).
Kadar protein terlarut atau sering disebut daya cerna protein merupakan kemampuan suatu protein untuk dihidrolisis menjadi asam amino oleh enzim-enzim pencernaan (protease) (Pellet dan Young, 1980). Daya cerna protein adalah salah satu faktor yang menentukan mutu protein karena menentukan ketersediaan asam amino secara biologis. Daya cerna yang rendah berarti protein yang masuk ke tubuh tidak dapat larut atau dicerna dengan sempurna sehingga asam-asam amino yang terkandung tidak dapat larut dan digunakan oleh tubuh. Hal ini dapat menurunkan mutu protein suatu makanan serta menimbulkan malnutrisi protein bagi konsumennya (Muchtadi, 1989).
Identifikasi Asam Amino dengan Kromatografi Lapis Tipis (KLT)
Mutu protein suatu bahan makanan ditentukan ketersediaan asam amino yang dapat diserap oleh tubuh. Susunan asam amino pada tepung gaplek yang hanya ditambah ragi, tepung gaplek terfortifikasi dan tepung kedelai mengalami perubahan. Komposisi susunan tersebut dapat dilihat pada Tabel 3, sedangkan hasil dan profil KLT identifikasi asam amino dapat dilihat pada Gambar 4 maupun Gambar 5.
Berdasarkan Tabel 3, asam amino pada tepung gaplek terfortifikasi yang teridentifikasi adalah sistein, treonin, metionin, dan leusin. Sedangkan pada tepung gaplek kontrol adalah treonin dan metionin. Perubahan asam amino ini diakibatkan adanya pembentukan enzim protease oleh mikroorganisme yang dapat menghidrolisis protein sehingga terjadi perubahan kandungan asam aminonya selama fermentasi (Rusli, 2011).
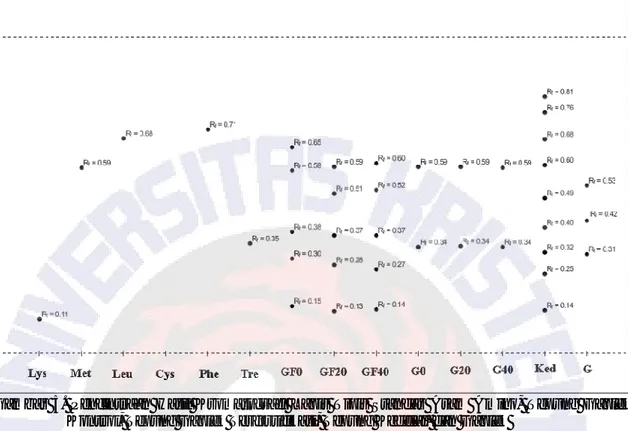
Tabel 3. Nilai Rf Asam Amino Standar, Kedelai, Gaplek, Tepung Gaplek yang Ditambah Ragi, dan Tepung Gaplek Terfortifikasi
A.A Std Ked G G0 G20 G40 GF0 GF20 GF40 0,11 (Lys) - - - - - 0,14 (Cys) 0,14 (Cys) - - - - 0,14 (Cys) 0,14 (Cys) 0,14 (Cys) 0,35 (Tre) 0,32 (Tre) 0,30 (Tre) 0,34 (Tre) 0,34 (Tre) 0,34 (Tre) 0,30 (Tre) 0,30 (Tre) 0,30 (Tre) 0,59 (Met) 0,60 (Met) - 0,59 (Met) 0,59 (Met) 0,59 (Met) 0,58 (Met) 0,59 (Met) 0,58 (Met) 0,68 (Leu) 0,68 (Leu) - - - - 0,65 (Leu) - 0,65 (Leu) 0,71 (Phe) 0,76 (Phe) - - - - 0,25 (Asp*) 0,42 (Cys*) - - - 0,38 (Cys*) 0,37 (Cys*) 0,38 (Cys*) 0,40 (Cys*) 0,53 (Met*) - - - - 0,51 (Met*) - 0,81 - - - -
Keterangan : A.A Std = Asam Amino Standar, Ked = Kedelai, G = Gaplek, Lys = Lisin, Tre = treonin, Met = Metionin, Cys = Sistein, Phe = Fenilalanin, Leu = Leusin. * Perbandingan Rf sampel dengan Rf asam amino literatur.
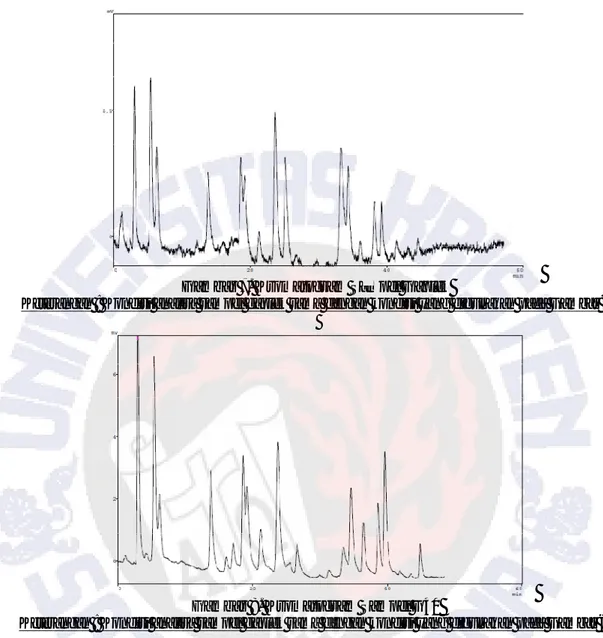
Gambar 4. Hasil Kromatografi Lapis Tipis Standar Asam Amino, Tepung Gaplek Kontrol, Tepung Gaplek Terfortifikasi, Tepung Kedelai, dan Gaplek
Gambar 5. Pencintraan Hasil Kromatografi Lapis Tipis Standar Asam Amino, Tepung Gaplek Kontrol, Tepung Gaplek Terfortifikasi, Tepung Kedelai, dan Gaplek
Pada proses fermentasi ini juga terjadi pengurangan jumlah asam amino dari tepung kedelai menjadi tepung gaplek terfortifikasi. Hilangnya asam amino ini disebabkan oleh deaminasi. Deaminasi adalah proses pemecahan (hidrolisis) asam amino menjadi asam keto dan ammonia (NH4+). Salah satu hasil deaminasi ini adalah senyawa nonnitrogen
(C,H,dan O) yang digunakan sebagai sumber energi untuk pertumbuhan mikroba (Nugroho, 2012).
Pengayaan jumlah asam amino juga terjadi pada tepung gaplek kontrol menjadi tepung gaplek terfortifikasi selama proses fermentasi. Asam amino yang muncul setelah proses fermentasi adalah leusin dan sistein.Hasil ini juga selaras dengan penelitian yang dilakukan oleh Aro dan Aletor (2012) yang menunjukkan selama proses fermentasi terjadi pengayaan asam amino pada kulit ubi kayu.
Pembentukan leusin melibatkan lima tahapan reaksi yang dimulai dari prekursor valin, yaitu 2- keto-isovalerate sampai reaksi terakhir yang dikatalisa oleh enzim transaminase. Sedangkan pembentukan atau sintesis asam amino sistein berasal dari metionin sebagai sumber sulfurnya. Kondensasi dari ATP dan metionin dikatalisis oleh
enzim metionin adenosiltransfrease menghasilkan Sadenosilmetionin (SAM). Sadenosilmetionin (SAM) akan berubah menjadi S-adenosilhomosistein karena adanya transmetil. Selanjutnya berubah menjadi homosistein dan adenosin dengan bantuan enzim adenosilhomosisteinase. Homosistein berkondensasi dengan serin menghasilkan sistationin dengan bantuan enzim sistationase. Selanjutnya dengan bantuan enzim sistationin liase, sistationin diubah menjadi sistein dan α-ketobutirat. Gabungan dari 2 reaksi terakhir ini dikenal sebagai trans-sulfurasi (Nugroho, 2012). Identifikasi Asam Amino dengan Kromatografi Cair Kinerja Tinggi (KCKT)
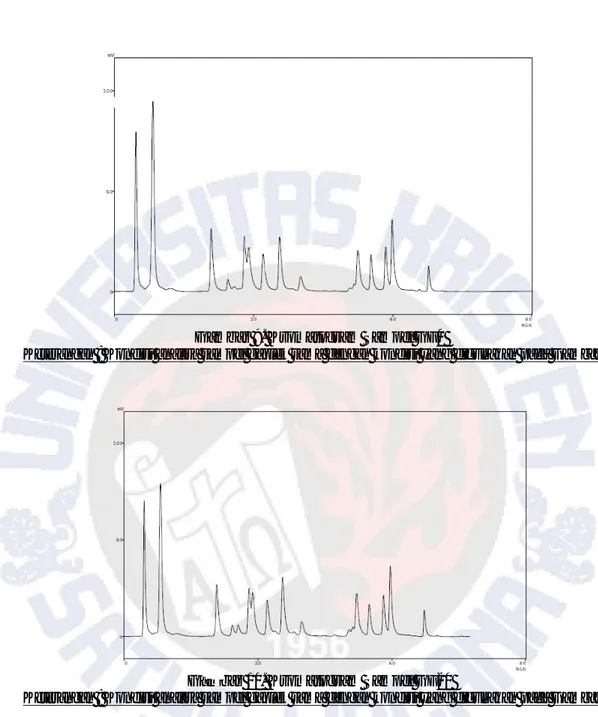
Kromatogram standar asam amino dengan konsentrasi 50 ppm (f) dapat dilihat pada Gambar 6. Sedangkan masing-masing kromatogram sampel G40, GF0, GF20, dan GF40 dapat dilihat pada Gambar 7, 8, 9, 10, dan 11.
Gambar 6. Kromatogram Standar Asam Amino 50 ppm
Keterangan : Standar dianalisa pada fase diam kolom Licrospher ® 100 RP 18 (125 x 4 mm,5 µm ) dan fase gerak adalah Eluent A : metanol : 50 mM natrium asetat : Teterahidrofuran (THF) dan Eluent B :65 % metanol. Suhu analisa adalah 27 0C dengan kecepatan alir 1 ml/menit serta dideteksi dengan detektor
Gambar 7. Kromatogram Sampel Gaplek
Keterangan : Kondisi analisa sampel gaplek sama dengan kondisi yang digunakan pada Gambar 6
Gambar 8. Kromatogram Sampel G40
Gambar 9. Kromatogram Sampel GF0
Keterangan : Kondisi analisa sampel gaplek sama dengan kondisi yang digunakan pada Gambar 6.
Gambar 10. Kromatogram Sampel GF20
Gambar 11. Kromatogram Sampel GF40
Keterangan : Kondisi analisa sampel gaplek sama dengan kondisi yang digunakan pada Gambar 6.
Gaplek merupakan suatu bahan pangan lokal yang memiliki kadar protein yang sangat rendah yaitu sebesar 1,8 % (Tabel 2). Walaupun kadar protein yang sangat rendah, gaplek memiliki jenis asam amino yang bervariasi, antara lain (dapat dilihat pada Tabel 4) : asam aspartat, glutamat, serin, glisin, arginin, alanin, tirosin, valin, isoleusin, dan leusin, namun kadar asam amino yang terkandung dalam gaplek juga sangatlah kecil bahkan beberapa asam amino seperti asam aspartat, valin, dan isoleusin tidak terkuantifikasi. Suatu bahan makanan dapat diperkaya atau ditingkatkan gizinya melalui fermentasi (Winarno, 1997). Fortifikasi dengan tepung kedelai yang dilakukan pada gaplek serta adanya proses fermentasi dapat meningkatkan kadar serta memperkaya jenis asam amino seperti histidin, metionin, dan lisin yang muncul pada sampel GF40. Hal tersebut dapat dilihat pada Tabel 4. Perubahan asam amino ini diakibatkan oleh mikroorganisme pada ragi yang memiliki aktivitas proteolitik yang mampu menguraikan protein menjadi bentuk lebih sederhana yaitu asam amino sehingga kadarnya pun meningkat (Deliani, 2008).
Tabel 4. Konsentrasi Asam Amino Pada Gaplek dan GF40 No Gaplek GF40 AA Kons (ppm) AA Kons (ppm) 1 Asp* - Asp 272,151 2 Glu 5,692 Glu 288,071 3 Ser 9,732 Ser 93,477 4 Glis 14,345 His 61,381 5 Arg 13,205 Glis 129,596 6 Ala 8,130 Arg 104,325 7 Tyr 12,350 Ala 147,923 8 Val* - Tyr 68,287 9 Iso* - Met 108,152 10 Leu 5,752 val 47,082 11 Iso 14,957 12 Leu 148,557 13 Lys 151,747
Ket : * menandakan bahwa asam amino tidak terkuantifikasi Asp = asam asapartat, Glu = Glutamat, Ser = serin, His = Histidin, Glis = Glisin, Arg = Arginin, Ala = Alanin, Tyr = Tirosin, Met = Metionin, Val = Valin, Ile = Isoleusin, Leu = Leusin, Lys = Lisin, Phe = Fenilalanin
Selain itu tepung gaplek terfortifikasi ini juga memiliki keunggulan yaitu adanya asam amino essensial jenis arginin yang tidak dimiliki oleh kedelai, dimana kedelai merupakan salah satu jenis bahan pangan yang mengandung 9 jenis asam amino esensial (Deliani, 2008).
Proses fermentasi ini juga dapat berlangsung karena adanya mikororganisme (Rhizopus oligosporus). Menurut Hesseltine (1965) dalam Deliani (2008) jamur Rhizopus oligosporus bersifat proteolitik dan ini penting dalam pemutusan protein. Jamur ini akan mendegradasi protein selama fermentasi menjadi dipeptida dan seterusnya menjadi senyawa NH3 atau N2 (Winarno, 1997). Sehingga, semakin lama
proses fermentasi berarti semakin lama kesempatan jamur mendegradasi protein, sehingga kesempatan untuk terjadinya perubahan jenis asam aminopun semakin besar selagi jamur tersebut masih memiliki kemampuan tersebut (Deliani, 2008). Selain itu berdasarkan penelitian Mursyid (2005) menyatakan bahwa terjadi peningkatan kadar yang tajam pada 14 jenis asam amino selama 72 jam waktu fermentasi pada onggok yang digunakan sebagai bahan pakan ayam yaitu sebesar 246%.
KESIMPULAN DAN SARAN
Kesimpulan
Peningkatan kadar protein terlarut pada tepung gaplek terfortifikasi tepung kedelai tertinggi didapatkan dengan lama waktu fermentasi 40 jam dan diikuti dengan lama waktu fermentasi 20 dan 0 jam, yaitu sebesar 22,86%, 20,96%, dan 18,70%.
Asam amino yang teridentifikasi dengan menggunakan metode Kromatografi Lapis Tipis (KLT) pada tepung gaplek terfortifikasi dengan waktu fermentasi 40 jam adalah leusin, metionin, treonin, dan sistein. Sedangkan berdasarkan hasil analisa Kromatografi Cair Kinerja Tinggi (KCKT), asam amino yang teridentifikasi adalah aspartat, glutamat, serin, histidin, glisin, arginin, alanin, tirosin, metionin, valin, isoleusin, leusin, dan lisin. Saran
Lama waktu fermentasi pada tepung gaplek terfortifikasi perlu dioptimalkan lebih lanjut, karena setelah 40 jam, kadar protein terlarutnya diharapkan masih dapat meningkat. Selain itu, perlu dilakukan analisa kuantitatif semua jenis asam amino yang terdapat pada tepung gaplek terfortifikasi.
DAFTAR PUSTAKA
Aguskrisno, 2011. Peranan Rhizopus Oryzae Pada Industri Tempe Dalam Peranan
Peningkatan Gizi Pangan.
http://aguskrisnoblog.wordpress.com/2011/01/13/peranan-rhizopus-oryzae-pada-industri-tempe-dalam-peranan-peningkatan-gizi-pangan/ [15 Februari 2012]
Anonim, 2007. Potensi Ekspor Gaplek Indonesia Ke China Mencapai Us$150 Juta. http://www.antaranews.com/view/?i=1194593012&c=ekb&s= [28 Februari 2012] Anonim, 2010. Rapat Konsolidasi Percepatan Penganekarakaman Pangan.
http://kantorketahananpanganblora.blogspot.com/2010/02/rapat-konsolidasi-percepatan.html [30 Maret 2012]
Anonim, 2012. 1-Fluoro-2,4-dinitrobenzene. http://en.wikipedia.org/wiki/1-Fluoro-2,4-dinitrobenzene [1 Mei 2012]
AOAC, 1995. Official Methods of Analysis of The Association of Official Analytical Chemits. AOAC, Washington DC.
Arief, Ratna Wylis. 2007. Penentuan Kualitas Protein Jagung dengan Metode Protein Efficiency Ratio.
http://www.puslittan.bogor.net//index.php?bawaan=publikasi/isi_informasi&kod =PG206/02&kd=1&id_menu=5&id_submenu=21&id=157 [12 Desember 2011] Aro S.O dan V.A. Aletor. 2012. Proximate composition and amino acid profile of
differently fermented cassava tuber wastes collected from a cassava starch producing factory in Nigeria. Livestock Research for Rural Development. ISSN 0121-3784. 24 March 2012.
Benson, J.R and Hare, P.E. 1975. O-Phthalaldehyde: fluorogenic detectionof primary amines in the picomole range. Comparison with fluorescamine and ninhydrin, Proc. Nat. Acad. Sci., 72(2), 619-622.
Deliani, 2008. Pengaruh Lama Fermentasi Terhadap Kadar Protein, Lemak, Komposisi Asam Lemak dan Asam Fitat Pada Pembuatan Tempe. Tesis. Medan. Sekolah PascaSarjana Univeristas Sumatera Utara.
DeMan, J.M. 1997. Kimia Makanan, Hal. : 105. Penerbit ITB, Bandung.
Dwianingsih, E.A. 2010. Karakteristik Kimia Dan Sensori Tempe Dengan Variasi Bahan Baku Kedelai/Beras Dan Penambahan Angkak Serta Variasi Lama Fermentasi. Laporan Hasil Penelitian. Surakarta. Universitas Sebelas Maret. Ezekiel, Olufunke O., Ogugua C. Aworh, Hans P. Blaschek and Thaddeus C. Ezeji.
2010. Protein enrichment of Cassava Peel by Submerged Fermentation with Trichoderma viride (ATCC 36316). African Journal of Biotechonology Vol. 9 (2), pp. 187-194, 11 January, 2010. ISSN 1684-5315.
Hadinataria, Nerissa. 2011. Pemanfaatan Tepung Kedelai (Glycine Max (L)) Dalam Optimalisasi Pembuatan Tepung Gaplek Berprotein Sebagai Bahan Substitusi Tepung Terigu. Skripsi. Salatiga. Universitas Kristen Satya Wacana, FSM-Kimia. Hesseltine, C.W. 1961. Research at Nothern Regional Laboratory on Fermented Food.
Proc. Conf. Soybean Products for Protein in Human Foods, USDA.
Linder, M.C. 1985. Nutrional Biochemistry and Metabolism. Elsiver Science Publishing Company, Inc., California
Muchtadi D. 1989. Protein : Sumber dan Teknologi. Pusat Antar Universitas Pangan dan Gizi Institut Pertanian Bogor, Bogor.
Musryid W. M, Ali. 2005. Solid State-Fermentation on Cassava Pomace with Aspergillus oryzae: The Evaluation of Proteins and Amino Acids Content, Digestibility, and Bioavailability Energy For Broiler Roasters. Buletin Peternakan Vol. 29(2), 2005. ISSN 01246-4400.
Nugroho, Heru Santoso Wahito. 2012. Metabolisme Asam Amino. Bahan Kuliah Biokimia D III Kebidananan, Dinkes, Ponorogo.
Pellet PL and VR Young (eds). 1980. Nutritional Evaluation of Protein Food. The United Nations University, Tokyo.
Purwoko dan Handajani. 2007. Kandungan Protein Kecap Manis Tanpa Fermentasi Moromi Hasil Fermentasi Rhizopus oryzae dan R. oligosporus. Jurnal Ilmiah Biodiversitas Vol. 8, No:2, 223-227. ISSN : 1412-033X, April 2007.
Rohman, Abdul dan Sumantri. 2007. Analisis Makanan, Hal.:1-37. Gajah Mada University Press, Yogyakarta.
Rohmer, Frank. 1991. Food Chemistry, Part 3: Chromatography-Enzymatic Test Methods. Leybold Didactic GmbH, Jerman.
Rosallina, 2011.Konsumsi Tepung Terigu Nasional Melambat. http://www.tempo.co/read/news/2011/10/27/090363609/Konsumsi-Tepung-Terigu-Nasional-Melambat [7 Desember 2011]
Rusli, Kurniawan Ridho. 2011. Giving Grounds Remaining Mixture Bran And Tofu Fermentation With Monascus Purpureus Performance And Eggs Quality Of Layer. Tesis. Padang. Universitas Andalas.
Silvia, Ayu. 2009. Pengaruh Penambahan Varietas Berat Inokulum terhadap Kualitas Tempe Biji Durian (Durio zibethinus). Skripsi. Medan. Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara. Hidayat, S. Prihatin and L. Budiono. 2000. Kontribusi Gaplek Sebagai Substitusi
Makanan Pokok terhadap Kecukupan Energi dan Status Gizi Balita Keluarga Petani Tadah Hujan Semarang. Penelitian Hibah Bersaing.
Winarno F.G. 1997. Kimia Pangan dan Gizi. Gramedia Pustaka Utama, Jakarta.