i ANALISIS VOLUMETRI (TITRIMETRI)
ANALISIS VOLUMETRI
(TITRIMETRI)
Yayuk Mundriyastutik, ST., MT.
Iffana Dani Maulida, S.Si., M.Sc.
apt. Eko Retnowati, M. Si., M. Farm.
Penerbit MU PRESS
ii ANALISIS VOLUMETRI (TITRIMETRI)
Penulis:
Yayuk Mundriyastutik, ST., MT.
Iffana Dani Maulida, S.Si., M.Sc.
apt. Eko Retnowati, M.Si., M.Farm.
ISBN: 978-623-96524-1-8
Editor: Anisa Sholikhati, S.Pd., MT.
Penyunting: Noor Cholifah, S.SiT., M.Kes.
Ukuran: 13 x 23
Desain sampul dan tata letak: Apt. Trisdian HadiJaya, S. Farm
Penerbit : MU Press
Redaksi :
Jl. Ganesha I Purwosari Kudus 59316 Telp/Fax. (0291) 437218/442993 Email: mupress@stikesmuhkudus.ac.id
Distributor Tunggal : MU Press
Jl. Ganesha I Purwosari Kudus 59316 Telp/Fax. (0291) 437218/442993 Email: mupress@stikesmuhkudus.ac.id
iii KATA PENGANTAR
Puji syukur kami panjatkan ke hadirat Allah SWT yang senantiasa melimpahkan rahmat dan rezeki kepada hambaNya sehingga penulis mampu menyelesaikan buku berjudul Analisis Volumetri (Titrimetri) ini. Ucapan terima kasih tak terhingga kami sampaikan kepada:
1. Bapak Rusnoto, SKM., M.Kes (Epid), selaku Rektor Universitas Muhammadiyah Kudus
2. Ibu Noor Cholifah, S. SiT., M. Kes., selaku Kepala Pusat Penelitian dan Pengabdian Masyarakat Universitas Muhammadiyah Kudus
3. Keluarga tercinta
4. Semua civitas Universitas Muhammadiyah Kudus
5. Semua pihak yang telah membantu dalam penyusunan buku ini
Penulis menyadari bahwa sebuah karya tidak terlepas dari kekurangan, maka kami sangat mengharapkan saran dan kritik untuk membuat buku ini menjadi semakin baik. Akhir kata, penulis berharap agar buku ini dapat bermanfaat bagi pembaca agar semakin mudah memahami kimia analisis, khususnya tentang analisis volumetri. Amin.
Kudus, Maret 2021 Penulis
iv SINOPSIS
Setiap pembelajaran pasti mempunyai proses dan kendalanya sendiri. Semua bidang ilmu, tanpa terkecuali. Proses belajar akan menjadi menjemukan apabila hanya sekedar mengejar rutinitas tanpa mengetahui apa sebenarnya tujuan sekaligus dasar pemahamannya. Termasuk pula di bidang ilmu kimia yang merupakan salah satu bidang ilmu eksperimental, yaitu tidak bisa terlepas dari praktik eksperimen langsung berbagai macam metode. Analisis bahan adalah salah satu ilmu yang sangat penting untuk dikuasai dan memiliki berbagai macam metode kerja, salah satunya adalah analisis menggunakan ukuran volume (volumetri). Telah banyak referensi yang membahas tentang analisis volumetri ini, namun mungkin belum ada yang menyentuh sisi dasar akan kebutuhan pemahaman mahasiswa, khususnya rumpun bidang ilmu kesehatan. Di bidang kesehatan, ilmu kimia tentang analisis volumetri menjadi ilmu dasar yang sangat aplikatif sekali untuk menunjang pemahaman ilmu utama. Buku ini disusun untuk memenuhi kebutuhan dasar tersebut agar pemahaman di bidang ilmu kesehatan akan lebih komprehensif.
v DAFTAR ISI
HALAMAN JUDUL ... i
HAK CIPTA (COPYRIGHT) ... ii
KATA PENGANTAR ... iii
SINOPSIS ... iv
DAFTAR ISI ... v
BAB I PENDAHULUAN ... 1
BAB II DASAR ANALISIS VOLUMETRI ... 3
BAB III ALAT-ALAT ANALISIS VOLUMETRI ... 11
BAB IV METODE ANALISIS VOLUMETRI ... 23
4.1 Asidi-Alkalimetri ... 23
4.2 Titrasi Bebas Air (TBA) ... 26
4.3 Titrasi Argentometri ... 28
4.4 Titrasi Redoks (Reduksi-Oksidasi) ... 31
4.4.1Titrasi Permanganometri ... 33
4.4.2Titrasi Serimetri ... 35
4.4.3Titrasi yang melibatkan Brom (Br2) ... 37
4.4.4Titrasi yang melibatkan Kalium iodat ... 37
4.4.5Titrasi dengan Kalium bromat ... 38
4.5 Titrasi Kompleksometri ... 38
4.6 Titrasi Diazotasi ... 43
DAFTAR PUSTAKA ... 47
BIOGRAFI PENULIS ... 49
1 BAB I
PENDAHULUAN
Analisis data dalam sebuah penelitian merupakan hal yang sangat penting untuk memecahkan permasalahan yang akan diteliti secara lengkap.
Seorang peneliti harus mengerti dan memahami berbagai teknik analisis untuk membantu permasalahan dan pertanggung jawaban secara ilmiah.
Ketepatan dan keakuratan dalam penggunaan alat analisis sangat menentukan dalam pengambilan kesimpulan, sehingga analisis data merupakan kegiatan yang tidak dapat diabaikan dalam proses penelitian. Kesalahan dalam analisis dapat berakibat fatal terhadap kesimpulan dan akan berdampak buruk pada penggunaan dan hasil penerapan penelitian.
Secara garis besar teknik analisis data dibagi menjadi dua, yaitu analisis kuantitatif dan analisis kualitatif. Analisis kuantitatif merupakan penentuan jumlah zat tertentu yang terdapat pada suatu sampel dan dinyatakan dalam suatu ukuran tertentu. Zat yang ingin ditentukan jumlahnya dalam analisis kuantitatif biasa disebut dengan zat yang dianalisis (analit) yang dibagi menjadi dua, yaitu kecil dan besarnya sampel yang dianalisis.
Analisis kuantitatif berkaitan dengan jumlah atau kadar sedangkan analisis kualitatif adalah analisis yang tidak diangkakan yaitu dilakukan dengan cara mengolah data, mengorganisasikan (membuat urutan) data, memilih data sebagai sampel dengan tujuan untuk menentukan pola dan prioritas sesuai dengan apa yang dipelajari. Analisis kuantitatif sedikit lebih rumit dibanding dengan metode analisis kualitatif karena menyangkut ketepatan dan ketelitian tinggi. Salah satu metode kuantitatif adalah analisis volumetri. Analisis volumetri adalah teknik analisis kuantitatif berdasarkan jumlah, yaitu volume suatu larutan yang diketahui konsentrasinya supaya bereaksi sempurna dengan sejumlah tertentu komponen cuplikan. Analisis volumetri biasa dikenal dengan nama titrasi atau dengan kata lain analisis volumetri disebut juga analisis titrimetri. Analisis ini pertama kali dikenal pada awal abad ke- 18. Perkembangan dan pemahaman metode titrimetri ini sangat memerlukan ilmu tentang stoikiometri, kesetimbangan kimia serta termodinamika kimia.
Titrasi merupakan suatu cara analisis untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya, yaitu dengan cara mencampurkan keduanya agak terjadi reaksi antara kedua zat
2 tersebut. Zat yang dalam metode umumnya telah diketahui secara pasti konsentrasinya (standar) disebut dengan titran/titer dan diisikan pada buret, sedangkan zat yang akan dianalisis konsentrasinya disebut dengan titrat dan diisikan dalam erlenmeyer. Titer dan titrat pada analisis volumetri harus berupa larutan agar dapat dianalisis dengan mudah volumenya.
Larutan standar atau larutan baku adalah larutan yang konsentrasinya sudah diketahui dan dibuat dengan cara penimbangan zat dengan jumlah tertentu yang telah dicampur dengan sejumlah air sebagai pelarut. Proses penentuan konsentrasi larutan standar disebut dengan pembakuan atau standarisasi. Konsentrasi larutan yang dijadikan pedoman yang paling sering digunakan dalam analisis dinyatakan dengan molaritas atau normalitas, akan tetapi tidak menutup kemungkinan dapat dinyatakan dengan satuan konsentrasi yang lainnya, misalnya persentase (v/v), molalitas, dan sebagainya. Molaritas adalah jumlah mol zat terlarut dalam satu liter larutan, sedangkan normalitas adalah jumlah mol ekivalen zat terlarut dalam satu liter larutan.
Penamaan metode volumetri (titrasi) umumnya dikenal berdasarkan reaksi kimia yang terjadi antara kedua reagennya, yaitu digolongkan menjadi 4 kelompok besar jenis titrasi; titrasi reaksi asam basa, reaksi reduksi oksidasi (redoks), reaksi pengendapan (presipitasi), dan reaksi pembentukan kompleks. Namun demikian selain dari reaksi yang terjadi, titrasi juga digolongkan berdasarkan prosesnya, yaitu titrasi secara langsung dan titrasi kembali. Jumlah sampel juga menjadi dasar penamaan teknik titrasi, yaitu titrasi makro (100-1000 mg), titrasi semi semi mikro (10-100 mg) dan titrasi mikro (1-10 mg).
3 BAB II
DASAR ANALISIS VOLUMETRI
Metode volumetri atau titrimetri secara umum masih digunakan secara luas karena metode ini merupakan metode yang handal dari segi teknis dan prinsip, murah dan mampu memberikan ketepatan yang tinggi.
Keterbatasan dari metode titrimetri adalah metodenya yang kurang spesifik.
Metode titrimetri menggunakan pengukuran volume, yaitu dengan cara sejumlah zat yang dianalisis direaksikan dengan larutan baku (standar) yang telah diketahui kadar atau konsentrasinya secara teliti dan reaksinya berlangsung secara kuantitatif. Reaksi yang terjadi tidak untuk dikhususkan bagi bahan tertentu saja, akan tetapi dapat mencakup semua bahan dengan sifat yang sama atau hampir mirip secara umum. Misalnya, suatu reaksi asam basa dapat berlangsung dalam titrasi tanpa memperhatikan apakah itu basa atau asam kuat maupun asam basa lemah.
Larutan standar diteteskan dari buret ke dalam larutan yang akan diteliti dalam tempat (reaktor)nya, misal erlenmeyer. Proses mereaksikan dengan cara seperti ini disebut dengan titrasi. Larutan baku yang diteteskan disebut dengan titran. Ketika reaksi telah selesai disebut dengan titik ekivalen teoretis (stoikiometris) yang menyatakan bahwa bahan yang diuji telah bereaksi dengan reagen lain secara kuantitas (jumlah) tertentu sebagaimana dinyatakan dalam persamaan reaksi. Dalam melakukan suatu metode titrimetri banyak hal yang harus diperhatikan. Kesetimbangan kimia, konsep stoikiometri dan termodinamika kimia menjadi tiga hal yang sangat penting untuk dipahami sebelum melakukan teknik analisis titrasi. Ketiga hal tersebut adalah dasar yang harus mutlak dipahami oleh seorang analis karena dalam suatu titrasi, segala sesuatu yang berkaitan dengan titik ekivalen dan titik akhir titrasi, pengamatan, perhitungan dan pengolahan data volume serta kurva titrasi menjadi sangat penting untuk diperhatikan.
Contoh analisis yang menggunakan teknik titrasi adalah penentuan konsentrasi larutan Asam klorida melalui titrasi dengan larutan natrium hidroksida. Pada titrasi tersebut hanya terjadi satu reaksi saja dan tidak ada produk samping, persamaan reaksinya adalah:
HCl + NaOH → NaCl + H2O; K=1x1014
4 Reaksi kedua reagen tersebut dapat berlangsung dengan cepat dan terjadi hampir sempurna sesuai dengan perbandingan jumlah mol produk dan reaktannya, dinyatakan dalam nilai konstanta kesetimbangan yang besar.
Kasus lainnya, misalnya perhatikan reaksi antara Asam borat dengan Natrium hidroksida (NaOH) berikut:
HBO2 + NaOH → NaBO2 + H2O; K= 6 x106
Reaksi Asam borat dengan Natrium hidroksida tersebut tidak habis bereaksi secara sempurna, terlihat pada konstanta kesetimbangan reaksi yang hanya mencapai 6x106.
2.1 Pengamatan dan Interpretasi Volume Hasil Titrasi
Pengamatan dalam metode titrimetri dilakukan dengan cara pengamatan volume. Jumlah analit dalam suatu sampel dapat diketahui secara stoikiometris pada sebuah metode titrimetri melalui jumlah volume titran.
Tiap liter larutan standar berisi sejumlah berat/mol ekivalen senyawa baku.
Berat atau kadar suatu bahan yang diteliti dihitung dari volume larutan serta kesetaraaan mol yang bereaksi dari reagennya. Di samping volume titran, massa titran juga dapat diketahui dengan mengetahui massa jenisnya terlebih dahulu. Untuk mengamati volume secara akurat, alat utama yang digunakan dalam metode ini salah satunya adalah buret. Kriteria buret yang cocok dan baik digunakan untuk titrasi yaitu buret yang memiliki diameter dalam yang kecil sehingga memudahkan dalam pengamatan meniskus cairan secara lebih presisi.Ketika volume titran mencapai “yang diperlukan” untuk suatu analit bereaksi secara stoikiometris dengan titran maka saat itulah titrasi dihentikan dan disebut titik ekivalen. Secara eksperimental, titik akhir titrasi dapat diamati dengan perubahan warna/perubahan bentuk larutan yang diakibatkan oleh adanya suatu indikator yang sengaja ditambahkan pada saat titrasi.
Syarat reaksi kimia yang tepat untuk berlangsung dalam analisis volumetri adalah:
a. Reaksinya harus cepat.
b. Reaksinya cukup sederhana sehingga dapat dinyatakan dengan persamaan reaksi yang tepat.
c. Bahan yang dianalisis harus bereaksi sempurna dengan senyawa baku (standar) dan perbandingan stoikiometrisnya bisa mencapai kesetimbangan/setara.
5 d. Perubahan yang terjadi harus tampak jelas saat titik ekivalen tercapai,
baik perubahan secara fisik maupun kimia.
e. Indikator diperlukan ketika salah satu syarat di atas tidak terpenuhi agar pengamatan dengan pengukuran daya hantar listrik (misalna untuk titrasi potensiometri atau konduktometri) dapat dilakukan dengan tepat sasaran.
Kelebihan metode volumetri untuk penetapan kadar suatu zat antara lain:
a. Alatnya sederhana, cepat dan tidak memerlukan pekerjaan yang menjemukan, seperti pengeringan dan penimbangan secara berulang- ulang.
b. Memiliki ketelitian hingga part per million (ppm), yaitu 1 bagian dalam 1000.
Hal-hal yang harus diperhatikan ketika analisis volumetri adalah sebagai berikut:
a. Alat pengukur volume seperti buret, pipet volume dan labu takar harus ditera secara teliti (telah dikalibrasi).
b. Senyawa yang digunakan sebagai larutan baku atau sebagai standar harus senyawa dengan kemurnian yang tinggi.
c. Indikator atau perangkat lain untuk mengetahui titik akhir (selesai)nya titrasi.
d. Neraca analitik yang akurat untuk menimbang bahan atau senyawa baku untuk membuat larutan baku.
2.2 Titik Ekivalen dan Titik Akhir Titrasi
Kesetaraan kimia teoretis antar reagen dapat diketahui dari perhitungan persamaan reaksinya. Hasil titrasi yang akurat bisa tercapai ketika jumlah larutan analit telah bereaksi secara stoikiometris adalah dinyatakan ekivalen. Pada saat itulah disebut sebagai titik ekivalen.
Pengamatan dan penentuan berapa volume yang pasti untuk mencapai titik ekivalen adalah sangat penting. Jumlah mol titran yang digunakan bisa diketahui dari volume yang digunakan untuk mencapai titik ekivalen dikali dengan konsentrasi larutan titran.
𝑚𝑜𝑙𝑡𝑖𝑡𝑟𝑎𝑛 = 𝑉𝑒𝑞𝑥𝐶𝑡𝑖𝑡𝑟𝑎𝑛
Veq= Volume titran saat titik ekivalen tercapai
6 Berakhirnya suatu titrasi harus disertai tanda yang muncul tepat saat reaksi kimia telah berlangsung setimbang. Tanda yang terjadi misal tampak dari perubahan warna atau adanya endapan (kekeruhan) yang dapat dilihat dengan jelas. Perubahan tersebut diamati dengan sendirinya atau dengan bantuan larutan (zat lain) yang disebut dengan indikator. Momen saat perubahan pertanda bahwa suatu titrasi harus berakhir disebut dengan titik akhir titrasi yang dinyatakan dengan berapa jumlah volume larutan baku yang terpakai dari buret sebanyak sekian miliLiter.
Titrasi yang ideal adalah titrasi yang akurat, yaitu jika titik akhir titrasi persis sama atau sangat mendekati (berimpit) titik ekivalen teoretis.
Perbedaan antara titik akhir titrasi dengan titik ekivalen dinyatakan dengan kesalahan titrasi, suatu kesalahan (error) dalam pengukuran. Dalam kenyataan praktiknya selalu ada perbedaan kecil antara titik akhir titrasi dengan titik ekivalen teoretis yang disebut dengan kesalahan titrasi, yaitu selisih sekian miliLiter larutan baku. Oleh karena itu, untuk melakukan titrasi perlu pengulangan analisis 3 kali atau lebih untuk meminimalisasi terjadinya kesalahan titrasi tersebut. Pemilihan indikator juga harus memperhatikan aspek kesesuaian reaksi kimia antar reagen agar kesalahan dalam analisis dapat dihindari.
2.3 Kurva Titrasi
Kurva titrasi dapat dibuat dengan tujuan sebagai alternatif untuk mengkoreksi suatu kesalahan (error) pada titrasi. Suatu kurva titrasi dapat menunjukkan progress (perjalanan) suatu reaksi dalam titrasi sebagai suatu fungsi volume. Kurva titrasi dapat memberikan gambaran secara visual tentang bagaimana profil perubahan sifat atau karakter larutan seiring dengan penambahan titran selama titrasi. Perubahan sifat larutan yang dapat diamati sesuai dengan jenis titrasi apa yang dilakukan. Misal, pada titrasi asam basa maka sifat larutan yang dapat diamati seiring penambahan volume selama titrasi adalah perubahan pH yang dapat diamati dengan alat ukur pH. Dari kurva titrasi juga dapat diamati karakter indikator, apakah sesuai untuk suatu jenis titrasi, ataukah justru menimbulkan kesalahan titrasi. Tentunya ini akan sangat berguna untuk evaluasi pada teknik titrasi selanjutnya.
7 Gambar 1. Kurva titrasi dengan titran NaOH (Harvey, 2000)
Pada gambar 1, terlihat kurva titrasi antara pH versus volume titran (NaOH) dalam satuan mL. Dengan seiring bertambahnya volume NaOH yang dialirkan ke larutan sampel maka dapat dilihat dari kurva tersebut bahwa terjadi peningkatan nilai pH larutan titrat (sampel). Pada titik volume tertentu, penambahan volume di atas 25 mL NaOH terjadi peningkatan nilai pH yang sangat signifikan. Hal ini adalah salah satu tanda titik ekivalen akan segera tercapai, yaitu sedikit saja penambahan volume titran akan menyebabkan perubahan signifikan pada karakter pH larutan. Ini adalah ciri bahwa suatu larutan sudah mencapai ekivalensi secara kesetimbangan stoikiometris.
Artinya, jumlah mol antara kedua reagen yang direaksikan tepat habis bereaksi dengan jumlah mol yang sama. Jika titrasi dilanjutkan hingga volume lebih dari titik ekivalen, maka dapat dipastikan bahwa volume titran sudah berlebih. Dari kurva titrasi dapat diprediksi seberapa besar kesalahan (error) dalam titrasi dan seberapa powerful suatu indikator yang digunakan.
Gambar 2a, 2b dan 2c di bawah adalah contoh kurva titrasi berturut- turut adalah kurva titrasi kompleksometri, titrasi redoks dan titrasi pengendapan (presipitasi). Pengukuran besaran pada titrasi tidak hanya konsentrasi dan pH saja. Banyak titrasi yang juga menggunakan parameter kenaikan temperatur, absorbansi cahaya untuk mengukur dampak dari penambahan volume titran. Seberapa signifikan efek yang timbul akibat penambahan volume pada parameter tersebut. Misalnya, untuk reaksi yang eksotermis terjadi kenaikan temperatur yang teratur selama titrasi, yaitu ketika titran dan analit saling bereaksi. Penambahan titran akan mengakibatkan kenaikan temperatur yang sangat signifikan ketika titik
8 ekivalen tercapai dan tidak akan lagi ada kenaikan temperatur jika titrasi sudah lewat dari titik ekivalen, dan menandakan bahwa titrasi sudah selesai.
Gambar 2. Contoh kurva titrasi : (a) kurva titrasi kompleksometri, (b) kurva titrasi redoks, (c) kurva titrasi presipitasi
2.4 Perhitungan dalam Titrasi
Dalam suatu analisis kuantitatif seperti halnya titrasi pasti diperlukan perhitungan yang tepat dan presisi karena suatu analisis kuantitatif selalu berkaitan dengan angka. Teknik titrasi juga dilakuan untuk tujuan standarisasi larutan. Standarisasi sebuah larutan pada dasarnya adalah untuk mengetahui kadar atau konsentrasi sebuah larutan dengan tepat sehingga perlu digunakan larutan baku (standar) lainnya yang sudah diketahui konsentrasinya secara pasti sebagai pembanding. Berikut contoh perhitungan standarisasi sebuah larutan:
Standarisasi HCl dilakukan dengan menggunakan baku primer Natrium karbonat. Sebanyak 354,2 mg Natrium karbonat dilarutkan dalam air dan dititrasi dengan larutan HCl (larutan yang akan distandarisasi) menggunakan indikator Metil orange. Titik akhir titrasi yaitu saat reaksi membutuhkan volume HCl sebesar 30,23 mL. Hitunglah berapa normalitas HCl?
Jawab:
9 Reaksi standarisasi HCl dengan Natrium karbonat menggunakan metil orange adalah:
Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2
Dari reaksi tersebut diketahui bahwa tiap mol Natrium karbonat bereaksi dengan 2 mol HCl (setara dengan 2 gram ekivalen ion H+) sehingga valensinya adalah 2. Sebagaimana diketahui pada titik ekivalen:
mgrek HCl = mgrek Na2CO3
Volume HCL (mL) x N HCl = mmol Na2CO3 x valensi Volume HCL (mL) x N HCl = mg Natrium karbonat
BM Natrium karbonat x valensi sehingga :
NHCl = mg Natrium karbonat x valensi
BM Natrium karbonat x mL HCl → 354,2 x 2
106 x 30,23= 0,2211 N
Cara perhitungan kadar suatu zat dapat dituliskan secara skematis sebagai berikut:
V x N = jumlah gram ekivalen (grek) jumlah mol
Kadar (% w/w) massa zat
Gambar 3. Skema perhitungan kadar analisis volumetri (Achmad dan Abdul, 2006)
2.5 Indikator
Di dalam titrasi, maksud indikator adalah suatu senyawa yang sengaja ditambahkan ke dalam sistem titrasi (ke dalam analit) yang bertujuan agar dapat memberikan tanda bahwa titrasi sudah bisa dihentikan. Laju alir titran menuju analit (sampel) dapat dihentikan saat larutan analit yang telah ditambahkan senyawa indikator mengalami perubahan dari keadaan awal, baik itu perubahan warna, terjadi endapan, dan lain-lain. Senyawa indikator sebenarnya adalah molekul yang dapat mengalami perubahan secara sifat fisik ketika suatu titrasi dilakukan. Pemilihan indikator disesuaikan dengan jenis titrasi, reagen yang terlibat dalam titrasi yang dilakukan. Perubahan sifat fisik yang dialami indikator disebabkan oleh perubahan dalam susunan atau struktur molekulnya, yaitu berubah secara ionik, atau berubah secara konformasi, berubah secara ikatan fisik bisa karena pH, pengaruh reagen lain
x ekivalen : ekivalen
(100%) x (: massa sampel)
x BM
10 dan lain-lain. Macam-macam indikator yang dikenal dalam dunia titrasi, khususnya asam basa antara lain disebutkan dalam tabel 1.
Tabel 1. Macam-macam indikator dan rentang pH perubahannya Indikator Warna pada
pH Asam
Warna pada
pH Basa Rentang pH
Methyl orange Merah Oranye 3,1-4,4
Thymol blue Merah Kuning 1,2-2,8
Bromothymol blue Kuning Biru 6,0-7,6
Bromophenol blue Kuning Biru 3,0-4,6
Cresol red Merah Kuning 0,2-1,8
Bromocresol green Kuning Biru 3,8-5,4
Bromocresol purple Kuning Ungu 5,2-6,8
Methyl red Merah Kuning 4,2-6,3
Litmus Merah Biru 5,0-8,0
Phenol red Kuning Merah 6,8-8,4
Allizarin yellow R Kuning Orange/merah 10,1-12,0 Phenolphthalein Tak berwarna Merah 8,3-10,0 Indikator campuran
Bromocresol green dan Chlorophenol red
kuning kehijauan biru violet 5,4-6,2
Bromocresol green dan methyl orange
orange biru kehijauan 3,5-4,3
Bromothymol blue dan phenol red
kuning violet 7,2-7,6
41 b. Titrasi balik
Titrasi kembali dilakukan untuk logam yang mengendap dengan hidroksida pada pH yang diinginkan untuk titrasi, senyawa tidak larut seperti sulfat, kalsium oksalat, untuk membentuk senyawa kompleks yang sangat lambat dan ion logam yang digunakan untuk membentuk senyawa kompleks lebih stabil dengan larutan standar daripada dengan indikator. Jika sudah stabil kemudian ditambahkan larutan baku berlebih lalu ditambahkan buffer pada pH yang diinginkan. Larutan standar yang berlebih diatasi dengan titrasi balik dengan menggunakan larutan standar ion logam. Penentuan titik akhir titrasi pada titrasi balik dengan menggunakan bantuan indikator logam.
c. Titrasi subtitusi
Titrasi subtitusi ini dilakukan karena ion logam yang tidak bereaksi sempurna dengan indikator maupun ion-ion logam yang membentuk kompleks yang lebih stabil dengan pengkhelat, misal EDTA. Ion logam tersebut akan mampu mengganti ion logam lainnya pada kompleks, misal ion logam Mg2+ atau Ca2+ pada Mg-EDTA atau Ca-EDTA diganti dengan ion logam M+. Indikator ang sering digunakan dalam titrasi substitusi, yaitu indikator hitam eriokrom.
d. Titrasi tidak langsung
Titrasi tidak langsung digunakan untuk menentukan kadar ion seperti anion yang tidak bereaksi dengan pengkelat, sehingga perlu penambahan treatment pra titrasi. Contohnya adalah ion barbiturat yang tidak dapat bereaksi dengan EDTA tetapi secara kuantitatif dapat diendapkan dengan ion Hg2+ dalam keadaan basa sebagai ion kompleks. Pengendapan ditandai dengan kelebihan Hg(II) sehingga endapan dapat disaring dan dilarutkan kembali dengan larutan baku EDTA berlebih. Larutan baku Zn(II) digunakan untuk menitrasi kelebihan EDTA menggunakan indikator yang sesuai untuk menentukan titik akhir titrasi dan kadar kelebihan EDTA dapat dideteksi sehingga kadar barbiturat dapat diketahui setelahnya. Reaksi lengkap dapat dilihat pada persamaan reaksi sebagai berikut.
Anion barbiturat (B-) + Hg2+ → Kompleks Hg-B
Kompleks Hg-B + EDTA2- berlebih → B- + Hg-EDTA + EDTA2- berlebih
EDTA2- berlebih + Zn2+ → Zn-EDTA + 2 H+
42 Cara lain yang dapat digunakan adalah dengan mengendapkan anion dengan kelebihan logam yang sesuai dan kelebihan ion logam dalam filtrat dititrasi dengan larutan baku EDTA.
e. Titrasi alkalimetri
Prinsip titrasi alkalimetri dalam kaitannya dengan metode kompleksometri yaitu menganalisis H+ yang dibebaskan dari kompleks logam-EDTA dengan cara dititrasi dengan larutan baku yang bersifat alkali (basa). Penentuan kadar logam dengan cara ini dapat dilakukan dengan syarat kondisi larutan sebelum titrasi harus netral terhadap indikator yang digunakan. Penentuan titik akhir titrasi menggunakan indikator asam-basa atau dapat juga dilakukan secara potensiometri. Dalam Farmakope Indonesia disebutkan bahwa titrasi kompleksometri umumnya digunakan untuk menetapkan kadar bismut subkarbonat, bismut subnitrat, kalsium karbonat, kalsium klorida dan sediaan injeksinya, kalsium glukonat, kalsium hidrogen pospat, kalsium hidroksida dan larutan tabletnya, kalsium pantotenat, kalsium sulfat, magnesium karbonat, magnesium stearat, mangan sulfat, zink klorida dan zink sulfat.
4.5.2 Indikator titrasi kompleksometri
Indikator yang digunakan untuk titrasi kompleksometri umumnya adalah zat warna organik yang dapat membentuk kompleks stabil dengan ion.
Zat warna tersebut disebut dengan indikator metallokromik. Agar dapat digunakan sebagai indikator dalam titrasi EDTA, maka kompleks logam- indikator secara visual harus memiliki warna yang berbeda dari indikator yang belum membentuk kompleks dengan logam. Terlebih lagi, konstanta pembentukan kompleks logam-indikator harus lebih kecil dibanding pembentukan kompleks logam-EDTA. Awalnya, indikator ditambahkan terlebih dahulu ke dalam larutan analit membentuk warna tertentu dari kompleks logam-indikator. Seiring dengan penambahan EDTA maka EDTA akan bereaksi terlebih dahulu dengan molekul analit yang masih bebas (tidak membentuk kompleks dengan indikator). Kemudian lama kelamaan EDTA dapat bereaksi penggantian analit dari kompleks logam-indikator sehingga mempengaruhi warna larutan. Akurasi titik akhir titrasi tergantung dari kekuatan kompleks logam-indikator dibanding kekuatan ikatan kompleks logam-EDTA. Jika kompleks logam-indikator terlalu kuat maka perubahan warna terjadi setelah titik ekivalen. Jika kompleks logam-indikator kekuatan
43 ikatnya lebih lemah maka titik akhir titrasi akan tampak sebelum titik ekivalen. Hampir semua indikator metalokromik adalah asam atau basa lemah. Konstanta pembentukan kompleks logam-indikator tergantung pada pH larutan. Kekuatan kompleks logam-indikator sangat tergantung pengaturan pH saat titrasi sehingga kesalahan titrasi dapat seminimal mungkin. Berikut tabel indikator yang cocok untuk logam tertentu dalam titrasi kompleksometri.
Tabel 7. Indikator metalokromik untuk logam dalam senyawa kompleks
Indikator Rentang pH Logam
Asam salisilat 2-3 Fe
PAN 2-11 Cd, Cu, Zn
Murexide 6-13 Ca, Ni, Cu
Calmagite 9-1 Ba, Ca, Mg, Zn
Eriochrome Blue Black R 8-12 Ca, Mg, Zn, Cu Eriochrome Black T 7,5-10,5 Ba, Ca, Mg, Zn
4.6 Titrasi Diazotasi
Titrasi diazotasi atau biasa disebut dengan nitrimetri merupakan cara analisa volumetri dengan titrasi redoks yang didasarkan pada reaksi pembentukan garam diazonium dari gugus amin aromatis bebas yang direaksikan dengan asam nitrit, dimana asam nitrit ini diperoleh dengan cara mereaksikan NaNO2 dengan suatu asam. Garam diazonium terbentuk dari hasil reaksi antara senyawa yang mengandung gugus amin aromatis bebas, pada suhu di bawah 15°C dalam senyawa asam.
Contoh titrasi diazotasi adalah digunakan untuk menetapkan kadar senyawa antibiotik sulfonamida dan senyawa anestetika lokal golongan asam amino benzoat. Titrasi diazotasi digunakan dalam analisis senyawa-senyawa organik, khususnya untuk persenyawaan amina primer. Contoh zat yang memiliki gugus amin aromatik primer adalah benzokain, parasetamol sekunder, gugus nitroaromatik (misalnya:kloramfenikol), senyawa nitrosamine, amin alifatik, senyawa dengan gugus hidrazida (INH=Isoniazid). Metode titrasi diazotasi dalam penetapan kadar secara kuantitatif dengan menggunakan larutan baku NaNO2.
Titrasi diazotasi mempunyai berat ekivalen sama dengan berat molekul karena 1 mol senyawa amina aromatis bereaksi dengan 1 mol asam
44 nitrit pada suasana asam dan akan membentuk garam diazonium. Pada titrasi diazotasi konsentrasi larutan lebih mudah dinyatakan dengan molaritas (M).
Syarat-syarat yang harus diperhatikan ketika titrasi diazotasi adalah:
a. Suhu
Suhu untuk melakukan titrasi harus antara 5-15˚C. Untuk menjaga agar selama titrasi berada pada suhu tersebut maka biasanya digunakan stabilitator yaitu dengan penambahan KBr. Titrasi ini tidak dapat dilakukan pada suhu tinggi karena HNO2 yang terbentuk akan menguap pada suhu tinggi, dan garam diazoniumnya akan terurai menjadi fenol.
b. Keasaman
Pada titrasi ini diperlukan suasana asam, yaitu berlangsung pada pH= 2.
Kondisi asam tersebut bertujuan untuk mengubah NaNO2 menjadi HNO2
dan pembentukan garam diazonium.
c. Kecepatan reaksi
Reaksi diazotasi berlangsung sangat lambat sehingga supaya reaksi berlangsung sempurna maka titrasi harus dilakukan perlahan-lahan dan dilakukan pengocokan yang kuat. Frekuensi tetesan pada awal titrasi diatur kurang lebih 1 mL/menit dan ketika mendekati titik akhir titrasi menjadi 2 mL/menit karena asam nitrit terbentuk pada suasana asam dan adanya KBr pada titrasi nitrimetri. KBr dapat mengikat NO2 untuk membentuk nitrosobromid yang akan menghilangkan reaksi tautomerasi dari bentuk keto ke bentuk enol sehingga dibutuhkan katalisator untuk mempercepat reaksi. Stabilisator suhu, yaitu KBr digunakan untuk menjaga suhu agar tetap rendah (5-150C) untuk mengikat NO2 agar asam nitrit tidak terurai atau menguap.
Penentuan titik akhir titrasi diazotasi dapat dilakukan dengan berbagai cara:
a. Menggunakan indikator luar
Penentuan titik akhir titrasi diazotasi tercapai jika menggunakan indikator luar seperti pasta kanji-iodida atau kertas kanji-iodida. Caranya adalah dengan penggoresan larutan yang dititrasi menggunakan pasta kanji iodida atau kertas kanji iodida akan menghasilkan warna hijau toska atau biru.
Hal ini disebabkan oleh oksidasi iodida oleh udara. Kelebihan asam nitrit akan mengoksidasi iodida menjadi iodium. Indikator kanji memberikan
45 kepekaan terhadap kelebihan 0,05-0,10 mL natrium nitrit dalam 200 mL larutan. Reaksi yang terjadi dapat dituliskan:
NaNO2 + HCl → HNO2 + NaCl KI + HCl → KCl + HI
2 HI + 2 HONO → I2 + 2 NO + 2 H2O I2 + Kanji → kanji iod (biru)
Kekurangan indikator luar adalah harus memperkirakan jumlah titran yang dibutuhkan terlebih dahulu sehingga harus sering melakukan pengujian apakah sudah tercapai titik akhir titrasi atau belum.
b. Indikator dalam
Penentuan titik akhir titrasi diazotasi dapat tercapai juga dengan menggunakan indikator dalam yang terdiri atas campuran tropeolin OO dan metilen biru. Tropeolin OO merupakan indikator asam basa yang berwarna merah jika dalam suasana asam dan berwarna kuning jika dioksidasi dengan kelebihan asam nitrit sedangkan metilen biru berfungsi sebagai pengkontras warna sehingga pada titik akhir titrasi memberikan perubahan warna dari ungu menjadi biru sampai hijau tergantung senyawa yang digunakan untuk titrasi. Kekurangan pemakaian indikator dalam yaitu jika menggunakan senyawa yang berbeda maka akan memberikan warna yang berbeda pula c. Metode potensiometer
Jenis reaksi nitritasi ini sangat praktis untuk analisis antibiotik sulfonamide dan anestetik lokal turunan asam benzoat. Jenis reaksinya antara lain reaksi sulfanilamide dengan asam nitrit. Reaksi diazotasi yang lain yaitu pada analisis suksinil sulfatiazol. Senawa tersebut harus dihidrolisis terlebih dahulu sehingga diperoleh gugus amin aromatis bebas yang bisa bereaksi dengan natrium nitrit dalam suasana asam membentuk garam diazonium.
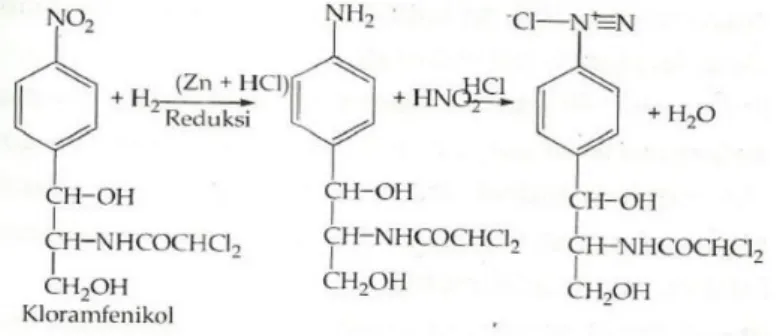
Senyawa yang mempunyai gugus nitro aromatis seperti kloramfenikol juga dapat dianalisis secara nitrimetri setelah direduksi terlebih dahulu supaya menghasilkan amin aromatis primer.
Kloramfenikol mempunyai gugus nitro aromatis yang direaksikan telebih dahulu dengan Zn/ HCl untuk menghasilkan senyawa amin aromatis pimer bebas kemudian dilanjutkan bereaksi dengan asam nitrit untuk membentuk garan diazonium. Pada Farmakope Indenesia diazotasi digunakan untuk menetapkan kadar benzokain, primakuin fosfat, dan sediaan
46 tabletnya, prokain HCl, sulfasetamid, sulfametazin, sulfadoksin, sulfametoksazol, tetrakain, dan tetrakain HCl.
Gambar 18. Reaksi diazotasi pada analisis kloramfenikol
47 DAFTAR PUSTAKA
Achmad, M dan Abdul, R. 2006. Pengantar Kimia Farmasi Analisis:
Volumetri dan Gravimetri. Pustaka Pelajar: Yogyakarta.
Anonim. 1994. Farmakope Indonesia. Edisi IV. Departemen Kesehatan Republik Indonesia: Jakarta.
Basset, J., Denny, R. C., Jeffery, G.H., and Mendham. 1989. Vogel’s Textbook of Quantitative Chemical Analysis. Fifth Edition.
Longman Scientific & Technical. John Wiley & Sons Inc: New York.
Day, Jr, R.A., and Underwood, A.L. 1998. Quantitative Analysis. 6th Ed.
Diterjemahkan oleh Iis Sopyan, Penerbit Airlangga: Jakarta.
Gandjar, I. G. 1991. Kimia Analisis Instrumental. Fakultas Farmasi.
Universitas Gadjah Mada: Yogyakarta.
Haryanto, Sri Haryani dan Agung Tri P. 2006. Petunjuk Praktikum Dasar- Dasar Kimia Analitik. Semarang: Jurusan Kimia FMIPA UNNES.
Harvey, D. 2000. Modern Analytical Chemistry. The McGraw-Hill Companies, Inc.: USA.
Daintith, J. 1994. Kamus Lengkap Kimia. Diterjemahkan oleh Suminar Achmadi. Jakarta: Erlangga
Khopkar, S.M. 1990. Basic Concepts of Analytical Chemistry, diterjemahkan oleh Saptoraharjo, Universitas Indonesia Press: Jakarta.
Harmita. 2006. Analisis Kuantitatif Bahan Baku dan Sediaan Farmasi edisi I (hal 98-101). Departemen Farmasi FMIPA Universitas Indonesia.
Depok.
48 Jenkins, G. L. 1967. Quantitative pharmaceutical chemistry. 6th edition. Mc
graw-Hill Book Company: New York.
Skoog, D. A. 1985. Principle of Instrumental Analysis. 3rd Ed., Saunders Collage Publishing: New York.
Watson, D. G. 1999. Pharmaceutical Analysis: A textbook for Pharmacy students and pharmaceutical chemists. Churchill Livingston: UK.
Wunas, J. Said. 1986. Analisa Kimia Farmasi Kuantitatif. Makassar : UNHAS.
49 BIOGRAFI PENULIS
Yayuk Mundriyastutik, ST., MT.
Lahir di Grobogan 6 November 1991 Penulis menyelesaikan Pendidikan S1 Teknik Kimia Universitas Muhammadiyah Surakarta pada tahun 2013 kemudian melanjutkan ke S-2 Teknik Kimia di Universitas Diponegoro tahun lulus 2015. Sebagai Dosen di Uniersitas Muhammadiyah Kudus mulai tahun 2015. Aktif Mengajar mata kuliah yang berhubungan dengan ilmu kimia dan aplikasinya.
50 Iffana Dani Maulida, S.Si., M.Sc.
Lahir di Demak, 29 September 1988. Telah menyelesaikan studi S1 Kimia di Universitas Diponegoro tahun 2010 dan lulus jenjang strata 2 di bidang ilmu yang sama di prodi S2 Kimia Universitas Gadjah Mada tahun 2014.
Mulai tahun 2017 aktif sebagai pengajar di Universitas Muhammadiyah Kudus.
Konsisten mendalami dan aktif mengajar mata kuliah yang berhubungan dengan Ilmu Kimia dan aplikasinya di berbagai prodi, salah satunya tentang bidang kimia analisis dan konsep titrasi.
51 Apt. Eko Retnowati, M.Si.,M.Farm.
Lahir di Pati, 18 Oktober 1975. Telah menyelesaikan studi S1 Farmasi di Universitas Surabaya tahun 2001, dilanjutkan dengan menyelesaikan Profesi Apoteker di Fakultas Farmasi Program Studi Profesi Apoteker Universitas Gadjah Mada tahun 2002 dan lulus jenjang strata 2 di bidang ilmu Manajemen Sumber Daya Manusia di prodi S2 Manajemen Sekolah Tinggi Ilmu Ekonomi dan Pariwisata (STIEPARI) Semarang tahun 2013. Pada tahun 2016 menyelesaikan S2 Farmasi Klinis di Universitas Ahmad Dahlan Yogyakarta.
Mulai tahun 2017 aktif sebagai pengajar di Universitas Muhammadiyah Kudus.
Konsisten mendalami dan aktif mengajar mata kuliah yang berhubungan dengan Ilmu Farmasi dan aplikasinya.
52 Ilmu kimia merupakan salah satu bidang ilmu eksperimental, yaitu tidak bisa terlepas dari praktik eksperimen langsung dengan berbagai macam metode. Analisis bahan adalah salah satu ilmu yang sangat penting untuk dikuasai dan memiliki berbagai macam metode kerja, salah satunya adalah analisis menggunakan ukuran volume (volumetri). Telah banyak referensi yang membahas tentang analisis volumetri ini, namun mungkin belum ada yang menyentuh sisi dasar akan kebutuhan pemahaman mahasiswa, khususnya rumpun bidang ilmu kesehatan.
Di bidang kesehatan, ilmu kimia tentang analisis volumetri menjadi ilmu dasar yang sangat aplikatif sekali untuk menunjang pemahaman ilmu utama. Buku ini disusun untuk memenuhi kebutuhan dasar pemahaman mahasiswa khususnya tentang aplikasi kimia di bidang ilmu kesehatan agar lebih komprehensif.
Penerbit : MU Press
Jl. Ganesha I Purwosari Kudus 59316 Telp/Fax. (0291) 437218/442993 Email: mupress@stikesmuhkudus.ac.id
A N A L I S I S V O L U M E T R I ( T I T R I M E T R I )