KEADAAN-KEADAAN TRANSISI MOLEKUL
1,3,5-HEKSATRIENA MENGGUNAKAN
KOMPUTASI SEMIEMPIRIK HUCKEL
Karya Tulis Ilmiah
Oleh:
Rustaman
KEADAAN-KEADAAN TRANSISI MOLEKUL
1,3,5-HEKSATRIENA MENGGUNAKAN
KOMPUTASI SEMIEMPIRIK HUCKEL
Karya Tulis Ilmiah
Oleh:
Rustaman
Mengetahui/Menyetujui: Ketua Jurusan Kimia FMIPA Unpad,
DAFTAR ISI
DAFTAR ISI... i
1. Pendahuluan... 1
2. Tinjauan Pustaka... 2
2.1. Metode Orbital Molekul Huckel... 2
2.2. Teori Simetri dan Grup ... 5
3. Metode Perhitungan... 6
4. Hasil dan Pembahasan ... 6
4.1. Perhitungan Huckel tanpa memperhatikan konsep simetri dan grup: ... 6
4.2. Perhitungan 1,3,5-heksatriena dengan metode Huckel yang sudah memasukkan konsep simetri dan grup... 9
5. Kesimpulan ... 19
6. Daftar Pustaka... 19
1. Pendahuluan
Ketika pertama kali kita mendengar frase “perhitungan orbital molekul”, kesan yang muncul adalah pekerjaan tersebut pasti memerlukan perhitungan matematika yang rumit dan setumpuk keluaran (output) hasil perhitungan komputer yang harus dianalisis. Namun, hal yang menarik untuk dicatat adalah kadang-kadang perhitungan yang relatif sederhana dapat memberikan informasi yang sangat berguna yang dapat menghubungkan hasil-hasil pengamatan secara eksperimen. Perhitungan sederhana yang dimaksud adalah metode orbital molekul Hückel (HMO). Metode ini dikembangkan pada tahun 1931 oleh Erich Hückel, seorang ahli fisika Jerman yang ingin mencoba memahami konsep aromatisitas pada benzena. tetapi kemudian metode ini dikembangkan untuk mempelajari sifat-sifat molekul molekul hidrokarbon linier yang memiliki ikatan rangkap terkonjugasi. Prosedur perhitungannya relatif sederhana sehingga menjadikannya dikenal sebagai perhitungan “di balik amplop”.1
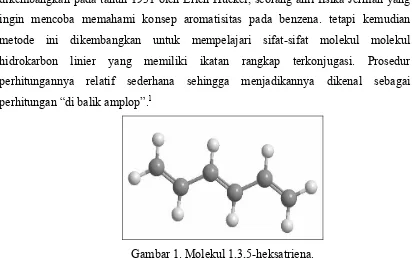
Gambar 1. Molekul 1,3,5-heksatriena.
Molekul 1,3,5-heksatriena adalah salah satu model molekul hidrokarbon terkonjugasi linier paling sederhana setelah molekul butandiena. Molekul heksatriena ini dapat dijadikan model untuk mempelajari molekul poliena terkonjugasi yang memiliki pola ikatan kimia yang sama, hanya saja poliena memiliki rantai yang panjang. Molekul poliena ini menarik untuk dipelajari karena polimer ini dapat menghantarkan arus listrik dengan adanya ikatan rangkap yang terkonjugasi ini.
Agar memudahkan dan mempercepat perhitungan, maka dilakukan pemrograman dengan menggunakan software MatLab™ versi 7.0.
2. Tinjauan Pustaka
2.1.Metode Orbital Molekul Huckel
Metode ini dikembangkan pada tahun 1931 oleh Erich Hückel, seorang ahli fisika Jerman. Pada awalnya Hückel ingin mencoba memahami konsep aromatisitas pada molekul benzena, tetapi kemudian metode ini dikembangkan untuk mempelajari sifat-sifat molekul molekul hidrokarbon linier yang memiliki ikatan rangkap terkonjugasi.
Pada metode Hückel, asumsi-asumsi yang dibuat adalah bagian ikatan-σ dan ikatan-π dalam molekul dapat dipisahkan karena ikatan-π berada pada bidang yang tegak lurus terhadap bidang molekul, jarak antara elektron-π dan elektron-σ cukup besar sehingga interaksi antara mereka relative lebih kecil daripada interaksi antara elektron-elektron sejenis. Juga, overlap orbital-orbital atom yang tidak berdekatan dianggap berharga nol. Selain itu, energi interaksi antar atom yang tidak berdekatan dianggap nol.
Bila interaksi ini dapat diabaikan, maka orbital molekul dari suatu molekul terkonjugasi dapat dinyatakan sebagai kombinasi linier dari orbital-orbital 2pz saja. Pandangan inilah yang mendasari teori elektron-π.
Hückel mengembangkan metode perhitungan yang dapat memberikan pengertian-pengertian dasar yang sangat berguna dari suatu senyawa terkonjugasi. Dalam metode ini, orbital molekul (ψ ) diungkapkan sebagai kombinasi linier dari orbital-orbital 2pz dari semua atom karbon dalam molekul, yaitu:
∑
=
i i i
cφ
ψ (1)
εψ ψ =
Hˆ (2)
Persamaan (2) memenuhi persamaan sekuler:
(
−)
=0∑
jj
ij
ij S c
H ε (3)
dengan
∫
∫
== Hˆ dv; S dv.
Hij φi φj ij φiφj (4)
Menurut Hückel, integral persamaan (4) dapat diungkapkan dengan data empiris; misalnya Hii merupakan potensial ionisasi elektron-π di karbon ke-i dan
, 1
i i
H ± merupakan energi yang diperlukan jika elektron-π melompat ke atom tetangga terdekat. Selain itu, Sii =1 dan Sij lainnya diabaikan karena jauh lebih kecil dari satu. Sehingga dapat dituliskan:
⎪⎩ ⎪ ⎨ ⎧ ± = = = lainnya i j j i Hij ; 0 1 ; ; β α (5a) ⎩ ⎨ ⎧ = = lainnya j i Sij ; 0 ; 1 (5b)
dengan potensial ionisasi (α) dan energi lompat (β) harus dinyatakan negatif. Selain itu, sebagai akibat persamaan (5b), dengan menormalisasi orbital molekul dalam persamaan (1) maka berlaku:
1
2 =
∑
i ci (6)Bila ψr adalah salah satu orbital molekul sebagai solusi dari persamaan sekuler; maka diperoleh
∑
= = N i i ri r c 1 φψ (7)
Karena orbital molekul ini dinormalisasi, maka 1 , = = =
∑ ∫
∑
∫
i ij rj ri j i j i rj ri rrψ dv c c φφ dv c c S
ψ . (8)
1
2 =
=
∑
∫
iri r
rψ dv c
ψ (9)
Besaran-besaran molekul yang dapat dihitung dengan metode Hückel adalah: 1. Rapat Elektron-π
Persamaan (9) mempunyai makna bahwa cri2 merupakan kerapatan parsial elektron-π di atom karbon ke-i karena sebuah elektron-π menempati orbital molekul ψr. Jika nr adalah jumlah elektron-π yang menempati orbital molekul
ψr maka total kerapatan elektron-π di atom karbon ke-i adalah
∑
=
r ri r
i n c
q 2 (10)
2. Order Ikatan Antar Atom Karbon
Order-ikatan antar atom-atom karbon ke-i dan ke-j adalah
j i c c n p
r
rj ri r
ij =
∑
; ≠ (11)Order-ikatan mempunyai hubungan dengan panjang ikatan. Semakin besar order-ikatan, semakin kuat pula ikatan tersebut sehingga panjang ikatannya semakin pendek.
3. Panjang Ikatan Antara Atom Karbon
Hubungan antara order-ikatan dan panjang ikatan dapat mengikuti rumusan empiris dari Coulson (Proc. R. Soc. 169A, 413 (1939)):
) (
15 , 0 5 ,
1 p Angstrom
rij = − ij (12)
4. Valensi Bebas Elektron-π
Coulson (Discuss. Faraday Soc. 2, 9(1947)) mengemukakan valensi bebas suatu atom karbon, yakni mudahnya atom itu diserang radikal bebas. Valensi bebas suatu atom karbon adalah selisih antara order-ikatan maksimum yang mungkin dan total order-ikatan yang terkait dengan atom karbon tersebut. Harga order-ikatan maksimum terjadi pada atom karbon di pusat trimetilenmetan (Gambar 1), yakni 1,732. Dengan demikian maka valensi bebas atom karbon ke-i adalah
i
i P
Jadi, semakin besar harga total order-ikatan pada suatu atom karbon, semakin kecil pula valensi bebasnya; artinya, semakin kecil peluang atom itu untuk bisa diserang radikal bebas.
5. Energi Total Elektron-π Energi total elektron-π adalah: =
∑
r r r
o n
E ε (14) dengan εr adalah energi orbital molekul ψr.
6. Energi Lokalisasi
Energi lokalisasi Elok adalah energi elektron-π jika semua ikatan dalam keadaan terlokalisasi. Energi ini dapat dihitung dengan memandang bahwa semua Hij=0 kecuali atom ke-i dan ke-j berikatan rangkap. Jika g1 menyatakan jumlah ikatan rangkap dan g2 menyatakan jumlah elektron yang tak berpasangan (radikal), maka energi lokalisasi adalah
Elok =g1(2α +2β)+g2α (15) 7. Energi Delokalisasi Molekul
Besarnya energi delokalisasi merupakan ukuran stabilitas molekul tersebut. Energi delokalisasi molekul adalah
lok o
d E E
E = − (16)
2.2.Teori Simetri dan Grup
3. Metode Perhitungan
Perhitungan komputasi molekul 1,3,5-heksatriena (C6H8) dengan menggunakan
metode semi empirik Huckel. Komputasi yang dilakukan meliputi: 1. Tanpa memasukkan konsep simetri dan grup dalam perhitungan:
a. Orbital-orbital molekul dan energi bersangkutan.
b. Fungsi-fungsi keadaan yang mungkin (keadaan dasar dan keadaan-keadaan tereksitasi).
c. Spektrum UV-Vis.
2. Tanpa memasukkan konsep simetri dan grup dalam perhitungan: a. Orbital-orbital molekul dan energi bersangkutan.
b. Fungsi-fungsi keadaan yang mungkin. c. Periksalah transisi-transi yang mungkin. 4. Hasil dan Pembahasan
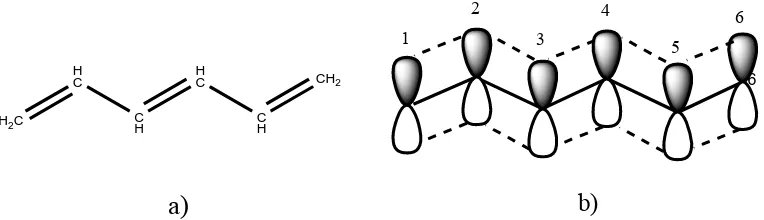
4.1.Perhitungan Huckel tanpa memperhatikan konsep simetri dan grup: Pada molekul heksatriena (Gambar 1), berdasarkan teori Hückel ada enam buah orbital 2pz yang digunakan dalam pembentukan orbital molekul.
3 4
5
6
1
2 3
4
5 6
H2C H C
C H
H C
C H
CH2
a)
b)Gambar 2. Molekul 1,3,5-Heksatriena: a) struktur garis b) diperlihatkan orbital-π-nya.
0 0 0 0 1 0 0 0 0
0 0 0 1 1 0 0 0
0 0 0 0 1 1 0 0
0
0 0 0 0 0 1 1 0
0 0 0 0 0 0 1 1
0 0 0 0 0 0 0 0 1
x x
x x
x x α ε β
β α ε β
β α ε β β
β α ε β
β α ε β
β α ε
−
−
− = =
−
−
−
(17)
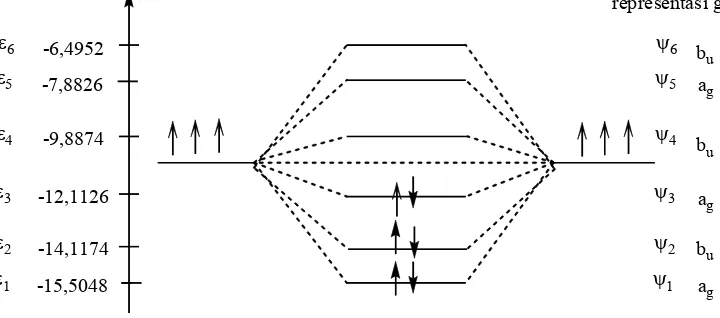
Untuk menghitung determinan matrik orde 6×6 dengan cara manual (cara perhitungan di atas kertas) adalah suatu pekerjaan yang tidak sederhana, begitu juga karena matriksnya mengandung peubah x, maka determinan yang dihasilkan masih berupa persamaan yaitu x6−5x4+6x2− =1 0. Untuk menyelesaikan persamaan tersebut tanpa bantuan komputer adalah suatu perkerjaan yang sulit. Oleh karena itu, perlu dibuat program untuk menyelesaikannya, yaitu menggunakan software MatLab™. Setelah dibuat program perhitungan menggunakan metode Huckel tersebut maka diperoleh hasil sebagai berikut: 1. Energi orbital-orbital molekul 1,3,5-heksatriena:
6
5 4 3
2 1
1,8019 6.4952 bonding
1, 2470 7,8826 bonding
0, 4450 9,8874 bonding
0, 4450 12,1126 bonding
1, 2470 14,1174 bonding
1,8019 15,5048 bonding
anti
anti
anti
ε α β
ε α β
ε α β
ε α β
ε α β
ε α β
= − = − −
= − = − −
= − = − −
= + = −
= + = −
Gambar 4. Diagram energi keadaan dasar E0untuk heksatriena. -6,4952
-7,8826
-9,8874
-12,1126
-14,1174
-15,5048
ε1 ε2 ε3 ε4 ε5 ε6
ψ1 ψ2 ψ3 ψ4 ψ5 ψ6
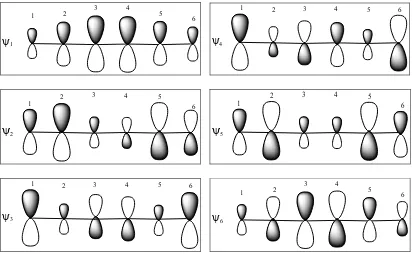
2. Orbital-orbital molekul 1,3,5-heksatriena:
6 1 2 3 4 5 6
5 1 2 3 4 5 6
4 1 2 3 4 5 6
3 1 2 3 4 5 6
0, 232 0, 418 0, 521 0, 521 0, 418 0, 232
0, 418 0, 521 0, 232 0, 232 0, 521 0, 418
0,521 0, 232 0, 418 0, 418 0, 232 0,521
0, 521 0, 232 0, 418 0, 418 0, 232 0,521
ψ φ φ φ φ φ φ
ψ φ φ φ φ φ φ
ψ φ φ φ φ φ φ
ψ φ φ φ φ φ φ
= − + − + −
= − + + − +
= − − + + −
= + − − + +
2 1 2 3 4 5 6
1 1 2 3 4 5 6
0, 418 0, 521 0, 232 0, 232 0, 521 0, 418
0, 232 0, 418 0, 521 0, 521 0, 418 0, 232
ψ φ φ φ φ φ φ
ψ φ φ φ φ φ φ
= + + − − −
= + + + + +
1 2
3 4
5 6 ψ1
1 2 3 4 5 6
ψ4
1
2 3 4 5
6
ψ2
1
2 3 4 5
6
ψ5
1 2 3 4 5 6
ψ3
1 2
3 4
4.2.Perhitungan 1,3,5-heksatriena dengan metode Huckel yang sudah memasukkan konsep simetri dan grup.
Gambar 4. Molekul heksatriena yang ditempatkan pada koordinat kartesian (x,y,z) dengan bidang-xy sebagai bidang molekul.3
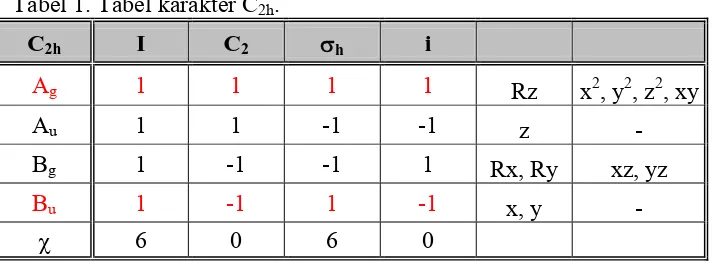
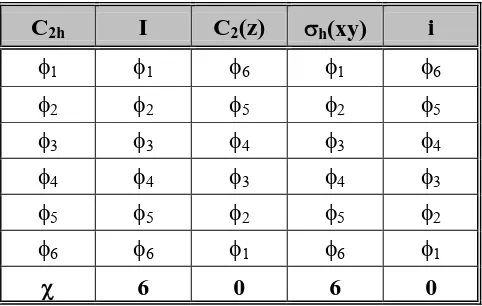
Jika ditinjau dari segi simetri, dengan bidang-xy sebagai bidang molekul, akan dipenuhi operasi-operasi simetri I, C2(z), σh(xy) dan i. Jadi, molekul ini memiliki grup C2h dengan karakter seperti pada Tabel 1.
Tabel 1. Tabel karakter C2h.
C2h I C2 σh i
Ag 1 1 1 1 Rz x2
, y2, z2, xy
Au 1 1 -1 -1 z -
Bg 1 -1 -1 1 Rx, Ry xz, yz
Bu 1 -1 1 -1 x, y -
χ 6 0 6 0
2 4
x z
3 5
y
1
Operasi elemen-elemen grup terhadap orbital-orbital
{
φi =2pz}
adalah sebagai berikut: 1 1 2 2 3 3 4 4 5 5 6 61 0 0 0 0 0
0 1 0 0 0 0
0 0 1 0 0 0
6
0 0 0 1 0 0
0 0 0 0 1 0
0 0 0 0 0 1
I I φ φ φ φ φ φ χ φ φ φ φ φ φ ⎛ ⎞ ⎛ ⎞ ⎛ ⎞ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ = → = → = ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜⎜ ⎟⎟ ⎜ ⎟ ⎜ ⎟ ⎝ ⎠ ⎝ ⎠ ⎝ ⎠ 1 6 2 5 3 4 2 2 4 3 5 2 6 1
0 0 0 0 0 1
0 0 0 0 1 0
0 0 0 1 0 0
( ) ( ) 0
0 0 1 0 0 0
0 1 0 0 0 0
1 0 0 0 0 0
C z C z
φ φ φ φ φ φ χ φ φ φ φ φ φ ⎛ ⎞ ⎛ ⎞ ⎛ ⎞ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ = → = → = ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜⎜ ⎟⎟ ⎜ ⎟ ⎜ ⎟ ⎝ ⎠ ⎝ ⎠ ⎝ ⎠ 1 1 2 2 3 3 4 4 5 5 6 6
1 0 0 0 0 0
0 1 0 0 0 0
0 0 1 0 0 0
( ) ( ) 6
0 0 0 1 0 0
0 0 0 0 1 0
0 0 0 0 0 1
h xy h xy
φ φ φ φ φ φ σ φ φ σ χ φ φ φ φ ⎛ ⎞ ⎛ ⎞ ⎛ ⎞ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ = → = → = ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜ ⎟ ⎜⎜ ⎟⎟ ⎜ ⎟ ⎜ ⎟ ⎝ ⎠ ⎝ ⎠ ⎝ ⎠ 1 6 2 5 3 4 4 3 5 2 6 1
0 0 0 0 0 1
0 0 0 0 1 0
0 0 0 1 0 0
0
0 0 1 0 0 0
0 1 0 0 0 0
1 0 0 0 0 0
Hasil ini dapat diringkaskan dalam Tabel 2 berikut:
Tabel 2. Daftar orbital-orbital atom karbon ke-i molekul hasil operasi simetri grup C2h molekul 1,3,5-heksatriena.
C2h I C2(z) σh(xy) i
φ1 φ1 φ6 φ1 φ6
φ2 φ2 φ5 φ2 φ5
φ3 φ3 φ4 φ3 φ4
φ4 φ4 φ3 φ4 φ3
φ5 φ5 φ2 φ5 φ2
φ6 φ6 φ1 φ6 φ1
χ 6 0 6 0
Selanjutnya, karakter pada tabel 2 di atas dipakai untuk menentukan representasi yang sesuai berdasarkan tabel karakter C2h (Tabel 1).
(
)
1 4
( g) (6 1) (0 1) (6 1) (0 1) 3
a A = × + × + × + × =
(
)
1 4
( g) (6 1) (0 1) (6 1) (0 1) 0
a A = × + × − × − × =
(
)
1 4
( g) (6 1) (0 1) (6 1) (0 1) 0
a A = × − × − × + × =
(
)
1 4
( g) (6 1) (0 1) (6 1) (0 1) 3
a A = × − × + × − × =
Jadi representasi untuk heksatriena adalah Γ =3Ag +3Bu. Artinya, tiga buah orbital teradaptasi simetri Ag dan tiga buah orbital teradaptasi Bu.
Selanjutnya, untuk memperoleh orbital yang teradaptasi simetri
{ }
ϕi sebagai kombinasi linier dari orbital-orbital asal{
φi =2pz}
tersebut, diperoleh sesuai dengan persamaan j j( )
R
R R
ϕ =
∑
χ φ; hasil operasi elemen-elemen grup padaorbital-orbital itu, dikalikan dengan karakter-karakter Ag dan Bu, kemudian
1
1 1 6 1 6 1 2 1 6 1
2 2 5 2 5 2 2 2 5 1
3 3 4 3 4 3 2 3 4 1
4 1 6 1 6 4 2 1 6 1
5 2 5 2 5 5 2 2 5 1
6 3 4 3 4 6 2 3 4
( ) ( ) ( ) ( ) ( ) ( ) g u A B ϕ φ φ φ φ ϕ φ φ ϕ φ φ φ φ ϕ φ φ ϕ φ φ φ φ ϕ φ φ ϕ φ φ φ φ ϕ φ φ ϕ φ φ φ φ ϕ φ φ ϕ φ φ φ φ ϕ φ φ ⎧ = + + + → = + ⎪⎪ = + + + → = + ⎨ ⎪ = + + + → = + ⎪⎩ ⎧ = − + − → = − ⎪⎪ = − + − → = − ⎨ ⎪ = − + − → = − ⎪⎩
Dengan orbital-orbital molekul ini, maka elemen-elemen matriks Hij adalah:
11 1 1
1
1 1 1 6 6 1 6 6
2 1 2
12 21 1 2
1
1 2 1 5 6 2 6 5
2 1 2
22 2 2
1
2 2 2 5 5 2 5 5
2 1 2 [ ] ( ) [ ] ( ) [ ] ( ) H H
H H H H
H H H
H H H H
H H
H H H H
ϕ ϕ φ φ φ φ φ φ φ φ α α α ϕ ϕ φ φ φ φ φ φ φ φ β β β ϕ ϕ φ φ φ φ φ φ φ φ α α α = = + + + = + = = = = + + + = + = = = + + + = + =
23 32 2 3
1
2 3 2 4 5 3 5 4
2 1 2
33 3 3
1
3 3 3 4 4 3 4 4
2 1 2
44 4 4
1
1 1 1 6 6 1 6 6
2 1 2
45 54 4 5
1
1 2 1 5 6 2 6 5
2 [ ] ( ) [ ] ( ) [ ] ( ) [ ]
H H H
H H H H
H H
H H H H
H H
H H H H
H H H
H H H H
55 5 5 1
2 2 2 5 5 2 5 5
2 1 2
56 65 5 6
1
2 3 2 4 5 3 5 4
2 1 2
66 6 6
1
3 3 3 4 4 3 4 4
2 1 2 [ ] ( ) [ ] ( ) [ ] ( ) H H
H H H H
H H H
H H H H
H H
H H H H
ϕ ϕ φ φ φ φ φ φ φ φ α α α ϕ ϕ φ φ φ φ φ φ φ φ β β β ϕ ϕ φ φ φ φ φ φ φ φ α β β α α β = = − − + = + = = = = − − + = + = = = − − + = − − + = −
Jika Hamiltonian ˆHdisusun dalam bentuk matriks, maka diperoleh determinan sekularnya sebagai berikut:
0 0 0 0 1 0 0 0 0
0 0 0 1 1 0 0 0
0 0 0 0 0 1 ( 1) 0 0 0
0
0 0 0 0 0 0 0 1 0
0 0 0 0 0 0 1 1
0 0 0 0 0 0 0 0 1 ( 1)
x x x x x x α ε β β α ε β β α β ε β α ε β β α ε β β α β ε − − + − = + = − − − − − (18)
Setelah dihitung menggunakan program Huckel yang sudah memasukkan konsep simetri dan grup maka hasil yang diperoleh adalah sebagai berikut:
Karena determinan matriks di atas mengandung elemen-elemen nol secara simetris, maka determinan dapat dipecah dua menjadi dua matriks dengan orde masing-masing 3×3. Dengan demikian dapat diselesaikan juga dengan cara perhitungan biasa (manual). Sesuai dengan representasi Ag dan Bu, maka diperoleh:
0 1 0
: 1 1 0
0 0 1 ( 1)
0 1 0
: 1 1 0
0 0 1 ( 1)
u x B x x α ε β β α ε β β β α β ε − − = = − − − (20)
Dengan bantuan software MatLab7, dicari persamaan polinom dari determinan matriks tersebut dengan perintah:
>> syms x;
>> A=det([x,1,0;1,x,1;0,1,(x+1)])
>> solve(A)
Untuk representasi Agdiperoleh persamaan berikut: 3 2 2 1 0 x + − − =x x , dan harga akar-akar x-nya adalah x1=-1,8019; x2 = −0, 445 dan x3 =1, 247.
Dengan cara yang sama untuk representasi Bu diperoleh persamaan
3 2 2 1 0
x − − + =x x , dengan akar-akarnya x1 =-1,247; x2 =0, 445 dan x3 =1,8019. Sehingga diperoleh energi orbital molekul sebagai berikut (apabila menggunakan harga : α = –11 dan β = –2,5):
1 3
5
1,8019 15, 5048
( ) 0, 445 12,1126
1, 247 7,8826
g A α β ε ε α β ε α β ε + = − = ⎧ ⎪ =⎨ + = − = ⎪ − = − = ⎩ 2 4 6
1, 247 14,1174
( ) 0, 445 9,8874
1,8019 6, 4952
u B α β ε ε α β ε α β ε + = − = ⎧ ⎪ =⎨ − = − = ⎪ − = − = ⎩
Selanjutnya dengan hasil di atas, maka untuk representasi Ag berlaku persamaan sekuler: 1 2 3 0 : 0 0 g c A c c α ε β β α ε β β α β ε − ⎛ ⎞⎛ ⎞ ⎜ − ⎟⎜ ⎟= ⎜ ⎟⎜ ⎟ ⎜ + − ⎟⎜ ⎟ ⎝ ⎠⎝ ⎠ (21)
1 1 2 3
3 1 2 3
5 1 2 3
15, 5048 : koefisien-koefisiennya 0, 328; 0,591; 0, 737 ( ) 12,1126 : koefisien-koefisiennya 0, 737; 0, 328; 0, 591
7,8826 : koefisien-koefisiennya 0, 591; 0, 737; 0, 328
g
c c c
A c c c
c c c
ε ε ε ε = − = = = ⎧ ⎪ =⎨ = − = = = − ⎪ = − = = − = ⎩
Untuk representasi Bu, berlaku:
1 2 3 0 : 0 0 u c B c c α ε β β α ε β β α β ε − ⎛ ⎞⎛ ⎞ ⎜ − ⎟⎜ ⎟= ⎜ ⎟⎜ ⎟ ⎜ − − ⎟⎜ ⎟ ⎝ ⎠⎝ ⎠ (22)
sehingga diperoleh harga koefisien-koefisien orbital sebagai berikut:
2 1 2 3
4 1 2 3
6 1 2 3
14,1174 : koefisien-koefisiennya 0, 591; 0, 737; 0, 328 ( ) 9,8874 : koefisien-koefisiennya 0, 737; 0, 328; 0,591
6, 4952 : koefisien-koefisiennya 0, 328; 0, 591; 0, 737
u
c c c
B c c c
c c c
ε ε ε ε = − = = − = ⎧ ⎪ =⎨ = − = = − = − ⎪ = − = = − = ⎩
Dengan demikian maka orbital molekulnya adalah:
1 1 2 3 1 6 2 5 3 4
3 1 2 3 1 6 2 5 3 4
5 1 2 3 1 6 2 5 3 4
0,328 0,591 0,737 0, 232( ) 0, 418( ) 0,521( )
: 0,737 0,328 0,591 0,521( ) 0, 232( ) 0, 418( )
0,328 0,591 0,737 0, 418( ) 0,521( ) 0, 232( )
g A ψ ϕ ϕ ϕ φ φ φ φ φ φ ψ ϕ ϕ ϕ φ φ φ φ φ φ ψ ϕ ϕ ϕ φ φ φ φ φ φ = + + = + + + + + ⎧ = + − = + + + − + ⎨ = + + = + − + + + ⎪ ⎪⎩
2 4 5 6 1 6 2 5 3 4
4 4 5 6 1 6 2 5 3 4
6 4 5 6 1 6 2 5 3 4
0,591 0,737 0,328 0, 418( ) 0,521( ) 0, 232( )
: 0,737 0,328 0,591 0,521( ) 0, 232( ) 0, 418( )
0,328 0,591 0,737 0, 232( ) 0, 418( ) 0,521( )
u B ψ ϕ ϕ ϕ φ φ φ φ φ φ ψ ϕ ϕ ϕ φ φ φ φ φ φ ψ ϕ ϕ ϕ φ φ φ φ φ φ = + + = − + − + − ⎧ = − − = − − − − − ⎨ = − + = − − − + − ⎪ ⎪⎩
Dengan hasil-hasil di atas, gambaran struktur elektronik heksatriena dalam keadaan dasar Ψ0adalah sebagai berikut:
Gambar 6. Diagram energi keadaan dasar E0untuk heksatriena yang telah memasukkan konsep simetri dan grup.
-6,4952 -7,8826 -9,8874 -12,1126 -14,1174 -15,5048 ε1 ε2 ε3 ε4 ε5 ε6 bu ψ1 ψ2 ψ3 ψ4 ψ5 ψ6 ag ag ag bu bu
Jelas terlihat bahwa harga-harga orbital molekul dan tingkat-tingkat energi orbital molekulnya sama antara perhitungan yang menggunakan konsep simetri dan grup dengan yang tidak. Hanya saja, dengan penerapan simetri dan grup, determinan sekuler matriks yang harus diselesaikan adalah dua matriks berukuran 3 × 3 yang jauh lebih mudah dibandingkan dengan determinan berukuran 6 × 6.
Pemeriksaan tentang transisi elektron-π dari keadaan dasar Ψ0 ke berbagai keadaan tereksitasiΨndilakukan dengan memperhatikan harga representasi simetri dari keadaan-keadaan tersebut. Peluang bertransisi sebanding dengan kuadrat momen transisi yang diungkapkan dengan
0 n 0 ˆ ndv
μ − = Ψ
∫
μ Ψ (23)dalam persamaan ini ˆμ adalah operator dipol listrik yang diungkapkan dengan komponen-komponennya μˆ =e x
(
ˆ+ +yˆ zˆ ,)
sehingga persamaan (23) dapat dinyatakan atas komponen-komponennya secara terpisah:( )
0 0
( )
0 0
( )
0 0
ˆ x
ˆ y
ˆ z
x
n n
y
n n
x
n n
e dv
e dv
e dv
μ μ μ
→
→
→
= Ψ Ψ
= Ψ Ψ = Ψ Ψ
∫
∫
∫
(24)
Berdasarkan persamaan (24) di atas, maka dapat dikatakan bahwa salah satu dari ketiga transisi tersebut dapat terjadi hanya jika representasi perkalian langsung
0 n
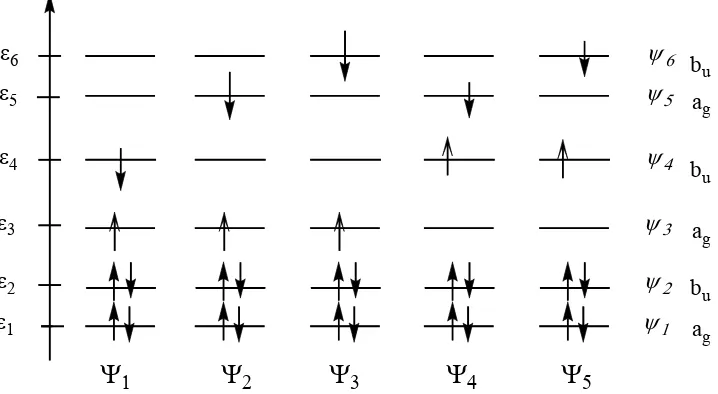
Gambar 7. Diagram energi keadaan tereksitasiΨ1,Ψ2,Ψ3,Ψ4dan Ψ5untuk heksatriena.
ε1 ε2 ε3 ε4 ε5 ε6
ψ1 ψ2 ψ3 ψ4 ψ5 ψ6
bu
ag ag ag
bu bu
Ψ
1Ψ
2Ψ
3Ψ
4Ψ
5Keterangan Gambar 7:
1. Keadaan dasar: Ψ ≡0 ψ ψ ψ12 22 32 dan energi E0 =2ε1+2ε2 +2ε3
2. Keadaan tereksitasi 1: Ψ ≡1 ψ ψ ψ ψ12 22 31 41 dan energi E1 =2ε1+2ε ε ε2+ +3 4. 3. keadaan tereksitasi 2: Ψ ≡2 ψ ψ ψ ψ12 22 31 51 dan energi E2 =2ε1+2ε ε ε2 + +3 5. 4. keadaan tereksitasi 3: Ψ ≡3 ψ ψ ψ ψ12 22 31 61 dan energi. E3 =2ε1+2ε ε ε2 + +3 6 5. Keadaan tereksitasi 4: Ψ ≡4 ψ ψ ψ ψ12 22 41 51 dan energi. E4 =2ε1+2ε ε ε2+ +4 5 6. keadaan tereksitasi 5: Ψ ≡5 ψ ψ ψ ψ12 22 41 61 dan energi. E5 =2ε1+2ε ε ε2 + +4 6
Berdasarkan struktur elektronik dan diagram energi (Gambar 7) representasi-representasi Γ Ψ( 0)dan Γ Ψ( 1) diturunkan sebagai berikut:
( )
0( )
a ag g( )
b bu u( )
a ag g A A Ag g g AgΓ Ψ = = = dan ( )1
( )
( )g g u u g u g g u u
a a b b a b A A B B
Γ Ψ = = =
sehingga Γ
(
μK0→1)
= A Bg u =Bu.Berdasarkan tabel karakter grup C2h (Tabel 1) terlihat bahwa transisi momen
diperiksa transisi-transisi yang terjadi dari keadaan dasar ke keadaan tereksitasi-tereksitasi lainnya dan diperoleh hasil sebagai berikut:
( )
0( )
a ag g( )
b bu u( )
a ag g A A Ag g g AgΓ Ψ = = =
( )
1( )
a ag g( )
b b a bu u g u A A Bg g u BuΓ Ψ = = =
( )
2( )
a ag g( )
b b a au u g g A A Ag g g AgΓ Ψ = = =
( )
3( )
a ag g( )
b b a bu u g u A A Bg g u BuΓ Ψ = = =
( )
4( )
a ag g( )
b b a bu u g u A A Bg g u BuΓ Ψ = = =
( )
5( )
a ag g( )( )
b bu u b bu u A A Ag g g AgΓ Ψ = = =
(
)
(
)
(
)
(
)
(
)
0 1
0 2
0 3
0 4
0 5
terijinkan (allowed) terlarang (forbidden) terijinkan (allowed) terijinkan (allowed) terlarang (forbidden)
g u u
g g g
g u u
g u u
g g g
A B B
A A A
A B B
A B B
A A A
μ μ μ μ μ
→
→
→
→
→
Γ = =
Γ = =
Γ = =
Γ = =
Γ = =
K K K K K
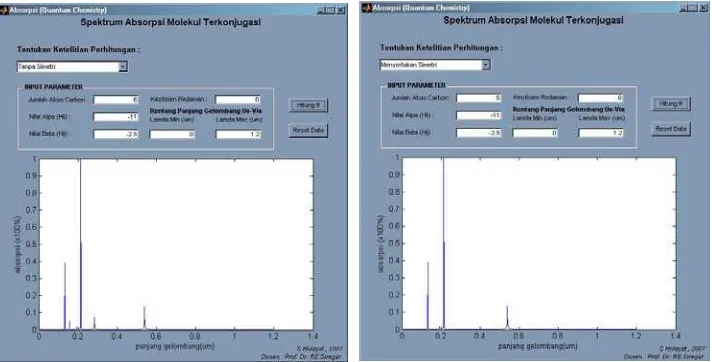
Spektrum UV-Vis yang dihasilkan dari paket Program Huckel4 antara perhitungan yang sudah memasukkan unsur simetri dan yang tidak dapat dilihat pada gambar 8:
5. Kesimpulan
Kesimpulan yang dapat diambil dari hasil perhitungan menggunakan metode orbital molekul Huckel (HMO) pada molekul 1,3,5-heksatriena antara perhitungan yang sudah memasukkan konsep simetri dan grup dengan yang belum adalah sebagai berikut:
1. Determinan sekuler Matrik yang dihasilkan dapat direduksi dari orde 6x6 menjadi dua buah matrik berorde 3x3, yang secara perhitungan manual jauh lebih mudah diselesaikan.
2. Tingkat-tingkat energi orbital molekul dan orbital-orbital molekul hasil perhitungan sama.
3. Spektrum absorpsi UV-Vis, tampak adanya pengurangan jumlah puncak absorpsi, yang menunjukkan simetri molekul telah menyeleksi keadaan eksitasi yang Forbiden.
6. Daftar Pustaka
1. House, E.J. (2004). Fundamentals of Quantum Chemistry. 2nd. Elsevier Academic Press. San Diego.
2. McQuarrie, D.A. and Simon, J.D. (1997). Physical Chemistry: A Molecular Approach. University Science Books Press. California.
3. Siregar, R.E. (2007). Kuantum Kimia. Diktat Kuliah.
4. Hidayat, S. (2007). Paket Program Huckel. Jurusan Fisika Universitas Padjadjaran Bandung.
7. Lampiran Lampiran 1
Keluaran (output) hasil perhitungan paket Program Huckel4 yang dibuat menggunakan software MatLab7.0
Energi orbital molekul
-15.5048 -14.1174 -12.1126 -9.8874 -7.8826 -6.4952 Koefisien energi orbital molekul:
-0.5211 0.2319 0.4179 0.4179 0.2319 -0.5211 -0.4179 0.5211 -0.2319 0.2319 -0.5211 0.4179 -0.2319 0.4179 -0.5211 -0.5211 0.4179 -0.2319 Orde Ikatan antar atom karbon yang berikatan: 0.8711 0.4834 0.7849 0.4834 0.8711
Panjang Ikatan antar atom karbon yang berdekatan: 1.3693 1.4275 1.3823 1.4275 1.3693
Kerapatan muatan atom karbon ke-i
1.0000 1.0000 1.0000 1.0000 1.0000 1.0000 Energi total:
-83.4698
Energi Lokalisasi: -81
Energi Delokalisasi: -2.4698
Valensi Bebas
0.8609 0.3774 0.4637 0.4637 0.3774 0.8609 Energi GAP
2.2252 Energi Eksitasi
0 0 0 5.6174 7.6223 9.0097 0 0 0 4.2301 6.2349 7.6223 0 0 0 2.2252 4.2301 5.6174 0 0 0 0 0 0
0 0 0 0 0 0 0 0 0 0 0 0 Proyeksi terhadap sumbu X
1.1859 1.2362 1.1971 1.2362 1.1859
Posisi Atom Karbon ke-i relatif terhadap karbon C1 0.8711 0.4834 0.7849 0.4834 0.8711
Momen Dipol Transisi
Lampiran 2