BAB I
PENDAHULUAN 1.1 Latar belakang
Pertumbuhan mikroba umumnya sangat tergantung dan dipengaruhi oleh faktor lingkungan, perubahan faktor lingkungan dapat mengakibatkan perubahan sifat morfologi dan fisiologi. Hal ini dikarenakan, mikroba selain menyediakan nutrient yang sesuai untuk kultivasinya, juga diperlukan faktor lingkungan yang memungkinkan pertumbuhan optimumnya. Mikroba tidak hanya bervariasi dalam persyaratan nutrisinya, tetapi juga menunjukkan respon yang berbeda-beda. Untuk berhasilnya kultivasi berbagai tipe mikroba, diperlukan suatu kombinasi nutrien serta faktor lingkungan yang sesuai. Perubahan faktor lingkungan terhadap pertumbuhan mikroba dapat mengakibatkan terjadinya perubahan sifat morfologi dan fisiologi. Faktor kimiawi yang mempengaruhi antara lain senyawa toksik atau senyawa kimia lainnya. Faktor biotik mencakup adanya asosiasi atau kehidupan bersama antara mikroorganisme, dapat dalam bentuk simbiose, sinergisme, antibiose, dan sintropisme.
1.2 Tujuan percobaan
Tujuan dari percobaan ini adalah :
1. Untuk mengetahui faktor-faktor lingkungan fisis yang dapat mempengaruhi pertumbuhan mikroorganisme; dan
2. Untuk dapat melakukan pengujian terhadap faktor lingkungan fisis pertumbuhan mikroorganisme.
BAB II
Kehidupan bakteri tidak hanya dipengaruhi oleh faktor-faktor lingkungan, akan tetapi juga mempengaruhi keadaan lingkungan. Bakteri dapat mengubah pH dari medium tempat ia hidup, perubahan ini disebut perubahan secara kimia. Adapun faktor-faktor lingkungan dapat di bagi atas faktor-faktor biotik dan faktor-faktor abiotik. Di mana, faktor-faktor biotik terdiri atas makhluk-makhluk hidup, yaitu, mencakup adanya asosiasi atau kehidupan bersama antara mikroorganisme, dapat dalam bentuk simbiose, sinergisme, antibiose, dan sintropisme. Sedangkan faktor-faktor abiotik terdiri atas faktor fisika (misal: suhu, atmosfer gas, pH, tekanan osmotik, kelembaban, sinar gelombang ,dan pengeringan) serta faktor kimia (misal: adanya senyawa toksik atau senyawa kimia lainnya (Hadientomo, 1985).
2.1 Sterilisasi
Sterilisasi yaitu proses membunuh semua mikroorganisme termasuk spora bakteri pada benda yang telah didekontaminasi dengan tepat. Tujuan sterilisasi yaitu untuk memusnahkan semua bentuk kehidupan mikroorganisme patogen termasuk spora, yang mungkin telah ada pada peralatan kedokteran dan perawatan yang dipakai. Hal yang perlu dipertimbangkan dalam memilih metode sterilisasi yaitu sifat bahan yang akan disterilkan. Metode sterilisasi antara lain :
a. Sterilisasi secara fisik
Sterilisasi secara fisik dipakai bila selama sterilisasi dengan bahan kimia tidak akan berubah akibat temperatur tinggi atau tekanan tinggi. Cara membunuh mikroorganisme tersebut adalah dengan panas. Panas kering membunuh bakteri karena oksidasi komponen-komponen sel. Daya bunuh panas kering tidak sebaik panas basah. Pemanasan basah dapat memakai Autoclave, tyndalisasi dan pasteurisasi. Autoclave adalah alat serupa tangki minyak yang dapat diisi dengan uap air. Tyndalisasi merupakan metode dengan mendidihkan medium dengan uap beberapa menit saja. Pasteurisasi adalah suatu cara disinfeksi dengan pemanasan untuk mengurangi jumlah mikrooranisme tanpa merusak fisik suatu bahan. Pemanasan kering dapat memakai oven dan pembakaran. Selain itu dapat dilakukan penyinaran dengan sinar gelombang pendek (Waluyo, 2005).
Sterilisasi secara kimia dapat memakai antiseptik kimia. Pemilihan antiseptik terutama tergantung pada kebutuhan daripada tujuan tertentu serta efek yang dikehendaki. Perlu juga diperhatikan bahwa beberapa senyawa bersifat iritatif, dan kepekaan kulit sangat bervariasi. Zat-zat kimia yang dapat dipakai untuk sterilisasi antara lain halogen (senyawa klorin, yodium), alkohol, fenol, hidrogen peroksida, zat warna ungu kristal, derivat akridin, rosalin, deterjen, logam-logam berat, aldehida, ETO, uap formaldehid ataupun beta-propilakton
(Volk, 1993). c. Sterilisasi secara mekanik.
Sterilisasi secara mekanik dapat dilakukan dengan penyaringan. Penyaringan dengan mengalirkan gas atau cairan melalui suatu bahan penyaring.
Pembiakan mikroba dalam laboratorium memerlukan medium yang berisi zat hara serta lingkungan pertumbuhan yang sesuai dengan mikroorganisme. Zat hara digunakan oleh mikroorganisme untuk pertumbuhan, sintesis sel, keperluan energi dalam metabolisme, dan pergerakan. Lazimnya, medium biakan berisi air, sumber energi, zat hara sebagai sumber karbon, nitrogen, sulfur, fosfat, oksigen, hidrogen, serta unsur-unsur lainnya. Dalam bahan dasar medium dapat pula ditambahkan faktor pertumbuhan berupa asam amino, vitamin, atau nukleotida
(Lim, 1998). 2.2 Pengaruh Suhu
Suhu merupakan salah satu faktor lingkungan yang berpengaruh terhadap pertumbuhan mikroba. Setiap mikroba mempunyai kisaran suhu dan suhu optimum tertentu untuk pertumbuhannya.
Berdasarkan kisaran suhu pertumbuhan, mikroba dibedakan atas tiga kelompok sebagai berikut:
Psikrofil, yaitu mikroba yang mempunyai kisaran suhu pertumbuhan 0 -20°C.
Mesofil, yaitu mikroba yang mempunyai kisaran suhu pertumbuhan 20 -45°C.
Kebanyakan mikroba perusak pangan merupakan mikroba mesofil, yaitu tumbuh baik pada suhu ruangan atau suhu kamar. Bakteri patogen umumnya mempunyai suhu optimum pertumbuhan sekitar 37 ℃, yang juga adalah suhu tubuh manusia. Oleh karena itu suhu tubuh manusia merupakan suhu yang baik untuk pertumbuhan beberapa bakteri patogen.
Mikroba perusak dan patogen umumnya dapat tumbuh pada kisaran suhu 4
−¿ 66 ℃ . Oleh karena kisaran suhu tersebut merupakan suhu yang kritis untuk penyimpanan pangan, maka pangan tidak boleh disimpan terlalu lama pada kisaran suhu tersebut. Pangan harus disimpan pada suhu di bawah 4 ℃ atau di atas 66 ℃ . Pada suhu di bawah 4°C, mikroba tidak akan mati tetapi kebanyakan mikroba akan terhambat pertumbuhannya, kecuali mikroba yang tergolong psikrofil. Pada suhu di atas 66 ℃ , kebanyakan mikroba juga terhambat pertumbuhannya meskipun beberapa bakteri yang tergolong termofil mungkin tidak mati (Dwijoseputro, 2010).
2.3 Pengaruh pH
Secara alami, kebanyakan bahan makanan (daging, ikan, dan suyuran) bersifat agak asam, sedangkan sebagian lainnya (sebagian besar buah-buahan) cukup asam, tetapi putih telur bersifat basa. Semakin rendah nilai pH, semakin efektif pengaruh asam organik sebagai pengawet, meskipun pertumbuhan setiap jasad renik dalam makanan mempunyai nilai pH optimum, minimum, dan maksimum. Meskipun demikian, pH tidak jarang berinteraksi dengan parameter lain dalam makanan dengan menghambat pertumbuhan. pH makanan juga berdampak terhadap kemampuan daya penghancur bakteri oleh pemanasan jika pH rendah (diturunkan), jumlah panas yang dibutuhkan lebih sedikit daripada jumlah jumlah panas pada makanan dengan pH yang lebih tinggi
pH netral (pH 7) atau pH yang sedikit basa (pH 7,4). Beberapa bakteri tumbuh pada pH 6 ; tidak jarang dijumpai organisme yang tumbuh baik pada pH 4 atau 5. Sangat jarang suatu organisme dapat bertahan dengan baik pada pH 4, bakteri autotrof tertentu merupakan pengecualian. Karena banyak bakteri menghasilkan produk metabolisme yang bersifat asam atau basa (Volk&Wheeler,1993).
Mikroba umumnya menyukai pH netral yaitu pH 7. Beberapa bakteri dapat hidup pada pH tinggi (medium alkalin) Apabila mikroba ditanam pada media dengan pH 5 maka pertumbuhan didominasi oleh jamur, tetapi apabila pH media 8 maka pertumbuhan didominasi oleh bakteri. Berdasarkan pHnya mikroba dapat dikelompokan menjadi 3 yaitu mikroba asidofil adalah kelompok mikroba yang dapat hidup tumbuh baik pada pH 6,0 – 8,0 pada pH 2,0 −¿ 5,0, mikroba mesofil (neutrofil) adalah kelompok mikroba yang dapat hidup pada pH 5,5
−¿ 8,0, dan mikroba alkafil adalah kelompok mikroba yang dapat hidup pada pH 8,4 −¿ 9,5 (Brooks dkk, 1994).
2.4 Pengaruh Kadar Air
Mikroorganisme menunjukkan perbedaan yang luas dari segi tuntutan keperluan akan kadar air . Untuk dapat membandingkan larutan dalam air dan zat-zat padat dari segi banyaknya air yang tersedia , digunakan parameter aktivitas air atau kelembaban relatif . Mikroorganisme sanggup tumbuh pada aktivitas air dari 0,998 sampai 0,6 (Schlegel, 1994).
2.3 Pengaruh cahaya
drastis ketika kondisi gelap. Pencahayaan sinambung menunjukkan laju pertumbuhan yang lebih konstan (Wijanarko, 2007).
2.6 Pengaruh Tekanan Osmosis
Pengaruh Tekanan Osmotik Terhadap Pertumbuhan Mikroba Tekanan osmosis sangat erat hubungannya dengan kandungan air. Apabila mikroba diletakkan pada larutan hipertonis, maka selnya akan mengalami plasmolisis, yaitu terkelupasnya membran sitoplasma dari dinding sel akibat mengkerutnya sitoplasma. Apabila diletakkan pada larutan hipotonis, maka sel mikroba akan mengalami plasmoptisa, yaitu pecahnya sel karena cairan masuk ke dalam sel, sel membengkak dan akhirnya pecah (Pratiwi, 2009).
Berdasarkan tekanan osmosis yang diperlukan mikroba dapat dikelompokkan menjadi: (1) mikroba osmofil, adalah mikroba yang dapat tumbuh pada kadar gula tinggi. Contohnya adalah khamir. (2) mikroba halofil, adalah mikroba yang dapat tumbuh pada kadar garam halogen yang tinggi. Contohnya yaitu Halobacterium. (3) mikroba halodurik, adalah kelompok mikroba yang dapat tahan (tidak mati) tetapi tidak dapat tumbuh pada kadar garam tinggi, kadar garamnya dapat mencapai 30% (Hamid, 2009).
BAB III
3.1.1 Alat
Sebelum melakukan sterilisasi, alat yang akan digunakan dicuci terlebih
dahulu, kemudian dikeringkan;
Diperiksa bagian bawah autoclave apakah berisi air atau tidak, jika air tidak ada maka dimasukkan air ke dalam tempat air pada bagian bawah autoclave;
Dibuka autoclave, dikeluarkan keranjang yang ada didalam autoclave, kemudian diisi dengan alat-alat yang akan disterilisasikan.
Dimasukkan kembali keranjang tersebut ke dalam autoclave, kemudian ditutup autoclave;
Ditekan tombol start, kemudian tunggu sampai suhu 121°C sampai alarm berbunyi;
Setelah alarm berbunyi, ditekan tombol exhaust kemudian ditunggu
sampai suhu turun 60 – 70°C, lalu dibuka autoclave; dan Sterilisasi selesai.
3.2.2 Pembuatan NA
Dicampurkan agar-agar 1,5 gram, NaCl 0,6 gram, glukosa 0,8 gram dan aquades sebanyak 100 ml di dalam Erlenmeyer;
Dimasukkan magnetic stirrer ke dalam campuran tersebut;
Diletakkan di atas hot plate sampai campuran tersebut homogen; dan Diletakkan ke dalam cawan petri dan didinginkan.
3.2.3 Pembuatan NB
Dicampurkan glukosa 0,6 gram, pepton 0,8 gram, ekstrak daging 10 ml dan aquades sebanyak 100 ml di dalam erlenmeyer; dan
Diaduk hingga homogen.
3.2.4 Pembuatan Media Kaldu Glukosa
Di campurkan glukosa 0,3 gram, NaCl 0,5 gram, dan aquades sebanyak 10 ml di dalam erlenmeyer; dan
Diaduk hingga homogen.
3.2.5 Uji pengaruh suhu
Dimasukkan media kaldu glukosa ke dalam tabung reaksi A dan B, dan ekstrak mangga ke dalam tabung reaksi C dan D yang dilengkapi tabung durham sebanyak ¾ tabung reaksi;
Dimasukkan sampel limbah air tahu ke dalam masing-masing tabung reaksi sebanyak 10 ml;
Diinkubasikan pada suhu 30°C di clean bench, dan 60°C di oven; dan Diamati perumbuhan bakteri setelah 24 −¿ 48 jam.
3.2.6 Uji pengaruh pH
Disiapkan 3 tabung reaksi yang dilengkapi dengan tabung durham; Dimasukkan ekstrak mangga, ekstrak singkong, dan air beras ke dalam
masing-masing tabung reaksi yang dilengkapi tabung durham sebanyak ¾ tabung reaksi, kemudian diukur pH;
Dimasukkan sampel limbah air tahu ke dalam masing-masing tabung reaksi sebanyak 10 ml;
Dimasukkan ke dalam clean bench; dan
Diamati pertumbuhan bakteri setelah 24 – 48 jam.
3.2.7 Uji pengaruh kadar air
Dimasukkan media singkong rebus ke dalam masing-masing 6 cawan petri. Diberi kode A, B, C, D, E, dan F;
Cawan petri A dan B diperlakukan dalam keadaan kering, cawan petri C dan D diberi air sampai lembab, cawan petri E dan F diberi air sampai basah pada masing-masing media;
Aspergillus yang diambil dari roti busuk yang telah dilarutkan dengan
aquades dimasukkan ke dalam cawan petri A, C dan E, dan Sacharomices Cereviceae yang di ambil dari ragi yang telah dilarutkan dengan aquades dimasukkan ke dalam cawan petri B, D dan F;
Dimasukkan ke dalam clean bench; dan
Diamati pertumbuhan bakteri setelah 24 – 72 jam.
3.2.8 Uji pengaruh cahaya
Sacharomyces cerevisiae yang diambil dari ragi yang telah dilarutkan
dengan aquades dimasukkan ke dalam masing-masing cawan petri; Diberi penyinaran dengan menggunakan sinar matahari selama 5, 15, dan
35 menit;
Dimasukkan ke dalam clean bench; dan
Diamati pertumbuhan mikroorganisme setelah 24 – 48 jam
3.2.9 Uji pengaruh tekanan osmosis
Disiapkan 4 tabung reaksi tanpa tabung durham yang telah diberi tanda A, B, C, dan D;
Dimasukkan NB ke dalam masing-masing tabung reaksi sebanyak ¾ tabung reaksi;
Dimasukkan sukrosa dengan konsentrasi 10% ke dalam tabung reaksi A dan C, dan konsentrasi 20% ke dalam tabung reaksi B dan D;
Dimasukkan suspensi Sacharomices Cereviceae ke dalam tabung reaksi A dan B, dan Aspergillus ke dalam tabung reaksi C dan D;
Dimasukkan ke dalam clean bench; dan
BAB IV
HASIL DAN PEMBAHASAN
Pertumbuhan adalah penambahan secara teratur semua komponen sel suatu jasad. Pembelahan sel adalah hasil dari pertumbuhan sel. Pada jasas tunggal (uniseluler), pertumbuhan atau pembiakan sel adalah pertambahan jumlah individunya. Tapi hanya merupakan pertumbuhan jaringan atau bertambahn besar jasadnya. Dalam membahas pertumbuhan mikroba harus dibedakan antara pertumbuhan individu dan pertumbuhan populasi (Suhrjono, 2006).
Faktor-faktor lingkungan yang mempengaruhi pertumbuhan mikroba meliputi suhu, pH, kadar air ,cahaya, dan tekanan osmosis.
4.1. Pengujian Pengaruh Suhu
Suhu optimum merupakan suhu pada saat pertumbuhan terbaik mikroorganisme. Pada suhu yang sangat tinggi akan terjadi denaturasi protein, sedangkan pada suhu yang sangat rendah aktifitas pada enzim akan berhenti
Pada pengujian ini digunakan dua sampel media cair, yaitu media kaldu glukosa dan ekstrak mangga dengan penambahan bekteri E. Coli dari limbah tahu. Media kaldu glukosa terbuat dari glukosa sebanyak 0,3 gram, NaCl 0,5 gram, dan aquades 10 ml. Limbah tahu yang mengandung bakteri E. Coli dimasukkan ke dalam tadung reaksi yang masing-masing berisi sampel media yang didalamnya telah terdapat tabung durham. Kemudian diinkubasikan pada suhu 30 ℃ yaitu di dalam clean bench, dan pada suhu 60 ℃ di dalam oven, kemudian diamati selama 24 −¿ 48 jam.
(a) (b)
Gambae 4.1 Perubahan yang terjadi pada sample media kaldu glukosa dengan penambahan bakteri E. Coli dari limbah tahu pada suhu 30
℃(a) dan suhu 60 ℃ (b) setelah 24 jam.
Gambar 4.2 Perubahan yang terjadi pada sampel media ekstrak mangga dengan penambahan bakteri E. Coli dari limbah tahu pada suhu 30 ℃
(a) dan suhu 60 ℃ (b) setelah 48 jam.
Pada suhu 30 ℃ , media glukosa yang telah ditambahkan E. Coli dari limbah tahu, terlihat adanya gelembung udara pada tabung durham yang menunjukkan adanya pertumbuhan bekteri.
Pada suhu 60 ℃ juga terlihat gelembung-gelembung udara pada tabung durham, akan tetapi tidak mengalami pertambahan seperti pada suhu 30 ℃ . Walaupun demikian, hal ini juga menandakan bahwa pada suhu 60 ℃ bakteri masih dapat tumbuh.
Hal yang sama juga terjadi pada medium ekstrak mangga, dimana pada suhu 30 ℃ bakteri masih memungkinkan untuk tumbuh, yang ditandai dengan adanya gelembung udara pada tabung durham. Sedangkan pada suhu 60 ℃ , pada tabung durham tidak terdapat gelembung udara yang menampakkan bahwa bakteri tidak dapat tumbuh.
4.2. Pengujian Pengaruh pH
Kebanyakan mikroorganisme dapat tumbuh pada kisaran pH sebesar 3 −¿ 4. Kebanyakan bakteri mempunyai pH optimum sekitar pH 6,5 −¿ 7,5. Dibawah pH 4 −¿ 5 dan diatas 8,5 tidak dapat tumbuh dengan baik. Nilai pH untuk pertumbuhan mikroba mempunyai hubungan dengan suhu pertumbuhan. Jika suhu naik, pH optimum untuk pertumbuhan juga naik (Abubakar,1994).
(a) (b) (C)
Gambar 4.3 Perubahan yanga terjadi pada sampel media ekstrak mangga pada pH 4 (a), ekstrak singkong pada pH (b), dan air beras pada pH 6,5 (c) dengan penambahan bakteri E. Coli dari limbah tahu setelah 48 jam.
Dari hasil pengamatan, E. Coli sedikit tumbuh pada pH 4, ditandai dengan gelembung udara yang sedikit pada tabung durham. Pada pH 5 lebih banyak gelembung udara dibandingkan pada pH 4. Pada pH 6,5 bakteri E Coli dapat tumbuh dengan baik. Ditandai dengan gelembung udara lebih banyak dari pada pH 4 dan 5. Hal ini dikarenakan bakteri mempunyai pH optimum untuk tumbuh yaitu pada pH 6,5 −¿ 7,5. Sedangkan pada pH 3 −¿ 4 bakteri juga bisa tumbuh namun tidak secara optimal.
4.3 Pengujian Pengaruh Kadar Air
Mikroorganisme mempunyai kelembaban optimum. Pada umumna untuk pertumbuhan ragi dan bakteri juga diperlukan kelembaban yang sangat tinggi sekitar 85 %. Sedangkan untuk jamur dan aktinomiset diperlikan kelembaban yang rendah dibawah 80 % (Suriawiria, 2003).
(a) (b) (c)
Gambar 4.4 Perubahan yang terjadi pada sampel medium singkong rebus dalam keadaan kering (a), lembab (b), dan basah (c) dengam penambahan Aspergillus dari roti setelah 72 jam.
Gambae 4.5 Perubahan yang terjadi pada sampel media singkong rebus dalam keadaan kering (a), lembab (b), dan basah (c) dengan penambahan Sacharonices Cereviceae setelah 72 jam.
Pada hasil pengamatan, perubahan yang terjadi pada sampel medium singkong rebus dengan menambahan jamur Aspergillus dari roti setelah 72 jam, yaitu pada keadaan kering jamur tidak bertambah. Setelah pada keadaan lembab jamur tumbuh lebih banyak dan semakin bertambah. Pada keadaan basah jamur hanya dapat bertambah sedikit dan ada gelembung.
Dari hasil pengamatan, singkong dengan kadar air lembab sangat cocok untuk pertumbuhan jamur. Kelembaan ragi dan Aspergillus yaitu dibawah 80% kadar airnya.
4.4. Penguian Pengaruh Cahaya
Umumnya cahaya, mempunyai daya merusak pada sel mikroorganisme yang tidak mempunyai pigmen fotosintesis. Sedangkan cahaya dengan gelombang pendek dapat berpengaruh pada jasad hidup. Sinar gelombang panjang juga mempunyai daya foto dinamik dan daya biofilik, misalnya cahaya matahari (Suriawiria, 2003). Percobaan ini dilakukan dengan terlebih dahulu membuat mediun NA (Nutrien agar) yaitu yang terbuat dari 1,5 gram nurtien agar, 0,6 gram NaCl, 0,8 gram glukosa, dan 100 ml aquades. Setelah medium NA mengeras, medium digores secara zigzag dangan mengunakan kawat oase yang telah dibakar agar steril. Pada semua medium NA diberi ragi dan disertai dengan A, B, dan C. Cawan petri A diberi sinar selama 5 menit, cawan petri B diberi sinar selama 15 menit, dan cawan petri C diberi penyinaran selama 35 menit. Kemudian diamati selama 24 −¿ 48 jam.
(a) (b) (c)
Gambar 4.6 Perubahan yang terjadi pada sampel media NA dengan penambahan jamur Sacharomices Cereviceae dari ragi pada penyinaran 5 menit (a), 15 menit (b) dan 35 menit (c) setelah 48 jam.
zigzagnya semakin merenggang. Sedangkan pada medium yang diberi penyinaran selama 15 menit, medium hanya menyusut sedikit dan garis zigzag hanya sedikit merenggang. Hal ini menandakan bahwa jamur hanya dapat tumbuh sedikit. Pada medium yang diberi penyinaran 35 menit tidak dapat tumbuh dengan baik.
4.5. Pengujian Pengaruh Tekanan Osmosis
Osmotik adalah difusi air ke dalam larutan yang lebih pekat. Biasanya sitoplasma sel bakteri lebih pekat daripada lingkungannya (sitoplasma memiliki nilai potensial lebih negatif), sehingga proses osmosis (masuknya air ke dalam sel) terjadi pada bakteri tersebut. Karena air masuk ke dalam sel, maka terjadi tekanan pada dinding sel oleh air. Tekaman itu disebut tekanan tugor
(purwoko, 2007).
Pada umumnya larutan hipertonis menghambat pertumbuhan karena menyababkan plasmilisis. Beberapa mikroorganisme dapat menyesuaikan diri terhadap kadar garam sampai 30%. Golongan ini bersifat halodurik (Suriawiria, 2003).
(a) (b)
Gambar 4.7 Perubahan yang terjadi pada sampel media NB dengan konsentrasi sukrosa 10% (a) dan 20% (b) dengan pemambahan Sacharomices Cereviceae dari ragi setelah 72 jam.
(a) (b)
Gambar 4.8 Perubahan yang terjadi pada sampel media NB yang konsentrasi sukrosa 10% (a) dan konsentrasi 20% (b) dengan penambahan Aspergillus dari roti setelah 72 jam.
Pada sampel medium NB yang diberi penambahan bakteri Aspergillus dengan konsentrasi sukrosa 10%, terjadi endapan, bercak lebih banyak, dan medium lebih keruh dari sebelumnya. Sedangkan pada medium NB dengan konsentrsi sukrosa 20% terjadi endapan, medium semakin keruh, dan ada bercak putih di permukaan.
Sampel media NB dengan konsentrasi sukrosa 10% bersifat hipertonis, sedangkan sampel medium NB dengan konsentrasi sukrosa 20% bersifat isotonis. Jamur dapat tumbuh dengan baik pada kondisi medium yang isotonis karena sel jamur berada pada tingkat tekanan osmosis yang sesuai dengan proses osmosis yang terjadi seimbang. Sebaiknya medium hipertonis akan menyebabkan sel membengkak dan mengakibatkan rusaknya sel.
BAB V
KESIMPULAN
Berdasarkan data hasil pengamatan dan pembahasan maka dapat diambil kesimpulan bahwa:
1. Faktor lingkungan fisis yang mempengaruhi pertumbuhan mikroorganisme adalan suhu, pH, kadar air, cahaya, dan tekanan osmosis.
2. Bakteri E. Coli tumbuh dengan baik pada suhu 30 ℃ dan tidak tumbuh pada suhu 60 ℃ , termasuk ke dalam golongan bekteri mesofit.
3. Mikroba dalam hal ini, E. Coli tidak dapat hidup pada suhu yang tinggi seperti pada suhu 60 ℃ , namun akan tumbuh optimum pada suhu 30
℃ .
4. Bakteri E. Coli dapat tumbuh pada kisaran pH 6,0 −¿ 8,0 , termasuk kedalam golongan bakteti neutrofil.
5. Air sangat penting untuk kehidupan mikroorganisme sebagai sumber oksigen untuk bahan organik sel pada respirasi mikroba lebih dominan tumbuh dalam keadaan medium yang lebih lembab.
6. Pada pengaruh cahaya mikroba banyak tumbuh pada cawan petri yang diberi sedikit penyinaran yaitu 5 menit dibandingkan 15 menit dan 35 menit.
DAFTAR PUSTAKA
AR, Abubakar. 1994. Mikrobiologi Teknik. Unsyiah: Banda Aceh.
Brooks, dkk., 1994. Mikrobiologi Kedokteran Edisi 2 .EGC, Jakarta
Dwijoseputro. 1995. Dasar-dasar Mikrobiologi. Jakarta: Djambatan.
Hadioetomo, R.S. 1985. Mikrobiologi Dasar dalam Praktek.. PT.Gramedia. Jakarta.
Hamid, Z. 2009. Nutrisi Mikroba, Sebuah Esensi Dasar Untuk Kehidupan Mikroba. http://zaifbio.wordpress.com./2009/01/31/nutrisi-mikroba, sebuah-esensi-dasar-untuk-kehidupan-mikroba/. Diakses pada tanggal (27-03-2011).
http://blog.unila.ac.id/wasetiawan/files/2009/07/kultivasi-reproduksi-dan
pertumbuhan bakteri. pdfSetiawan. Diakses pada tanggal (28-03-2011).
Lim, D. 1998. Microbiology 2nd Edition. McGraw Hill. United of States America.
Pratiwi, A. 2009. Pengaruh Faktor Fisika Dan Kimia Terhadap Mikroba Laut http://www.scribd.com/doc/50076130/Pengaruh-faktor-fisika-dan-kimia-terhadap-mikroba-laut. Diakses pada tanggal (27-03-2011).
Purwoko, Tjahjadi. 2007. Fisiolagi Mikroba. PT. Umi Aksara : Jakarta.
Suriwiria, Unus. 2003. Mikrobiologi Air dan Dasar-dasar Pengolahan Buagan Secara biologi. PT. Alimni :Bandung.
Tortora Gj Funke Br, Case Cl. 2001. Mikrobiologi : an Introduktion 7 th edition. Addison Wesley. Inc : California.
Volk &Wheeler. 1993. Mikrobiologi Dasar jilid 1. Erlangga. Jakarta.
Waluyo, L. 2005. Mikrobiologi Umum. Universitas Muhammadiyah Malang penambahan bakteri E. Coli dari limbah tahu setelah 48 jam.
NO.
1 30 Timbul gelembung udara gelembung udara bertambah 2 60 timbul gelembung udara gelembung udara tidak bertambah
Tabel 1.2 Perubahan yang terjadi pada media ektrak mangga dengan penambahan E. Coli dari limbah tahu setelah 48 jam.
NO.
1 30 Timbul gelembng udara gelembung udara bertambah 2 60 tidak timbul gelembng udara tidak timbul gelembung udara
Tabel A.3 Perubahan yang terjadi pada media ektrak mangga, ektrek singkong, dan air beras dengan penambahan bakteri E. Coli dari limbah tahu setelah 48 jam.
mangga 4 sedikit gelembung udara
gelembung udara
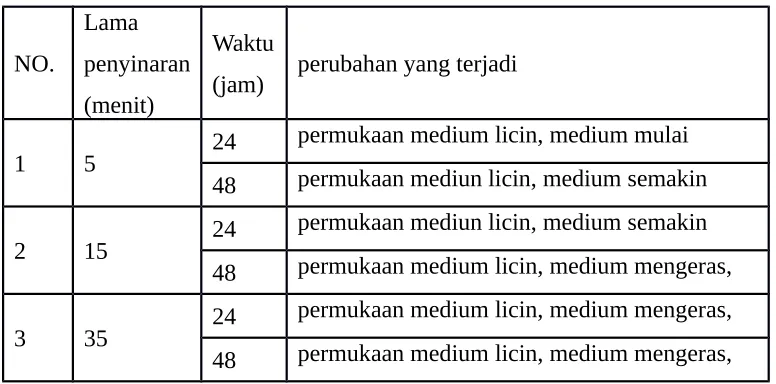
A.3 Pengujian Pengaruh Kadar Air
Tabel A.4 Perubahan yang terjadi pada smpel media singkong rebus dengan penambahan jamur Aspergillus dari roti setelah 72 jam.
NO. keadaan 2 lembab jamur berwarna
hijau pudar dan
jamur berwarna hijau dan
jamur bertambah banyak dari 3 basah jamur berwarna
hijau lumut pudar
jamur berwarna hijau pudardan
warna jamur hijau pudar dan
Tabel A.5. Perubahan yang terjadi pada sampel media singkong rebus dengan penambahan jamur Sacharumices cereviceae dari ragi setelah 72 jam.
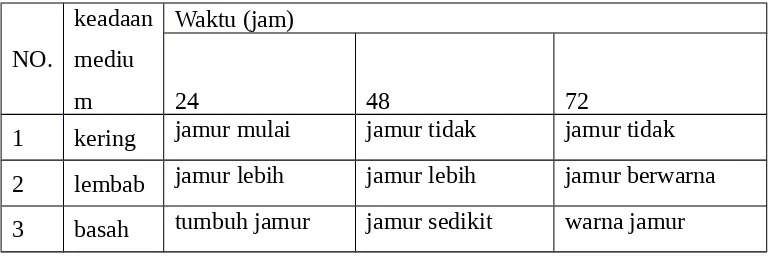
Tabel A.6. Perubahan yang terjadi pada sampel media NA dengan penambahan jamur Sacharonices Cerevirceae dari ragi setelah 48 jam.
NO.
permukaan medium licin, medium mulai menyusut, dan tubuh jamur
48 permukaan mediun licin, medium semakin menyusut, dan jamur mulai banyak
2 15 24
permukaan mediun licin, medium semakin menyusut, dan tumbuh jamur
48 permukaan medium licin, medium mengeras, dan hanya sedikit menyusut
3 35 24
permukaan medium licin, medium mengeras, dan medium mulai menyusut
48 permukaan medium licin, medium mengeras, dan sangat sedikit menyusut
A.5 Pengujian Pengaruh Tekanan Osmotik
Tabel A.7. Perubahan yang terjadi pada sampel media NB dengan penambahan Sacharonices Cereverceae dari ragi setelah 72 jam
NO. Konsentras
Tabel A.8. Perubahan yang terjadi pada sampel media NB dengan penambahan Aspergillus dari roti setelah 72 jam.
dan medium
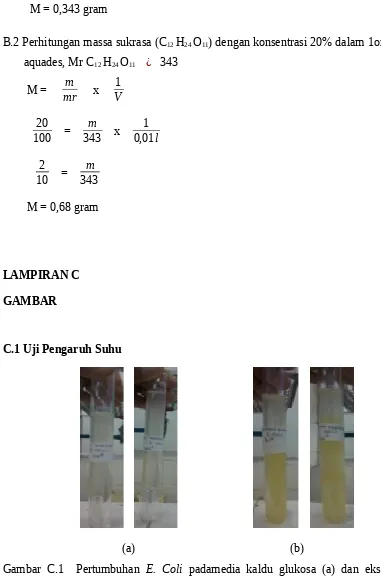
Mr : massa molekul relatif (gram/mol) V : volume (liter)
101 = 343m
M = 0,343 gram
B.2 Perhitungan massa sukrasa (C12 H24 O11) dengan konsentrasi 20% dalam 1oml aquades, Mr C12 H24 O11 ¿ 343
M = mrm x V1
10020 = 343m x 0,01l1
2 10 =
m 343
M = 0,68 gram
LAMPIRAN C GAMBAR
C.1 Uji Pengaruh Suhu
(a) (b)
(a) (b)
Gambar C.2 Pertumbuhan E. Coli pada media kaldu glulosa (a) dan ekstrak mangga (b) suhu 30 ℃ dan 60 ℃ setelah 24 jam.
(a) (b)
Gambar C.3 Pertumbuhan E. Coli pada media kaldu glukosa (a) dan ekstrak mangga (b) suhu 30 ℃ dan 60 ℃ setelah 48 jam.
Gambar C.4 Pertumbuhan E. Coli yang terjadi pada media ekstrak mangga pH 4 setelah 0, 24, dan 48 jam.
Gambar C.5 Pertumbuhan E. Coli pada medium ekstrak singkong pH 5 setelah 0, 24, dan 72 jam.
Gambar C.6 Pertumbuhan E. Coli pada medium air beras pH setelah 0, 24, dam 48 jam.
Gambar C.7 Pertumbuhan Aspergillus pada medium singkong rebus dengan kadar air (kering, lembab, dam basah) pada saat 0 jam.
Gambar C.8 Pertumbuhan Sacharomices Cereviceae pada medium singkong rebus dengan kadar air (kering , lembab, dan basah) pada saat 0 jam.
Gambar C.9 Pertumbuhan Aspergillus pada medium singkong redus dengan kadar air (kering, lembab, dan basah) setelah 24 jam.
Gambar C.11 Pertumbuhan Apergillus pada medium singkong rebus dengan kadar air (kering, lembab, dan basah) setelah 48 jam.
Gambar C.12 Pertumbuhan Sacharomices Cereviceae pada medium singkong rebus dengan kadar (air kering, lembab, dan basah) setelah 48 jam.
Gambar C. 14 Pertumbuhan Sacharomices Cereviceae pada media singkong rebus dengan kadar air (kering, lembab, dan basah) setelah 72 jam.
C.4 Pengujian Pengaruh Cahaya
Gambar C.15 Pertumbuhan Sacharomices Cereviceae pada medium NA dengan penyinaran 5, 15, dan 35 menit pada saat 0 jam.
Gambar C. 17 Pertumbuhan Sacharomices Cereviceae pada medium NA dengan penyinaran 5, 15, dan 35 menit setelah 48 jam.
C.5 Pengujian Pengaruh Tekanan Osmosis
Gambar C.19 Pertumbuhan Sacharomices Cereviceae pada NB dengan konsentrasi sukrosa 10% dan 20% pada saat 0 jam.
Gambar C.20 Pertumbuhan Aspergillus pada NB dengan konsentrasi sukrosa 10% dan 20% setelah 24 jam.
Gambar C.22 Pertumbuhan Aspergillus pada medium NB dengan konsentrasi sukrosa 10% dan 20% setelah 48 jam.
Gambar C.23 Pertumbuhan Sacharomices Cereviceae pada NB dengan konsentrasi 10% dan 20% setelah 48 jam.