Lentera Vol. 15. No. 13. April 2015
56
STOIKIOMETRI PERSENYAWAAN
LIGAN 3-METILSALISALDEHIDE-4-HIDROKSI
BENZOIL HIDRAZON DENGAN ALUMINIUM (III)
Abdul Malik
Dosen Program Studi Pendidikan Fisika Universitas Almuslim malikmnur@gmail.com
ABSTRAK
Kimia koordinatan bagi ligan 3-metilsalisaldehide-4-hidroksi benzoil hidrazon telah dikaji dengan aluminium(III). Tapak koordinatan dengan aluminium (III) telah dikaji berdasarkan data spektroskopi inframerah, spektroskopi ultralembayung-nampak dan rmn 1H dan 13C. Pengkoordinatan ligan dengan ion aluminium(III) berlaku melalui atom N daripada kumpulan C=N dan atom O daripada kumpulan C=O. Perbandingan molar aluminium(III) terhadap ligan dalam tidak balas pengkompleksannya adalah 1:3, terungkap daripada kajian stoikiometri pengkompleksan. Formula bagi kompleks yang terbentuk boleh diwakili oleh [Al(Ligan)3] (NO3)3 .
Kata Kunci: Stoikiometri, 3-Metilsalisaldehide-4-Hidroksi Benzoil Hidrazon, Spektrofluorimetri, Aluminium (III)
PENDAHULUAN
Sebahagian besar sifat kimia sebatian organoalmin iu m sudah dipahami berdasarkan tiori-tiori asid
Le wis monomer-mono mer
organoalumin iu m yang mana, alu min iu m cendrung untuk me mbentuk sebuah atom yang me menuhi sistim oktet elektron-e lekt ron.
Sebatian koordinatan alu miniu m dengan keadaan pengoksidaan +3 biasanya bersifat penerima e lektron dan hasil penambahan yang terbentuk dengan spesis yang kaya dengan elektron menyebabkan kepelbagaian dala m koordinatan alu min iu m.
Apabila suatu ligan neutral bidentat berinteraksi dengan AlX3, (X = Cl,Br, atau I), yang le mah pengkoordinatannya, dua jenis pengkompleksan berlaku. Salah satu daripadanya ialah kumpulan halida a kan disingkirkan untuk me mbentuk [A lL3]3+ kation yang boleh diidentifikasikan secara kristalografi atau spektroskopi dala m keadaan pepejal dan mela lui konduktivit i mola r dala m larutan tanpa akues. Ligan yang biasa adalah 2,2’-b ipirid il, 1,10-fenantrolin dan etanadiamina. Alu miniu m
me mbentuk pe lbagai struktur dengan ligan bidentat. Dengan 1,10-fenantrolin dan 2,2’-b ipirid il, hasil hablurnya adalah spesis ionik seperti [Al(bpy)3]Cl3, tetapi kimia larutan sebatian ini me mberikan struktur [AlX2(bpy)2]X, [Al(bpy)3]X3, dan lain-la in. Da la m pengkomp leksan yang kedua, stoikio metrinya mungkin AlX3L atau AlX2L2 dan setiap satunya boleh diformu lasikan sebagai sebatian ionik. Sebagai contohnya, AlX3.bpy boleh ditulis sebagai [AlX2(bpy)2][AlX4] (X=Cl,Br). Ini men jelaskan bahawa faktor saiz ligan adalah penting dala m kajian kimia koord inatan alu min iu m. Jika X=I, ia a kan disingkirkan untuk me mbentuk [A lL3] ke rana, AlL4I2 dengan nombor koordinatan 6, adalah tidak stabil [Phua, 2000].
Lentera Vol. 15. No. 13. April 2015
57
Umu mnya, alu miniu m me mbentuk ko mple ks oktahedron dengan beberapa ligan neutral. Seperti yang ditunjukkan dala m Ga mbar 1, kebanyakan ko mple ks alu min iu m me mpunyai ge lang kelat seperti dengan -diketon, kateko l, asid dikarboksilik dan 8-hidro ksiku inolina [Cotton, 1975]. Ko mple ks neutral larut
Senyawaan hidrazon telah dikenal secara meluas sebagai agen pengkomple k di dala m analisis kimia, terutama dala m penentuan ion-ion logam secara spektrofotometri. Akan tetapi, turunan keto dari hidra zon belu m banyak mendapat perhatian. Peggunaannya sebagai reagen pengkomple ks dalam ana lisis ion-ion logam be lu m banyak dibahas, hal ini diketahui dari hanya terdapat sedikit sahaja laporan yang berkenaan dengannya.
Dala m beberapa tahun terakhir ini, satu siri dari terbitan ketohidrazon telah berhasil disintesis dan didapati sangat baik sebagai reagen pendarfluor da la m penentuan kandungan ion alu min iu m. Turunan ketohidrazon dengan N dan O sebagai atom pengkelatnya didapati sangat selektif di dala m reaksi pengkelatan. Oleh ke rana itu, ka jian penggunaan reagen organik seperti senyawaan ketohidrazon perlu dike mbangkan, dengan mengkaji reaksi pembentukan, pentautomeran, dan sifat pengkomple ksannya dengan ion-ion logam kerana, laporan terdahulu menunjukkan bahawa senyawaan ketohidrazon sangat berpotensi digunakan sebagai reagen pengkomple ksan dalam analisis logam alu min iu m secara spektrofluorimetri.
Tujuan penulisan artikel ini ada lah untuk me mbahas sintesis senyawaan ketohidrazon dan komp leksnya dengan alu min iu m dan menentukan potensinya untuk digunakan sebagai reagen dalam
analisis spektrofluorimetri alu min iu m(III). Senyawaan hidra zon dipilih ke rana gugus fungsi dalam hidrazon diperkirakan bisa menga mbil bahagian dalam reaksi pengkomp leksan dengan ion aluminiu m untuk me mbentuk ko mp leks berpendarflour yang dapat digunakan untuk menge mbangkan metode analisa logam alu min iu m secara kualitatif dan kuantitatif d i dala m sampe l a ir.
METODE PENELITIAN
Bahan dan Alat Pe nelitian
Peralatan yang digunakan dalam penelitian in i terdiri dari spektrofotometer ultravio let-na mpak 2501PC (Shimadzu, Kyoto, Jepang) dengan sel kuartza 0.5 c m. Untuk pengukuran spektrum ultrav iolet-nampak. Sebuah pH mete r dig ital
Cyberscan 500 dengan elektrod
ko mbinasi kaca-ka lo mel d igunakan untuk penentuan pH. Infra me rah (IM) diperoleh me lalu i le mpeng KBr dengan menggunakan spektrometer FTIR Perkin Elme r Model 1650 dala m frekuensi 400 cm-1 hingga 4000 c m-1. Spektru m Resonans Magnet Nukleus proton dan karbon (rmn -1H & 13C) pada 400 MHz diperoleh dengan cara melarutkan sampel dala m pelarut DM SO-d6. Titik lebur hasil yang didapati telah ditentukan dengan menggunakan peralatan titik lebur dig ital e lekt roterma. Se mua bahan kimia yang digunakan adalah jenis bahan bergred tinggi. Air ternyahion dua kali (DDW) digunakan untuk menyediakan kese mua la rutan. Etanol mutla k dipero leh daripada Fluk a
Chemie Gmb H. La rutan penimba l yang
Lentera Vol. 15. No. 13. April 2015
58
Pengukuran peng aruh pH terhadap ligan diulang untuk mendapatkan larutan dengan pH 3 dan pH 5. Bag i larutan yang me mpunyai pH 7, pH 9 dan pH 11, HCl d iganti dengan NaOH dan langkah yang sama diulangi. Ke mudian ditentukan spektrum ultra le mbayung-nampak bagi semua larutan.
Pengaruh pel arut terhadap ligan
La rutan ligan I berkonsentrasi 1x10 -3 M disediakan dengan mela rutkan ligan (0.0115 g) men jadi 50 mL da la m pelarut DMSO-d6. Ke mudian, larutan tersebut (1,0 mL) d icairkan menjadi 10 mL dan spektrum ultra le mbayung-nampak ditentukan. Langkah yang sama diulang menggunakan pelarut dimetilforma mida.
Pengkompleksan alumini um (III)-ligan
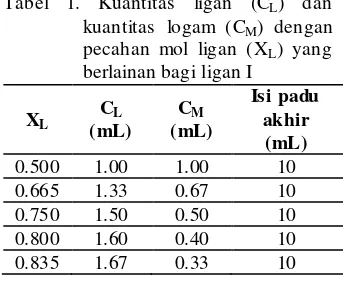
Untuk mensintesis komp leks alu min iu m (III)-ligan, perbandingan alu min iu m (III) terhadap ligan dala m reaksi pengko mple ksan atau stoikio metri ditentukan terlebih dahulu. Stokio metri pengkomple ksan dapat ditentukan dengan menggunakan metode Jobs.
Dengan menggunakan larutan alu min iu m (III) 1x10-3 M dan larutan La rutan penimbal asid asetik-natriu m asetat pH 5 (3 mL) dica mpurkan ke dala m larutan dan dicairkan dengan DDW sehingga ke tanda batas, digoncang dan dibiarkan 5 minit sebelum spektrum ultra le mbayung-nampak ditentukan.
Tabel 1. Kuantitas ligan (CL) dan kuantitas logam (CM) dengan pecahan mol ligan (XL) yang berlainan bagi ligan I
XL
HAS IL DAN PEMBAHASAN
Spektru m ultra le mbayung-nampak larutan ligan I dala m etanol pada berbagai pH menunju kkan serapan ma ksimu m yang berbeda-beda (Ga mbar 3), ligan bersifat sebagai sebuah mo leku l dengan dua spesies dasar yang berlainan, bergantung kepada pH.
Secara keseluruhan, spektrum ultrale mbayung-nampak larutan ligan I
menunjukkan adanya tiga puncak serapan yang berbeda, satu yang agak lebar sekitar 330 n m dan yang dua lagi agak taja m sekitar 280 dan 300 n m. Pada pH yang tinggi, puncak ma ksimu m pada 330 n m teru ja ke panjang gelombang yang lebih besar disertai dengan peningkatan nilai serapan. Sebaliknya serapan bagi puncak ma ksimu m pada 280 dan 300 n m menurun. Kehadiran titik isobestik pada sekitar 310 n m menunjukkan terjad inya satu keseimbangan yang melibatkan spesies yang berlainan struktur. Dengan demikian, fa ktor pH adalah penting dala m berbagai interaksi yang me libatkan ligan in i.
Lentera Vol. 15. No. 13. April 2015
59
Ga mbar 2. Spektru m ultra le mbayung-nampak ligan I (2x10-4 M) pada: a) pH 1, b) pH 3, c) pH 5, d) pH 7, e) p H 9, dan f) p H 11
Tabel 2. Puncak serapan ultrale mbyung-nampak bagi ligan pada berbagai pelarut
Panjang gelombang serapan ultrale mbyung-nampak pada
ber bag ai pelar ut, nm
Etanol DMSO DMF
292.50 302.50 329.50
295.00 305.40 329.40
293.50 305.00 328.00 Spektru m ultra le mbayung-nampak larutan komp leks alu min iu m(III)-ligan I
pada berbagai perbandingan mol
alu min iu m (III) terhadap ligan ditunjukkan dala m Ga mbar 2.
Plot ke kuatan serapan ultrale mbayung-nampak pada 396.4 n m terhadap pecahan mol ligan I (Ga mbar 3) menunjukkan bahawa nilai serapan ma ksimu m terjadi pada 0.75 pecahan mo l ligan I. Bilangnan mol ligan yang sesuai bisa dihitung yaitu:
Ga mbar 3. Spektru m ultra le mbayung-nampak larutan ko mple ks alu min iu m (III)-ligan I pada berbagai perbandingan mol alu min iu m (III) terhadap ligan
Ga mbar 4. Pengaruh pecahan mol ligan terhadap serapan spektrum ultra le mbayung larutan ko mple ks alu min iu m (III)-ligan I pada panjang gelombang 396.4 nm
Ini menunjukkan bahawa ko mp leks alu min iu m (III)-ligan I terbentuk dengan ko mposisi 1:3 a lu miniu m (III) terhadap ligan I atau me mpunyai stoikio metri 1:3.
Persamaan reaksi pengko mple ksan yang dicadangkan adalah:
3HL+Al3+ Al–L3+3H+ 0,07
0,09 0,11 0,13 0,15 0,17 0,19
0,45 0,55 0,65 0,75 0,85 0,95
ke
se
ra
p
a
n
Lentera Vol. 15. No. 13. April 2015
61
Tiga mol ligan akan tepat habis bereaksi dengan satu mol ion logam alukiniu m (III).
PENUTUP
Kesimpul an
Dari kenyataan dan uraian yang di atas maka dapat diambil kesimpulan bahwa perbandingan molar alu miniu m terhadap ligan dala m reaksi pengkomple ksannya adalah 1:3. Perbandingan ini terungkap dari ka jian stoikio metri pengkomp leksan.
Saran
Kimia koordinatan bagi ligan yang disintesis terhadap alumin iu m telah diketahui terjad i dengan perbandingan mo l 1:3. Oleh karena itu, penulis menyarankan dila kukan penelit ian lebih lanjut berkaitan dengan sifat-sifat senyawa komp leks senyawa ketohidrazon in i dengan alumin iu m dan pemanfaatannya sebagai reagen dalam analisis fluorimet ri atau dala m analisis -analisis yang lainnya.
DAFTAR RUJ UKAN
Constable, E. C. (1996). “Metal and Ligand Reactivity, an Introduction to the Organic Che mistry of Metal Complexes.” Ne w Yo rk: VCH.
Cotton, F. A. and Wilkinson, G. (1975). “Advanced Inorganic
Chemisry.” 2nd ed. New Delh i: Wiley Eastern Private Limited.
Hill, Z. D. and Patrick Mac Carthy (1990). “Novel approach to Job’s method.” Journal of
Chemical Education. 63.
Jiang, C., Bo Tang, R. Wang and J. Yen (1997). “Spectrofluorimetric determination of trace amounts of aluminiu m with 5-bro mo-salicyla ldehide salicyloyhydrazone.”
Talanta. 44.
Mole, T and Je ffry, E. A. (1972). “Organoaluminium
Compounds.” New York: Elsevier Publishing Co mpany. 23.
Phua, Pim Huat (2000). “Sintesis dan Pencirian Ko mple ks Aluminiu m(III)-Hidrazon.” Universiti Teknologi Malaysia: Tesis Sarjana Muda.
Richard Bos, N. W. Barnett, G. A. Dyson, and R. A. Russell (2002). “Characterisation of a synthesized fluorescent ligand (4-acridinol-1-sulphonic acid) using nuclear magnetic resonance spectroscopy.”
Analytica Chimica Acta. 454.