BAB I PENDAHULUAN
I.1 Latar Belakang
Asam dan Basa merupakan dua golongan zat kimia yang sangat penting dalam kehidupan sehari-hari. Berkaitan dengan sifat asam basa, larutan dikelompokkan dalam tiga golongan, yaitu bersifat asam, bersifat basa, dan bersifat netral. Asam dan basa memiliki sifat-sifat yang berbeda, sehingga dapat kita bisa menentukan sifat suatu larutan. Untuk menentukan suatu larutan bersifat asam atau basa, ada beberapa cara, yaitu pertama menggunakan indikator warna, yang akan menunjukkan sifat suatu larutan dengan perubahan warna yang terjadi. Misalnya Lakmus, akan berwarna merah dalam larutan yang bersifat asam dan akan berwarna biru dalam larutan yang bersifat basa. Sifat asam basa suatu larutan juga dapat ditentukan dengan mengukur pH-nya. pH merupakan suatu parameter yang digunakan untuk menyatakan tingkat keasaman larutan.
Larutan asam memiliki pH kurang dari 7, larutan basa memiliki pH lebih dari 7, sedangkan larutan netral memiliki pH=7. pH suatu larutan dapat ditentukan dengan indikator pH atau dengan pH meter. Menurut penjelasan tersebut menjelaskan tentang keseimbangan asam basa serta berbagai macam faktor atau hal - hal yang berkaitan dengan keseimbangan asam basa.
I.2 Tujuan
1. Tujuan Umum
Mahasiswa mengetahui tentang keseimbangan asam basa yang ada dalam tubuh manusia.
2. Tujuan khusus
BAB II
TINJAUAN PUSTAKA
II.1 Pengertian II.1.1 Asam
Asam didefinisikan sebagai zat yang dapat memberikan ion H+ ke zat lain
(disebut sebagai donor proton), sedangkan basa adalah zat yang dapat menerima ion H+ dari zat lain (disebut sebagai akseptor proton). Suatu asam
baru dapat melepaskan proton bila ada basa yang dapat menerima proton yang dilepaskan. Satu contoh asam adalah asam hidroklorida (HCL), yang berionasi dalam air membentuk ion- ion hidrogen (H+) dan ion klorida (CL-)
demikian juga, asam karbonat (H2CO3) berionisasi dalam air membentuk ion
H+ dan ion bikarbonat (HCO 3-).
Asam kuat adalah asam yang berdiosiasi dengan cepat dan terutama melepaskan sejumlah besar ion H+ dalam larutan. Contohnya adalah HCL.
Asam lemah mempunyai lebih sedikit kecenderungan untuk mendisosiasikan ion-ionnya dan oleh karena itu kurang kuat melepaskan H+. Contohnya
H2CO3.
II.1.2 Basa
Basa adalah ion atau molekul yang menerima ion hidrogen. Sebagai contoh, ion bikarbonat (HCO3-), adalah suatu basa karena dia dapat
bergabung dengan satu ion hidrogen untuk membentuk asam karbonat (H2CO3). Demikian juga (HPO4) adalah suatu basa karena dia dapat menerima
satu ion hidrogen untuk membentuk (H2PO4). Protein- protein dalam tubuh
juga berfungsi sebagai basa karena beberapa asam amino yang membangun protein dengan muatan akhir negatif siap menerima ion-ion hidrogen. Protein hemoglobin dalam sel darah merah dan protein dalam sel-sel tubuh yang lain merupakan basa-basa tubuh yang paling penting.
Basa kuat adalah basa yang bereaksi secara cepat dan kuat dengan H+.
Oleh karena itu dengan cepat menghilangkannya dari larutan. Contoh yang khas adalah OH-, yang bereaksi dengan H+ untuk membentuk air ( H
Basa lemah yang khas adalah HCO3- karena HCO3- berikatan dengan H+
secara jauh lebih lemah daripada OH-. Kebanyakan asam dan basa dalam
cairan ekstraseluler yang berhubungan dengan pengaturan asam basa normal adalah asam dan basa lemah.
II.1.3 Keseimbangan Asam dan Basa
Keseimbangan asam basa adalah suat keadaan dimana konsentrasi ion hydrogen yang diproduksi setara dengan konsentrasi ion hydrogen yang dikeluarkan oleh sel. Pada proses kehidupan keseimbangan asam pada tingkat molecular umumnya berhubungan dengan asam lemah dan basa lemah, begitu pula pada tingkat konsentrasi ion H+ atau ion OH- yang sangat rendah.
Keseimbangan asam basa adalah keseimbangan ion hydrogen. Walaupun produksi akan terus menghasilkan ion hydrogen dalam jumlah sangat banyak, ternyata konsentrasi ion hydrogen dipertahankan pada kadar rendah pH 7,4.
Derajat keasaman (pH) darah manusia normalnya berkisar antara 7.35 hingga 7.45. Tubuh manusia mampu mempertahan keseimbangan asam dan basa agar proses metabolisme dan fungsi organ dapat berjalan optimal.
Keseimbangan asam basa dalam tubuh manusia diatur oleh dua sistem organ yakni paru dan ginjal. Paru berperan dalam pelepasan (eksresi CO2) dan ginjal berperan dalam pelepasan asam.
Beberapa prinsip yang perlu kita ketahui terlebih dahulu adalah:
1. Istilah asidosis mengacu pada kondisi pH < 7.35 sedangkan alkalosis
bila pH > 7.45
2. CO2 (karbondioksida) adalah gas dalam darah yang berperan sebagai
komponen asam. CO2 juga merupakan komponen respiratorik. Nilai normalnya adalah 40 mmHg.
3. HCO3 (bikarbonat) berperan sebagai komponen basa dan disebut juga
sebagai komponen metabolik. Nilai normalnya adalah 24 mEq/L.
4. Asidosis berarti terjadi peningkatan jumlah komponen asam atau
berkurangnya jumlah komponen basa.
5. Alkalosis berarti terjadi peningkatan jumlah komponen basa atau
II.1.4 Pengaturan Keseimbangan Asam dan Basa
Pengaturan keseimbangan ion hidrogen dalam beberapa hal sama dengan pengaturan ion-ion lain dalam tubuh. Sebagai contoh, untuk mencapai homeostatis. Harus ada keseimbangan antara asupan atau produksi ion hidrogen dan pembuangan ion hidrogen dari tubuh. Dan seperti pada ion-ion lain, ginjal memainkan peranan kunci dalam pengaturan-pengaturan ion hidrogen. Akan tetapi, pengaturan konsentrasi ion hidrogen cairan ekstraseluler yang tepat melibatkan jauh lebih banyak daripada eliminasi sederhana ion-ion hidrogen oleh ginjal. Terdapat juga banyak mekanisme penyangga asam basa yang melibatkan darah, sel-sel, dan paru-paru yang perlu untuk mempertahankan konsentrasi ion hidrogen normal dalam cairan ekstraseluler dan intraseluler.
Dalam hal ini berbagai mekanisme yang turut membantu mengatur konsentrasi ion hidrogen, dengan penekanan khusus pada kontrol sekresi ion hidrogen ginjal dan reabsorpsi, produksi, dan ekskresi ion – ion bikarbonat oleh ginjal, yaitu salah satu komponen kunci sistem kontrol asam basa dalam berbagai cairan tubuh.
Konsentrasi ion hidrogen dan pH cairan tubuh normal serta perubahan yang terjadi pada asidosis dan alkalosis. Konsentrasi ion hidrogen darah secara normal dipertahankan dalam batas ketat suatu nilai normal sekitar 0,00004 mEq/liter ( 40 nEq/liter ). Variasi normal hanya sekitar 3 sampai 5 mEq/liter, tetapi dalam kondisi yang ekstrim, konsentrasi ion hidrogen yang bervariasi dari serendah 10 nEq/liter sampai setinggi 160 nEq/liter tampa menyebabkan kematian.
Karena konsentrasi ion hidrogen normalnya adalah rendah dan dalam jumlah yang kecil ini tidak praktis, biasanya konsentrasi ion hidrogen disebutkan dalam skala logaritma, dengan menggunakan satuan pH. pH berhubungan dengan konsentrasi ion hidrogen.
pH normal darah arteri adalah 7,4 , sedangkan pH darah vena dan cairan interstetial sekitar 7,35 akibat jumlah ekstra karbondioksida ( CO2 ) yang
dibebaskan dari jaringan untuk membentuk H2CO3. Karena pH normal darah
nilai ini dan mengalami alkolisis saat pH meningkat diatas 7,4. Batas rendah pH dimana seseorang dapat hidup lebih dari beberapa jam adalah sekitar 6,8 dan batas atas adalah sekitar 8,0.
pH intraseluler biasanya sedikit lebih rendah daripada pH plasma karena metabolisme sel menghasilkan asam, terutama H2CO3. Bergantung pada jenis
sel, pH cairan intraseluler diperkirakan berkisar antara 6,0 dan 7,4. Hipoksia jaringan dan aliran darah yang buruk ke jaringan dapat menyebabkan pengumpulan asam dan itu dapat menurunkan pH intraseluler.
pH urin dapat berkisar dari 4,5 sampai 8,0 bergantung pada status asam basa cairan ekstraseluler. Contoh ekstrim dari suatu cairan tubuh yang bersifat asam adalah HCL yang diekskresikan kedalam lambung oleh oksintik ( sel-sel parietal ) dari mukosa lambung.
II.2 Faktor yang Mempengaruhi Keseimbangan Asam dan Basa
Pengaturan keseimbangan asam basa diselenggarakan melalui koordinasi dari 3 sistem:
1. Sistem Buffer
Sistem penyangga asam basa kimiawi dalam cairan tubuh, yang dengan segera bergabung dengan asam atau basa untuk mencegah perubahan konsentrasi ion hidrogen yang berlebihan.
Sistem buffer ini menetralisir kelebihan ion hydrogen, bersifat temporer dan tidak melakukan eliminasi. Fungsi utama system buffer adalah mencegah perubahan pH yang disebabkan oleh pengaruh asam fixed dan asam organic pada cairan ekstraseluler. Sebagai buffer, system ini memiliki keterbatasan yaitu:
a. Tidak dapat mencegah perubahan pH di cairan ekstraseluler yang disebabkan karena peningkatan CO2.
b. System ini hanya berfungsi bila system respirasi dan pusat pengendali system pernafasan bekerja normal
Ada 4 sistem buffer:
1. Buffer bikarbonat merupakan sistem dapar di cairan ekstrasel terutama untuk perubahan yang disebabkan oleh non-bikarbonat
2. Buffer protein merupakan sistem dapar di cairan ekstrasel dan intrasel 3. Buffer hemoglobin merupakan sistem dapar di dalam eritrosit untuk perubahan asam karbonat
4. Buffer fosfat merupakan sistem dapar di sistem perkemihan dan cairan intrasel.
Sistem dapat kimia hanya mengatasi ketidakseimbangan asam-basa sementara. Jika dengan buffer kimia tidak cukup memperbaiki ketidakseimbangan, maka pengontrolan pH akan dilanjutkan oleh paru-paru yang berespon secara cepat terhadap perubahan kadar ion H dalam darah akinat rangsangan pada kemoreseptor dan pusat pernafasan, kemudian mempertahankan kadarnya sampai ginjal menghilangkan ketidakseimbangan tersebut. Ginjal mampu meregulasi ketidakseimbangan ion H secara lambat dengan menskresikan ion H dan menambahkan bikarbonat baru ke dalam darah karena memiliki dapar fosfat dan amonia.
Proses eliminasi dilakukan oleh paru dan ginjal. Mekanisme paru dan ginjal dalam menunjang kinerja system buffer adalah dengan mengatur sekresi, ekskresi, dan absorpsi ion hydrogen dan bikarbonat serta membentuk buffer tambahan (fosfat, ammonia). Untuk jangka panjang, kelebihan asam atau basa dikeluarkan melalui ginjal dan paru sedangkan untuk jangka pendek, tubuh dilindungi dari perubahan pH dengan system buffer. Mekanisme buffer tersebut bertujuan untuk mempertahankan pH darah antara 7,35- 7,45.
2. Sistem Paru
tekanan parsial karbondioksida dalam darah arteri (PaCO2) juga
mempengaruhi respirasi. Meskipun demikian, efeknya tidak sejelas efek yang dihasilkan oleh PaCO2.
Pada keadaan asidosis metabolik, frekuensi pernapasan meningkat sehingga menyebabkan eliminasi karbon dioksida yang lebih besar (untuk mengurangi kelebihan asam). Pada keadaan alkalosis metabolik , frekuensi pernapasan diturunkan, dan menyebabkan penahanan karbondioksida (untuk meningkatkan beban asam).
3. Sistem Ginjal
Untuk mempertahankan keseimbangan asam basa, ginjal harus mengeluarkan anion asam non volatile dan mengganti HCO3-. Ginjal mengatur keseimbangan asam basa dengan sekresi dan reabsorpsi ion hidrogen dan ion bikarbonat. Pada mekanisme pemgaturan oleh ginjal ini berperan 3 sistem buffer asam karbonat, buffer fosfat dan pembentukan ammonia. Ion hydrogen, CO2, dan NH3 diekskresi ke dalam lumen tubulus dengan bantuan energi yang dihasilkan oleh mekanisme pompa natrium di basolateral tubulus. Pada proses tersebut, asam karbonat dan natrium dilepas kembali ke sirkulasi untuk dapat berfungsi kembali. Tubulus proksimal adalah tempat utama reabsorpsi bikarbonat dan pengeluaran asam.
Ion hidrogen sangat reaktif dan mudah bergabung dengan ion bermuatan negative pada konsentrasi yang sangat rendah. Pada kadar yang sangat rendahpun, ion hydrogen mempunyai efek yang besar pada system biologi. Ion hydrogen berinteraksi dengan berbagai molekul biologis sehingga dapat mempengaruhi struktur protein, fungsi enzim dan ekstabilitas membrane. Ion hydrogen sangat penting pada fungsi normal tubuh misalnya sebagai pompa proton mitokondria pada proses fosforilasi oksidatif yang menghasilkan ATP.
tubuh. Di dalam tubuh ion hidrogen terbentuk sebagai hasil metabolism karbohidrat, protein dan lemak, glikolisis anaerobik atau ketogenesis. II.3 Jenis Gangguan Keseimbangan Asam dan Basa
1. Asidosis Respiratorik a. Pengertian
Asidosis Respiratorik adalah keasaman darah yang berlebihan karena penumpukan karbondioksida dalam darah sebagai akibat dari fungsi paru-paru yang buruk atau pernafasan yang lambat. Kecepatan dan kedalaman pernafasan mengendalikan jumlah karbondioksida dalam darah. Dalam keadaan normal, jika terkumpul karbondioksida, pH darah akan turun dan darah menjadi asam. Tingginya kadar karbondioksida dalam darah merangsang otak yang mengatur pernafasan, sehingga pernafasan menjadi lebih cepat dan lebih dalam. b. Penyebab
Asidosis respiratorik terjadi jika paru-paru tidak dapat mengeluarkan karbondioksida secara adekuat. Hal ini dapat terjadi pada penyakit-penyakit berat yang mempengaruhi paru-paru, seperti:
- Emfisema - Bronkitis kronis - Pneumonia berat - Edema pulmoner - Asma.
Selain itu, seseorang dapat mengalami asidosis respiratorik akibat narkotika dan obat tidur yang kuat, yang menekan pernafasan Asidosis respiratorik dapat juga terjadi bila penyakit-penyakit dari saraf atau otot dada menyebabkan gangguan terhadap mekanisme pernafasan.
c. Gejala
terganggu. Ginjal berusaha untuk mengkompensasi asidosis dengan menahan bikarbonat, namun proses ini memerlukan waktu beberapa jam bahkan beberapa hari.
d. Diagnose
Biasanya diagnosis ditegakkan berdasarkan hasil pemeriksaan pH darah dan pengukuran karbondioksida dari darah arteri.
e. Pengobatan
Pengobatan asidosis respiratorik bertujuan untuk meningkatkan fungsi dari paru-paru. Obat-obatan untuk memperbaiki pernafasan bisa diberikan kepada penderita penyakit paru-paru seperti asma dan emfisema. Pada penderita yang mengalami gangguan pernafasan yang berat, mungkin perlu diberikan pernafasan buatan dengan bantuan ventilator mekanik.
2. Asidosis Metabolik a. Pengertian
b. Penyebab
Penyebab asidosis metabolik dapat dikelompokkan kedalam 3 kelompok utama adalah:
1. Jumlah asam dalam tubuh dapat meningkat jika mengkonsumsi suatu asam atau suatu bahan yang diubah menjadi asam.Sebagian besar bahan yang menyebabkan asidosis bila dimakan dianggap beracun. Contohnya adalah metanol (alkohol kayu) dan zat anti beku (etilen glikol).Overdosis aspirin pun dapat menyebabkan asidosis metabolik.
2. Tubuh dapat menghasilkan asam yang lebih banyak melalui metabolisme. Tubuh dapat menghasilkan asam yang berlebihan sebagai suatu akibat dari beberapa penyakit; salah satu diantaranya adalah diabetes melitus tipe I. Jika diabetes tidak terkendali dengan baik, tubuh akan memecah lemak dan menghasilkan asam yang disebut keton. Asam yang berlebihan juga ditemukan pada syok stadium lanjut, dimana asam laktat dibentuk dari metabolisme gula. 3. Asidosis metabolik bisa terjadi jika ginjal tidak mampu untuk
membuang asam dalam jumlah yang semestinya. Bahkan jumlah asam yang normal pun bisa menyebabkan asidosis jika ginjal tidak berfungsi secara normal. Kelainan fungsi ginjal ini dikenal sebagai asidosis tubulus renalis, yang bisa terjadi pada penderita gagal ginjal atau penderita kelainan yang mempengaruhi kemampuan ginjal untuk membuang asam.
Penyebab utama dari asidois metabolik: Gagal ginjal - Asidosis tubulus renalis (kelainan bentuk ginjal) - Ketoasidosis diabetikum
- Asidosis laktat (bertambahnya asam laktat)
- Bahan beracun seperti etilen glikol, overdosis salisilat, metanol, paraldehid, asetazolamid atau amonium klorida
- Kehilangan basa (misalnya bikarbonat) melalui saluran pencernaan karena diare, leostomi atau kolostomi.
-c. Gejala
Asidosis metabolik ringan bisa tidak menimbulkan gejala, namun biasanya penderita merasakan mual, muntah dan kelelahan. Pernafasan menjadi lebih dalam atau sedikit lebih cepat, namun kebanyakan penderita tidak memperhatikan hal ini. Sejalan dengan memburuknya asidosis, penderita mulai merasakan kelelahan yang luar biasa, rasa mengantuk, semakin mual dan mengalami kebingungan. Bila asidosis semakin memburuk, tekanan darah dapat turun, menyebabkan syok, koma dan kematian.
d. Diagnosa
Diagnosis asidosis biasanya ditegakkan berdasarkan hasil pengukuran pH darah yang diambil dari darah arteri (arteri radialis di pergelangan tangan). Darah arteri digunakan sebagai contoh karena darah vena tidak akurat untuk mengukur pH darah.
Untuk mengetahui penyebabnya, dilakukan pengukuran kadar karbon dioksida dan bikarbonat dalam darah. Mungkin diperlukan pemeriksaan tambahan untuk membantu menentukan penyebabnya. Misalnya kadar gula darah yang tinggi dan adanya keton dalam urin biasanya menunjukkan suatu diabetes yang tak terkendali. Adanya bahan toksik dalam darah menunjukkan bahwa asidosis metabolik yang terjadi disebabkan oleh keracunan atau overdosis. Kadang-kadang dilakukan pemeriksaan air kemih secara mikroskopis dan pengukuran pH air kemih. e. Pengobatan
Pengobatan asidosis metabolik tergantung kepada penyebabnya. Sebagai contoh, diabetes dikendalikan dengan insulin atau keracunan diatasi dengan membuang bahan racun tersebut dari dalam darah. Kadang-kadang perlu dilakukan dialisa untuk mengobati overdosis atau keracunan yang berat.
mungkin secara intravena; tetapi bikarbonat hanya memberikan kesembuhan sementara dan dapat membahayakan
3. Alkalosis Respiratorik a. Pengertian
Alkalosis Respiratorik adalah suatu keadaan dimana darah menjadi basa karena pernafasan yang cepat dan dalam, sehingga menyebabkan kadar karbondioksida dalam darah menjadi rendah.
b. Penyebab
Pernafasan yang cepat dan dalam disebut hiperventilasi, yang menyebabkan terlalu banyaknya jumlah karbondioksida yang dikeluarkan dari aliran darah. Penyebab hiperventilasi yang paling sering ditemukan adalah kecemasan. Penyebab lain dari alkalosis respiratorik adalah:
- rasa nyeri - sirosis hati
- kadar oksigen darah yang rendah - demam
- overdosis aspirin. c. Gejala
Alkalosis respiratorik dapat membuat penderita merasa cemas dan dapat menyebabkan rasa gatal disekitar bibir dan wajah. Jika keadaannya makin memburuk, bisa terjadi kejang otot dan penurunan kesadaran.
d. Diagnosa
Diagnosis ditegakkan berdasarkan hasil pengukuran kadar karbondioksida dalam darah arteri. pH darah juga sering meningkat. e. Pengobatan
bisa membantu meningkatkan kadar karbondioksida setelah penderita menghirup kembali karbondioksida yang dihembuskannya.
Pilihan lainnya adalah mengajarkan penderita untuk menahan nafasnya selama mungkin, kemudian menarik nafas dangkal dan menahan kembali nafasnya selama mungkin. Hal ini dilakukan berulang dalam satu rangkaian sebanyak 6-10 kali. Jika kadar karbondioksida meningkat, gejala hiperventilasi akan membaik, sehingga mengurangi kecemasan penderita dan menghentikan serangan alkalosis respiratorik 4. Alkalosis Metabolik
a. Pengertian
Alkalosis Metabolik adalah suatu keadaan dimana darah dalam keadaan basa karena tingginya kadar bikarbonat.
b. Penyebab
Alkalosis metabolik terjadi jika tubuh kehilangan terlalu banyak asam. Sebagai contoh adalah kehilangan sejumlah asam lambung selama periode muntah yang berkepanjangan atau bila asam lambung disedot dengan selang lambung (seperti yang kadang-kadang dilakukan di rumah sakit, terutama setelah pembedahan perut).
Pada kasus yang jarang, alkalosis metabolik terjadi pada seseorang yang mengkonsumsi terlalu banyak basa dari bahan-bahan seperti soda bikarbonat.
Selain itu, alkalosis metabolik dapat terjadi bila kehilangan natrium atau kalium dalam jumlah yang banyak mempengaruhi kemampuan ginjal dalam mengendalikan keseimbangan asam basa darah.
Penyebab utama akalosis metabolik:
- Penggunaan diuretik (tiazid, furosemid, asam etakrinat) - Kehilangan asam karena muntah atau pengosongan lambung
- Kelenjar adrenal yang terlalu aktif (sindroma Cushing atau akibat penggunaan kortikosteroid).
c. Gejala
sekali. Bila terjadi alkalosis yang berat, dapat terjadi kontraksi (pengerutan) dan spasme (kejang) otot yang berkepanjangan (tetani). d. Diagnosa
Dilakukan pemeriksaan darah arteri untuk menunjukkan darah dalam keadaan basa.
e. Pengobatan
Biasanya alkalosis metabolik diatasi dengan pemberian cairan dan elektrolit (natrium dan kalium). Pada kasus yang berat, diberikan amonium klorida secara intravena.
II.4 Analisa Gas Darah
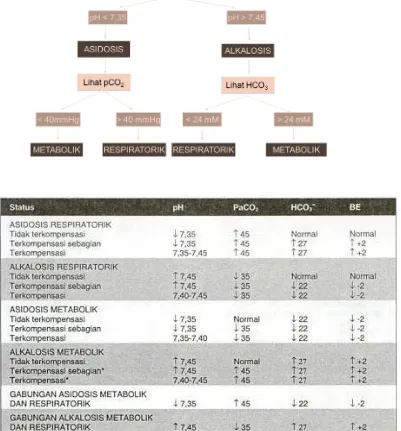
Rentang nilai normal dan interpretasi dari tiap komponen: 1. pH
Rentang nilai normal : 7,35 – 7,45 Asidosis : <7,35 Alkalosis : >7,45 2. PaO2
Rentang nilai normal : 80 – 100 mmHg Hipoksemia ringan : 70 – 80 mmHg Hipoksemia sedang : 60 – 70 mmHg Hipoksemia berat : <60 mmHg 3. SaO2
Rentang nilai normal : 93% – 98%
Bila nilai SaO2 >80% sudah dapat dipastikan bahwa darah diambil dari arteri, kecuali pada gagal napas.
4. PaCO2
Rentang nilai normal : 35 – 45 mmHg
Asidosis respiratorik : >45 mmHg (pH turun) Alkalosis respiratorik : <35 mmHg (pH naik) 5. HCO3
Rentang nilai normal : 22 – 26 mEq/L
Alkalosis metabolik : >26 mEq/L (pH naik) 6. BE
Rentang nilai normal : -2 s/d +2 mEq/L Nilai – (negative) : asidosis
Nilai + (positif) : alkalosis BE dilihat saat pH normal.
Cara menentukan apakah suatu kondisi termasuk ke dalam salah satu dari 4 gangguan asam-basa dengan melihat diagram dibawah ini:
a. Pengertian
Pengukuran gas darah arteri sangat penting dalam menilai pertukaran gas di dalam paru. Pengukuran ini untuk mengukur keasaman darah dan kadar bikarbonat. Pemeriksaan dapat dilakukan melalui pengambilan darah astrup dari arteri radialis, brakhialis, atau formalis. Analisa gas darah (AGD) dilakukan untuk mengevaluasi status oksigen dan karbondioksida di dalam darah arteri dan mengukur pH-nya. Proses perubahan pH darah ada dua macam, yaitu proses perubahan yang bersifat metabolik (adanya perubahan konsentrasi bikarbnat yang disebabkan gangguan metabolisme) dan yang bersifat respiratorik (adanya perubahan tekanan parsial CO2 yang disebabkan gangguan respirasi). Perubahan PaCO2 akan menyebabkan perubahan pH darah. pH darah akan turun /asidosis jika PaCO2 meningkat (asidosis respiratorik primer) atau jika HCO3- /asidosis metabolik primer, pH
darah akan naik /alkalosis jika PaCO2 /alkalosis respiratorik primer atau jika HCO3- /alkalosis metabolik primer.
b. Indikasi
Indikasi dilakukannya pemeriksaan Analisa Gas Darah (AGD) yaitu : 1) Pasien dengan penyakit obstruksi paru kronik
Penyakit paru obstruktif kronis yang ditandai dengan adanya hambatan aliran udara pada saluran napas yang bersifat progresif non reversible ataupun reversible parsial. Terdiri dari 2 macam jenis yaitu bronchitis kronis dan emfisema, tetapi bisa juga gabungan antar keduanya.
2) Pasien dengan edema pulmo
Pulmonary edema dapat disebabkan oleh banyak faktor-faktor yang berbeda. Ia dapat dihubungkan pada gagal jantung, disebut cardiogenic pulmonary edema, atau dihubungkan pada sebab-sebab lain, dirujuk sebagai non-cardiogenic pulmonary edema.
3) Pasien akut respiratori distress sindrom (ARDS)
ARDS terjadi sebagai akibat cedera atau trauma pada membran alveolar kapiler yang mengakibatkan kebocoran cairan kedalam ruang interstisiel alveolar dan perubahan dalarn jaring- jaring kapiler, terdapat ketidakseimbangan ventilasi dan perfusi yang jelas akibat-akibat kerusakan pertukaran gas dan pengalihan ekstansif darah dalam paru-paru. ARDS menyebabkan penurunan dalam pembentukan surfaktan, yang mengarah pada kolaps alveolar . Komplians paru menjadi sangat menurun atau paru- paru menjadi kaku akibatnya adalah penurunan karakteristik dalam kapasitas residual fungsional, hipoksia berat dan hipokapnia.
4) Infark miokard
Infark miokard adalah perkembangan cepat dari nekrosis otot jantung yang disebabkan oleh ketidakseimbangan antara suplai dan kebutuhan oksigen. Klinis sangat mencemaskan karena sering berupa serangan mendadak umumya pada pria 35-55 tahun, tanpa gejala pendahuluan. 5) Pneumonia
Pneumonia merupakan penyakit dari paru-paru dan sistem dimana alveoli(mikroskopik udara mengisi kantong dari paru yang bertanggung jawab untuk menyerap oksigen dari atmosfer) menjadi radang dan dengan penimbunan cairan.Pneumonia disebabkan oleh berbagai macam sebab,meliputi infeksi karena bakteri,virus,jamur atau parasit. Pneumonia juga dapat terjadi karena bahan kimia atau kerusakan fisik dari paru-paru, atau secara tak langsung dari penyakit lain seperti kanker paru atau penggunaan alkohol.
6) Pasien syok
Perfusi jaringan yang adekuat tergantung pada 3 faktor utama, yaitu curah jantung, volume darah, dan pembuluh darah. Jika salah satu dari ketiga faktor penentu ini kacau dan faktor lain tidak dapat melakukan kompensasi maka akan terjadi syok. Pada syok juga terjadi hipoperfusi jaringan yang menyebabkan gangguan nutrisi dan metabolism sel sehingga seringkali menyebabkan kematian pada pasien.
7) Post pembedahan coronary arteri baypass
Coronary Artery Bypass Graft adalah terjadinya suatu respon inflamasi sistemik pada derajat tertentu dimana hal tersebut ditandai dengan hipotensi yang menetap, demam yang bukan disebabkan karena infeksi, DIC, oedem jaringan yang luas, dan kegagalan beberapa organ tubuh. Penyebab inflamasi sistemik ini dapat disebabkan oleh suatu respon banyak hal, antara lain oleh karena penggunaan Cardiopulmonary Bypass.
8) Resusitasi cardiac arrest
c. Kontra Indikasi Analisa Gas Darah
1. Denyut arteri tidak terasa, pada pasien yang mengalami koma. 2. Modifikasi Allen tes negatif , apabila test Allen negative tetapi tetap
dipaksa untuk dilakukan pengambilan darah arteri lewat arteri radialis, maka akan terjadi thrombosis dan beresiko mengganggu viabilitas tangan.
3. Selulitis atau adanya infeksi terbuka atau penyakit pembuluh darah perifer pada tempat yang akan diperiksa
4. Adanya koagulopati (gangguan pembekuan) atau pengobatan denganantikoagulan dosis sedang dan tinggi merupakan kontraindikasi relatif.
d. Alat dan Bahan untuk Pengambilan Darah Arteri
Alat dan bahan yang dibutuhkan untuk pengambilan darah arteri antara lain :
1. Disposible Spuit 2,5 cc, jarum ukuran 23 G/ 25 G 2. Penutup jarum khusus atau gabus
Mencegah kontaminasi dengan udara bebas. Udara bebas dapat mempengaruhi nilai O2 dalam AGD arteri.
3. Nierbeken/Bengkok
Digunakan untuk membuang kapas bekas pakai. 4. Anticoagulant Heparin
Untuk mencegah darah membeku. 5. Alcohol swabs ( kapas Alkohol )
Merupakan bahan dari wool atau kapas yang mudah menyerap dan dibasahi dengan antiseptic berupa etil alkohol. Tujuan penggunaan kapas alkohol adalah untuk menghilangkan kotoran yang dapat mengganggu pengamatan letak vena sekaligus mensterilkan area penusukan agar resiko infeksi bisa ditekan.
6. Plester
7. Kain pengalas
Untuk memberi kenyamanan pada pasien saat plebotomis melakukan pengambilan darah vena.
8. Tempat berisi es batu
Bila laboratorium jauh, maka specimen darah arteri harus dimasukkan kedalam tempat berisi es batu sebab suhu yang rendah akan menurunkan metabolism sel darah yang mungkin merubah nilai pH, PCO2, PO2, HCO3-.
9. Tempat sampah khusus needle
Tempat untuk membuang needle yang sudah dipakai untuk mengurangi kontaminasi pasien satu dengan pasien yang lain.
e. Antikoagulan yang Digunakan
Antikoagulan yang digunakan dalam pengambilan darah arteri adalah heparin. Pemberian heparin yang berlebiham akan menurunkan tekanan CO2.Antikoagulan dapat mendilusi konsentrasi gas darah dalam tabung.
Sedangkan pH tidak terpengaruh karena efek penurunan CO2 terhadap
pH dihambat oleh keasaman heparin.
f. Alat Perlindungan Diri (APD) untuk Petugas
Alat Perlindungan Diri (APD) yang harus digunakan seorang petugas yaitu:
1. Jas Laboratorium
Pemakaian utama dari jas laboratorium adalah untuk melindungi pakaian petugas pelayanan kesehatan. Jas laboratorium diperlukan sewaktu melakukan tindakan, bila baju tidak ingin kotor.
2. Sarung Tangan (Handscoon)
a. Mengurangi resiko petugas kesehatan terkena infeksi dari pasien.
b. Mencegah penularan flora kulit petugas kepada pasien. c. Mengurangi kontaminasi tangan petugas kesehatan dengan
mikroorganisme yang dapat berpindah dari satu pasien ke pasien lain.
3. Masker
Masker digunakan untuk menahan cipratan yang keluar sewaktu petugas kesehatan atau petugas bedah berbicara, batuk, bersin, dan juga mencegah ciprtan darah atau cairan tubuh yang terkontaminasi masuk ke dalam hidung atau mulut petugas kesehatan.
4. Sepatu Laboratorium
Alas kaki/sepatu laboratorium dipakai untuk melindungi kaki dari perlukaaan oleh benda tajam atau dari cairan yang jatuh atau menetes kaki. Sepatu bot dari karet atau kulit lebih melindungi, tapi harus bersih dan bebas dari kontaminasi darah atau cairan tubuh lainnya.
5. Kap (penutup rambut)
Dipakai untuk menutup rambut dan kepala, tujuan utamanya adalah melindungi pemakainya dari ciprtan darah dan cairan tubuh lainnya. 6. Pelindung Mata
Pelindung mata melindungi petugas kesehatan dari cipratan darah atau cairan tubuh lainnya yang terkontaminasi dengan pelindung mata.
g. Lokasi Pengambilan Darah Arteri
1. Arteri Radialis dan Arteri Ulnaris (sebelumnya dilakukan allen’s test)
observasi warna jari-jari, ibu jari dan tangan. Jari-jari dan tangan harus memerah dalam 15 detik, warnamerah menunjukkan test allen’s positif. Apabila tekanan dilepas, tangan tetap pucat, menunjukkan test allen’s negatif. Jika pemeriksaan negative, hindarkan tangan tersebut dan periksa tangan yang lain.
2. Arteri Dorsalis pedis
Merupakan arteri pilihan ketiga jika arteri radialis dan ulnaris tidak bisa digunakan.
3. Arteri Brakialis
Merupakan arteri pilihan keempat karena lebih banyak resikonya bila terjadi obstruksi pembuluh darah. Selain itu arteri femoralis terletak sangat dalam dan merupakan salah satu pembuluh utama yang memperdarahi ekstremitas bawah.
4. Arteri Femoralis
Merupakan pilihan terakhir apabila pada semua arteri diatas tidak dapat diambil. Bila terdapat obstruksi pembuluh darah akan menghambat aliran darah ke seluruh tubuh / tungkai bawah dan bila yang dapat mengakibatkan berlangsung lama dapat menyebabkan kematian jaringan. Arteri femoralis berdekatan dengan vena besar, sehingga dapat terjadi percampuran antara darah vena dan arteri.
Selain itu arteri femoralis terletak sangat dalam dan merupakan salah satu pembuluh utama yang memperdarahi ekstremitas bawah. Arteri Femoralis atau Brakialis sebaiknya jangan digunakan jika masih ada alternative lain karena tidak memiliki sirkulasi kolateral yang cukup untuk mengatasi bila terjadi spasme atau thrombosis. Sedangkan arteri temporalis atau axillaris sebaiknya tidak digunakan karena adanya resiko emboli ke otak.
II.5 Penatalaksanaan
2. Alkalosis diberikan terapi intravena dengan ammonium klorida (165 mmol/1),penyediaan oksigen
Penilaian Sistematik dalam Penilaian gangguan asam basa 1. Awali dengan kecurigaan klinis yang tinggi
a. Teliti riwayat klinis dari perjalanan penyakit yang dapat mengakibatkan ketidakseimbangan asam basa. Ini membutuhkan pengetahuan tentang patogensis dari berbagai gangguan asam basa. Contohnya, asidosis respiratorik mungkin dapat diperkirakan timbul pada penderita penyakit paru obstruksi menahun.
b. Perhatikan tanda dan gejala klinis yang mengarah kepada gangguan asam basa. Banyak tanda dan gejala dari gangguan asam basa tidak jelas dan non spesifik. Contoh, pernafasan kussmaul pada pasien diabetes dapat merupakan tanda kompensasi pernafasan terhadap asidosis metabolik. c. Periksa hasil pemeriksaan laboratorium untuk elektrolit dan data lainnya
yang mengarah kepada proses penyakit yang berkaitan dengan gangguan asam basa. Contoh, hipokalemia sering berkaitan dengan alkalosis metabolik.
2. Menilai variabel-variabel asam basa untuk mengetahui tipe gangguan. a. Pertama, periksa PH darah arteri untuk menentukan arah dan besarnya
gangguan asam basa. Jika menurun, pasien mengalami asidemia dengan dua sebab yang mungkin : asidosis metabolik atau asidosis respiratorik. Jika meningkat, pasien mengalami alkalemia dengan dua sebab yang mungkin : alkalosis metabolik atau alkalosis respiratorik. Ingatlah bahwa kampensasi ginjal dan pernafasan jarang memulihkan PH kembali normal sehingga jika ditemukan PH yang normal meskipun ada perubahan dalam PaCO2 dan HCO3 ,mungkin ada gangguan campuran ; contohnya seorang pasien dengan asidosis respiratorik yang bercampur dengan alkalosis metabolik mungkin akan mempunyai PH yang normal.
b. Perhatikan variabel pernafasan (PaCO2) dan metabolik HCO3, yang berhubungan dengan PH untuk mencoba mengetahui apakah gangguan primer bersifat respiratorik, metabolik atau campuran.
- Apakah HCO3 normal (24 mEq/L), meningkat atau menurun ? - Tambahan : apakah ada kelebihan atau kekurangan basa ?
- Pada gangguan asam basa sederhana, PaCO2 dan HCO3 selalu berubah dalam arah yang sama.
- Penyimpangan dari PaCO2 dan HCO3 dalam darah yang berlawanan menunjukkan adanya gangguan asam basa campuran.
- Cobalah untuk menduga campuran primer dengan menghubungkan hasil pemeriksaan yang ditemukan dengan keadaan klinis.
3. Perkirakan respon kompensatorik yang bakal terjadi pada gangguan asam basa primer.
a. Jika respon kompensatorik lebih berat atau ringan dari pada yang diperkirakan, mungkin ada gangguan asam basa campuran (normogram asam basa juga dapat digunakan untuk mengetahui gangguan asan basa campuran)
b. Hitung selisih (gap) anion plasma.
Jika meningkat ( >16 mEq/l ), mungkin sekali terjadi acidosis metabolik.
c. Bandingkan besarnya penurunan HCO3 plasma dengan peningkatan selisih anion : seharusnya sama besar.
d. Jika peningkatan < dari selisih anion penurunan HCO3 , mungkin komponen dari acidosis metabolik disebabkan oleh kehilangan HCO3. Jika peningkatan selisih dari anion jauh lebih besar dari penurunan HCO3 berarti ada alkalosis metabolik yang menyertainya.
4. Buat penafsiran tahap akhir.
a. Gangguan asam-basa sederhana 1) Akut (tidak terkompensasi) atau
2) Kronik (sebagian atau sepenuhnya terkompensasi ) b. Gangguan asam-basa campuran