Sintesis Alkohol dengan Reagen Grignard
Nicodemus Dwiputra
10513016; Kelas 02; Kelompok 2
[email protected]
Abstrak
Senyawa alkohol dapat disintesis dengan menggunakan reagen Grignard (senyawa organologam) yang direaksikan dengan aldehid atau keton. Percobaan ini bertujuan untuk mensintesis trifenilmetanol melalui reaksi Grignard. Reagen Grignard dapat disiapkan dengan sonikasi magnesium dan bromobenzena dalam dietil eter. Reaksi fenilmagnesium bromida dengan benzofenon dingin dan penambahan HCl membentuk dua fasa dalam campuran. Dari pencucian dan penguapan pelarut pada fasa organik diperoleh kristal putih trifenilmetanol. Setelah proses rekristalisasi diperoleh sebanyak 0.235 gram kristal putih trifenilmetanol (% rendemen sebesar 21,94 %) dengan titik leleh 48-50oC . Dari hasil kromatografi lapis tipis menggunakan eluen etil asetat : n-heksana = 3 : 7 diperoleh nilai Rf produk sebesar 0,6 dan 0,88.
Kata kunci: reagen Grignard, trifenilmetanol, benzofenon, bromobenzena
Abstract
Alcohol compounds can be synthesized using Grignard reagent (organometallic compounds) through reaction with aldehyde or ketone compounds. The aim of this experiment is to synthesize triphenylmethanol through Grignard reaction. An ultrasonic bath is used to initiate the formation of Grignard reagent from magnesium and bromobenzene in diethyl ether. Reaction between phenylmagnesium bromide and benzophenone proceeded with addition of HCl divided the mixture into two phases. After washing and solvent vaporization of the organic phase, white crystal of triphenylmethanol is collected. 0.235 gram of product obtained after re-crystallization (percent yield = 21.94 %) with melting point 48-50 oC. Thin layer chromatography test of the product (using
ethyl acetate : n-hexane = 3 : 7 as eluent) gives Rf of 0.6 and 0.88 .
Keywords: Grinard reagent, triphenylmethanol, benzophenone, bromobenzene
1. PENDAHULUAN
Senyawa alkohol dapat disintesis melalui banyak cara, salah satunya adalah dengan menggunakan reagen Grignard. Reagen Grignard adalah suatu senyawa organomagnesium halide yang banyak digunakan dalam sintesis organik. Reagen Grignard pertaman kali ditemukan oleh Victor Grignard, seorang kimiawan Perancis, pada tahun 1900. Untuk menghargai jasanya, senyawa organomagnesium halida diberi nama reagen Grignard [1].
Reagen Grinard (RMgX atau ArMgX) dapat dibuat dengan reaksi dari senyawa oganik halida dengan logam magnesium dalam pelarut eter anhidrat. Pada reagen Grignard terdapat pemisahan muatan yang jelas dimana atom C memiliki sifat elektronegatif. Struktur sebenarnya dari reagen Grignard lebih kompleks dari rumus umum RMgX. Dari hasil experiment, reagen Grignard diketahui berada dalam kesetimbangan dengan dialkilmagnesium. Mekanisme reaksi pembentukan reagen Grignard melibatkan reaksi radikal.
Reagne Grignard dapat disiapkan melalui peralatan sonikasi pada laboratorium reguler[2].
Reagen Grignard akan bereaksi dengan senyawa aldehid atau keton menghasilkan senyawa
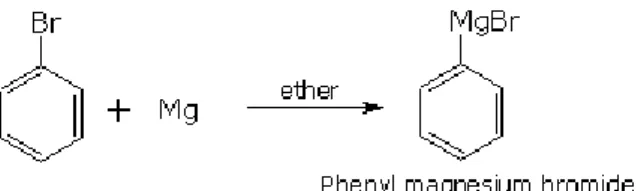
Gambar 1. Pembentukkan reagen Grignard alkohol. Jika reagen Grignard bereaksi dengan suatu aldehid maka hasilnya adalah suatu alkohol sekunder. Jika reagen Grignard bereaksi dengan suatu keton maka hasilnya adalah suatu alkohol tersier. Reagen Grignard akan melakukan adisi pada karbonil menghasilkan suatu alkoksida. Penambahan asam akan memprotonasi alkoksida menjadi alkohol.
Pada percobaan ini alkohol akan disintesis menggunakan reagen Grignard fenilmagnesium bromida yang direaksikan dengan suatu keton, benzofenon. Senyawa produk yang dihasilkan adalah suatu alkohol tersier, trifenilmetanol.
2. METODE PERCOBAAN
0.26 gram Magnesium turnings (dalam vial yang sudah berisi parafin dan dibersihkan dengan tissue) dimasukkan ke dalam tabung reaksi yang kering (tabung A) dan segera ditutup menggunakan kertas
parafilm. Sebanyak 1 mL bromobenzena dimasukkan
ke dalam tabung reaksi lain (tabung B), kemudian 3,1 mL eter anhidrat ditambahkan engan menggunakan syringe dan segera tutup dengan kertas parafilm. Tabung B digoyang agar tercampur dengan baik, ketinggian larutan di tabung B diukur dan diberi tanda lalu tabung A diberi tanda juga pada ketinggian yang sama seperti tabung B.
Bromobenzena dalam eter di tabung B diambil secukupnya dengan menggunakan syringe dan ditambahkan ke tabung A hingga menutupi sebagian dari magnesium. Tabung A yang ditutup parafilm disimpan dalam penangas air di alat sonikasi pada lemari asam dengan tabung reaksi diarahkan ke tempat kosong. Ketika cairan dalam tabung A berubah warna menjadi kelabu atau putih, tabung segera diangkat dari alat sonikasi. Eter akan mendidih. Jika eter belum mendidih, tabung A diletakkan kembali dalam alat sonikasi. Saat campuran dalam tabung A sudah mendidih, tabung diangkat dari alat sonikasi dan ditambahkan 0,5 mL eter dengan syringe. Ketika campuran sudah tidak mendidih lagi, bromobenzena ditambahkan kembali dengan menggunakan syringe. Saat reaksi melambat, 0,5 mL eter ditambahkan untuk menggantikan eter yang menguap. Tabung A diletakkan dalam penganas es jika reaksi meletup-letup.
Saat semua bromobenzena sudah ditambahkan ke tabung A, eter ditambahkan lagi untuk menjaga ketinggian larutan sesuai tanda. Ketika reaksi melambat dan magnesium sudah melarut, tabung A kembali disonikasi selama 5 menit. Tabung lalu diangkat dan didinginkan dalam penangas es. Sisa magnesium dikeluarkan dengan spatula, dikeringkan dan ditimbang. Tabung A ditutup kembali dengan
parafilm. 1,82 gram benzofenon ditimbang dan
dilarutkan dalam eter di tabung reaksi C. Tabung C disimpan dalam penangas air yang sama seperti tabung A. Lrutan benzofenon dingin ini ditambahkan pelahan menggunakan syringe dalam ruang asam. Setelah semua benzofenon ditambahkan, isi tabung dipindahkan ke dalam erlenmeyer 50 mL, tabung reaksi A dibilas dengan eter sesedikit mungkin. Beberapa tetes HCl 0,1 M ditambahkan ke dalam campuran dan diaduk dengan batang pengaduk. Penambahan HCl terus dilakukan hingga terlihat jelas pemisahan fasa air dan fasa organik.
Isi labu Erlenmeyer dipindahkan ke corong pisah 125 mL, lalu dikocok dan dibiarkan hingga terbentuk dua fasa. Fasa air dikeluarkan dan ditampung. Fasa organik dicuci dengan 4 mL NaCl dan dilakukan kembali ekstraksi. Fasa air kembali dipisahkan. Semua fasa organik ditampung dan ditambah dengan
CaCl2 anhidrat kemudian disaring. Filtratnya ditampung dalam labu Erlenmeyer 50 mL. Wadah penampung fasa organik dibilas, disaring dan digabung dengan filtrat larutan eter. Pelarut diuapkan dalam penangas air panas di atas pemanas listrik. Sisa larutan didinginkan hingga terbentuk padatan. Padatan yang terbentuk dicuci dengan 1 mL petroleum eter sebanyak 3-4 kali hingga terbentuk kristal putih. Cairan petroleum eter dibuang dengan menggunakan pipet tetes yang ujungnya disumbat kapas. Titik leleh produk yang didapat diukur.
Sedikit dari produk yang didapat dilarutkan dalam kloroform dan ditotolkan pada pelat KLT. Benzofenon dan bromobenzena juga ditotolkan disebelahnya. Pengelusian dilakukan dengan menggunakan eluen etil asetat : n-heksana = 3: 7. Produk lalu direkristalisasi ddengan menggunakan etanol. Spektrum NMR dari produk ditentukan.
3. HASIL DAN PEMBAHASAN
massa magnesium awal : 0,256 g massa magnesium akhir : 0,156 g massa produk setelah rekristalisasi : 0,235 g titik leleh produk : 48-50oC
% yield : 21,94%
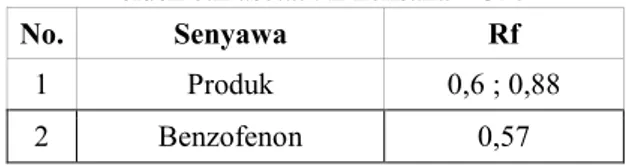
Tabel 1. Nilai Rf hasil pemeriksaan KLT dengan
eluen etil asetat : n-heksana = 3: 7
No. Senyawa Rf
1 Produk 0,6 ; 0,88
2 Benzofenon 0,57
Reaksi Grignard merupakan salah satu cara untuk mensintesis suatu alcohol. Reagen Grignard terlebih dahulu disiapkan pada percobaan ini melalui sonikasi logam magnesium dan bromobenzena di tabung reaksi yang berbeda dalam ultrasonic bath.
Magnesium yang tersedia sudah berada dalam parafin dan harus dikeringkan terlebih dahulu menggunakan tissue, kemudian langsung dimasukan ke dalam tabung reaksi dan ditutup dengan kertas parafilm. Tujuannya adalah supaya tidak ada air yang masuk dan ikut dalam reaksi. Begitu pula dengan penambahan eter anhidrat ke dalam benzofenon yang menggunakan alat suntik yaitu agar meminimalkan jumlah air yang masuk. Proses pembuatan reagen Grignard biasanya dilakukan di dalam pelarut eter karena senyawa organologam merupakan nukleofil yang baik sekaligus basa yang kuat, perlakuan harus dilakukan dengan teliti untuk menghindari kelembaban. Sifat basa dari reagen Grignard menyebabkannya akan bereaksi dengan senyawa- senyawa yang bersifat asam seperti asam karboksilat, fenol, thiol, alcohol bahkan dengan air, (bereaksi dengan senyawa-senyawa yang memiliki atom hydrogen yang menempel pada atom yang
elektronegatif seperti oksigen, nitrogen atau sulfur) oleh karena itu kondisi reaksi harus bebas dari asam dan benar-benar bebas air. Reagen Grignard juga akan bereaksi dengan oksigen di udara membentuk hidroperoksida, oleh sebab itu sangat tidak stabil jika terekspos ke udara dan tidak diisolasi dari larutan. Dietil eter anhidrat dipilih sebagai pelarut dalam reaksi Grignard atas dasar beberapa alasan. Uap dari pelarut dietil eter anhidrat yang mudah sekali menguap akan menghalangi oksigen dari udara untuk mencapai campuran reaksi sehingga akan mengurangi kemungkinan reaksi antara oksigen dengan reagen Grignard yang akan menghasilkan produk samping yang tidak diinginkan. Reagen Grignard juga akan membentuk kompleks dengan pelarut eter-nya, dimana pelarut eter tersebut menyediakan ligan yang diperlukan untuk pembentukkan kompleks. Pembentukkan kompleks dengan molekul-molekul eter ini merupakan factor yang penting pada pembentukkan dan kestabilan dari reagen Grignard. Proses penambahan dietil eter anhidrat ini dilakukan di dalam lemari asam dan tidak boleh ada api disekitarnya karena dietil eter merupakan zat yang
highly flammable (sangat mudah terbakar).
Pada saat bromobenzene dalam eter sudah ditambahkan ke dalam tabung berisi magnesium di
ultrasonic bath, gelembung-gelembung akan mulai
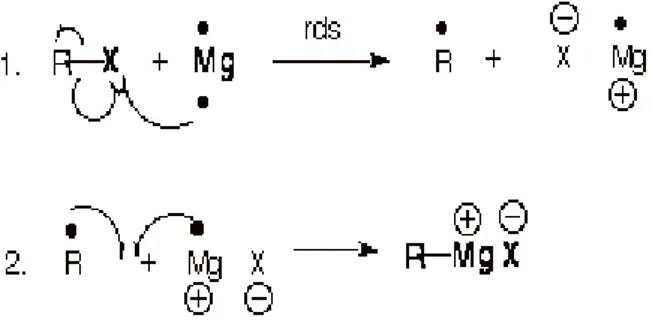
muncul di permukaan logam magnesium. Timbulnya gelembung-gelembung ini menandakan keberjalanan reaksi. Mekanisme reaksi pembentukkan reagen Grignard sebenarnya sangat rumit dan masih menjadi perdebatan, namun sudah disepakati bahwa reaksi pembentukkan reagen Grignard ini melibatkan radikal. Mekanisme umum pembentukkan reagen Grignard diberikan dalam gambar 2.
Gambar 2. Mekanisme reaksi umum pembentukkan
reagen Grignard
Tahap pertama adalah pembentukkan organologam, yaitu reaki kupling antara readikal Mg terhadap halide X, menghasilkan suatu radikal alkil R·. Kemudian alkil radikal akan bergabung dengan Mg-X membentuk suatu reagen Grignard. Reaksi pembentukkan reagen Grignard ini bersifat sangat eksoterm, sehingga setelah reaksi pembentukkan ini dimulai, proses refluks akan terjadi tanpa penambahan sumber panas dari luar. Reaksi dapat berlangsung dengan cepat dan meletup-letup oleh karena itu
digunakan penangas es untuk meredakan reaksi yang sangat eksoterm ini.
Setelah reagen Grignard terbentuk, ke dalamnya ditambahkan suatu keton, benzofenon. Karena reaksi yang akan terjadi adalah antara reagen Grignard dengan benzofenon yang merupakan suatu keton, maka produk yang diharapkan terbentuk adalah suatu alcohol tersier, trifenilmetanol. Reaksi yang dilakukan berada dalam penangas es dan masih tetap ditutup dengan menggunakan kertas parafilm, karena kertas parafilm merupakan kertas yang tahan air, dan dapat digunakan untuk penyimpanan yang cukup lama. Kontak antara reagen Grignard dengan air dan udara sangat dihindari dalam percobaan ini karena reagen Grignard dapat bereaksi dengan air dan gas O2 serta CO2 di udara menghasilkan produk lain yang tidak diinginkan sehingga dapat mengurangi rendemen percobaan. Reagen Grignard dapat bereaksi dengan air menghasilkan suatu alkana dan Mg(OH)X, reaksi dengan alcohol pun akan menghasilkan alkana. R-MgX + H-O-H → R-H + HO _ + Mg2+ + X-- . Reaksi
yang terjadi ini adalah reaksi asam-basa, dimana reaksi terjadi kearah pembentukkan asam konjugasi yang lebih lemah dan basa konjugasi yang lebih lemah. Reagen Grignard bertindak seakan-akan mempunyai anion dari alkana, suatu karbanion.
Penambahan benzofenon ke dalam reagen Grignard dilakukan menggunakan syringe dan penambahannya dilakukan sedikit demi sedikit dan dengan perlahan-lahan karena reaksi antara reagen Grignard dengan benzofenon sangat eksoterm sehingga harus dilakukan dalam penangas es untuk berjaga-jaga jika terjadi letupan kuat, juga unutk menghindari terbentuknya senyawa produk samping yang dapat mengurangi rendemen produk utama yang diinginkan. Reaksi sintetis yang paling penting dari reagen Grignard adalah reaksi-reaksi dimana reagen Grignard tersebut bertindak sebagai nukleofil dan menyerang ikatan karbon tak jenuh, terutama atom karbon pada gugus karbonil, dimana senyawa yang memiliki gugus karbonil yang digunakan pada percobaan ini adalah benzofenon. Senyawa-senyawa karbonil merupakan senyawa yang rentan sekali terhadap serangan nukleofilik, dimana atom karbon pada gugus karbonilnya memiliki muatan parsial postif akibat berikatan rangkap dengan atom yang elektronegatif, atom O, sehingga kerapatan electron di atom C rendah karena ditarik oleh atom O.
Mekanisme reaksi antara reagen Grignard dan bromobenzena dapat dilihat pada gambar 3. Reaksi yang terjadi masih dilakukan dalam dietil eter anhidrat. Reagen Grignard yang merupakan nukleofil kuat akan menggunakan pasangan elektronnya diantara ikatan atom C dengan MgBr untuk membentuk ikatan dengan atom C pada gugus karbonil. Satu pasang electron pada gugus karbonil berpindah ke atom oksigen. Reaksi yang terjadi ini merupakan reaksi adisi nukleofilik pada gugus karbonil yang pada akhirnya berujung pada pembentukkan ion alkoksida yang berasosiasi dengan
ion Mg2+ dan ion halide Br-. Setelah reaksi antara reagen Grignard dan benzofenon selesai, penambahan asam, dimana pada percobaan ini digunakan asam encer HCl 0,1 M, berfungsi untuk mengubah garam dari lakohol (RMgOX) menjadi alkohol itu sendiri memprotonasi dari ion alkoksida yang mana bertujuan pada pembentukkan alcohol dan MgCl2. Jika alcohol yang terbentuk adalah alcohol tersier, maka akan menjadi rentan terhadap proses dehidrasi yang dikatalisis oleh asam. Oleh karena itu digunakan asam yang cukup encer sehingga cukup kuat untuk mengubah garam dari alkoholnya menjadi alcohol tanpa terjadinya reaksi yang dikatalisis asam dari alcohol tersier yang dihasilkan. Setelah penambahan asam yang cukup larutan akan terpisah menjadi dua lapisan yang jelas, dimana terdapat fasa air dan fasa organic. Di fasa organic-lah terdapat hasil reaksi yang diinginkan. . Dalam fasa organic ditambahkan sedikit NaOH yang bertujuan untuk menetralkan HCl yang masih tersisa jika penambahan HCl berlebih. Jika HCl masih terdapat dalam fasa organic maka akan ada kemungkinan asam akan memprotonasi gugus –OH pada trifenilmetanol sehingga gugus terebut akan berubah menjadi leaving group yang baik dan produk trifenilmetanol yang diinginkan akan berkurang akibat sebagiannya berubah menjadi senyawa alkana. Hasil ekstraksi berupa fasa organic tersebut kemudian ditambahkan CaCl2 anhidrat untuk menghilangkan kemungkinan air yang masih tersisa dalam larutan. Fasa organic kemudian dipanaskan untuk menguapkan pelarut sehingga larutan menjadi jenuh dan padatan produk dapat terbentuk. Pendinginan larutan di dalam penangas es dilakukan untuk menurunkan kelarutan padatan dalam pelarutnya sehingga semakin mudah dan banyak padatan yang terbentuk. Pencucian dilakukan dengan menggunakan
petroleum eter sebanyak 3-4 kali hingga padatan terbentuk menjadi Kristal putih. Pencucian dengan petroleum eter ini berfungsi menghilangkan senyawa-senyawa pengotor ataupun dapat menghilangkan senyawa produk samping yang mungkin terbentuk yang dapat mempengaruhi hasil analisis untuk identifikasi produk utama seperti uji kromatografi lapis tipis.
Dari hasil percobaan sintesis trifenilmetanol ini, diperoleh suatu kristal putih dengan massa kristal seberat 0,255 gram dengan percent yield sebesar 21,94%. Pada awal pembentukkan reagen Grignard digunakan 0,256 gram magnesium turnings yang setelah bereaksi tersisa sebanyak 0,156 gram. Artinya jumlah magnesium yang bereaksi adalah sebanyak 0,1 gram atau sebanyak 4.1135 mmol. Jumlah magnesium
turnings yang bereaksi ini akan menjadi pereaksi
pembatas dari reaksi pembentukkan trifenilmetanol ini karena jumlah bromobenzena dan benzofenon yang digunakan lebih banyak dari jumlah magnesium yang bereaksi yaitu sebanyak 0,01 mol. Besar percent
yield yang diperoleh kurang maksimal dimana hal ini
dapat disebabkan oleh beberapa hal, diantaranya adalah terbentuknya produk-produk samping yang dapat mengurangi percent yield. Produk-produk samping yang dapat terbentuk dalam reaksi selain reagen Grignard yang dapat bereaksi dengan udara (gas oksigen dan karbon dioksida) dan terbentuknya senyawa alkana akibat reaksi dengan air adalah terbentuknya senyawa bifenil akibat reaksi antara fenilmagnesium bromide dengan bromobenzene. Produk samping ini sangat mungkin terbentuk karena jumlah bromobenzene yang ditambahkan lebih banyak dari jumlah Magnesium-nya mengingat hanya sedikit jumlah magnesium yang bereaksi. Senyawa hasil reaksi samping ini dapat dihilangkan dengan
pencucian padatan produk menggunakan ligroin (petroleum eter) karena bifenil jauh lebih larut dalam petroleum eter dibandingkan dengan trifenilmetanol. Salah satu cara penghilangan senyawa-senyawa pengotor adalah dengan menggunakan proses rekristalisasi dengan pelarut. Seringnya kontak dengan udara diakibatkan kertas parafilm yang mudah tersobek sehingga larutan terekspos dengan udara dalam waktu yang lama, untuk meminimalisirnya kertas parafilm dapat dilapis lagi dengan menggunakan aluminum foil, selain itu peralatan gelas yang akan digunakan pada percobaan juga sebaiknya dibersihkan dikeringkan dalam oven pada 110OC selama minimal 30 menit. Ketidakmaksimalan pembentukkan produk trifenilmetanol juga dapat disebabkan oleh sedikitnya magnesium turnings yang ikut bereaksi menghasilkan reagen Grignard. Permukaan logam magnesium yang digunakan sebenarnya dilapisis oleh suatu lapisan oksida yang dapat melindungi magnesium untuk tidak bereaksi dengan bromobenzena. Oleh karena itu sebelum magnesium digunakan harus terlebih dahulu dihilangkan lapisan oksidanya melalui beberapa cara[3]. Penggoresan magnesium menggunakan
sandpaper atau kertas ampelas adalah salah satu
caranya. Sonikasi juga merupakan salah satu cara untuk menghilangkan lapisan oksida dari magnesium, penambahan kristal iodine pun dapat dilakukan.
Hasil analisis kromatografi lapis tipis dari senyawa produk menggunakan eluen etil asetat : n-heksana = 3 : 7 menghasilkan dua noda pada pelat
dengan nilai Rf noda pertama adalah 0,6 dan noda kedua 0,88. Pengukuran titik leleh produk menghasilkan nilai 48-50OC. Dilihat dari data KLT produk dapat dilihat bahwa produk yang dihasilkan belum murni dibuktikan dengan munculnya dua buah noda. Noda pertama memiliki nilai Rf yang mirip dengan nilai Rf reaktan benzofenon yaitu sekitar 0,57. Nilai titik leleh produk yang didapat juga serupa dengan nilai titik leleh benzofenon yaitu pada rentang suhu 48-50OC dimana seharusnya trifenilmetanol memiliki titik leleh 163 OC (literature). Dari data-data tersebut dapat disimpulkan bahwa produk yang dihasilkan sebagian besar masih merupakan benzofenon yang tidak bereaksi dengan reagen Grignard yang terbentuk akibat jumlah benzofenon yang lebih berlebih.
4.
KESIMPULAN
massa kristal produk : 0,235 g
% yield : 21,94 %
Titik leleh produk : 48-50OC
Rf produk : 0,6 dan 0,88
UCAPAN TERIMAKASIH
Penulis mengucapkan rasa syukur dan terimakasih kepada Tuhan Yang Maha Esa, kedua orang tua atas
segala dukungannya, pemimpin praktikum Ibu Alni dan juga dosen mata kuliah kimia organik Dr. Deana Wahyuningrum, asisten praktikum, teman-teman kelompok praktikum, dan pihak-pihak lain yang ikut membantu namun tidak bisa disebutkan satu per satu oleh penulis, baik yang ikut terlibat secara langsung maupun tidak langsung dalam penulisan laporan ini.
DAFTAR PUSTAKA
[1] Solomons, T. W. G.; Fryhle, C. B. Organic
Chemistry, 10th ed.; John Wiley & Sons, Inc.,:
Hoboken, NJ, 2011, 561-573.
[2] David H. Smith. (1999) Grignard Reactions in “Wet” Ether; J. Chem. Educ., 1999, 76 (10), p 1427.
[3] Mayo, D.W., Pike, R.M., Forbes, D.C.,
Microscale Organic Laboratory: with
Multisteps and Multiscale Synthesis, 5th edition,