LAPORAN PROYEK SAINS TUMBUHAN (BI-2204) PENDAHULUAN
“Pengenalan Mikroskop, Pembuatan Preparat Segar, Pengamatan Aliran Sitoplasma, Zat Ergastik Pati dan Kristal, Pembuatan Larutan Sukrosa, dan
Plasmolisi”
Tanggal Praktikum : 27 Januari 2016 Tanggal Pengumpulan : 03 Februari 2016
Disusun oleh: Hany Husnul Chotimah
10614025 Kelompok 4
Asisten:
Azarine Rahmawati Gandira 10612039
PROGRAM STUDI BIOLOGI
SEKOLAH ILMU DAN TEKNOLOGI HAYATI INSTITUT TEKNOLOGI BANDUNG
BAB I PENDAHULUAN
1.1. Latar Belakang
Tumbuhan merupakan organisme multiseluler yang dapat menyerap air dan senyawa organik melalui akar kemudian melakukan fotosintesis menghasilkan senyawa-senyawa organik. Tumbuhan juga memiliki berbagai sistem dalam tubuhnya untuk menjalankan fungsi hidup. Sistem yang terjadi dalam tubuh tumbuhan dilaksanakan oleh berbagai komponen yang terdapat dalam sel. Sel memiliki konsentrasi optimum untuk memfasilitasi fungsi hidupnya. Jika konsentrasi lingkungan sekitar sel lebih rendah, maka sel akan menjadi turgid, sedangkan jika konsentrasi lingkungan sel lebih tinggi maka sel akan mengalami plasmolisis. Pada sel tumbuhan terdapat suatu parameter yang dapat menyatakan bahwa sel tumbuhan tersebut benar-benar hidup, yaitu aliran sitoplasma tumbuhan (Taiz and Zeigher, 2002).
Suatu sel hidup harus memiliki protoplas, yaitu bagian sel yang berada di dalam dinding sel. Protoplas dibedakan atas komponen protoplasma dan non-protoplasma. Komponen protoplasma terdiri atas membran sel, inti sel, dan sitoplasma (terdiri dari organel-organel hidup). Komponen non-protoplasma disebut sebagai zat ergastik. Zat ergastik pada tumbuhan dapat berupa karbohidrat (amilum), protein, lipid, dan kristal (Taiz and Zeigher, 2002).
1.2. Tujuan
Tujuan dari praktikum ini adalah sebagai berikut.
1. Menentukan jenis-jenis aliran plasma yang teramati dari daun Hydrilla verticillata dan rambut filamen bunga Rhoeo discolor.
2. Menetukan jenis-jenis zat ergastik yang teramati pada sayatan daun Ficus elastica, batang suji (Pleomele angustifolia), kerokan umbi kentang, dan tangkai daun Carica papaya.
3. Menentukan jenis-jenis sel sklerenkim pada kerokan tempurung kelapa dan sayatan tumbuhan Sansevieria.
4. Menentukan sifat reversibilitas sel terhadap peristiwa plasmolisis.
1.3. Hipotesis
Hipotesis yang diajukan dalam praktikum ini diantaranya:
1. Hydrilla verticillata memiliki aliran sitoplasma sirkulasi sedangkan Rhoeo discolor memiliki aliran sitoplasma rotasi.
2. Zat ergastik pada daun Ficus elastica berupa ca-okasalat, pada batang suji berupa kristal rafida, pada tangkai daun Carica papaya berupa kristal druses, dan pada kerokan umbi kentang berupa pati tunggal.
3. Jenis sel sklerenkim yang terdapat pada kerokan temperung kelapa adalah sel batu atau sklereid dan pada Sansevieria berupa sel serat.
BAB II
TINJAUAN PUSTAKA
2.1. Jenis-Jenis Mikroskop dan Fungsinya
Mikroskop adalah alat atau instrumen yang digunakan untuk melihat benda yang ukurannya kecil atau struktur dari suatu material tertentu yang tidak dapat dilihat secara langsung oleh mata manusia. Prinsip kerja mikroskop adalah dengan memfokuskan bayangan yang diperbesar dari suatu spesimen dengan bantuan suatu lensa atau medan magnet tertentu. Ada dua jenis mikroskop berdasarkan pada penampakan objek yang diamati yaitu mikroskop dua dimensi (mikroskop cahaya) dan mikroskop tiga dimensi (mikroskop stereo). Sedangkan berdasarkan sumber cahayanya mikroskop dibedakan menjadi mikroskop cahaya dan mikroskop elektron (Respati, 2008). Mikroskop cahaya atau compound light microscope adalah sebuah mikroskop yang menggunakan cahaya lampu sebagai pengganti cahaya matahari sebagaimana yang digunakan pada mikroskop konvensional. Mikroskop cahaya memiliki tiga sistem lensa, yaitu lensa objektif, lensa okuler, dan kondensor. Fungsi dari mikroskop cahaya adalah untuk mengamati suatu objek tanpa diwarnai, cahaya dari sumber akan menembus spesimen secara langsung. Sedikit kontras dan struktur sel tidak dapat terlihat secara detail (Bima, 2005).
Mikroskop stereo atau biasa disebut stereoskopik digunakan untuk mengamati objek dengan penampang tiga dimensi. Kerja mikroskop stereo melibatkan dua set sistem optik. Berbeda dengan mikroskop cahaya, mikroskop stereo tidak memiliki kondensor dan diafragma. Terdapat dua sumber cahaya, yaitu lampu atas dan lampu bawah. Perbesaran yang dapat dilakukan oleh mikroskop stereo ini antara 4-10 kali (Bima, 2005).
foto. Mikroskop elektron mempunyai pembesaran sampai 100 ribu kali. Mikroskop elektron mempunyai tiga tipe, yaitu mikroskop elektron scanning (SEM), mikroskop elektron transmisi (TEM), dan mikroskop krioelektron (Bima, 2005).
2.2. Teknik Pembuatan Sayatan Preparat Segar
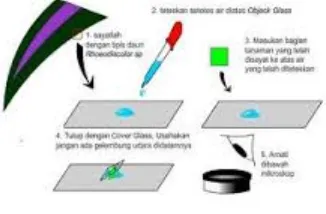
Bentuk sel epidermis dan organel-organel sel pada sampel dapat diamati dengan membuat preparat anatomi sayatan segar pada objek yang akan digunakan. Pertama, objek yang akan diteliti disayat dengan sayatan yang sangan tipis, kemudian sayatan tersebut diletakkan di atas kaca objek yang telah diberi air ataupun reagen lain setelah itu ditutup perlahan dengan cover glass dengan bantuan jarum jara (Alatlabor, 2016).
Pada prinsipnya ada tiga macam sayatan berdasarkan bidang pemotongan, yaitu sayatan melintang (tegak lurus sumbu horizontal objek), sayatan membujur (sejajar sumbu horizontal objek), dan sayatan tengah (sejajar atau tegak lurus pada bagian tengah objek) (Abdul, 2005).
Gambar 2. 1 Pembuatan preparat segar (Alatlabor, 2016)
2.3. Osmosis dan Aliran Sitoplasma
dalam tahapan pertumbuhan dan perkembangan, sehingga masih membutuhkan bahan-bahan organik untuk sintesis komponen-komponen sel. Sedang aliran sitoplasma yang mengelilingi vakuola disebut aliran rotasi, terjadi pada sel tua, karena sel tua tidak terlalu banyak membutuhkan senyawa organik lagi, maka bahan organik tersebut dibawa ke vakuola untuk disimpan sebagai cadangan makanan, jika suatu saat tumbuhan membutuhkannya, misalnya dalam kondisi kekeringan atau kemarau (Taiz and Zeigher, 2002).
2.4. Sklerenkim dan Zat Ergastik (Pati dan Kristal)
Jaringan sklerenkim merupakan jaringan sel yang mengalami penebalan di seluruh bagian dinding selnya. Dinding selnya lebih kuat dibandingkan jaringan kolenkim. Hal tersebut karena sel sklerenkim memiliki lignin. Sklerenkim merupakan jaringan penguat atau pelindung mekanik. Jaringan ini terdiri dari sel hidup atau sudah mati, bersifat elastis atau kenyal, dinding sel merupakan dinding sekunder yang tersusun dari lignin yang tebal, sehingga dapat membentuk noktah sederhana yang bercabang. Jaringan ini berasal dari meristem primer atau dari parenkim. Sklerenkim terdiri dari serabut dan sklereid. Sklereid berasal dari parenkim, bentuk sel pendek dengan ujung tumpul atau runcing dapat sebagai idioblas atau berkelompok. Berdasarkan bentuk dapat dibagi menjadi brakisklereid atau sel batu, bentuk isodiametris; makrosklereid, berbentuk seperti batang; osteosklereid, seperti tulang; asterosklereid, seperti bintang, dan trikosklereid (Ferdinand & Ariebowo, 2007).
Zat ergastik adalah zat-zat nonprotoplasmik (tak hidup) yang ada di dalam sel-sel makhluk hidup khususnya pada sel tumbuhan. Zat ergastik terdiri dari substansi yang bersifat cair maupun padat yang merupakan hasil dari metabolisme sel. Adapun zat ergastik yang bersifat padat adalah amilum, aleuron, kristal Ca-oksalat, kristal kersik, dan sistolit. Sedangkan yang bersifat cair adalah karbohidrat, protein, dan lemak (Beck, 2010).
bentuk dan susunan tertentu, namun pada umumnya berbentuk bundar atau lonjong. Adanya perbedaan bentuk dan susunan butir amilum ini karena adanya hilus (titik permulaan terbentuknya butir tepung) di setiap butir tepung. Berdasarkan letak hilus, butir amilum dapat dibedakan menjadi dua, yaitu: amilum yang konsentris (hilus terletak di tengah) dan eksentris (hilus terletak di tepi). Sedang berdasarkan jumlah hilus dapat dibedakan menjadi tiga, yaitu: monoadelph (hilus hanya satu), diadelph atau setengah majemuk (hilus berjumlah dua yang masing-masing dikelilingi oleh lamela) dan poliadelph/majemuk (hilus berjumlah banyak dan tiap hilus dikelilingi oleh lamela) (Purnobasuki, 2011).
Kristal merupakan hasil tambahan yang terjadi pada berbagai proses metabolisme. Yang paling sering ditemukan adalah kristal garam kalsium, terutama Ca-oksalat (kalsium oksalat). Kristal Ca-oksalat merupakan hasil akhir atau hasil sekresi dari suatu pertukaran zat yang terjadi di dalam sitoplasma. Kristal ini terdapat di dalam plasma atau vakuola sel dan larut dalam asam kuat (HCl dan H2SO4). Bentuk dari kristal Ca-oksalat
BAB III METODOLOGI
3.1. Alat dan Bahan
Alat dan bahan yang digunakan dalam praktikum ini dapat dilihat pada tabel 3.1 berikut.
Tabel 3. 1 Alat dan Bahan Praktikum
Alat Bahan
Mikroskop Air
Kaca objek Alkohol 95%
Pinset Kertas saring atau tissue
Brix refraktometer Bunga Rhoeo discolor
Tabung reaksi Daun Hydrilla verticillata
Umbi kentang
Kaca tutup diletakkan sampai menyentuh spesimen dengan baik dan air atau reagennya tersebar merata. Kelebihan air dapat dihilangkan dengan menggunakan tissue pad salah satu ujung kaca objek.
Pengamatan aliran sitoplasma, zat ergastik pati, dan kristal
Diambil satu helai rambut filamen bungan Rhoeo discolor, diletakkan diatas kaca objek yang telah ditetesi air, kemudian tutup perlahan dengan kaca tutup sampai airnya tersebar merata. Diamati aliran sitoplasma dan sel yang terlihat.
Dibuat penampang permukaan daun Hydrilla verticillata dengan menggunakan daun yang masih segar kemudian diletakkan di atas kaca objek yang telah ditetesi air, ditutup dengan kaca tutup secara perlahan dan diamati aliran sitoplasmanya di bawah mikroskop.
Dibuat kerokan umbi kentang, kemudian diletakkan di atas kaca objek yang telah diberi reagen I2KI. Ditutup secara perlahan dengan kaca tutup, lalu
diamati struktur pati yang terlihat melalui mikroskop dan ditentukan jenis patinya.
Dibuat penampang melintang daun Ficus elastica, batang suji, dan tangkai daun Carica papaya, kemudian masing-masing diletakkan di atas kaca objek yang telah diberi air. Ditutup secara perlahan dengan kaca tutup. Diamati struktur dan bentuk kristal yang terlihat di bawah mikroskop.
Dibuat kerokan tempurung kelapa, kemudian diletakkan di atas kaca objek yang telah ditetesi anilin sulfat 2% dalam etanol 96%, lalu ditutup dengan kaca tutup. Diamati sel sklerenkimnya dan digambarkan strukturnya.
Dibuat sayatan epidermal peel dari tanaman Sansevieria, diletakkan pada kaca objek yang telah ditetesi air, kemudian diamati sel-sel seratnya.
Pembuatan larutan sukrosa
10%, dan 5%. Lalu larutan-larutan tersebut diuji menggunakan Brix refraktometer.
Plasmolisis dan reversibilitas
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Pengamatan
4.1.1. Hasil Pengamatan dan Analisis Tahapan Meiosis
Tabel 4. 1 Hasil Pengamatan
Keterangan Foto Hasil
Pengamatan
Foto Literatur
Daun Hydrilla verticillata.
Perbesaran
40x10 Gambar 4.1 Daun
Hydrilla
(Dokumen pribadi, 2016)
(Beck, 2010)
Rambut
filamen bunga
Rhoeo discolor
Perbesaran 40x10
Gambar 4.2 Filamen bunga Rhoeo discolor (Dokumen pribadi, 2016)
(Beck, 2010)
Kerokan umbi kentang
Perbesaran
40x10 Gambar 4.3 kerokan
umbi kentang (Dokumen pribadi, 2016)
Sayatan batang suji
Perbesaran
40x10 Gambar 4.4 sayatan
batang suji
40x10 Gambar 4.5 Daun Ficus elastica
Gambar 4.6 Daun Ficus elastica + cuka (Dokumen pribadi, 2016)
(Purnobasuki, 2011)
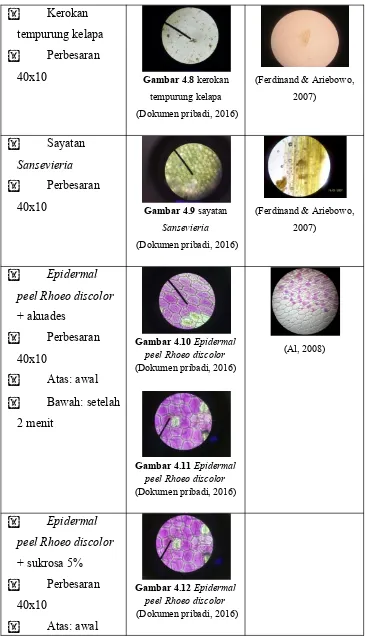
Sayatan
Kerokan tempurung kelapa Perbesaran
40x10 Gambar 4.8 kerokan
tempurung kelapa
40x10 Gambar 4.9 sayatan
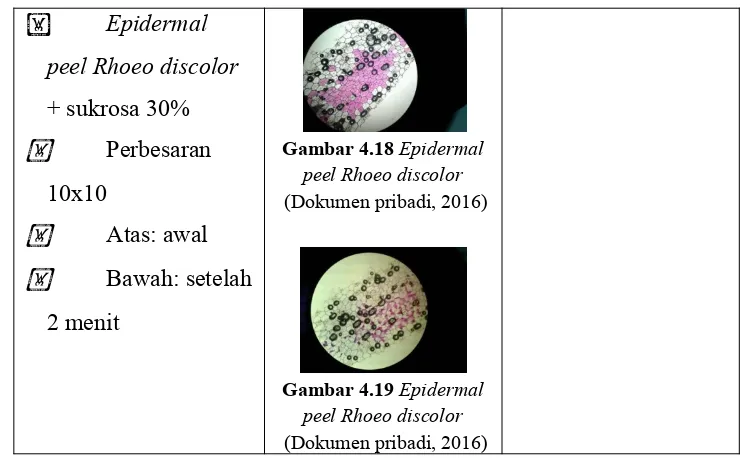
Epidermal
peel Rhoeo discolor
+ sukrosa 30% Perbesaran
10x10
Atas: awal Bawah: setelah
2 menit
Gambar 4.18 Epidermal peel Rhoeo discolor (Dokumen pribadi, 2016)
Gambar 4.19 Epidermal peel Rhoeo discolor (Dokumen pribadi, 2016)
4.1.2. Hasil Perhitungan Pengenceran
Pada pembuatan larutan dengan konsentrasi 20%, 10%, dan 5% dilakukan dengan mengencerkan larutan stok berkonsentrasi 30% sebanyak 2 ml untuk masing-masing pengencerannya.
Pengenceran larutan 20%
Diketahui: M1 = 30% M2= 20%
V1 = 2 ml
Ditanya: V akuades yang harus ditambahkan = ?
Jawab: M1V1=M2V2↔30×2=20× V2↔ V2=3020×2=3ml
Vakuades=3−2=1ml
Pengenceran larutan 10%
Diketahui: M1 = 30% M2= 10%
V1 = 2 ml
Ditanya: V akuades yang harus ditambahkan = ?
Jawab: M1V1=M2V2↔30×2=10× V2↔ V2=3010×2=6ml
Pengenceran larutan 5%
Diketahui: M1 = 30% M2= 5%
V1 = 2 ml
Ditanya: V akuades yang harus ditambahkan = ?
Jawab: M1V1=M2V2↔30×2=5× V2↔ V2=305×2=12ml
Vakuades=12−2=10ml
4.2. Pembahasan
Pada praktikum ini, dilakukan beberapa percobaan seperti pembuatan preparat segar, pengamatan aliran sitoplasma, zat ergastik pati dan kristal, pembuatan larutan sukrosa dan pengenceran, serta pengamatan terhadap plasmolisis dan sifat reversibilitas sel tumbuhan.
Aliran sitoplasma dibedakan menjadi dua yaitu sirkulasi dan rotasi. Aliran sitoplasma pada tumbuhan akan menggerakkan plastida melewati beberapa vakuola ke segala arah yang disebut dengan sirkulasi, aliran ini biasanya terdapat pada sel tumbuhan yang masih muda, karena pada tumbuhan muda sel-sel masih dalam tahapan pertumbuhan dan perkembangan, sehingga masih membutuhkan bahan-bahan organik untuk sintesis komponen-komponen sel. Sedangkan aliran sitoplasma yang mengelilingi vakuola disebut aliran rotasi, terjadi pada sel tua karena sel tua tidak membutuhkan senyawa organik, maka bahan organik tersebut dibawa ke vakuola untuk disimpan sebagai cadangan makanan pada saat dibutuhkan seperti saat kemarau (Beck, 2010).
Sedangkan pada rambut filamen bunga Rhoeo discolor aliran sitoplasma teramati dengan sangat jelas dan merupakan jenis aliran rotasi dimana sitoplasma mengalir ke satu arah (Beck, 2010).
Zat ergastik adalah zat-zat nonprotoplasmik (tak hidup) yang ada di sel-sel makhluk hidup khususnya pada sel tumbuhan. Zat ergastik terdiri dari substansi yang bersifat cair maupun padat yang merupakan hasil dari metabolisme sel. Adapun benda ergastik yang bersifat padat adalah amilum, aleuron, kristal Ca-oksalat, kristal kersik, kristal Ca-karbonat, dan sistolit. Sedangkan yang bersifat cair adalah karbohidrat, protein, dan lemak (Beck, 2010). Pada praparat kerokan umbi kentang terlihat bahwa molekul patinya adalah jenis pati tunggal, dimana molekul pati ini terlihat saling berpisah dan tergolong pati sederhana. Pembuatan preparat kerokan umbi kentang ini menggunakan reagen I2KI dimana reagen ini berfungsi sebagai pewarna atau
pemberi tanda bagi molekul pati yang ketika bereaksi dapat merubah warna molekul pati menjadi biru kehitaman (Johnson, 1985) .
Pada preparat sayatan batang suji, kristal tidak teramati tetapi seharusnya terlihat adanya kristal jenis rafida. Hal ini disebabkan karena sayatan masih terlalu tebal dan preparat yang dibuat masih kurang baik. Preparat sayatan daun Ficus diberi dua larutan yang berbeda. Pertama sayatan daun Ficus ini ditetesi oleh akuades dan terlihat adanya kristal berbentuk druses, namun kristal ini belum diketahui molekul penyusunnya. Kemudian sayatan daun
Ficus diberi larutan cuka untuk menentukan molekul penyusun tersebut. Ternyata kristal tersebut meluruh sehingga dapat ditentukan bahwa kristal tersebut merupakan kristal Ca-karbonat. Larutan cuka ini berfungsi sebagai reagen yang dapat meluruhkan molekul karbonat dan menentukan apakah suatu kristal termasuk kristal Ca-oksalat atau Ca-karbonat. Sedangkan pada preparat sayatan tangkai daun Carica papaya terlihat adanya kristal druses yang cukup jelas, yaitu berupa molekul berbentuk bulat dan cukup besar (Johnson, 1985).
kerokan tempurung kelapa digunakan anilin sulfat 2% dalam etanol 96% yang berfungsi untuk penebalan sudut-sudut dinding sel sehingga sel tidak rusak dan bentuk aslinya dapat dipertahankan. Dari pengamatan, diketahui bahwa jenis sel sklerenkim pada tempurung kelapa adalah sel sklereid. Sel sklereid merupakan jenis sel mati yang bentuknya membulat dan mengalami penebalan dinding sel. Sedangkan pada tumbuhan Sansevieria terdapat sel serat yang berbentuk seperti pembuluh dan bagian ujungnya runcing (Beck, 2010).
Plasmolisis adalah peritiwa keluarnya air dari sel akibat sel dimasukkan ke dalam larutan hipertonik dan menyebabkan sitoplasmanya menyusut dan terlepas dari dinding sel pada tumbuhan (Campbell et al., 2002). Pada pengamatan plasmolisis, digunakan larutan sukrosa dengan konsentrasi 5%, 10%, 20%, dan 30% terhadap preparat epidermal peel Rhoeo discolor. Pada konsentrasi sukrosa 5% dan 10% di waktu 2 menit pertama sel-sel belum menunjukkan perbedaan dari kondisi awalnya. Sedangkan pada konsentrasi sukrosa 20% dan 30% di waktu 2 menit pertama, sel-sel tampak mengalami perubahan dari kondisi awalnya, dimana warna ungu sel pada bagian pinggir mulai memudar dan warna ungu tersebut hanya terpusat dibagian tengah sel. Perbedaan antara plasmolisis pada konsentrasi sukrosa 20% dan 30% adalah pada konsentrasi 30% plasmolisis lebih cepat terjadi ditandai dengan warna mayoritas sel yang berubah menjadi putih dan hanya menunjukkan warna ungu yang sangat tipis.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan praktikum yang telah dilakukan, dapat disimpulkan bahwa: 1. Jenis aliran sitoplasma yang terdapat pada daun Hydrilla verticillata
adalah aliran sirkulasi, sedangkan pada rambut filamen bungan Rhoeo discolor adalah aliran rotasi (sesuai hipotesis).
2. Zat ergastik yang terdapat pada daun Ficus elastica adalah kristal Ca-karbonat, pada batang suji adalah kristal rafida, pada tangkai daun Carica papaya adalah kristal druses, dan pada kerokan umbi kentang terdapat pati tunggal (jenis kristal pada daun Ficus elastica kurang sesuai hipotesis). 3. Jenis sel sklerenkim yang terdapat pada kerokan tempurung kelapa adalah
sel sklereid atau sel batu dan pada Sansevieria berupa sel serat (sesuai hipotesis).
4. Sifat reversibilitas sel epidermal peel tumbuhan Rhoeo discolor dalam sukrosa tidak teramati sedangkan plasmolisis lebih cepat terjadi pada larutan sukrosa dengan konsentrasi 20% dan 30%.
5.2. Saran
Saran yang diajukan untuk praktikum ini adalah:
1. Sayatlah sampel dengan setipis mungkin agar sel-sel yang akan diamati menjadi lebih terlihat dan waktu praktikum menjadi lebih efisien.
2. Jika objek sayatan terlalu tipis gunakan penahan seperti wortel, kentang atau lainnya.
3. Dahulukan membuat preparat dari objek yang mudah kering (contoh: daun
DAFTAR PUSTAKA
Abdul, Aryati. 2005. Bahan Ajar Biologi Umum. Gorontalo: Universitas Negeri Gorontalo.
Al, Suyitno. 2008. Osmosis & Penyerapan Zat pada Tumbuhan. Yogyakarta: UNY.
Alat Labor. 2016. “Cara Membuat dan Mengamati Preparat Mikroskop”. [Online]
http://www.alatlabor.com/article/detail/39/cara-membuat-dan-mengamati-preparat-mikroskop diakses pada 01 Februari 2016.
Beck, C. B. 2010. An Introduction to Plant Structure and Development, Plant Anatomy for The Twenty-First Century Second Edition. Cambridge: Cambridge University Press.
Bima. 2005. “Mikroskop dan Penggunaannya”. [Online] http://bima.ipb.ac.id
diakses pada 29 Januari 2016.
Campbell, N. A., Reece, J. B., Mitchell, L. G. 2002. Biologi Edisi Kelima Jilid 3. Jakarta: Erlangga.
Ferdinand, P. F. Dan M. Ariebowo. 2007. Praktis Belajar Biologi. Jakarta: Visindo Media Persada.
Johnson. 1985. Anatomi Tumbuhan. Yogyakarta: UGM. Purnobasuki, Hery. 2011. Inklusi Sel. Unair: Unair Press.
Respati. 2008. “Macam-Macam Mikroskop dan Cara Penggunaannya”.
Momentum 4(2) : 42-44.