Karakterisasi Hidrolisat Pati Sagu
Sebelum digunakan sebagai media kultivasi, hidrolisat pati sagu terlebih dahulu dikarakterisasi (Tabel 2). Parameter konsentrasi total gula dan total nitrogen digunakan sebagai dasar perhitungan konsentrasi karbon dan nitrogen dalam formulasi media kultivasi. Profil gula (sakarida) menggambarkan berbagai jenis gula yang terkandung dalam hidrolisat pati sagu. Hal ini terkait dengan efektifitas proses hidrolisis yang dilakukan dan juga terkait dengan evaluasi kemungkinan konsumsi gula oleh bakteri. Sementara itu, informasi mengenai kandungan logam pada hidrolisat pati sagu digunakan untuk mendeteksi jika ada logam-logam yang mungkin dapat menghambat atau justru menunjang pertumbuhan bakteri.
Tabel 2 Karakteristik hidrolisat pati sagu
Komponen J umlah Satuan
Konsentrasi total gula g/L
Komposisi gula : Glukosa Maltosa Maltotriosa Matotetrosa Maltopentosa Maltoheksosa Maltoheptosa Lainnya 43,29 9,04 14,71 9,71 7,46 4,82 9,46 1,51 % % % % % % % % Nitrogen 141,75 mg/L Kandungan logam : P b Zn Cu Fe Ca Mn Mg Na K 0,057 0,276 0,024 0,411 78,725 4,416 7,325 2,111 99,75 ppm ppm ppm ppm ppm ppm ppm ppm ppm
Konsentrasi total gula hidrolisat sagu sebagaimana tertera pada Tabel 2 adalah 465 g/L, menunjukkan bahwa terdapat 465 g glukosa/L hidrolisat pati sagu, baik dalam bentuk glukosa bebas (monosakarida) maupun unit-unit glukosa yang terikat sebagai molekul disakarida maupun oligosakarida. Kurva standar untuk penentuan konsentrasi glukosa disajikan pada Lampiran 3. Pada pembahasan selanjutnya, istilah ‘konsentrasi total gula’ (hasil analisis menggunakan metode Fenol-Sulfat) menggambarkan konsentrasi total glukosa yang terdapat pada analat.
Berdasarkan hasil analisis HPLC (Lampiran 4 dan 5) didapatkan bahwa selain mengandung glukosa sebagai komponen gula utama (43,29%), hidrolisat pati sagu juga mengandung maltosa (disakarida ), maltotriosa, maltotetrosa, maltopentosa, maltoheksosa dan maltoheptosa (oligosakarida ) lebih dari 50% . Hal ini menunjukkan bahwa proses hidrolisis secara enzimatis yang terjadi belum sempurna. Meskipun demikian, dengan terurainya komponen polis akarida pati sagu yang kompleks menjadi turunan gula yang lebih sederhana akan memudahkan bakteri memanfaatkannya sebagai sumber karbon bagi pertumbuhan dan pembentukan produk yang diharapkan. Babel et al. (2001) me nyatakan bahwa PHB dapat disintesis dari komponen-komponen C1 tereduksi seperti metana dan metanol, dari Knallgas (gas peledak) dan dari substrat multikarbon seperti karbohidrat dan hidrokarbon baik dari substrat murni maupun limbah bahkan dari komponen beracun seperti fenol.
R. eutropha tipe liar dilaporkan dapat tumbuh pada fruktosa sedangkan tipe mutan dapat tumbuh pada glukosa (John et al. 1994). Karbohidrat lain yang telah diteliti dapat digunakan sebagai sumber karbon bagi pertumbuhan dan produksi PHA oleh R. eutropha adalah xilosa (Linko et al. 1993), L-laktat hasil konversi xilosa (Tanaka et al. 1993), hidrolisat laktosa , gula invert (Marangoni et al. 2001), selulosa limbah jagung (Chakraborty et al. 2004) dan hidrolisat tapioka yang mengandung 90% glukosa (Kim dan Chang 1995 dikutip oleh Madison dan Huisman 1999) . Pada penelitian ini akan dikaji kemampuan R. eutropha untuk tumbuh dan memproduksi PHA dengan sumber karbon hidrolisat pati sagu yang mengandung glukosa sekitar 43% .
Kandungan nitrogen dan mineral logam pada hidrolisat sagu seperti Mg, Fe, Na, K, Zn, Cu, Ca, Mn merupakan elemen-elemen yang dibutuhkan untuk
pertumbuhan mikroba. Nitrogen pada hidrolisat pati sagu berasal dari kandungan protein alami pada pati sagu dan komponen protein pada enzim yang digunakan pada proses hidrolisis pati sagu, yaitu a-amilase dan amiloglukosidase. Hughes et al. (1984) menyatakan bahwa berbagai nutrisi dalam bentuk garam la rut air yang secara umum dibutuhkan untuk pertumbuhan mikroba adalah nitrogen (N), fosfor (P), sulfur (S), potasium (K), sodium (Na), magnesium (Mg), kalsium (Ca) dan besi (Fe). Selain itu juga dibutuhkan mineral kelumit seperti mangan (Mn), seng (Zn) dan tembaga (Cu). Konsent rasi mineral yang paling dominan pada hidrolisat pati sagu adalah K (kalium) sebanyak 99,75 ppm dan Ca (kalsium) sebanyak 78,725 ppm. Kalsium terutama berasal dari penambahan CaCO3 yang berfungsi sebagai penstabil a-amilase pada proses likuifikasi pati sagu.
Pada media kultivasi, berfungsi sebagai sumber karbon adalah hidrolisat pati sagu sedangkan sebagai sumber nitrogen adalah (NH4)2HPO4 yang merupakan nitrogen inorganik dan kandungan nitrogen organik yang terdapat dalam hidrolisat sagu. Rasio C/N media pada awal kultivasi diatur dengan perbandingan 10:1 dengan asumsi penghitungan bahwa konsentrasi karbon dalam gula (glukosa) adalah 40% (sebanding dengan perbandingan bobot atom C dalam molekul gula) sedangkan konsentrasi N dalam (NH4)2HPO4 adalah 21,21% (sebanding dengan perbandingan bobot atom N dalam molekul diamonium hidrogen fosfat). Jumlah (NH4)2HPO4 yang ditambahkan disesuaikan dengan jumlah N yang terdapat pada hidrolisat sagu sedemikian, sehingga konsentrasi total N dalam media mencapai sepersepuluh konsentrasi karbon. Contoh perhitungan dapat dilihat pada Lampiran 2.
Penetapan rasio C/N awal media 10:1 dipilih berdasarkan hasil penelitian Syamsu et al. (2003), Chakraborty et al. (2004) dan Wicaksono (2005). Syamsu et al. (2003) mendapakan bahwa R. eutropha IAM 12368 yang ditumbuhkan pada susbtrat hidrolisat minyak sawit dengan rasio C/N 10:1 menunjukkan kadar PHA dalam sel tertinggi. Chakraborty et al. (2004) melaporkan bahwa R. eutropha ATCC 17699 yang ditumbuhkan pada substrat CCS (condensed corn soluble) dengan rasio C/N 10:1 menunjukkan laju pertumbuhan spesifik dan pertumbuhan sel yang optimum dibandingkan dengan rasio C/N 5:1 maupun 15:1. Wicaksono (2005) mendapatkan bahwa
pertumbuhan R. eutropha IAM 12368 pada hidrolisat minyak sawit (skala labu kocok 250 mL) pada rasio C/N sekitar 10:1 (konsentrasi karbon 41,9 g/L dan konsentrasi nitrogen 4,3 g/L) menunjukkan konsentrasi biomassa tertinggi yaitu 19,43 g/L. Sementara itu, konsentrasi PHA maksimum sebesar 10,96 g/L diperoleh pada konsentrasi karbon 40 g/L dan konsentrasi nitrogen 4,5 g/L (rasio C/N sekitar 9:1). Berdasarkan uraian di atas, didapatkan gambaran bahwa media kultivasi dengan rasio C/N awal sekitar 10:1 kondusif bagi pertumbuhan sel R. eutropha sekaligus juga bagi pembentukan PHA di dalam sel R. eutropha.
Kinetika Kultivasi Batch R. eutropha
Kultivasi R. eutropha pada Labu Kocok 250 mL
Produksi PHA oleh R. eutropha dilakukan dalam dua tahap, yaitu tahap pertumbuhan sel yang bertujuan untuk pembentukan biomassa dan tahap akumulasi polimer, tergantung dari sumber karbon yang diumpankan dengan pembatasan-pembatasan nutrisi (nitrogen, fosfat, oksigen, dll). Dikarenakan PHA merupakan granula intraselular maka laju pertumbuhan spesifik pada tahap pertama haruslah setinggi mungkin agar tercapai produktifitas sel yang optimal (Marangoni et al. 2001). Berdasarkan hal tersebut maka pada tahap ini dilakukan evaluasi konsentrasi gula yang memberikan laju pertumbuhan spesifik maksimal R. eutropha yang tertinggi pada kultivasi batch.
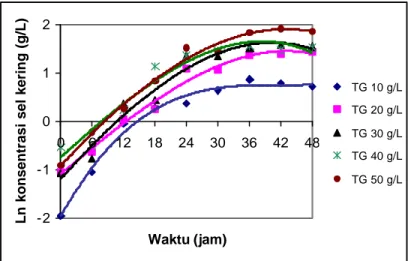
Pola pertumbuhan sel R. eutropha yang ditumbuhkan secara batch pada skala labu kocok 250 mL dengan konsentrasi awal total gula hidrolisat pati sagu 10, 20, 30, 40, 50 g/L dan rasio C/N awal 10:1 disajikan pada Gambar 9 (data selengkapnya disajikan pada Lampiran 6a). R. eutropha secara umum mengalami fase eksponensial pada jam ke-6 hingga jam ke-24, tumbuh melambat pada jam ke-24 hingga jam ke-36 dan cenderung stasioner mulai jam ke-36. Terkecuali pada konsentrasi gula 10 g/L, sel tumbuh secara eksponensial setelah jam ke-0 hingga jam ke-12, melambat hingga jam ke-30 dan cenderung stasioner mulai jam ke-30.
-2 -1 0 1 2 0 6 12 18 24 30 36 42 48 Waktu (jam)
Ln konsentrasi sel kering (g/L)
TG 10 g/L
TG 20 g/L
TG 30 g/L
TG 40 g/L
TG 50 g/L
Gambar 9 Pola pertumbuhan R. eutropha secara batch pada berbagai konsentrasi total gula (TG) hidrolisat pati sagu (labu kocok 250 mL).
Pada rentang konsentrasi gula awal 10 sampai 50 g/L, secara umum semakin tinggi konsentrasi gula maka semakin tinggi pula konsentrasi sel R. eutropha yang tumbuh selama kultivasi meskipun tida k demikian dengan tingkat laju pertumbuhannya. Pada rasio C/N awal yang sama, semakin tinggi konsentrasi karbon dan nitrogen dalam media berarti semakin banyak bahan yang dapat dikonversi menjadi materi penyusun dan penggandaan sel. Evaluasi konsentrasi gula yang akan digunakan pada tahap selanjutnya dilakukan berdasarkan nilai laju pertumbuhan spesifik maksimal (µmaks) yang tertinggi. Nilai µmaks merupakan gradien kemiringan garis (slope) yang didapatkan dari hasil regresi lin ier nilai Ln (logaritmik natural) konsentrasi sel kering selama fase pertumbuhan eksponensial yaitu jam ke-6 sampai dengan jam ke-24 (Gambar 10). Rekapitulasi nilai µmaksR. eutropha yang ditumbuhkan secara batch pada berbagai konsentrasi gula awal hidrolisat pati sagu (skala labu kocok 250 mL) disajikan pada Tabel 3.
y10 = 0,076x - 1,2578 y20 = 0,0892x - 1,1562 y30 = 0,1083x - 1,2804 y40 = 0,1082x - 1,0679 y50 = 0,0966x - 0,8517 -2 -1 0 1 2 0 6 12 18 24 Waktu (jam)
Ln Konsentrasi sel kering (g/L)
TG 10 g/L
TG 20 g/L
TG 30 g/L
TG 40 g/L
TG 50 g/L
Gambar 10 Plot nilai µmaksR. eutropha yang ditumbuhkan secara batch pada berbagai konsentrasi total gula (TG) hidrolisat pati sagu.
Tabel 3 Nilai µmaksR. eutropha yang ditumbuhkan pada berbagai konsentrasi gula hidrolisat pati sagu
Konsentrasi gula awal (g/L) µmaks (jam-1) 10 0,0760 20 0,0892 30 0,1083 40 0,1082 50 0,0966
Pada rentang konsentrasi gula 10-30 g/L, terdapat kecenderungan semakin tinggi konsentrasi gula maka semakin tinggi pula nilai µmaks yang diperoleh; menunjukkan bahwa laju pertumbuhan spesifik maksimal semakin tinggi dengan meningkatnya konsentrasi karbon dan nitrogen dalam media. Akan tetapi, µmaks pada konsentrasi gula 30 g/L relatif sama dengan µmaks pada konsentrasi gula 40 g/L sedangkan pada konsentrasi gula 50 g/L, µmaks justru sedikit menurun. Fenomena ini menunjukkan bahwa pada konsentrasi gula yang lebih besar dari 40 g/L, sel mulai mengalami penurunan laju pertumbuhan. Hal ini mungkin disebabkan oleh adanya penghambatan substrat atau akumulasi produk samping selama kultivasi, seperti asam-asam organik, yang pada taraf tertentu dapat menghambat laju pertumbuhan bakteri. Scragg (1991) menyatakan bahwa substrat
tertentu seperti glukosa dan NaCl pada konsentrasi tinggi dapat menjadi toksik yang menyebabkan penghambatan pertumbuhan dan menurunkan nilai µ. Pada konsentrasi glukosa yang tinggi (40-300 g/L), tekanan osmotik dalam media menyebabkan sel mengalami dehidrasi. Hanya organisme osmotoleran yang dapat bertahan pada kondisi tersebut. Greasam (1993) juga menyatakan bahwa jika konsentrasi glukosa pada media ditingkatkan hingga 50 g/L atau lebih maka pertumbuhan bakteri mulai menurun karena terjadi dehidrasi sel (plasmolisis).
Nilai µmaks yang didapatkan pada penelitian ini berkisar 0,0760-0,1083/jam; nilai µmaks tertinggi diperoleh pada konsentrasi gula 30 g/L, yaitu 0,1083/jam. Nilai tersebut lebih rendah dibandingkan temuan dan Braunegg et al. (1995) dan Marangoni et al. (2001). Nilai µmaks R. eutropha mutan DSM 454 yang ditumbuhkan secara batch dengan sumber karbon gula invert, glukosa, fruktosa dan galaktosa berturut-berturut adalah 0,26, 0,23, 0,21 dan 0,13 jam-1 (Marangoni et al. 2001). Sementara itu, nilai µmaks R. eutropha G3+ yang ditumbuhkan dengan sumber karbon glukosa mencapai 0,32 jam-1 (Braunegg et al. 1995).
Lambatnya pertumbuha n sel pada hidrolisat pati sagu diduga disebabkan oleh terbatasnya kemampuan R. eutropha untuk memecah gula -gula kompleks yang terdapat pada hidrolisat pati sagu. Pada dasarnya, bakteri akan mengkonsumsi gula yang paling sederhana (glukosa) terlebih dahulu kemudian beradaptasi untuk memecah gula -gula yang lebih panjang (maltosa-maltoheptosa) jika memiliki enzim yang dapat memecah ikatan a -glikosidik antar monomer glukosa. Berdasarkan hasil evaluasi konsumsi gula oleh R. eutropha selama kultivasi batch (Gambar 11), terlihat bahwa konsentrasi gula sisa pada akhir kultivasi jam ke-48 mencapai > 20% dari konsentrasi gula awal. Hal ini menunjukkan bahwa lebih dari 20% gula kompleks yang terdapat pada hidrolisat pati sagu tidak dikonsumsi atau tidak dapat dipecah oleh R. eutropha.
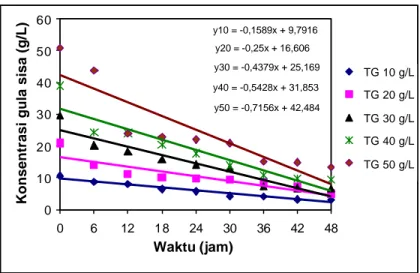
y10 = -0,1589x + 9,7916 y20 = -0,25x + 16,606 y30 = -0,4379x + 25,169 y40 = -0,5428x + 31,853 y50 = -0,7156x + 42,484 0 10 20 30 40 50 60 0 6 12 18 24 30 36 42 48 Waktu (jam)
Konsentrasi gula sisa (g/L)
TG 10 g/L
TG 20 g/L
TG 30 g/L
TG 40 g/L
TG 50 g/L
Gambar 11 P ola konsumsi gula R. eutropha yang ditumbuhkan secara batch pada berbagai konsentrasi total gula (TG) hidrolisat pati sagu.
Pada Gambar 11 terlihat bahwa konsentrasi gula menurun selama kultivasi berlangsung; menunjukkan bahwa R. eutropha mengkonsumsi sebagian besar gula yang terdapat pada hidrolisat pati sagu untuk proses metabolisme sel dan atau produk. Kemiringan garis dari persamaan regresi linier menggambarkan besarnya kecepatan konsumsi gula (g/L.jam) pada tingkat konsentrasi gula awal yang dicobakan (10, 20, 30, 40 dan 50 g/L). Tampak bahwa pada konsentrasi gula awal yang semakin tinggi, kecepatan konsumsi gula juga semakin tinggi. Hal ini terkait dengan semakin tingginya konsentrasi sel yang terbentuk dengan semakin tingginya konsentrasi awal gula hidrolisat pati sagu. Data konsentrasi gula sisa selama kultivasi selengkapnya disajikan pada Lampiran 6b.
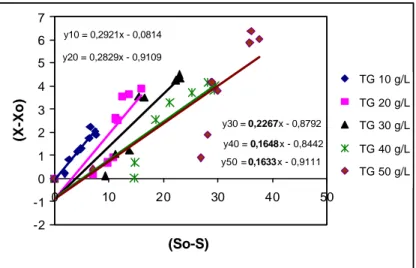
Oleh karena nilai µmaks yang diperoleh pada total gula 30 g/L relatif sama dengan µmaks pada total gula 40 g/L maka untuk menentukan konsentrasi gula awal terbaik digunakan parameter lain, yaitu nilai Yx/s. Nilai Yx/s merupakan kemiringan garis (slope) hasil plot linier konsentrasi sel yang terbentuk akibat konsumsi sejumlah gula pada selang waktu tertentu (Gambar 12). Rekapitulasi nilai Yx/s selengkapnya disajikan pada Tabel 4.
y10 = 0,2921x - 0,0814 y20 = 0,2829x - 0,9109 y30 = 0,2267x - 0,8792 y40 = 0,1648x - 0,8442 y50 = 0,1633x - 0,9111 -2 -1 0 1 2 3 4 5 6 7 0 10 20 30 40 50 (So-S) (X-Xo) TG 10 g/L TG 20 g/L TG 30 g/L TG 40 g/L TG 50 g/L Linear (TG
Gambar 12 Plot nilai Yx/s R. eutropha yang ditumbuhkan pada berbagai konsentrasi total gula (TG) hidrolisat pati sagu.
Tabel 4 Nilai Yx/sR. eutropha yang ditumbuhkan secara batch pada hidrolisat pati sagu
Konsentrasi gula awal (g/L) Yx/s (g sel/g gula) 10 0,292 20 0,283 30 0,227 40 0,165 50 0,163
Nilai Yx/s pada penelitian ini berkisar 0,163-0,292 g sel/g gula; hasil tersebut lebih rendah daripada temuan Braunegg et al. (1995) yang mendapatkan koefisien yield biomassa dari sumber karbon tunggal glukosa (Yx/s) 0,47 g sel/g glukosa selama fase pertumbuhan R. eutropha G3+ pada skala labu kocok dengan nutrisi pembatas NH4+. Rendahnya koefisien rendemen molekular ini mengindikasikan bahwa keberadaan gula -gula yang lebih kompleks dari glukosa pada hidrolisat pati sagu menyebabkan efisiensi konversinya menjadi sel relatif rendah. Berdasarkan studi literatur, sejauh ini belum pernah dilaporkan bahwa R. eutropha dapat tumbuh pada maltosa dan oligosakarida daripada glukosa seperti maltotriosa, maltotetrosa, maltopentosa, maltoheksosa maupun maltoheptosa. Berbagai referensi menunjukkan bahwa R. eutropha dapat tumbuh dan memproduksi PHA dengan sumber karbon gula -gula sederhana (monosakarida)
seperti fruktosa, glukosa, galaktosa dan xilosa; kalaupun substrat yang digunakan merupakan dimer, oligomer atau polimer maka terlebih dahulu harus dilakukan tahap hidrolisis untuk memecah ikatan polimerik.
Berdasarkan Tabel 4, secara umum nilai Yx/s cenderung menurun dengan meningkatnya konsentrasi gula. Semakin banyak nutrisi yang tersedia maka efisiensi konversinya menjadi sel cenderung berkurang. Nilai Yx/s pada perlakuan 30 g/L (0,227 g sel/g gula) lebih tinggi dibandingkan nilai Yx/s pada perlakuan 40 g/L (0,165 g sel/g gula); menunjukkan bahwa konversi substrat sel pada perlakuan 30 g/L lebih efisien daripada perlakuan 40 g/L. Oleh karena itu untuk tahap selanjutnya dipilih konsentrasi total gula awal 30 g/L.
Kultivasi R. eutropha pada Bioreaktor 2 L
Untuk mempelajari kinetika kultivasi secara lebih rinci, R. eutropha ditumbuhkan secara batch pada bioreaktor berkapasitas 2 L, volume kerja 1 L selama 96 jam. Pada penelitian ini, proses recovey (pemisahan) PHA dari sel dilakukan dengan metode NaOH digestion (Lee et al. 1999). Endapan sel hasil sentrifugasi kultur direaksikan dengan larutan NaOH 0,2 N yang berfungsi untuk memecah bahan-bahan sel non-PHA. Pada kondisi alkali, dinding sel akan rusak dan PHA terlepas dari sel (Schlingmann dan Präve 1978 dikutip oleh Lafferty et al. 1988). Sebagaimana penggunaan sodium hipoklorit, larutan alkali akan melarutkan materi-materi sel selain PHA.
Pola pertumbuhan sel dan pembentukan PHA oleh R. eutropha dievaluasi. Hasil percobaan (Gambar 13) menunjukkan bahwa sel R. eutropha mengalami fase pertumbuhan eksponensial setelah jam ke -0 hingga jam ke-36, tumbuh melambat pada jam ke-36 sampai jam ke-48 dan memasuki fase pertumbuhan stasioner mulai jam ke-48. Oleh karena PHA merupakan produk intraselular maka konsentrasi sel perlu dikoreksi sebagai konsentrasi residu sel yang menunjukkan konsentrasi sel kering dikurangi dengan konsentrasi PHA yang terbentuk. PHA mulai terbentuk sejak jam ke -12, konsentrasinya meningkat sampai jam ke-60 dan cenderung menurun hingga akhir kultivasi jam ke-96. Pada jam ke-48 hingga jam ke -60 ketika konsentrasi residu sel menurun, konsentrasi PHA justru sedikit meningkat. Hal ini menunjukkan bahwa pada konsentrasi total
sel (sel dan PHA) yang cenderung konstan masih terjadi sintesis/akumulasi PHA di dalam sel pada awal fase stasioner. Kecepatan pembentukan PHA selama kultivasi batch selengkapnya dapat dilihat pada Gambar 14.
0 1 2 3 4 5 0 12 24 36 48 60 72 84 96 Waktu (jam) Konsentrasi (g/L)
[sel kering] [PHA] [residu sel kering]
Gambar 13 Pola pertumbuhan sel dan pembentukan PHA oleh R. eutropha pada hidrolisat pati sagu (batch, bioreaktor 2 L).
0,008 0,024 0,036 0,027 -0,01 0 0,01 0,02 0,03 0,04 0 12 24 36 48 60 72 84 96 Waktu (jam) dP/dt (g/L/jam)
Gambar 14 Kecepatan pembentukan PHA oleh R. eutropha pada kultivasi batch.
Pada Gambar 14 dapat dilihat bahwa kecepatan pembentukan PHA meningkat signifikan hingga jam ke -36 dan perlahan menurun hingga tidak terjadi lagi pembentukan PHA pada jam ke -72. Hal ini menunjukkan bahwa pembentukan PHA te rjadi sejak fase eksponensial hingga awal fase stasioner.
Menjelang akhir kultivasi (setelah jam ke-72), ketika ketersediaan karbon dalam media sudah menipis, terjadi penurunan konsentrasi PHA. Diduga mulai terjadi depolimerisasi PHA menjadi karbondioksida dan air yang akan digunakan sebagai sumber karbon dan energi bagi sel akibat keterbatasan nutrisi karbon yang tersedia dalam media.
Fenomena di atas sejalan dengan temuan Braunegg et al. (1995) yang mendapatkan bahwa sintesis PHA oleh R. eutropha G+3 dengan substrat glukosa menunjukkan pola berasosiasi sebagian dengan pertumbuhan (partial association with growth), yaitu pembentukan PHA sebagian terjadi pada fase pertumbuhan eksponensial dan sebagian terjadi pada fase pertumbuhan stasioner. Namun demikian, hal ini bertentangan dengan pendapat Madison dan Huisman (1999) yang menyatakan bahwa R. eutropha tidak memulai pembentukan PHA sampai fase stasioner. Literatur tentang pola pembentukan PHA oleh R. eutropha terkadang menyatakan hal yang berbeda-beda karena galur R. eutropha yang digunakan juga berbeda.
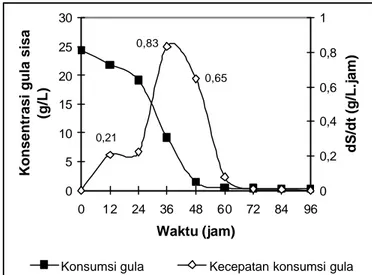
Pola penggunaan gula oleh R. eutropha selama 96 jam kultivasi batch dan kecepatan konsumsinya disajikan pada Gambar 15. R. eutropha akan mengkonsumsi gula yang lebih sederhana (glukosa, maltosa) terlebih dahulu dibandingkan gula yang lebih kompleks (oligosakarida). Semakin sederhana komponen gula maka semakin cepat laju konsumsinya.
0,65 0,83 0,21 0 5 10 15 20 25 30 0 12 24 36 48 60 72 84 96 Waktu (jam)
Konsentrasi gula sisa
(g/L) 0 0,2 0,4 0,6 0,8 1 dS/dt (g/L.jam)
Konsumsi gula Kecepatan konsumsi gula
Gambar 15 Pola dan kecepatan konsumsi gula dalam hidrolisat pati sagu oleh R. eutropha selama kultivasi batch.
Kecepatan konsumsi gula (dihitung sebagai glukosa) oleh R. eutropha berfluktuasi selama kultivasi. Hal ini terkait dengan laju pertumbuhan sel pada masing-masing fase pertumbuhannya dan komposisi gula yang beragam pada hidrolisat sagu. Pada fase pertumbuhan eksponensial, laju konsumsi gula meningkat tajam dari 0,21 hingga 0,83 g/L.jam. Ketika laju pertumbuhan sel melambat, laju konsumsi gula juga melambat menjadi 0,65 g/L.jam. Memasuki fase stasioner (mulai jam ke-48), laju konsumsi gula menurun tajam hingga 0,08 g/L.jam pada jam ke-60 dan mendekati angka nol pada jam ke-72 seiring dengan semakin rendahnya residu gula dalam media.
Pada fase stasioner (terutama jam ke-60 hingga jam ke-96), konsentrasi residu gula mendekati titik nol (< 1 g/L) seiring dengan laju pertumbuhan spesifik (µ) yang menunjukkan angka nol sedangkan ? S/So mencapai 99% (data disajikan pada Lampiran 7). Fenomena ini menunjukkan bahwa hidrolisat pati sagu yang mengandung gula-gula kompleks dapat digunakan oleh R. eutropha sebagai sumber karbon bagi pertumbuhan sel dan pembentukan produk hingga 99% selama 96 jam kultivasi batch pada skala bioreaktor 2 L, hanya sekitar 1% yang tidak dapat dikonsumsi. Kemungkinan besar komponen yang tidak dikonsumsi adalah komponen gula yang lebih kompleks daripada maltoheptosa dimana jumlah komponen tersebut pada hidrolisat sagu mencapai 1,51% (Tabel 2). Namun demikian, kemampuan R. eutropha dalam memecah oligosakarida dari glukosa ini belum dapat dijustifikasi karena memerlukan klarifikasi lebih lanjut, misalnya analisis HPLC untuk mengevaluasi komposisi gula kultur pada awal dan akhir kultivasi batch. Pada penelitian ini, analisis tersebut tidak lakukan.
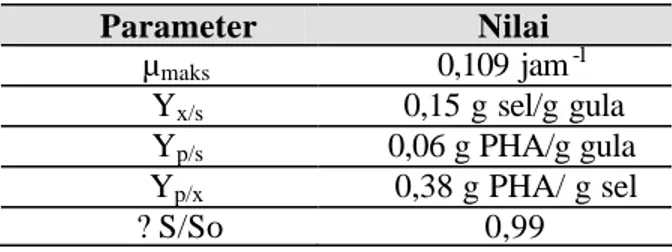
Parameter kinetika kultivasi R. eutropha secara batch pada bioreaktor 2 L terkait dengan laju pertumbuhan spesifik (µmaks), rendemen sel yang terbentuk per g substrat (Yx/s), rendemen produk PHA per g substrat (Yp/s), rendemen produk PHA per g sel (Yp/x) dan tingkat konsumsi gula selama 96 jam kultivasi (? S/So) disajikan pada Tabel 5. Nilai µmaks yang didapat 0,109 jam-1, lebih rendah daripada hasil percobaan Braunegg et al. (1995) yang mendapatkan nilai µmaks sebesar 0,19 jam-1 selama fase pertumbuhan R. eutropha G3+ dengan sumber karbon glukosa pada bioreaktor 10 L. Nilai Yx/s yang didapat pada penelitian ini lebih besar daripada nilai Yp/s. Hal ini menunjukkan bahwa gula yang dikonsumsi lebih
banyak digunakan untuk pembentukan dan penggandaan sel dibandingkan untuk pembentukan produk PHA.
Tabel 5 Parameter kinetika kultivasi batchR. eutropha yang ditumbuhkan pada hidrolisat pati sagu (bioreaktor 2 L )
Parameter Nilai µmaks 0,109 jam-1 Yx/s 0,15 g sel/g gula Yp/s 0,06 g PHA/g gula Yp/x 0,38 g PHA/ g sel ? S/So 0,99
Pada kondisi pertumbuhan yang relatif seimbang (rasio awal C/N 10:1), secara alami R. eutropha mengakumulasi PHA dalam selnya meskipun relatif rendah, ditunjukkan dengan nilai Yp/x = 0,38 g PHA/g sel. PHA disintesis sebagai bahan cadangan karbon dan energi intraselular. Dengan demikian, bakteri yang secara alami menghasilkan PHA memiliki ketahanan hidup yang lebih besar dibandingkan dengan yang tidak (Tal dan Okon 1985 dikutip oleh Kim dan Lenz 2001). Pada akhir kultivasi (jam ke-96) dihasilkan biomassa kering dengan konsentrasi 4,41 g/L dan PHA dengan konsentrasi 1,44 g/L atau 32,65 % dari bobot biomassa. Data dan penghitungan kinetika kultivasi selengkapnya dapat dilihat pada Lampiran 7.
Kultivasi Fed-batch
Percobaan utama yang dilakukan pada tahap ini adalah ketika konsentrasi sel mencapai maksimum dan konsentrasi gula dalam media hampir habis dikonsumsi mikroba pada awal fase pertumbuhan stasioner maka diumpankan berbagai formula substrat/media segar ke dalam kultur untuk dilihat responnya terhadap pembentukan sel dan PHA. Berdasarkan informasi pada tahap sebelumnya bahwa fase pertumbuhan stasioner (ketika konsentrasi gula sisa dalam media mendekati 1 g/L) mulai terjadi pada jam ke-48 dan nilai µmaks = 0,109/jam maka pengumpanan substrat dilakukan mulai jam ke-48 dengan fluktuasi laju dilusi diatur sedemikian, sehingga lebih kecil dari 0,109/jam.
Teknik pengumpanan substrat ini dikembangkan untuk menjaga konsentrasi sumber karbon agar tetap berada dalam rentang yang optimal bagi akumulasi PHA (Lee dan Choi 2001). Hal ini didasarkan pada fenomena akumulasi PHA dalam sel R. eutropha dapat dipicu bila nutrisi dalam media tidak seimbang, misalnya pada saat konsentrasi karbon berlebih dan nutrisi esensial lainnya terbatas. Beberapa literatur menyebutkan jenis nutrisi pembatas yang dapat memicu akumulasi PHA oleh R. eutropha adalah amonium (Kim dan Lenz 2001), fosfat (Ryu et al. 1997), magnesium atau sulfat (Repaske dan Repaske 1976 dikutip oleh Lefebvre et al. 1997).
Hipotesis yang akan dibuktikan pada tahapan penelitian ini adalah dengan mengumpankan sumber karbon saja (dalam hal ini hidrolisat sagu) diduga dapat meningkatkan konsentrasi PHA dan kadar PHA dalam sel. Sementara itu, pengumpanan sumber karbon yang dilengkapi dengan sumber N dan mineral maupun pengumpanan media lengkap diduga dapat meningkatkan konsentrasi sel sekaligus perolehan PHA. Berdasarkan hal tersebut, akan dilihat jenis pembatasan nutrisi yang sesuai untuk meningkatkan akumulasi PHA dalam sel R. eutropha.
Pada perlakuan F1, ke dalam kultur diumpankan media segar dengan komposisi dan volume sama dengan media yang digunakan pada awal kultivasi batch. Volume awal media batch dan volume umpan masing-masing adalah 500 mL. Dengan kecepatan pengumpanan konstan 1 mL/menit maka waktu pengumpanan berlangsung selama 8,33 jam dengan laju dilusi berfluktuasi dari 0,107/jam pada jam pertama pengumpanan kemudian menurun hingga 0,06/jam saat pengumpanan berakhir (Gambar 16a). Laju dilusi menurun karena volume kultur meningkat selama pengumpanan susbtrat baru.
Pada perlakuan F2, larutan umpan berupa konsentrat hidrolisat sagu (konsentrasi total gula 300 g/L). P ada perlakuan F3, larutan umpan berupa konsentrat hidrolisat sagu (konsentrasi total gula 300 g/L) ditambah dengan MgSO4 8,57 g/L sedangkan pada perlakuan F4 larutan umpan berupa konsentrat hidrolisat sagu (konsentrasi total gula 300 g/L) ditambah dengan MgSO4 8,57 g/L dan (NH4)2HPO4 56,15 g/L. Ke dalam kultur awal sebanyak 1 L (F2, F3 dan F4) diumpankan sejumlah larutan stok yang setara dengan 20 g gula/L kultur atau sekitar 66,7 mL dengan kecepatan pengumpanan konstan 1,7 mL/menit sehingga
waktu pengumpanan hanya berlangsung sekitar 39,2 menit dengan laju dilusi cenderung konstan yaitu sekitar 0,1/jam (Gambar 16b). Pada perlakuan F4, dilakukan dua kali pengumpanan yaitu pada jam ke-48 dan ke-96 yaitu pada kondisi pH kultur > 6,9 (menandakan konsentrasi gula dalam kultur hampir habis). Laju dilusi cenderung konstan karena substrat yang diumpankan berupa konsentrat yang tidak signifikan menambah volume akhir kultur.
0,00 0,02 0,04 0,06 0,08 0,10 0,12 0 1 2 3 4 5 6 7 8 9
Waktu pengumpanan (jam)
Laju dilusi (/jam) Laju dilusi F1
(a) 0,00 0,02 0,04 0,06 0,08 0,10 0,12 0 10 20 30 40 50
Waktu pengumpanan (menit)
Laju dilusi (1/jam)
Pengumpanan ke-1 (F2,F3,F4) Pengumpanan ke-2 (F4)
(b)
Gambar 16 Laju dilusi pada kultivasi fed -batch (a) F1 (b) F2, F3, F4 Rekapitulasi data konsentrasi sel kering, konsentrasi PHA dan kadar PHA dalam sel pada akhir kultivasi batch dan fed -batch disajikan pada Tabel 6. Data pertumbuhan sel dan konsumsi gula selama kultivasi F1, F2, F3 dan F4 selengkapnya dapat dilihat pada Lampiran 8, 9, 10 dan 11 sedangkan penghitungan laju dilusi dapat dilihat pada Lampiran 12.
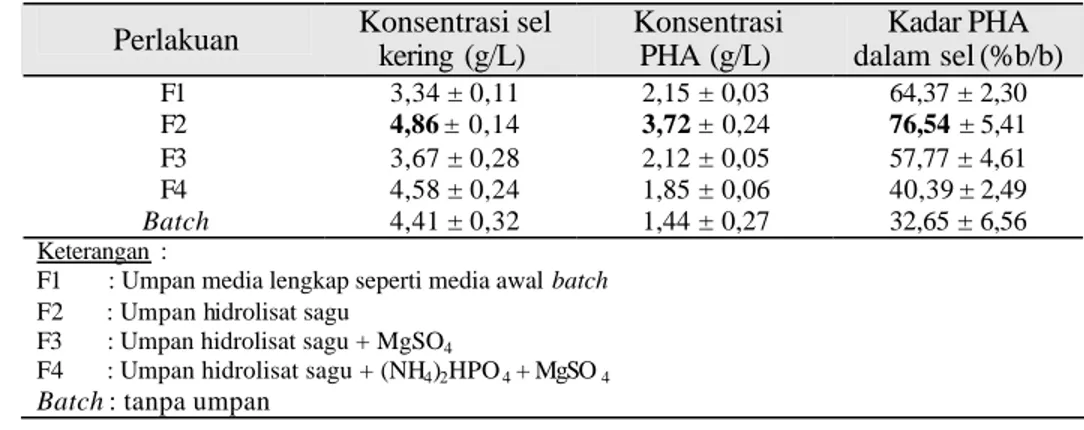
Tabel 6 Konsentrasi sel kering, PHA dan kadar PHA dalam sel R. eutropha pada akhir kultivasi batch dan fed -batch
Perlakuan Konsentrasi sel kering (g/L) Konsentrasi PHA (g/L) Kadar PHA dalam sel (%b/b) F1 F2 F3 F4 Batch 3,34 ± 0,11 4,86 ± 0,14 3,67 ± 0,28 4,58 ± 0,24 4,41 ± 0,32 2,15 ± 0,03 3,72 ± 0,24 2,12 ± 0,05 1,85 ± 0,06 1,44 ± 0,27 64,37 ± 2,30 76,54 ± 5,41 57,77 ± 4,61 40,39± 2,49 32,65 ± 6,56 Keterangan :
F1 : Umpan media lengkap seperti media awal batch F2 : Umpan hidrolisat sagu
F3 : Umpan hidrolisat sagu + MgSO4
F4 : Umpan hidrolisat sagu + (NH4)2HPO4 + MgSO4
Batch : tanpa umpan
Hasil analisis ragam menunjukkan bahwa variasi jenis substrat pengumpan tidak berpengaruh nyata terhadap konsentrasi akhir sel kering (Lampiran 15), akan tetapi berpengaruh nyata terhadap konsentrasi akhir PHA (Lampiran 16a) dan berpengaruh sangat nyata terhadap kadar PHA dalam sel (Lampiran 17a). Uji lanjut Tukey dan Fisher (Lampiran 16b dan 16c) menunjukkan bahwa konsentrasi akhir PHA akibat perlakuan F2 (pengumpanan dengan hidrolisat sagu) berbeda nyata dibandingkan empat perlakuan lainnya (F1, F3, F4 dan batch). Konsentrasi PHA akibat perlakuan F1, F3, F4 dan batch tidak berbeda nyata antara satu dengan yang lainnya. Sementara itu, uji lanjut Tukey dan Fisher (Lampiran 17b dan 17c) menunjukkan bahwa kadar PHA dalam sel akibat perlakuan F1, F2 dan F3 berbeda nyata bila dibandingkan dengan kontrol (batch). Kadar PHA dalam sel akibat perlakuan F4 (pengumpanan dengan hidrolisat sagu+N+Mg) tidak berbeda nyata bila dibandingkan dengan kontrol (batch). Kadar PHA dalam sel akibat perlakuan F2 berbeda dengan F4 dan kontrol tetapi tidak berbeda dengan perlakuan F1 dan F3.
Pengaruh Jenis Substrat Pengumpan terhadap Konsentrasi Sel Kering pada Akhir Kultivasi
Pola pertumbuhan sel (dihitung sebagai total sel hidup dan mati) pada masing-masing perlakuan dapat dilihat pada Gambar 17. Hasil pengamatan menunjukkan bahwa secara umum substrat yang diumpankan pada awal fase stasioner tidak signifikan meningkatkan konsentrasi sel pada akhir kultivasi.
-2 -1 0 1 2 0 12 24 36 48 60 72 84 96 108 120 132 144 156 168 Waktu (jam)
Ln konsentrasi sel kering (g/L)
F1 F2 F3 F4 Batch
Poly. (F1) Poly. (F2) Poly. (F3) Poly. (F4) Poly. (Batch) Keterangan :
F1 : Umpan media lengkap seperti media awal batch F2 : Media pengumpan hidrolisat sagu
F3 : Media pengumpan hidrolisat sagu + MgSO4
F4 : Media pengu mpan hidrolisat sagu + (NH4)2HPO4 + MgSO4 jam ke-48 dan ke-96
Batch : Tanpa umpan
Gambar 17 Pertumbuhan sel R. eutropha pada kultivasi batch dan fed -batch (bioreaktor 2 L).
Meskipun mungkin jumlah sel meningkat dengan bertambahnya waktu kultivasi namun konsentrasi sel cenderung konstan sampai akhir kultivasi dengan bertambahnya volume kultur akibat pengumpanan. Hal ini terkait dengan besaran laju dilusi dan laju pertumbuhan spesifik sel pada saat pengumpanan dimulai. Pada penelitian ini laju dilusi diatur sedemikian, sehingga berada pada kisaran di bawah nilai µmaks. Sementara itu, pengumpanan untuk meningkatkan perolehan PHA dilakukan pada awal fase stasioner dimana laju pertumbuhan spesifik mendekati angka nol. Oleh karena itu, laju konsumsi substrat menjadi lebih kecil dibandingkan dengan laju pengumpanan substrat, sehingga peningkatan konsentrasi sel menjadi tidak nyata besarnya. Selain itu, konsentrasi sel yang terukur merupakan total sel hidup dan sel mati sekaligus PHA yang terdapat di dalam sel. Dalam hal ini substrat dikonsumsi tidak hanya untuk memenuhi kebutuhan karbon, energi dan komponen struktural untuk pertumbuhan sel, namun juga digunakan untuk pemeliharaan viabilitas sel seperti mekanisme
perbaikan sel, proses transpor substrat, pemeliharaan membran dan pembentukan produk (Scragg 1991).
Terkait dengan temuan di atas, terdapat beberapa alasan lain kemungkinan yang menyebabkan pertumbuhan sel konstan pada tahap fed-batch sebagaimana dikemukakan oleh Kim et al. (1992), yaitu:
Pertama, pertumbuhan sel menurun karena terjadinya diversi (perubahan) lintasan asetil-KoA dari jalur pertumbuhan sel ke jalur produksi PHA.
Kedua, penggandaan sel menjadi abnormal sejak terbentuknya granula PHA. Dengan adanya akumulasi PHA dalam sel, sel menjadi lebih ‘gemuk’ (Gambar 18b) dibandingkan sel yang ditumbuhkan pada media seimbang (Gambar 18a), sehingga menghambat laju penggandaan sel.
Ketiga, kultur menjadi kekurangan oksigen ketika jumlah sel maksimal pada akhir tahap batch. Pada penelit ian ini, aerasi selama kultivasi ditetapkan sebesar 0,2 vvm, sehingga kemungkinan besar kebutuhan oksigen untuk pertumbuhan tidak terpenuhi akibat ketersediaannya dalam bioreaktor tidak ditambah.
Keempat, adanya pembentukan asam asetat (hasil glikolisis) sebagai produk samping kultivasi yang dalam konsentrasi tertentu dapat menghambat pertumbuhan sel. Pada penelitian ini, pH kultur cenderung menurun selama kultivasi, ditunjukkan dengan banyaknya volume larutan NaOH 2 N (> 100 mL) yang dibutuhkan untuk menaikkan pH kultur agar sesuai dengan set pH awal sebesar 6,9. Hal ini menunjukkan bahwa selama kultivasi banyak terbentuk asam-asam sebagai hasil samping kultivasi.
(a) kultivasi batch pada media Nutrient Broth, jam ke-24
(b) kultivasi fed -batch F2 pada hidrolisat pati sagu, jam ke -96 Gambar 18 Sel R. eutropha (mikroskop cahaya, perbesaran 1000 kali)
Pengaruh Jenis Substrat Pengumpan terhadap Konsentrasi PHA dan Kadar PHA dalam Sel pada Akhir Kultivasi
Hasil akhir perolehan PHA pada perlakuan F1, F2, F3 dan F4 dibandingkan dengan kontrol batch (tanpa pengumpanan) disajikan pada Gambar 19. Perlakuan pengumpanan dengan hidrolisat sagu (F2) merupakan perlakuan
pengumpanan yang menghasilkan konsentrasi PHA tertinggi sebesar 3,72 g/L (76,54% dari bobot kering sel). Pengumpanan dengan media lengkap (F1) menghasilkan konsentrasi PHA sebesar 2,15 g/L (63,97% dari bobot kering sel), sedikit lebih tinggi daripada konsentrasi PHA hasil pengumpanan dengan hidrolisat sagu + MgSO4 (F3) yang mencapai 2,12 g/L (57,77% dari bobot kering sel). Pengumpanan dengan hidrolisat sagu + (NH4)2HPO4 + MgSO4 (F4) menghasilkan konsentrasi PHA yang paling kecil yaitu 1,85 g/L (40,39% dari bobot kering sel).
Konsentrasi PHA dan kadar PHA dalam sel pada semua perlakuan pengumpanan lebih tinggi dibandingkan dengan kontrol batch. Persentase peningkatan konsentrasi PHA akibat perlakuan F1, F2, F3 dan F4 berturut-turut adalah 49, 158, 47 dan 28% sedangkan persentase peningkatan kadar PHA dalam sel berturut-turut adalah 96, 134, 77 dan 24% bila dibandingkan dengan kontrol batch. 2,15 3,72 2,12 1,85 1,44 63,97 76,54 57,77 40,39 32,65 F1 F2 F3 F4 Batch Perlakuan pengumpanan
Konsentrasi PHA (g/L) Kadar PHA dalam sel (%)
Keterangan :
F1 : Umpan media lengkap seperti media awal batch F2 : Umpan hidrolisat sagu
F3 : Umpan hidrolisat sagu + MgSO4
F4 : Umpan hidrolisat sagu + (NH4)2HPO4 + MgSO4
Batch : Tanpa umpan
Gambar 19 Konsentrasi PHA dan kadar PHA dalam sel pada akhir kultivasi batch dan fed-batch.
Terdapat kecenderungan bahwa pengumpanan dengan hidrolisat pati sagu (F2) menghasilkan konsentrasi dan kadar PHA dalam sel tertin ggi. Pengumpanan hidrolisat pati sagu dengan MgSO4 (F3) sedikit menurunkan konsentrasi dan kadar PHA dalam sel sedangkan penambahan hidrolisat pati sagu dengan MgSO4 dan (NH4)2HPO4 justru menurunkan perolehan PHA. Sementara itu, pengumpanan dengan media lengkap (F1) menghasilkan konsentrasi akhir PHA yang relatif rendah (berbeda nyata dengan F2 tetapi tidak berbeda nyata dengan batch), namun kadar PHA dalam selnya cukup tinggi (tidak berbeda nyata dengan F2 tetapi berbeda nyata dengan batch). Hal ini menunjukkan bahwa pengumpanan perlahan dengan media yang kamba atau bulky (bukan konsentrat sebagaimana F2, F3 dan F4) pada kultivasi fed -batch dapat meningkatkan kadar PHA dalam sel, tetapi tidak nyata meningkatkan konsentrasi PHA dalam media karena adanya faktor pengenceran sebagai akibat dari pengumpanan media segar.
Dengan membandingkan hasil perolehan PHA pada perlakuan F2, F3 dan F4 terdapat indikasi bahwa N, P, Mg dan sulfat merupakan nutrisi pembatas yang dapat meningkatkan akumulasi PHA di dalam sel R. eutropha. Setelah diumpan dengan hidrolisat pati sagu, komposisi media menjadi tidak seimbang karena terdapat kelebihan sumber karbon sedangkan komponen lainnya seperti nitrogen, fosfat, magnesium dan sulfat terbatas pada awal fase stasioner. Babel et al. (2001) menjelaskan bahwa ketika nitrogen (dalam bentuk amonia k) merupakan pembatas pertumbuhan maka potensi penggunaan asetil-KoA dan NAD(P)H menjadi terbatas. NAD(P)H yang dilepaskan tidak dapat dikonsumsi untuk sintesis reduktif, misalnya pada asam amino, sehingga dapat menghambat enzim sitrat sintase (yaitu enzim yang mengkatalisis konversi sumber karbon menjadi asetil-KoA). Hal ini menyebabkan terhambatnya siklus TCA sehingga asetil-KoA menjadi tersedia untuk 3-ketot iolase dan dapat memasuki jalur sintesis PHA.
Pada saat fosfat terbatas, bakteri tidak dapat menghasilkan ATP (dengan cara memfosforilasi ADP) karena tidak ada fosfat. Pada kondisi tersebut 2/H/ tidak dapat mengalir sehingga 2/H/ terakumulasi sedangkan asetil-KoA menjadi tersedia. Kedua substrat tersebut kemudian diasimilasi dan dikumpulkan secara intraselular seba gai PHA.
Secara umum, pasokan nutrisi yang tidak seimbang akan menurunkan kompleksitas metabolisme dan menyalurkan rangkaian karbon ke jalur sintesis PHA. Sebaliknya, pada saat sumber karbon, nitrogen dan Mg berlebih maka jalur metabolisme substrat sangat kondusif bagi berjalannya siklus TCA sehingga menyalurkan rangkaian karbon ke siklus TCA. Dengan demikian, laju sintes is PHA menjadi terhambat sebagaimana hasil perolehan PHA perlakuan F4 dibandingkan dengan perlakuan F2.
Pembatasan Aerasi pada Kultivasi Batch dan Fed-batch
Berdasarkan hasil evaluasi tahap sebelumnya bahwa jenis substrat pengumpan yang menghasilkan konsentrasi dan kadar PHA dalam sel tertinggi adalah hidrolisat pati sagu (F2) maka pada tahap ini dilakukan perlakuan kombinasi pembatasan aerasi dengan pengumpanan hidrolisat sagu (disimbolkan dengan F5). Pada awal fase stasioner (jam ke-48), ke dalam kultur batch diumpankan larutan stok/konsentrat hidrolisat pati sagu yang setara dengan 20 g gula/L kultur batch (sekitar 66,7 mL larutan stok) dengan kecepatan pengumpanan 1,7 mL/menit. Setelah pengumpanan selesai, sistem aerasi dimatikan hingga akhir kultivasi. Dalam hal ini kondisi kultivasi direkayasa agar selama fase stasioner konsentrasi karbon berlebih sedangkan ketesediaan oksigen dalam media menurun.
Selain itu, dilakukan pula kultivasi batch dengan sistem aerasi dimatikan mulai jam ke-48 hingga akhir kultivasi (disimbolkan dengan Ao). Sebagai pembanding digunakan data hasil kultivasi batch dan fed -batch F2. Rekapitulasi data konsentrasi sel kering, konsentrasi PHA dan kadar PHA dalam sel disajikan pada Tabel 7 sedangkan data pertumbuhan sel dan konsumsi gula selama kultivasi selengkapnya dapat dilihat pada Lampiran 13 dan 14.
Hasil analisis ragam (Lampiran 18) menunjukkan bahwa faktor aerasi tidak berpengaruh nyata terhadap konsentrasi sel kering, PHA dan kadar PHA dalam sel pada akhir kultivasi. Interaksi faktor aerasi dengan pengumpanan ju ga tidak berpengaruh nyata terhadap konsentrasi sel kering, konsentrasi PHA maupun kadar PHA dalam sel pada akhir kultivasi. Hanya faktor pengumpanan yang berpengaruh nyata terhadap konsentrasi PHA (Lampiran 18b) dan
berpengaruh sangat nyata terhadap kadar PHA dalam sel (Lampiran 18c) namun tidak berpengaruh nyata terhadap konsentrasi sel kering (Lampiran 18a) pada akhir kultivasi.
Tabel 7 Konsentrasi sel kering, PHA dan kadar PHA dalam sel R. eutropha pada akhir kultivasi batch dan fed -batch dengan dan tanpa pembatasan aerasi Perlakuan Konsentrasi sel
kering (g/L) Konsentrasi PHA (g/L) Kadar PHA dalam sel (%b/b) Batch F2 Ao F5 4,41 ± 0,32 4,86 ± 0,14 3,39 ± 0,21 4,13 ± 0,52 1,44 ± 0,27 3,72 ± 0,24 1,65 ± 0,14 2,68 ± 0,08 32,65 ± 6,56 76,54 ± 5,41 48,67 ± 5,11 64,89 ± 8,40 Keterangan :
Batch : Tanpa umpan, aerasi tetap F2 : U mpan hidrolisat sagu, aerasi tetap
F5 : Umpan hidrolisat sagu, aerasi dihentikan mulai jam ke-48 Ao : Tanpa umpan, a erasi dihentikan mulai jam ke-48
Berdasarkan hasil yang tertera pada Tabel 7 didapatkan bahwa perlakuan pengumpanan dengan hidrolisat sagu saja (F2) merupakan perlakuan terbaik yang memberikan konsentrasi sel 4,86 g/L dan konsentrasi PHA dalam media 3,72 g/L (76,54 % dari bobot sel). Dapat dikatakan bahwa pembatasan aerasi maupun interaksi atau kombinasinya dengan pengumpanan hidrolisat pati sagu kurang efektif meningkatkan konsentrasi dan kadar PHA dalam sel. Faktor pengumpanan hidrolisat sagu saja lebih efektif diterapkan untuk meningkatkan konsentrasi dan kadar PHA dalam sel dibandingkan dengan pembatasan aerasi saja maupun jika pengumpanan hidrolisat sagu dipadukan secara simultan dengan pembatasan aerasi. Hal tersebut mengindikasikan bahwa oksigen bukan merupakan nutrisi pembatas yang signifikan untuk meningkatkan akumulasi PHA dalam sel R. eutropha IAM 12368.
Pengaruh Pembatasan Aerasi terhadap Konsentrasi Sel Kering pada Akhir Kultivasi
Pola pertumbuhan sel selama kultivasi disajikan pada Gambar 20. Konsentrasi sel kering (dihitung sebagai total sel hidup dan mati) pada akhir kultivasi tidak dipengaruhi oleh faktor aerasi, pengumpanan maupun kombinasi
aerasi dengan pengumpanan hidrolisat pati sagu. P ada saat sistem aerasi dimatikan, pasokan oksigen (dalam udara) dari luar terhenti. Kebutuhan bakteri akan oksigen setidaknya dipenuhi dari ketersediaan udara pada head space (ruang kosong) di atas permukaan kultur di dalam bejana kultivasi.
-2 -1 0 1 2 0 12 24 36 48 60 72 84 96 Waktu (jam)
Ln Konsentrasi sel kering (g/L)
F2 F5 Ao Batch
Poly. (F2) Poly. (F5) Poly. (Ao) Poly. (Batch) F2 : U mpan hidrolisat sagu, aerasi tetap
F5 : Umpan hidrolisat sagu, aerasi dihentikan mulai jam ke -48 Ao : Tanpa umpan, a erasi dihentikan mulai jam ke-48
Batch : Tanpa umpan, aerasi tetap
Gambar 20 Pertumbuhan sel pada kultivasi batch dan fed-batch dengan dan tanpa pembatasan aerasi.
Pengaruh Pembatasan Aerasi terhadap Konsentrasi PHA dan Kadar PHA dalam Sel pada Akhir Kultivasi
Histogram perolehan PHA pada akhir kultivasi secara lebih jelas dapat dilihat pada Gambar 21. Perolehan PHA pada perlakuan Ao, F5 dan F2 lebih tinggi dibandingkan kontrol batch. Persentase peningkatan konsentrasi PHA akibat perlakuan Ao, F5 dan F2 berturut-turut adalah 15, 86 dan 158% sedangkan persentase peningkatan kadar PHA dalam sel berturut-turut adalah 49, 99 dan 134% bila dibandingkan dengan kontrol batch. Meskipun besarannya tidak signifikan, namun secara umum dapat dilihat bahwa perolehan PHA pada kondisi terbatasnya aerasi (perlakuan Ao dan F5) relatif lebih tinggi daripada kontrol batch. Pembatasan aerasi selama fase stasioner menyebabkan kandungan oksigen terlarut dalam me dia berkurang. Ketika oksigen membatasi pertumbuhan dan
3,72 2,68 1,65 1,44 32,65% 48,67% 64,89% 76,54% F2 F5 Ao Batch
Konsentrasi PHA (g/L) Kadar PHA dalam sel (%)
penggandaan bakteri aerobik maka nilai adaptif dan mekanisme induksi sintesis PHA sangat mirip dengan mekanisme pada saat terbatasnya nitrogen. 2/H/ yang dihasilkan tidak dioksidasi melalui fosforilasi transpor elektron sehingga menyebabkan siklus TCA terhenti. Pada kasus tersebut, siklus TCA dikatakan ‘endergonic’ karena ketiadaan oksigen (Babel et al. 2001). Atkinson dan Mavituna (1991) menyatakan bahwa pembatasan oksigen menyebabkan peningkatan rasio NADH2/NAD intraselular , sehingga menghambat siklus TCA dan meningkatkan ketersediaan asetil-koA intraselular. Hal ini menyebabkan peningkatan laju sintesis PHA dibandingkan laju sintesis PHA pada kondisi tanpa pembatasan oksigen (kontrol batch).
F2 : U mpan hidrolisat sagu, aerasi tetap
F5 : Umpan hidrolisat sagu, aerasi dihentikan mulai jam ke -48 Ao : Tanpa umpan, a erasi dihentikan mulai jam ke-48
Batch : Tanpa umpan, aerasi tetap
Gambar 21 Konsentrasi PHA dan kadar PHA dalam sel R. eutropha pada akhir kultivasi batch dan fed-batch dengan dan tanpa pembatasan aerasi. Sementara itu, perolehan PHA pada kondisi karbon berlebih dan oksigen terbatas (F5) secara umum menunjukkan hasil yang relatif lebih tinggi daripada kontrol batch maupun pada kondisi terbatasnya aerasi saja (Ao). Akan tetapi, bila dibandingkan dengan pengumpanan sumber karbon saja (F2), efek simultan pengumpanan sumber karbon dan pembatasan aerasi ini justru menurunkan produksi PHA oleh R. eutropha. Sintesis PHA lebih lambat pada kandungan
oksigen terlarut rendah diduga karena laju konsumsi oksigen lebih lambat sehingga terjadi pengurangan kebutuhan oksigen untuk dekarboksilasi propionil koenzim A menjadi asetil-KoA (Lafebvre et al. 1997).
Lafebvre et al. (1997) juga mendapatkan sintesis 3HB pada produksi PHBV yang lebih rendah pada pasokan oksigen yang rendah. Ketika R. eutropha ditumbuhkan secara fed -batch dengan pembatasan nitrogen dan pengurangan konsentrasi oksigen terlarut secara simultan selama tahap akumulasi polimer maka rendemen 3HB tidak terpengaruh dengan kadar oksigen terlarut yang rendah. Bahkan secara keseluruhan produktifitas polimer menurun pada kadar oksigen terlarut yang rendah.
Evaluasi Perlakuan Terbaik
Berdasarkan uraian di atas, dapat diambil kesimpulan bahwa kultivasi fed-batch dengan jenis umpan hidrolisat pati sagu merupakan perlakuan terbaik yang dapat meningkatkan hasil perolehan PHA lebih dari dua kali lipat, yaitu dari 1,44 g/L (32,65% dari bobot kering sel) pada kultivasi batch menjadi 3,72 g/L (76,54% bobot kering sel). Berikut ini dipaparkan secara ringkas perbandingan hasil kultivasi fed-batch dengan kultivasi batch.
Pola pembentukan sel dan PHA oleh R. eutropha pada kultivasi fed -batch dengan umpan hidrolisat pati sagu dibandingkan dengan pola pembentukan PHA pada kultivasi batch disajikan pada Gambar 22. Setelah diumpan dengan hidrolisat sagu pada jam ke -48, konsentrasi PHA dan kadar PHA dalam sel (P/X) cenderung meningkat hingga akhir kultivasi. Sementara itu, tanpa diumpan dengan sumber karbon (batch), konsentrasi PHA dan kadar PHA dalam sel cenderung menurun terutama pada jam ke -60 hingga akhir kultivasi jam ke -96. Demikian pula dengan konsentrasi residu sel (sel tanpa PHA). Pada kultivasi batch, konsentrasi residu sel cenderung konstan mulai jam ke -60 hingga akhir kultivasi. Namun pada kultivasi fed-batch, konsentrasi residu sel menurun tajam terutama pada akhir kultivasi (jam ke -84 hingga 96). Pada konsentrasi akhir sel kering yang tidak berbeda signifikan antara kultivasi batch dan fed-batch, hal tersebut menunjukkan terjadinya peningkatan akumulasi PHA dalam sel sebagai akibat adanya pengumpanan sumber karbon.
0 1 2 3 4 5 0 12 24 36 48 60 72 84 96 Waktu (jam) Konsentrasi (g/L)
[sel] batch [PHA] batch [residu sel] batch [sel] fed-batch [PHA] fed-batch [residu sel] fed-batch
(a) 0 10 20 30 40 50 60 70 80 0 12 24 36 48 60 72 84 96 Waktu (jam)
Kadar PHA dalam sel (%)
P/X batch P/X fed-batch
(b)
Gambar 22 Pertumbuhan sel dan pembentukan PHA oleh R. eutropha selama kultivasi batch dan fed-batch (a) konsentrasi sel, residu sel dan PHA (b) kadar PHA dalam sel.
Karakterisasi PHA
Serbuk kering PHA (Gambar 23) yang dihasilkan pada kultivasi fed -batch terbaik (F2) selanjutnya dikarakterisasi sifat termal, gugus fungsi dan tingkat kemurnian relatifnya terhadap PHB standar.
Gambar 23 Serbuk PHA hasil kultivasi fed-batch R. eutropha dengan sumber karbon hidrolisat pati sagu.
Sifat Te rmal PHA
PHA sebagian besar merupakan polimer yang bersifat kristalin. Penjelasan terhadap sifat termal dan mekanisnya diekspesikan dengan suhu peralihan kaca-karet pada fase amorf dan suhu pelelehan pada fase kristalin (Anderson dan Dawes 1990). Kumar da n Gupta (1998) me nyata kan bahwa suhu pada saat suatu polimer dapat mulai melebur disebut titik leleh atau melting point (Tm) sedangkan suhu pada saat polimer berada pada suatu transisi antara fase gelas menuju fase elastis disebut suhu transisi gelas atau glass transition temperature (Tg). Differential Scanning Calorimeter (DSC) mengukur sejumlah energi (panas) yang diserap atau dilepaskan oleh suatu sampel ketika dipanaskan, didinginkan atau didiamkan pada suhu konstan. DSC juga mengukur suhu sampel pada kondisi tersebut. Prinsip kerja menggunakan metode ini adalah pengukuran aliran panas berdasarkan kompensasi tenaga (Rabek 1983).
Pada penelitian ini, titik leleh dan entalpi fusi (panas pembentukan) produk PHA diukur dengan DSC (Gambar 25) dan hasiln ya dibandingkan dengan PHB standar (Gambar 24). Pada Gambar 24 yang menunjukkan spektra DSC
PHB standar , hanya muncul satu peak (puncak) pada suhu 170,15 oC yang merupakan titik leleh PHB dengan entalpi pembentukan sebesar 32,35 J/g. Tidak nampaknya peak-peak lain, menunjukkan kevalidan tingkat kemurnian PHB
standar yang diuji.
Gambar 24 Spektra DSC PHB standar.
Pada Gambar 25 yang menunjukkan spektra DSC PHA sagu muncul dua peak, yaitu pada suhu 79,50 oC dan 163,96 oC. Peak pertama yang lebar dan tidak runcing muncul pada suhu 79,50 oC; menunjukkan adanya komponen-komponen pengotor yang terikat pada PHA dan diduga merupakan bahan-bahan organik seperti senyawa-senyawa berkarbon maupun protein. Reusch (1992) melaporkan bahwa PHB dapat membentuk interaksi hidrofobik melalui gugus metil dan metilennya. Selain itu, gugus ester karbonil oksigennya dapat berfungsi sebagai akseptor ikatan hidrogen dengan kation-kation. Dengan karakteristik demikian, PHB dapat melarutkan molekul-molekul lain seperti garam atau makromolekul seperti protein.
Peak kedua (163,96 oC) merupakan titik leleh sampel PHA pati sagu dimana nilainya sedikit lebih rendah daripada titik leleh PHB standar (170,15 oC). Oleh karena itu, sampel PHA sagu yang didapat pada penelitian ini diduga merupakan jenis PHB. Lafferty et al. (1988) menyatakan bahwa titik leleh (Tm) PHB bervariasi antara 157-188 oC, suhu peralihan kaca (Tg) 5-20 oC dan suhu kristalisasi (Tc) 25-125 oC tergantung dari komposisi dan thermal history (riwayat pengolahan dan penanganan) bahan tersebut. Pada penelitian ini, Tg dan Tc PHA pati sagu maupun PHB standar tidak terdeteksi karena keterbatasan kemampuan alat untuk dioperasikan pada suhu di bawah 40 oC.
Berdasarkan nilai entalpi fusi (pembentukan) hasil pengukuran DSC dapat diperkirakan derajat kristalinitas PHA. Secara teoritis, sampel dengan derajat kekristalan 100% diasumsikan memiliki entalpi fusi sebesar 146 J/g (Barham et al. 1984 dikutip oleh Hahn et al. 1995). Derajat kristalinitas sampel PHA merupakan persentase hasil pembagian nilai entalpi fusi PHA yang diuji terhadap nilai entalpi fusi sampel dengan derajat kekristalan 100%. Berdasarkan hasil pada Gambar 23 dan 24, didapatkan bahwa PHB standar dan PHA sagu masing-masing memiliki entalpi fusi 32,35 J/g dan 12,23 J/g. Dengan demikian dapat diperkirakan bahwa derajat kristalinitas PHB standar dan PHA pati sagu masing-masing sekitar 22% dan 8%. Hasil tersebut menunjukkan bahwa baik PHB standar maupun PHA yang diperoleh pada penelitian ini dominan berada dalam bentuk amorf de ngan derajat kekristalan yang relatif rendah. Temuan ini sejalan dengan hasil penelitian Hahn et al. (1995) dan Lauzier et al. (1992) yang mendapatkan bahwa sebagian
besar granula PHB yang dihasilkan oleh R. eutropha berada dalam bentuk mobile amorphous (amorf/nirbentuk).
Analisis Gugus Fungsional
Prinsip dasar analisis gugus fungsional menggunakan metode FTIR (Fourier Transform Infrared) adalah ketika cahaya infrare d melewati suatu contoh polimer maka sebagian frekuensinya akan diserap dan sebagian lagi akan diteruskan. Transisi yang terjadi pada absorpsi infrared terkait dengan perubahan vibrasi (getaran) di dalam molekul. Ikatan-ikatan yang ada dalam polimer akan menunjukkan frekuensi vibrasi yang berbeda -beda sehingga dapat dideteksi sebagai pita absorbansi dalam spektrum infrared (Rabek 1983). Oleh karena itu, spektrum infrared suatu bahan menunjukkan komposisi kimia bahan tersebut karena masing-masing komponen kimia menghasilkan spektrum absorbansi yang khas (Kansiz et al. 2000) .
Perbedaan masing-masing spektrum ditentukan oleh struktur kimia dan tingkat kontribusi masing-masing komponen terhadap spe ktrum (Kansiz et al. 2000) . Pada Tabel 8 ditampilkan kriteria penentuan jenis-jenis ikatan kimia terkait dengan pita spektrum FTIR yang terbaca pada bilangan gelombang tertentu. Ciri khas molekul PHA adalah adanya ikatan karbonil ester (C=O), ikatan –C-O- dan ikatan – C-O-C- polimerik. Bloembergen et al. (1986) me nyata kan bahwa ikatan C-H dan C-C dapat terdeteksi pada bilangan gelombang sekitar 2900 da n 977 cm-1.
Hasil analisis gugus fungsional menggunakan FTIR terhadap serbuk bioplastik PHA yang dihasilkan pada penelitian ini disajikan pada Gambar 26. Sebagai pembanding digunakan spektra FTIR PHB standar yang disajikan pada Gambar 27. Pada sampel yang diuji, muncul 18 spektrum yang dapat diidentifikasi berdasarkan ketentuan pada Tabel 8. Hasil identifikasi/interpretasi spektra FTIR sampel PHA pada penelitian ini disajikan pada Tabel 9. Dari 18 spektrum yang muncul terdapat 15 spektrum yang sama dengan spektrum PHB standar. Oleh karena itu, diduga kuat bahwa sampel yang diuji dominan mengandung PHB karena selain sesuai dengan ciri khas grup PHA, juga muncul gugus metil bebas (-CH3) dan metilen tunggal (-CH2-), sehingga sesuai dengan
struktur PHB sebagaimana disajikan pada Gambar 28. Dugaan bahwa PHA yang diperoleh pada penelitian ini merupakan jenis PHB relevan dengan pendapat Kansiz et al. (2000) yang menyatakan bahwa ikatan utama dalam molekul PHB adalah karbonil ester (C=O) yang terbaca pada bilangan gelombang 1738-1728 cm-1, deformasi metil (CH3), metilen (CH2) serta ikatan C-O pada bilangan gelombang 1450-1000 cm-1.
Tabel 8 Penentuan jenis ikatan pada pita spe ktrum FTIR Bilangan
gelombang (cm-1)
Ketentuan Keterangan
~1735 C=O pada grup fungsional ester, terutama dari lipida, asam lemak dan PHB
Posisi pasti absorbansi PHB tergantung pada derajat kristalinitas PHB
~1650 C=O pada amida yang
berasosiasi dengan protein
Biasanya disebut band (pita) amida I; mungkin juga terdapat kontribusi dari ikatan C=C pada olefinik dan
komponen aromatik ~1540 N-H pada amida yang
ber-asosiasi dengan protein
Biasa disebut band amida II; mungkin juga terdapat kontribusi dari ikatan C=N
~1455 (CH3) dan (CH2) pada protein
Posisi bervariasi, kontribusi juga dari PHB
~1398 CH3 dan CH2 pada protein, C-O pada grup COO
-Posisi bervariasi, kontribusi juga dari PHB
~1242 (P=O) dari tulang pung-gung fosfodiester pada asam nukleat (DNA dan RNA)
Kemungkinan karena adanya produk simpanan protein dan polifosfat terfosforilasi
~1080 (P=O) dari tulang pung-gung fosfodiester dari asam nukleat (DNA dan RNA
Kemungkinan karena adanya produk simpanan protein dan polifosfat terfosforilasi
~1200-900 (C-O-C) pada polisakarida Kontribusi juga dari PHB
Sumber: Hendrick et al. (1991), Nelson (1991), Wiliam dan Fleming (1996), Zeroual et al.
Gambar 26 Spektra FTIR PHA dari pati sagu.
Gambar 27 Spektra FTIR PHB standar. -OH C-H C=O ester Amida protein -CH3 -CH2- COCC - -C-O-C-C-H C=O ester C-O -CH3 -CH2- C-C C -O -C C=O amida protein
Tabel 9 Hasil id entifikasi spektrum FTIR sampel PHA dari hidrolisat pati sagu
PHA dari pati sagu1 PHB standar2
No Bilangan gelombang (cm-1) Identifikasi No Bilangan gelombang (cm-1) Identifikasi 1 ~3435 * -OH 1 ~<3500* -OH 2 ~2931,6* C-H 2 ~2979,8 tdd 3 ~1726,2* C=O ester 3 ~2933,8* C-H 4 ~1654,8* C=O amida protein 4 ~2875,7 tdd 5 ~1548,7 N-H amida protein 5 ~1726,2* C=O ester 6 7 ~1456,2* ~1382,9* -CH3 6 ~1689,5 ttd
8 ~1284,5* -C-O- 7 ~1658,7* C=O amida
protein 9 ~1456,2* ~1228,6 -(CH2)- 8 9 ~1454,2* ~1380,9* -CH3 10 11 12 13 14 ~1184,2* ~1132,1* ~1099,3* ~1056,9* ~979,8* (C-O-C) polimer C-C 10 ~1357,8 ttd 15 ~896,8* Ttd 11 ~1278,7* -C-O-16 ~825,5* Ttd ~1454,2* ~1278,5 -(CH2)- 17 ~669,3 ttd 12 13 14 15 16 17 18 ~1186,1* ~1132,1* ~1101,3* ~1058,8* ~979,8* ~956,6 ~935,4 (C-O-C) polimer C-C 19 ~896,8* ttd 20 ~827,4* ttd 21 ~597,9 ttd 18 ~515,0* ttd 22 ~515,0* ttd
Catatan: 1 hasil analis is produk PHA penelitian ini
2
hasil analis is Wicaksono (2005) menggunakan metode dan alat yang sam a * menunjukkan bahwa spektrum tersebut juga muncul pada PHB standar ttd : tidak diketahui
CH3 O
CH C
CH2 O
n
Gambar 28 Struktur kimia PHB.
Namun demikian, munculnya gugus-gugus lain seperti C=O dan N-H pada bilangan gelombang 1654,8 da n 1548,7 cm-1 yang merupakan gugus amida protein menunjukkan masih adanya residu protein. Residu protein tersebut diduga berasal dari membran yang melapisi PHA. Jensen dan Sicko (1971) sebagaimana dikutip oleh Lafferty et al. (1988) me nyata kan bahwa PHB dilapisi oleh satu lapisan membran yang mengandung protein, sehingga dikatakan granula PHB terdiri dari 98% PHB dan 2% protein. Selain itu, residu protein diduga juga berasal dari sisa materi pecahan sel (cell debris) yang belum terpisahkan dari produk PHA.
Kuatnya intensitas spektrum -OH yang muncul pada bilangan gelombang 3435 cm-1 menunjukkan bahwa pada sampel PHA masih banyak mengandung residu – OH. Gugus –OH diduga berasal dari residu NaOH yang digunakan pada proses hilir pemisahan PHA. Kemungkinan lain, –OH diduga berasal dari senyawa polifenol. Se nyawa tersebut merupakan hasil oksidasi dari D-catechin dan D,L -epicatechin pada pati sagu oleh polifenol oksidase yang menjadi menjadi penyebab warna coklat (Hammer 1993) baik pada pati sagu, hidrolisat pati sagu maupun pada produk akhir PHA. Selain itu, terdapat kemungkinan sampel PHA mengandung senyawa-senyawa antara (intermediet) glukosa menjadi asam-asam organik turunannya ataupun senyawa antara pembentukan PHA yang mengandung gugus –OH. Wicaksono (2005) juga mendapati spektra gugus –OH dalam intensitas yang cukup tinggi ketika menguji spektra FTIR PHA dari R. eutropha yang ditumbuhkan pada glukosa.
Kemurnian Relatif terhadap PHB Standar
Untuk menguji tingkat kemurnian PHB yang diperoleh pada penelitian ini maka sampel PHA dianalisis menggunakan Gas Chromatography (GC). Analisis dengan kromatografi gas dilakukan dengan membandingkan data retensi dari komponen sampel dengan komponen yang sudah diketahui (standar). Waktu retensi merupakan perbedaan waktu antara penyuntikan komponen sampel dengan puncak maksimum yang tercatat pada kromatogram (Fardiaz 1989).
Metode analisis dilakukan berdasarkan Braunegg et al. (1978) yang meliputi hidrolisis dan metanolisis sampel PHA secara bertahap oleh asam sulfat dan kloroform. Hasil metanolisis berupa metil asam hidroksialkanoat yang mudah menguap kemudian diinjeksikan ke alat GC. Kromatogram PHB standar dan PHA yang dihasilkan pada penelitian ini disajikan pada Gambar 29 dan Gambar 30.
Gambar 29 Kromatogram hasil metanolisis PHB standar (menggunakan kromatografi gas)
Gambar 30 Kromatogram hasil metanolisis PHA yang dihasilkan pada penelitian (menggunakan kromatografi gas).
Berdasarkan kromatogram di atas didapatkan bahwa peak (puncak) dominan pada PHB standar (diduga sebagai asam metil-3-hidroksibutirat) muncul pada waktu retensi 1,18 menit dengan konsentrasi 91,01%. Pada kromatogram PHA yang dihasilkan pada penelitian ini muncul p eak dominan pada waktu retensi yang mendekati standar (1,18 menit) yaitu pada waktu retensi 1,25 menit dengan konsentrasi 69,69%. Dengan demikian, kemurnian relatif PHB pati sagu terhadap PHB standar sebesar 76,57%. Cara penghitungan lebih jelas dapat dilihat pada Lampiran 19 dan 20.
Uraian hasil analisis di atas menguatkan dugaan sebelumnya bahwa sampel PHA yang dihasilkan dari perlakuan terbaik penelitian ini merupakan jenis PHB. Hal ini sesuai dengan teori yang dikembangkan oleh banyak peneliti bahwa R. eutropha akan menghasilkan PHB bila ditumbuhkan dengan sumber karbon glukosa.