1 BAB I PENDAHULUAN
A. Latar Belakang
Kelarutan adalah sifat instrinsik dari zat terlarut (solut) baik berupa padat, cair,
atau gas untuk dapat terlarut di dalam pelarut (solven) dan membentuk larutan
yang homogen. Kelarutan merupakan salah satu parameter fisikokimia yang
penting dalam studi preformulasi obat yang kemudian akan menentukan bentuk
sediaan obat yang cocok. Molekul obat umumnya harus memiliki kelarutan di
dalam cairan fisiologis usus atau berada di dalam larutan air, sehingga obat dapat
diabsrobsi secara sistemik dan menghasilkan efek farmakologis yang dinginkan
(Stegemann dkk, 2007; Chaurasia, 2016). Hal ini menjadikan kelarutan obat di
dalam air sebagai indikator utama yang mempengaruhi kelarutan obat di dalam
cairan fisiologis usus dan potensi yang dihasilkan dari bioavailibilitasnya.
Senyawa Pentagamavunon-0 dengan nama kimia
2,5-bis-(4’-hidroksi-3’-metoksibenzilidin) siklopentanon merupaka senyawa hasil modifikasi struktur
kurkumin yang disintesis oleh Tim Peneliti Fakultas Farmasi UGM.
Pentagamavunon-0 telah terbukti memiliki potensi antioksidan dan antiinflamasi
(Sardjiman, 2000). PGV-0 dapat terlarut dalam pelarut organik seperti dalam
etanol 3,8 mg/5ml dan dalam metanol 14,9 mg/ml, tetapi PGV-0 praktis tidak
larut di dalam air (Kurniawati, 1999). Hal ini mengakibatkan PGV-0 sulit
diabsorbsi dalam cairan gastrointestinal dan memiliki bioavailibilitas rendah di
dalam tubuh. Oleh karena itu, penelitian ini dilakukan untuk meningkatkan
Sistem hidrotropik adalah sistem solubilisasi untuk meningkatkan kelarutan
obat tak larut melalui penambahan sejumlah besar zat terlarut lain atau disebut zat
hidrotrop. Zat hidrotrop merupakan zat yang dapat melarutkan komponen
hidofobik dalam larutan air. Zat hidrotrop tersusun atas bagian hidrofilik dan
hidrofobik (seperti surfaktan) (Deepshikha dkk, 2012). Peningkatan kelarutan
molekul tak larut oleh zat hidrotrop terjadi dengan proses kompleksasi melalui
pembentukan interaksi lemah Van der Waals seperti ikatan π–π atau ikatan
dipol-dipol antara molekul tak larut dengan zat hidrotrop (Kumar dkk, 2014; Neumann
dkk, 2007; Maheshwari dkk, 2007). Fenomena ini selanjutnya dikenal dengan “Hidrotropisme” (Rasool dkk, 1991). Zat hidrotrop yang digunakan dapat berupa
garam anionik, kationik, atau netral, organik atau anorganik dan cairan atau
padatan (Dhapte dan Mehta, 2016). Dalam penelitian ini, natrium benzoat
merupakan garam anionik digunakan yang digunakan sebagai agen hidrotrop.
Natrium benzoat sudah banyak dimanfaatkan sebagai zat hidrotrop untuk
meningkatkan kelarutan dari obat yang sukar larut, seperti ibuprofen, lornoxicam,
cephalexin, dan ketoprofen (Maheswari dkk, 2008). Peningkatan kelarutan
PGV-0 oleh natrium benzoat terjadi melalui mekanisme kompleksasi antara natrium
benzoat dengan PGV-0. Natrium benzoat dapat mebantu meningkatkan kelarutan
PGV-0 karena natrium benzoat bersifat mudah larut di dalam air (Dhapte dan
B. Rumusan Masalah
1. Bagaimana pengaruh penambahan natrium benzoat sebagai zat hidrotrop
terhadap peningkatan kelarutan PGV-0?
2. Bagaimana pengaruh pH terhadap kelarutan PGV-0 dalam sistem
hidrotropik dengan natrium benzoat sebagai agen hidrotrop?
3. Bagaimana parameter termodinamika yang terjadi selama proses kelarutan
PGV-0?
C. Manfaat Penelitian 1. Bagi Mahasiswa Peneliti
Penelitian ini diharapkan dapat menambah ilmu pengetahuan dan
pengalaman mahasiswa dalam mengkaji dan menganalisis tentang
pengaruh sistem hidrotropik terhadap kelarutan PGV-0 dengan natrium
benzoat sebagai agen hidrotropnya.
2. Bagi Akademisi dan Ilmu Pengetahuan
Penelitian ini diharapkan dapat menjadi ilmu dasar yang menambah
kajian tentang kelarutan senyawa aktif PGV-0 di dalam sistemn
hidrotropik dengan natrium benzoat sebagai agen hidrotrop, sehingga
dapat mendukung penelitian lanjutan untuk menciptakan bentuk sediaan
yang cocok untuk senyawa aktif PGV-0 dan menemukan manfaat lain
dari natrium benzoat sebagai agen hidrotrop yang untuk membantu
3. Bagi Masyarakat
Penelitian ini diharapkan mampu menjadi dasar terciptanya produk obat
dengan senyawa aktif PGV-0 dengan bentuk sediaan yang cocok,
sehingga produk obat PGV-0 dapat memberikan efek terapi optimal bagi
penggunanya.
D. Tujuan Penelitian
1. Mengetahui pengaruh penambahan natrium benzoat sebagai agen
hidrotrop terhadap peningkatan kelarutan PGV-0.
2. Mengetahui pengaruh variasi pH larutan dapar sebagai pelarut larutan
natrium benzoat dalam sistem hidrotropik terhadap peningkatan kelarutan
PGV-0.
3. Mengetahui parameter termodinamika yang terjadi selama proses
kelarutan PGV-0 dalam sistem hidrotropik
E. Tinjauan Pustaka 1. Kelarutan
Kelarutan adalah sifat instrinsik zat terlarut (solut) baik berupa padat, cair,
atau gas untuk dapat terlarut dalam pelarut (solven) dan membentuk larutan yang
homogen. Tingkat kelarutan suatu zat dalam pelarut tertentu dihitung sebagai
konsentrasi jenuhnya, yaitu saat penambahan yang berlebih solut tidak akan
meningkatkan konsentrasinya dalam larutan (Savjani dkk, 2012). Kelarutan suatu
zat terlarut dinyatakan sebagai komposisi analit pada larutan jenuh atau
diistilahkan dengan proporsi dari zat terlarut yang ditunjuk dalam pelarut yang
molalitas, fraksimol dll. Jumlah kesetimbangan maksimal zat terlarut yang dapat
larut per jumlah pelarut adalah kelarutan dari zat terlarut dalam pelarut tersebut
pada kondisi tertentu.
Kelarutan obat menjadi faktor penting yang menentukan jumlah komponen
yang akan terlart dan tesedia untuk diabsorpsi. Senyawa dengan kelarutan air yang
rendah memiliki disolusi dan absorbsi yang terbatas di dalam saluran pencernaan.
Dalam biofarmasetika, kelarutan menjadi parameter penting yang dicantumkan
dalam sistem pengelompokan biofarmasetika (Biopharmaceutical Classification
System/ BCS), obat-obatan diklasifikasikan menjadi empat bagian berdasarkan
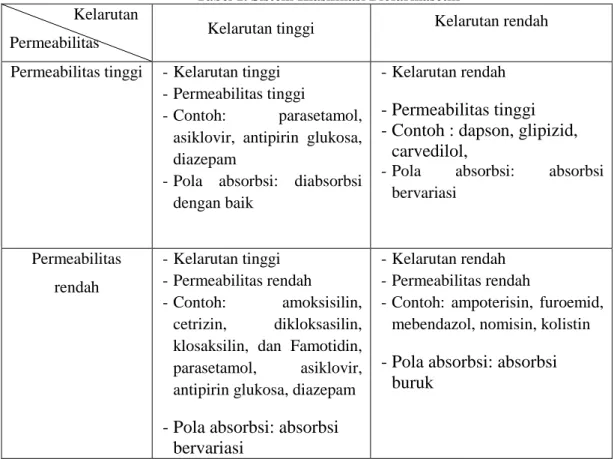
sifat kelarutan dan permeabilitasnya seperti pada Tabel 1.
Tabel 1. Sistem Klasifikasi Biofarmasetik Kelarutan
Permeabilitas Kelarutan tinggi
Kelarutan rendah Permeabilitas tinggi - Kelarutan tinggi
- Permeabilitas tinggi
- Contoh: parasetamol, asiklovir, antipirin glukosa, diazepam
- Pola absorbsi: diabsorbsi dengan baik
- Kelarutan rendah
- Permeabilitas tinggi - Contoh : dapson, glipizid,
carvedilol,
- Pola absorbsi: absorbsi bervariasi Permeabilitas rendah - Kelarutan tinggi - Permeabilitas rendah - Contoh: amoksisilin, cetrizin, dikloksasilin, klosaksilin, dan Famotidin, parasetamol, asiklovir, antipirin glukosa, diazepam
- Pola absorbsi: absorbsi bervariasi
- Kelarutan rendah - Permeabilitas rendah
- Contoh: ampoterisin, furoemid, mebendazol, nomisin, kolistin
- Pola absorbsi: absorbsi buruk
Pengelompokan BCS bertujuan untuk memperhitungkan dosis obat yang
diperlukan karena obat dalam dosis yang rendah akan lebih cukup larut di dalam
cairan usus pada saluran penceernaan, sementara tidak untuk dosis yang lebih
tinggi dengan kelarutan di dalam air yang sama. Untuk menggambarkan
kelarutan, USP dan British Pharmacopeia mengelompokkan kelarutan menjadi
beberapa kriteria yang dapat terlihat pada Tabel 2.
Tabel 2. Kriteria Kelarutan Berdasarkan USP dan British Pharmacopeia Deskripsi Istilah Jumlah Pelarut yang Dibutuhkan per
Jumlah Zat Terlarut
Sangat larut Kurang dari 1
Praktis larut Dari 1 sampai 10
Larut Dari 10 sampai 30
Sebagian larut Dari 30 sampa100
Sedikit larut Dari 100 sampai 1000
Sangat sedikit larut Dari 1000 sampai 10.000
Praktis tidak larut Lebih dari 10.000
Berdasarkan Martin dalam Diana (2004), proses kelarutan terdiri atas
beberapa tahap yaitu:
a. Tahap 1
Proses yang tejadi pada tahap 1 adalah pemindahan molekul dari fase
terlarut pada suhu tertentu. Pemindahan molekul fase terlarut terjadi melalui
pemecahan ikatan antara molekul-molekul yang berdekatan. Jika pemecahan
terjadi pada 2 molekul berdekatan, maka interaksi antara molekul terlarutnya
Namun, apabila molekul melepaskan diri dari zat terlarut dan menerima kembali
½ energinya, maka energi yang diterima pada proses ini dinotasikan dengan W22.
b. Tahap 2
Proses yang terjadi adalah pembentukan lubang dalam pelarut yang cukup
besar untuk menerima pelarut. Pada tahap ini terjadi interaksi antara molekul –
molekul pelarut, kerjanya dinotasikan dengan W11.
c. Tahap 3
Proses yang terjadi adalah penempatan molekul terlarut ke dalam lubang
pelarut. Pada proses ini terjadi pertambahan kerja dan penurunan energi potensial.
Kerja pada proses ini dinotasikan dengan –W12, sedangkan notasi 12 merupakan
energi untuk interaksi pada proses ini. Kemudian, lubang pada pelarut pun
tertutup dan ada penurunan tambahan dalam energi, sehingga kerja netto dalam
tahap terakhir ini adalah -2W12. Kerja total untuk keseluruhan tahap ditulis dalam
persamaan 1
W = W22 + W11 – 2W12 (1)
Ketiga tahapan tersebut terjadi secara skematis seperti pada Gambar 1.
Gambar 1. Tiga Tahap Kelarutan (Nidhi dkk, 2011). Tahap 1 adalah pemindahan
molekul. Tahap 2 adalah pembentukan lubang dalam pelarut. Tahap 3 penempatan molekul terlarut dalam pelarut
Berdasarkan gambar tersebut, Hildebrand dan Scatchard mengusulkan suatu
persamaan dengan mengasumsikan W22 sebagai ð22 dan W11sebagai ð12, yaitu
pada persamaan 2 berikut :
(2)
2. Sistem Hidrotropik
Istilah Hidrotropik pertama kali diungkapkan oleh Carl A. Neuberg.
Hidrotropik merupakan fenomena molekuler dari proses solubilisasi dengan
penambahan sejumlah besar zat terlarut kedua atau zat hidrotrop untuk
meningkatan kelarutan dari zat terlarut lain. Zat hidrotrop merupakan senyawa
yang dapat melarutkan komponen hidrofobik dalam larutan air. Hidrotrop
memiliki gugus hidrofobik dan hidrofilik yang sangat kecil untuk bisa
mengakibatkan agregasi spontan yang terjadi seperti pada surfaktan.
Keseimbangan bagian hidrofobik dan hidrofilik pada zat hidrotrop akan
menentukan efisiensi kelarutan. Semakin besar bagian hidrofobiknya, maka
efisiensi hidrotropik semakin besar (Beig dkk, 2016; Bauduin dkk, 2005).
Planaritas bagian hidrofobik dari hidrotrop mempunyai peran yang penting dalam
mekanisme solubilisasi oleh zat hidrotrop (Nidhi dkk, 2011). Hal ini karena zat
hidrotrop dengan struktur hidrofobik planar akan terbawa ke dalam larutan oleh
gugus polar (Maheswari dkk, 2010). − 𝐿𝑜𝑔 𝑋2 = ∆𝐻𝑓 2,303 𝑅𝑇 𝑇𝑜− 𝑇 𝑇𝑜 + (𝛿2− 𝛿1) 2 . 𝑉2𝑄12 2,303 𝑅𝑇
Gambar 2. Struktur hidrotrop (Nidhi, 2011)
Zat hidrotrop terdiri dari garam-garam logam alkali dari berbagai asam
organik. Zat hidrotrop biasa disebut sebagai garam organik ion. Garam yang meningkatkan kelarutan dalam pelarut tertentu disebut "salt in” dan garam-garam
yang menurunkan kelarutan disebut "salt out". Beberapa garam dengan jumlah
anion atau kation yang besar dengan sendirinya akan sangat larut dalam air sehingga akan terjadi proses “salting in” dari non elektrolit yang disebut "garam
hydrotropik". Fenomena ini yang dikenal sebagai "hidrotropisme" (Dhapte dan
Mehta, 2015; Rasool dkk, 1991).
Hidrotrop tidak bersifat membentuk koloid, tetapi dapat meningkatkan
kelarutan melalui pembentukan ikatan lemah dengan molekul obat insoluble yaitu
ikatan van der waals seperti ikatan π-π atau ikatan dipol-dipol (Neumann dkk,
2007). Berdasarkan penelitian sebelumnya, ada tiga mekanisme zat hidrotrop
dalam meningkatkan kelarutan yaitu :
1. Potensi self-aggregation
2. Structure-breaker dan struktur-maker
3. Kemampuan untuk membentuk struktur misel
Penggunaan larutan hidrotrop memiki nilai yang tinggi di dunia industri
karena kelebihannya yang mudah didapatkan seperti, recovery yang baik, tidak
adanya kemungkinan terbakar, dan faktor pemisahan yang tinggi tanpa ada
masalah emulsifikasi. Hal ini menyebabkan kualitas dari larutan hidrotrop sangat
diperhatikan. Konsetrasi, parameter hidrofobik (luas permukaan, volum molar
dari bagian hidrofobik), dan panjang rantai hidrofobik dari zat hidrotrop akan
menentukan sifat hidrotrop yang terbentuk.
3. Pentagamavunon-0
Pentagamavunon-0 (PGV-0) dengan nama kimia
2,5-bis-(4’-hidroksi-3’-metoksibenzilidin) siklopentanon merupakan senyawa turunan kurkumin dari
hasil modifikasi struktur kurkumin yang disintesis oleh Tim Peneliti MOLNAS
Fakultas Farmasi UGM.
Gambar 3. Struktur kimia pentagamavunon-0
PGV-0 disintesis dari vanilin dan siklopentanon dengan katalis asam sulfat
(Oetari dkk, 2001). Pada sintesis PGV-0, modifikasi struktur dilakukan dengan
cara merubah gugus diketon pada kurkumin menjadi analog gugus monoketon dan
menghilangkan gugus metilen aktif. Modifikasi struktur ini bertujuan untuk
menghasilkan pentagamavunon-0 yang memiliki sifat lebih stabil terhadap pH dan
toksisitas yang kecil (Sharma dkk, 2005). PGV-0 telah diteliti memiliki berbagai
aktivitas farmakologis yaitu aktivitas antioksidan, antifungi, antibakteri,
antiinflamasi, aktivitas sitotoksik dan analgetik (Sardjiman, 2000). PGV-0
memiliki kelarutan yang sangat rendah di dalam air, tetapi dapat terlarut dalam
pelarut organik seperti dalam etanol 3,8 mg/5ml dan dalam metanol 14,9 mg/ml
(Wahyuni, 1998). Pentagamavenon memiliki berat molekul 352.13 dan jarak
lebur 2120C-2140C (Istyastono, 2004).
4. Natrium Benzoat
Gambar 4. Struktur kimia natrium benzoat
Natrium benzoat adalah garam natrium dari asam benzoat. Natrium benzoat
mengandung tidak kurang dari 99% dan tidak lebih dari 100,5% C7H5NaO2
dihitung sebagai basa anhidrat. Bobot molekul natrium benzoat adalah 144,10
gram/mol (USP, 2006). Natrium benzoat terdeteksi pada sinar UV panjang
gelombang 225 nm (Bahremand dan Eskandaril, 2013). Kelarutan natrium
benzoat di dalam air adalah 556 g/L (Anonim, 2015). Satu gram garam NaOH
larut dalam 2 ml air, dalam 75 ml etil alkohol, dan dalam 50 ml campuran dari
47.5 alkohol dan 3,7 ml air. Natrium benzoat berbentuk larutan cair yang khas
higroskopis, berwarna putih, tidak berbau atau hampir tidak berbau (Anonim,
2015)
Garam natrium benzoat merupakan zat hidrotropik golongan cincin
aromatik anionik yang dapat meningkatkan kelarutan melalui pembentukan
kompleks, yakni ikatan antara hidrotrop dengan zat terlarut dan membentuk misel.
Misel yang terbentuk merupakan misel campuran stabil dengan nilai tolakan
elektrostatik yang menurun pada gugus kepala (Malik dkk, 2014; Lee dkk, 2007).
Pada peningkatan kelarutan indometasin, natrium benzoat pada konsentrasi
rendah digunakan sebagai hidrotrop dengan mekanisme pelarutannya melalui
pembentukan pembentukan interaksi ionik lemah. Jika natrium benzoat yang
digunakan adalah konsentrasi tinggi, maka peningkatan kelarutannya adalah
dengan membentuk molekul agregat (Jain dkk, 2008). Selain itu, penggunaan
natrium benzoat sebagai agen hidrotrop untuk meningkatkan kelarutan obat yang
sukar larut telah dibuktikan melalui beberapa penelitian seperti pada furosemid
meningkat kelarutannya sebanyak 90 kali, pada ibuprofen meningkat kelarutannya
sebanyak 80 kali, asam nalidiksat meningkat kelarutannya sebanyak 98 kali, dan
tenofovir disoproksil fumerat meningkat kelarutannya sebanyak 121 kali (Dhapte
dan Mehta, 2015).
5. Termodinamika
Kelarutan merupakan proses kesetimbangan antara keadaan larut dan tidak
larut. Pemahaman mengenai parameter termodinamika dalam suatu proses
pelarutan obat dapat membantu dalam memahami mekanisme interaksi yang
termodinamika yang disebut juga dengan tetapan stabilitas kompleks (K), dapat
ditentukan bila terjadi kesetimbangan pada proses. Nilai K dapat ditentukan
dengan persamaan Higuchi pada persamaan (3).
Tetapan stabilitas kompleks dapat digunakan untuk menghitung
parameter-parameter termodinamika. Parameter termodinamika yang dapat ditentukan,
seperti perubahan energi bebas (∆F), beda entalpi (∆H), dan beda entropi (∆S)
(Martin dkk, 1993).
Energi bebas (∆F) merupakan energi pada sistem untuk melakukan kerja.
Energi bebas berkaitan dengan proses kelarutan obat karena terlibat saat transfer molekul obat ke dalam “rongga” bagian pelarut. Harga energi bebas (∆F) dapat
ditentukan menggunakan persamaan (4) (Martin dkk, 1993).
Keterangan :
Perbedaan energi bebas antara reaktan dengan produk dapat memperkirakan
apakah reaksi berlangsung secara spontan atau tidak.
Beda entalpi (∆H) merupakan panas yang dilepaskan atau diabsorbsi jika
suatu mol zat terlarut dilarutkan ke dalam pelarut dalam jumlah yang besar
(Lachman dan Cartensen, 1986). Harga ∆H yang bertanda negatif menunjukkan
bahwa panas dilepaskan dari larutan, terjadi pelepasan energi, dan proses
K=𝑖𝑛𝑡𝑒𝑟𝑠𝑒𝑝 (1−𝑠𝑙𝑜𝑝𝑒)𝑠𝑙𝑜𝑝𝑒 (3)
∆F = -2,303.R.T.Log K (4)
∆F : energi bebas (kal/mol)
R : tetapan gas = 1,987 kal.mol.der T : suhu (K)
eksotermik berlangsung, sedangkan ∆H yang bertanda positif menunjukkan panas
diabsorbsi ke dalam larutan, terjadi reaksi endotermik. Adanya peningkatan suhu akan menningkatkan kelarutan suatu zat. Nilai ∆H dapat diperoleh dengan
mengalikan nilai slope dengan -2,303R. Slope didapatkan dengan membuat kurva
hubungan antar Log K dengan 1/T (K).
Beda entropi (∆S) menggambarkan perubahan ketidakteraturan dalam suatu
sistem. Nilai entropi akan meningkat sesuai dengan derajat peningkatan
ketidakteraturan (Florence dan Attwood, 2002). Nilai ∆S menggambarkan kespontanan dari proses yang terjadi pada sistem. Nilai ∆S dapat diperoleh
melalui persamaan 5 berikut (Martin dkk, 1993) :
F. Landasan Teori
Pentagamavunon-0 (PGV-0) diteliti terbukti mempunyai berbagai aktivitas
farmakologis, seperti aktivitas antioksidan, antifungi, antibakteri, antiinflamasi,
aktivitas sitotoksik dan analgetik. PGV-0 memiliki toksisitas dan efek samping
ulserogenisitas yang jauh lebih rendah dibandingkan dengan obat anti inflamasi
yang beredar di pasaran. Kelarutan PGV-0 yang rendah dapat ditingkatkan agar
sediaan obat PGV-0 dapat diabsorbsi dengan baik dalam gastrointestinal.
Peningkatan kelarutan PGV-0 akan dilakukan menggunakan sistem
hidrotrop dengan penambahan zat hidrotop natrium benzoat berbagai konsentrasi
dan variasi pH. Natrium benzoat merupakan salah agen hidrotrop golongan
aromatik anionik yang dapat meningkatan kelarutan PGV-0 oleh natrium benzoat
terjadi melalui mekanisme kompleksasi antara natrium benzoat dengan PGV-0. ∆S = ∆H− ∆F
Dalam sistem hidrotropik, pH dapat mempengaruhi disosiasi dari natrium benzoat
dalam pembentukan ikatan dengan PGV-0. Pada pH disekitar asam, dapat
mengionisasi zat hidrotropik menjadi molekul terionkan yang bersifat lebih polar.
Suhu merupakan salah satu faktor yang mempengaruhi kelarutan dan
menggambarkan termodinamika yang terjadi selama proses kelarutan. Penelitian
ini bertujuan untuk meningkatkan kelarutan PGV-0 melalui sistem hidrotropik
dan mempelajari pengaruh penambahan kosentrasi agen hidrotrop dan pH
terhadap kelarutan PGV-0.
G. Hipotesis
1. Sistem hidrotropik dapat meningkatkan kelarutan PGV-0 melalui
penambahan natrium benzoat sebagai zat hidrotrop.
2. pH mempengaruhi bentuk terion natrium benzoat terhadap kelarutan PGV-0.
3. Suhu dapat menggambarkan termodinamika yang terjadi selama proses