Tugas Khusus
Praktikum Kimia Fisika II
Shift
: Rabu Siang
Nama Co-Shift : Dina
Sapta Rianda
Sofyan Usman
Kelompok
: VI (enam)
Nama
: 1. Nita Fitriyanti
(56081010006)
2. Putyawismarina Lasutri (56081010008)
Fakultas Keguruan dan Ilmu Pendidikan
Pogram Studi Pendidikan Kimia (Ekstensi)
Nama : Rananda Vinsiah NIM : 06091410006 Kelompok : V (lima)
Judul Tugas : Skala pH Meter
pH Meter
pH adalah suatu satuan ukur yang menguraikan derajat tingkat kadar keasaman atau kadar alkali dari suatu larutan. Unit pH diukur pada skala 0 sampai 14. Istilah pH berasal dari " p", lambang matematika dari negatif logaritma, dan " H", lambang kimia untuk unsur Hidrogen. Definisi yang formal tentang pH adalah negative logaritma dari aktivitas ion Hydrogen.
pH = -log[H+].
pH dibentuk dari informasi kuantitatif yang dinyatakan oleh tingkat derajat keasaman atau basa yang berkaitan dengan aktivitas ion hydrogen. Nilai pH dari suatu unsur adalah perbandingan antara konsentrasi ion hydrogen [H+] dengan konsentrasi ion hidroksil [OH-]. Jika konsentrasi H+ lebih besar dari OH-, material disebut asam; yaitu., nilai pH adalah kurang dari 7. Jika konsentrasi OH- lebih besar dari H+, material disebut basa, dengan suatu nilai pH lebih besar dari 7. Jika konsentrasi H+ sama dengan OH- maka material disebut sebagai material netral. Asam dan basa mempunyai ion hydrogen bebas dan ion alkali bebas.Besarnya konsentrasi ion H+ dalam larutan disebut derajat keasaman.Untuk menyatakan derajat keasaman suatu larutan dipakai pengertian pH.
Atas dasar pengertian ini, ditentukan:
• Jika nilai pH = pOH = 7, maka larutan bersifat netral.
• Jika nilai pH < 7, maka larutan bersifat asam.
• Jika nilai pH > 7, maka larutan bersifat basa.
Pengukuran pH secara kasar bias dilakukan dengan kertas pH atau kertas indicator pH, dengan perubahan warna pada level pH yang bervariasi. Indicator ini mempunyai keterbatasan pada tingkat akurasi pengukuran, dan dapat terjadi kesalahan pengamatan warna yang disebabkan larutan sampel yang berwarna atau sampel yang keruh..
Pengukuran pH yang lebih akurat biasa dilakukan dengan menggunakan pH meter. Sestem pengukuran pH mempunyai tiga bagian yaitu elektroda pengukuran pH, elektroda reffernsi,dan alat pengukur impedansi tinggi. pH elektroda dapat diasumsikan sebagai battery, dengan voltase yang bervariasi hasil pengukuran dari pH larutan yang diukur.
Sejarah pH Meter
Sejarah pengukuran pH suatu larutan dengan menggunakan pH meter system elektrik dimulai pada tahun 1906 ketika Max Cremer dalam sebuah penelitiannya menemukan adanya interaksi dari aktivitas ion hydrogen yang dihubungkan dengan suatu sel akan menghasilkan tegangan listrik. Dia menggunakan gelembung kaca yang tipis yang diisi dengan suatu larutan dan dimasukan kedalam larutan yang lain dan ternyata menghasilkan tegangan listrik. Gagasan ini kemudian dikembangkan oleh Firtz Haber dan Zygmunt Klemsiewcz yang menemukan bahwa tegangan yang dihasilkan oleh gelembung kaca tersebut merupakan suatu fungsi logaritmis.
pH meter untuk penggunaan komersial pertama kali diproduksi oleh Radiometer pada tahun 1936 di Denmark dan Arnold Orville eckman dari Amerika Serikat. Penemuan tersebut dilakukan ketika Beckman menjadi assisten professor kimia di California Institute of Technology, dia mekatakan untuk mendapatkan metoda yang cepat dan akurat untuk pengukuran asam dari jus lemon yang diproduksi oleh California Fruit Growers Exchange (Sunkist). Hasil penemuannya tersebut
membawa dia untuk mendirikan Beckman Instruments Company (sekarang Beckman Coulter).
Prinsip Kerja pH Meter
Pada prinsipnya pengukuran suatu pH adalah didasarkan pada potensial elektro kimia yang terjadi antara larutan yang terdapat didalam elektroda gelas (membrane gelas) yang telah diketahui dengan larutan yang terdapat diluar elektroda gelas yang tidak diketahui. Hal ini dikarenakan lapisan tipis dari gelembung kaca akan berinteraksi dengan ion hydrogen yang ukurannya relative kecil dan aktif, elektroda gelas tersebut akan mengukur potensial elektrokimia dari ion hydrogen atau diistilahkan dengan potential of hydrogen. Untuk melengkapi sirkuit elektrik dibutuhkan suatu elektroda pembanding. Sebagai catatan, alat tersebut tidak mengukur arus tetapi hanya mengukur tegangan.
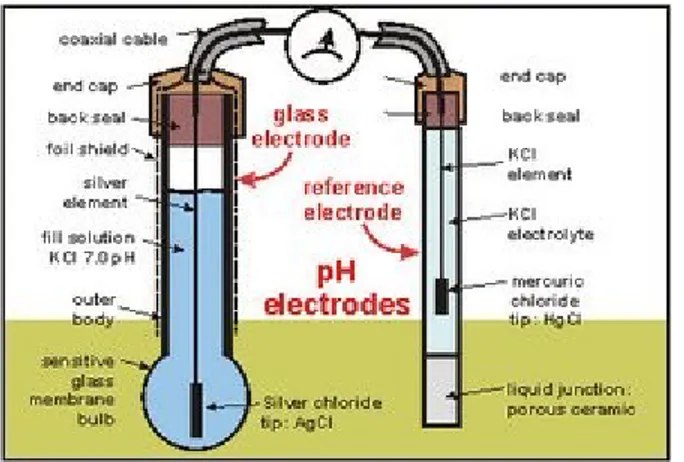
Gambar 1. Skema elektroda pH meter
pH meter akan mengukur potensial listrik (pada gambar alirannya searah jarum jam) antara merkuri Cloride (HgCl) pada elektroda pembanding dan potassium chloride (KCl) yang merupakan larutan didalam gelas electrode serta potensial antara larutan dan elektroda perak. Tetapi potensial antara sampel yang tidak diketahui dengan elektroda gelas dapat berubah tergantung sampelnya, oleh karena itu perlu
dilakukan kalibrasi dengan menggunkan larutan yang equivalen yang lainya untuk menetapkan nilai dari pH.
Elektroda pembanding calomel terdiri dari tabung gelas yang berisi potassium kloride (KCl) yang merupakan elektrolit yang mana terjadi kontak dengan mercuri chloride (HgCl) diujung larutan KCl. Tabung gelas ini mudah pecah sehingga untuk menghubungkannya digunkan ceramic berpori atau bahan sejenisnya. Elektroda semacam ini tidak mudah terkontaminasi oleh logam dan unsure natrium.
Elektroda gelas terdiri dari tabung kaca yang kokoh yang tersambung dengan gelembung kaca tipis yang. Didalamnya terdapat larutan KCl sebagai buffer pH 7. Elektroda perak yang ujungnya merupakan perak kloride (AgCl2) dihubungkan kedalam larutan tersebut. Untuk meminimalisir pengaruh electric yang gak diinginkan, alat tersebut dilindungi oleh suatu lapisan kertas pelindung yang biasanya terdapat dibagian dalam elektroda gelas. Pada kebanyakan pH meter modern sudah dilengkapi dengan thermistor temperature yaitu suatu alat untuk mengkoreksi pengaruh temperature. Antara elektroda pembanding dengan elektroda gelas sudah disusun dalam satu kesatuan.
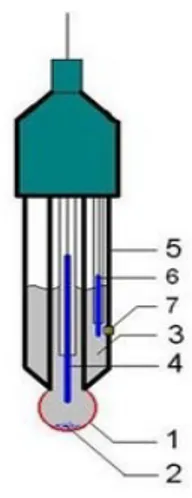
Gambar 2. Elektroda pH meter modern Keterangan gambar.
2. Sometimes the electrode contains a small amount of AgCl precipitate inside the glass electrode
3. Internal solution, usually 0.1M HCl for pH electrodes or 0.1M MeCl for pMe electrodes
4. Internal electrode, usually silver chloride electrode or calomel electrode 5. Body of electrode, made from non-conductive glass or plastics.
6. Reference electrode, usually the same type as 4
7. Junction with studied solution, usually made from ceramics or capillary with asbestos or quartz fiber.
Cara Penggunaan.
• Calibrasi
Sebelum pH meter digunakan, pH meter harus dikalibrasi terlebih dahulu dengan menggunkan standar pH atau sering disebut buffer pH. Standar pH adalah larutan yang nilai pH-nya telah diketahui pada setiap perubahan suhu. Standar pH merupakan larutan buffer pH (penyangga pH) dimana nilainya relative konstan dan tidak mudah berubah.
Urutan kerja kalibrasi pH meter adalah : 1. Siapkan buffer pH 7 dan buffer pH 4 2. Buka penutup plastic elektroda
3. Bilas elektroda dengan air DI (De Ionisasi/ air bebas ion) dan keringkan dengan menggunakan kertas tisu
4. Nyalakan pH meter dengan menekan tombol ON/OFF. 5. Masukan elektroda kedalam larutan buffer pH 7
6. Tekan tombol CAL dua kali, putar elektroda agar larutan buffer homogeny 7. Biarkan beberapa saat sampai nilai yang tertera di disply tidak berubah
8. Tekan tombol CAL satu kali lagi, dan biarkan tulisan CAL pada disply berhenti berkedip
9. Angkat elektroda dari larutan buffer pH 7, kemudian bilas dengan air DI beberapa kali dan keringkan dengan kertas tisu
10. Masukan elektroda kedalam larutan buffer pH 4
11. Tekan tombol CAL dua kali, putar elektroda agar larutan buffer homogeny 12. Biarkan beberapa saat sampai nilai yang tertera di disply tidak berubah
13. Tekan tombol CAL satu kali lagi, dan biarkan tulisan CAL pada disply berhenti berkedip
14. Angkat elektroda dari larutan buffer pH 4, kemudian bilas dengan air DI beberapa kali dan keringkan dengan kertas tisu
15. Pada layar bagian bawah akan muncul angka 7 dan angka 4 yang menunjukan pH meter tersebut telah dikalibrasi dengan buffer pH 7 dan buffer pH 4
16. pH meter telah siap digunakan
Pengukuran pH Larutan
Setelah pH meter dikalibrasi maka pH meter tersebut sudah siap digunakan. Biasanya kalibrasi disarankan dilakukan setiap 1 kali sehari sebelum digunakan. Cara pengukurannya adalah sebagai berikut :
1. Siapkan sampel larutan yang akan di check pH-nya.
2. Jika larutan panas, biarkan larutan mendingin sampai dengan suhunya sama dengan suhu ketika kalibrasi. Contohnya jika kalibrasi dilakukan pada suhu 20°C maka pengukuranpun dilakukan pada suhu 20°C.
3. Buka penutup plastic elektroda, bilas dengan air DI dan keringkan dengan menggunakan kertas tisu.
4. Nyalakan pH meter dengan menekan tombol ON/OFF.
6. Tekan tombol MEAS untuk memulai pengukuran, pada layar akan muncul tulisan HOLD yang kelapkelip.
7. Biarkan sampai tulisan HOLD pada layar berhenti kelap-kelip.
8. Nilai pH yang ditunjukan pada layar adalah nilai pH larutan yang di check 9. Matikan pH meter dengan menekan kembali tombol ON/OFF
Pemeliharaan pH Meter
pH meter harus dilakukan perawatan berkala untuk menjaga umur pakai dari alat tersebut. Pemeliharaannya meliputi :
a. Batere, penggantian batere dilakukan jika pada layar muncul tulisan low battery
b. Elektroda, pembersihan elektroda bisa dilakukan berkala setiap minimal satu minggu satu kali. Pembersihannya menggunakan larutan HCL 0.1N (encer) dengan cara direndam selama 30 menit, kemudian dibersihkan dengan air DI. c. Penyimpanan, ketika tidak dipakai, elektroda terutama bagian gelembung
gelasnya harus selalu berada pada keadaan lembab. Oleh karena itu penyimpanan elektroda disarankan selalu direndam dengan menggunkan air DI. Penyimpanan pada posisi kering akan menyebabkan membrane gelas yang terdapat pada gelembung elektroda akan mudah rusak dan pembacaannya tidak akurat.
d. Suhu penyimpan. Ketika disimpan, pH meter tidak boleh berada pada suhu ruangan yang panas karena akan menyebabkan sensor suhu pada alat cepat rusak.
Pada umumnya asam-asam anorganik berupa cairan pekat ada yang berasap atau bersifat korosif. Zat cair organik umumnya bersifat mudah menguap dan mudah terbakar. Asam-asam anorganik dan beberapa cairan organik sering harus disiapkan sebagai sediaan berupa larutannya yang lebih encer dalam suatu pelarut.
Teknik pengenceran cairan pekat asam anorganik dan cairan pekat organik pada dasarnya tidak begitu berbeda. Teknik pengenceran melibatkan teknik pengukuran volum dan teknik pelarutan(teknik pencampuran). Tentang kedua teknik ini, beberapa hal harus diperhatikan seperti diuraikan berikut ini:
a. Teknik pengenceran dari cairan pekat
pra pengenceran:
- hitung volume cairan pekat dan volume akuades yang akan diukur
- ukur volume akuades tersebut dan siapkan didalam gelas kimia teknik pengukuran volume cairan pekat
- mengingat sifat zat cair pekat, maka pengukuran vlumenya harus dilakukan diruang asam dan pembacaan skala volumenya harus sesegera mungkin
- sebaiknya menggunakan masker pencampuran atau pelarutan
- segera alirkan perlahan cairan pekat lewat batang pengaduk kedalam gelas kimia berisi akuades diatas.
- hitung balik, konsentrasi cairan hasil pengenceran; tambahkan sesuai dengan kekurangan akuades.
b. teknik pengenceran dari cairan kurang pekat
teknik pengenceran dari larutan tidak pekat menjadi larutan yang lebih encer(misal dari 3M ke 1M) lebih mudah dilakukan dan tidak perlu diruang asam. Caranya: ukur akuades(hasil hitung) dengan gelas ukur(berukuran sesuai dengan volume akhir larutan); kemudian tuangkan larutan lebih pekatnya kedalam gelas ukur tersebut sampai volumenya mendekati tanda batas; lanjutkan penambahan tetes per tetes sampai tanda batas volume akhir yang diharapkan.
sebelum melakukan perhitungan volume cairan, catatlah harga kadar/konsentrasi cairan yang akan diencerkan dari label kemasannya, dan tetapkan besarnya volume larutan encer yang hendak dibuat. Asam-asam pekat yang diperdagangkan, pada labelnya ditemukan dari harga molar, persen(b/b), dan massa jenisnya. Hubungan pengenceran Molar(M) hubungan matematis yang diterapkan:
V1 x M1 = V2 x M2
dimana: V= volume cairan(L), dan M= molaritas(mol/L)
Teknik Pelarutan
Pelarutan zat padat untuk menghasilkan larutannya sering dilakukan dalam kesehrian. Caranya, ” sejumlah zat padat dituangi sevolum pelarut” atau “sevolum pelarut dimasukkan sejumlah zat padat”; biasanya diikuti dengan pengadukan. Pembuatan larutan dari zat padat sebagai pereaksi itu untuk tujuan analisa kuantitatif atau untuk tujuan tertentu lainnya.
Pembuatannya harus melakukan perencanaan (termasuk perhitungan) sesuai dengan kebutuhan atau sifat analisis yang diterapkan (kualitatif atau kuantitatif). Bayangkan bila terjadi kesalahan, akibatnya adalah pemborosan zat kimia yang mahal, tenaga dan waktu hilang, data pengamatan yang tidak jelas, serta hasil analisis yang tidak tepat(salah).
Beberapa hal dan langkah tentang pembuatan larutan dari padatan dan teknik pelarutannya yang harus diperhatikan adalah:
a. Sifat analisis: tetapkan apakah akan melakukan analisis kuantitatif atau kualitatif(sesuaikan dengan tujuan analisis)
b. Kuantitas larutan(volum, konsentrasi): tetapkan sesuai dengan kebutuhan
c. Kuantitas zat padat(rumus, kelarutan, massa): tetapkan rumus zat padat(kristal), daya larut dan massa padatan yang akan dilarutkan(dihitung)
d. Sifat zat padat: tetapkan apakah stabil, higroskopis, atau dapat bereaksi dengan air.
e. Alat ukur massa(neraca): jika kualitatif gunakan neraca T atau Sa dan jika kuantitatif gunakan neraca T dan neraca A.
f. Alat ukur volum: jika kualitatif gunakan gelas ukur dan jika kuantitatif gunakan labu takar.
g. Pelarutan, meliputi:
- peralatan pendukung: siapkan gelas kimia, batang pengaduk, botol timbang, corong, pipet tetes, botol semprot, botol kemasan pereaksi.
- pelaksanaan: jika kualitatif pindahkan padatan kedalam gelas kimia dan larutkan dengan akuades secukupnya, lalu pindahkan kedalam gelas ukur dan tuang akuades sampai tanda batas. sedangkan jika kualitatif pindahkan dulu seluruh padatan kedalam gelas kimia dan larutkan dengan akuades secukupnya, lalu pindahkan seluruhnya secara kuantitatif kedalam labu takar lewat corong; tambahkan akuades sedemikian; keringkan bagian atas skala; lalu secara tetes per tetes sampai tanda batas volum; tutup labunya dan homogenkan.
- pengemasan: bilasi botol pereaksi hingga bersih/kering dengan sedikit larutan diatas, dan pindahkan seluruh larutan ke botol, tutup dan beri label dengan jelas.