TINJAUAN PUSTAKA
A. Hidroliiis proteinHidrolisis protein pangan dilakukan untuk berbagai tujuan, yaitu memperbaiki karakteristik nutrisi, menghambat kerusakan, memberi tekstur, meningkatkan atau menurunkan kelmtan, menambah sifat pembusaan dan koagulasi, menambah kapasitas emulsi, mencegah interaksi yang tidak diinginkan, menghilangkan of- flavor d m bau, dan menghilangkan r a m atau bahan-bahan penghambat (Lahl &
Brauq 1994). Menurutnya hidrolisat prdein sebagai bahan pangan dibagi ke dalam tiga generasi. Generasi pertama, hidrolisat kasein formula hipoalergenik yang sudah dipasarkan selama lebih dari 40 tahun, dengan karakteristik 70% mol komposisi asam amino bebas dan peptidanya tersusun oleh lebih dari 8 asam amino. Generasi kedua, hidrolisat protein whey dengan 4040% mol asam amino dan peptidanya tersusun -
oleh lebih dari '12 asarn amino, sudah dipasarkan lebih dari 10 tahun. Generasi ketiga, hidrolisat protein whey yang didapat beberapa tahun yang laly dengan karakteristik kurang dari 20% asam amino bebas dan peptidanya tersusun lebih dari IS asam amino
Menurut Fennema (1996), hidrolisis protein pangan menggunakan protease dapat mengubah sifat-sifat fbngsional protein asalnya. Sifat fungsional protein didefinisikan sebagai sifat fisik dan kimia yang mempengmhi perilah protein dalam sistem pangaxi selama proses pengolahan, penyimpanan, persiapan, dan pemakaian. Hidrolisis secara luas oleh protease non spesifik seperti papain menyebabkan kelarutan lebih tinggi pada protein yang sukar larut. Hidrolisat umumnya
mengandung peptida dengan berat molekul rendah, terdiri dari lebih h a n g 2 atau 4 sekuen asam amino. Giese (1994) menyebutkan protease mengkatalisis pemutusan ikatan peptida dan menghasilkan unit molekul lebih kecil atau peptida-peptida, dan unit-unit yang lebih kecil akan lebih mudah larut. Kelarutan suatu peptida dianggap sebagai proporsi nitrogen yang terkandung dalam produk protein yang terlarut dalam kondisi spesifik. Kelaiutan protein adalah sifat fingsional pertama yang biasanya ditentukan selama pengembangan dan uji bahan pangan protein baru (Zayas, 1997).
Kilara et al. (1996) menyatakan, kelarutan merupakan indikasi perubahan struktur protein dan penggunaan istilah "kelarutan" digunakan dalam literatur protein pangan sebagai kriteria untuk menentukan perubahan konformasi protein. Secara umum diakui bahwa protein dengan nilai kelarutan tinggi mengindikasikan protein yang serbaguna dan potensial dalam sistem pangan.
Ada 3 perubahan yang terjadi pada hidrolisis ikatan peptida yaitu kenaikan jumlah gugus terionisasi COO-) sehingga produk lebih bersifat hidrofilik, penurunan ukuran molekul rantai polipeptida sehingga sifat antigenisitas menurun tajam, dan perubahan struktur molekul membentuk stmktur hidrofobik yang terbuka terhadap lingkurlgan berair (Mahmoud, 1994). Zayas (1 997) menyatakan ha1 yang sarna yaitu, hidrolisis ikatan peptida dalam protein dapat meningkatkan jumlah gugus bermuatan dan sisi hidrofilik karena membukanya molekul protein, umumnya meningkatkan kelarutan dan menurunkan viskositas dan diamati dengan meningkatnya derajat hidrolisis. Dasar proses hidrolisis enzimatis adalah pemutusan ikatan peptida oleh enzim dengan bantuan air, secara kimiawi digambarkan sebagai berikut (Peterson,
Konsep modifikasi protein secara enzimat is bukanlah ha1 yang baru, perolehan kembali (recovery) protein dari bahan sisa atau limbah protein hewan sudah mengalami perkembangan yang tinggi (Cowan, 1983).
Berlangsungnya proses hidrolisis diukur dengan rasio ANITN, jumlah amino nitrogen yang ada dalam hidrolisat relatif terhadap jumlah nitrogen total dalam substrat (Lahl & Braun, 1994). AN ditentukan dengan titrasi formaldehid dan
TN
ditentukan dengan kjeldahl. Pernyataan yang sama dinyatakan oleh Mahmoud (1994) bahwa derajat hidrolisis atau pemutusan ikatan peptida yang terjadi pada protein dapat digambarkan oleh rasio amino nitrogen dan total nitrogen atau persen ikatan peptida yang terputus. Derajat hidrolisis digunakan dalam mengontrol proses sehingga dapat menentukan dengan jelas sifat-sifat hidrolisat seperti kelmtan, sifat kngsional dan rasa (j'hvor). Sifat fbngsional intrinsik seperti viskositas, pembusaan dan emulsifikasi protein dapat dioptimasi dengan mengontrol proses (Peterson,
1981). Ukuran rantai polipeptida yang dihasilkan dapat divariasikan dengan mengatur rasio enzim terhadap substrat dan mengubah-ubah waktu hidrolisis.
Mahmoud (1994) melaporkan sifat-sifat fisikokimia dan sifat fbngsional hidrolisat protein pada produk-produk nutrisi. Hidrolisat protein yang digunakan dalam formulasi nutrisi umumnya dibagi atas dua kategori, yaitu hidrolisis sebagian dpartiaZ) dan hidrolisis secara keseluruhan (extensive). Masing-masing produk memiliki sifat-sifat yang berbeda, yang mempengaruhi penggunaannya pada produk akhir. Penggolongan hidrolisat protein berdasarkan berat molekul fraksi yang terbentuk pada proses hidrolisis ditunjukkan pada Tabel 1.
Tabel 1. Profil berat molekul hidrolisat protein pada penggolongan yang berbeda*
Seleksi enzim atau campuran enzim seringkali menjadi dasar kemampuan hidrolisis substrat menjadi produk yang diinginkan &ah1 & Braun, 1994). Untuk formula terhidrolisis tinggi, rasio ANtTN umumnya 50 atau lebih besar, bahkan untuk formula tertentu membutuhkan nilai AN/TN lebih besar dari 60. Larutan enzim murni terbatas kapasitas hidrolisisnya, contohnya larutan enzim tanaman memiliki batasan derajat hidrolisis dengan nilai rasio AN/TN maksimum sekitar 35. Daerah yang lebar dari hidrolisat terhidrolisis sebagian didefinisikan dengan rasio ANITN yang bervariasi antara 2-67%.
Sifat fbngsional hidrolisat protein dipengaruhi oleh spesifisitas enzim proteolitik yang digunakan, sifat fisik dan kimia protein bahan baku, dan kondisi hidrolisis. Protease digolongkan menurut spesifisitas ikatan peptida yang diserangnya dan mekanisme aksinya. Protease adalah enzim yang memiliki aktivitas endo-peptidolitik yaitu memutuskan ikatan peptida di dalam rantai polipeptida protein. Stauffer (1989) menyebutkan bahwa protease tidak akan menghidrolisis ikatan peptida jika gugus R memiliki gugus amino bebas (gugus N terminal) atau jika R memiliki gugus karboksil
(dalton) < 500
>5000
Derajat hidrolisis (Oh dalam tiap fraksi) Ringan 3.8 1.1 1.8 3.7 89.7 Sedang 9.8 13.5 13.7 16.6 46.4 Ekstensif 90.2 5.5 2.9 1.4 0
bebas (gugus C terminal). Papain adalah protease sistein yang memiliki range pH dan spesifisitas yang lebar.
Pada protein yang terdiri atas 20 asam amino yang berbeda, ada 380 ikatan peptida yang berbeda yang dapat dibuat oleh protein dan dapat menjadi sasaran aksi enzim. Enzim tertentu hanya memutuskan ikatan tertentu yang secara fisik cocok dengan enzim. Pada protein alami (native), ikatan seringkali dilindungi dalam struktur tiga dimensi dan hal ini dapat menghambat proses hidrolisis (Peterson 1981). Interaksi kompleks antara sifat substrat dan sifat enzim dalarn hubungannya dengan pH, temperatur, dan tujuan produk akhir menunjukkan bahwa kondisi proses hidrolisis
adalah spesifik untuk substrat dan enzim tertentu (Peppler, 1982).
Proses hidrolisis protein secara enzimatis dilakukan dengan melarutkan sejurnlah tertentu bahan berprotein ke dalarn air dan selanjutnya ditambahkan sejumlah tertentu enzim protease. Kondisi lingkungan hidrolisis seperti pH clan suhu diatur sekai dengan lingkungan yang cocok bagi aktivitas enzim tersebut agar aktivitas enzim optimum. Hidrolisis dilakukan dalam waktu tertentu untuk mendapatkan produk sesuai dengan karakteristik yang diinginkan. Untuk menghentikan proses dapat dilakukan dengan mengatur pH dan secara bersamaan mengatur temperatur karena sebagian enzim sensitif atau rusak terhadap panas (Cowan, 1983). Cara lain untuk menghentikan proses hidrolisis adalah memisahkan enzim dengan membran ultrafiltrasi. Pembuatan hidrolisat protein dengan bantuan membran ultrafiltrasi tidak hanya untuk menghentikan proses atau memisahkan enzim, tetapi juga memberikan distribusi normal asam amino dan peptida pendek tanpa memerlukan derajat hidrolisis yang tinggi (Lahl & Braun, 1994). Parameter penting untuk sebagian besar
produk komersial adalah temperatur, waktu, pH, dan rasio ANITN. Kondisi hidrolisis dikontrol untuk mendapatkan karakteristik produk yang spesifik seperti distribusi asam amino, distribusi berat molekul, dan jurnlah protein residu utuh. Waktu hidrolisis berhubungan langsung dengan rasio AN/TN, sernakin panjang waktu hidrolisis semakin tinggi nilai AN/TN. Penentuan berat molekul menggunakan kromatografi dengan kolom filtrasi gel memberikan korelasi positif antara ukuran molekul dan berat molekul.
B. Protein kedelai
Protein adalah komponen yang membentuk
+
40% total padatan kedelai. Sekitar 90% protein tersebut dapat diekstraksi dengan air dan mengendap pada pH 4.5-
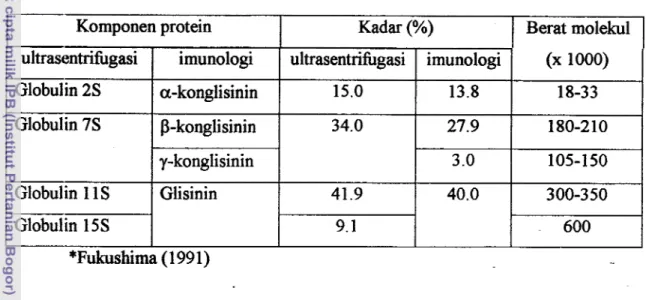
4.8, disebut: globulin kedelai (Fukushima, '1991). Berdasarkan laju sedimentasi ultrasentrifhgasi, -globulin kedelai disusun oleh 4 komponen yaitu 2S, 7S, 1 1 S, dan 15s dan yang paling utarna adalah 7 s dan 1 1 S. Kadar nitrogen, karbohidrat, dan komposisi asam amino globulin 7 s dan 1 1 s berbeda, hal ini mempengaruhi struktur dan sifat fbngsionalnya, terutama karena pengaruh radikal -SH dan ikatan S-S. Globulin 7 s tidak memiliki radikal -SH dan memiliki 2 ikatan S-S, sebaliknya globulin 11s memiliki 2 radikal -SH dan 20 ikatan S-S. Tabel 2 menunjukkan komponen protein globulin kedelai.Kilara et al. (1996) menyatakan kira-kira 80% protein kedelai memiliki bobot molekul lebih besar dari 10.000, menunjukkan struktur berorde tinggi, atau ada interaksi antar protein. Protein 7 s dan 11s dapat membentuk ikatan disulfida intermolehler dan mengakibatkan protein kedelai sukar larut, kekeruhan tinggi, dan
viskositas meningkat. Kedua fraksi 7 s dan 1 1 S memiliki struktur kompleks kuartener dan kecendenlngan yang tinggi ke arah reaksi asosiasi-disosiasi. Fraksi-fraksi tersebut memiliki kandungan a-helik rendah dan struktur utarna adalah f! antiparalel dan daerah tidak teratur.
Tabel 2. Komponen protein globulin kedelai
*
1 I I
ultrasentrifbgasi
I
imunologiI
ultrasentrifbgasiI
imunologiI
(x 1000)1
Komponen protein Kadar (%)
1
Berat molekulI
I I I I
Globulin 2s
I I I I
Faktor-faktor yang mempengaruhi laju dan terjadinya hidrolisis protein secara Globulin 7s
Globulin 1 1 S
enzimatis adalah spesifisitas substrat terhadap enzim, modifikasi rantai samping asam a-konglisinin
amino substrat protein, dan struktur tiga dimensi substrat protein (Fukushima, 1991). P-konglisinin
Glisinin
Produk. yang mengandung protein kedelai umumnya diberi perlakuan panas untuk 15.0
menginaktifkan berbagai faktor antinutrisi (Kilara et al., 1996). Daya cerna protein 34.0
41.9
kedelai oleh enzim dipengaruhi oleh kondisi selarna perlakuan panas kedelai. Protein 13.8
asalnya lebih tahan terhadap proteolisis tergantung pada derajat pembukaan struktur 18-33 27.9
40.0
(unfolding) molekul substrat protein. Gambar l a dan 1 b masing-masing menu~jukkan 180-210
300-350
hidrolisis enzimatis pada molekul protein terikat (protein asal) clan hidrolisis enzimatis pada molekul terbuka (protein terdenaturasi).
a. hidrolisis enzimatis protein terikat (protein native) Catalytic s i t e ' a Active
a
6.' Bindinc rite center -.b. hidrolisis enzimatis pada molekul protein terbuka (protein terdenaturasi)
Gdmbar 1. Skema hidrolisis enzimatis protein terdenaturasi (Fukushima, 1991) Romagnolo et al. (1990) melaporkan analisis dengan SDS-PAGE, ada dua komponen besar dalarn protein kedelai yaitu P-konglisinin dan konglisinin.
P-
konglisinin terpisah dalam 3 spot yang diperkirakm memiliki berat molekul masing- masing 83.2, 72.4, dm 48.4 kDa. Glisinin memiliki 2 pita polipeptida yang diidentifikasi sebagai sub unit asarn dan basa dengan perkiraan berat molekul 38.9 dan 20.7 m a . Dilaporkan pula bahwa P-konglisinin lebih mudah terdegradasi pada rumen sapi dari glisinin. Resistensi glisinin terhadap degradasi ruminal diduga ada hubungannya dengan struktur fisik dm kimianya. Sub unit asam dan basadihubungkan dengan ikatan disulfida intermolekuler dan sebagian besar bagian dalam molekul glisinin dilindungi oleh ikatan S-S. Dijelaskan pula gabungan gaya elektrcrstatik dan hidrofobik terlibat dalam mempertahankan struktur tersier glisinin. De
Rm
et al. (1995) menyatakan ha1 yang sama bahwa P-konglisinin dihidrolisis lebih cepat dari glisinin pada fermentasi Tempe dengan Rhizopus oligo~porus. Lei et al. (1983) melaporkan hasil analisis dengan elektroforetik dua dimensi, didapatkan protein kedelai terdiri dari glisinin (13 komponen asam, 11 komponen basa), j3- konglisinin (6 komponen), lektin (4 komponen), clan inhibitor tripsin Kunitz.Muchtadi (1986) menyatakan bahwa perlakuan panas pada kedelai seperti perebusan, dapat meningkatkan daya cerna protein kedelai disebabkan oleh hilangnya antitripsin dalarn protein kedelai. Dengan kata lain inhibitor tripsin yang terdapat pada protein kedelai labil terhadap panas. Bungkil kedelai adalah sisa dari proses ekstraksi minyak kedelai. Proses ekstraksi minyak kedelai yang melibatkan panas memberi nilai positif pada protein bungkil kedelai karena bahan penghambat tripsin rusak oleh pemanasan sehingga protein bungkil kedelai diperkirakan akan lebih mudah terhidrolisis dibandingkan protein kedelai utuh. Santosa et al. (1998) melaporkan komposisi kimiawi bungkil kedelai yaitu kadar air, kadar abu, kadar lemak, kadar protein, karbohidrat, asam fitat, antitripsin masing-masing sebesar (9.3; 4.0; 1.2; 45.1; 40.4; 1.8)0/0 dan 17.7unitImg. Dilaporkan pula pH suspensi cairan bungkil kedelai yang diperoleh pada penelitian tersebut adalah 5.6.
C.
PeptonPepton dan proteosa dijelaskan dalam terminologi sebagai bahan antara peptida dan protein. Proteosa didefinisikan sebagai kelompok turunan protein antara protein asal dan pepton sedangkan pepton adalah campuran larut air dari proteosa dan asam amino tuninan albumin, daging atau susu. Sifat-sifatnya antara lain larut dalam air, tidak terkoagulasi atau tahan terhadap panas, tetapi dapat diendapkan dengan amonium sulfa. dm seng sulfat Pepton digunakan sebagai nutrisi media dalarn bakteriologi (Peterson & Johnson, 1978).
Pepton dapat dibuat dari bahan yang mengandung protein melalui hidrolisis asam atau enzimatis. Pepton memiliki kemampuan yang berbeda dalam menunjang pertumbuhan bakteri tergantung pada jenis protein yang digunakan dan proses pembuatannya. Bridson & Brecker (1970) menyebutkan kandungan protein bahan b a h pembuatan pepton untuk media perhunbuhan bakteri dapat bervariasi, dari protein hewan dengan kadar 50-90% berat kering sampai pada protein beberapa seralia yang mengandung protein h a n g dari 1%. Dijelaskan pula pepton adalah hidrolisat protein yang dapat dibuat dari bahan-bahan berprotein seperti daging, ikan, kasein, gelatin, keratin, tepung kedelai, khamir, biji kapas, biji bunga matahari, dan lain-lain. Hidrolisis enzimatis protein tersebut dapat dilakukan dengan berbagai enzim proteolitik atau protease. Protease mengkatalisis proses hidrolisis protein kompleks menjadi larutan campuran polipeptida, dipeptida, dan asam amino yang secara keseluruhan disebut pepton. Komposisi kimia pepton tidak diketahui secara tepat. Produksi pepton dalam skala besar umumnya menggunakan papain, tripsin, atau pepsin (Bridson & Brecker, 1970). Proteolisis dalam skala besar hams dikontrol
dengan ketat untuk memperoleh hasil maksimal dan kualitas hidrolisat standar. Ciri yang paling penting dari pepton bakteri adalah penarnpakannya sebagai sumber nitrogen untuk mendukung pertumbuhan bakteri. Analisis kimia hanya dapat digunakan sebagai penunjuk yang tepat dalam mengevaluasi karakteristik pepton. Analisis tipikal untuk identifikasi pepton adalah total nitrogen, total nitrogen proteosa, nitrogen proteosa primer, nitrogen
asam
amino bebas, dan nitrogen amino.Bailey (1992) menyatakan bahwa protein adalah molekul besar yang biasanya mengaadung paling sedikit 50 residu asam amino d m kadang-kadang lebih dari 100.
Ciri paling penting dari protein adalah memiliki struktur tiga dimensi yang kompleks. Dijelaskan bahwa protein memiliki struktur primer yaitu merupakan sekuen residu asam amino, struktur sekunder yaitu bentuk yang dihubungkan dengan struktur spesifik dalarn molekul, d m struktur tersier yaitu keseluruhan bentuk molekul tiga dimensi. Peptida adalah molekul yang lebih kecil, biasanya mengandung h a n g dari
50 asam amino, wnurnnya tidak memiliki
stnrktur
3 dimensi yang kompleks. Perbedaan antara peptida dan protein kadang-kadang tidak jelas khususnya pada ukuran molekul 15 sampai 50 residu, komponen ini disebut sebagai polipeptida.D. Pratease Papain
Secara umum protease dapat dibagi ke dalam dua golongan yaitu proteinase dan peptidase. Proteinase mengkatalisis hidrolisis molekul protein menjadi fiagrnen- fiagmen besar, sedangkan peptidase mengkatalisis fragmen polipeptida menjadi asam amino (Suhartono, 1992). Dilihat dari letak pemutusan ikatan peptida, protease dibedakan menjadi endopeptidase dan eksopeptidase. Endopepticlase memutuskan
ikatan peptida yang berada di dalam rantai protein sehingga dihasilkan peptida dan polipeptida, sedangkan eksopeptidase menguraikan protein dari ujung rantai sehingga dihasilkan satu asam amino dan sisa peptida. Ditinjau dari lingkungan daya kerjanya, protease dapat digolongkan menjadi protease asam (bekerja pada pH asam), protease netral (bekerja pada pH netral), dan protease alkalis (bekerja pa& pH basa). Berdasarkan sifat kimia dan sisi aktifnya diienal empat golongan protease, yaitu protease serin, protease sulfhidril, protease metal, dan protease asam (Suhartono, 1992). Protease serin adalah enzim yang mempunyai residu serin pada sisi aktifnya dan merupakan endopeptidase, protease sulfhidril adalah enzim yang aktivitasnya bergantung pada adanya satu atau lebih residu sulfhidril pada sisi aktifhya dan disebut juga sebagai protease ti04 protease metal adalah protease yang aktivitasnya tergantung pada adanya logam, dan protease asam adalah enzim yang
-
keaktivannya disebabkan oleh adanya dua gugus karboksil pada sisi aktifhya. Berdasarkan perjanjian internasional, semua protease termasuk ke dalam golongan enzim yang diberi nomor 3.4.
Berdasarkan sifat-sifat kimianya, papain digolongkan sebagai protease sulfhidril (Muchtadi et al., 1992). Papain adalah protein sederhana berupa sebuah rantai tunggal polipeptida yang terdiri dari 212 residu asam amino dengan sistein-25 tempat gugus aktif ti01 (-SH) esensial. Papain mempunyai titik isoelektrik pada pH 8.75 dan berat molekul 21.000
-
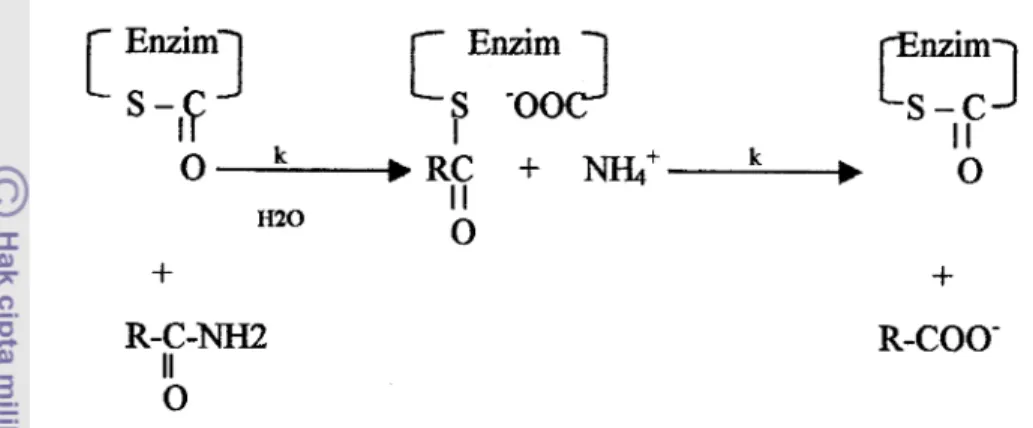
23.700 dalton, mengandung unsur sulfur 1.2% (Leung, 1996). Aktivitas papain dipengaruhi banyak faktor seperti suhy pH, kelcuatan ion, dan tekanan, juga dipengaruhi oleh sisi aktifnya yang mengandung gugus sulfhidril. Gugus sulfhidril ini berperan dalam reaksi hidrolisis substrat, dan ikatan kovalentioester terbentuk sebagai produk intermediet. Mekanisme pembentukan tioester antara gugus karboksil d m sulfhidril protein papain ditunjukkan pada Gambar 2,
R-COO-
Gambar 2. Mekanisme reaksi hidrolisis yang dikatalisis oleh enzim papain (Cunningham, 1965 dalam Muchtadi et al., 1992)
Spesifisitas papain diketahui luas, tidak spesifik, dapat menghidrolisis protein, peptida berukuran kecil, amida pada residu asam amino seperti arginin, lisin, glutamin, histidin, glisin, dan tirosin. Papain aktif rnenghidrolisis golongan ester dan amida dan dihambat oleh oligopeptida yang memiliki fenilalanin pada asarn amino kedua di sisi karboksil. Kemampuan hidrolisis papain pada sebagian besar substrat protein lebih ektensif dari protease lainnya seperti tripsin dan pepsin (Leung, 1996).
Belitz & Grosch (1999) menyatakan papain tennasuk protease sistein. Aktivitas enzim ini berada pada daerah pH yang luas dan tergantung pada substrat (4.5-10) dengan aktivitas maksimum pada pH 6-7.5. Residu sistein berada pada sisi aktif Enzim papain sangat sensitif terhadap zat pengoksidasi seperti ion logam atau zat pengemulsi, dapat diaktifkan oleh zat pereduksi seperti sistein dan zat pengkelat seperti EDTA (etilen diamin tetra asetat). Papain merupakan enzim hidrolase yaitu dapat mengkatalisis reaksi-reaksi hidrolisis suatu substrat (protein) dengan kode E.C.
3.4.22 2. Analisis difraksi sinar-X menunjukkan bahwa molekul papain berbentuk seperti telur dengan ukuran 36x36~48 Angstrom (Suhartono, 1992).
Papain kasar dapat diisolasi dari buah pepaya mentah dengan cara mengiris permukaan buah, mengumpullcan getahnya dan dilanjutkan dengan pengeringan menggunakan sinar matahari atau alat pengering. Leung (1996) menyebutkan kualitas dan aktivitas papain kasar sangat bervariasi tergantung pada proses pengeringan. Pengeringan dalam waktu singkat pada temperatur di bawah 50 OC menghasilkan
produk yang lebih bersih dan lebih aktif Aktivitas proteolitik papain juga dipengaruhi oleh jenis buah, umur buah, dan penanganan pasca panennya (Muhidin, 2000). Buah pepaya berumur tiga bulan setelah berbunga atau tepat sebelum pektin hadir akan menghasilkan papain yang paling baik atau disebut super papain kasar. Teknik pengendapan dengan alkohol dapat menghasilkan perolehan papain dengan aktivitas lebih tinggi dan menurunkan kadar impuritis logam pada produk akhir.
Suhartono (1989) menyatakan pH optimum papain adalah 4.5-7, suhu optimum 60-75 OC. Winarno (1986) menyatakan kestabilan enzim papain baik sekali pada larutan yang mempunyai pH 5.0, pH optimal untuk substrat kasein adalah 7.0 dan substrat gelatin 5.0. Papain mempunyai daya tahan panas lebih tinggi dari enzim lain. Keaktifan enzim papain hanya menurun 20% pada pemanasan 70 OC selama 30 menit
pada pH 7.0. Papain dalam bentuk bubuk tahan terhadap panas kering 100 OC selama
3 jam (Leung, 1996). Temperatur optimal papain secara normal berada pada 60-70
0
C.
Papain banyak digunakan di bidang obat-obatan, f m a s i , dan kosmetik. Dalam bidang pangan umumnya digunakan sebagai pengempuk daging, digunakan juga
sebagsi penjernih bii dan hidrolisat protein (Winarno, 1986; Muchtadi et al., 1992; Suhartono, 1992; Leung, 1996).
E.
KhamirKhiamir termasuk fungi, tetapi dibedakan dari kapang karena bentuknya yang terutarna uniseluler. Khamir dapat dibedakan atas dua kelompok berdasarkan metabolismenya, yaitu bersifat fermentatif dan oksidatif Khamir fermentatif dapat melakukan fermentasi alkohol, yaitu memecah glukosa melahi jalur glikolisis, namun dapat bersifat oksidatif bila tersedia cukup oksigen (Fardiaz, 1992).
Khamir dari jenis Saccharomyces uvarum atau S. carlsbergensis adalah khamir fermentatif kuat yang umumnya digunakan pada fermentasi bir. Khamir turnbuh berlipat ganda lebih dari 10 fold selama fermentasi, dan dipisahkan dari bir. Walaupun seb.agian diperlukan - untuk penarnbahan pada fermentasi berikutnya, sekitar
YI
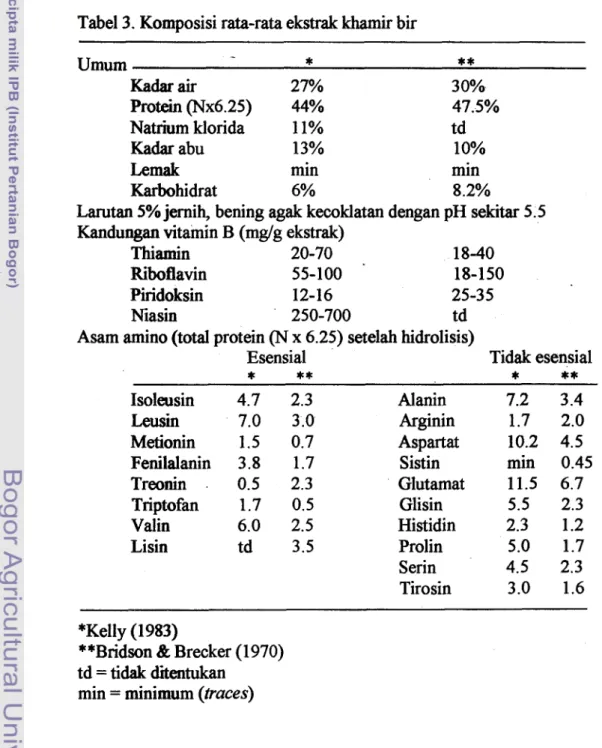
merupakan limbah atau berlebih. Pemanfaatan limbah ini di Inggris antara lain urltuk pakan ternak karena mengandung protein tinggi dan vitamin B, sebagian dibuat dalam benhrk tablet untuk keperluan farmasi, namun umumnya digunakan untuk menghasilkan ekstrak khamir, produk yang komersial sejak akhir abad 19 (Kelly, 1983). Ekstrak khamir secara sederhana didefinisikan sebagai konsentrat zat terlarut yang diperoleh dari suatu perlakuan terhadap protein khamir, rnisalnya hidrolisis asam atau penghancuran sel secara mekanik. Atmaka (1997) melaporkan ekstrak khamir yang dihasilkan dari penghancuran sel secara mekanik dapat memperbaiki sifat-sifat fbngsional proteinnya menjadi lebih baik. Jenis dan konsentrasi pelarut serta pH, mempengaruhi perolehan produk. Jika prosesmelibatkan hidrolisis enzimatis rnaka tujuannya adalah untuk mendegradasi strulctur makromolekul dari protein khamir menjadi zat terlarut dalarn jumlah rnaksimum pada nilai komersial yang dapat diterima (Kelly, 1983). Komposisi ekstrak khamir dari fermentasi bir ditunjukkan pada Tabel 3. Ditinjau dari nilai nutrisinya rnaka ekstrak khamir cocok digunakan sebagai media pertumbuhan mikroba dan produk flavor.
Tabel 3. Komposisi rata-rata ekstrak khamir bir
Umum -
*
**
Kadar air 27% 30%
Protein (Nx6.25) 44% 47.5%
Natrium klorida 11% td
Kadar abu 13% 10%
Lemak min min
Karbohidrat 6% 8.2%
Larutan 5% jernih, bening agak kecoklatan dengan pH sekitar 5.5 Kandungan vitamin B (mglg ekstrak)
Thiamin 20-70 18-40
Riboflavin 55-100 18-150
Piridoksin 12-16 25-35
Niasin 250-700 td
Asam amino (total protein (N x 6.25) setelah hidrolisis)
Esensial Tidak esensial
*
-**
*
* *
Isoleusin 4.7 2.3 Leusin 7.0 3.0 Metionin 1.5 0.7 Fenilalanin 3.8 1.7 Treonin . 0.5 2.3 Triptofan 1.7 0.5 Valin 6.0 2.5 Lisin td 3.5 - AIanin Arginin Aspartat Sistin Glut amat Glisin Histidin Prolin Serin Tirosin 7.2 3.4 1.7 2.0 10.2 4.5 min 0.45 11.5 6.7 5.5 2.3 2.3 1.2 5.0 1.7 4.5 2.3 3.0 1.6 *Kelly (1 983)**Bridson & Brecker (1970) td = tidak ditentukan
Sel khamir limbah industri bir dapat dimanfaatkan sebagai autolisat dan hidrolisat khamir yang berfbngsi sebagai sumber pepton (Peppler, 1979). Rasa pahit dari komponen hop dapat dihilangkan dengan mencuci sel dengan larutan sedikit basa satu atau dua kali selanjutnya disentrifbgasi dan dikeringkan. Ekstrak khamir yang mengandung resin hop dapat menghambat pertumbuhan mikroorganisme.
Hidrolisis khamir umurnnya dilakukan dengan asam dan panas tinggi (Peppler, 1982), namun ha1 ini mendapat perhatian dewasa ini karena kandungan garam pada produk akhir menjadi tinggi akibat penetralan
(Reed
& Nagodawithana, 1991). Hidrolisis asam dapat menyebabkan beberapa asam amino membentuk rasemisasi sehingga menyebabkan daya cerna protein berkwang karena ikatan peptida pada residu asam amino D kurang efisien terhidrolisis oleh protease dan juga mendukung kehilangan asam amino esensial. D prolin dilaporkan bersifat neurotoksik (Fennema, 1996). Kandungan lisinoalanin (LAL) pada produk protein pangan yang diperlakukan dengan panas tinggi dan asarn didapatkan tinggi. LAL selain menurunkan asarn amino lisin juga merupakan produk yang tidak bernilai gizi. Hidrolisis asam pada suhu tinggi juga dilaporkan dapat menghasilkan produk samping 3MCPD (mono~oro propandiol), yang b e h g s i sebagai prekursor 1,3 DCP (dikloro propandiol) yang bersifat karsinogenik (Anonim, 200 1).Menurut Peppier (1982), autolisat khamir dapat diperoleh dari proses autolisis yaitu penghancuran sel oleh enzim yang ada di dalam sel dan merupakan proses alamiah akibat dari penuaan sel, prosesnya relatif lama sehingga jarang digunakan dalam industri. Pemanasan 45-65 OC dan agitasi dapat mempercepat proses autolisis.
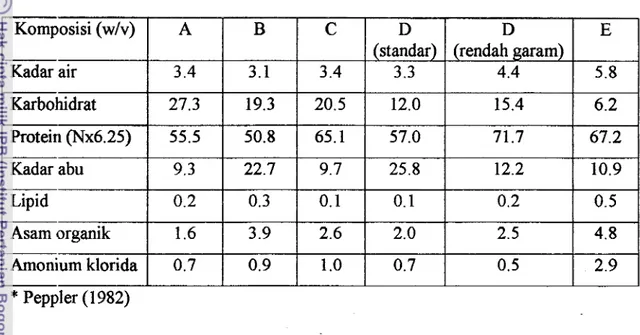
ditunjukkan pada Tabel 4. Perbedaan dalam komposisi menunjukkan derajat keragaman (degree of variability) dari komposisi khamir asalnya dan kondisi proses yang berbeda.
Tabel 4. Analisis proksimat beberapa autolisat kharnir komersial*
Kadar air
1
3.41
3.11
3.4 Komposisi (wlv) A B 1 I I Karbohidrat1
27.31
19.31
20.5 - C Kadar abu1
9.31
22.71
9.7 I I I Lipid(
0.21
0.31
0.1 Protein (Nx6.25) I I I Arnonium klorida1
0.71
0.91
1 .O Asam organik I I I*
Peppler (1982) 65.1 55.5 50.8 1.6Ekstrak khamir pada dasarnya adalah campuran asam amino dan peptida, vitamin
larut air, dan karbohidrat. Karbohidrat utarna pada khamir adalah glikogen dan trehalosa, substansi ini diubah menjadi glukosa oleh hidrolisis enzim pada saat ekstraksi. Poliheksosa seperti glukan dan manan tetap berada dalam dinding sel dan dapat tlipisahkan atau terbawa bersama zat tidak terlarut (Peppler, 1982).
Penambahan protease dapat meningkatkan produk akhir, peran protease adalah untuk meningkatkan laju kelarutan dan produk akhir. Papain mempercepat pemutusan ikatan lisin, arginin dan fenilalanin pada protein khamir (Kelly, 1983). Papain juga mengandung lisozim yang dapat membantu merusak dinding sel khamir.
(st andar) 3.3 3.9 (rendah garam) 4.4 2.6 5.8