KULTIVASI Spirulina
Cultivation of Spirulina
Venny Santosa
1,2dan Leenawaty Limantara
1 1)Program Magister Biologi, Program Pascasarjana – Universitas Kristen Satya Wacana 2) PT Pasific Millenia Indonesia
Pendahuluan
Proses bioteknologi terhadap ganggang biru hijau makin berkembang dan diminati akhir-akhir ini. Perkembangan ini dipicu oleh makin terkuaknya potensi besar yang dimiliki oleh spesies-spesies di dalamnya. Di antara spesies tersebut, Spirulina merupakan strain yang memiliki potensi besar. Selain sebagai alternatif sumber makanan baru, strain ini memiliki kandungan bahan aktif yang dapat digunakan untuk berbagai terapi kesehatan. Kandungan bahan aktif tersebut terdapat dalam pigmennya (klorofil, karoten dan fikosianin).
Semakin majunya teknologi dan pengetahuan manusia, tuntutan terhadap kesehatan pun bertambah. Makanan yang tersedia diharapkan masuk dalam kelompok ‘makanan sehat’, yaitu makanan yang tidak berbahaya dan memberikan efek positif bila dikonsumsi. Spirulina termasuk dalam makanan sehat karena telah menjalani uji klinis dan memberikan efek seperti peningkatan energi dan kesegaran.
Kultivasi Spirulina demi kepentingan manusia telah dilakukan sejak dahulu kala. Perkembangan pengetahuan memungkinkan pengembangan teknik kultivasi konvensional untuk menghasilkan produktivitas yang lebih tinggi, maupun manipulasi komposisi sel sesuai tujuan kepentingan.
Habitat Alami Spirulina dan Persyaratan Tumbuh
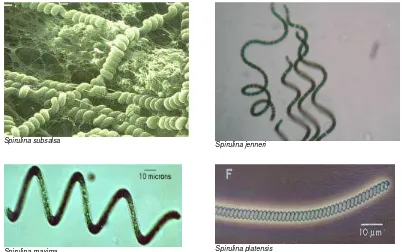
Strain Spirulina umum ditemukan secara alami di perairan beralkalinitas tinggi, yang mengandung karbonat atau bikarbonat. Sampai saat ini sudah diidentifikasi 35 spesies Spirulina. Spesies-spesies yang banyak dikenal antara lain: S. platensis, S. major, S. princes, S. laxissima, S. subtilissima, S. caldaria, S. curta, S. subsalsa dan S. spirulinoides. Ciri-ciri sel Spirulina ialah sebagai berikut: sel berbentuk silinder dan bersepta, berwarna biru kehijauan, diameter 6–8 µm (S. platensis), 4–6 µm (S. maxima), memunyai granula sitoplasma berisi gas. Sel membentuk filamen tidak bercabang berbentuk heliks, dengan ukuran 3–5 mm. Filamen motil, meluncur sepanjang aksisnya dan tidak ditemui heterosista. Kondisi pertumbuhan tertentu dapat menyebabkan perubahan pada bentuk spiralnya, diameter sel, maupun kandungan selnya. Spesies yang banyak dikutivasi adalah S. platensis. Alasan pemilihan spesies tersebut di antara banyak spesies Spirulina, karena S. platensis ditemui di berbagai lokasi dengan
Korespondensi penulis: Venny Santosa
Program Magister Biologi, Program Pascasarjana Universitas Kristen Satya Wacana
Jl. Diponegoro 52-60 Salatiga, 50711
kondisi lingkungan yang berbeda. Realita ini mengindikasikan bahwa Spirulina mudah ditumbuhkan, tidak membutuhkan terlalu banyak persyaratan tumbuh. Selain S. platensis, spesies yang sudah digunakan dalam produksi masal adalah S. maxima. Spesies ini merupakan penghubi asli Danau Texcoco, Meksiko dan juga banyak ditemukan di berbagai lokasi di alam. Tujuan awal pemanfaatan danau ini mula-mula untuk ekstraksi soda, namun kemudian diperoleh hasil sampingan S. maxima, yang tumbuh subur tanpa perawatan. Dengan luas permukaan 900 ha dan diameter 3 km, produksi harian S. maxima mencapai 2 ton berat kering.
Spirulina subsalsa
Spirulina jenneri
Spirulina maxima Spirulina platensis
Gambar 1. Perbesaran mikroskopik Spirulina
Salah satu habitat alami Spirulina adalah Danau Chad, Afrika. Zarrouk menganalisis nutrien yang terdapat pada danau tersebut dengan hasil sebagai berikut: kandungan natrium 9.64 g/l, kalium 0.54 g/l, klorida 1 g/l, nitrat 120 mg/l, sulfat 2.98 g/l, fosfat 64 mg/l, karbonat 5 g/l, bikarbonat 11 g/l dengan pH 9.5.
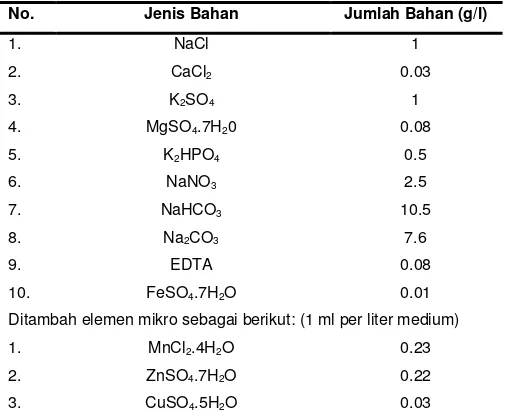
Penelitian strain Spirulina setelah itu umumnya mengikuti komposisi standar di atas. Beberapa penelitian lanjutan mencoba untuk menyempurnakan komposisi medium tersebut untuk mencapai produktivitas lebih tinggi. Salah satunya dengan komposisi akhir seperti terlihat pada Tabel 1. Pertumbuhan Spirulina dikatakan paling baik dicapai pada nisbah C:N:P: Mg = 1:3:0.3:0.2.
dengan variasi periode penyinaran, spektrum cahaya dan metode kultur. Masing-masing usaha tersebut mempunyai implikasi sendiri-sendiri dan penggunaannya disesuaikan dengan tujuan kepentingan kultivasi.
Tabel 1. Komposisi Medium Zarrouk yang Dimodifikasi
No. Jenis Bahan Jumlah Bahan (g/l)
Ditambah elemen mikro sebagai berikut: (1 ml per liter medium)
1. MnCl2.4H2O 0.23
2. ZnSO4.7H2O 0.22
3. CuSO4.5H2O 0.03
Secara umum, Spirulina dapat tumbuh dengan baik pada kisaran pH 8-11, dengan intensitas cahaya 2000-3500 lux. Periode penyinaran yang umum digunakan adalah 12 jam, walau beberapa peneliti menyatakan bahwa pertumbuhan terbaik diperoleh pada periode penyinaran 16 jam dengan waktu gelap 8 jam pada intensitas cahaya 2000 ± 200 lux, temperatur 30 ± 1°C dan pH 9.1.
Pertumbuhan seluler dan konsentrasi seluler klorofil optimal dicapai pada intensitas cahaya 3500 lux. Terjadi fotoinhibisi pertumbuhan di atas 4000 lux, namun pembentukan fikosianin berjalan optimal. Fotoinhibisi disertai pelepasan panas, penurunan hasil fotokimia dan asimilasi CO2.
Pertumbuhan pada spektrum warna berbeda memberikan hasil berturut-turut kuning > merah > hijau > biru. Cahaya merah dan biru meningkatkan konsentrasi -karoten, sedangkan menyatakan bahwa cahaya hijau meningkatkan pembentukan fikosianin, sedangkan cahaya merah dan putih tidak berpengaruh.
Pertumbuhan dengan Sistem Curah, Semikontinu dan Kontinu
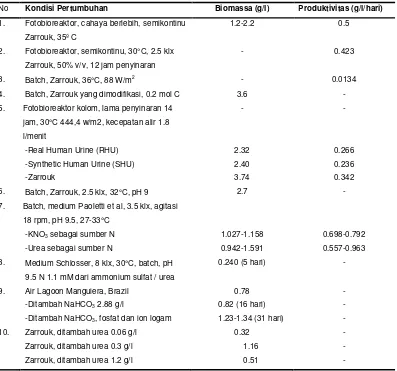
g/l) dan laju pembaruan yang tinggi (50% v/v) menghasilkan laju pertumbuhan yang tinggi yaitu sebesar 0.111/hari. Nilai ini 4 kali lebih tinggi daripada yang diperoleh dengan kultivasi curah sederhana. Pertambahan laju ini lebih disebabkan karena pembaharuan nutrien dan bukan karena keterbatasan nitrogen. Beberapa hasil penelitian tentang produksi biomassa dan produktivitas S. platensis disajikan pada Tabel 2.
Tabel 2. Konsentrasi Biomassa dan Produktivitas Spirulina platensis pada berbagai Kondisi
Pertumbuhan (Skala Laboratorium)
No Kondisi Pertumbuhan Biomassa (g/l) Produktivitas (g/l/hari) 1. Fotobioreaktor, cahaya berlebih, semikontinu
Zarrouk, 35º C
1.2-2.2 0.5
2. Fotobioreaktor, semikontinu, 30°C, 2.5 klx Zarrouk, 50% v/v, 12 jam penyinaran
- 0.423
3. Batch, Zarrouk, 36°C, 88 W/m2 - 0.0134
4. Batch, Zarrouk yang dimodifikasi, 0.2 mol C 3.6 -
5. Fotobioreaktor kolom, lama penyinaran 14 jam, 30°C 444,4 w/m2, kecepatan alir 1.8 l/menit
- -
-Real Human Urine (RHU) 2.32 0.266
-Synthetic Human Urine (SHU) 2.40 0.236
-Zarrouk 3.74 0.342
6. Batch, Zarrouk, 2.5 klx, 32°C, pH 9 2.7 -
7. Batch, medium Paoletti et al, 3.5 klx, agitasi 18 rpm, pH 9.5, 27-33°C
-KNO3 sebagai sumber N 1.027-1.158 0.698-0.792
-Urea sebagai sumber N 0.942-1.591 0.557-0.963
8. Medium Schlosser, 8 klx, 30°C, batch, pH
Produksi Masal Spirulina pada Kolam Terbuka dan Fotobioreaktor
Produksi industrial Spirulina pertama kali dilakukan pada tahun 1979 di Meksiko. Produk Spirulina yang dihasilkan berupa bubuk halus. Pada tahun 1993, produksi dunia mencapai 1000 ton/tahun, terutama dihasilkan oleh Meksiko, California, Thailand, Hawaii, India dan Israel. Jepang merupakan negara konsumen terbesar. Spirulina digunakan sebagai pengganti daging di beberapa masakan. Eropa menggunakan Spirulina terutama untuk produk kimia dan makanan kesehatan.
misalnya saus dan minuman, tanpa mempengaruhi cita rasa bahan lain tersebut. Namun demikian, Spirulina tetap akan memberi warna hijau pada bahan pokok yang diberi penambahan, yang dapat mempengaruhi penampilan. Produk Spirulina berupa kapsul tidak mempunyai sifat tersebut, namun harganya puluhan kali lebih mahal.
Gambar 2. Sistem kultivasi sederhana Spirulina
Metode kultur yang diklaim ekonomis dan efisien untuk produksi masal Spirulina dijabarkan oleh Marg dkk. Metode tersebut menggunakan medium berbahan dasar air laut yang ekonomis dengan pH berkisar 6.5 8, mengandung natrium bikarbonat 1,2–3% w/v, konsentrasi nitrogen 0.1–0.3% w/v, kandungan fosfor 0.1–0.3% w/v, kandungan kalium 0,1– 0,3% w/v, dengan metode kultur sebagai berikut:
a. Menumbuhkan Spirulina pada agar miring medium Zarrouk pada suhu 25–35°C, radiasi cahaya 1000–2000 lux, dengan lama penyinaran 12-16 jam perhari selama 25–40 hari.
b. Memindahkan kultur ke medium berbahan dasar air laut dengan A560 sebesar 0,1 c. Menumbuhkan kultur pada suhu 25–35 °C, radiasi cahaya 2000–3000 lux, dengan
lama penyinaran 12–16 jam perhari sampai diperoleh kultur dengan A560 sebesar 1, umumnya 6-12 hari.
d. Memindahkan kultur ke jalur semen terbuka yang berisi medium berbahan dasar air laut sampai A560 sebesar 0.1
e. Mengaduk kultur dengan kecepatan 20–25 cm/detik menggunakan roda pedal, suhu 20–25 °C, radiasi cahaya 3000–4500 lux sampai diperoleh kultur dengan A560 sebesar 2.
f. Memanen kultur
Pengaturan kultur pada produksi masal umumnya diusahakan mirip dengan habitat aslinya, sebagai berikut: daerah yang panas dan kering, kolam buatan dengan pH dan alkalinitas tinggi, konsentrasi nutrien terlarut yang tinggi, dengan pengaduk pedal. Sistem tertutup, tidak ada pembuangan ke luar sistem. Tidak ada kontak dengan tanah untuk meminimalisasi kontaminasi dan tidak digunakan pestisida/herbisida. Penggunaan energi, tanah dan air lebih efisien daripada di pertanian konvensional.
Metode kultivasi dengan sistem terbuka umum digunakan untuk produksi, seperti misalnya di Jepang, Taiwan, Auroville dan Meksiko. Pertumbuhan Spirulina di kolam terbuka menunjukkan migrasi dengan cahaya sebagai penginduktor utama. Jika cahaya
Kolam Air Nutri
Pemadat Tahap 1
Corong
Prod
Pengering
terlalu berlebih, maka Spirulina akan bermigrasi ke kedalaman yang intensitas cahayanya cocok, lalu tetap tinggal di situ sampai senja. Pada saat senja, terjadi migrasi ke arah permukaan.
Di Gurun Negev, kultur ditumbuhkan pada saluran plastik hitam dangkal (0,2 m) sepanjang 50–300 m. Luas keseluruhan 5-10 hektar. Kemiringan saluran diatur sehingga kecepatan alir 30 ml/menit. Pada ujung saluran, kultur dipompa kembali ke titik tertinggi. Agitasi penting untuk meningkatkan pertumbuhan, terutama pada kultur berkepadatan tinggi, karena meningkatkan proporsi sel yang terpapar cahaya. Tidak adanya agitasi menyebabkan hanya 3 cm kultur di bagian atas (sekitar 20% populasi) yang menerima cahaya.
Negara 4 musim mengalami masalah untuk kultivasi sehubungan dengan iklimnya. Kolam terbuka pada Gurun Negev di atas hanya berproduksi pada bulan Desember – Februari. Suhu udara rata-rata hanya 18°C dibandingkan 40°C pada musim panas. Pada malam hari, suhu dapat turun sampai 5°C. Jika suhu siang hari ditingkatkan sampai 25°C, pertumbuhan yang diperoleh menyerupai musim panas. Peningkatan suhu pada malam hari tidak meningkatkan pertumbuhan jika suhu siang hari tidak mencukupi. Kultivasi dengan sistem di atas menghasilkan produksi tahunan sebesar 62 ton per hektar (produksi harian 40 g dan 10 g untuk musim panas dan dingin). Pada iklim yang lebih hangat, seperti Israel, produksi tahunan dapat mencapai 74 ton/hektar. Salah satu upaya mengatasi rendahnya suhu ini dilakukan dengan memasang tutup polietilen di atas kolam, menghasilkan kenaikan suhu sebesar 5–7°C. Selain itu, dikembangkan sistem saluran baru dengan tabung polietilen, tebal 0.3 cm dengan diameter 14 cm. Tabung ini berfungsi sebagai penangkap cahaya matahari, mengurangi kontaminan dan penguapan. Namun pada musim panas, suhu dapat mencapai 40–45°C, sehingga tabung perlu dinaungi atau didinginkan dengan air. Sistem tabung ini menghasilkan produk 40–50 ton/hektar, walau kandungan proteinnya relatif lebih rendah dibandingkan kultur di kolam terbuka.
Kultivasi di kolam luar ruangan tersebut membutuhkan kontrol kondisi yang ketat. Walau demikian, sulit dicapai kondisi ideal bagi pertumbuhan. Pada intensitas cahaya yang terlalu tinggi akan terjadi fotoinhibisi, sedangkan pada intensitas cahaya terlalu rendah, terjadi penurunan aktivitas fotosintesis.
Salah satu mekanisme pertahanan diri terhadap radiasi UV adalah produksi senyawa fotoproteksi, misalnya MAA (microspore like amio acid) dan scytonemin. Konsentrasi MAA lebih rendah pada kultur yang ditumbuhkan pada kolam terbuka, mengindikasikan adanya fungsi proteksi yang lain, yaitu penyesuaian struktur. Strain Spirulina yang memiliki struktur heliks yang rapat lebih toleran terhadap intensitas cahaya daripada strain dengan spiral longgar. Strain dengan spiral yang longgar tersebut dapat bertransformasi menjadi bentuk per rapat saat dipindahkan pada kondisi paparan tinggi. Perubahan struktur yang diinduksi oleh UVR atau cahaya tampak tersebut berhubungan dengan strategi pertahanan diri dengan mempersempit permukaan terpapar. Morfologi Spirulina sering dikaitkan dengan kualitas produknya. Panjang filamen spiral sangat penting untuk efisiensi panen.
berfungsi sebagai penangkap cahaya matahari dengan kapasitas 1000 ml, menara kaca yang dihubungkan dengan bagian tabung untuk ekstraksi oksigen terlarut dalam medium dan pengaturan parameter pertumbuhan untuk mencapai kondisi optimum, dilengkapi sistem pompa yang memompa medium tanpa merusak sel. Ruang yang diperlukan seluas 5 m2, hanya 8% dari luas kolam yang diperlukan untuk memperoleh hasil yang sama. Tabung dan menara terbuat dari materi modifikasi Boron dan Silikon, dengan rasio 40% permukaan terhadap volume, dengan desain khusus untuk menangkap cahaya secara maksimal sehingga dapat memperpanjang jam penyerapan cahaya dan tingkat fotosintesis yang efisien.
Reaktor berbentuk tabung memberikan hasil pertumbuhan yang lebih baik dibanding dengan reaktor datar. Bentuk yang melengkung menyebarkan cahaya dengan lebih baik, sehingga dapat dijadikan solusi untuk mengatasi cahaya berlebih, di samping skala volume dan permukaan. Jenis reaktor lain yang dikembangkan ialah untuk iradiasi supra tinggi. Fotobioreaktor tersebut dikembangkan dengan atap penangkap cahaya dengan konversi energi berlebih untuk sistem pemanasan air.
Gambar 3. Fotobioreaktor Rancangan Miao (2003) berkapasitas 1000 L
Selain dikhususkan untuk produksi biomassa, Spirulina juga dapat digunakan untuk membantu regenerasi nutrien dari limbah, misalnya urin manusia. Spirulina platensis adalah mikroalga yang paling umum digunakan dalam sistem pendukung kehidupan biologis karena kandungan nutrisinya yang tinggi dan potensinya untuk menggantikan makanan konvensional. Spirulina juga dapat dimanfaatkan untuk mengolah limbah dan dilaporkan dapat tumbuh dengan baik pada urin manusia. Regenerasi nutrien berjalan baik, terjadi asimilasi CO2 yang menghasilkan oksigen, bahkan tingkat pelepasan oksigennya lebih tinggi daripada di medium Zarrouk yang umum digunakan. Bahan limbah lain yang dapat digunakan untuk menumbuhkan Spirulina adalah serum lateks. Limbah ini perlu diperkaya dengan penambahan makro dan mikronutrien tertentu, namun memberikan keuntungan ganda, membantu pengolahan limbah, murah dan menghasilkan konsentrasi karoten yang tinggi pada biomassa. Limbah peternakan babi juga dapat digunakan untuk menumbuhkan Spirulina. Terjadi peruraian NH4-N dan P yang cukup signifikan pada limbah.
Pengembangan Budidaya Spirulina di Indonesia
tingkat yang ekstrim, dapat terjadi ‘photobleaching’ yang mengakibatkan kematian sel. Suhu yang tinggi dapat menyebabkan akumulasi panas dalam kolam kultivasi yang terpapar cahaya. Sampai tingkat tertentu, akumulasi panas ini menguntungkan pertumbuhan Spirulina, yang memiliki suhu pertumbuhan optimum sebesar 35°C. Namun perlu diwaspadai akumulasi panas berlebih 38°C, dapat menyebabkan terhentinya pertumbuhan dan, bahkan menimbulkan kematian sel.
Proses produksi yang mudah dan ekonomis adalah sebagai berikut: kolam kultivasi mempunyai luas permukaan minimal 10 m2 dan kedalaman minimal 20 cm. Sisi-sisinya membulat, tidak membentuk siku untuk memudahkan pembersihan dan agitasi. Bahan kolam dapat beragam, asal kedap air dan aman bagi kesehatan. Bergantung pada intensitas cahaya, perlu dipasang atap plastik atau lembaran poliester transparan untuk melindungi kultur. Atap tersebut juga berguna melindungi kolam dari kontaminasi kotoran atau hujan. Kondisi kultur perlu diatur agar suhu ≥ 25 – ≤ 38°C dipasang kasa nyamuk di sekeliling kultur untuk menghindari berkembangnya jentik nyamuk. Kasa nyamuk ini sekaligus dapat mengurangi paparan cahaya. Pengadukan dapat dilakukan dengan tenaga listrik atau secara manual. Pengadukan manual minimal dilakukan 4 kali sehari, untuk meratakan paparan cahaya dan suhu kultur. Pengaturan
Gambar 4 . Contoh Kolam Terbuka untuk Kultivasi Spirulina : 20 m2 menghasilkan 200 g Spirulina kering per hari, cukup untuk suplemen nutrisi 150 anak
pH dan penggantian air yang hilang akibat penguapan dapat dilakukan sekaligus. Air yang digunakan haruslah air yang mengandung banyak mineral. Nilai pH dijaga agar berada pada kisaran 8.5-10.5, dengan penambahan natrium bikarbonat atau urea. Natrium bikarbonat dapat diganti dengan air abu kayu, sedangkan urea dapat diganti dengan urin manusia (jika kultivasi bukan untuk tujuan pangan).
Gambar 5. Metode Secchi Disc
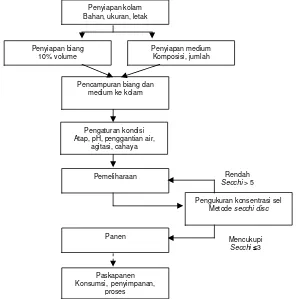
Panen dapat dilakukan saat kedalaman kultur mencapai 15 cm dan piringan tidak terlihat pada kedalaman sekitar 3 cm. Panen dapat dilakukan dengan menyaring kultur menggunakan kantong poliester atau nilon. Sebelumnya, perlu dipasang saringan berukuran besar untuk menyingkirkan kotoran yang mungkin ada. Filtrat akan tersaring dan masuk kembali ke kolam. Filtrat ini perlu diperbaharui selang beberapa waktu untuk menjamin ketersediaan nutrisi. Spirulina dapat langsung dikonsumsi atau disimpan dalam lemari es dengan menambahkan 5–10% garam dapur dan memberi lapisan minyak. Diagram alir dapat dilihat pada Gambar 6.
Gambar 6. Diagram Alir Kultivasi Spirulina Sederhana
Rendah Secchi > 5 Penyiapan kolam
Bahan, ukuran, letak
Penyiapan medium Komposisi, jumlah Penyiapan biang
10% volume
Pencampuran biang dan medium ke kolam
Pengaturan kondisi Atap, pH, penggantian air,
agitasi, cahaya
Pemeliharaan
Pengukuran konsentrasi sel Metode secchi disc
Panen Mencukupi
Secchi 3
Paskapanen Konsumsi,penyimpanan,
BIBLIOGRAFI
Babu, T.S., Kumar, A., Varma, A.K. 1991. Effect of Light Quality on Phycobilisomes Components of The Cyanobacterium Spirulina platensis. Plant Physiol. 95:492-497.
Belay. A. 2001. Unique Features of Microalgae Culture System: Organic Spirulina Production. NOSB Meeting. California.
Costa, J.A.V., Colla, L. M., Filho, P.D. 2003. Spirulina platensis Growth in Open Raceway Ponds Using Fresh Water Supplemented with Carbon, Nitrogen and Metal Ions. Z. Naturforsch. 58 c: 76-80.
Challem, J.J. 1981. Spirulina. A Keats Good Health Guide. Keats Publ. Connecticut.
Chen, F., Zhang, Y., and Guo, S. 1986. Growth and Phycocyanin Formation of Spirulina platensis in Photoheterotrophic Culture. Biotechnol. Letters. Vol.18. No. 5: 603.608.
Ciferri, O. 1983. Spirulina, The Edible Microorganism. Microbiol. Rev. Vol. 47. No.4: 551-574.
Cogne, G., Lehmann, B., Dussap, C.G., and Gross, J. B. 2003. Uptake of Macrominerals and Trace Elements by the Cyanobacterium Spirulina platensis (Arthrospira platensis PCC 8005) Under Photoautotrophic Conditions: Culture Medium Optimization. Biotech and BioEng. Vol 81. No 5.
Danesi, E.D.G., Rangel-Yagui, C.de.O., de Carvalho, J.C.M., Sato, S. 2002. An Investigation of Replacing Nitrate by Urea in The Growth and Production of Chlorophyll by Spirulina platensis. Biomass and Bioenergy 23: 261-269.
Dao-lun, F., and Zu-cheng, W. 2006. Culture of Spirulina in Human Urine for Biomass Production and O2 Evolution. J. Zhejiang.
Donati, G. and Paludetto, R. 1999. Batch and Semi-Batch Catalytic Reactors (from Theory to Practice). Catalysis Today. Vol 52: 183-195.
Fabregas, J. Patino, M., Morales, E.D., Dominguez, A. and Otero, A. 1996. Distinctive Control of Metabolic Pathways by Chlorella autotrophica in Semicontinuous Culture. Canadian Journal of Microbiol. Vol 42: 1087-1090.
Hills, C. 1980. The Secret of Spirulina. Univ. of Trees Press. California.
Jetley, U.K., Choudhary, M., Fatma, T. 2004. The Impact of Physical Stresses on The Growth of Spirulina platensis-S5. J. Environ. Sci. Eng. 46 (4): 303-311.
Marg, R., Swamy, Murthy, Ravishankar. 2006. An Economic and Efficient Method of Mass Production of Spirulina. World Intellectual Property Organization. 018668 A1.
Masojidek, J., Papacek, S., Sergejevova, M., Jirka, V., Cerveny, J., Kunc, J., Korecko, J., Verbovikova, O., Kopecky, J., Stys, D. and Torzillo, G. 2003. A Closed Solar Photobioreactor for Cultivation of Microalgae Under Supra-high Irradiance: Basic Design and Performance. Journal of Applied Phycology. Vol. 15: 239-248.
Miao, J.R. 2003. A High Productivity Photobioreactor.Jianxhi.
Olaizola, M. and Duerr, E.O. 1990. Effects of Light Intensity and Quality on the Growth Rate and Photosynthetic Pigment Content of Spirulina platensis. Journal of Appl. Phycology. Vol.2. No.2: 97-104.
Olguin, E.J., Galicia, S., Mercado. G. Perez, T. 2003. Annual Productivity of Spirulina (Arthrospira) and Nutrient Removal in A Pig Wastewater Recycling Process Under Tropical Condition. J. Appl. Phycology. 15 (2-3): 249-257.
Pichel, F.G., Mechling, M. and Castenholz, R.W. 1994. Diel Migrations of Microorganism within a Benthic, Hypersaline Mat Community. Appl. And Env. Microbiol. 60 (5): 1500-1511.
Rafiqul, I.M., Jalal, K.C.A., and Alam, M.Z. 2005. Environmental Factors for Optimization of Spirulina Biomass in Laboratory Culture. Biotechnol. 4 (1): 19-22.
Rangel-Yagui, C.O., Danesi, E.D.G., de Carvalho, J.C.M., and Sato, S. 2004. Chlorophyll Production from Spirulina platensis: Cultivation with Urea Addition by Fed-batch Process. Bioresource Technology. Vol. 92. Issue 2: 133-141.
Reichert, C.C., Reinehr, C.O., and Costa, J.A.V. 2006. Semicontinuous Cultivation of the Cyanobacterium Spirulina platensis in A Closed Photobioreactor. Brazilian Journal of Chemical Eng. Vol. 23. No.1: 23-28.
Sinha, R.P., Klisch, M. Helbling, E.W., Hader, D.P. 2001. Induction of Microspore-like Amino Acids in Cyanobacteria by Solar Ultraviolet-B Radiation. J. Photochem. Photobiol. 60: 129-135.
Tredici, M.R. and Zitteli, G.C. 1998. Efficiency of Sunlight Utilization: Tubular vs Flat Photobioreactors. Biotechnol. Bioeng. 57 (2):187-197.
Tripanji and Suharyanto. 2001. Optimization Media from Low Cost Nutrient Sources for Growing Spirulina platensis and Carotenoid Production. Menara Perkebunan 69 (1): 18-28.
Torzillo, G., Accola, P., PInzani, E., and Masojidek, J. 1996. In Situ Monitoring of Chlorophyll Fluorescence to Assess The Synergistic Effect of Low Temperature and High Irradiance Stresses in Spirulina Cultures Grown Outdoors in Photobioreactors. Journal of Appl. Phycology 8: 283-291.
Wu, H., Gao, K., Villafane. V. E., Watanabe, T. and Helbling, E.W. 2005. Effects of Solar UV Radiation on Morphology and Photosynthesis of Filamentous Cyanobacterium Arthrospira platensis. Appl. and Environ. Microbiol. 71 (9): 5004-5013.